Кальпротектин. Повышен фекальный кальпротектин? Без паники!
Многие пациенты с заболеваниями желудочно-кишечного тракта (ЖКТ) знакомы с таким анализом как фекальный кальпротектин. Известен этот анализ и врачам различных специальностей. Зачем же тогда нужна эта статья? Нужна, я бы даже сказал необходима!
Широкое распространение метода по оценке уровня фекального кальпротектина в последние годы привело к зарождению разнообразных мифов вокруг этого анализа. «Повышен уровень кальпротектина в кале? Это у Вас болезнь Крона или язвенный колит». Или вот такой вариант: «Кальпротектин выше нормы в 3 (!) раза, это какое же сильное воспаление в кишечнике у Вас! Срочно бегите к гастроэнтерологу!».
И приходят пациенты к гастроэнтерологу, встревоженные и напуганные высокими цифрами в анализе и уже озвученным (пусть и под вопросом) диагнозом. И приходится гастроэнтерологу разъяснять значения этого исследования с азов.
Вот, пожалуй, с азов и начнем.
1. Что такое кальпротектин?
Кальпротектин, это кальций- и цинк-связывающий белок, относящийся к семейству белков S-100.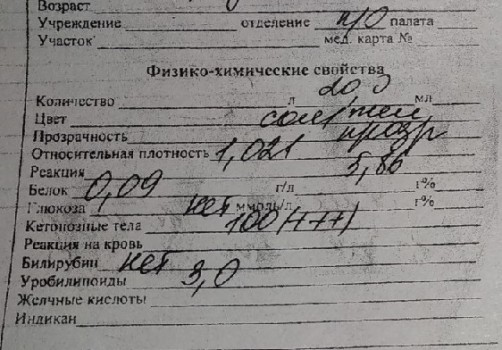 То есть к слову «кал» название белка отношения не имеет. Этот белок сосредоточен преимущественно в цитоплазме нейтрофилов, и (в меньшей степени) в моноцитах и макрофагах, которые могут быть обнаружены в любых органах человека, но в основном сосредоточены в крови, спинномозговой жидкости, фекалиях, слюне или синовиальной жидкости.
То есть к слову «кал» название белка отношения не имеет. Этот белок сосредоточен преимущественно в цитоплазме нейтрофилов, и (в меньшей степени) в моноцитах и макрофагах, которые могут быть обнаружены в любых органах человека, но в основном сосредоточены в крови, спинномозговой жидкости, фекалиях, слюне или синовиальной жидкости.
Кальпротектин участвует в различных процессах организма человека, включая дифференцировку клеток, процессы воспаления, иммунные реакции, апоптоз и т.д. В воспалительных процессах кальпротектин играет важную роль, и считается белком острой фазы воспаления.
2. Как и зачем определяется фекальный кальпротектин?
Как мы уже говорили, кальпротектин может содержаться в кале (в этом случае он носит название фекальный кальпротектин, ФК), и этот факт широко используется в гастроэнтерологии для диагностики некоторых болезней ЖКТ. Еще раз напомню, что кальпротектин ― воспалительный белок. Некоторые патологические состояния (инфекция или воспаление слизистой оболочки кишечника другого происхождения) приводят к увеличению проницаемости слизистой оболочки и перемещению иммунных клеток (нейтрофилов, макрофагов) в очаг воспаления. Они также вызывают выход кальпротектина из цитоплазмы нейтрофилов. Все это приводит к тому, что количество кальпротектина в кале значительно повышается.
Они также вызывают выход кальпротектина из цитоплазмы нейтрофилов. Все это приводит к тому, что количество кальпротектина в кале значительно повышается.
ФК устойчив к расщеплению ферментами желудочно-кишечного тракта, а также к бактериальной деградации. Его равномерное распределение в стуле и стабильность в кале (в течение 3 дней при комнатной температуре, 5-7 дней при 4С0 и длительно при -20 С0) позволяет транспортировать образцы кала в лабораторию для анализа хоть в другую страну. Концентрация кальпротектина в кале определяется несколькими лабораторными методами, например иммуноферментным анализом (ИФА). Этот простой, неинвазивный и более дешевый (по сравнению с колоноскопией) количественный тест является наиболее широко используемым маркером для выявления и отслеживания воспалительной активности в кишечнике.
3. Когда фекальный кальпротектин повышается?
Итак, мы уже разобрали, что ФК используется как маркер кишечного воспаления. Очень важно понимать, какие состояния могут привести к его повышению, и всегда ли это болезнь.
Начнем с того, что, кальпротектин может выявляться в кале и у абсолютно здоровых лиц. Клетки, содержащие кальпротектин в своей цитоплазме, закономерно отмирают, и небольшое количество этого белка попадает в кал. В таких случаях ФК находится в пределах референсных значений (так называют лабораторные нормы). Если же значения этого показателя превышают норму, то это требует дополнительной оценки.
Так, ФК может быть повышен при острой бактериальной (реже вирусной) кишечной инфекции. Иногда он выше нормы при целиакии, остром аппендиците, приеме нестероидных противовоспалительных препаратов и ингибиторов протонной помпы. Незначительное повышение может наблюдаться даже при эрозивно-язвенном поражении желудка и пищевода.
Наконец, существует еще одна группа болезней, ради которых ФК и был внедрен в клиническую практику: воспалительные заболевания кишечника (ВЗК). К ВЗК относятся болезнь Крона (БК) и язвенный колит (ЯК). Дело было примерно так: требовалось найти достоверный маркер, который позволил бы врачу быстро и с высокой точностью отличить воспалительный процесс в кишке от невоспалительного. Почему это актуально?
Почему это актуально?
Например, потому, что синдром раздраженного кишечника (СРК) своими клиническими проявлениями (боль в животе и нарушения стула) очень похож на БК. При этом СРК страдает каждый 15 человек из 100 жителей Земли, а БК встречается намного реже. Как различить эти заболевания на первом этапе диагностики? Всем делать колоноскопию? Денег не напасешься: стоимость одной колоноскопии с анестезией и биопсией в Европе достигает 1500 евро.
В ходе исследований выяснилось, что при значениях ФК ниже 50 мкг/г вероятность наличия активного ВЗК составляет менее 1%. В клинической практике я вижу примерно те же цифры ― редкий пациент с обострением ЯК или БК имеет нормальный уровень ФК. То есть, если значения кальпротектина в норме, нет симптомов тревоги (лихорадка, кровь в стуле и т.д.), вероятнее всего симптомы пациента не обусловлены ВЗК.
А какие же значения позволят с наибольшей достоверностью отличить ВЗК от функциональных заболеваний кишечника? Тут начинаются сложности. За последние десять лет проведено много исследований, целью которых было определение пограничных значений ФК, выше которых вероятен диагноз ВЗК. Значения варьируют от 150 до 250 мкг/г, однако большинство экспертных сообществ остановились на цифрах >150 мкг/г. В этом случае следует подумать о значимом воспалении в кишечнике (при наличии симптомов) и обсудить колоноскопию.
За последние десять лет проведено много исследований, целью которых было определение пограничных значений ФК, выше которых вероятен диагноз ВЗК. Значения варьируют от 150 до 250 мкг/г, однако большинство экспертных сообществ остановились на цифрах >150 мкг/г. В этом случае следует подумать о значимом воспалении в кишечнике (при наличии симптомов) и обсудить колоноскопию.
Всегда ли мы найдем в кишечнике ВЗК даже при значениях ФК более 150 мкг/г? Нет, конечно! Во-первых, никто не исключает ошибку метода. Во-вторых, повышение этого показателя могут вызывать описанные выше заболевания и прием лекарственных препаратов. В-третьих, высокие значения ФК могут наблюдаться и при других болезнях, вызывающих кишечное воспаление – дивертикулит, болезнь Бехчета, поражение кишки в рамках васкулитов и т.д.
При установленном диагнозе ВЗК кальпротектин в кале хорошо подходит для оценки заживления слизистой кишки и достижения эндоскопической ремиссии. Более того, повышение уровня ФК наблюдается перед обострением болезни или при послеоперационном рецидиве, и может помочь принять решение о своевременной коррекции терапии.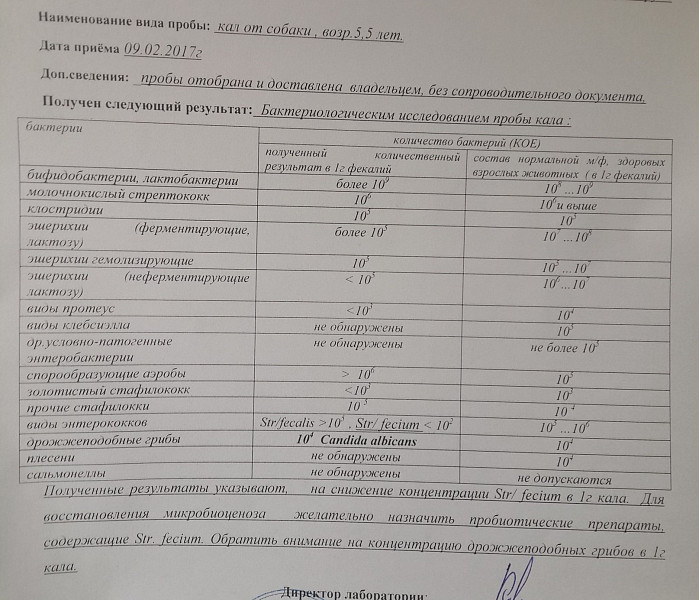
Наконец, хочется обсудить еще один вопрос: связан ли высокий уровень кальпротектина с выраженностью воспаления в кишке? И да, и нет. С одной стороны, имеются исследования, которые свидетельствуют, что значения фекального кальпротектина более 250 мкг/г чаще ассоциированы с выявлением больших язвенных дефектов слизистой оболочки толстой кишки при БК и ЯК. Однако при этом нет информации, что 1000 мкг/г это намного более выраженное воспаление, чем 250-300 мкг/г. На практике приходится часто сталкиваться со значениями ФК более 1000 мкг/г, при которых в кишке не всегда находят даже язвы.
В качестве резюме мои рекомендации по оценке уровня ФК:
- Значения ФК могут несколько превышать норму в 50 мкг/г и у здоровых лиц. Требуется повторная оценка показателя.
- Небольшое превышение ФК по сравнению с нормой может быть вызвано приемом некоторых лекарственных препаратов.
- Высокие значения ФК не помогают поставить определенный диагноз, а лишь позволяют расширить план обследования пациента.
 Повышенный ФК не равно болезни Крона или язвенному колиту!
Повышенный ФК не равно болезни Крона или язвенному колиту! - Интерпретация результатов анализа кала на ФК должна быть проведена вместе с данными других обследований с учетом симптомов пациента.
- ФК надежный маркер для оценки заживления кишки на фоне лечения у лиц с установленным диагнозом ВЗК.
Копрограмма — описание анализа, показания, расшифровка
КопрограммаКопрограмма – это комплексное исследование кала человека, его физических, химических свойств и различных включений.
Копрограмма позволяет оценить работу желудочно-кишечного тракта, обнаружить нарушение функций печени, поджелудочной железы, выявить гельминтов в кишечнике или диагностировать воспалительные изменения в пищеварительном тракте.
Показания к проведению исследования
Диагностика заболеваний желудочно-кишечного тракта.
Оценка эффективности проводимого лечения болезней пищеварительной системы.
Подготовка к исследованию
За два дня до сдачи анализа следует исключить приём слабительных лекарств, нельзя ставить клизмы.
Собирать кал нужно в стеклянную банку или пластиковый контейнер.
Перед дефекацией необходимо помочиться в унитаз. Нельзя собирать кал вместе с мочой.
Собрать кал в подготовленный контейнер или в подставное судно, а затем переместить в контейнер.
Подписать фамилию и инициалы, дату сбора материала.
Материал для исследования
Кал
Интерпретация результатов
Копрограмма включает в себя перечень показателей, нормы которых приведены в таблице.
Показатель копрограммы | Нормативное значение |
Форма | Оформленный |
Консистенция | Мягкая |
Цвет | Коричневый |
Запах | |
Реакция | Нейтральная |
Соединительная ткань | Не обнаружено |
Мышечные волокна неперевариваемые | Не обнаружено |
Мышечные волокна перевариваемые | Отсутствуют |
Исчерченность мышечных волокон | Без исчерченности |
Нейтральный жир | Не обнаружено У детей до 1 месяца – в малом количестве |
Жирные кислоты | Не обнаружено |
Мыла | Не обнаружено |
Непереваримая клетчатка | В небольшом или умеренном количестве |
Переваримая клетчатка | Не обнаружено |
Крахмальные зерна внеклеточные | Не обнаружено |
Крахмальные зерна внутриклеточные | Не обнаружено |
Йодофильные бактерии | Не обнаружено |
Слизь | Не обнаружено |
Лейкоциты | Не обнаружены или 0-2 в п/зр. |
Эритроциты | Не обнаружено |
Эпителий | Не обнаружено |
Простейшие | Не обнаружено |
Дрожжевой грибок | Не обнаружено |
Яйца гельминтов | Не обнаружено |
Отклонения от нормы
Форма
Твёрдый мелкий кал характерен для запоров при колитах, язве желудка или двенадцатиперстной кишки.
Консистенция
Мазевидная консистенция характерна для заболеваний поджелудочной железы.
Жидкий кал – признак энтерита или диспепсии.
Кашицеобразный кал бывает при колитах.
Цвет
Измененная окраска каловых масс связана с употреблением в пищу определённых продуктов или лекарственных препаратов либо связана с нарушением циркуляции желчи и её производных в организме.
Светло-жёлтый кал – встречается у любителей молочных продуктов.
Ярко-жёлтый цвет – признак ускоренной эвакуации пищи из кишечника, когда билирубин не успевает перейти в форму гидробилирубина.
Тёмно-коричневый кал характерен для преимущественно мясной пищи в организме.
Интенсивно тёмно-коричневый кал возникает при внезапном большом поступлении билирубина в кишечник, когда устраняется причина, преграждающая его движение (разрушение камня желчного протока, распад опухоли).
Чёрный (дегтеобразный) кал – признак кровотечения из верхних отделов желудочно-кишечного тракта, поскольку кровь приобретает чёрный цвет при взаимодействии с соляной кислотой в желудке. Это может быть язва желудка, кровотечение из расширенных вен пищевода при циррозе печени. Препараты железа, висмута, карболена также окрашивают кал в чёрный цвет.
Черноватый оттенок придают калу черника, вишня, черноплодная рябина.
Ахоличный обесцвеченный кал – следствие прекращения поступления билирубина в кишечник. Встречается при закупорке желчного протока камнем, при раке головки поджелудочной железы или при повреждении печёночной ткани при гепитите А, хронических гепатитах, циррозе печени.
Встречается при закупорке желчного протока камнем, при раке головки поджелудочной железы или при повреждении печёночной ткани при гепитите А, хронических гепатитах, циррозе печени.
Светлый кал – признак повышенного содержания в нём жира, наблюдается при нарушении функции поджелудочной железы (панкреатит, рак ПЖ).
Запах
Резкий запах кала указывает на преимущество мясных продуктов в рационе. Кислый появляется при чрезмерном употреблении углеводов (сахара, фруктов, мучного, гороха и капусты). Зловонный кал бывает при нарушении выделения ферментов поджелудочной железы или при отсутствии поступления желчи в просвет кишечника.
Реакция
Щелочная реакция кала отмечается при преобладании гнилостных процессов. Когда в кишечнике усиливается гниение белков, не переваренных в тонкой кишке, выделяется аммиак. Он обусловливает щелочную реакцию.
Кислая реакция – следствие процессов брожения, при которых выделяется углекислый газ, преобладания углеводных продуктов питания в рационе, избыточного образования жирных кислот.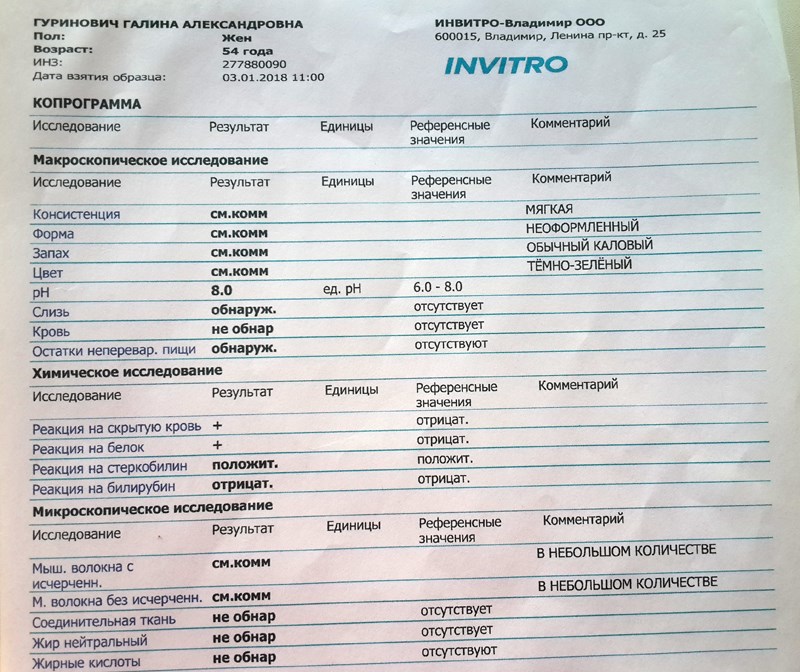
Соединительная ткань
Соединительная ткань – это остатки мясной пищи, которые недостаточно переварились в желудочно-кишечном тракте и попали в кал. При микроскопическом исследовании соединительная ткань имеет вид бело-серых элементов с волокнистой структурой. От слизи они отличаются высокой плотностью и чёткими контурами.
Соединительная ткань в кале указывает на нарушение переваривания пищи в желудке, поскольку для разрушения её волокон необходима соляная кислота. Непереваренные волокна соединительной ткани – признак пониженной кислотности желудочного сока.
Вторая причина появления соединительнотканных волокон – недостаток ферментов поджелудочной железы. Изменение состава панкреатического сока приводит к неполному перевариванию мясной пищи и выделению её остатков с калом.
Мышечные волокна
Мышечные волокна в кале – следствие недостаточного переваривания белковой пищи (мясных продуктов или рыбы), остатки которой попадают в кал. Выделяют мышечные волокна переваримые (измененные) и непереваримые (неизмененные). Непереваримые мышечные волокна цилиндрической формы, с чётко выраженной поперечной исчерченностью. Переваримые мышечные волокна – это небольшие комочки овальной формы, без выраженной исчерченности.
Выделяют мышечные волокна переваримые (измененные) и непереваримые (неизмененные). Непереваримые мышечные волокна цилиндрической формы, с чётко выраженной поперечной исчерченностью. Переваримые мышечные волокна – это небольшие комочки овальной формы, без выраженной исчерченности.
Соляная кислота в желудке разрушает мышечные волокна, исчезает их исчерченность. Окончательное переваривание мышечных волокон осуществляется в двенадцатиперстной кишке под воздействием ферментов поджелудочной железы.
Наличие большого числа мышечных волокон в кале называют креаторея. Она встречается при сниженной кислотности желудочного сока или при недостаточности ферментов поджелудочной железы, отвечающих за расщепление белков.
Допускается появление мышечных волокон в кале детей до 1 года. Это объясняется незрелостью пищеварительной системы. По мере взросления ребёнка мясная пища переваривается у него полностью.
Нейтральный жир, жирные кислоты, мыла
Жирные кислоты и мыла представляют собой продукт расщепления нейтрального жира.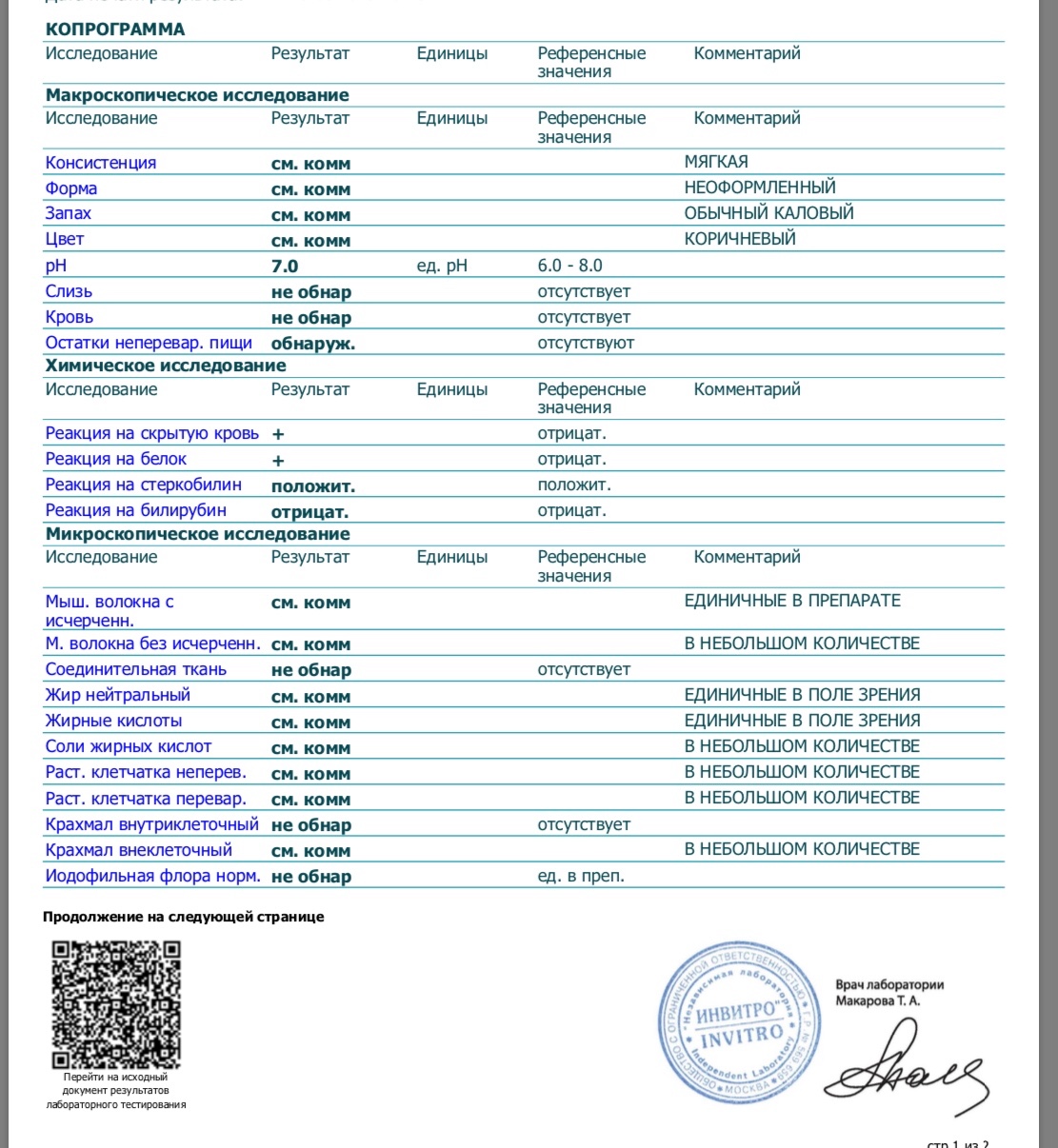
Появление в кале нейтрального жира, жирных кислот или мыла носит название стеаторея. Недостаточное переваривание жиров и появление их в кале характерно для следующих состояний:
1. Заболевания поджелудочной железы (хронический панкреатит, рак поджелудочной железы).
Поджелудочная железа вырабатывает липазу. Это фермент, который расщепляет жиры. Если его недостаточно, то жиры пищи не усваиваются, и в кале появляется нейтральный жир. Причём признаком заболевания поджелудочной железы является стойкая стеаторея – подтверждение результата в нескольких анализах кала.
2. Нарушение поступления желчи в кишечник (механическая желтуха).
В здоровом организме желчь участвует в расщеплении жиров, её отсутствие нарушает переваривание жиров.
3. Нарушение всасывания жиров в кишечнике (амилоидоз кишечника) или ускоренное выведение кишечного содержимого из прямой кишки.
4. Чрезмерное поступление жиров с пищей либо применение лекарственных средств, содержащих жиры (применение ректальных свечей или касторового масла).
Клетчатка
Клетчатка представляет собой сложный углевод, который формирует клеточную стенку растений. Она поступает в организм с овощами и фруктами, со злаками и бобовыми растениями.
В пищеварительном тракте здорового человека клетчатка практически не переваривается из-за отсутствия специальных ферментов, которые смогут её расщепить. Только частично её может расщепить микрофлора кишечника.
Клетчатка – источник питательных веществ для нормальной микрофлоры кишечника, которая «предпочитает» грубые пищевые волокна. Кроме того, она является стимулятором перистальтики (нормальной сократимости кишечника), она механически раздражает нервные окончания стенки кишки и ускоряет её сокращения. Благодаря этому пища равномерно продвигается по пищеварительному тракту.
В кале может встречаться переваримая и неперваримая клетчатка. Переваримая клетчатка в норме разрушается соляной кислотой в желудке и в кале здоровых людей отсутствует. Её появление – признак пониженной кислотности желудочного сока, ускоренной эвакуации из кишечника или заболеваний поджелудочной железы, сопровождаемых диареей. При заболеваниях организм не получает питательные вещества переваримой клетчатки, и они выводятся наружу.
При заболеваниях организм не получает питательные вещества переваримой клетчатки, и они выводятся наружу.
Непереваримая клетчатка встречается постоянно в кале здоровых людей. Это эпидермис злаков, кожица фруктов и овощей, которые в организме не разрушаются. Её количество в каловых массах указывает на характер питания человека – преимущественное употребление либо недостаток растительной пищи.
Крахмал
Крахмал – самый часто употребляемый углевод в питании человека. Он содержится в рисе, пшенице, картофеле, бобовых.
У здоровых людей крахмал в кале отсутствует. Его появление называется амилорея. Зёрна крахмала в кале – это признак:
- нарушение работы тонкого кишечника с ускоренным продвижением каловых масс,
- недостаточность ферментов желудка,
- недостаточность ферментов поджелудочной железы.
Йодофильные бактерии
Йодофильные бактерии получили своё название из-за способности окрашиваться в тёмно-синий цвет раствором йода (чаще всего применяется раствор Люголя). Это представители микрофлоры кишечника, которые в норме отсутствуют – кокки, палочки. Встречаются они при следующих состояниях:
Это представители микрофлоры кишечника, которые в норме отсутствуют – кокки, палочки. Встречаются они при следующих состояниях:
- недостаточность ферментов поджелудочной железы,
- нарушение процессов пищеварения в желудке,
- бродильная диспепсия при чрезмерном употреблении в пищу углеводов.
Слизь
Слизь может встречаться в кале при злоупотреблении острой пищей или при насморке, но в большинстве случаев она является признаком воспалительного процесса в кишечнике:
- острый колит (при заболеваниях толстой кишки слизь располагается на поверхности кала),
- аллергический колит (слизь располагается в кале в виде лент),
- энтерит (при этом хлопья слизи могут перемешиваться с каловыми массами).
Лейкоциты
Микроскопическое обнаружение лейкоцитов указывает на следующие состояния:
- отсутствие туалета наружных половых органов перед сбором каловых масс на анализ, когда лейкоциты из влагалища женщины или мочеиспускательного канала попадают в кал,
- колит (воспаление толстой кишки),
- энтерит (воспаление тонкой кишки),
- трещина слизистой оболочки прямой кишки,
- распад опухоли кишечника.

Эритроциты
Обнаружение эритроцитов в кале возможно при заболеваниях:
- кровотечение в нижних отделах кишечника (дизентерия, неспецифический язвенный колит),
- распад опухоли кишечника,
- трещины заднего прохода,
- полипы толстой кишки,
- расширение геморроидальных узлов прямой кишки.
Эпителий
Эпителий – это клетки, которые выстилают изнутри пищеварительный тракт. Его предназначение – защита от механического повреждения и от инфекционных агентов. В кале возможно обнаружение плоского эпителия, который попадает из анального отверстия при твёрдой консистенции каловых масс.
Появление в кале цилиндрического эпителия (который обычно обнаруживают в слизи) указывает на воспаление слизистой оболочки кишечника, особенно если одновременно с большим количеством эпителия в кале обнаруживаются лейкоциты.
Простейшие
Обнаруженные в кале простейшие являются возбудителями определённых заболеваний – кишечных протозоонозов. Возможно обнаружение патогенных простейших:
Возможно обнаружение патогенных простейших:
- дизентерийная амёба (Entamoeba histolytica),
- балантидий кишечный (Balantidium coli),
- кишечные трихомонады (Trichomonas hominis),
- лямблии (Lamblia intestinalis).
Дрожжевой грибок
Наиболее распространенными являются дрожжевые грибы рода Candida, которые вызывают кандидоз кишечника.
Яйца гельминтов
Исследование позволяет обнаружить яйца гельминтов, их личинки при кишечных и печёночных гельминтозах. При положительном результате лаборант отмечает в копрограмме «обнаружены яйца Trichocephalus trichiurus».
Чаще всего у человека обнаруживаются плоские черви (класс ленточных червей Cestoidea и сосальщиков Trematoda) и круглые (класс Nematoda):
- Нематоды: аскариды (Ascaris lumbricoides), власоглав (Trichocephalus trichiurus), томинкс (Thominx aerofilus), кривоголовка двенадцатиперстная (Ancylostoma duodenale), некатор (Necator americanus), трихостронгилида (Trichostrongyloides).

- Трематоды: двуустка печеночная (Fasciola hepatica), двуустка кошачья (Opisthorchis felineus), двуустка ланцетовидная (Dicrocoelium lanceatum), шистосома (Schistosoma mansoni end japonicum).
- Ленточные черви: цепень невооружённый (Taeniarhynchus saginatus), цепень вооружённый (Taenia solium), лентец широкий (Diphyllobothrium latum), лентец малый (Diphyllobotrium minus).
Скрытая кровь + и белок + в кале у грудничка — Вопрос детскому гастроэнтерологу
Если вы не нашли нужной информации среди ответов на этот вопрос, или же ваша проблема немного отличается от представленной, попробуйте задать дополнительный вопрос врачу на этой же странице, если он будет по теме основного вопроса. Вы также можете задать новый вопрос, и через некоторое время наши врачи на него ответят. Это бесплатно. Также можете поискать нужную информацию в похожих вопросах на этой странице или через страницу поиска по сайту. Мы будем очень благодарны, если Вы порекомендуете нас своим друзьям в социальных сетях.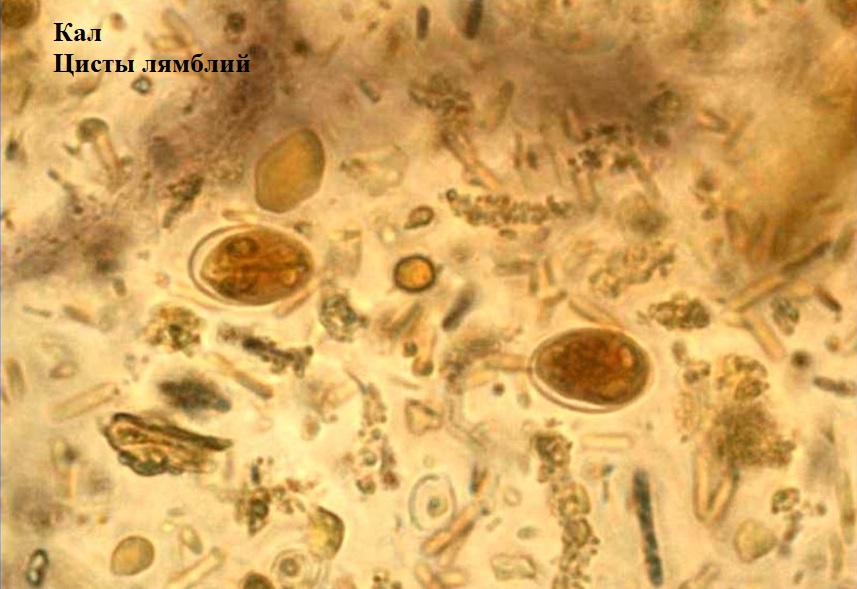
Медпортал 03online.com осуществляет медконсультации в режиме переписки с врачами на сайте. Здесь вы получаете ответы от реальных практикующих специалистов в своей области. В настоящий момент на сайте можно получить консультацию по 74 направлениям: специалиста COVID-19, аллерголога, анестезиолога-реаниматолога, венеролога, гастроэнтеролога, гематолога, генетика, гепатолога, гериатра, гинеколога, гинеколога-эндокринолога, гомеопата, дерматолога, детского гастроэнтеролога, детского гинеколога, детского дерматолога, детского инфекциониста, детского кардиолога, детского лора, детского невролога, детского нефролога, детского онколога, детского офтальмолога, детского психолога, детского пульмонолога, детского ревматолога, детского уролога, детского хирурга, детского эндокринолога, дефектолога, диетолога, иммунолога, инфекциониста, кардиолога, клинического психолога, косметолога, липидолога, логопеда, лора, маммолога, медицинского юриста, нарколога, невропатолога, нейрохирурга, неонатолога, нефролога, нутрициолога, онколога, онкоуролога, ортопеда-травматолога, офтальмолога, паразитолога, педиатра, пластического хирурга, подолога, проктолога, психиатра, психолога, пульмонолога, ревматолога, рентгенолога, репродуктолога, сексолога-андролога, стоматолога, трихолога, уролога, фармацевта, физиотерапевта, фитотерапевта, флеболога, фтизиатра, хирурга, эндокринолога.
Мы отвечаем на 97.35% вопросов.
Оставайтесь с нами и будьте здоровы!
Анализ кала у животных
Лабораторное исследование кала включает в себя макроскопический, биохимический и микроскопический методы исследования. Доставлять материал для анализа следует в максимально короткие сроки.
Макроскопическое исследование
Простой осмотр каловых масс позволяет обнаружить взрослых гельминтов, членики ленточных гельминтов, определить характер кормления животного, наличие нежелательных компонентов (острые кости, палки, веревки, полиэтилен и т.д.). Основными показателями макроскопического исследования являются:
- консистенция
- цвет
- запах
Консистенция зависит от количества воды, клетчатки, слизи и жира. Плотный, оформленный кал выделяется у здоровых животных. Мазевидная консистенция обусловлена нарушением секреции поджелудочной железы (острый панкреатит, некроз поджелудочной железы, муковисцидоз). Твердым материал становится при снижении скорости продвижения химуса по кишечнику. Жидкие фекалии сопровождают недостаточное переваривание в тонкой кишке при энтерите, ускоренной эвакуации, колите с изъязвлениями. Кашицеобразным — становится при бродильной диспепсии, колите, хроническом энтероколите. Пенистый характерприобретается в результате бродильного колита, дисбиоза, дисбактериоза. Лентовидную, карандашеобразную форму приобретает при наличии геморроидальных узлов, спазме ректального сфинктера, трещине ануса, опухоли прямой кишки.
Твердым материал становится при снижении скорости продвижения химуса по кишечнику. Жидкие фекалии сопровождают недостаточное переваривание в тонкой кишке при энтерите, ускоренной эвакуации, колите с изъязвлениями. Кашицеобразным — становится при бродильной диспепсии, колите, хроническом энтероколите. Пенистый характерприобретается в результате бродильного колита, дисбиоза, дисбактериоза. Лентовидную, карандашеобразную форму приобретает при наличии геморроидальных узлов, спазме ректального сфинктера, трещине ануса, опухоли прямой кишки.
Цвет в норме коричневый, становится желтым при молочной диете, темно-коричневым при мясной. Черный цвет фекалии приобретают при кровотечении в переднем отделе ЖКТ (желудок, двенадцатиперстной и тонкой кишке).
Темно-коричневый наблюдается при недостаточности желудочного пищеварения, гнилостной диспепсии, колите с запором, колите с изъязвлениями, повышенной секреторной функции толстой кишки. Светло-коричневым становится ускоренной эвакуации из толстой кишки. Красноватый цвет обусловлен наличием кровотечения в задних отделах ЖКТ. Желтый цвет наблюдается при недостаточности переваривания в тонкой кишке и бродильной диспепсии. Серый цвет обусловлен недостаточностью поджелудочной железы. Белым становится при интрагепатальном застое или полной обтурации общего желчного протока.
Красноватый цвет обусловлен наличием кровотечения в задних отделах ЖКТ. Желтый цвет наблюдается при недостаточности переваривания в тонкой кишке и бродильной диспепсии. Серый цвет обусловлен недостаточностью поджелудочной железы. Белым становится при интрагепатальном застое или полной обтурации общего желчного протока.
Запах обусловлен, в основном, продуктами распада белков. Гнилостный запах появляется при недостаточности желудочного пищеварения, гнилостной диспепсии, язвенном колите. Зловонный (запах прогорклого масла) — при нарушении секреции липазы поджелудочной железой, отсутствии поступления желчи. Кислый запах обусловлен бродильными процессами в толстой кишке, нарушением всасывания жирных кислот в тонкой.
Микроскопическое исследование
При микроскопии могут обнаруживаться яйца гельминтов, простейшие или их цисты, мышечные волокна (при недостаточности переваривания в желудке), жировые компоненты корма (при поражении поджелудочной железы, нарушении желчеотделения, нарушении всасывания в тонкой кишке), крахмал, клетчатка, лейкоциты, эритроциты, клетки эпителия, опухолевые клетки, кристаллы.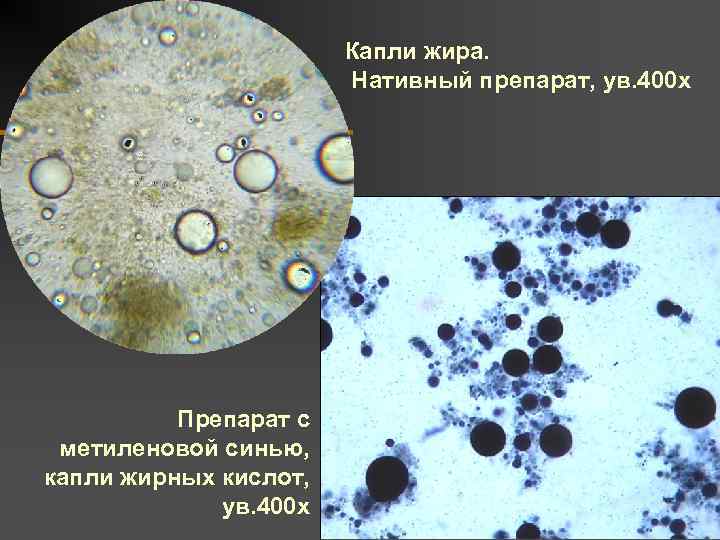 Также можно обнаружить артефакты (попадают извне, например блохи, клещи и т.д.).
Также можно обнаружить артефакты (попадают извне, например блохи, клещи и т.д.).
Биохимическое исследование
Биохимические показатели указываются в крестах, так как являются качественными, а не количественными.
Белок
Положительная реакция на белок указывает на наличие непереваренного или неусвоенного пищевого белка. Белок появляется при поражении желудка (гастрит, язва, новообразование), двенадцатиперстной кишки (дуоденит, язва, рак), тонкой, толстой и прямой кишок.
Кровь
Это реакция на скрытую кровь, не выявляемую макроскопически. Обнаруживает кровь при кровотечениях из всех отделов пищеварительного тракта (десен, пищевода, желудка и т.д.). Реакция может быть ложноположительной в присутствии пероксидаз бактерий, грибов, лекарственных препаратов, содержащих железо. Также она будет положительна при поедании животным сырого мяса.
Стеркобилиноген
Образуется из билирубина желчи. Как следствие его отсутствие в кале говорит об обтурации желчевыводящих путей. При скрытом дисбактериозе содержание стеркобилиногена снижено и обнаруживается билирубин.
При скрытом дисбактериозе содержание стеркобилиногена снижено и обнаруживается билирубин.
Билирубин
Его обнаружение в кале указывает на следующие патологии: быстрая эвакуация кала по кишечнику, тяжелый дисбактериоз (отсутствие в толстой кишке нормальной микрофлоры).
Литература:
И.И. Миронова, Л.А. Романов, В.В. Долгов «Общеклинические исследования: моча, кал, ликвор, мокрота»; Москва 2009
А. Хэм, Д. Кормак «Гистология» том 4; Москва «Мир» 1983
С.Ю. Зайцев, Ю.В. Конопатов «Биохимия животных, фундаментальные и клинические аспекты» СПб, Москва, Краснодар 2004
Генрих Е.В. ветеринарный врач — терапевт
Насколько срочно нужно делать колоноскопию у пациентов с положительным анализом кала на скрытую кровь
23.12.2017
Отсрочка более 12 месяцев значительно повышает вероятность наличия колоректального рака: вдвое для локализованного и втрое для распространенного
Риск развития колоректального рака значительно выше, если выполнение колоноскопии отложить более чем на девять месяцев после положительного анализа кала на скрытую кровь, согласно большому исследованию Kaiser Permanente, опубликованному в Журнале Американской медицинской ассоциации. Фекальный иммунохимический тест (FIT) является скрининговым методом для колоректального рака, во время которого возможно обнаружить небольшое количество крови в стуле. При положительном результате гастроэнтерологи рекомендуют проведение колоноскопии для выявления и возможного удаления малигнизированных или предраковых полипов до появления каких-либо симптомов.
Фекальный иммунохимический тест (FIT) является скрининговым методом для колоректального рака, во время которого возможно обнаружить небольшое количество крови в стуле. При положительном результате гастроэнтерологи рекомендуют проведение колоноскопии для выявления и возможного удаления малигнизированных или предраковых полипов до появления каких-либо симптомов.
«В этом исследовании мы получили убедительные доказательства того, что колоноскопия должна проводиться в течение нескольких месяцев после положительного анализа кала на скрытую кровь», — сказал ведущий автор исследования, Дуглас Корли (Douglas A Corley), врач-гастроэнтеролог Kaiser Permanente, Северная Калифорния.
В исследовании, опубликованном в JAMA (Журнал американской медицинской ассоциации) проанализировали данные 70 124 человека в возрасте от 50 до 75 лет со средним риском развития колоректального рака, у которых были положительные результаты FIT с 2010 по 2013 год. В течение одного месяца колоноскопия была выполнена 40 процентам пациентов, в течение двух месяцев — 64 % и в течение трех месяцев — 74 %.
По сравнению с периодом наблюдения от восьми до 30 дней, исследование не выявило существенных различий в рисках развития колоректального рака при выполнении колоноскопии через два, три, четыре, шесть, семь или девять месяцев. Однако, при выполнении колоноскопии через 10-12 месяцам риск наличия рака толстой кишки увеличился примерно на 50 процентов, а риск наличия распространенного рака почти удвоился. Ожидание более 12 месяцев увеличивало риски еще больше: вдвое для локализованного и втрое для распространенного колоректального рака.
Колоректальный рак выявили у 3% людей с положительными результатами FIT (2 191 случай). Менее у 1% из них (601 случаев) обнаружили распространенные опухоли. Результаты исследования скорректировали с учетом различий между пациентами, у которых проводились более ранние и поздние обследования.
«Данные выводы должны помочь снизить беспокойство людей с положительным результатом FIT», — сказал гастроэнтеролог Kaiser Permanente, доктор Теодор Р Левин (Theodore R Levin), старший автор исследования и глава отдела скрининга колоректального рака в Kaiser Permanente Северной Калифорнии.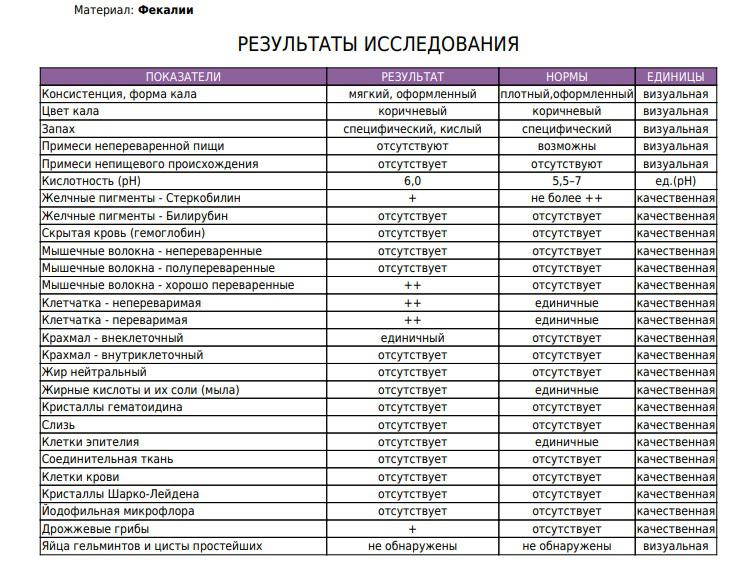
«Пациенты тратят довольно много времени и усилий для выполнения колоноскопии, учитывая необходимость временного прекращения работы и невозможность самостоятельно добраться до дома после», — добавил Левин. «Наше исследование показывает, что вы должны выполнить колоноскопию как только это будет возможно, но в любое время в течение нескольких месяцев».
Колоректальный рак — вторая по значимости причина онкологической смертности в США, согласно данным Центров по контролю и профилактике заболеваний. Сотрудники данных центров рекомендуют людям в возрасте от 50 до 75 лет без достоверно высокого риска развития колоректального рака выполнять анализ кала на скрытую кровь ежегодно, колоноскопию каждые 10 лет, а сигмоидоскопию каждые пять лет.
Анализ на cкрытую кровь в кале (гемоглобин и трансферин)
Общая характеристика
Качественное определение гемоглобина и трансферрина человека в кале с целью обнаружения желудочно-кишечного кровотечения любой этиологии. «Скрытой» называют кровь, которая не изменяет цвет кала и не определяется макро- и микроскопически.
«Скрытой» называют кровь, которая не изменяет цвет кала и не определяется макро- и микроскопически.
Человеческий гемоглобин в кале является высокоспецифичным исследованием для диагностики кровотечений из нижних отделов ЖКТ, т.к. гемоглобин – нестабильное соединение, он разрушается по мере прохождения по кишечнику и при кровотечениях в желудке, верхних отделах кишечника возможно получение «ложноотрицательных» результатов.
Трансферрин — белок крови, который попадает в просвет кишечника только при заболеваниях, сопровождающихся кровотечениями в ЖКТ и является более стабильным соединением, позволяющий с высокой степенью достоверности выявлять кровотечения в верхних отделах ЖКТ.
Исследование не дает перекрестных реакций с гемоглобином и трансферрином животного происхождения, поэтому перед исследованием пациенту не нужно исключать мясо из рациона питания.
Показания для назначения
1. Раннее скрининговое исследование для диагностики колоректального рака, включая профилактические осмотры в возрасте после 50 лет.
2. Неинвазивная диагностика скрытых кровотечений ЖКТ, отбор пациентов для эндоскопического исследования.
3. Дифференциальная диагностика анемий.
4. Диагностика заболеваний ЖКТ: полипоза кишечника, дивертикулита, язвенного колита, некротизирующего энтероколита у детей раннего возраста и др.
5. При обнаружении гельминтов – для оценки повреждения слизистых ЖКТ.
6. Оценка адекватности терапии язвенной болезни желудка, неспецифического язвенного колита, болезни Крона, туберкулёза кишечника и др.
Маркер
Маркер диагностики скрытых кровотечений из верхних и нижних отделов ЖКТ.
Клиническая значимость
Своевременное определение «скрытого» кровотечения крайне важно для диагностики целого ряда тяжелых заболеваний желудочно-кишечного тракта (ЖКТ), в том числе онкологических:
1. Первичные и метастатические опухоли ЖКТ
2. Язвенные повреждения слизистой ЖКТ
3. Дивертикулит
Дивертикулит
4. Туберкулёз кишечника
5. Неспецифический язвенный колит, болезнь Крона, некротизирующие энтероколиты
6. Гельминтозы с повреждением слизистой кишечника
7. Инфекционные поражения кишечника.
Состав показателей:
Гемоглобин
: СпектрофотометрическийДиапазон измерений: 0-0
Референтные значения:
Возраст
Комментарии
Трансферрин
: ИммунотурбидиметрическийДиапазон измерений: 0-0
Референтные значения:
Возраст
Комментарии
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
кал
Условия доставки:
24 час. при температуре от 2 до 8 градусов Цельсия
при температуре от 2 до 8 градусов Цельсия
Контейнер:
Одноразовый контейнер с герметичной крышкой и л/ш
Правила подготовки пациента
Стандартные условия подготовки (если иное не определено врачом): За 14 дней Исключить проведение инструментальных исследований желудочно-кишечного тракта или медицинских процедур, которые могут вызвать механические повреждения слизистой (например, колоноскопия, ректороманоскопия, очищение кишечника с помощью клизм и др. ). Не требуется соблюдения предварительной диеты.
). Не требуется соблюдения предварительной диеты.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Возможны «ложноположительные результаты» при попадании в пробу человеческой крови из других источников кровотечения (менструальная кровь, кровоточащий геморрой, механические повреждения слизистой при колоноскопия, ректороманоскопия, очищение кишечника с помощью клизм и др.
 ).
).
Интерпретация:
- В пробе обнаружен человеческий гемоглобин и/или трансферрин — «положительно», что сведетельствует о наличии повреждений слизистой оболочки ЖКТ.
Следует помнить, что результаты должны оцениваться в комплексе с другими клинико-инструментальными исследованиями, так как сами по себе не могут быть единственным критерием для постановки диагноза. - Результат — «отрицательно» свидетельствует об отсутствие данных в пользу кровотечений в ЖКТ.
Следует помнить, что результаты должны оцениваться в комплексе с другими клинико-инструментальными исследованиями, так как сами по себе не могут быть единственным критерием для постановки диагноза
Journal of Pediatric Gastroenterology and Nutrition
Тезисы: Ежегодное собрание Североамериканского общества детской гастроэнтерологии, гепатологии и питания, 20–22 октября 2005 г. , Солт-Лейк-Сити, Юта: ПОСТЕРНАЯ СЕССИЯ II, ПЯТНИЦА, 21 ОКТЯБРЯ 2005 г., 12:15–2 : 15:00: Клинические науки
, Солт-Лейк-Сити, Юта: ПОСТЕРНАЯ СЕССИЯ II, ПЯТНИЦА, 21 ОКТЯБРЯ 2005 г., 12:15–2 : 15:00: Клинические науки
73
Пол, Джон; Адзума, Линн; Уоттс, Мэтью; Исли, Дэвид
Информация об автореДетская гастроэнтерология, Скотт и Уайт, Темпл, Техас
дои: 10.1097/01.миль на галлон.0000181929.86800.78
Метрики Было показано, что Кальпротектин, белок массой 36,5 кДа, высвобождаемый в просвет кишечника макрофагами и нейтрофилами, полезен для определения активности заболевания и ответа на лечение при воспалительных состояниях кишечника, таких как воспалительное заболевание кишечника. Аллергия на белок коровьего молока (АБКМ) является распространенной желудочно-кишечной проблемой в младенчестве, связанной с ректальным кровотечением, рвотой, диареей и экземой.Мы предположили, что фекальный кальпротектин является полезным скрининговым тестом для оценки разрешения АБКМ у младенцев. Пилотное исследование было проведено у шести детей в возрасте до 90 дней с ректальным кровотечением и другими симптомами, характерными для аллергии на белок коровьего молока. Уровни фекального кальпротектина определяли с помощью анализа ELISA в исходном состоянии, через 3 и 6 недель после введения смеси с белковым гидролизатом. У всех младенцев клиническое улучшение и ректальное кровотечение прекратилось в течение 6 недель после перевода на смесь с гидролизатом.Исходные уровни кальпротектина в кале варьировались от 135 до 1537 мг/л (в среднем 557 мг/л) и снижались до диапазона 42-219 мг/л (в среднем 163 мг/л) через 6 недель приема смеси с гидролизатом белка. У контрольного пациента без симптомов АБКМ на протяжении всего исследования сохранялись значения кальпротектина в кале от 97 до 129 мг/л. Результаты этого пилотного исследования позволяют предположить, что фекальный кальпротектин может быть полезным скрининговым тестом для ответа на лечение формулой гидролизата белка; однако необходимы дальнейшие исследования с большим числом пациентов, чтобы определить полезность этого теста у младенцев с АБКМ.
Пилотное исследование было проведено у шести детей в возрасте до 90 дней с ректальным кровотечением и другими симптомами, характерными для аллергии на белок коровьего молока. Уровни фекального кальпротектина определяли с помощью анализа ELISA в исходном состоянии, через 3 и 6 недель после введения смеси с белковым гидролизатом. У всех младенцев клиническое улучшение и ректальное кровотечение прекратилось в течение 6 недель после перевода на смесь с гидролизатом.Исходные уровни кальпротектина в кале варьировались от 135 до 1537 мг/л (в среднем 557 мг/л) и снижались до диапазона 42-219 мг/л (в среднем 163 мг/л) через 6 недель приема смеси с гидролизатом белка. У контрольного пациента без симптомов АБКМ на протяжении всего исследования сохранялись значения кальпротектина в кале от 97 до 129 мг/л. Результаты этого пилотного исследования позволяют предположить, что фекальный кальпротектин может быть полезным скрининговым тестом для ответа на лечение формулой гидролизата белка; однако необходимы дальнейшие исследования с большим числом пациентов, чтобы определить полезность этого теста у младенцев с АБКМ.
Одновременное количественное определение клинически значимых иммунных маркеров в мазках кала новорожденных для выявления воспаления SIL) пептидные стандарты с С-концевым аргинином (R*;
13 C 6 H 14 O 2 15 N 4 ; 2+ 10 масс Дазина) C 6 H 14 O 2 15 N 2 ; + 8 Да сдвиг массы) были синтезированы на заказ (SpikeTides™ L и TQL, JPT Technologies, Берлин, Германия).Мы использовали пептиды SIL (SpikeTides™ L) для разработки и оптимизации анализа. Синтетические пептиды SIL, удлиненные на С-конце расщепляемой трипсином меткой (SIL-TCT, SpikeTides™ TQL), использовали в качестве внутренних стандартов для количественного определения белка. Расщепляемая трипсином метка состоит из тетрапептида, который включает остаток нитротирозина 38 . Последовательности всех протеотипических пептидов, использованных для количественного определения белка, представлены в таблицах 1 и 2. Золотой трипсин был получен от Promega (номер по каталогу V5280). Ацетонитрил класса LC–MS (ACN, кат.№ 00136878) и изопропиловый спирт (IPA, № по каталогу 16267802) от Biosolv (Valkenswaard, Нидерланды). Муравьиная кислота (FA, № по каталогу 94318), бикарбонат аммония (ABB, ≥ 99,5%; № по каталогу 09830), йодацетамид (IAA, № по каталогу I6125) и дезоксихолат натрия (SDC, ≥ 98%; № по каталогу 30970). ) были от Sigma Aldrich (Сент-Луис, Миссури). Дитиотреитол (DTT, № по каталогу 20290) и набор для анализа белка ВСА (№ по каталогу 23225) были получены от Thermo Fisher Scientific (Waltham, MA). Деионизированная вода производилась в системе сверхчистой воды Simplicity 185 (Merck Millipore corp.Биллерика, Массачусетс). Таблица 2. Параметры валидации оцениваемых протеотипических пептидов, т. е. линейность ответа, диапазон анализа, LOD и LOQ. Все концентрации в (нМ) для пептидных заменителей и в (мкг/мг) целевого белка в общем белке (по BCA) . Положение стабильного изотопом аргинина (R *; 13 C 6 H 14 o 2 15 N 4 ; + 10 DA Shift) или лизин (K *; 13 C 6 H 14 O 2 15 N 2 ; + 8 Да сдвиг массы) в протеотипической последовательности внутренних стандартных синтетических пептидов, выделенных жирным шрифтом.
Золотой трипсин был получен от Promega (номер по каталогу V5280). Ацетонитрил класса LC–MS (ACN, кат.№ 00136878) и изопропиловый спирт (IPA, № по каталогу 16267802) от Biosolv (Valkenswaard, Нидерланды). Муравьиная кислота (FA, № по каталогу 94318), бикарбонат аммония (ABB, ≥ 99,5%; № по каталогу 09830), йодацетамид (IAA, № по каталогу I6125) и дезоксихолат натрия (SDC, ≥ 98%; № по каталогу 30970). ) были от Sigma Aldrich (Сент-Луис, Миссури). Дитиотреитол (DTT, № по каталогу 20290) и набор для анализа белка ВСА (№ по каталогу 23225) были получены от Thermo Fisher Scientific (Waltham, MA). Деионизированная вода производилась в системе сверхчистой воды Simplicity 185 (Merck Millipore corp.Биллерика, Массачусетс). Таблица 2. Параметры валидации оцениваемых протеотипических пептидов, т. е. линейность ответа, диапазон анализа, LOD и LOQ. Все концентрации в (нМ) для пептидных заменителей и в (мкг/мг) целевого белка в общем белке (по BCA) . Положение стабильного изотопом аргинина (R *; 13 C 6 H 14 o 2 15 N 4 ; + 10 DA Shift) или лизин (K *; 13 C 6 H 14 O 2 15 N 2 ; + 8 Да сдвиг массы) в протеотипической последовательности внутренних стандартных синтетических пептидов, выделенных жирным шрифтом.
Мазки с меконием и фекалиями
В соответствии с Хельсинкской декларацией исследование было одобрено Комитетом по этике CELSPAC: TNG (CELSPAC/EK/4/2016) в Университетской больнице Брно, Чешская Республика. Методы, использованные в исследовании и описанные ниже, применялись в соответствии с соответствующими руководствами и правилами. Авторы подтверждают, что данные, подтверждающие результаты этого исследования, доступны в статье и дополнительных материалах. Информированное согласие было получено от родителей и/или законного опекуна для всех участников исследования и заархивировано.В когортное исследование были включены только одноплодные беременности. Обученный персонал больницы собирал мазки кала у новорожденных (n = 134) в течение первого, второго или третьего дня после рождения с помощью тампонов FLOQSwabs (кат. № 520CS01, Копан, Италия). Меконий или фекалии собирали с обычного подгузника с помощью тампона, затем тампон помещали во флакон объемом 2 мл и отламывали ручку. Флакон запечатывали, немедленно помещали в морозильную камеру при температуре –80 °C и хранили до проведения преаналитической обработки и анализа образца.Объектами исследования были новорожденные женского пола (n = 56) и мужского пола (n = 78) в гестационном возрасте (недель + дней) в диапазоне от 38 + 2 до 41 + 3. до 4900 г. Образцы были взяты у новорожденных, родившихся вагинально (n = 114) или путем кесарева сечения (n = 20). Демографические и клинические характеристики всех субъектов исследования и информация о сборе образцов приведены в таблице S1.
Флакон запечатывали, немедленно помещали в морозильную камеру при температуре –80 °C и хранили до проведения преаналитической обработки и анализа образца.Объектами исследования были новорожденные женского пола (n = 56) и мужского пола (n = 78) в гестационном возрасте (недель + дней) в диапазоне от 38 + 2 до 41 + 3. до 4900 г. Образцы были взяты у новорожденных, родившихся вагинально (n = 114) или путем кесарева сечения (n = 20). Демографические и клинические характеристики всех субъектов исследования и информация о сборе образцов приведены в таблице S1.
Протокол экстракции белков
Мы осаждали белки, добавляя к образцу 1 мл 80 % IPA и орбитальное встряхивание (5 мин, 1600 об/мин).Мы центрифугировали образцы (2 мин, 12 000 × g) и удалили 50 мкл супернатанта. Остаточный объем образца (950 мкл), включая тампон, сушили в скоростном вакууме в течение ночи (минимум 6 ч). Высушенные образцы восстанавливали в 1500 мкл буфера (50 мМ ABB с 5 г/л SDC) и гомогенизировали (Benchmark Scientifics, гомогенизатор Bead Blaster 24, 4 импульса × 30 с; 4 м/с; интервал между интервалами 10 с; температура окружающей среды ).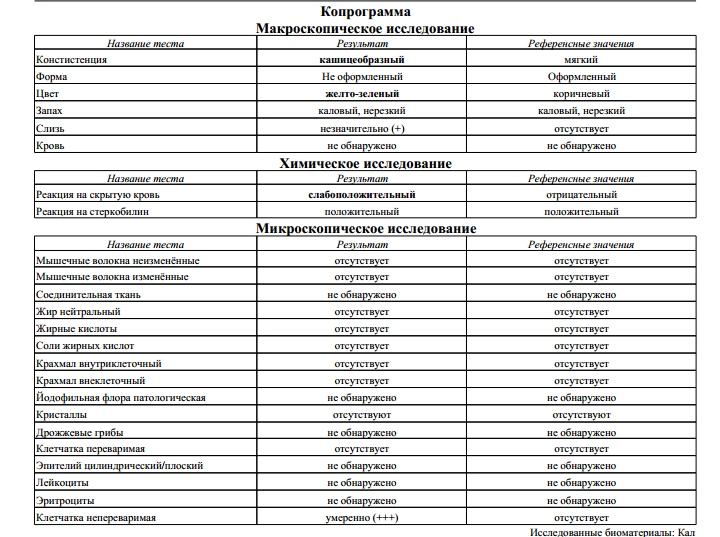 Затем мы центрифугировали образцы (3000 × g; 10 мин), переносили супернатант (500 мкл) в чистый флакон и снова центрифугировали флакон (12 000 × g; 5 мин).После второго центрифугирования супернатант (400 мкл) переносили в другой чистый флакон для расщепления экстрагированных белков трипсином. Концентрацию общего белка в 134 экстрактах мазков неонатального мекония или кала (таблица S2) оценивали в 10 мкл белкового экстракта с использованием анализа BCA (кат. № 23225). Мы подвергли белковый экстракт (50 мкл) протоколу расщепления трипсином.
Затем мы центрифугировали образцы (3000 × g; 10 мин), переносили супернатант (500 мкл) в чистый флакон и снова центрифугировали флакон (12 000 × g; 5 мин).После второго центрифугирования супернатант (400 мкл) переносили в другой чистый флакон для расщепления экстрагированных белков трипсином. Концентрацию общего белка в 134 экстрактах мазков неонатального мекония или кала (таблица S2) оценивали в 10 мкл белкового экстракта с использованием анализа BCA (кат. № 23225). Мы подвергли белковый экстракт (50 мкл) протоколу расщепления трипсином.
Образец свежего веса с содержанием общего белка
Мы подготовили материал для контроля качества (КК), объединив образцы свежего мекония и кала от 12 случайно выбранных новорожденных.Различные количества материала для контроля качества были точно взвешены (25, 50, 75, 100, 125, 150 мг) на тампоне в трех экземплярах. Мы экстрагировали белки из мазков фекалий, как описано выше, и определили содержание белка в белковых экстрактах с помощью анализа BCA (таблица S3). Мы установили корреляцию между свежей массой образца стула и общим содержанием белка и использовали мазки для контроля качества для проверки метода и оценки воспроизводимости.
Мы установили корреляцию между свежей массой образца стула и общим содержанием белка и использовали мазки для контроля качества для проверки метода и оценки воспроизводимости.
Протокол протеолиза трипсина
Мы восстановили и алкилировали белковые экстракты (50 мкл) путем добавления 5 мкл 200 мМ ДТТ (10 мин при 95°C) и последующего добавления 5 мкл 400 мМ ИУК (30 мин при температуре окружающей среды в темный).Мы добавили в образец рабочий раствор (10 мкл; 500–600 нМ) внутренних стандартов пептида SIL-TCT. Далее добавляли трипсин (3 мкл; 1 мкг/мкл) примерно в соотношении 1:70 к общему содержанию белка и инкубировали образцы при 37 ˚C (орбитальное встряхивание 200 об/мин). Мы подавили расщепление трипсином через 5 часов, добавив 200 мкл 2% FA, и пептиды очистили с помощью твердофазной экстракции (SPE, Oasis HLB prime; формат 96-луночного планшета, 30 мг; Waters, Милфорд, Массачусетс). Образцы наносили на ТФЭ, промывали 300 мкл 2% FA и элюировали 200 мкл 50% ACN с 2% FA.Элюаты ТФЭ высушивали в скоростном вакууме, восстанавливали в 50 мкл 5% ACN с 0,1% FA, что приводило к концентрациям внутреннего стандарта SIL-TCT 100–120 нМ в образце (таблица 2), и анализировали с помощью УВЭЖХ/SRM-MS.
Оптимизация времени протеолиза
Белковые экстракты из отдельно взятых мазков для контроля качества (n = 3) объединяли (1200 мкл) и делили на 21 идентичную аликвоту (50 мкл) для подготовки эксперимента с интервальной съемкой в трех экземплярах. Мы не добавляли трипсин в образцы без инкубации (время 0 ч), обогащенные протеотипическими пептидами SIL (добавляли 10 мкл 1.5 мкМ смешанный рабочий раствор, все протеотипические последовательности перечислены в таблице 1). Ко всем инкубированным образцам добавляли трипсин с добавлением внутренних стандартов SIL-TCT (все протеотипические последовательности перечислены в таблице 1). Мы гасили трипсиновое расщепление через 1, 3, 5, 17, 20 и 24 часа инкубации. Ко всем образцам добавляли 2% FA (200 мкл) с последующей обработкой ТФЭ и анализом УВЭЖХ/СРМ-МС. Воспроизводимость расщепления трипсином тестировали с использованием пептидов SIL-TCT SAVQGPPER, DASGATFTWTPSSGK, TPLTATLSK, AVLTIDEK, DLQNFLK, LGHPDTLNQGEFK, ALNSIIDVYHK, DPPQYPVVPVHLDR, NQNTFLR и VVLEGGIDPILR.
Избранные анализы белков с масс-спектрометрическим мониторингом реакций
Образцы вводили (2 мкл) в систему УВЭЖХ (Agilent серии 1260, Калифорния), оснащенную аналитической колонкой (C 18 Пептид CSH; 1,7 мкм, внутр. диаметр 2,1 мм × 100 мм; номер по каталогу 186006937; Уотерс, Милфорд, Массачусетс) в термостате при 40 °C. Подвижная фаза состояла из раствора А (0,1% ФК в воде) и раствора Б (0,1% ФК в АЦН). Скорость потока составляла 300 мкл/мин, а программа градиентного элюирования состояла из аналитических (0–30.9 мин) и часть повторного уравновешивания (31–35 мин): 0,0 мин 5% Б; 25 мин 30% В; 25,5 мин 95% В; 30,9 мин 95% В; 31 мин 5% В; 35 мин. 5 % B. Для соединения системы УВЭЖХ с тройным квадрупольным масс-спектрометром (AJS 6495A, Agilent, CA) использовали электрораспылитель со стандартным потоком. Источник электрораспыления работал в режиме положительных ионов (напряжение на капилляре 3,5 кВ, скорость потока газа 11 л/мин при 130 °C, давление газа в оболочке 25 фунтов на квадратный дюйм при 400 °C, напряжение на сопле 500 В). Мы отслеживали 98 переходов на анализ в динамическом режиме SRM с 2-минутным окном, запланированным для экспериментальной RT пептида.Сигнатурные переходы SRM были эквивалентны для протеотипического пептида и соответствующего внутреннего стандарта SIL, т. е. были получены один переход квантификатора SRM и 2–4 дополнительных перехода SRM квалификатора (таблица S4).
Мы отслеживали 98 переходов на анализ в динамическом режиме SRM с 2-минутным окном, запланированным для экспериментальной RT пептида.Сигнатурные переходы SRM были эквивалентны для протеотипического пептида и соответствующего внутреннего стандарта SIL, т. е. были получены один переход квантификатора SRM и 2–4 дополнительных перехода SRM квалификатора (таблица S4).
Валидация и воспроизводимость анализа белков
Мы выделили белки из всех 134 мазков мекония и фекалий, используя протокол, и объединили белковые экстракты (70 мкл) из всех отдельных образцов. Мы подготовили серию разведений, добавив пептиды SIL-TCT или SIL (10 мкл) в объединенный экстракт, и применили протокол расщепления трипсином и УВЭЖХ-SRM.Мы определили диапазон линейности, предел обнаружения (LOD), предел количественного определения (LOQ), внутридневную и внутридневную точность мультиплексного анализа белка SRM. Серия разведений включала до 9 уровней концентрации, измеренных в 3–6 технических повторностях. Для белков ECP и EDN с низким содержанием использовали отдельную калибровочную кривую. Для воспроизводимости в течение дня и в течение дня белковые экстракты готовили при семи уровнях концентрации (т. е. 0,1; 0,5; 1; 2; 4; 6 и 8 г/л) в трех повторностях, обрабатывали и анализировали в течение трех дней подряд (n = 6). каждый день).
Для белков ECP и EDN с низким содержанием использовали отдельную калибровочную кривую. Для воспроизводимости в течение дня и в течение дня белковые экстракты готовили при семи уровнях концентрации (т. е. 0,1; 0,5; 1; 2; 4; 6 и 8 г/л) в трех повторностях, обрабатывали и анализировали в течение трех дней подряд (n = 6). каждый день).
Анализ данных
Анализы SRM были уточнены с использованием Skyline (версия 19.1.0.193; MacCoss Lab, Вашингтонский университет, Вашингтон). Мы получили интегрированные площади пиков в MassHunter (Agilent, CA), провели статистический анализ для проверки метода с помощью Excel (Microsoft Office Professional Plus, 2013) и выполнили статистический анализ в GraphPad Prism. LOD и LOQ определяли по калибровочной кривой, соответствующей матрице. Для расчета использовалось стандартное отклонение (SD) на самом низком уровне концентрации с коэффициентом вариации (CV) < 20% (n = 6), т.е.g., 3*SD, деленное на НАКЛОН (для LOD) и 10*SD, деленное на НАКЛОН (для LOQ). Коэффициент определений составил R 2 > 0,99, определение с помощью корреляции Спирмена проводили в GraphPad Prism. Критерий Манна-Уитни U использовался для сравнения двух групп в GraphPad Prism (версия 8.3.0).
Коэффициент определений составил R 2 > 0,99, определение с помощью корреляции Спирмена проводили в GraphPad Prism. Критерий Манна-Уитни U использовался для сравнения двух групп в GraphPad Prism (версия 8.3.0).
Повышенный уровень фекальной пептидазы D в начале колита у мышей Galphai2-/-, мышиной модели ВЗК
Аннотация
Фон
Идентификация новых фекальных биомаркеров при воспалительном заболевании кишечника (ВЗК) затруднена из-за сложности человеческого фекального протеома.С другой стороны, в экспериментальных моделях мышей, вероятно, меньше вариаций. Мы исследовали содержание белка в кале у мышей, чтобы определить возможные биомаркеры и патогенные механизмы.
Методы
Образцы фекалий были собраны в начале воспаления у мышей Galphai2 -/- , хорошо описанной спонтанной модели хронического колита, и у здоровых однопометников. Фекальный протеом анализировали с помощью двумерного электрофореза и количественной масс-спектрометрии, а затем результаты подтверждали на новой группе мышей.
Результаты
Как потенциальный главный маркер заболевания, пептидаза D была обнаружена в более высоком соотношении в фекалиях мыши Galphai2 -/- по сравнению с контролем (кратное изменение 27; p = 0,019). Другие белки, обогащенные Gαi2 -/- мышей, представляли собой в основном протеазы поджелудочной железы и белки из плазмы и клеток крови. Также наблюдалась тенденция к увеличению кальпротектина, субъединицы S100-A8 (кратность изменения 21; p = 0,058). Протеазы являются потенциальными активаторами воспаления в желудочно-кишечном тракте благодаря их взаимодействию с рецептором 2, активируемым протеиназой (PAR2).Соответственно, было обнаружено, что уровень PAR2 повышен как в толстой кишке, так и в поджелудочной железе мышей Galphai2 -/- на разных стадиях заболевания.
Выводы
Эти результаты идентифицируют пептидазу D, повсеместно экспрессируемую внутриклеточную пептидазу, как потенциальный новый маркер колита. Повышенные уровни фекальных протеаз могут быть вовлечены в патогенез колита и способствовать клиническому фенотипу, возможно, за счет активации кишечного PAR2.
Повышенные уровни фекальных протеаз могут быть вовлечены в патогенез колита и способствовать клиническому фенотипу, возможно, за счет активации кишечного PAR2.
Образец цитирования: Bergemalm D, Kruse R, Sapnara M, Halfvarson J, Hörnquist EH (2017) Повышенный уровень фекальной пептидазы D в начале колита у мышей Galphai2 -/- , мышиная модель ВЗК.ПЛОС ОДИН 12(3): е0174275. https://doi.org/10.1371/journal.pone.0174275
Редактор: Адам Леснер, Uniwersytet Gdanski, POLAND
Поступила в редакцию: 19 декабря 2016 г.; Принято: 6 марта 2017 г .; Опубликовано: 21 марта 2017 г.
Авторское право: © 2017 Bergemalm et al. Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в документе и в его файле вспомогательной информации.
Финансирование: DB сообщает о грантах исследовательского фонда Бенгт Ихре (http://ihrefellowship.se) и грантах региона Эребру (http://www.fou.nu/is/oll/forskningskommitten, OLL-526131). ), во время проведения исследования. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Компания DB получила дополнительные гранты от окружного совета Эребру, фонда Лизы и Йохана Гронбергов и фонда Mag-tarm.EHH получил дополнительные гранты от Шведского онкологического общества. Спонсоры этих грантов для другой работы не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи. JH сообщает о личных вознаграждениях от Abbvie, личных вознаграждениях от Hospira, личных вознаграждениях от Janssen-Cilag, личных вознаграждениях от Medivir, личных вознаграждениях от MSD, личных вознаграждениях от RenapharmaVifor, личных вознаграждениях от Takeda, и все это не относится к представленной работе. Это не меняет нашей приверженности политике PLOS ONE в отношении обмена данными и материалами.
Это не меняет нашей приверженности политике PLOS ONE в отношении обмена данными и материалами.
Введение
Воспалительное заболевание кишечника (ВЗК), в основном язвенный колит (ЯК) и болезнь Крона (БК), представляет собой потенциально разрушительное заболевание, поражающее людей всех возрастов. ВЗК имеет пик начала у молодых людей и часто характеризуется хроническим течением с обострениями и бессимптомными периодами [1]. Сочетание раннего начала и ожидаемой нормальной продолжительности жизни означает высокую степень накопленной заболеваемости и значительных затрат. Постановка диагноза и мониторинг заболевания традиционно основывались на клинических параметрах, эндоскопической оценке, визуализации и неспецифических маркерах крови, таких как С-реактивный белок, гемоглобин и альбумин.В последние годы было показано, что фекальные маркеры, такие как кальпротектин, позволяют различать функциональные расстройства и ВЗК, а недавно было предложено использовать их в качестве надежных маркеров для раннего выявления рецидива и выявления пациентов с повышенным риском обострения в будущем [2, 3].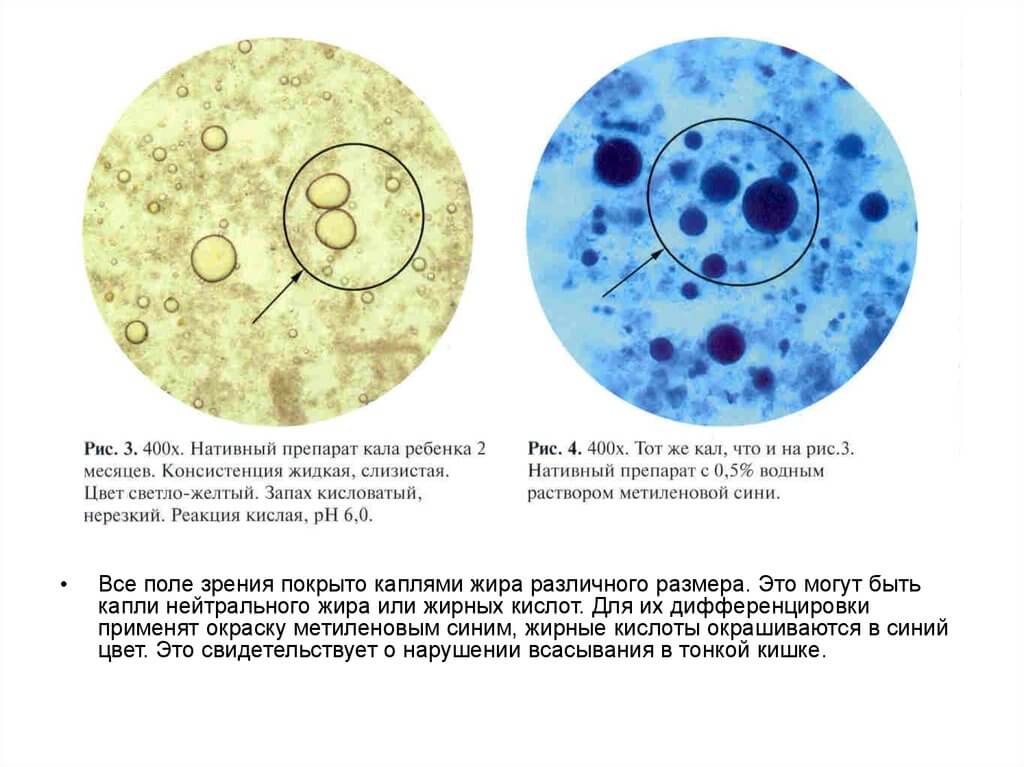 Концепция использования новых фекальных белковых маркеров, например, для диагностики, мониторинга тяжести заболевания и эффективности лекарств, является многообещающей, поскольку она будет неинвазивной и легкодоступной. Однако можно ожидать, что различия в потреблении пищи и кишечной микробиоте между людьми вызовут высокую степень сложности фекального протеома [4].Эти опасения могут препятствовать открытию новых маркеров, особенно когда они выполняются на людях, даже несмотря на то, что в последнее время сообщалось о некоторых достижениях [5]. Напротив, модели лабораторных мышей имеют контролируемую среду с минимальными вариациями в пище и воздействием бактерий, поэтому можно ожидать, что они будут иметь менее изменчивые фекальные протеомы.
Концепция использования новых фекальных белковых маркеров, например, для диагностики, мониторинга тяжести заболевания и эффективности лекарств, является многообещающей, поскольку она будет неинвазивной и легкодоступной. Однако можно ожидать, что различия в потреблении пищи и кишечной микробиоте между людьми вызовут высокую степень сложности фекального протеома [4].Эти опасения могут препятствовать открытию новых маркеров, особенно когда они выполняются на людях, даже несмотря на то, что в последнее время сообщалось о некоторых достижениях [5]. Напротив, модели лабораторных мышей имеют контролируемую среду с минимальными вариациями в пище и воздействием бактерий, поэтому можно ожидать, что они будут иметь менее изменчивые фекальные протеомы.
Нокаут гетеротримерной субъединицы G-белка Galphai2 у мышей приводит к фенотипу, в котором доминирует тяжелый и хронический колит, напоминающий ВЗК [6].Летальное воспаление у мышей с фоном 129Sv начинается с 6–12-недельного возраста и включает кровавый понос, вздутие толстой кишки, перитонит, дисплазию слизистой оболочки и колоректальный рак, тогда как у мышей с фоном C57Bl/6 колит отсутствует. Воспаление характеризуется провоспалительными Th2-лимфоцитами на поздних стадиях заболевания [7], но у мышей до появления симптомов наблюдаются другие изменения, включая повышенное количество антител к комменсальной микробиоте, продуктам питания и собственным тканям, включая перинуклеарные антинейтрофильные антитела. цитоплазматические антитела (p-ANCA) [8, 9].Клетки Galphai2 -/- , полученные из костного мозга, опосредуют колит, что было показано реципрокным переносом костного мозга между Galphai2 -/- и мышами дикого типа [10]. Более свежие данные, полученные нами, выявили раннее и резкое усиление цитокиновых ответов, связанных с Th27, а также изменения микробиоты, связанные со степенью воспаления в модели Galphai2 -/- [11, 12].
Воспаление характеризуется провоспалительными Th2-лимфоцитами на поздних стадиях заболевания [7], но у мышей до появления симптомов наблюдаются другие изменения, включая повышенное количество антител к комменсальной микробиоте, продуктам питания и собственным тканям, включая перинуклеарные антинейтрофильные антитела. цитоплазматические антитела (p-ANCA) [8, 9].Клетки Galphai2 -/- , полученные из костного мозга, опосредуют колит, что было показано реципрокным переносом костного мозга между Galphai2 -/- и мышами дикого типа [10]. Более свежие данные, полученные нами, выявили раннее и резкое усиление цитокиновых ответов, связанных с Th27, а также изменения микробиоты, связанные со степенью воспаления в модели Galphai2 -/- [11, 12].
Proteomics — идеальный метод для идентификации ранее неизвестных белковых маркеров.Влияние колита на фекальный протеом еще не было проанализировано в контролируемой системе, такой как лабораторная модель мыши. Лишь в нескольких исследованиях был проанализирован фекальный протеом лабораторных мышей, но, насколько нам известно, никогда в контексте ВЗК [4, 13, 14]. Кроме того, поскольку у всех мышей Galphai2 -/- в конечном итоге развивается колит, можно исследовать мышей, предрасположенных к заболеванию, но все еще находящихся в предсимптомной фазе.
Кроме того, поскольку у всех мышей Galphai2 -/- в конечном итоге развивается колит, можно исследовать мышей, предрасположенных к заболеванию, но все еще находящихся в предсимптомной фазе.
В настоящем исследовании мы стремились исследовать любые изменения в фекальном протеоме, вызванные нокаутом Galphai2 , чтобы идентифицировать возможные биомаркеры и лучше понять патогенные события, которые вызывают проявления, связанные с ВЗК, в этой модели.
Материалы и методы
Животные
Galphai2 -/- мыши с чистым фоном 129SvEv были выведены с использованием гетерозиготных (Galphai2 +/- самцов и самок). Животные содержались в Отделе экспериментальной биомедицины Гетеборгского университета. Полимеразная цепная реакция на геномной ДНК хвост использовали для подтверждения гомозиготности.У гетерозиготных (Galphai2 +/- ) или животных дикого типа не развивался явный фенотип, и они имели нормальную продолжительность жизни.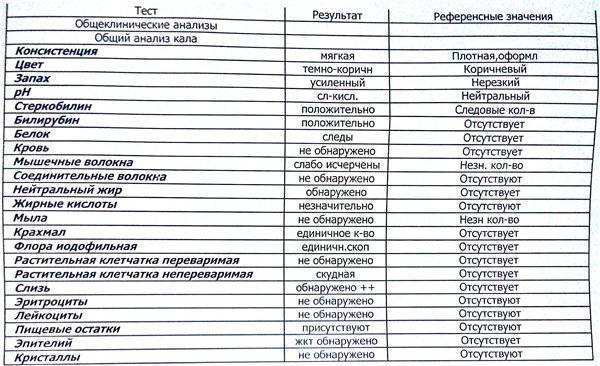 У гомозиготных животных примерно в шестинедельном возрасте развилась тяжелая диарея, и в течение нескольких недель они умерли от колита. За мышами ежедневно наблюдали опытные зоотехники, у которых есть устная и письменная информация об этом конкретном генотипе и симптомах болезни, и их подвергали эвтаназии, если у них наблюдалось ухудшение общего состояния, такое как торчащий мех и/или изменение социального поведения, или если они потеряли больше не более 15 % массы их тела. Их разводили и содержали в клетках микроизолятора с фильтром, во всех случаях в сопровождении других мышей.Они получили экологическое обогащение в виде, например, гнездовые подушечки, корм и воду давали вволю. Ни одна из мышей в исследовании не умерла без эвтаназии в результате тяжелого колита. Мышей не подвергали эвтаназии для сбора фекалий. Мышей с симптомами тяжелого колита, как описано выше, подвергали эвтаназии путем смещения шейных позвонков с последующим удалением сердца. Мыши были проверены на здоровье в соответствии с рекомендациями Федерации европейских лабораторных ассоциаций животных (FELASA), и Комитет по этике животных Гетеборгского университета одобрил исследование.
У гомозиготных животных примерно в шестинедельном возрасте развилась тяжелая диарея, и в течение нескольких недель они умерли от колита. За мышами ежедневно наблюдали опытные зоотехники, у которых есть устная и письменная информация об этом конкретном генотипе и симптомах болезни, и их подвергали эвтаназии, если у них наблюдалось ухудшение общего состояния, такое как торчащий мех и/или изменение социального поведения, или если они потеряли больше не более 15 % массы их тела. Их разводили и содержали в клетках микроизолятора с фильтром, во всех случаях в сопровождении других мышей.Они получили экологическое обогащение в виде, например, гнездовые подушечки, корм и воду давали вволю. Ни одна из мышей в исследовании не умерла без эвтаназии в результате тяжелого колита. Мышей не подвергали эвтаназии для сбора фекалий. Мышей с симптомами тяжелого колита, как описано выше, подвергали эвтаназии путем смещения шейных позвонков с последующим удалением сердца. Мыши были проверены на здоровье в соответствии с рекомендациями Федерации европейских лабораторных ассоциаций животных (FELASA), и Комитет по этике животных Гетеборгского университета одобрил исследование.
Гомогенизация тканевых и фекальных гранул
Белки из фекальных гранул экстрагировали, как описано ранее, с некоторыми модификациями [4]. Вкратце, фекальные гранулы от самцов и самок мышей Galphai2 -/- собирали при подозрении на начало заболевания и до появления каких-либо явных клинических признаков заболевания (4–5 недель) для протеомики. Фекальные гранулы от четырехнедельных мышей были просты в обращении и гомогенизировались по отдельности. Для проверочных экспериментов белки также экстрагировали из фекалий мышей с манифестным колитом (возраст 6–12 недель).Отбор проб отдельных фекальных гранул у нескольких мышей с симптоматическим колитом осложнялся диареей, но для экстракции белка всегда использовалось одинаковое количество буфера по отношению к массе фекалий. Погадки от однопометников дикого типа и Galphai2 +/- собирали аналогичным образом в том же возрасте. Чтобы свести к минимуму экспериментальные отклонения, мы собирали только свежеприготовленные гранулы. Это было обеспечено перемещением отдельных животных в новые клетки для сбора образцов. Все гранулы сразу же хранили при температуре -80°С.Перед гомогенизацией фекальные осадки взвешивали и помещали в разведение 1:10 (г/мл) раствора мочевины (8 М мочевина, 2 М CHAPS) для двумерного электрофореза или Трис-буфер (20 мМ Трис-HCl, рН 7,5, 1% Triton X-100) для количественной масс-спектрометрии и иммуноблоттинга. Все образцы были обработаны коктейлем ингибиторов протеаз (Sigma Aldrich), поскольку высокие уровни протеаз связаны с колитом [15, 16]. Осадки разрушали вручную с помощью наконечника пластиковой пипетки перед гомогенизацией с использованием Ultraturrax (IKA, Stufen, Germany).
Это было обеспечено перемещением отдельных животных в новые клетки для сбора образцов. Все гранулы сразу же хранили при температуре -80°С.Перед гомогенизацией фекальные осадки взвешивали и помещали в разведение 1:10 (г/мл) раствора мочевины (8 М мочевина, 2 М CHAPS) для двумерного электрофореза или Трис-буфер (20 мМ Трис-HCl, рН 7,5, 1% Triton X-100) для количественной масс-спектрометрии и иммуноблоттинга. Все образцы были обработаны коктейлем ингибиторов протеаз (Sigma Aldrich), поскольку высокие уровни протеаз связаны с колитом [15, 16]. Осадки разрушали вручную с помощью наконечника пластиковой пипетки перед гомогенизацией с использованием Ultraturrax (IKA, Stufen, Germany).
Белковые экстракты из толстой кишки и поджелудочной железы для иммуноблоттинга готовили аналогичным образом в Трис-буфере с использованием Ultraturrax. Затем гомогенаты центрифугировали при 20 000 g для осаждения нерастворившегося материала, а собранные надосадочные жидкости перед анализом хранили при -80°C. Общее содержание белка в образцах фекального белка определяли с помощью анализа белка DC (Bio-Rad, Hercules, CA, США) или набора 2D Quant (GE Healthcare, Уппсала, Швеция). Концентрация белка обычно составляла около 2–2.5 мг/мл с тенденцией к несколько более низкой концентрации у мышей Galphai2 -/- .
Общее содержание белка в образцах фекального белка определяли с помощью анализа белка DC (Bio-Rad, Hercules, CA, США) или набора 2D Quant (GE Healthcare, Уппсала, Швеция). Концентрация белка обычно составляла около 2–2.5 мг/мл с тенденцией к несколько более низкой концентрации у мышей Galphai2 -/- .
Двумерный гель-электрофорез (2DE)
Чтобы получить общее представление о распределении белка, вариации отдельных образцов и полуколичественных измерений отдельных белковых пятен, был проведен двумерный гель-электрофорез, как описано ранее [17]. 30 мкг отдельных образцов белка фекалий от четырехнедельных животных Galphai2 -/- , без признаков колита или только с ранними признаками, а также аналогичные образцы белка от здоровых животных того же возраста Galphai2 +/- и фон дикого типа, снабжали буфером IPG с pH 3-11NL (GE Healthcare) до конечной концентрации 0.5% и буфер для регидратации (8 М мочевина, 2% CHAPS и 0,002% бромфеноловый синий) до конечного объема 200 мкл.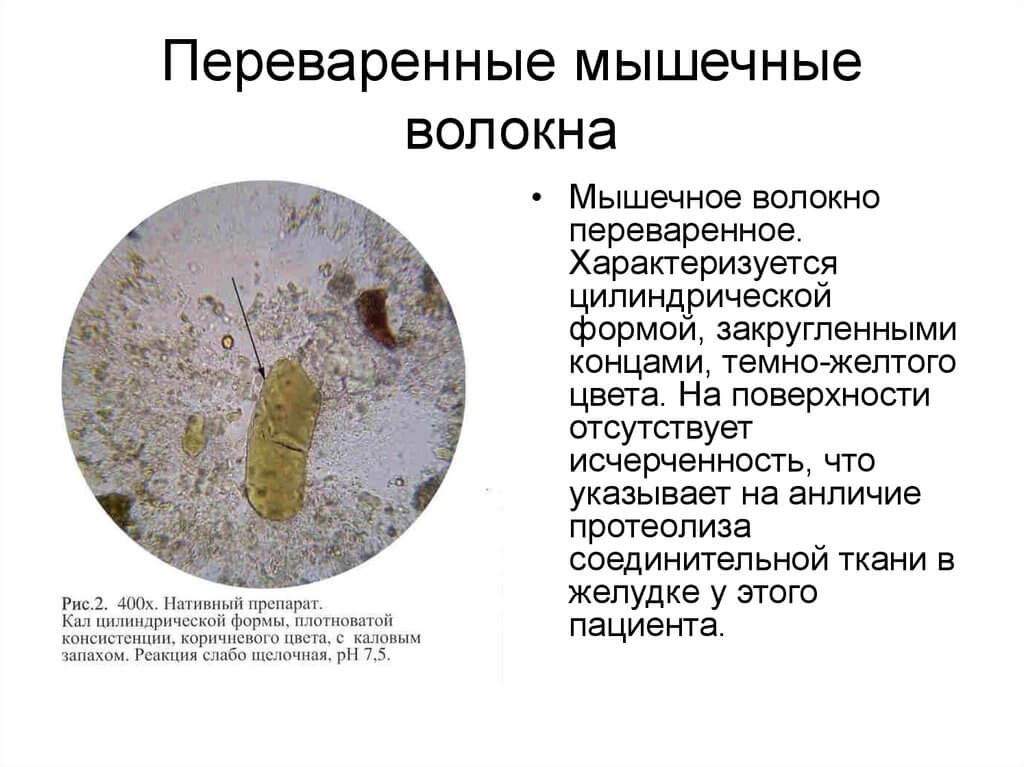 Образцы загружали и регидратировали в 11-сантиметровые полоски 3-11NL IPG (GE Healthcare) в течение 12–16 часов. Изоэлектрическое фокусирование (ИЭФ) выполняли с использованием ячейки Protean IEF (Bio-Rad) при 20°C, а максимальный ток устанавливали на 50 мкА на полоску с пошаговым увеличением напряжения до достижения 11 000 вольт-часов. После IEF полоски уравновешивали в течение 15 минут в уравновешивающем буфере (6 М мочевина, 50 мМ Трис-HCl, pH 8.8, 30% (об./об.) глицерина, 2% SDS и 0,002% бромфенолового синего), содержащего 1% дитиотреитола, а затем в течение 15 мин с 2,5% йодацетамида в том же буфере. Электрофорез второго измерения проводили в системе электрофореза Criterion TM Cell (Bio-Rad). Полоски IPG помещали поверх акриламидных гелей с градиентом 10–20% (масса/объем) (Bio-Rad) и запечатывали 1% расплавленной агарозой в подвижном буфере SDS. Гели запускали при 20°С и 200 В в течение одного часа. Для анализа их окрашивали флуоресцентным красителем Oriole™ (Bio-Rad) и возбуждали УФ-светом с использованием устройства для визуализации Chemidoc XRS (Bio-Rad) с эмиссионным фильтром при 580 нм.
Образцы загружали и регидратировали в 11-сантиметровые полоски 3-11NL IPG (GE Healthcare) в течение 12–16 часов. Изоэлектрическое фокусирование (ИЭФ) выполняли с использованием ячейки Protean IEF (Bio-Rad) при 20°C, а максимальный ток устанавливали на 50 мкА на полоску с пошаговым увеличением напряжения до достижения 11 000 вольт-часов. После IEF полоски уравновешивали в течение 15 минут в уравновешивающем буфере (6 М мочевина, 50 мМ Трис-HCl, pH 8.8, 30% (об./об.) глицерина, 2% SDS и 0,002% бромфенолового синего), содержащего 1% дитиотреитола, а затем в течение 15 мин с 2,5% йодацетамида в том же буфере. Электрофорез второго измерения проводили в системе электрофореза Criterion TM Cell (Bio-Rad). Полоски IPG помещали поверх акриламидных гелей с градиентом 10–20% (масса/объем) (Bio-Rad) и запечатывали 1% расплавленной агарозой в подвижном буфере SDS. Гели запускали при 20°С и 200 В в течение одного часа. Для анализа их окрашивали флуоресцентным красителем Oriole™ (Bio-Rad) и возбуждали УФ-светом с использованием устройства для визуализации Chemidoc XRS (Bio-Rad) с эмиссионным фильтром при 580 нм.
Количественная масс-спектрометрия (QMS) с использованием тандемных масс-меток (TMT)
Подготовка проб для масс-спектрометрического анализа.
Белки экстрагировали из фекалий трех 4-недельных животных Galphai2 -/- с ранними признаками колита и однопометников дикого типа, сопоставимых по возрасту, путем гомогенизации в экстракционном буфере (20 мМ Трис-HCl и 1 % Triton X-100), содержащий смесь ингибиторов протеазы (Sigma Aldrich). Общее содержание белка определяли с помощью теста Pierce™ BCA Protein Assay (Thermo Scientific, Уолтем, Массачусетс, США).Образцы (45 мкг) восстанавливали добавлением 2М DL-дитиотреитола до конечной концентрации 100 мМ и инкубировали при 60°С в течение 30 мин. Образцы были расщеплены трипсином с использованием метода подготовки образцов с фильтрацией (FASP), модифицированного Wisniewski et al [18]. Вкратце, восстановленные образцы наносили на фильтры Nanosep 10k Omega (Pall Life Sciences) и многократно промывали 8 М мочевиной. Алкилирование проводили метилметантиосульфонатом (ММТС), разведенным в буфере для расщепления (1% дезоксихолат натрия и 20 мМ TEAB) в течение 20 мин при комнатной температуре с последующей промывкой буфером для расщепления.Трипсин (трипсиновая протеаза Пирса, класс MS; Thermo Scientific, Уолтем, Массачусетс, США) в соотношении 1:100 по отношению к содержанию белка добавляли в 50 мМ TEAB до pH около 8, и образцы инкубировали в течение ночи при 37°С. Добавляли еще одну порцию трипсина и смесь инкубировали при 37°С в течение трех часов. Пептиды собирали центрифугированием и подвергали реагенту для мечения изобарической массы, TMT®, в соответствии с инструкциями производителя (Thermo Scientific). После мечения ТМТ образцы объединяли и подкисляли муравьиной кислотой для осаждения дезоксихолата натрия.
Алкилирование проводили метилметантиосульфонатом (ММТС), разведенным в буфере для расщепления (1% дезоксихолат натрия и 20 мМ TEAB) в течение 20 мин при комнатной температуре с последующей промывкой буфером для расщепления.Трипсин (трипсиновая протеаза Пирса, класс MS; Thermo Scientific, Уолтем, Массачусетс, США) в соотношении 1:100 по отношению к содержанию белка добавляли в 50 мМ TEAB до pH около 8, и образцы инкубировали в течение ночи при 37°С. Добавляли еще одну порцию трипсина и смесь инкубировали при 37°С в течение трех часов. Пептиды собирали центрифугированием и подвергали реагенту для мечения изобарической массы, TMT®, в соответствии с инструкциями производителя (Thermo Scientific). После мечения ТМТ образцы объединяли и подкисляли муравьиной кислотой для осаждения дезоксихолата натрия.
Пептиды дополнительно очищали и фракционировали с помощью сильной катионообменной хроматографии (ÄKTA-system; Amersham-Pharmacia) на колонке PolySULFOETHYL A™ (100 × 2,1 мм, 5 мкм, 300 Å; PolyLC Inc.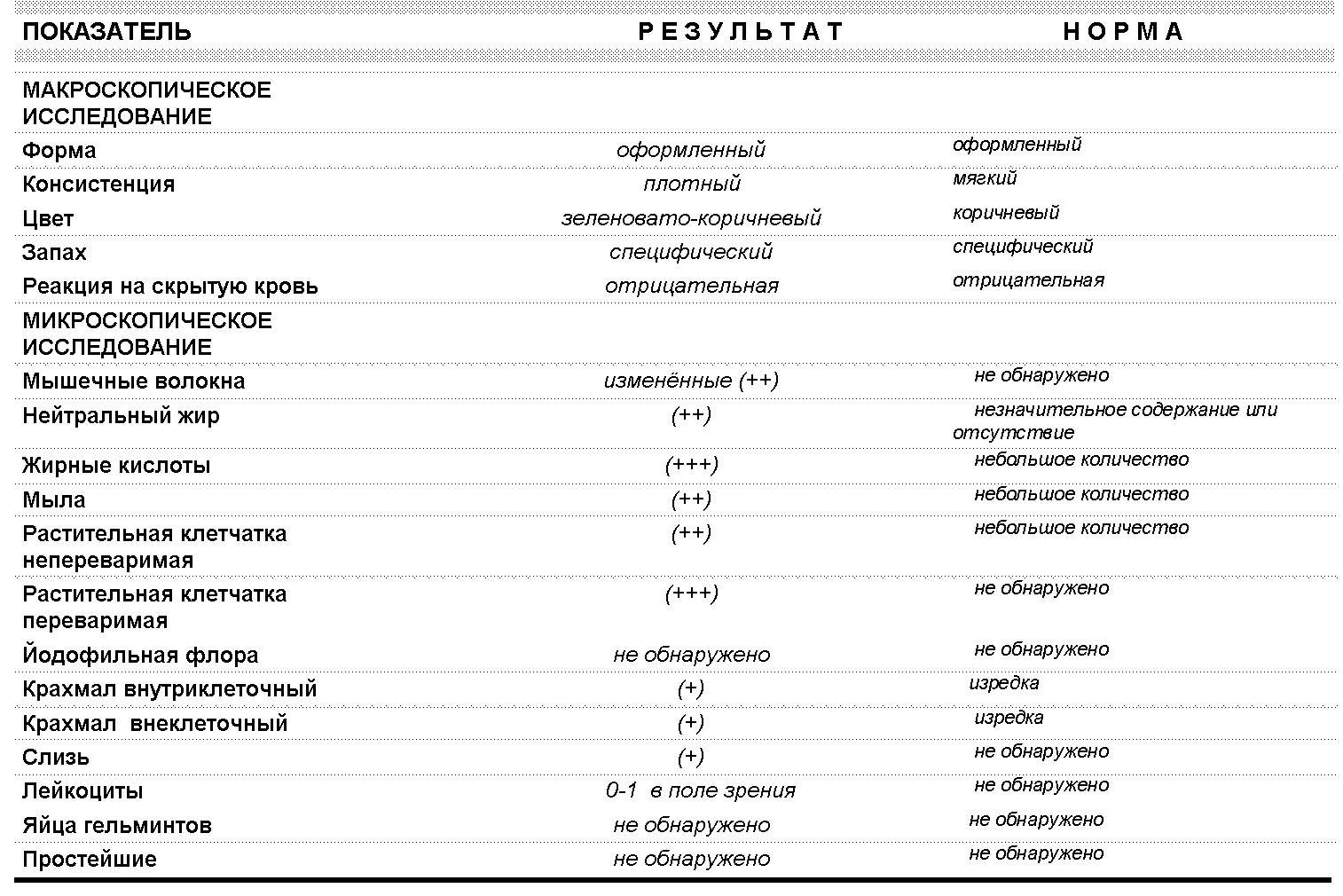 ). Растворитель А представлял собой 25 мМ формиата аммония, рН 2,8, а растворитель В представлял собой 500 мМ формиата аммония, рН 2,8. Градиент работал со скоростью 0,25 мл/мин; 20% растворителя B в течение 20 минут, 40% растворителя B в течение 10 минут и, наконец, 100% растворителя B в течение 10 минут. Всего было собрано 28 фракций, и 22 фракции, содержащие пептиды из каждого набора, были обессолены с использованием спин-колонок PepClean C18 (Thermo Fisher Scientific) в соответствии с рекомендациями производителя.
). Растворитель А представлял собой 25 мМ формиата аммония, рН 2,8, а растворитель В представлял собой 500 мМ формиата аммония, рН 2,8. Градиент работал со скоростью 0,25 мл/мин; 20% растворителя B в течение 20 минут, 40% растворителя B в течение 10 минут и, наконец, 100% растворителя B в течение 10 минут. Всего было собрано 28 фракций, и 22 фракции, содержащие пептиды из каждого набора, были обессолены с использованием спин-колонок PepClean C18 (Thermo Fisher Scientific) в соответствии с рекомендациями производителя.
Анализ ЖХ-МС/МС.
Высушенный, обессоленный 10-плексированный образец, меченный ТМТ, был восстановлен 15 мкл 0,1% муравьиной кислоты (Sigma Aldrich) в 3% ацетонитриле и проанализирован на масс-спектрометре Orbitrap Fusion Tribrid, соединенном с Easy-nLC II (Thermo Fisher научный). Пептиды (вводимый объем 2 мкл) разделяли с использованием аналитической колонки собственной конструкции (внутренний диаметр 300 × 0,075 мм), заполненной частицами Reprosil-Pur C18-AQ размером 1,8 мкм (Dr. Maisch, Германия).Растворитель А представлял собой 0,2% муравьиной кислоты в воде, а растворитель В представлял собой 0,2% муравьиной кислоты в ацетонитриле. Использовали следующий градиент со скоростью 200 нл/мин: 5–30 % растворителя B в течение 75 мин и 30–80 % растворителя B в течение 5 мин с окончательной выдержкой при 80 % растворителя B в течение 10 мин. Ионы вводили в масс-спектрометр при напряжении распыления 1,6 кВ в режиме положительных ионов. МС сканирование проводили с разрешением 120 000, диапазон m/z 350–1500. Анализ МС/МС выполняли в многоканальном режиме, зависящем от данных, с циклом максимальной скорости 3 с для наиболее интенсивных двух- или многозарядных ионов-предшественников.Ионы в каждом MS-сканировании с пороговым значением 5000 были отобраны для фрагментации (MS2) с помощью диссоциации, индуцированной столкновениями (CID), для идентификации на уровне 30% и обнаружения в ионной ловушке с последующей многоступенчатой (одновременной) изоляцией 10 верхних ионов фрагментов MS2 с m/z 400–900, выбрано для фрагментации (MS3) методом диссоциации столкновений высоких энергий (HCD) при 55% и детектировании в Orbitrap с разрешением 60 000, диапазон m/z 100–500.
Maisch, Германия).Растворитель А представлял собой 0,2% муравьиной кислоты в воде, а растворитель В представлял собой 0,2% муравьиной кислоты в ацетонитриле. Использовали следующий градиент со скоростью 200 нл/мин: 5–30 % растворителя B в течение 75 мин и 30–80 % растворителя B в течение 5 мин с окончательной выдержкой при 80 % растворителя B в течение 10 мин. Ионы вводили в масс-спектрометр при напряжении распыления 1,6 кВ в режиме положительных ионов. МС сканирование проводили с разрешением 120 000, диапазон m/z 350–1500. Анализ МС/МС выполняли в многоканальном режиме, зависящем от данных, с циклом максимальной скорости 3 с для наиболее интенсивных двух- или многозарядных ионов-предшественников.Ионы в каждом MS-сканировании с пороговым значением 5000 были отобраны для фрагментации (MS2) с помощью диссоциации, индуцированной столкновениями (CID), для идентификации на уровне 30% и обнаружения в ионной ловушке с последующей многоступенчатой (одновременной) изоляцией 10 верхних ионов фрагментов MS2 с m/z 400–900, выбрано для фрагментации (MS3) методом диссоциации столкновений высоких энергий (HCD) при 55% и детектировании в Orbitrap с разрешением 60 000, диапазон m/z 100–500. Прекурсоры выделяли в квадруполе с окном m/z 1,6, а динамическое исключение в пределах 10 ppm в течение 30 с использовали для значений m/z, уже выбранных для фрагментации.
Прекурсоры выделяли в квадруполе с окном m/z 1,6, а динамическое исключение в пределах 10 ppm в течение 30 с использовали для значений m/z, уже выбранных для фрагментации.
Обработка данных и количественный анализ.
Файлы необработанных данных МС для каждого набора TMT были объединены для относительного количественного определения и идентификации с использованием Proteome Discoverer версии 1.4 (Thermo Fisher Scientific). Поиск в базе данных для каждого набора был выполнен с помощью поисковой системы Mascot (Matrix Science) с использованием базы данных Mus musculus Swissprot Database, ноябрь 2014 г. (Швейцарский институт биоинформатики, Швейцария) с допуском МС пептидов 10 ppm и допуском МС/МС для идентификации. 500 миллимассовых единиц (ммм).Принимали триптические пептиды с нулевым пропущенным расщеплением и вариабельными модификациями окисления метионина и алкилирования цистеина, а также отбирали фиксированные модификации N-концевой ТМТ-метки и лизиновой ТМТ-метки.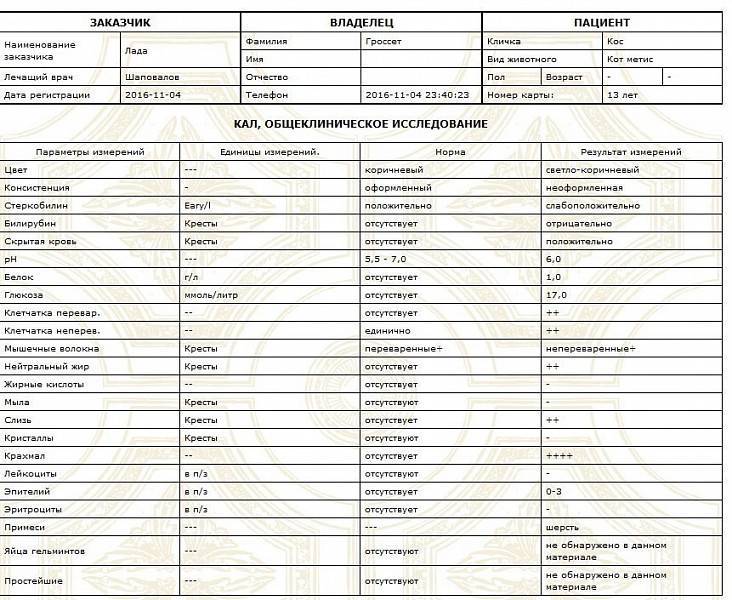 Порог обнаруженного пептида в программном обеспечении был установлен на 1% False Discovery Rate путем поиска в обращенной базе данных, а идентифицированные белки были сгруппированы путем использования одних и тех же последовательностей для минимизации избыточности. Для количественного определения ТМТ использовали отношения интенсивностей репортерных ионов ТМТ в спектрах HCD MS/MS (m/z 126–131) из исходных наборов данных.Соотношения были получены с помощью Proteome Discoverer с использованием следующих критериев: устойчивость к фрагментным ионам как 3 мкМ для наиболее достоверного центроидного пика, а отсутствующие значения заменены минимальной интенсивностью. Для относительного количественного определения учитывались только пептиды, уникальные для данного белка, за исключением пептидов, общих для других изоформ или белков того же семейства. Количественное определение нормализовали, используя влажную массу фекалий и общую концентрацию белка. Отсутствующие белки от отдельных животных были заменены фоновым значением, оцененным по шуму.
Порог обнаруженного пептида в программном обеспечении был установлен на 1% False Discovery Rate путем поиска в обращенной базе данных, а идентифицированные белки были сгруппированы путем использования одних и тех же последовательностей для минимизации избыточности. Для количественного определения ТМТ использовали отношения интенсивностей репортерных ионов ТМТ в спектрах HCD MS/MS (m/z 126–131) из исходных наборов данных.Соотношения были получены с помощью Proteome Discoverer с использованием следующих критериев: устойчивость к фрагментным ионам как 3 мкМ для наиболее достоверного центроидного пика, а отсутствующие значения заменены минимальной интенсивностью. Для относительного количественного определения учитывались только пептиды, уникальные для данного белка, за исключением пептидов, общих для других изоформ или белков того же семейства. Количественное определение нормализовали, используя влажную массу фекалий и общую концентрацию белка. Отсутствующие белки от отдельных животных были заменены фоновым значением, оцененным по шуму. Для количественного анализа спектры MS3 оценивали вручную.
Для количественного анализа спектры MS3 оценивали вручную.
Иммуноблоттинг
Электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) проводили в соответствии со стандартными процедурами. Вкратце, такое же количество мкг отдельных образцов белка снабжали буфером Лэммли (2% ДСН, 5% 10-меркаптоэтанола, 10% глицерина, 0,002% бромфенолового синего, 62,5 мМ трис-HCl, рН 6,8) и загружали в каждую лунку в течение разделение на предварительно приготовленных полиакриламидных гелях Criterion с градиентом 10–20% (Bio-Rad) и последующее электроблоттирование на поливинилидиндифторидных мембранах (GE Healthcare).Блоты исследовали моноклональным первичным антителом против трипсина (1:1 000; Abcam, Кембридж, Великобритания), моноклональным первичным антителом против PAR2 (1:2 000; Abcam) или поликлональным антителом против PEPD (1:500; Sigma Aldrich). затем вторичное антитело против мышиного IgG или против кроличьего IgG, связанное с пероксидазой хрена (разведение 1:100 000; GE Healthcare), и визуализировали с помощью хемилюминесценции с использованием ECL prime (GE Healthcare). Полосы были захвачены с помощью устройства для формирования изображений Chemidoc XRS (Bio-Rad), а количественный анализ денсиометрии был выполнен с использованием программного обеспечения Image Lab v.5.0 (Био-Рад).
Полосы были захвачены с помощью устройства для формирования изображений Chemidoc XRS (Bio-Rad), а количественный анализ денсиометрии был выполнен с использованием программного обеспечения Image Lab v.5.0 (Био-Рад).
Статистический анализ и аннотация функции белка и его субклеточной локализации
Критерий Стьюдента использовали для статистического анализа количественной масс-спектрометрии. Статистическая значимость была установлена на уровне p < 0,05, а биологическая значимость была установлена на уровне кратности ≥ 2 между группами или ≥ 2 по сравнению с фоновым шумом.
Индивидуальные денсиометрические данные иммуноблотов были разделены на среднее значение уровней белка у мышей дикого типа или у мышей до появления симптомов, как указано на каждом рисунке.Эти относительные значения белка были импортированы в SPSS версии 22 (IBM) для статистического сравнения с использованием непараметрического критерия Манна-Уитни.
Для анализа функциональных и субклеточных компартментов использовалась база знаний программного обеспечения Ingenuity Pathway Analysis (5 декабря 2015 г. ) [19] вместе с информацией из базы знаний UniProt [20] и Атласа белков человека [21].
) [19] вместе с информацией из базы знаний UniProt [20] и Атласа белков человека [21].
Результаты
Выделение фекального белка
Все мыши Galphai2 -/- родились здоровыми, и у них появились явные признаки колита (диарея, кровь в стуле) в возрасте 5-6 недель, как описано ранее [22].Для идентификации белковых маркеров, отражающих начало заболевания, образцы фекалий брали в возрасте от четырех до пяти недель. В этом возрасте у мышей не было признаков колита, но фекальные шарики были немного мягче. Можно предположить, что этот момент времени соответствует моменту, когда пациентов с подозрением на ВЗК направляют к специалисту, и поэтому может иметь клиническое значение для определения возможных диагностических маркеров.
Протеомный анализ
Двумерный электрофорез.
Фекалии мышей Galphai2 -/- , здоровых мышей Galphai2 +/- и однопометников дикого типа гомогенизировали, и белки разделяли с помощью 2DE (рис. 1).
1).
Рис. 1. Двумерный электрофорез образцов белка фекалий мышей Galphai2 -/- , мышей Galphai2 +/- и однопометников дикого типа.
Образцы анализировали на гелях с широким охватом изоэлектрических точек (3–11) и молекулярных масс. В гелях от мышей Galphai2 -/- преобладали несколько пятен высокой интенсивности, которые заметно отличались от их гетерозиготных однопометников и однопометников дикого типа.
https://doi.org/10.1371/journal.pone.0174275.g001
Гели показали воспроизводимый рисунок пятен, хотя и немного слабее, чем ожидалось, исходя из нанесенного количества общего белка. В среднем около 400 отдельных белковых пятен были обнаружены в образцах фекалий здоровых мышей Galphai2 +/- и однопометников дикого типа, тогда как у мышей Galphai2 -/- было несколько меньше пятен при разделении 2DE.
Количественная масс-спектрометрия.
Для идентификации и количественного определения потенциальных биомаркеров мы затем проанализировали другой набор образцов фекалий от четырехнедельных мышей Galphai2 -/- и мышей дикого типа с помощью QMS. Мы решили сосредоточиться только на белках-хозяевах, поэтому поиск данных был выполнен в базе данных протеома мыши для идентификации белков. Всего было идентифицировано 120 мышиных белков; десять из этих белков были уникальными для образцов фекалий мышей Galphai2 -/- , тогда как только один белок был уникальным для здоровых однопометников (таблица S1). Однако разница в уровнях отдельных белков между двумя группами превышала кратное изменение +/- 2 и была статистически значимой только для десяти белков, а семь других белков оказались погранично значимыми (таблица 1).Интересно, что концентрация пептидазы D (дипептидазы Xaa-Pro) была высокой в фекалиях мышей Galphai2 -/- , но не могла быть обнаружена ни у одной из мышей дикого типа, что соответствует 27-кратному увеличению Galphai2 — /- мышей относительно наблюдаемого фонового шума у здоровых однопометников (p = 0,019). Возможное увеличение белка S100-A8 (кратность изменения = 21, p = 0,058), известного как одна из субъединиц кальпротектина, можно наблюдать у мышей Galphai2 -/- по сравнению с мышами дикого типа (таблица 1).
Мы решили сосредоточиться только на белках-хозяевах, поэтому поиск данных был выполнен в базе данных протеома мыши для идентификации белков. Всего было идентифицировано 120 мышиных белков; десять из этих белков были уникальными для образцов фекалий мышей Galphai2 -/- , тогда как только один белок был уникальным для здоровых однопометников (таблица S1). Однако разница в уровнях отдельных белков между двумя группами превышала кратное изменение +/- 2 и была статистически значимой только для десяти белков, а семь других белков оказались погранично значимыми (таблица 1).Интересно, что концентрация пептидазы D (дипептидазы Xaa-Pro) была высокой в фекалиях мышей Galphai2 -/- , но не могла быть обнаружена ни у одной из мышей дикого типа, что соответствует 27-кратному увеличению Galphai2 — /- мышей относительно наблюдаемого фонового шума у здоровых однопометников (p = 0,019). Возможное увеличение белка S100-A8 (кратность изменения = 21, p = 0,058), известного как одна из субъединиц кальпротектина, можно наблюдать у мышей Galphai2 -/- по сравнению с мышами дикого типа (таблица 1).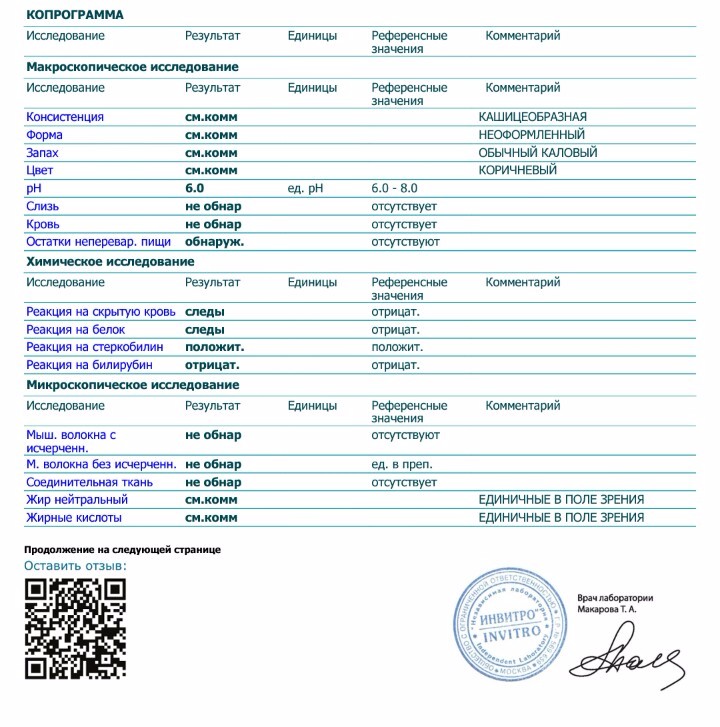 .
.
Анализ данных
Субклеточное происхождение.
Все фекальные белки (n = 120), идентифицированные с помощью QMS, были дополнительно проанализированы с помощью IPA. Результаты показывают, что белки происходят из разных субклеточных компартментов (рис. 2). Большинство белков были классифицированы как внутриклеточные (цитозольные или ядерные), 48%, и в меньшей степени как происходящие из плазматической мембраны (25%) или секретируемые (27%).
Функциональные группы белков.
Для классификации фекальных белков, содержание которых было значительно (p<0.05) или, возможно, (p = 0,05–0,1) изменены (n = 17) у мышей Galphai2 -/- в соответствии с функцией и тканью происхождения, Ingenuity Pathway Analysis [19], базой данных UniProt [20] и использовали Атлас белков человека [21] (табл. 1). Семь из 13 белков с более высокими концентрациями в фекалиях мышей Galphai2 -/- были отнесены к пищеварительным, причем большинство из них (n = 5) были протеазами (табл.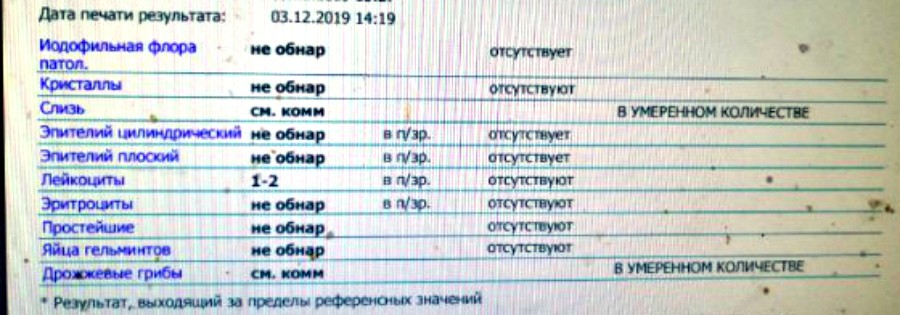 1). Среди протеаз наиболее заметным открытием было значительное повышение уровня пептидазы D.Два белка, транстиретин (р = 0,003) и серотрансферрин (р = 0,087), были взяты из плазмы. Другие белки имели различные функции и не могли быть легко классифицированы в общие группы (таблица 1).
1). Среди протеаз наиболее заметным открытием было значительное повышение уровня пептидазы D.Два белка, транстиретин (р = 0,003) и серотрансферрин (р = 0,087), были взяты из плазмы. Другие белки имели различные функции и не могли быть легко классифицированы в общие группы (таблица 1).
Валидация
Пептидаза D как маркер колита.
Для проверки пептидазы D в качестве потенциального маркера колита были собраны фекалии новых когорт мышей Galphai2 -/- и однопометников дикого типа, а белковые экстракты были подвергнуты иммуноблотингу с использованием антитела к пептидазе D (рис. 3) .
Рис. 3. Иммуноблоты пептидазы D.
Новый набор образцов фекального белка от Galphai2 -/- мышей и здоровых однопометников подвергали иммуноблотингу для обнаружения пептидазы D. Равные количества фекального белка загружали из пяти Galphai2 -/- мыши на разных стадиях колита. Первые две дорожки (слева) были от 4-недельных мышей до появления симптомов, тогда как дорожки 3–5 были от 7-, 10- и 7-недельных мышей с манифестным колитом. Здоровым мышам на момент сбора образцов было всего 4 недели.На прямоугольной диаграмме показан денситометрический количественный анализ блотов, где уровни пептидазы D у мышей Galphai2 -/- представлены относительно среднего значения у здоровых однопометников дикого типа. а.е. = произвольные единицы.
Здоровым мышам на момент сбора образцов было всего 4 недели.На прямоугольной диаграмме показан денситометрический количественный анализ блотов, где уровни пептидазы D у мышей Galphai2 -/- представлены относительно среднего значения у здоровых однопометников дикого типа. а.е. = произвольные единицы.
https://doi.org/10.1371/journal.pone.0174275.g003
Результаты соответствовали данным QMS, но у одной из мышей Galphai2 -/- сигнал был слабее — с интенсивностью, аналогичной к таковому в фекалиях мышей дикого типа. Однако эта мышь была старше других мышей и страдала тяжелым колитом, что могло повлиять на результаты.В отличие от QMS, в образцах от мышей дикого типа также была обнаружена слабая полоса, что указывает на то, что низкий уровень белка пептидазы D является частью нормального фекального протеома.
Фекальные протеазы.
Самой большой функциональной группой измененных белков в фекалиях Galphai2 -/- были протеазы. Повышенное количество панкреатического трипсина сериновой протеазы последовательно связывают с ВЗК [15, 16]. Хотя уровень/содержание панкреатического трипсина не был значительно повышен в наших анализах QMS, мы оценили количество трипсина-2 в фекалиях мышей Galphai2 -/- , мышей Galphai2 +/- и однопометников дикого типа с помощью иммуноблот (рис. 4).
Повышенное количество панкреатического трипсина сериновой протеазы последовательно связывают с ВЗК [15, 16]. Хотя уровень/содержание панкреатического трипсина не был значительно повышен в наших анализах QMS, мы оценили количество трипсина-2 в фекалиях мышей Galphai2 -/- , мышей Galphai2 +/- и однопометников дикого типа с помощью иммуноблот (рис. 4).
Рис. 4. Иммуноблоты трипсина-2.
Образцы белка фекалий от мышей Galphai2 -/- , мышей Galphai2 +/- и однопометников дикого типа подвергали иммуноблотингу для обнаружения трипсина-2. (A) Были загружены равные количества фекального белка от мышей Galphai2 -/- с ранними признаками колита, а также образцы от мышей Galphai2 +/- и однопометников дикого типа того же возраста. (B) Образцы фекального белка от мышей Galphai2 -/- на разных стадиях колита показали тенденцию к более высоким уровням трипсина при прогрессирующем заболевании.На диаграммах показан денситометрический количественный анализ блотов, где уровни трипсина-2 у мышей Galphai2 -/- были изображены относительно среднего значения здоровых однопометников дикого типа (A) или мышей Galphai2 -/- до появления симптомов ( Б). а.е. = произвольные единицы.
а.е. = произвольные единицы.
https://doi.org/10.1371/journal.pone.0174275.g004
В целом уровни трипсина-2 были выше в фекалиях мышей с симптомами Galphai2 -/- , чем в фекалиях мышей дикого типа и до -симптоматические мыши.Известно, что сериновая протеаза и другие протеазы взаимодействуют и активируют протеиназно-активируемый рецептор-2 (PAR2) в желудочно-кишечном тракте [23, 24]. Предполагается, что это способствует патогенезу ВЗК [23, 25, 26]. Чтобы исследовать этот механизм у мышей Galphai2 -/- , мы оценили количество и распределение PAR2 в толстой кишке мышей на разных стадиях заболевания с использованием антитела против PAR2 (фиг. 5A).
Рис. 5. Иммуноблоты PAR2 гомогенатов ткани толстой кишки и поджелудочной железы мышей Galphai2 -/- и здоровых однопометников.
Чтобы изучить возможное влияние повышенного количества люминальных протеаз на уровни PAR2, все образцы мышей Galphai2 -/- , загруженные в гели, были получены от мышей с различными стадиями клинически наблюдаемого колита (> 5 недель). A. PAR2 в гомогенатах толстой кишки Galphai2 -/- и мышей дикого типа. Полоса с несколько более низкой молекулярной массой представляла собой перекрестно реагирующий белок вторичного антитела против мыши и была исключена из денситометрического количественного определения. Б. PAR2 в гомогенатах поджелудочной железы Galphai2 -/- и мышей дикого типа. По сравнению с Galphai2 -/- сигнал PAR2 был слабым у мышей дикого типа. На диаграммах показан денситометрический количественный анализ блотов, где уровни PAR2 у мышей Galphai2 -/- представлены относительно среднего значения у здоровых однопометников дикого типа. а.е. = произвольные единицы.
A. PAR2 в гомогенатах толстой кишки Galphai2 -/- и мышей дикого типа. Полоса с несколько более низкой молекулярной массой представляла собой перекрестно реагирующий белок вторичного антитела против мыши и была исключена из денситометрического количественного определения. Б. PAR2 в гомогенатах поджелудочной железы Galphai2 -/- и мышей дикого типа. По сравнению с Galphai2 -/- сигнал PAR2 был слабым у мышей дикого типа. На диаграммах показан денситометрический количественный анализ блотов, где уровни PAR2 у мышей Galphai2 -/- представлены относительно среднего значения у здоровых однопометников дикого типа. а.е. = произвольные единицы.
https://doi.org/10.1371/journal.pone.0174275.g005
В толстой кишке уровни PAR2 были одинаковыми у отдельных животных дикого типа, тогда как различия были больше у отдельных мышей Galphai2 -/- .В среднем у мышей Galphai2 -/- уровни PAR2 были примерно в три-четыре раза выше. Также известно, что PAR2 экспрессируется в ацинарных клетках поджелудочной железы, где активация рецептора участвует в высвобождении ферментов поджелудочной железы [26, 27]. Поэтому мы подвергли гомогенаты поджелудочной железы мышей Galphai2 -/- с симптомами иммуноблотингу с использованием антитела против PAR2 (фиг. 5B). У мышей Galphai2 -/- уровни PAR2 были явно повышены (со средним кратным изменением примерно в 8 раз), но с различиями между отдельными мышами.
Также известно, что PAR2 экспрессируется в ацинарных клетках поджелудочной железы, где активация рецептора участвует в высвобождении ферментов поджелудочной железы [26, 27]. Поэтому мы подвергли гомогенаты поджелудочной железы мышей Galphai2 -/- с симптомами иммуноблотингу с использованием антитела против PAR2 (фиг. 5B). У мышей Galphai2 -/- уровни PAR2 были явно повышены (со средним кратным изменением примерно в 8 раз), но с различиями между отдельными мышами.
Обсуждение
Насколько нам известно, это исследование является первым протеомным анализом фекалий в мышиной модели ВЗК. Мы идентифицировали потенциальный новый фекальный биомаркер, пептидазу D, которая была обнаружена в фекалиях мышей Galphai2 -/- даже в более высоких относительных количествах, чем белок S100-A8, который является частью комплекса кальпротектина. В соответствии с предыдущими исследованиями мы также наблюдали повышенный уровень фекальных протеаз и активацию тканевого PAR2.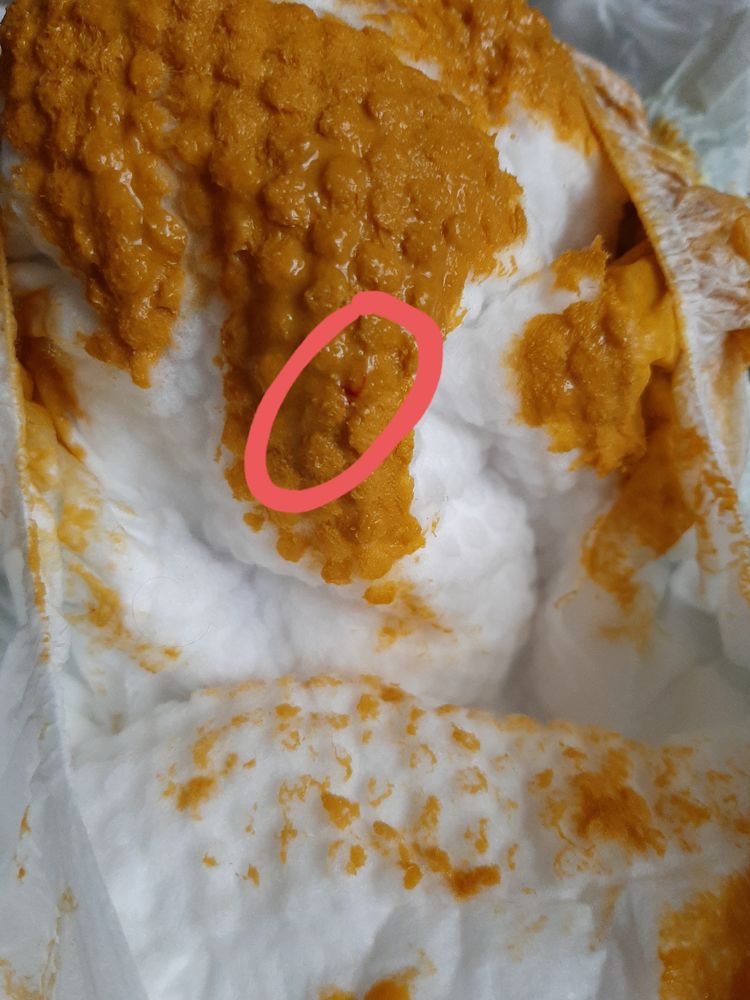 Активация PAR2 может привести к воспалительным реакциям как части патогенеза ВЗК.
Активация PAR2 может привести к воспалительным реакциям как части патогенеза ВЗК.
Наши данные 2DE показали, что фекальный протеом мышей Galphai2 -/- содержал меньше белковых пятен, чем мыши дикого типа. Это может быть связано с повышенным уровнем просветных протеаз и, таким образом, с усилением деградации белков. Однако вариации концентрации общего белка в гомогенатах фекалий были довольно небольшими (2–3 мг/мл, что аналогично тому, что можно было бы ожидать от препаратов тканей), независимо от выбранного метода количественного определения. Как по данным 2DE, так и по QMS, уровни отдельных белков и оценочные количества общего белка были многократно ниже, чем ожидалось, исходя из того, что теоретически применялось при измерении концентрации общего белка в экстрактах фекалий.Причина этого несоответствия неясна, но частично это может быть связано с большим количеством небольших, частично деградированных пептидов, выходящих за пределы диапазона протеомного анализа. Мы также могли ожидать, что значительная часть фекальных белков была получена из микробиоты или переваренной пищи и, следовательно, не была идентифицирована при поиске в базе данных мышей.
Фекальный протеом мышей ранее исследовали на предмет выявления возможных биомаркеров колоректальных аденом [13]. Энг и др.идентифицировали 115 белков мышиного происхождения, что было аналогично количеству белков, идентифицированных в настоящем исследовании. Примерно треть белков, идентифицированных в их модели, совпала с результатами нашего исследования. Лихтман и др. нанесли на карту разнообразие фекального протеома в ответ на различную микробиоту и сообщили об основном фекальном протеоме из 68 белков [4]. Двадцать восемь из этих 68 «коровых» белков были идентифицированы в нашем наборе данных, но ни один из белков, уникальных для мышей Galphai2 -/- , не рассматривался как часть основного протеома.В нашем исследовании белки, предположительно секретируемые или внеклеточные, составляли только 27% идентифицированных белков, что ниже, чем можно было ожидать из более ранних исследований [13]. Явное увеличение просветных белков внутриклеточного происхождения (рис. 2) может быть связано с повреждением слизистой оболочки у мышей Galphai2 -/- , страдающих воспалением, несмотря на наличие минимальных клинических признаков заболевания, но также может быть связано с инфильтративными лейкоцитами. . Небольшое совпадение между моделью Galphai2 -/- и предыдущими исследованиями мышиных моделей колоректального рака, вероятно, связано с различиями, характерными для мышиных моделей.Однако влияние возможных различий, характерных для животноводческих помещений, также может повлиять на вариацию.
. Небольшое совпадение между моделью Galphai2 -/- и предыдущими исследованиями мышиных моделей колоректального рака, вероятно, связано с различиями, характерными для мышиных моделей.Однако влияние возможных различий, характерных для животноводческих помещений, также может повлиять на вариацию.
Пептидаза D представляет собой внутриклеточную пептидазу, в первую очередь участвующую в деградации коллагена, но в некоторой степени также и в пищевых белках — для утилизации аминокислоты пролина. Известно, что мутации зародышевой линии, вызывающие потерю активности белка, приводят к дефициту пролидазы при рецессивно-наследственном заболевании [28]. Белок активируется посредством фосфорилирования и регулируется в основном посредством передачи сигналов интегрина β1 и коллагена-1 [29, 30].Как пептидаза D оказывается в просвете кишечника и кале, неясно; это, конечно, может происходить в результате активного транспорта или в виде остатков некротизированных клеток слизистой оболочки.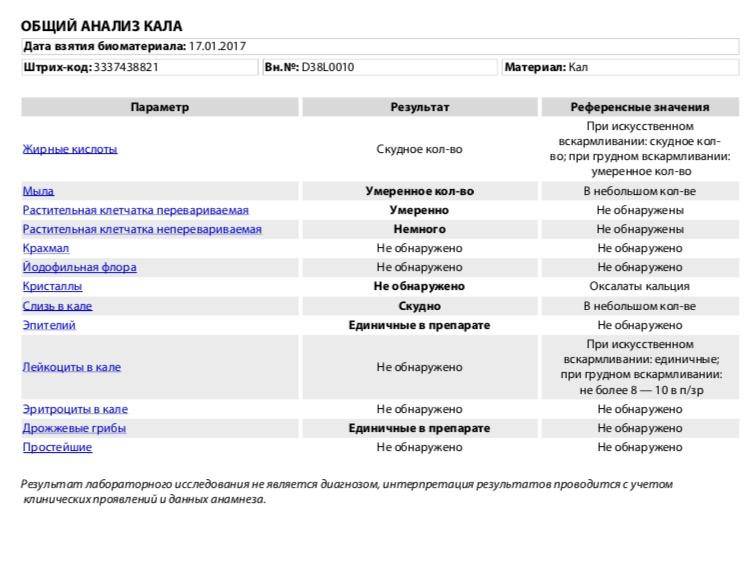 Потенциал пептидазы D как фекального маркера колита должен быть подтвержден дальнейшими исследованиями на людях, что выходит за рамки данного исследования. Пептидаза D, однако, кажется многообещающим маркером, поскольку мы обнаружили, что этот белок имеет даже более высокое отношение сигнал/шум, чем белок S100-A8, в начале заболевания.
Потенциал пептидазы D как фекального маркера колита должен быть подтвержден дальнейшими исследованиями на людях, что выходит за рамки данного исследования. Пептидаза D, однако, кажется многообещающим маркером, поскольку мы обнаружили, что этот белок имеет даже более высокое отношение сигнал/шум, чем белок S100-A8, в начале заболевания.
На вопрос о том, что вызывает воспаление у мышиной модели Galphai2 -/- , еще предстоит ответить.Увеличение люминальных протеаз, например, панкреатического и микробного происхождения, по-видимому, не является специфичным для этой модели, так как об этом уже сообщалось при ВЗК человека [15, 16]. Здесь мы обнаружили доказательства явной активизации или снижения элиминации протеаз до появления явных клинических признаков заболевания, таких как выраженная диарея. Известно, что протеазы, включая трипсин и триптазу, активируют PAR2, который распределяется по желудочно-кишечному тракту [24, 26]. Было показано, что у мышей введение агонистов PAR2 в толстую кишку повышает экспрессию PAR2 и вызывает воспаление [25].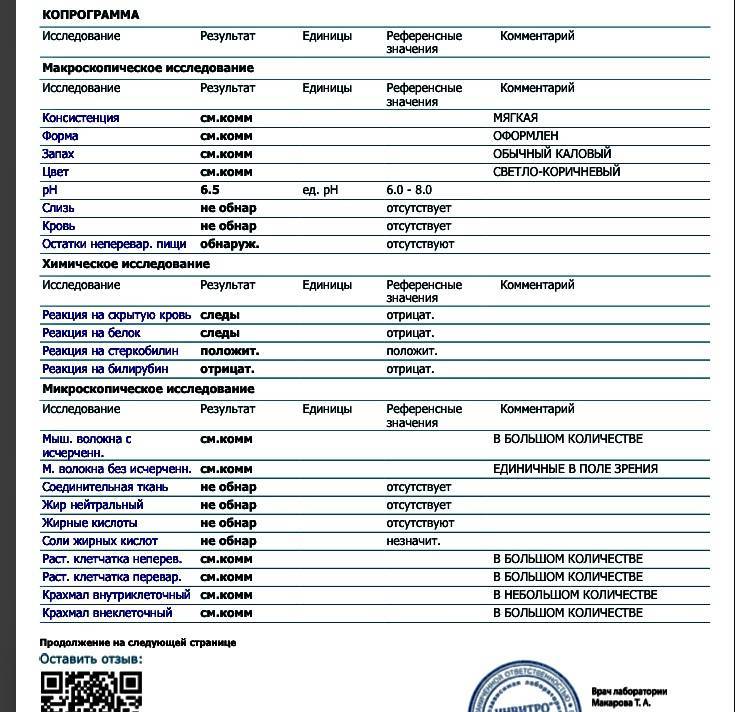 Кроме того, в модели с нокаутом PAR2 химически индуцированный колит (например, с использованием декстрансульфата натрия) приводит к значительному снижению фенотипа [31]. Также было показано, что антагонист PAR2 является эффективным средством лечения колита на крысиных моделях ВЗК [32]. То, как эти результаты коррелируют с патогенными событиями ВЗК человека, требует дальнейшего изучения, но увеличение экспрессии кишечного PAR2 было показано в тканях как у пациентов с болезнью Крона, так и у пациентов с ЯК [33, 34]. Регуляция этого пути, по-видимому, является общей чертой моделей ВЗК грызунов с совершенно разным фоном, и здесь мы обнаружили, что он регулируется при колите, вызванном делецией Galphai2 .
Кроме того, в модели с нокаутом PAR2 химически индуцированный колит (например, с использованием декстрансульфата натрия) приводит к значительному снижению фенотипа [31]. Также было показано, что антагонист PAR2 является эффективным средством лечения колита на крысиных моделях ВЗК [32]. То, как эти результаты коррелируют с патогенными событиями ВЗК человека, требует дальнейшего изучения, но увеличение экспрессии кишечного PAR2 было показано в тканях как у пациентов с болезнью Крона, так и у пациентов с ЯК [33, 34]. Регуляция этого пути, по-видимому, является общей чертой моделей ВЗК грызунов с совершенно разным фоном, и здесь мы обнаружили, что он регулируется при колите, вызванном делецией Galphai2 .
В заключение, мы определили возможный новый фекальный маркер колита; пептидаза D. Дальнейшие исследования ее потенциала в качестве биомаркера ВЗК у людей имеют важное значение. Мы также определили возможный патогенный механизм нокаута Galphai2 , то есть увеличение фекальных протеаз и активацию уровней PAR2. Ранее сообщалось о важности PAR2 в других мышиных моделях, а также у пациентов с ВЗК. Однако, если эти изменения вызваны нокаутом Galphai2 per se или другими вторичными эффектами, требуется дальнейшее исследование.
Ранее сообщалось о важности PAR2 в других мышиных моделях, а также у пациентов с ВЗК. Однако, если эти изменения вызваны нокаутом Galphai2 per se или другими вторичными эффектами, требуется дальнейшее исследование.
Благодарности
Мы благодарим исследовательскую стипендию Бенгта Ире за научную поддержку, а также Центр протеомики Сальгренской академии Гетеборгского университета, который выполнил количественную масс-спектрометрию.
Вклад авторов
- Концептуализация: БД.
- Обработка данных: БД.
- Формальный анализ: БД РК.
- Приобретение финансирования: ДБ.
- Исследование: БД МС.
- Ресурсы: БД MS.
- Надзор: EHH JH.
- Проверка: БД.
- Визуализация: БД РК ЭХХ.
- Письмо – исходный вариант: DB EHH.

- Написание – рецензирование и редактирование: БД МС РК JH EHH.
Каталожные номера
- 1. Дигнасс А., Элиаким Р., Магро Ф., Маасер С., Чауэрс Ю., Гебоес К. и др. Второй европейский доказательный консенсус по диагностике и лечению язвенного колита, часть 1: определения и диагностика.Журнал Крона и колит. 2012;6(10):965–90.
- 2. Mooiweer E, Severs M, Schipper ME, Fidder HH, Siersema PD, Laheij RJ, et al. Низкий уровень фекального кальпротектина предсказывает устойчивую клиническую ремиссию у пациентов с воспалительными заболеваниями кишечника: призыв к глубокой ремиссии. Журнал Крона и колит. 2015;9(1):50–5. Эпублик 18.12.2014.
- 3. Райт Э.К., Камм М.А., Де Круз П., Гамильтон А.Л., Ричи К.Дж., Крежани Э.О. и др. Измерение фекального кальпротектина улучшает мониторинг и выявление рецидива болезни Крона после операции.Гастроэнтерология. 2015;148(5):938–47 e1. пмид:25620670
- 4.
 Лихтман Дж. С., Маркобал А., Зонненбург Дж. Л., Элиас Дж. Э. Протеомика стула, ориентированная на хозяина: новая стратегия, ориентированная на реакцию кишечника на микробиоту кишечника. Молекулярная и клеточная протеомика MCP. 2013;12(11):3310–8. Центральный PMCID в PubMed: PMC3820941.
Лихтман Дж. С., Маркобал А., Зонненбург Дж. Л., Элиас Дж. Э. Протеомика стула, ориентированная на хозяина: новая стратегия, ориентированная на реакцию кишечника на микробиоту кишечника. Молекулярная и клеточная протеомика MCP. 2013;12(11):3310–8. Центральный PMCID в PubMed: PMC3820941. - 5. Verberkmoes NC, Russell AL, Shah M, Godzik A, Rosenquist M, Halfvarson J, et al. Метапротеомика дробовика микробиоты дистального отдела кишечника человека.Журнал ISME. 2009;3(2):179–89. Эпублик 31.10.2008. пмид:18971961
- 6. Рудольф У., Финеголд М.Дж., Рич С.С., Гарриман Г.Р., Шринивасан И., Брабет П. и др. Язвенный колит и аденокарцинома толстой кишки у мышей с дефицитом G альфа i2. Генетика природы. 1995;10(2):143–50. пмид:7663509
- 7.
Hornquist CE, Lu X, Rogers-Fani PM, Rudolph U, Shappell S, Birnbaumer L, et al. У мышей с дефицитом G(альфа)i2 с колитом наблюдается локальное увеличение CD4+ Т-клеток памяти и провоспалительных цитокинов Th2-типа.
 Журнал иммунологии (Балтимор, штат Мэриленд, 1950 г.). 1997;158(3):1068–77.
Журнал иммунологии (Балтимор, штат Мэриленд, 1950 г.). 1997;158(3):1068–77. - 8. Ohman L, Franzen L, Rudolph U, Harriman GR, Hultgren Hornquist E. Иммунная активация в слизистой оболочке кишечника перед началом колита у мышей с дефицитом Galphai2. Скандинавский журнал иммунологии. 2000;52(1):80–90. пмид:10886787
- 9. Uhlig HH, Hultgren Hornquist E, Ohman Bache L, Rudolph U, Birnbaumer L, Mothes T. Реакция антител на диетические и аутоантигены у мышей с дефицитом G альфа i2.Европейский журнал гастроэнтерологии и гепатологии. 2001;13(12):1421–9.
- 10. Бьюрстен М., Виллен Р., Халтгрен Хорнквист Э. Передача колита Т-лимфоцитами с дефицитом Galphai2: влияние субпопуляций и тканевого происхождения. Воспалительные заболевания кишечника. 2005;11(11):997–1005. пмид:16239846
- 11.
Rangel I, Ganda Mall JP, Willen R, Sjoberg F, Hultgren-Hornquist E. Степень колита коррелирует с микробным составом и реакцией цитокинов в толстой и слепой кишке у мышей с дефицитом Galphai2.
 FEMS микробиология экология. 2016;92(7).
FEMS микробиология экология. 2016;92(7). - 12. Gotlind YY, Fritsch Fredin M, Kumawat AK, Strid H, Willen R, Rangel I, et al. Взаимодействие между путями эффекторных Т-клеток T(h)1 и T(h)17 в патогенезе спонтанного колита и рака толстой кишки у мышей с дефицитом Galphai2. Международная иммунология. 2013;25(1):35–44. пмид:22962436
- 13. Анг К.С., Ротакер Дж., Пациурас Х., Берджесс А.В., Найс ЕС. Фекальная протеомика мышей: модельная система для обнаружения потенциальных биомаркеров колоректального рака.Журнал хроматографии А. 2010;1217(19):3330–40. пмид:19875126
- 14. Олексевич М.Б., Кьельдал Х.О., Клено Т.Г. Идентификация белков стула у мышей C57BL/6J с помощью двумерного гель-электрофореза и масс-спектрометрии MALDI-TOF. Биомаркеры биохимические индикаторы воздействия, реакции и восприимчивости к химическим веществам. 2005;10(1):29–40. пмид:16097391
- 15.
Боэ М. Панкреатические и гранулоцитарные эндопротеазы в фекальных экстрактах пациентов с активным язвенным колитом.
 Скандинавский журнал гастроэнтерологии. 1987;22(1):59–64. Эпб 1987/01/01. пмид:3551049
Скандинавский журнал гастроэнтерологии. 1987;22(1):59–64. Эпб 1987/01/01. пмид:3551049 - 16. Эриксон А.Р., Кантарел Б.Л., Ламенделла Р., Дарзи Ю., Монгодин Э.Ф., Пан С. и соавт. Интегрированная метагеномика/метапротеомика выявляет признаки болезни Крона в микробиоте человека-хозяина. ПлоС один. 2012;7(11):e49138. Центральный PMCID в PubMed: PMC3509130. пмид:23209564
- 17. Бергемальм Д., Форсберг К., Сривастава В., Граффмо К.С., Андерсен П.М., Браннстрем Т. и др. Супероксиддисмутаза-1 и другие белки во включениях трансгенных мышей с моделью бокового амиотрофического склероза.Журнал нейрохимии. 2010;114(2):408–18. пмид:20412382
- 18. Вишневски Дж. Р., Зоугман А., Нагарадж Н., Манн М. Универсальный метод подготовки образцов для анализа протеома. Природные методы. 2009;6(5):359–62. Эпб 2009/04/21. пмид:19377485
- 19.
ЦИАГЕН. Функциональные анализы были проведены с использованием QIAGEN’s Ingenuity Pathway Analysis (IPA®, QIAGEN Redwood City) 2015.
 Доступно по адресу: http://www.qiagen.com/ingenuity).
Доступно по адресу: http://www.qiagen.com/ingenuity). - 20. Юнипрот С.UniProt: центр информации о белках. Исследование нуклеиновых кислот. 2015; 43 (выпуск базы данных): D204–12. Центральный PMCID в PubMed: PMC4384041. пмид:25348405
- 21. Улен М., Фагерберг Л., Халльстром Б.М., Линдског С., Оксволд П., Мардиноглу А. и соавт. Протеомика. Тканевая карта протеома человека. Наука. 2015;347(6220):1260419. пмид:25613900
- 22. Gotlind YY, Raghavan S, Bland PW, Hornquist EH. Регуляторные Т-клетки CD4+FoxP3+ от мышей Galphai2-/- функционально активны in vitro, но не предотвращают колит.ПлоС один. 2011;6(9):e25073. Центральный PMCID в PubMed: PMC3178583. пмид:21966415
- 23. Кэрролл И.М., Махаршак Н. Энтеробактериальные протеазы при воспалительных заболеваниях кишечника — патофизиология и клинические последствия. Всемирный журнал гастроэнтерологии. 2013;19(43):7531–43. Центральный PMCID в PubMed: PMC3837251. пмид:24431894
- 24.
 Vergnolle N. Клиническая значимость рецепторов, активированных протеиназой (pars) в кишечнике. Кишка. 2005;54(6):867–74. Центральный PMCID в PubMed: PMC1774539.пмид:15888798
Vergnolle N. Клиническая значимость рецепторов, активированных протеиназой (pars) в кишечнике. Кишка. 2005;54(6):867–74. Центральный PMCID в PubMed: PMC1774539.пмид:15888798 - 25. Cenac N, Coelho AM, Nguyen C, Compton S, Andrade-Gordon P, MacNaughton WK, et al. Индукция воспаления кишечника у мышей путем активации рецептора-2, активируемого протеиназой. Американский журнал патологии. 2002; 161 (5): 1903–15. Центральный PMCID в PubMed: PMC1850779. пмид:12414536
- 26.
Soreide K. Рецептор 2, активируемый протеиназой (PAR-2), в патофизиологии желудочно-кишечного тракта и поджелудочной железы, воспалении и новообразованиях. Скандинавский журнал гастроэнтерологии.2008;43(8):902–9. пмид:1
62
- 27.
Кавабата А., Курода Р., Нисида М., Нагата Н., Сакагучи Ю., Кавао Н. и др. Активируемый протеазой рецептор-2 (PAR-2) в поджелудочной и околоушной железах: иммунолокализация и участие оксида азота в вызванной секреции амилазы.
 Науки о жизни. 2002;71(20):2435–46. пмид:12231404
Науки о жизни. 2002;71(20):2435–46. пмид:12231404 - 28. Джексон С.Х., Деннис А.В., Гринберг М. Иминодипептидурия: генетический дефект в переработке коллагена; метод определения пролидазы в эритроцитах.Журнал Канадской медицинской ассоциации. 1975;113(8):759, 62–3. Центральный PMCID в PubMed: PMC1956611. пмид:803128
- 29. Карна Э., Шока Л., Палка Дж. Тромбин-зависимая модуляция бета1-интегрин-опосредованной передачи сигналов активирует пролидазу и HIF-1альфа через p-FAK в клетках колоректального рака. Молекулярная и клеточная биохимия. 2012;361(1–2):235–41. пмид:21993963
- 30. Палка Дж. А., Пханг Дж. М. Активность пролидазы в фибробластах регулируется взаимодействием внеклеточного матрикса с интегриновыми рецепторами клеточной поверхности.Журнал клеточной биохимии. 1997;67(2):166–75. пмид:9328822
- 31.
Hyun E, Andrade-Gordon P, Steinhoff M, Vergnolle N. Активация рецептора-2, активируемая протеазой: основной фактор воспаления кишечника.
 Кишка. 2008;57(9):1222–9. пмид:18460552
Кишка. 2008;57(9):1222–9. пмид:18460552 - 32. Ломан Р.Дж., Коттерелл А.Дж., Суен Дж., Лю Л., До А.Т., Веси Д.А. и соавт. Антагонизм к активируемому протеазой рецептору 2 защищает от экспериментального колита. Журнал фармакологии и экспериментальной терапии.2012;340(2):256–65. пмид:22028393
- 33. Christerson U, Keita AV, Soderholm JD, Gustafson-Svard C. Повышенная экспрессия рецептора-2, активируемого протеазой, в тучных клетках слизистой оболочки при илеите Крона. Журнал Крона и колит. 2009;3(2):100–8.
- 34. Kim JA, Choi SC, Yun KJ, Kim DK, Han MK, Seo GS и др. Экспрессия активируемого протеазой рецептора 2 при язвенном колите. Воспалительные заболевания кишечника. 2003;9(4):224–9. пмид:125
Текущее состояние фекального кальпротектина как диагностического или мониторингового биомаркера аллергии к белкам коровьего молока у детей: предварительный обзор
Nissen SP, Kjaer HF, Høst A, Nielsen J, Halken S. Естественное течение сенсибилизации и аллергических заболеваний от детского до зрелого возраста. Детская Аллергия Иммунол. 2013; 24: 549–55.
Естественное течение сенсибилизации и аллергических заболеваний от детского до зрелого возраста. Детская Аллергия Иммунол. 2013; 24: 549–55.
Артикул Google ученый
Sicherer SH, Sampson HA. Пищевая аллергия: эпидемиология, патогенез, диагностика и лечение. J Аллергия и Клин Иммунол. 2014;133:e5.
Google ученый
Колецко С., Ниггеманн Б., Арато А., Диас Дж. А., Хойшкел Р., Хасби С. и др.Диагностический подход и лечение аллергии на белок коровьего молока у младенцев и детей: Практические рекомендации ESPGHAN GI Committee. J Pediatr Gastroenterol Nutr. 2012;55:221–9.
КАС Статья Google ученый
Гейне Р.Г. Патофизиология, диагностика и лечение заболеваний желудочно-кишечного тракта, вызванных пищевыми белками. Курр Опин Аллергия Клин Иммунол.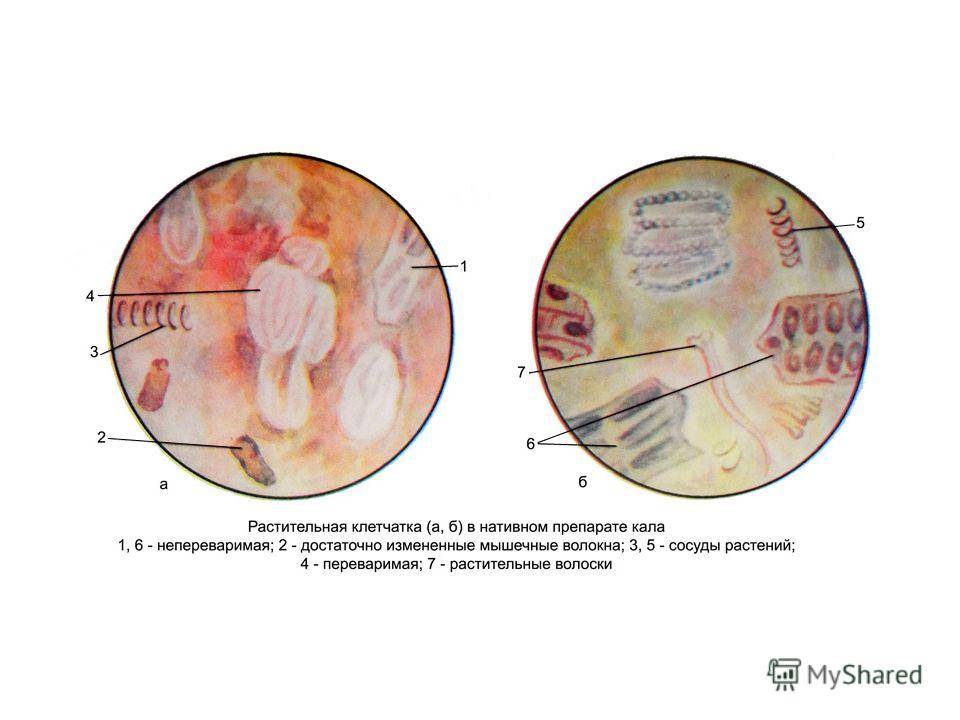 2004; 4: 221–9.
2004; 4: 221–9.
Артикул Google ученый
Неха К., Киртика П.FPIES: обзор лечения синдрома энтероколита, вызванного пищевыми белками. Дело Rep Педиатр. 2016;2016:1–5.
Google ученый
Caubet JC, Cianferoni A, Groetch M. Синдром энтероколита, вызванный пищевыми белками. Клин Эксперт Аллергия. 2019;49:1178–90.
КАС Статья Google ученый
Стриз И., Требичевский И. Кальпротектин: плейотропная молекула при остром и хроническом воспалении.Физиол рез. 2020; 53: 245–53.
Google ученый
Эррера О.Р., Кристенсен М.Л., Хелмс Р.А. Кальпротектин: клиническое применение в педиатрии. J Pediatr Pharmacol Ther. 2016;21:308–21.
ПабМед ПабМед Центральный Google ученый
Холтман Г.А., Лисман-ван Левен Ю., Дэй А.С., Фагерберг У.Л., Хендерсон П., Лич С.Т. и др. Использование лабораторных маркеров в дополнение к симптомам для диагностики воспалительного заболевания кишечника у детей: метаанализ данных отдельных пациентов.JAMA Педиатр. 2017; 171:984–91.
Артикул Google ученый
Панг Т., Лич С.Т., Кац Т., Дэй А.С., Оои С.И. Фекальные биомаркеры здоровья и заболеваний кишечника у детей. Фронт Педиатр. 2014;2:6.
Артикул Google ученый
Jo J, Garssen J, Knippels L, Sandalova E. Роль клеточного иммунитета в аллергии на коровье молоко: патогенез, индукция толерантности и не только.Медиаторы воспаления. 2014;2014:249784.
Артикул Google ученый
Zhu Q, Li F, Wang J, Ma J, Sheng X. Активация кальпротектина при легкой IgE-опосредованной гиперчувствительности к овальбумину. Онкотаргет. 2017;8:37342–54.
Онкотаргет. 2017;8:37342–54.
Артикул Google ученый
Bunn SK, Bisset WM, Main MJ, Golden BE. Фекальный кальпротектин как показатель активности заболевания при воспалительных заболеваниях кишечника у детей.J Pediatri Gastroenterol Nutr. 2001; 32: 171–7.
КАС Статья Google ученый
Берни Канани Р., Рапаччуоло Л., Романо М.Т., Тантурри де Горацио Л., Террин Г., Мангузо Ф. Диагностическое значение фекального кальпротектина в клинической практике педиатрической гастроэнтерологии. Копать печень Dis. 2004; 36: 467–70.
КАС Статья Google ученый
Аркси Х., О’Мэлли Л.Предварительные исследования: к методологической основе. Int J Soc Res Methodol. 2005; 8: 19–32.
Артикул Google ученый
Tricco AC, Lillie E, Zarin W, O’Brien KK, Colquhoun H, Levac D, et al. Расширение PRISMA для предварительных обзоров (PRISMA-ScR): контрольный список и объяснение. Энн Интерн Мед. 2018; 169: 467–73.
Артикул Google ученый
Джон П., Линн А., В.С. М., Дэвид Э.Фекальный кальпротектин и аллергия на белок коровьего молока у младенцев: 73. J Pediatr Gastroenterol Nutr. 2005; 41:515.
Google ученый
Baldassarre ME, Laforgia N, Fanelli M, Laneve A, Grosso R, Lifschitz C. Lactobacillus GG улучшает выздоровление у младенцев с кровью в стуле и подозрением на аллергический колит по сравнению с применением только сильно гидролизованной смеси. J Педиатр. 2010; 156: 397–401.
КАС Статья Google ученый
Бешер О.Ф., Санджак С., Эркан Т., Кутлу Т.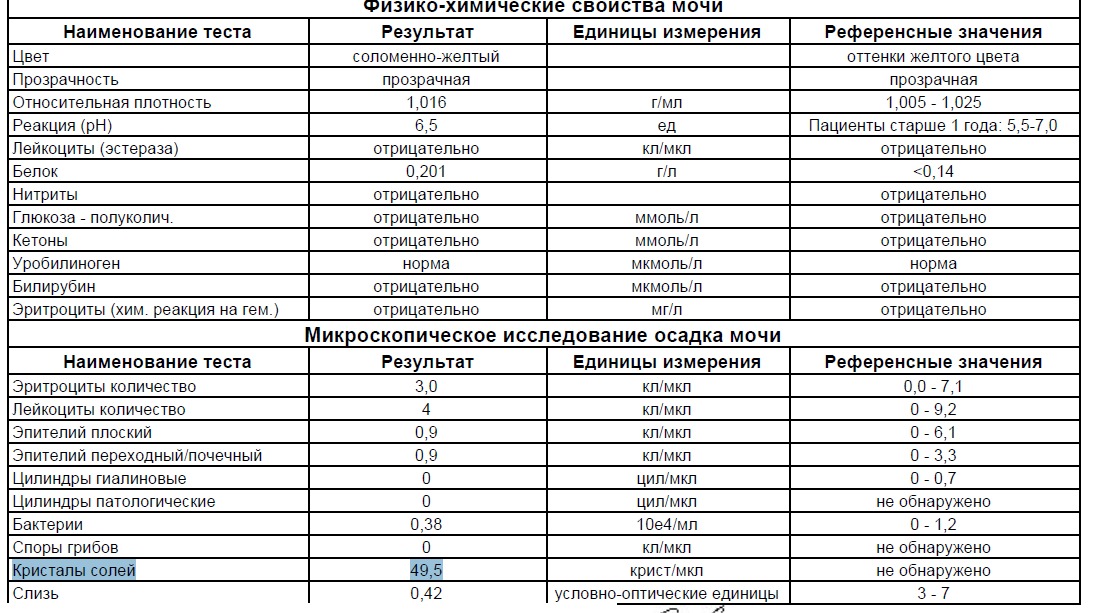 , Кокуграш Х., Кокуграш Ф.Ч.Можно ли использовать уровень кальпротектина в кале в качестве маркера воспаления при диагностике и последующем наблюдении за аллергией на белок коровьего молока? Аллергия Астма Immunol Res. 2014;6:33–8.
, Кокуграш Х., Кокуграш Ф.Ч.Можно ли использовать уровень кальпротектина в кале в качестве маркера воспаления при диагностике и последующем наблюдении за аллергией на белок коровьего молока? Аллергия Астма Immunol Res. 2014;6:33–8.
Артикул Google ученый
Трилло Белисон С., Ортега Паес Э., Медина Кларос А.Ф., Родригес Санчес И., Рейна Гонсалес А., Вера Медиалдеа Р. и др. Фекальный кальпротектин как средство диагностики не-IgE-опосредованной аллергии к белкам коровьего молока. Педиатр (Барк).2016;84:318–23.
Артикул Google ученый
Lendvai-Emmert D, Emmert V, Fusz K, Premusz V, Boncz I, Tóth G. Количественный анализ фекального кальпротектина у детей с аллергией на белок коровьего молока. Ценность в здоровье. 2018;21:S128.
Артикул Google ученый
Атаи П., Зогали М., Никху Б., Гадери Э., Мансури М., Насири Р. и др. Диагностическое значение фекального кальпротектина в ответ на диету матери у детей, находящихся на грудном вскармливании, с колитом, вызванным аллергией на коровье молоко.Иран Дж Педиатр. 2018;28:e66172.
Артикул Google ученый
Диас М., Гуадамуро Л., Эспиноса-Мартос И., Манкабелли Л., Хименес С., Молинос-Норниэлла С. и др. Микробиота и производные параметры в образцах фекалий младенцев с аллергией на белок коровьего молока без IgE при ограниченной диете. Питательные вещества. 2018;10:E1481.
Артикул Google ученый
Берни Канани Р., Ночерино Р., Леоне Л., Ди Костанцо М., Террин Г., Пассарелло А. и др.Толерантность к новой смеси на основе свободных аминокислот у детей с IgE или не-IgE-опосредованной аллергией на коровье молоко: рандомизированное контролируемое клиническое исследование. БМС Педиатр. 2013;13:24.
БМС Педиатр. 2013;13:24.
Артикул Google ученый
Меррас-Салмио Л., Колхо К.Л., Пелконен А.С., Куйтунен М., Мякеля М.Дж., Савилахти Э. Маркеры воспаления слизистой оболочки кишечника и специфические иммуноглобулины коровьего молока при аллергии на коровье молоко без IgE. Клин Трансл Аллергия. 2014;4:8.
Артикул Google ученый
Винберг А., Нагаева О., Нагаев И., Лунделл С., Аренсибия И., Минчева-Нильссон Л. и др.Динамика экспрессии мРНК цитокинов и фекальных биомаркеров у школьников, подвергшихся серии двойных слепых плацебо-контролируемых пищевых проб. Цитокин. 2016; 88: 259–66.
КАС Статья Google ученый
Baldassarre ME, Fanelli M, Lasorella ML, Laneve A, Grosso R, Falcone MR, et al. Фекальный кальпротектин у новорожденных: прогностический маркер гастроинтестинальных и/или аллергических заболеваний? Иммунофармакол Иммунотоксикол. 2011;33:220–3.
2011;33:220–3.
Артикул Google ученый
Оривуори Л., Мустонен К., де Гоффау М.С., Хакала С., Паасела М., Родуит С. и др. Высокий уровень фекального кальпротектина в возрасте 2 месяцев как маркер воспаления кишечника позволяет прогнозировать развитие атопического дерматита и астмы к 6 годам. Clin Exp Allergy. 2015;45:928–39.
КАС Статья Google ученый
Seo SC, Ahn SH, Ri S, Yoon Y, Byeon JH, Kim SH и др.Повышенные уровни фекального кальпротектина связаны с тяжестью атопического дерматита у детей. Азиатская Пак J Аллергия Иммунол. 2018;36:82–7.
КАС пабмед Google ученый
Olafsdottir E, Aksnes L, Fluge G, Berstad A. Уровни фекального кальпротектина у младенцев с младенческими коликами, здоровых младенцев, детей с воспалительными заболеваниями кишечника, детей с рецидивирующей болью в животе и здоровых детей. Акта Педиатр. 2002; 91:45–50.
Акта Педиатр. 2002; 91:45–50.
КАС Статья Google ученый
Дороско С.М., Маккензи Т., Коннор Р.И. Концентрация кальпротектина в кале у детей, находящихся на исключительно грудном вскармливании, выше, чем у детей, находящихся на смешанном вскармливании. Грудное вскармливание Мед. 2008;3:117–9.
Артикул Google ученый
Пеура С., Фолл Т., Алмквист С., Андольф Э., Хедман А., Першаген Г. и др. Нормальные значения кальпротектина в образцах стула младенцев из популяционного лонгитюдного исследования «от рождения до жизни».Scand J Clin Lab Invest. 2018;78:120–4.
КАС Статья Google ученый
Непереносимость соевого белка Клиническая картина: анамнез, физикальное исследование, причины
Автор
Стефано Гуандалини, доктор медицины Основатель и медицинский директор Центра целиакии, заведующий отделением детской гастроэнтерологии, гепатологии и питания отделения педиатрии Медицинского центра Чикагского университета; Профессор кафедры педиатрии, секция гастроэнтерологии, гепатологии и питания, Чикагский университет, отделение биологических наук, Притцкеровская школа медицины
Стефано Гуандалини, доктор медицинских наук, является членом следующих медицинских обществ: Американская гастроэнтерологическая ассоциация, Европейское общество Детская гастроэнтерология, гепатология и питание, Североамериканское общество детской гастроэнтерологии, гепатологии и питания, Североамериканское общество по изучению глютеновой болезни
Раскрытие информации: Не раскрывать.
Соавтор (ы)
Агостино Ночерино, доктор медицины, доктор медицинских наук Заведующий отделением детской онкологии, отделение педиатрии, Университет Удине, Италия
Агостино Ночерино, доктор медицинских наук, является членом следующих медицинских обществ: Итальянское общество детской гематологии и онкологии, Итальянское общество педиатрии
Раскрытие информации: Нечего раскрывать.
Редакционная коллегия специалистов
Мэри Л. Виндл, PharmD адъюнкт-профессор Фармацевтического колледжа Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: Нечего раскрывать.
Дэвид А. Пикколи, доктор медицины , заведующий отделением детской гастроэнтерологии, гепатологии и питания Детской больницы Филадельфии; Профессор Медицинской школы Пенсильванского университета
Дэвид А.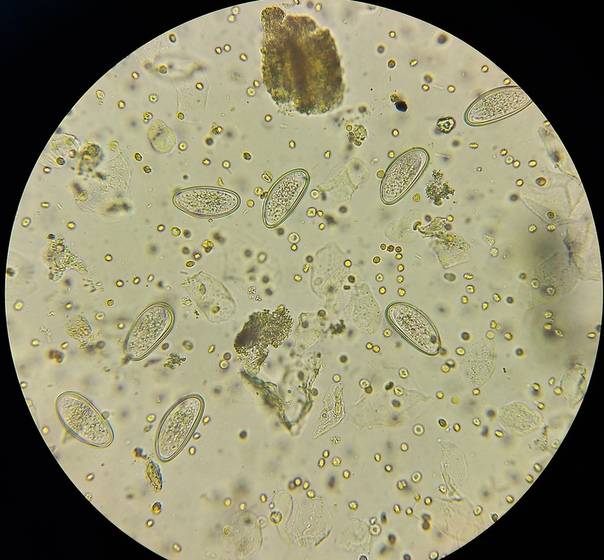 Пикколи, доктор медицинских наук, является членом следующих медицинских обществ: Американская ассоциация по изучению заболеваний печени, Американская гастроэнтерологическая ассоциация, Североамериканское общество детской гастроэнтерологии, гепатологии и питания
Пикколи, доктор медицинских наук, является членом следующих медицинских обществ: Американская ассоциация по изучению заболеваний печени, Американская гастроэнтерологическая ассоциация, Североамериканское общество детской гастроэнтерологии, гепатологии и питания
Раскрытие информации : Нечего раскрывать.
Главный редактор
Кармен Каффари, доктор медицины Доцент кафедры педиатрии, отделение гастроэнтерологии/питания, Медицинский факультет Университета Джона Хопкинса
Кармен Куффари, доктор медицины, является членом следующих медицинских обществ: Американский колледж гастроэнтерологии, Американская гастроэнтерологическая ассоциация, Североамериканское общество детской гастроэнтерологии, гепатологии и питания, Королевский колледж врачей и хирургов Канады
Раскрытие информации: Получил гонорары от Prometheus Laboratories за выступления и преподавание; Получал гонорары от Abbott Nutritionals за выступления и преподавание. для: Abbott Nutritional, Abbvie, бюро докладчиков.
для: Abbott Nutritional, Abbvie, бюро докладчиков.
Дополнительные участники
Хорхе Х. Варгас, доктор медицины , профессор педиатрии и клинический профессор детской гастроэнтерологии, Калифорнийский университет, Лос-Анджелес, Медицинская школа Дэвида Геффена; Врач-консультант кафедры педиатрии Калифорнийского университета в Лос-Анджелесе Health System
Jorge H Vargas, MD, является членом следующих медицинских обществ: American Liver Foundation, Латиноамериканское общество детской гастроэнтерологии, гепатологии и питания, Американское общество желудочно-кишечных заболеваний Эндоскопия, Американское общество парентерального и энтерального питания, Североамериканское общество детской гастроэнтерологии, гепатологии и питания
Раскрытие информации: Не раскрывать.
Как пищевая аллергия влияет на пищеварение?
Everyday Health: Показатели пищевой аллергии продолжают расти. Каковы наиболее распространенные пищевые аллергии и как они влияют на пищеварение?
Каковы наиболее распространенные пищевые аллергии и как они влияют на пищеварение?
Mark Babyatsky, MD (mssm.edu)
Пищевая аллергия, по оценкам, затрагивает от 6 до 8 процентов детей в Соединенных Штатах и от 3 до 4 процентов взрослых. Многие дети с аллергией на молочный белок перерастают ее. У взрослых чаще всего встречаются моллюски, арахис, лесные орехи, рыба и яйца.Следует отметить, что люди с аллергией на арахис и лесные орехи вряд ли перерастут ее, включая в последнее время все более распространенную аллергию на кунжут. Симптомы обычно острые, но могут быть хроническими и включать весь спектр аллергических реакций во всем организме. В пищеварительном тракте симптомы включают тошноту, рвоту, боль в животе, одинофагию (болезненное глотание), диарею или любую комбинацию этих симптомов.
Kenneth Brown, MD (kennethbrownmd.com)
Многие пациенты считают, что у них аллергия на какой-либо пищевой продукт, потому что у них была какая-то реакция после еды. Хотя неблагоприятные пищевые реакции распространены, истинная пищевая аллергия присутствует только у 3-4% взрослых. Аллергия определяется наличием неблагоприятного иммунного ответа на пищевой белок. Одной из наиболее распространенных пищевых аллергий является непереносимость глютена, известная как глютеновая болезнь. Целиакия является распространенной проблемой, затрагивающей 1 из каждых 133 человек в Соединенных Штатах. Это пожизненное аутоиммунное заболевание, при котором организм создает токсическую реакцию на прием любого типа глютена. Глютен — это белок, содержащийся во всех видах пшеницы, ячменя, ржи и некоторых видах овса.Это вызывает повреждение тонкой кишки, что не позволяет организму всасывать необходимые питательные вещества и минералы. Таким образом, целиакия классифицируется как заболевание аутоиммунной реакции на глютен.
Хотя неблагоприятные пищевые реакции распространены, истинная пищевая аллергия присутствует только у 3-4% взрослых. Аллергия определяется наличием неблагоприятного иммунного ответа на пищевой белок. Одной из наиболее распространенных пищевых аллергий является непереносимость глютена, известная как глютеновая болезнь. Целиакия является распространенной проблемой, затрагивающей 1 из каждых 133 человек в Соединенных Штатах. Это пожизненное аутоиммунное заболевание, при котором организм создает токсическую реакцию на прием любого типа глютена. Глютен — это белок, содержащийся во всех видах пшеницы, ячменя, ржи и некоторых видах овса.Это вызывает повреждение тонкой кишки, что не позволяет организму всасывать необходимые питательные вещества и минералы. Таким образом, целиакия классифицируется как заболевание аутоиммунной реакции на глютен.
Чаще всего люди имеют непереносимость пищевых продуктов, а не аллергию. Примером пищевой непереносимости является вздутие живота и диарея после употребления лактозы. У этих людей низкий уровень фермента лактазы, который препятствует расщеплению лактозы.
У этих людей низкий уровень фермента лактазы, который препятствует расщеплению лактозы.
Лиза Ганджу, DO (wehealnewyork.org)
Некоторыми из наиболее распространенных пищевых аллергий являются арахис, молоко, соя, моллюски, рыба, орехи и яйца. Некоторые люди могут иметь очень серьезные реакции на эти продукты, если у них аллергия. Пищеварительный тракт является первой линией контакта с пищей, поэтому именно здесь возникают аллергические реакции. Желудочно-кишечная реакция заключается в быстром избавлении или нейтрализации раздражителя или аллергена. Общие желудочно-кишечные реакции включают боль в животе, тошноту, рвоту и диарею.
Лиза Пични, доктор медицинских наук (стопколонрак сейчас.com)
Восемь наиболее распространенных пищевых аллергенов — это молоко, пшеница, соя, моллюски, рыба, арахис, орехи и яйца. Целиакия связана с аллергией или чувствительностью к глютену, который содержится в пшенице. Пациенты с глютеновой болезнью могут мальабсорбировать макронутриенты и заболеть.
Seth Rosen, MD (gastrohealth.com)
Хотя истинную пищевую аллергию часто бывает трудно определить, существует множество состояний, которые могут вызывать непереносимость определенных продуктов.Примерами этого являются непереносимость лактозы и целиакия. Непереносимость лактозы — это неспособность правильно переваривать молоко и другие лактозные продукты, такие как сыр и мороженое. Пациент с непереносимостью лактозы может испытывать вздутие живота, газы и метеоризм, а также диарею после употребления этих продуктов. Существует специальный дыхательный тест, который можно использовать для диагностики этого состояния. Непереносимость лактозы довольно легко лечится ферментными таблетками (Lactaid) или молочными продуктами, в которые добавлен этот фермент. Даже сыр и мороженое можно найти с включенным ферментом.Существует также несколько альтернатив безлактозным молочным продуктам, например, соевое молоко или рисовое молоко. Целиакия, также называемая чувствительностью к глютену, возникает, когда организм развивает ненормальную реакцию на белок глютен, который обычно содержится в зернах. Этот иммунный ответ запускает реакцию в слизистой оболочке тонкой кишки, которая может вызвать мальабсорбцию. Лечение глютеновой спру заключается в отказе от продуктов, приготовленных из ячменя, ржи, овса или пшеницы. Есть специальный хлеб, печенье, пирожные и хлопья без глютена.Растущая частота диагностирования целиакии также привлекла внимание ресторанов, так что безглютеновые блюда обычно можно найти в меню. Вздутие живота, рецидивирующая или хроническая диарея, анемия, потеря веса и остеопороз — вот некоторые признаки и симптомы, развивающиеся в результате аллергии на глютен. Если вы испытываете некоторые из этих симптомов, сообщите об этом своему врачу.
Этот иммунный ответ запускает реакцию в слизистой оболочке тонкой кишки, которая может вызвать мальабсорбцию. Лечение глютеновой спру заключается в отказе от продуктов, приготовленных из ячменя, ржи, овса или пшеницы. Есть специальный хлеб, печенье, пирожные и хлопья без глютена.Растущая частота диагностирования целиакии также привлекла внимание ресторанов, так что безглютеновые блюда обычно можно найти в меню. Вздутие живота, рецидивирующая или хроническая диарея, анемия, потеря веса и остеопороз — вот некоторые признаки и симптомы, развивающиеся в результате аллергии на глютен. Если вы испытываете некоторые из этих симптомов, сообщите об этом своему врачу.
Sutha Sachar, MD (susacharmd.com)
Пищевая аллергия возникает, когда ваша иммунная система идентифицирует определенный продукт как чужеродный или вредный.Ваша иммунная система заставляет клетки высвобождать антитела, известные как иммуноглобулин Е (IgE). Это то, что вызывает выброс гистамина, который вызывает боль в животе, диарею, тошноту или рвоту. Наиболее распространенные аллергии включают моллюсков, таких как креветки, омары и крабы; арахис; лесные орехи, такие как грецкие орехи и орехи пекан; рыбы; и яйца.
Albert Snow, ND (holisticgastroenterology.com)
Пищевая аллергия не влияет на пищеварение; пищеварение влияет на пищевую аллергию. Пищевая аллергия — это просто нарушение пищеварения.Еда никогда не виновата; это связано только с тем, что мы не обрабатываем его должным образом. Нам нужно перестать играть в «игру с обвинением». Наша пищеварительная система и наша иммунная система — это одно и то же. Ему все равно и нет разницы между пищей и зародышем. При хорошей работе переваривает и то, и другое. Молочные продукты и продукты из пшеницы вызывают большинство пищевых аллергий, потому что они более сложные. Пищеварение нашего организма было «притуплено» универсальным использованием определенных лекарств.
АА Старполи, Мэриленд (старполи.com)
Аллергия на глютен, известная как спру целиакии, вызывает острую воспалительную реакцию на уровне тонкой кишки ближе к желудку, что приводит к отеку и воспалению проксимальных отделов тонкой кишки, что препятствует правильному всасыванию питательных веществ . Существует также аллергия на сою, которая вызывает аналогичную воспалительную реакцию, препятствующую правильному усвоению. Непереносимость лактозы также может считаться одной из них.
Уильям Чей, MD (med.umich.edu)
Национальный институт аллергии и инфекционных заболеваний (NIAID), входящий в состав Национального института здоровья, определяет пищевую аллергию как «неблагоприятное воздействие на здоровье, возникающее в результате специфического иммунного ответа, который воспроизводимо возникает при воздействии данной пищи. » Пищевой аллерген определяется как определенные компоненты пищи или ингредиенты в пище (обычно белки), которые распознаются определенными иммунными клетками и вызывают специфические иммунные реакции, приводящие к характерным симптомам.Пищевая аллергия может вызвать широкий спектр проблем, начиная от легких нечетких симптомов, таких как ощущение зуда во рту или горле, до серьезных последствий для дыхательной и сердечно-сосудистой систем, которые редко могут привести к смерти. Наиболее распространенными пищевыми аллергиями являются арахис, лесные орехи, рыба, моллюски, молоко и яйца. Хотя частота пищевых аллергий, по-видимому, растет, они все еще редки: от 4 до 8 процентов детей и 1-4 процента взрослых будут иметь настоящую пищевую аллергию. Большинство симптомов, возникающих после приема пищи, не являются результатом истинной пищевой аллергии.Так называемая пищевая непереносимость относится к развитию побочных реакций на пищу. Пищевая непереносимость довольно распространена, о ней сообщают от 5 до 45 процентов населения в целом.
Jacqueline Wolf, MD (drjacquelinewolf.com)
Пищевая аллергия встречается у 3-4% взрослых. У детей в возрасте до 5 лет пищевая аллергия примерно в два раза выше, чем у взрослых. IgE-опосредованная пищевая аллергия может вызвать анафилаксию (затрудненное дыхание, отек горла и кожи и т. д.). Арахис, лесные орехи, рыба и моллюски вызывают больше анафилактических реакций, чем другие продукты.Молоко у детей также является частой причиной пищевой аллергии. В этом состоянии может быть отек слизистой оболочки кишечника и даже поражения, такие как крапивница в кишечнике. Высвобождающийся гистамин может вызывать тошноту и/или диарею.
Целиакия может рассматриваться как иммунно-опосредованная аллергия, не связанная с IgE. Реакция на белок глиаден в глютене (белок пшеницы, ячменя и ржи) вызывает повреждение тонкой кишки и может привести к нарушению всасывания питательных веществ, диарее, анемии и даже боли в суставах и депрессии.В Соединенных Штатах от 1 из 80 до 1 из 140 человек страдают глютеновой болезнью, и это число растет. Это вызывает повреждение клеток слизистой оболочки тонкой кишки, так что питательные вещества не могут нормально всасываться, и даже может быть секреция жидкости в кишечнике.
Ректальные кровотечения у детей раннего возраста: клиническое, аллергологическое и микробиологическое обследование | Педиатрия
ЦЕЛЬ. Ректальное кровотечение является тревожным симптомом и требует дополнительного обследования.У младенцев это объясняется в основном гиперчувствительностью. Помимо пищевых антигенов, внутрипросветные микробные агенты воздействуют на незрелую слизистую оболочку кишечника. Хотя эти антигены контролируются в зрелом кишечнике, они могут вызывать воспаление в развивающемся желудочно-кишечном тракте. Целью этого исследования было проспективно оценить клиническое течение ректального кровотечения и оценить влияние аллергии на коровье молоко и аберрантной кишечной микробиоты на состояние. Поскольку изъятие антигенов коровьего молока из рациона младенцев используется в качестве первого лечения без доказательств его эффективности, мы также стремились оценить влияние диеты, исключающей коровье молоко, на продолжительность ректального кровотечения.
МЕТОДЫ. В исследование были включены 40 младенцев (средний возраст: 2,7 месяца) с видимым ректальным кровотечением в течение 2-летнего периода в отделении педиатрии университетской больницы Тампере. Большинство младенцев (68%) находились на полном грудном вскармливании. При включении младенцы были случайным образом распределены для получения диеты, исключающей коровье молоко ( n = 19), или для продолжения прежней диеты ( n = 21) в течение 1 месяца. Были оценены результаты колоноскопии, фекальной бактериальной культуры, флуоресцентной гибридизации in situ выбранных родов кишечника, специфического обнаружения фекальных энтеровирусов, ротавирусов и аденовирусов, электронной микроскопии кала на наличие вирусов и электронной микроскопии слизистых оболочек на наличие вирусов.Во время каждого визита оценивали степень тяжести атопической экземы, если таковая была, по методу SCORAD. При оценке степени сенсибилизации исследовали сывороточный общий иммуноглобулин Е (IgE) и специфический IgE, а также кожные прик-тесты на коровье молоко, яйца и пшеницу. Аллергию на коровье молоко диагностировали с помощью элиминационной и провокационной проб. Пятеро пациентов были госпитализированы; все остальные лечились амбулаторно. Последующие визиты были запланированы через 1 месяц и в возрасте 1 года. Шестьдесят четыре здоровых референтных младенца были отобраны в качестве контроля в соответствии со следующими критериями: возраст и сроки взятия образцов кала идентичны в пределах 1 месяца.
РЕЗУЛЬТАТЫ. В общей сложности у 32 (80%) младенцев во время наблюдения отмечался стул с примесью крови (средний [диапазон]: 2,1 [1–15] в день). Среднее количество дней с ректальным кровотечением при последующем наблюдении составило 6. Как правило, стул с примесью крови возникал нерегулярно, по этой причине среднее время до последнего ректального кровотечения составляло 24 (диапазон: 1–85) дней с момента поступления. Атопическая экзема при поступлении или во время наблюдения была диагностирована у 38% новорожденных. Повышение концентрации специфических IgE или положительный кожный прик-тест встречались редко.Рост детей был нормальным при поступлении и во время наблюдения. Колоноскопия выявила типично очаговую эритему слизистой оболочки и афтозные изъязвления. Слизистая оболочка выглядела нормальной менее чем у половины пациентов. Трещин аноректальной области и полипов толстой кишки не обнаружено. Световая микроскопия показала, что общая архитектура слизистой оболочки хорошо сохранилась. Наиболее частыми аномалиями были острое воспаление или поствоспалительное состояние и очаговая инфильтрация эозинофилами в собственной пластинке. Диета, исключающая коровье молоко, не влияла на продолжительность ректального кровотечения.Аллергия на коровье молоко диагностирована у 7 (18%) пациентов. Агрегаты вирусных частиц были обнаружены в слое микроворсинок эпителия толстой кишки в 8 случаях. Поверхностный эпителий вирус-позитивных биоптатов толстой кишки регулярно обнаруживал дегенеративные изменения в слое микроворсинок и эпителиальных клетках. Электронно-микроскопическое исследование биоптатов толстой кишки выявило вирусные частицы (диаметром 30 нм) на поверхности эпителиальных клеток. Вирусные частицы или РНК присутствовали в фекалиях лишь у меньшинства пациентов.Все фекальные культуры были отрицательными для Salmonella, Shigella и Yersinia . Campylobacter jejuni был обнаружен в кале 1 пациента, а культура фекалий была положительной на Clostridium difficile у 4 пациентов, Staphylococcus aureus у 8 пациентов и дрожжи у 2 пациентов. Флуоресцентная гибридизация in situ показала, что на момент поступления общее количество бактерий, а также количество бифидо- и лактобактерий в кале у больных было ниже по сравнению с контрольной группой.Концентрации микробов в кале, характерные для данного исследования ( Bacteroides , бифидобактерии, Clostridium , лактобациллы и энтерококки), существенно не отличались между временем поступления и вторым визитом у пациентов или контрольной группы. В возрасте 1 года 7 пациентов все еще страдали аллергией на коровье молоко, 5 из них также страдали множественной пищевой аллергией. Атопическая экзема и гистопатологически подтвержденное воспаление слизистой оболочки толстой кишки при поступлении были связаны с персистенцией аллергии на коровье молоко в возрасте 1 года.Ни у одного из пациентов не было желудочно-кишечных жалоб или видимой крови в стуле.
ВЫВОДЫ. Ректальное кровотечение у младенцев, как правило, является доброкачественным и самокупирующимся заболеванием. Кровавый стул происходил нерегулярно всего несколько дней в течение следующих месяцев. Как и в предыдущем отчете, большинство детей находились на исключительно грудном вскармливании. У большинства больных причина состояния остается неизвестной. У некоторых пациентов можно увидеть связь с вирусами. Микробы, которые обычно вызывают кровавую диарею у детей старшего возраста и взрослых, Salmonella , Shigella и Yersinia , в настоящем материале отсутствовали.Низкое количество бифидобактерий в образцах кала может указывать на значительное отклонение от нормы, которое может стать целью пробиотического вмешательства для нормализации микробиоты кишечника. Кишечная микробиота в целом казалась стабильной, поскольку количество основных групп тестируемой микробиоты существенно не менялось между моментом поступления и через 1 месяц.

 Повышенный ФК не равно болезни Крона или язвенному колиту!
Повышенный ФК не равно болезни Крона или язвенному колиту!
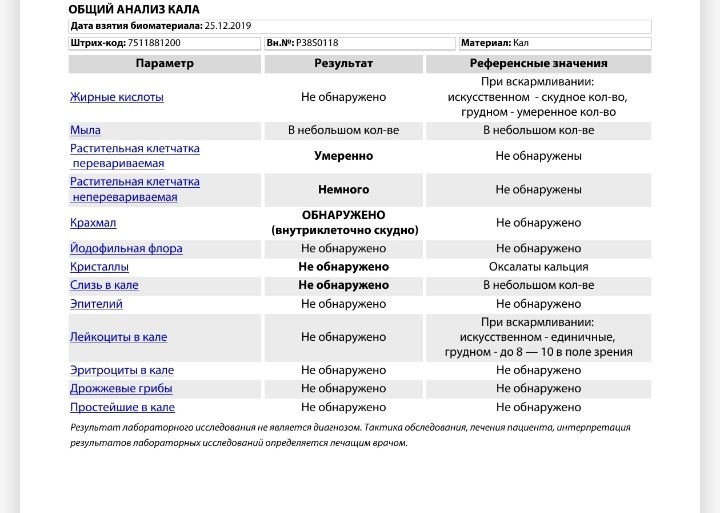

 ).
).
 Лихтман Дж. С., Маркобал А., Зонненбург Дж. Л., Элиас Дж. Э. Протеомика стула, ориентированная на хозяина: новая стратегия, ориентированная на реакцию кишечника на микробиоту кишечника. Молекулярная и клеточная протеомика MCP. 2013;12(11):3310–8. Центральный PMCID в PubMed: PMC3820941.
Лихтман Дж. С., Маркобал А., Зонненбург Дж. Л., Элиас Дж. Э. Протеомика стула, ориентированная на хозяина: новая стратегия, ориентированная на реакцию кишечника на микробиоту кишечника. Молекулярная и клеточная протеомика MCP. 2013;12(11):3310–8. Центральный PMCID в PubMed: PMC3820941. Журнал иммунологии (Балтимор, штат Мэриленд, 1950 г.). 1997;158(3):1068–77.
Журнал иммунологии (Балтимор, штат Мэриленд, 1950 г.). 1997;158(3):1068–77.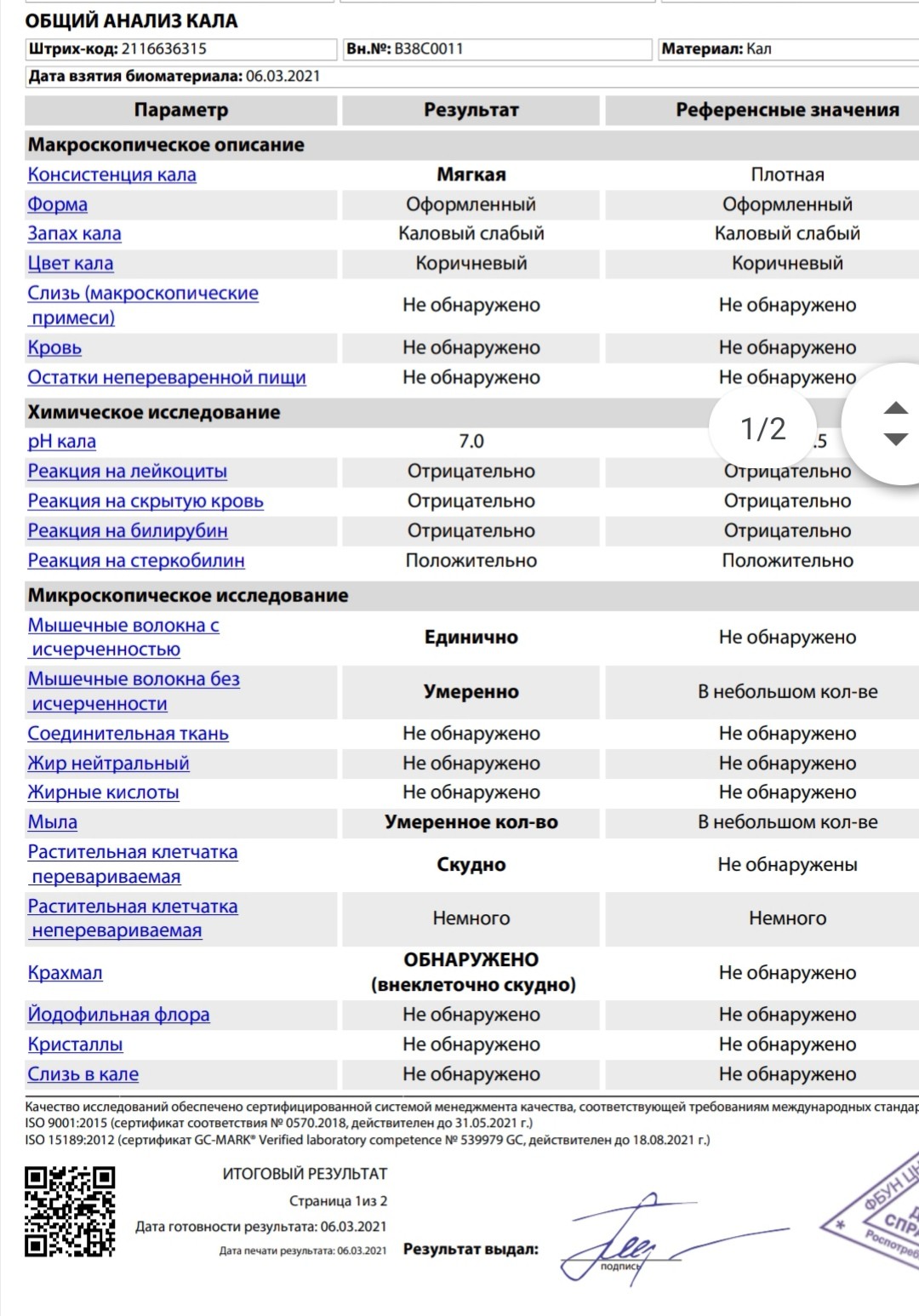 FEMS микробиология экология. 2016;92(7).
FEMS микробиология экология. 2016;92(7).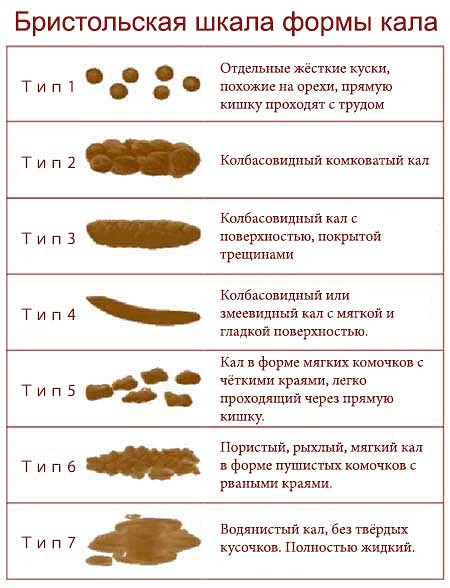 Скандинавский журнал гастроэнтерологии. 1987;22(1):59–64. Эпб 1987/01/01. пмид:3551049
Скандинавский журнал гастроэнтерологии. 1987;22(1):59–64. Эпб 1987/01/01. пмид:3551049 Доступно по адресу: http://www.qiagen.com/ingenuity).
Доступно по адресу: http://www.qiagen.com/ingenuity). Vergnolle N. Клиническая значимость рецепторов, активированных протеиназой (pars) в кишечнике. Кишка. 2005;54(6):867–74. Центральный PMCID в PubMed: PMC1774539.пмид:15888798
Vergnolle N. Клиническая значимость рецепторов, активированных протеиназой (pars) в кишечнике. Кишка. 2005;54(6):867–74. Центральный PMCID в PubMed: PMC1774539.пмид:15888798 Науки о жизни. 2002;71(20):2435–46. пмид:12231404
Науки о жизни. 2002;71(20):2435–46. пмид:12231404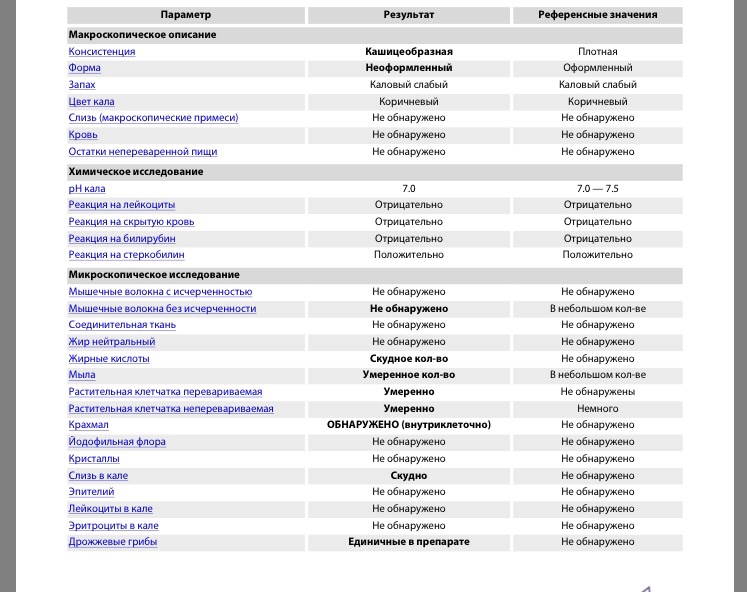 Кишка. 2008;57(9):1222–9. пмид:18460552
Кишка. 2008;57(9):1222–9. пмид:18460552