Синдром Дауна
Синдром Дауна — самая распространённая генетическая аномалия, которая определяется наличием в клетках человека дополнительной, 47-й, хромосомы. При этом у родителей ребенка набор хромосом абсолютно нормальный. Синдром Дауна с одинаковой частотой встречается у мальчиков и у девочек, и по статистике каждый 700-й ребенок на планете появляется на свет с синдромом Дауна. Это соотношение примерно одинаково в разных странах, климатических зонах, социальных слоях. Оно не зависит от образа жизни родителей, их здоровья, вредных привычек, цвета кожи, национальности.
Обычно диагноз ставится внутриутробно или сразу после рождения. Существуют характеристики, которые можно увидеть у ещё не рожденного малыша на УЗИ:
плоское лицо, на котором слабо выделяются нос, рот, надбровные дуги и тд;
практически плоская переносица;
брахицефалия (слишком укороченный череп), часто сопровождается плоским затылком;
складка кожи на шее у новорожденных;
азвитый эпикантус (складка кожи около угла глаза).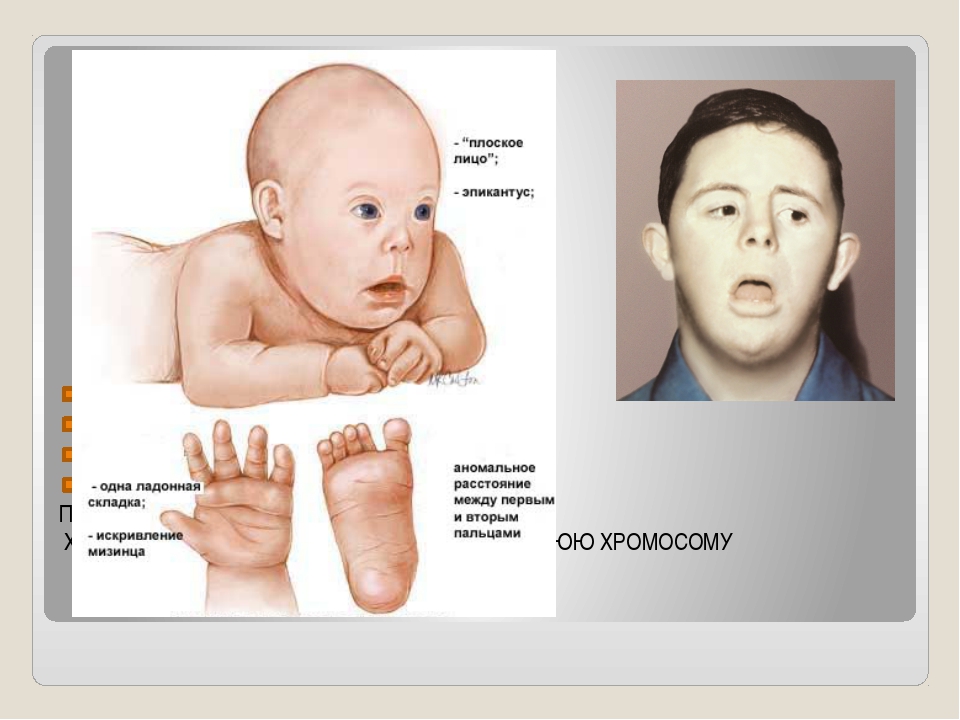
В число диагностических признаков определяющих наличие даунизма входит поперечная ладонная складка, она встречается с частотой 45%.
Дети с синдромом Дауна, которые живут в семьях, успешно учатся ходить, бегать, прыгать, самостоятельно есть, одеваться, играть, выполнять обычные для ребенка обязанности по дому. Они учатся в школе, занимаются спортом, осваивают множество профессий. Однако у них есть важные особенности, которые влияют на скорость освоения навыков, двигательное поведение, и обуславливают трудности, с которыми сталкиваются такие дети в процессе развития.
У детей с синдромом Дауна имеются характерные нарушения движений. По сравнению со сверстниками без нарушений такие дети развиваются медленнее и их двигательное развитие имеет ряд характерных особенностей. Наиболее типичное нарушение, свойственное им в той или иной степени, — это сниженный мышечный тонус: все дети гипотоничны, хотя степень гипотонии варьируется достаточно сильно.
Вследствие этого наблюдаются неадекватные выпрямительные реакции и реакции сохранения равновесия; гипермобильность в суставах. А это приводит к тому, что таким детям трудно контролировать положение тела в пространстве и движения, трудно переходить из одной позы в другую и поддерживать стабильную позу.
А это приводит к тому, что таким детям трудно контролировать положение тела в пространстве и движения, трудно переходить из одной позы в другую и поддерживать стабильную позу.
Кроме этого, у ребенка с синдромом Дауна есть специфические анатомические особенности: руки и ноги у них пропорционально короче, чем у сверстников без синдрома Дауна. Это, в сочетании с гипотонией и вторичной слабостью мышц, приводит к тому, что рука редко оказывается в поле зрения, и, соответственно, хуже формируется такой навык, как точное дотягивание и удержание предмета под контролем зрения.
Важную роль в замедленном формировании двигательных навыков играют патологические позы, характерные для этих детей. Так, в положении лежа на спине при спонтанном двигательном развитии характерны асимметричные позы, ретракция плеч и неспособность оторвать руки от поверхности опоры: когда ребенок замечает какой-либо предмет, его двигательная активность повышается, но руки совершают движения лишь по поверхности опоры, а направленного движения к предмету не происходит.
Характерные черты умственного развития:
Заметное отставание в развитии. Даже при своевременном комплексном лечении задержки в развитии будут всё заметнее с возрастом. Развитие умственных способностей, в большинстве случаев, остается на уровне семилетнего ребенка. В редких случаях интеллект достигает более высокого уровня.
Небольшой словарный запас. Кроме того, что пациенты с данной аномалией невнятно говорят, отмечается довольно скудный набор используемых речевых конструкций.
Отсутствие способностей к абстрактному мышлению. Таким детям легче понимать и анализировать только то, что они видят непосредственно перед глазами, представить какую-то ситуацию или пофантазировать для них уже проблематично.
Низкая концентрация внимания.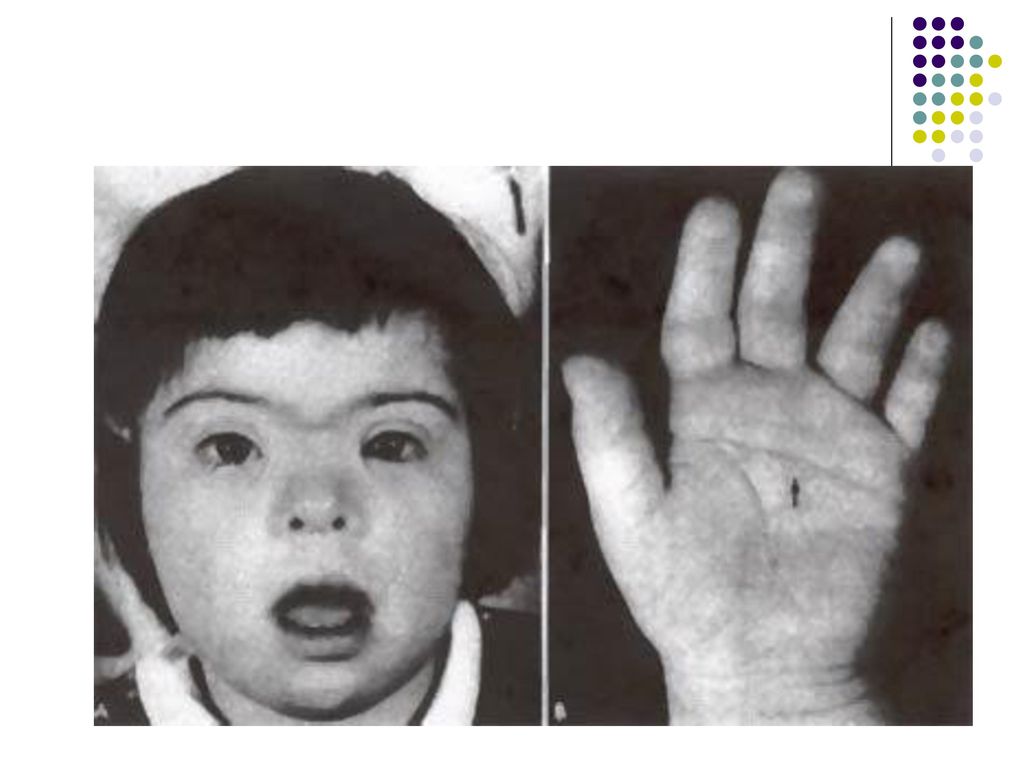 Ребенку тяжело сфокусироваться на какой-либо задаче, достаточно быстро они начинают отвлекаться.
Ребенку тяжело сфокусироваться на какой-либо задаче, достаточно быстро они начинают отвлекаться.
Сопутствующие заболевания
Помимо наличия самого синдрома Дауна у больных практически всегда отмечается ряд других проблем со здоровьем. Носители данной хромосомной аномалии очень часто сталкиваются с недугами кардиологического характера. Врожденные пороки сердца отмечаются приблизительно в 40% случаев. Нарушение биологических процессов влечет за собой также раннее развитие катаракты, с которым сталкиваются две трети больных старше восьми лет. При синдроме Дауна значительно увеличивается риск развития болезни Альцгеймера и появления острого миелоидного лейкоза. У пациентов с данной патологией часто имеются отклонения в работе пищеварительного тракта. Рекомендуются регулярные обследования у гастроэнтеролога и кардиолога.
Простудные заболевания, ОРВИ и пневмонии – регулярные спутники больного синдромом Дауна. Это объясняется ослабленной иммунной системой организма.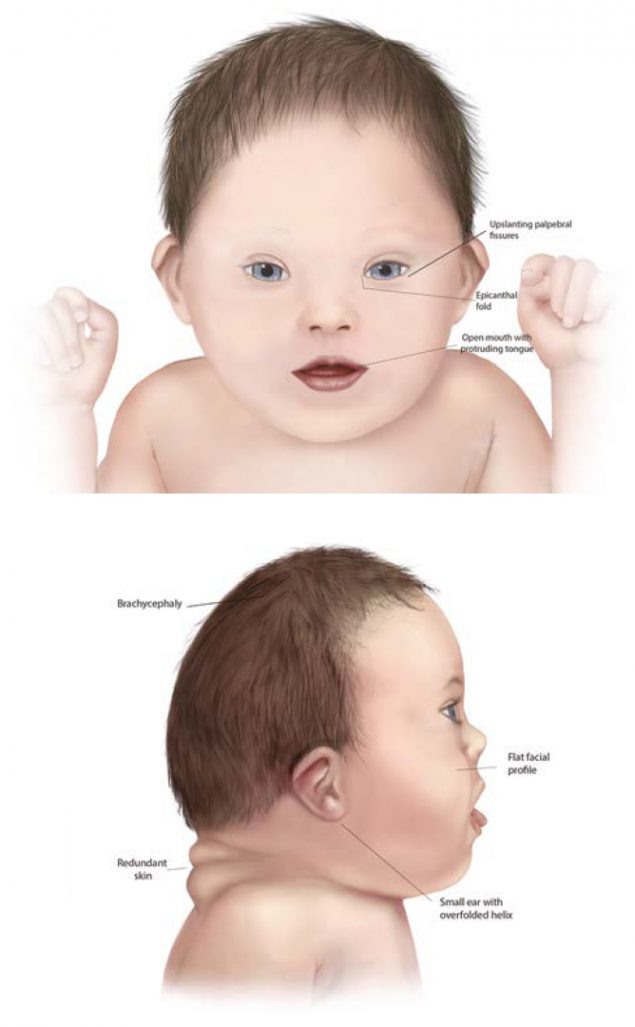
Появление лишней хромосомы в организме вызывает также нарушение обмена веществ, что приводит к неисправному функционированию внутренних органов (заболевания щитовидной железы, нарушения зрения, слуха и т.д).
Родители должны проявлять терпение и стремиться ежедневно прикладывать усилия для развития своего ребенка. Только в этом случае он сможет приобрести все необходимые для жизни навыки, пусть даже с задержкой. Существуют и программы реабилитации, разработанные квалифицированными психологами и педиатрами, которые могут существенно помочь в решении проблем воспитания особенных детей, но даже их использование, к сожалению, мало облегчает ношу родителей.
Детей с синдромом Дауна иногда называют «солнечными». Объясняется это тем, что они очень дружелюбны, позитивны и доброжелательны, несмотря на возможные перепады настроения и периодические вспышки агрессии.
Физическая терапия для ребенка с синдромом Дауна должна начинаться вскоре после рождения. Основная цель занятий: способствовать формированию важнейших компонентов движений и двигательных навыков и препятствовать формированию патологических поз и движений. Общая цель терапии — добиться необходимого уровня контроля за положением тела, чтобы голова, туловище и конечности участвовали в правильных функциональных и произвольных движениях.
Основная цель занятий: способствовать формированию важнейших компонентов движений и двигательных навыков и препятствовать формированию патологических поз и движений. Общая цель терапии — добиться необходимого уровня контроля за положением тела, чтобы голова, туловище и конечности участвовали в правильных функциональных и произвольных движениях.
Инновационные технологии сопровождения семей с детьми-инвалидами (синдром Дауна) 2015
сдать анализ в лаборатории KDLmed
Синдром Дауна – это генетическое заболевание, вызывающее умственную отсталость, задержку физического развития, врожденные пороки сердца. Кроме того, он часто сопровождается нарушением функции щитовидной железы, нарушением слуха, зрения.
Синдром Дауна является самым распространенным заболеванием, вызванным аномалией хромосом. С возрастом матери риск рождения ребенка с синдромом Дауна увеличивается.
Заболевание не лечится, степень его тяжести может варьироваться.
Лечениезависит от проявлений заболевания. Хотя от самого синдрома избавиться невозможно, работа с дефектологом с ранних лет способствует развитию психических функций ребенка.
Хотя от самого синдрома избавиться невозможно, работа с дефектологом с ранних лет способствует развитию психических функций ребенка.
Трисомия по 21-й хромосоме, Трисомия G.
Синонимы английские
Down Syndrome, Down’s syndrome, Trisomy 21.
Симптомы
У детей с синдромом Дауна могут наблюдаться специфические черты лица и особенности строения головы:
- маленькая голова,
- широкое лицо,
- короткая шея, избыток кожи на задней поверхности шеи,
- короткий и широкий нос
- недоразвитая верхняя челюсть,
- светло-серые пятна на радужной оболочке глаз вплоть до 12-го месяца жизни,
- эпикантус – полулунная кожная складка во внутреннем углу верхнего века – «третье веко» – и, как следствие, узкий, монголоидный разрез глаз,
- маленькие, асимметричные, низко прикрепленные уши,
- большой язык без центральной борозды, часто открытый рот,
- неправильно расположенные зубы.

Также для больных синдромом Дауна характерны следующие признаки:
- низкий тонус мышц,
- непропорциональное телосложение,
- недоразвитие половых признаков,
- широкие короткие ладони с одной складкой вместо двух, большой палец расположен низко по отношению к другим пальцам,
- сандалевидная щель между первым и вторым пальцами ног,
- относительно короткие, чрезмерно гибкие пальцы.
Развитие детей с синдромом Дауна обычно происходит медленнее нормы. Они начинают сидеть, ползать и ходить примерно в два раза позже, чем дети с нормальным развитием.
Также у больных присутствует умеренная степень умственной отсталости.
Общая информация о заболевании
Синдром Дауна – это генетическое заболевание, вызванное аномалией 21-й хромосомы, которое проявляется в виде умственной отсталости, пороков сердца и нарушения развития.
Он часто сопровождается нарушением работы щитовидной железы, нарушением слуха, зрения.
В хромосомном наборе человека присутствует 23 пары хромосом. При этом одна хромосома из пары достается от матери, одна – от отца. Всего в организме 46 хромосом.
Причина болезни Дауна – аномалия 21-й хромосомы, которая характеризуется наличием дополнительных копий генетического материала по 21-й хромосоме в виде трисомии или транслокации. 21-я хромосома влияет почти на все системы органов и отвечает за черты и особенности развития, нарушенные при болезни Дауна.
- Трисомия по 21-й хромосоме предполагает наличие копии данной хромосомы. То есть вместо двух хромосом 21-я пара представлена тремя. Таким образом, во всех клетках организма присутствует три хромосомы 21-й пары вместо двух.
Трисомия составляет 95 % случаев аномалии 21-й хромосомы. Она возникает при нарушении деления клеток во время формирования половых клеток (сперматозоидов и яйцеклеток) родителей. Практически всегда лишняя хромосома передается ребенку с синдромом Дауна от матери. С увеличением возраста матери повышается риск рождения ребенка с синдромом Дауна. Чем старше яйцеклетка, тем больше веротяность неправильного деления клеток.
Чем старше яйцеклетка, тем больше веротяность неправильного деления клеток.
- Мозаичный вариант синдрома встречается, когда лишь в некоторых клетках организма присутствует аномальная копия 21-й хромосомы. «Мозаика» из аномальных и нормальных клеток обусловлена нарушением деления клеток после оплодотворения в зародыше.
- Транслокация 21-й хромосомы на другие хромосомы (чаще на 15-ю или 14-ю). Дети имеют две хромосомы 21 пары и дополнительный материал 21 хромосомы. При этом часть 21-й хромосомы перемещается на другую при нарушении деления хромосом во время формирования сперматозоидов и яйцеклеток родителей (примерно 25 % случаев транслокации) или в момент зачатия (около 75 % случаев).
Таким образом, синдром Дауна вызван нарушением деления клеток во время развития яйцеклетки, сперматозоида или зародыша.
Синдром Дауна не является наследственным заболеванием, хотя предрасположенность к его развитию существует. У женщин с синдромом Дауна вероятность родить больного ребенка составляет 50 %, часто происходит спонтанное прерывание беременности. Мужчины с синдромом Дауна бесплодны, за исключением мозаичного варианта синдрома.
Мужчины с синдромом Дауна бесплодны, за исключением мозаичного варианта синдрома.
У носителей генетической транслокации хромосом вероятность рождения ребенка с синдромом Дауна также будет повышена. Если носителем является мать, ребенок с синдромом Дауна рождается в 10-30 %, если носитель отец – в 5 %.
У женщин, имеющих ребенка с синдромом Дауна, шанс родить второго больного ребенка составляет 1 %.
У детей с синдромом Дауна могут возникать следующие осложнения.
- Пороки сердца. Примерно половина детей с синдромом Дауна рождается с пороками сердца, которые могут потребовать хирургического вмешательства уже в раннем детстве.
- Лейкемия (злокачественное заболевание кроветворной системы). Дети с синдромом Дауна, особенно в раннем возрасте, более склонны к развитию лейкемии, чем другие дети.
- Инфекционные заболевания. Из-за нарушений иммунной системы организма дети с синдромом Дауна более восприимчивы к инфекционным заболеваниям.
- Деменция.
 После 40 лет у больных синдромом Дауна повышен риск развития слабоумия.
После 40 лет у больных синдромом Дауна повышен риск развития слабоумия. - Сонное апноэ. Дети с синдромом Дауна предрасположены к сонному апноэ – состоянию, при котором во время сна на 20-30 секунд прекращается вентиляция легких. В тяжелых случаях апноэ может занимать до 60 % всего времени ночного сна. Регулярные апноэ приводят к дневной сонливости, ухудшению памяти, снижению интеллекта, работоспособности и постоянной усталости.
- Ожирение.
Продолжительность жизни людей с синдромом Дауна зависит от степени выраженности проявлений и в среднем составляет 50 и более лет.
Кто в группе риска?
- Женщины с синдромом Дауна (мужчины с синдромом Дауна, как правило, бесплодны).
- Матери после 30 лет. С возрастом риск родить ребенка с синдромом Дауна увеличивается: к 35 годам он составляет 1 к 400, к 45 – 1 к 35. Однако примерно 80 % детей с синдромом Дауна рождается матерями до 35 лет.
- Отцы старше 42 лет.
- Носители генетической транслокации хромосом.
 Если носителем является мать, риск рождения ребенка с синдромом Дауна сост
Если носителем является мать, риск рождения ребенка с синдромом Дауна сост
Записки психиатра. «Дети Солнца»
Эта складка вкупе с уплощённым лицом делала их похожими на представителей монголоидной расы. Термин прижился и просуществовал больше века, с 1866 по 1970 год. То есть ещё пять лет после того, как возмущённая монгольская делегация обратилась к Всемирной организации здравоохранения с нотой протеста — мол, сколько можно ставить знак равенства между дебилами и монголами! Кто всё это описал, пусть тот и отдувается!
Так появилось новое официальное название синдрома — синдром Дауна. Первооткрыватель возражать не стал. Во всяком случае, ОТТУДА жалоб не поступало. В русском устном слово и вовсе приобрело ругательный характер, но это уже наш национальный вид спорта: делать из обычных слов обзывательные. Одни только курва (на латыни — кривая) с лярвой (на латыни — личинка) чего стоят!
Причину развития синдрома Дауна обнаружил в 1958 году Жером Жан Луи Мари Лежен. Ею оказалась лишняя хромосома, довесок к 21-й паре. Больше — не всегда лучше, и синдром Дауна — наглядный тому пример. Есть и другие варианты нарушений хромосомного набора, приводящих к развитию этой болезни, но не столь частые. Трисомия (три хромосомы вместо двух) является причиной синдрома в 95% случаев.
Ею оказалась лишняя хромосома, довесок к 21-й паре. Больше — не всегда лучше, и синдром Дауна — наглядный тому пример. Есть и другие варианты нарушений хромосомного набора, приводящих к развитию этой болезни, но не столь частые. Трисомия (три хромосомы вместо двух) является причиной синдрома в 95% случаев.
Синдром Дауна не так уж редок. Раньше он встречался в одном случае на 700 родов, сейчас — в одном на 1000. Чуть реже? Да, но не за счёт улучшения генофонда человечества, а за счёт новых возможностей диагностики, позволяющих обнаружить болезнь ещё в период беременности. И дальше уже женщина решает, рожать или делать аборт.
Чем проявляется синдром? Внешне — целым набором признаков:
- «плоское лицо» — 90%
- брахицефалия (аномальное укорочение черепа) — 81%
- кожная складка на шее у новорождённых — 81%
- эпикантус (вертикальная кожная складка, прикрывающая медиальный угол глазной щели) — 80%
- гиперподвижность суставов — 80%
- мышечная гипотония (сниженный тонус) — 80%
- плоский затылок — 78%
- короткие конечности — 70%
- брахимезофалангия (укорочение всех пальцев за счёт недоразвития средних фаланг) — 70%
- катаракта в возрасте старше 8 лет — 66%
- открытый рот (в связи с низким тонусом мышц и особым строением нёба) — 65%
- зубные аномалии — 65%
- клинодактилия пятого пальца (искривлённый мизинец) — 60%
- аркообразное нёбо — 58%
- плоская переносица — 52%
- бороздчатый язык — 50%
- поперечная ладонная складка (называемая также обезьяньей) — 45%
- короткая широкая шея — 45%
- ВПС (врождённый порок сердца) — 40%
- короткий нос — 40%
- страбизм (косоглазие) — 29%
- деформация грудной клетки, килевидная или воронкообразная — 27%
- пигментные пятна по краю радужки — пятна Брушфильда — 19%
И снова следует подчеркнуть, что здесь ни в коем случае нельзя стричь всех пациентов под одну гребёнку.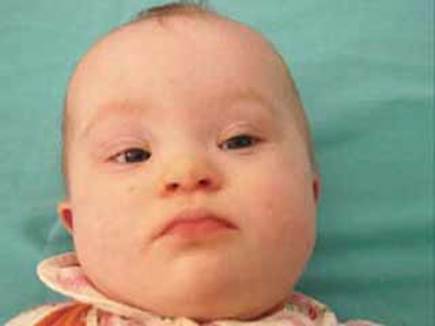 К примеру, известен случай, когда пациент с синдромом Дауна получил университетское образование. То есть у ряда больных способность обучаться имеется, и если таким ребёнком заниматься, то есть шанс адаптировать его к тем требованиям, которые предъявляет современное общество к своим членам. Было бы желание и терпение.
К примеру, известен случай, когда пациент с синдромом Дауна получил университетское образование. То есть у ряда больных способность обучаться имеется, и если таким ребёнком заниматься, то есть шанс адаптировать его к тем требованиям, которые предъявляет современное общество к своим членам. Было бы желание и терпение.
Да, мышление будет конкретно-наглядным. Да, абстрактные понятия будут недоступны. Да, полёта мысли и фантазии ожидать не стоит. Но есть шанс сформировать хотя бы базовые навыки самообслуживания, общения, а то и научить какой-то специальности.
Что касается характера и черт личности — они столь же разнообразны и непохожи, как и у остальных. Невозможно в описании подогнать всех пациентов под один шаблон. Да, присутствуют доверчивость и внушаемость. Да, встречаются беспокойные и вяло-пассивные. Но такие черты, как злобность и агрессивность, — скорее, исключение, чем правило. Во всяком случае, они проявляются не чаще, чем среди здоровых людей. Не зря в Китае таких детей называли детьми Солнца.
И, кстати, именно китайцы сделали в отношении этих больных очень правильный ход на уровне формирования мировоззрения. Они считают, что появление такого ребёнка в семье — это шанс для родителей, братьев и сестёр. Шанс получить много плюсов к карме и достичь просветления. Наивно? Внешне — возможно. А если разобраться — вот оно, нужное отношение к проблеме, на уровне более высоком и эффективном, чем государственный. И никаких рассуждений о естественном отборе, о той пользе, которую каждый человек должен приносить обществу, об объеденном и обкраденном налогоплательщике.
Просто человеческое. Просто по совести.
Новый анализ крови упрощает дородовую диагностику синдрома Дауна | Научные открытия и технические новинки из Германии | DW
Болезнь, известная как сидром Дауна, была описана еще в середине XIX века, но причину этой врожденной патологии ученые выяснили лишь целое столетие спустя. Оказалось, что синдром Дауна возникает в результате генетической аномалии — наличия лишней хромосомы. Если в ядре каждой клетки здорового человека присутствует набор из 23 пар хромосом, то в клетках больных, страдающих синдромом Дауна, 21-я хромосома представлена не двумя, а тремя копиями.
Если в ядре каждой клетки здорового человека присутствует набор из 23 пар хромосом, то в клетках больных, страдающих синдромом Дауна, 21-я хромосома представлена не двумя, а тремя копиями.
Эта аномалия, именуемая трисомией по 21-й хромосоме, проявляется в ряде специфических внешних черт (низкий рост, гипотония, недоразвитые уши, плоское лицо с раскосыми глазами, утолщенная шейная кожная складка, широкие кисти рук с короткими пальцами и единичной складкой вдоль ладони) и нередко сопровождается врожденным пороком сердца, недоразвитостью кишечника, глухотой, косоглазием. Кроме того, у многих таких больных наблюдаются признаки умственной отсталости.
Амниоцентез — процедура рискованная
Вероятность родить ребенка с синдромом Дауна, и так не столь уж малая, повышается с возрастом родителей, особенно матери. В Германии, например, один такой младенец приходится в среднем на 800 родов. У беременных, желающих заранее удостовериться, что их эта участь минует, до недавнего времени в распоряжении был лишь один надежный способ — пренатальная (то есть дородовая) диагностика.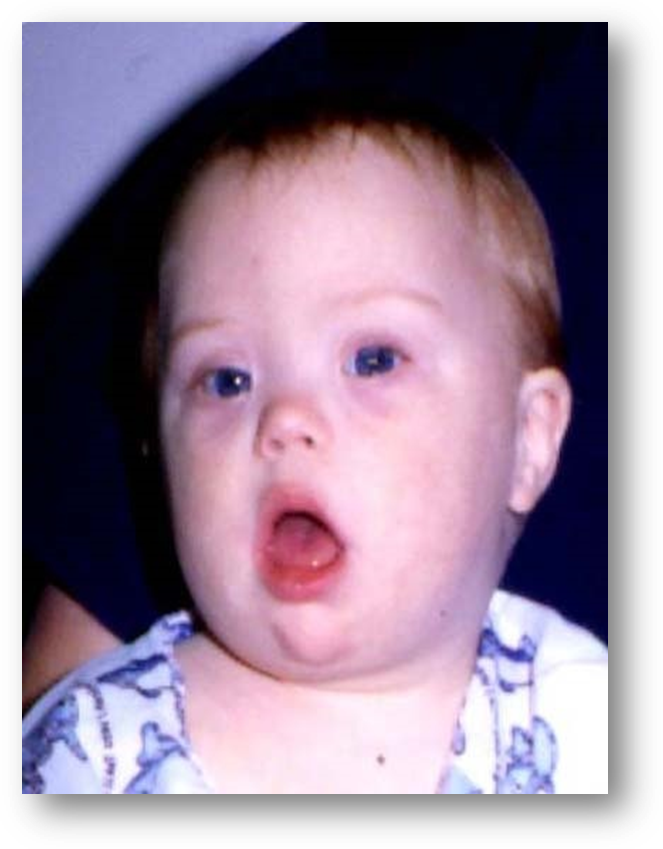 Конкретно — амниоцентез. Речь идет об инвазивной процедуре, в ходе которой врач специальной иглой через переднюю брюшную стенку беременной выполняет пункцию зародышевой оболочки с целью получения пробы околоплодных вод для их последующего лабораторного исследования. Ведь околоплодные воды содержат и клетки эмбриона, и их анализ позволяет выявить генетические и хромосомные дефекты.
Конкретно — амниоцентез. Речь идет об инвазивной процедуре, в ходе которой врач специальной иглой через переднюю брюшную стенку беременной выполняет пункцию зародышевой оболочки с целью получения пробы околоплодных вод для их последующего лабораторного исследования. Ведь околоплодные воды содержат и клетки эмбриона, и их анализ позволяет выявить генетические и хромосомные дефекты.
Одна беда: прокол зародышевой оболочки чреват осложнениями. Михаэль Энтезами (Michael Entezami), врач-гинеколог берлинского Центра пренатальной диагностики и генетики человека, поясняет: «Вероятность того, что сам по себе забор пробы околоплодных вод приведет к выкидышу, составляет от 0,3 до 1,0 процента. Через несколько дней или даже недель после процедуры либо сердце плода вдруг перестает биться, либо происходит разрыв плодных оболочек, преждевременное излитие околоплодной жидкости, начинаются схватки, поднимается температура, и в результате — выкидыш».
Новый тест — подлинный прорыв
До сих пор в одной только Германии каждый год около 70 тысяч беременных решались на амниоцентез.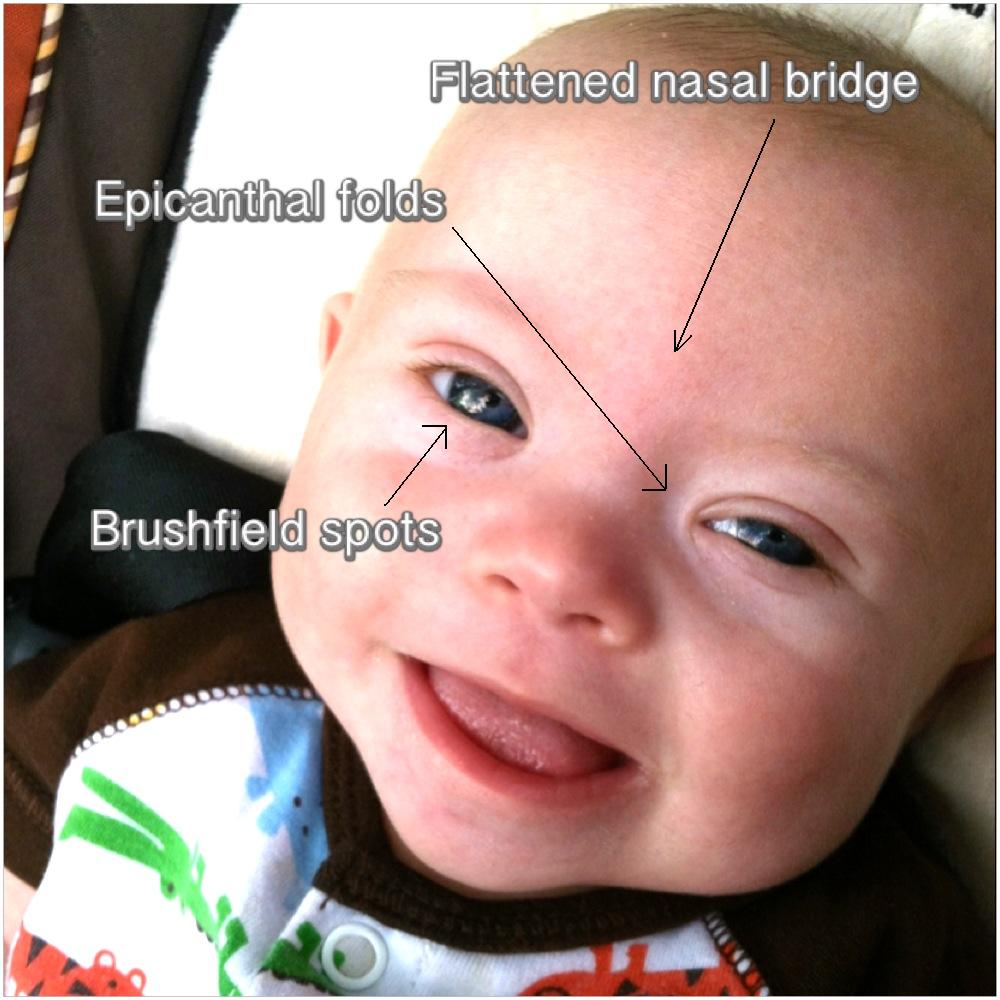 Но теперь подавляющее большинство будущих мам смогут обойтись без этой неприятной и рискованной процедуры: вскоре у медиков появится возможность диагностировать трисомию у плода на основе анализа крови беременной. Михаэль Энтезами говорит: «Этот тест — подлинный прорыв в области, где 20 лет велись исследования, направленные на создание метода, позволяющего делать заключения о хромосомах плода, не подвергая риску протекание беременности. И вот они увенчались успехом».
Но теперь подавляющее большинство будущих мам смогут обойтись без этой неприятной и рискованной процедуры: вскоре у медиков появится возможность диагностировать трисомию у плода на основе анализа крови беременной. Михаэль Энтезами говорит: «Этот тест — подлинный прорыв в области, где 20 лет велись исследования, направленные на создание метода, позволяющего делать заключения о хромосомах плода, не подвергая риску протекание беременности. И вот они увенчались успехом».
Все, что требуется для анализа, — проба крови матери. Гинеколог поясняет: «В материнской крови всегда присутствует наследственный материал матери из распавшихся клеток ее организма и непосредственно из клеток крови, но примерно пять процентов — это наследственный материал эмбриона из клеток плаценты»
Не только трисомия 21, но и 13, и 18
А клетки плаценты, как правило, генетически идентичны клеткам плода. Используя специальные методы, принятые в молекулярной биологии, исследователи повышают концентрацию наследственного материала эмбриона в пробе материнской крови, а затем определяют, каким количеством копий представлена в нем 21-я хромосома. Да и не только 21-я. Этот же анализ заодно позволяет выявлять и такие реже встречающиеся генетические аномалии как трисомия по 13-й и по 18-й хромосомам.
Да и не только 21-я. Этот же анализ заодно позволяет выявлять и такие реже встречающиеся генетические аномалии как трисомия по 13-й и по 18-й хромосомам.
Михаэль Энтезами одним из первых в Германии уже использует новый тест — пока в рамках эксперимента, с целью проверки его надежности и достоверности. Кровь на такой анализ сегодня сдают лишь те пациентки берлинских медиков, которым в любом случае рекомендовано также исследование околоплодных вод. Но если здесь итоги подводить еще рано, то в США, где тест был введен в клиническую практику в октябре прошлого года, цифры уже есть, говорит Михаэль Энтезами: «Процент ошибок мал, надежность выявления трисомии 21 составляет около 98 процентов, и случаев «ложной тревоги» практически не зарегистрировано. Но следует все же иметь в виду, что в принципе ошибки возможны».
Не панацея, но серьезная альтернатива
Поэтому гинеколог не рекомендует будущим матерям полагаться исключительно на анализ крови. Прежде всего, на 11-й неделе беременности им следует пройти ультразвуковое исследование, в ходе которого, в частности, измеряется толщина воротникового пространства у плода. И только в случае, если этот скрининг даст основания для тревоги, имеет смысл обратиться к новому тесту вместо амниоцентеза.
И только в случае, если этот скрининг даст основания для тревоги, имеет смысл обратиться к новому тесту вместо амниоцентеза.
Михаэль Энтезами полагает, что такой тест избавит 80 — 90 процентов беременных от необходимости исследования околоплодных вод, особенно если она продиктована лишь возрастом. Но если анализ крови укажет на трисомию и встанет вопрос об искусственном прерывании беременности, вот тут, считает гинеколог, без амниоцентеза не обойтись: «Внутреннее чувство подсказывает мне, что, по крайней мере, в ближайшие годы едва ли кто-то возьмет на себя ответственность решать вопрос об аборте лишь на основании такого анализа крови».
И все же, хотя новый тест и не панацея, он существенно упростит дородовую диагностику синдрома Дауна и станет заслуживающей внимания альтернативой для тысяч и тысяч беременных, избавляя их от малоприятной и рискованной процедуры пункции зародышевой оболочки. В Германии новый тест должен появиться на рынке в середине текущего года.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
Какие физические признаки шеи характерны для синдрома Дауна?
[Директива] Bull MJ. Наблюдение за здоровьем детей с синдромом Дауна. Педиатрия . 2011 Август 128 (2): 393-406. [Медлайн]. [Полный текст].
Лежен Дж.Le mongolisme. Главный пример аутосомической аберрации человека. Энн Генет . 1959. 1: 41-9.
Джейкобс PA, Baikie AG, Court Brown WM, Strong JA. Соматические хромосомы в монголизме. Ланцет . 1959 г. 4. 1 (7075): 710. [Медлайн].
Петерсон М.Б., Миккельсен М. Неразхождение при трисомии 21: происхождение и механизмы. Cytogenet Cell Genet . 2000. 91: 199-203.
ЛЕЖЕН Ж., ГОТЬЕ М., ТУРПИН Р. Исследование соматических хромосом у 9 детей-монголоидов. C R Hebd Seances Acad Sci . 1959 16 марта. 248 (11): 1721-2. [Медлайн].
Левенсон Д. Говоря о синдроме Дауна. Ам Дж. Мед Генет А . 2009 15 февраля. 149A (4): vii-viii. [Медлайн].
[Рекомендации] Хартвей С. Руководство для родителей по генетике синдрома Дауна. Adv Neonatal Care . 2009 Февраль 9 (1): 27-30. [Медлайн].
Ранвейлер Р. Оценка и уход за новорожденным с синдромом Дауна. Adv Neonatal Care . 2009 февраля, 9 (1): 17-24; Тест 25-6. [Медлайн].
Cheon MS, Shim KS, Kim SH, Hara A, Lubec G.Уровни белка в генах, кодируемых на хромосоме 21 в мозге плода с синдромом Дауна: оспаривая гипотезу о влиянии дозировки гена (Часть IV). Аминокислоты . 2003 июл.25 (1): 41-7. [Медлайн].
Тарани Л., Карито В., Феррагути Дж. И др. Нейровоспалительные маркеры в сыворотке крови детей препубертатного возраста с синдромом Дауна. Дж. Иммунол Рес . 2020. 2020: 6937154. [Медлайн]. [Полный текст].
Романо А., Корниа Р., Мораски М. и др.Снижение толщины коры головного мозга, связанное с возрастом, у субъектов с синдромом Дауна без деменции. Дж. Нейровизуализация . 2015 21 мая. [Medline].
2015 21 мая. [Medline].
[Рекомендации] Практический бюллетень № 163: Скрининг на анеуплоидию плода. Акушерский гинекол . 2016 май. 127 (5): e123-37. [Медлайн]. [Полный текст].
Canfield MA, Honein MA, Yuskiv N, Xing J, Mai CT, Collins JS. Национальные оценки и расовые / этнические различия отдельных врожденных дефектов в США, 1999-2001 гг. Врожденные дефекты Res A Clin Mol Teratol . 2006 ноябрь 76 (11): 747-56. [Медлайн].
Coppus AM, Evenhuis HM, Verberne GJ, et al. Выживаемость у пожилых людей с синдромом Дауна. Дж. Ам Гериатр Соц . 2008 декабрь 56 (12): 2311-6. [Медлайн].
Хартли Д., Блюменталь Т., Каррилло М. и др. Синдром Дауна и болезнь Альцгеймера: общие пути, общие цели. Демент Альцгеймера . 2015 июн. 11 (6): 700-9. [Медлайн].[Полный текст].
11 (6): 700-9. [Медлайн].[Полный текст].
Мэтьюз Т.Дж., Аллен Д.К., Мэтьюз А.Л., Митчелл А., Санторо С.Л., Коэн Л. Оценка здоровья, социальных, коммуникативных и повседневных навыков взрослых с синдромом Дауна. Ам Дж. Мед Генет А . 2018 25 апреля. [Medline].
[Рекомендации] Коэн В.И., изд. Рекомендации по оказанию медицинской помощи лицам с синдромом Дауна (медицинский контрольный список для профилактики синдрома Дауна). Синдром Дауна Q . 1996. 1 (2): 1-10. [Полный текст].
Nieuwenhuis-Mark RE. Диагностика деменции Альцгеймера при синдроме Дауна: проблемы и возможные решения. Res Dev Disabil . 2009. 30 (5): 827-838.
Kusters MA, Verstegen RH, Gemen EF, de Vries E. Внутренний дефект иммунной системы у детей с синдромом Дауна: обзор. Clin Exp Immunol . 2009 Май. 156 (2): 189-93. [Медлайн]. [Полный текст].
Clin Exp Immunol . 2009 Май. 156 (2): 189-93. [Медлайн]. [Полный текст].
Vis JC, Duffels MG, Winter MM, Weijerman ME, Cobben JM, Huisman SA.Синдром Дауна: сердечно-сосудистая перспектива. J Intellect Disabil Res . 2009 Май. 53 (5): 419-25. [Медлайн].
Lanfranchi S, Carretti B, Spanò G, Cornoldi C. Специфический дефицит зрительно-пространственной одновременной рабочей памяти при синдроме Дауна. J Intellect Disabil Res . 2009 Май. 53 (5): 474-83. [Медлайн].
Levorato MC, Roch M, Beltrame R. Понимание текста при синдроме Дауна: роль способностей более низкого и высокого уровня. Клинический лингвист Телефон . 2009 г., 23 (4): 285-300. [Медлайн].
Саломон Л.Дж., Бернар М., Амарси Р., Бернар Дж. П., Вилле Ю. Влияние ошибки измерения длины темени и крестца на комбинированный скрининг синдрома Дауна: исследование с помощью моделирования.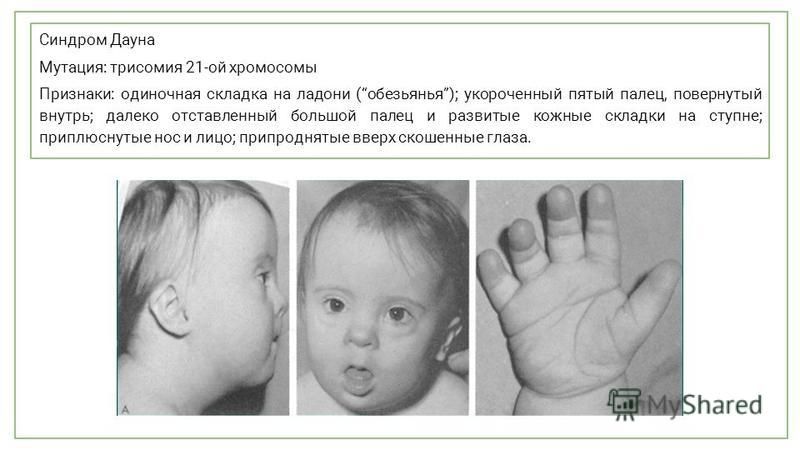 Ультразвуковой акушерский гинеколь . 2009 Май. 33 (5): 506-11. [Медлайн].
Ультразвуковой акушерский гинеколь . 2009 Май. 33 (5): 506-11. [Медлайн].
Зигман ВБ. Атипичное старение при синдроме Дауна. Dev Disabil Res Rev.. 2013. 18 (1): 51-67. [Медлайн].
Scherbenske JM, Benson PM, Rotchford JP, James WD.Кожные и глазные проявления синдрома Дауна. J Am Acad Dermatol . 1990 Май. 22 (5 Пет 2): 933-8. [Медлайн].
Вильмс А., Даммер Р. [Серпигинозный перфорированный эластоз при синдроме Дауна]. Hautarzt . 1997 декабрь 48 (12): 923-5. [Медлайн].
Daneshpazhooh M, Nazemi TM, Bigdeloo L, Yoosefi M. Кожно-слизистые исследования у 100 детей с синдромом Дауна. Педиатр дерматол . 2007 май-июнь. 24 (3): 317-20. [Медлайн].
Masjkey D, Bhattacharya S, Dhungel S, Jha CB, Shrestha S, Ghimire SR, et al.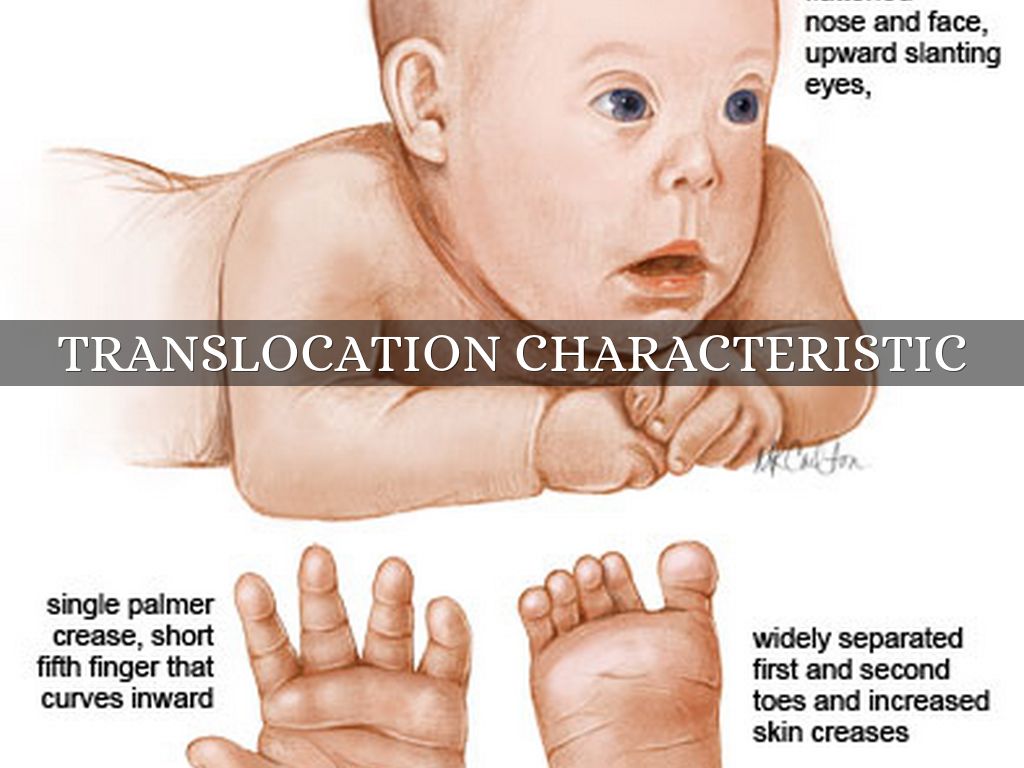 Использование фенотипических дермальных показателей в выявлении пациентов с синдромом Дауна. Nepal Med Coll J . 2007 декабрь 9 (4): 217-21. [Медлайн].
Использование фенотипических дермальных показателей в выявлении пациентов с синдромом Дауна. Nepal Med Coll J . 2007 декабрь 9 (4): 217-21. [Медлайн].
Геггель Р.Л., О’Брайен Дж. Э., Фейнгольд М. Развитие клапанной дисфункции у подростков и молодых людей с синдромом Дауна и неизвестными врожденными пороками сердца. J Педиатр . 1993 Май. 122 (5 Пет 1): 821-3.[Медлайн].
Земель Б.С., Пипан М., Столлингс В.А. и др. Диаграммы роста для детей с синдромом Дауна в США. Педиатрия . 2015 ноябрь 136 (5): e1204-11. [Медлайн]. [Полный текст].
Аннерен Г., Густавсон К. Х., Сара В. Р., Тувемо Т. Задержка роста при синдроме Дауна в отношении инсулиноподобных факторов роста и гормона роста. Am J Med Genet Suppl . 1990. 7: 59-62. [Медлайн].
Попова Г., Патерсон В.Ф., Браун А., Дональдсон М.Д. Тиреоидит Хашимото при синдроме Дауна: клинические проявления и эволюция. Horm Res . 2008. 70 (5): 278-84. [Медлайн].
Шалитин С., Филип М. Аутоиммунный тиреоидит у младенцев с синдромом Дауна. J Педиатр эндокринол . 2002. 15: 649-652.
Идрис И., О’Мэлли Б.П. Тиреотоксикоз при синдромах Дауна и Тернера: вероятность тиреоидита Хашимото как основной этиологии. Int J Clin Pract . 2000. 54: 272-273.
Zwaan MC, Reinhardt D, Hitzler J, Vyas P. Острые лейкемии у детей с синдромом Дауна. Педиатр Клин N Am . 2008. 55: 53-70.
Лернер Л.Х., Висс К., Геллис С., Барнхилл Р. Необычная пустулезная сыпь у младенца с синдромом Дауна и врожденной лейкемоидной реакцией. J Am Acad Dermatol . 1996, 35 августа (2, часть 2): 330-3. [Медлайн].
Хитцлер Дж. К., Зипурский А. Происхождение лейкемии у детей с синдромом Дауна. Нат Рев Рак . 2005 января 5 (1): 11-20. [Медлайн].
Li Z, Godinho FJ, Klusmann JH, Garriga-Canut M, Yu C, Orkin SH. Селективный эффект стадии развития соматически мутировавшего лейкемогенного фактора транскрипции GATA1. Нат Генет . 2005 июн. 37 (6): 613-9. [Медлайн].
Селективный эффект стадии развития соматически мутировавшего лейкемогенного фактора транскрипции GATA1. Нат Генет . 2005 июн. 37 (6): 613-9. [Медлайн].
Magalhaes IQ, Splendore A, Emerenciano M, et al. Преходящее миелопролиферативное заболевание новорожденных без синдрома Дауна и обнаружение мутации GATA1. J Педиатр Hematol Oncol . 2005 27 января (1): 50-2. [Медлайн].
Ахмед М., Штернберг А., Холл Г. и др. Естественная история мутации GATA-1 при синдроме Дауна. Кровь . 2004. 103: 2480-2489.
Bhatt S, Schreck R, Graham JM, Korenberg JR, Hurvitz CG, Fischel-Ghodsian N. Транзиторная лейкемия с трисомией 21: описание случая и обзор литературы. Am J Med Genet . 1995 25 сентября. 58 (4): 310-4. [Медлайн].
Родерик Дж. А., Брэдшоу, штат Вашингтон. Преходящее миелопролиферативное заболевание у новорожденного с синдромом Дауна. Adv neonat Care . 2008. 8: 208-218.
А., Брэдшоу, штат Вашингтон. Преходящее миелопролиферативное заболевание у новорожденного с синдромом Дауна. Adv neonat Care . 2008. 8: 208-218.
Gamis A, Hilden J. Преходящее милеопролиферативное заболевание со слишком небольшим количеством данных и множеством вопросов без ответов: содержит ли оно важную часть головоломки для понимания гематаопоэза и острого миелогенного лейкоза ?. J Педиатр Hematol Oncol . 2002. 24: 2-5.
Ма СК, Ван Т.С., Чан ГК, Ха СИ, Фунг Л.Ф., Чан ЛК.Связь между преходящим аномальным миелопоэзом и острым мегакариобластным лейкозом при синдроме Дауна. Br J Haematol . 2001 Март 112 (3): 824-5. [Медлайн].
Тауб Дж. Синдром Дауна и мегакариоцитарный лейкоз / преходящее миелопролиферативное заболевание: когда это начинается ?. Кровь . 2003. 101: 4228-4300.
Аль-Касим Ф., Дойл Дж. Дж., Месси Г. В. и др. Заболеваемость и лечение потенциально летальных заболеваний при транзиторной лейкемии синдрома Дауна: Групповое исследование детской онкологии. J Педиатр Hematol Oncol . 2002. 24: 9-13.
Massey GV, Zipursky A, Chang MN, Doyle JJ, Nasim S, Taub JW. Проспективное исследование естественного течения преходящего лейкоза (TL) у новорожденных с синдромом Дауна (DS): исследование детской онкологической группы (COG) POG-9481. Кровь . 15 июня 2006 г. 107 (12): 4606-13. [Медлайн].
Кривит З., Хорошее РА. Одновременное возникновение лейкемии и монголизма; сообщать о наших случаях. AMA J Dis Child .1956. 91: 218-222.
Хасле Х, Клемменсен И. Х., Миккельсен М. Риски лейкемии и солидных опухолей у людей с синдромом Дауна. Ланцет . 2000 15 января. 355 (9199): 165-9. [Медлайн].
Ланцет . 2000 15 января. 355 (9199): 165-9. [Медлайн].
Йенсен К.М., Булова П.Д. Организация ухода за взрослыми с синдромом Дауна. BMJ . 2014 30 сентября. 349: g5596. [Медлайн].
Ringman JM, Rao N, Lu PH, Cederbaum S. Мозаицизм по поводу трисомии 21 у пациента с деменцией с ранним началом.Отчет о болезни и краткий обзор литературы. Arch Neurol . 2008. 65: 412-415.
Папавассилиу П., Йорк Т.П., Гурсой Н., Хилл Дж., Найсли Л.В., Сундарам У. Фенотип лиц, страдающих мозаицизмом по трисомии 21 / синдрому Дауна, отражает процентное содержание трисомных клеток в различных тканях. Ам Дж. Мед Генет А . 2009 15 февраля. 149A (4): 573-83. [Медлайн].
Баум Р.А., Нэш П.Л., Фостер Дж. Э., Спейдер М., Рэтлифф-Шауб К., Кури Д. Л.Первичная помощь детям и подросткам с синдромом Дауна: обновленная информация. Curr Probl Pediatr Adolesc Health Care . 2008 Сентябрь 38 (8): 241-61. [Медлайн].
Л.Первичная помощь детям и подросткам с синдромом Дауна: обновленная информация. Curr Probl Pediatr Adolesc Health Care . 2008 Сентябрь 38 (8): 241-61. [Медлайн].
Colvin KL, Yeager ME. Что люди с синдромом Дауна могут рассказать нам о сердечно-легочных заболеваниях. Eur Respir Ред. . 2017 26 января (143): [Medline]. [Полный текст].
McDowell KM, Craven DI. Легочные осложнения синдрома Дауна в детстве. J Педиатр .2011 Февраль 158 (2): 319-25. [Медлайн].
Алими А., Тейтард Дж., Абу Таам Р. и др. Легочный гемосидероз у детей с синдромом Дауна: отечественный опыт. Орфанет J Редкие диски . 2018 20 апреля. 13 (1): 60. [Медлайн]. [Полный текст].
Лиянаге С., Барнс Дж. Глаз и синдром Дауна. Br J Hosp Med (Лондон) .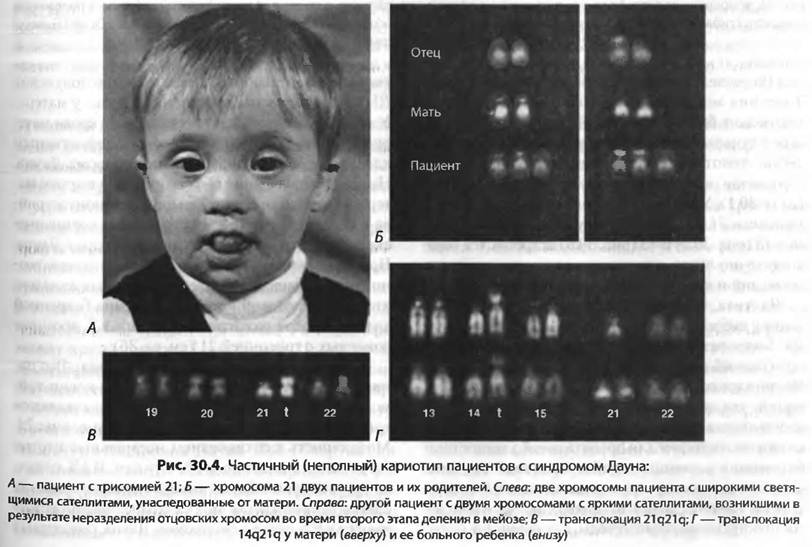 2008 ноябрь 69 (11): 632-4. [Медлайн].
2008 ноябрь 69 (11): 632-4. [Медлайн].
Миядзаки Э.А. Ортоптика синдрома Дауна. Am Orthopt J . 2014. 64: 12-6. [Медлайн].
Рабин KR, Whitlock JA. Злокачественные новообразования у детей с трисомией 21. Онколог . 2009 14 февраля (2): 164-73. [Медлайн]. [Полный текст].
Бхатнагар Н., Низери Л., Танстолл О., Вьяс П., Робертс И. Преходящий аномальный миелопоэз и ОМЛ при синдроме Дауна: обновление. Curr Hematol Malig Rep . 2016 11 октября (5): 333-41. [Медлайн]. [Полный текст].
Мартинес Э., Кастанеда Д., Харамилло С. и др.Измененные иммунные параметры коррелируют с госпитализацией детей с синдромом Дауна в связи с инфекцией. Хум Иммунол . 2016 июл.77 (7): 594-9. [Медлайн].
Rogers PT, Ройзен, штат Нью-Джерси, Капоне, GT. Синдром Дауна. Капуте А.Дж., Аккардо П.Дж. Нарушения развития в младенчестве и детстве .2-й. 1996. 221-224.
Pueschel SM, Scola FH. Атлантоаксиальная нестабильность у людей с синдромом Дауна: эпидемиологические, рентгенографические и клинические исследования. Педиатрия . 1987. 80: 555-560.
Джудж Х., Эмери Х. Артропатия синдрома Дауна: недиагностированное и недооцененное состояние. J Педиатр . 2009 Февраль 154 (2): 234-8. [Медлайн].
Майерс Б.А., Пуэшель С.М. Психиатрические расстройства у лиц с синдромом Дауна. Дж. Нерв Мент Дис . 1991 Октябрь 179 (10): 609-13. [Медлайн].
Дж. Нерв Мент Дис . 1991 Октябрь 179 (10): 609-13. [Медлайн].
миль JH. Расстройства аутистического спектра — обзор генетики. Генет Мед . 2011 Апрель 13 (4): 278-94. [Медлайн].
Кент Л., Эванс Дж, Пол М., Шарп М. Коморбидность расстройств аутистического спектра у детей с синдромом Дауна. Dev Med Детский Neurol . 1999 г., 41 (3): 153-8. [Медлайн].
Райс К. Центры по контролю и профилактике заболеваний.Распространенность расстройств аутистического спектра — сеть мониторинга аутизма и пороков развития, 14 сайтов, США, 2002 г. MMWR CDC Surveill Summ . 2007. 56: 12-28.
Фоли К.Р., Бурк Дж., Эйнфельд С.Л., Тонг Б.Дж., Джейкоби П., Леонард Х. Паттерны депрессивных симптомов и поведения, связанного с социальными отношениями, со временем отличаются от других поведенческих сфер у молодых людей с синдромом Дауна. Медицина (Балтимор) . 2015 май. 94 (19): 1-7. [Медлайн].
Медицина (Балтимор) . 2015 май. 94 (19): 1-7. [Медлайн].
Wisniewski KE, Wisniewski HM, Wen GY.Возникновение невропатологических изменений и деменции при болезни Альцгеймера при синдроме Дауна. Энн Нейрол . 1985 марта 17 (3): 278-82. [Медлайн].
Fonseca LM, Yokomizo JE, Bottino CM, Fuentes D. Дегенерация лобной доли у взрослых с синдромом Дауна и болезнью Альцгеймера: обзор. Демент Гериатр, когнитивное расстройство . 2016. 41 (3-4): 123-36. [Медлайн]. [Полный текст].
Эсбенсен А.Дж., Джонсон Э.Б., Амарал Дж.Л., Тан С.М., Макс Р.Дифференциация старения среди взрослых с синдромом Дауна и коморбидной деменцией или психопатологией. Am J Intellect Dev Disabil . 2016 января 121 (1): 13-24. [Медлайн]. [Полный текст].
Саммерфилд П. Пренатальный скрининг синдрома Дауна: необходимы сбалансированные дискуссии. Ланцет . 2009 28 февраля. 373 (9665): 722. [Медлайн].
Fransen MP, Hajo Wildschut, Vogel I, Mackenbach J, Steegers E, Essink-Bot ML. Информация о пренатальном скрининге на синдром Дауна: этнические различия в знаниях. Кабинеты по обучению пациентов . 2009 ноябрь 77 (2): 279-88. [Медлайн].
Кукл Х. Биохимический скрининг синдрома Дауна. евро J Obstet Gynecol Reprod Biol . 2000 Сентябрь 92 (1): 97-101. [Медлайн].
Nicolaides KH, Spencer K, Avgidou K, Faiola S, Falcon O. Многоцентровое исследование скрининга на трисомию 21 в первом триместре у 75 821 беременность: результаты и оценка потенциального воздействия индивидуального ориентированного на риск двухэтапного первого триместра скрининг. Ультразвуковой акушерский гинеколь . 2005 25 марта (3): 221-6. [Медлайн].
Многоцентровое исследование скрининга на трисомию 21 в первом триместре у 75 821 беременность: результаты и оценка потенциального воздействия индивидуального ориентированного на риск двухэтапного первого триместра скрининг. Ультразвуковой акушерский гинеколь . 2005 25 марта (3): 221-6. [Медлайн].
Каган К.О., Райт Д., Бейкер А., Сахота Д., Николаидес К.Х. Скрининг на наличие трисомии 21 по возрасту матери, толщине затылочной кости плода, свободному бета-хорионическому гонадотропу человека и белку плазмы крови, связанному с беременностью. Ультразвуковой акушерский гинеколь . 31 июня 2008 г. (6): 618-24. [Медлайн].
Nicolaides KH. Прозрачность затылочной кости и другие сонографические маркеры хромосомных аномалий в первом триместре. Am J Obstet Gynecol . 2004 Июль 191 (1): 45-67. [Медлайн].
Dreux S, Olivier C, Dupont JM, Leporrier N, Oury JF. Скрининг материнской сыворотки при мозаичном и транслокационном синдроме Дауна. Prenat Diagn . 2008 28 августа (8): 699-703. [Медлайн].
Натоли Дж. Л., Акерман Д. Л., МакДермотт С., Эдвардс Дж. Дж. Пренатальная диагностика синдрома Дауна: систематический обзор показателей прерывания (1995-2011). Prenat Diagn .2012 Февраль 32 (2): 142-53. [Медлайн].
Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. Многоцентровый проект в Великобритании по оценке риска трисомии 21 по возрасту матери и толщине затылочной кости плода на 10-14 неделе беременности. Группа скрининга первого триместра Фонда медицины плода. Ланцет . 1998, 1 августа. 352 (9125): 343-6. [Медлайн].
Многоцентровый проект в Великобритании по оценке риска трисомии 21 по возрасту матери и толщине затылочной кости плода на 10-14 неделе беременности. Группа скрининга первого триместра Фонда медицины плода. Ланцет . 1998, 1 августа. 352 (9125): 343-6. [Медлайн].
Нортон М.Э., Брар Х., Вайс Дж., Карими А., Лоран Л.К., Каугей А.Б. и др. Исследование неинвазивной хромосомной оценки (NICE): результаты многоцентрового проспективного когортного исследования для выявления трисомии 21 и трисомии 18 плода. Am J Obstet Gynecol . 1 июня 2012 г. [Medline].
Barclay L. Анализ крови матери может выявить трисомию в первом триместре. Медицинские новости Medscape. 7 июня 2013 г. Доступно по адресу http://www.medscape.com/viewarticle/805519. Доступ: 8 июля 2013 г.
Gil MM, Quezada MS, Bregant B, Ferraro M, Nicolaides KH. Внедрение тестирования бесклеточной ДНК материнской крови в раннем скрининге на анеуплоидии. Ультразвуковой акушерский гинеколь .2013 Июль 42 (1): 34-40. [Медлайн].
Внедрение тестирования бесклеточной ДНК материнской крови в раннем скрининге на анеуплоидии. Ультразвуковой акушерский гинеколь .2013 Июль 42 (1): 34-40. [Медлайн].
Николаидес К. Х., Райт Д., Пун Л. С., Сингелаки А., Гил М. М.. Контингентный скрининг в первом триместре на трисомию 21 по биомаркерам и бесклеточный анализ ДНК материнской крови. Ультразвуковой акушерский гинеколь . 2013 Июль 42 (1): 41-50. [Медлайн].
Паломаки Г.Е., Клоза Е.М., Ламберт-Мессерлиан Г.М. и др. Секвенирование ДНК материнской плазмы для выявления синдрома Дауна: международное клиническое валидационное исследование. Генет Мед .2011 13 ноября (11): 913-920. [Медлайн].
Barclay L. Анализ крови матери может выявить трисомию в первом триместре. Medscape Medical News, 7 июня 2013 г. Доступно по адресу http://www.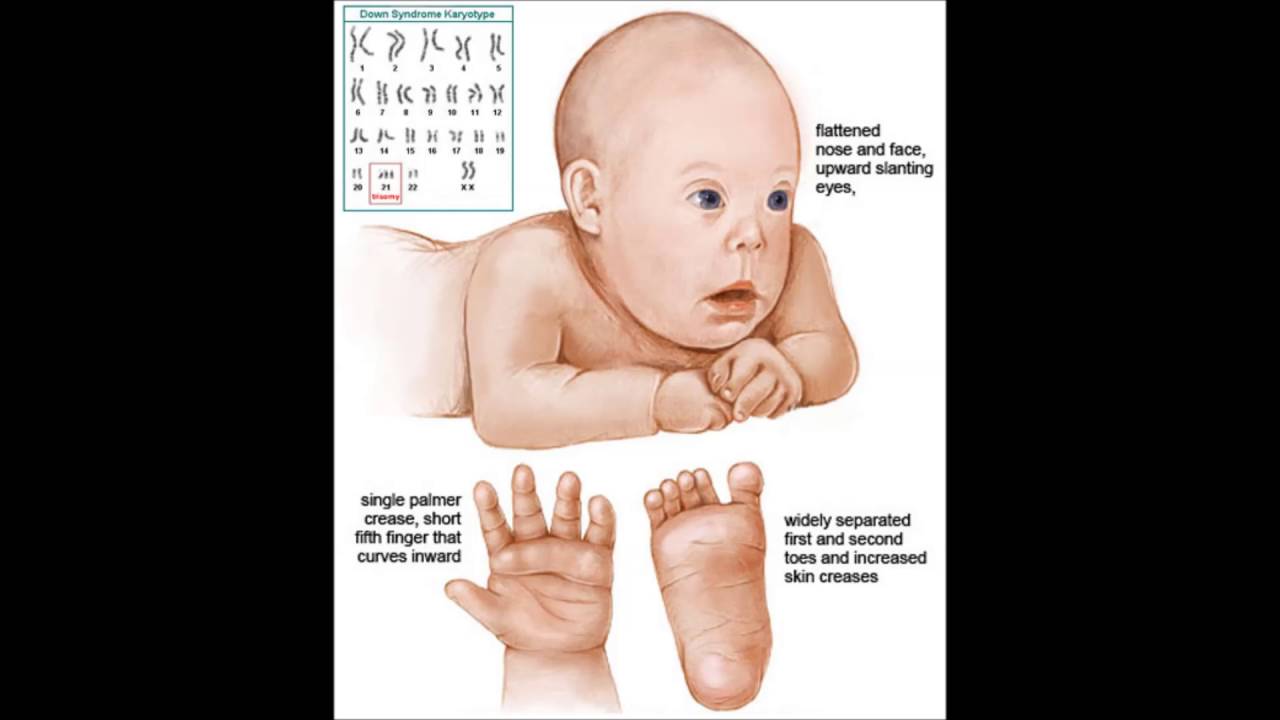 medscape.com/viewarticle/805519. Доступ: 8 июля 2013 г.
medscape.com/viewarticle/805519. Доступ: 8 июля 2013 г.
Gil MM, Quezada MS, Bregant B, Ferraro M, Nicolaides KH. Внедрение тестирования бесклеточной ДНК материнской крови в раннем скрининге на анеуплоидии. Ультразвуковой акушерский гинеколь . 2013 Июль 42 (1): 34-40.[Медлайн].
Рупела В., Веллеман С.Л., Андрианопулос М.В. Двигательные речевые навыки у детей с синдромом Дауна: описательное исследование. Int J Speech Lang Pathol . 2016 11. 1-10 января. [Медлайн].
Бунт CW, Бунт СК. Роль семейного врача в уходе за детьми с синдромом Дауна. Am Fam Врач . 2014 15 декабря. 90 (12): 851-8. [Медлайн]. [Полный текст].
Tassone JC, Duey-Holtz A.Проблемы с позвоночником в Специальном олимпийце с синдромом Дауна. Sports Med Arthrosc . 2008 16 марта (1): 55-60. [Медлайн].
2008 16 марта (1): 55-60. [Медлайн].
Диаз КМ. Физическая активность и сидячий образ жизни среди детей США с синдромом Дауна и без него: Национальное исследование здоровья детей. Am J Intellect Dev Disabil . 2020 май. 125 (3): 230-42. [Медлайн].
Уорбертон Д., Даллер Л., Тангавелу М., Росс Л., Левин Б., Клайн Дж. Повторение трисомии: пересмотр на основе данных по Северной Америке. Ам Дж Хам Генет . 2004 Сентябрь 75 (3): 376-85. [Медлайн].
Нуссбаум Р.Л., Макиннес Р.Р., Уиллард Х.Ф. Томпсон и генетика Томпсона в медицине. Шестое исправленное издание . Филадельфия: W.B. Сондерс; 2004.
Синдром Толми Дж. Дауна и другие аутосомные трисомии. Римоин Д.Л., Коннор Дж.М., Пайериц Р.Э., Корф Б.Р. Принципы и практика медицинской генетики Эмери и Римоина . 4-е издание. 2002. 1129-1183.
4-е издание. 2002. 1129-1183.
Galleguillos C, Galleguillos B, Larios G, Menchaca G, Bont L, Castro-Rodriguez JA. Синдром Дауна является фактором риска тяжелой инфекции нижних дыхательных путей, вызванной респираторно-синцитиальным вирусом. Acta Paediatr . 2016 ноябрь 105 (11): e531-5. [Медлайн].
Сугимото Д., Боуэн С.Л., Михан В.П., 3-й, Страччолини А. Влияние нервно-мышечной тренировки на детей и молодых людей с синдромом Дауна: систематический обзор и метаанализ. Res Dev Disabil . 2016 25 апреля. 55: 197-206. [Медлайн].
| Мичиган Медицина
Обзор теста
Скрининг затылочной (скажем, «NEW-kuhl») прозрачности — это тест, проводимый во время беременности. Он использует ультразвук для измерения толщины скопления жидкости на задней части шеи развивающегося ребенка. Если эта область толще, чем обычно, это может быть ранним признаком синдрома Дауна, трисомии 18 или проблем с сердцем.
Если эта область толще, чем обычно, это может быть ранним признаком синдрома Дауна, трисомии 18 или проблем с сердцем.
Тест проводится на сроке от 11 до 14 недель беременности. Это может быть сделано как часть скринингового теста в первом триместре или интегрированного скринингового теста.
Этот тест показывает шанс , что у ребенка может быть определенная проблема. Нельзя с уверенностью сказать, что у ребенка проблема. Вам понадобится диагностический тест, например, биопсия ворсин хориона (CVS) или амниоцентез, чтобы точно узнать, действительно ли у ребенка проблема.
Почему это делается
Тест на прозрачность воротниковой зоны проводится для определения вероятности того, что ваш развивающийся ребенок (плод) может быть подвержен риску развития синдрома Дауна или других проблем.
Как подготовить
Вам может потребоваться полный мочевой пузырь для теста на затылочную прозрачность. В этом случае вас попросят выпить воды или других жидкостей непосредственно перед тестом и избегать мочеиспускания перед тестом.
В этом случае вас попросят выпить воды или других жидкостей непосредственно перед тестом и избегать мочеиспускания перед тестом.
Поговорите со своим врачом о любых проблемах, которые у вас есть относительно необходимости теста, его рисков, того, как это будет проводиться или что будут означать результаты. Чтобы помочь вам понять важность этого теста, заполните информационную форму медицинского теста.
Как это делается
Чаще всего тест на прозрачность воротниковой зоны проводится специально обученным ультразвуковым технологом. Но это может сделать рентгенолог или акушер, прошедший специальную подготовку для выполнения этого теста.
Часто перед тестом снимать одежду не нужно. Вы можете приподнять рубашку и опустить пояс юбки или брюк. Если вы носите платье, вам дадут тканевое или бумажное покрытие, чтобы накинуть на ноги во время теста.
Если вам нужен полный мочевой пузырь для теста, сообщите своему врачу или ультразвуковому технику, если ваш мочевой пузырь настолько переполнен, что вы испытываете боль.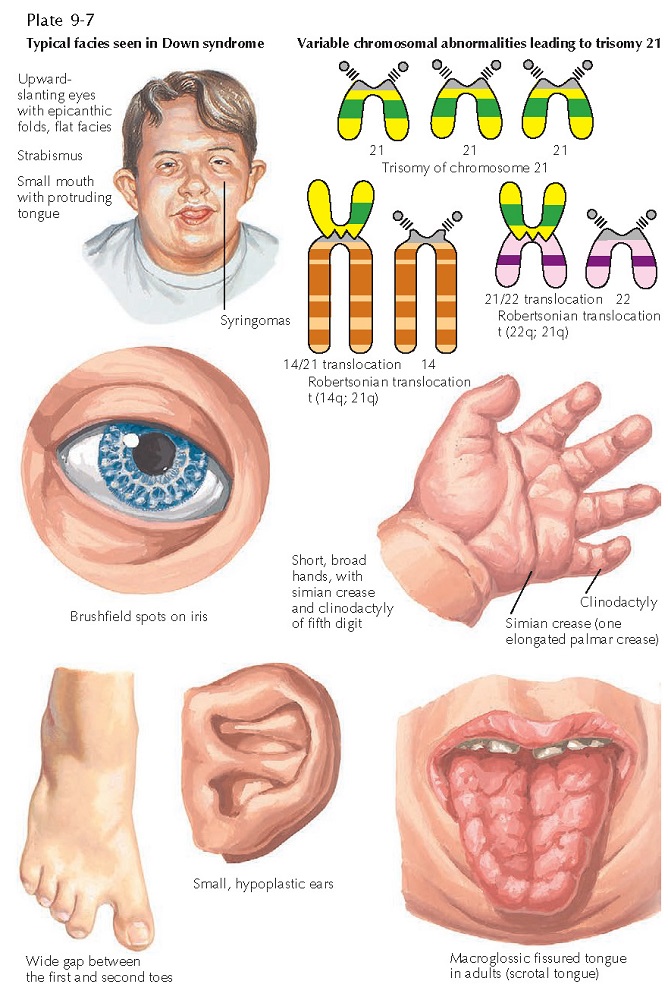
Во время теста:
- Вы ляжете на спину или на бок на экзаменационном столе.
- Гель намазывается на живот.
- Небольшое портативное устройство, называемое датчиком, будет прижиматься к гелю на вашей коже и перемещаться по вашему животу. Изображения малыша отображаются на мониторе. Технолог или врач будет искать и измерять толщину скопления жидкости на задней части шеи ребенка.
По окончании теста гель вытирается с кожи. Вы можете помочиться сразу после сдачи анализа.
Обычно проверка занимает от 15 до 20 минут.
Каково это
Во время теста на прозрачность затылочной кости у вас может возникнуть ощущение давления в мочевом пузыре. При первом нанесении геля на живот может казаться прохладным. Вы почувствуете легкое давление датчика, когда он пройдет по вашему животу.
Риски
Нет известных рисков, связанных с тестом на затылочную прозрачность ни для вас, ни для ребенка. Но вы можете почувствовать беспокойство, если тест покажет, что вероятность того, что у вашего ребенка может быть проблема, повышена.
Но вы можете почувствовать беспокойство, если тест покажет, что вероятность того, что у вашего ребенка может быть проблема, повышена.
Ультразвук — это безопасный способ проверить наличие проблем и получить информацию о вашем развивающемся ребенке. Он не использует рентгеновские лучи или другие виды излучения, которые могут нанести вред ребенку.
Результаты
Ваш врач изучит результаты теста на полупрозрачность воротниковой зоны, чтобы определить, является ли область задней части шеи ребенка толще, чем обычно.
Нормальный: | 2.5 миллиметров (мм) или меньше |
Ненормальное: | Более 2,5 мм |
Вы можете не сразу получить информацию о тесте. Полные результаты обычно доступны через 1-2 дня.
Насколько точен тест?
Тест на полупрозрачность затылочной кости может определить, подвержен ли ваш развивающийся ребенок (плод) более высокому, чем обычно, риску возникновения проблем. Но нельзя сказать наверняка, что у ребенка проблема.Чтобы убедиться в этом, вам понадобится еще один тест, называемый диагностическим.
Но нельзя сказать наверняка, что у ребенка проблема.Чтобы убедиться в этом, вам понадобится еще один тест, называемый диагностическим.
Точность этого теста зависит от того, как часто тест правильно обнаруживает проблему. Например:
- Тест на затылочную прозрачность правильно выявляет синдром Дауна у 64–70 из 100 плодов, у которых он есть. Он пропускает синдром Дауна у 30–36 из 100 плодов. сноска 2
- Скрининг в первом триместре (затылочная прозрачность в сочетании с анализами крови) правильно выявляет синдром Дауна у 82–87 из 100 плодов, у которых он есть.Но эти тесты пропускают его у 13-18 из 100 плодов. сноска 2
- Интегрированный скрининговый тест (тесты в первом триместре плюс тройные или четырехкратные скрининговые анализы крови во втором триместре) правильно выявляет синдром Дауна у 96 из 100 плодов, у которых он есть. Это означает, что тест пропускает синдром Дауна у 4 из 100 плодов. сноска 2
Возможно, скрининговый тест покажет, что у ребенка повышенная вероятность возникновения проблемы, когда у него или нее нет проблемы. Это называется ложноположительным результатом теста. И также возможно, что обследование может показать, что у ребенка нет проблем, когда они есть. Это называется ложноотрицательным результатом теста.
Это называется ложноположительным результатом теста. И также возможно, что обследование может показать, что у ребенка нет проблем, когда они есть. Это называется ложноотрицательным результатом теста.
Что влияет на тест
На результаты теста на прозрачность затылочной кости могут влиять:
- Избыточный вес или ожирение.
- Стул (кал) или воздух в кишечнике или прямой кишке.
- Чрезмерно низкое количество околоплодных вод.
- Невозможно неподвижно лежать во время теста.
- Плод находится в определенных положениях во время теста.
- Очень активный плод.
Что думать о
Поговорите со своим врачом о любых проблемах, которые у вас есть.
Список литературы
Цитаты
- Фишбах Ф, Даннинг МБ III (2015). Руководство по лабораторным и диагностическим исследованиям , 9 изд.
Филадельфия: Wolters Kluwer Health.
- Американский колледж акушеров и гинекологов (2016). Скрининг на анеуплоидию плода. Бюллетень практики ACOG № 163. Акушерство и гинекология , 127 (5): e123 – e137. DOI: 10.1097 / AOG.0000000000001406. По состоянию на 6 апреля 2017 г.
Кредиты
Текущий по состоянию на: 8 октября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Сара Маршалл, доктор медицины, семейная медицина
Адам Хусни, доктор медицины, семейная медицина
Кэтлин Ромито, доктор медицины, семейная медицина
Шивон М.Долан, доктор медицины, магистр здравоохранения — Репродуктивная генетика
По состоянию на 8 октября 2020 г.
Автор: Здоровый персонал
Медицинский обзор: Сара Маршалл, доктор медицины, семейная медицина, Адам Хусни, доктор медицины, семейная медицина, Кэтлин Ромито, доктор медицины, и Шивон М. Долан, доктор медицины, магистр здравоохранения, репродуктивная генетика,
Долан, доктор медицины, магистр здравоохранения, репродуктивная генетика,
Fischbach F, Dunning MB III (2015). Руководство по лабораторным и диагностическим исследованиям , 9 изд. Филадельфия: Wolters Kluwer Health.
Американский колледж акушеров и гинекологов (2016). Скрининг на анеуплоидию плода. Бюллетень практики ACOG № 163. Акушерство и гинекология , 127 (5): e123-e137. DOI: 10.1097 / AOG.0000000000001406. По состоянию на 6 апреля 2017 г.
Причины, симптомы, диагностика и лечение
Что такое синдром Дауна?
Синдром Дауна — это генетическое заболевание, которое вызывает легкие или серьезные физические проблемы и проблемы развития.
Люди с синдромом Дауна рождаются с лишней хромосомой. Хромосомы — это связки генов, и ваше тело зависит от наличия нужного количества из них. При синдроме Дауна эта дополнительная хромосома приводит к ряду проблем, которые влияют на вас как умственно, так и физически.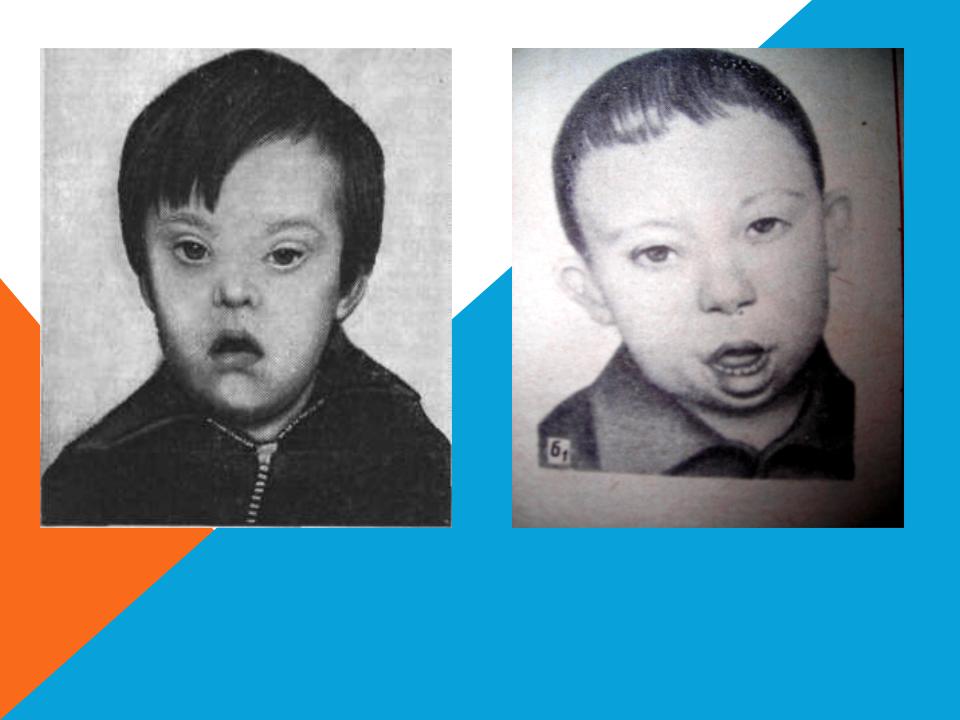
Синдром Дауна — это пожизненное заболевание. Хотя его невозможно вылечить, сейчас врачи знают о нем больше, чем когда-либо. Если у вашего ребенка это заболевание, получение правильного ухода на раннем этапе может иметь большое значение, помогая ему жить полноценной и содержательной жизнью.
Симптомы синдрома Дауна
Синдром Дауна может иметь множество эффектов, и у разных людей они разные. Некоторые вырастут и будут жить почти полностью самостоятельно, а другим потребуется дополнительная помощь в уходе за собой.
Умственные способности различаются, но у большинства людей с синдромом Дауна есть проблемы с мышлением, рассуждением и пониманием от легких до умеренных. Они будут учиться и осваивать новые навыки всю свою жизнь, но им может потребоваться больше времени, чтобы достичь таких важных целей, как ходьба, разговор и развитие социальных навыков.
Люди с синдромом Дауна, как правило, обладают некоторыми общими физическими особенностями. Это могут быть:
- Глаза, скошенные к внешнему углу
- Маленькие уши
- Плоские носы
- Выступающий язык
- Маленькие белые пятна в цветной части глаз
- Короткая шея
- Маленькие руки и ноги
- Низкий рост
- Свободные суставы
- Слабый мышечный тонус
Многие люди с синдромом Дауна не имеют других проблем со здоровьем, но у некоторых есть. Общие состояния включают проблемы с сердцем и проблемы со слухом и зрением.
Общие состояния включают проблемы с сердцем и проблемы со слухом и зрением.
Синдром Дауна Причины и факторы риска
У большинства людей каждая клетка тела имеет 23 пары хромосом. Одна хромосома в каждой паре принадлежит вашей матери, а другая — вашему отцу.
Но с синдромом Дауна что-то идет не так, и вы получаете дополнительную копию хромосомы 21. Это означает, что у вас есть три копии вместо двух, что приводит к симптомам синдрома Дауна. Врачи не знают, почему это происходит.Нет никакой связи ни с чем в окружающей среде, ни с чем, что родители делали или не делали.
Хотя врачи не знают, чем это вызвано, они знают, что у женщин 35 лет и старше больше шансов родить ребенка с синдромом Дауна. Если у вас уже был ребенок с синдромом Дауна, скорее всего, у вас будет еще один ребенок, у которого он есть.
Это нечасто, но возможно передать синдром Дауна от родителя к ребенку. Иногда у родителей есть то, что эксперты называют «перемещенными» генами.Это означает, что некоторые из их генов находятся не на своем нормальном месте, возможно, на другой хромосоме, чем обычно.
У родителей нет синдрома Дауна, потому что у них есть нужное количество генов, но у их ребенка может быть так называемый «транслокационный синдром Дауна». Не все с транслокационным синдромом Дауна передаются от родителей — это тоже может случиться случайно.
Типы синдрома Дауна
Существует три типа синдрома Дауна:
- Трисомия 21. Это, безусловно, наиболее распространенный тип, при котором каждая клетка тела имеет три копии хромосомы 21 вместо двух.
- Транслокационный синдром Дауна. В этом типе каждая клетка имеет часть дополнительной 21 хромосомы или полностью лишнюю хромосому. Но он прикреплен к другой хромосоме, а не сам по себе.
- Мозаичный синдром Дауна. Это самый редкий тип, при котором только некоторые клетки имеют дополнительную 21 хромосому.
Вы не можете определить, какой тип синдрома Дауна у человека, просто по внешнему виду.Эффекты всех трех типов очень похожи, но у человека с мозаичным синдромом Дауна может быть не так много симптомов, потому что меньше клеток имеет лишнюю хромосому.
Диагностика синдрома Дауна
Врач может заподозрить синдром Дауна у новорожденного на основании его внешнего вида. Это можно подтвердить с помощью анализа крови, называемого тестом кариотипа, который выстраивает хромосомы и показывает, есть ли лишняя 21 хромосома.
Скрининг на синдром Дауна при беременности
Стандартные тесты, проводимые во время беременности, могут проверить, вероятно ли, что у вашего ребенка Даун синдром.Если эти результаты положительны или вы подвержены высокому риску, вы можете выбрать дополнительные, более инвазивные тесты, чтобы быть уверенным.
В первом триместре у вас может быть:
- Анализы крови. Ваш врач измерит уровни белка, называемого PAPP-A, и гормона, называемого ХГЧ, в вашей крови. Все, что выходит за рамки нормы, может означать проблему с ребенком. Если у вас высокий риск развития синдрома Дауна, они также могут искать ДНК ребенка в вашей крови, которую они могут исследовать на предмет хромосомных аномалий.

- УЗИ. Ваш врач взглянет на фотографию вашего ребенка и измерит складки ткани на задней части его шеи. У младенцев с синдромом Дауна обычно бывает лишняя жидкость.
Во втором триместре у вас могут быть:
- Анализы крови. С помощью трех- или четырехскринного теста измеряются другие вещества в крови, включая белок АФП и гормон эстриол. Эти уровни в сочетании с результатами тестов в первом триместре дают вашему врачу хорошую оценку шансов, что у вашего ребенка синдром Дауна.
- УЗИ. Когда ваш ребенок более развит, ультразвуковое исследование может выявить некоторые физические признаки синдрома Дауна.
С помощью других тестов можно диагностировать синдром Дауна до рождения ребенка, проверяя образец его ДНК на наличие дополнительной хромосомы 21:
- Взятие образца ворсин хориона (CVS). Это можно сделать в течение первого триместра, используя клетки, взятые из плаценты.

- Амниоцентез. Жидкость берется из околоплодных вод, окружающих ребенка, обычно во втором триместре.
- Чрескожный забор пуповинной крови (PUBS). Это также делается во втором триместре с использованием крови, взятой из пуповины.
Лечение синдрома Дауна
Специального лечения синдрома Дауна не существует. Но существует широкий спектр методов физиотерапии и терапии развития, призванных помочь людям с синдромом Дауна полностью раскрыть свой потенциал. Чем раньше вы их запустите, тем лучше. У каждого ребенка будут разные потребности. Вам могут пригодиться:
- Физическая, профессиональная и логопедическая
- Услуги специального образования
- Социальные и развлекательные мероприятия
- Программы, которые предлагают профессиональную подготовку и обучают навыкам самообслуживания
Вы также будете тесно сотрудничать со своим детский врач для наблюдения и лечения любых проблем со здоровьем, связанных с этим заболеванием.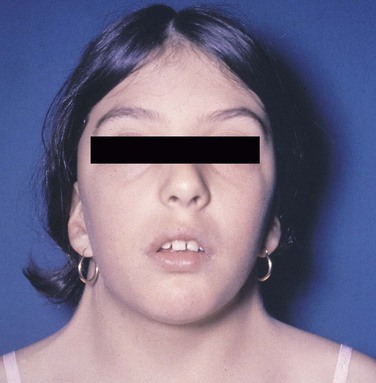
Осложнения при синдроме Дауна
Младенцы с синдромом Дауна могут родиться с другими физическими проблемами, и они подвергаются более высокому риску определенных проблем со здоровьем в дальнейшей жизни.
Возможные осложнения синдрома Дауна включают:
Тест на затылочную прозрачность (сканирование NT)
Что такое тест на затылочную прозрачность?
Тест на полупрозрачность затылочной кости (также называемый сканированием NT) использует ультразвук для оценки риска развития у вашего развивающегося ребенка синдрома Дауна (СД) и некоторых других хромосомных аномалий, а также серьезных врожденных проблем с сердцем.Он предлагается всем беременным женщинам вместе с анализом крови в комбинированных вариантах скрининга в первом триместре.
NT-сканирование измеряет прозрачное (полупрозрачное) пространство в тканях задней части шеи вашего ребенка. (Это «затылочная полупрозрачность».) Младенцы с аномалиями имеют тенденцию накапливать больше жидкости в задней части шеи в течение первого триместра, из-за чего это свободное пространство больше, чем в среднем.
NT-сканирование необходимо проводить на сроке от 11 до 14 недель беременности, потому что именно тогда основание шеи вашего ребенка еще прозрачно.(Последний день беременности — это день, когда вам исполняется 13 недель и 6 дней беременности.)
Некоторые врачи также обращают внимание на наличие носовой кости плода во время NT-сканирования. Некоторые эксперты считают, что если у развивающегося ребенка не наблюдается носовой кости, это увеличивает вероятность хромосомных аномалий. В некоторых очень специализированных центрах тестирования во время сканирования могут быть обнаружены другие серьезные отклонения.
Сканирование NT не инвазивно и не дает окончательных результатов. Для подтверждения положительного результата скрининга необходимы диагностические тесты, такие как CVS или амниоцентез.
В дополнение к тестированию на синдром Дауна (трисомия 21), сканирование NT также будет проверять:
- Трисомия 18 (синдром Эдварда)
- Трисомия 13 (синдром Патау)
- Некоторые другие хромосомные аномалии
- Некоторые структурные проблемы, такие как сердце, брюшная стенка и дефекты скелета
Если измерение затылочной прозрачности вашего ребенка показывает, что они подвержены повышенному риску структурных дефектов, вам будет проведено специальное ультразвуковое исследование (также называемое ультразвуком повышенного уровня или уровня II) и специальный тест, называемый эхокардиограммой плода, во втором триместре. Если у вашего ребенка структурный дефект, его нужно будет регулярно контролировать с помощью ультразвука и доставить в медицинский центр, оборудованный для лечения этого состояния.
Если у вашего ребенка структурный дефект, его нужно будет регулярно контролировать с помощью ультразвука и доставить в медицинский центр, оборудованный для лечения этого состояния.
Как проводится тест на затылочную прозрачность?
Сонограф сначала подтверждает гестационный возраст вашего ребенка, измеряя его от макушки до крупа, чтобы увидеть, соответствуют ли они размерам, которые должны быть для их возраста. Затем сонографист размещает датчик, называемый преобразователем, над вашим животом, чтобы на мониторе отображалась прозрачность шеи вашего ребенка, и измеряет ее толщину на экране штангенциркулем.
Как рассчитываются результаты сканирования NT?
Шансы вашего ребенка на хромосомную аномалию определяются измерением затылочной прозрачности, вашим возрастом, гестационным возрастом вашего ребенка и результатами анализа крови.
Ваш возраст учитывается, потому что, хотя любой может родить ребенка с хромосомной аномалией, риск увеличивается с возрастом. Например, ваша вероятность вынашивать ребенка с синдромом Дауна составляет примерно от 1 из 1200 в возрасте 25 лет до 1 из 100 в возрасте 40 лет.
Например, ваша вероятность вынашивать ребенка с синдромом Дауна составляет примерно от 1 из 1200 в возрасте 25 лет до 1 из 100 в возрасте 40 лет.
Поскольку полупрозрачность шеи ребенка обычно становится немного толще с каждым днем беременности, исследователи смогли установить, насколько большой должна быть полупрозрачная область каждый день в течение трех недель, когда может проводиться скрининг.
Они также вычислили статистическую взаимосвязь между этим измерением, возрастом ребенка, возрастом матери и вероятностью того, что ребенок родится с определенными отклонениями. В целом, чем толще затылочная прозрачность на определенном сроке беременности, тем выше вероятность хромосомной проблемы.
Вы можете получить результаты сразу же или вам, возможно, придется подождать до 10 дней, если врачу придется отправить данные в центр обработки.
Что означают результаты сканирования NT?
Вы захотите поговорить со своим практикующим или генетическим консультантом о том, как интерпретировать результаты, которые могут сбивать с толку.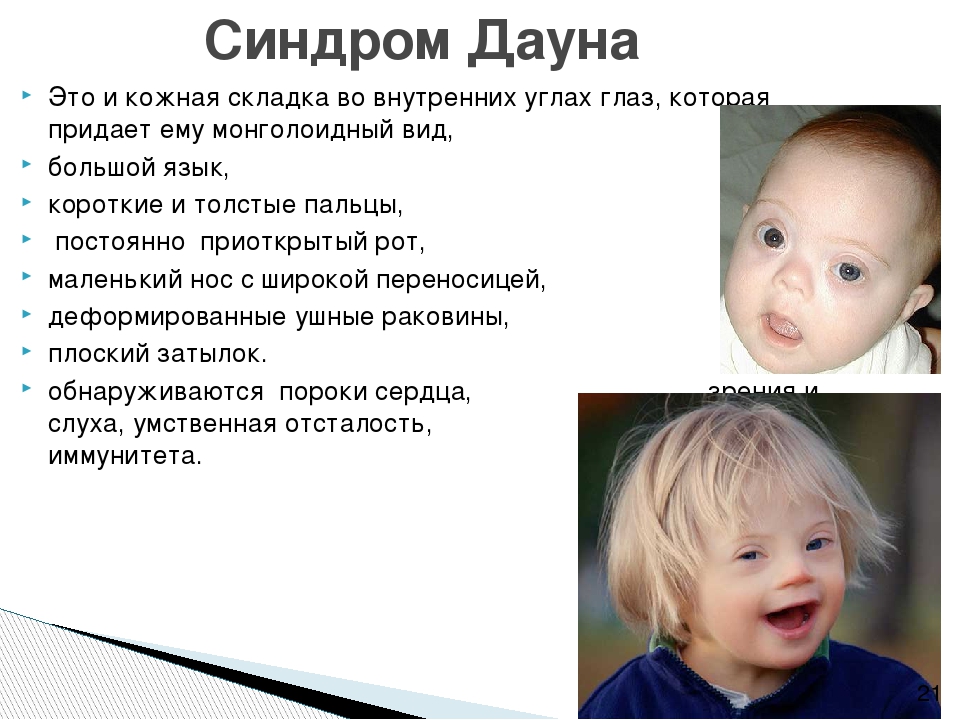 Многие центры сообщают каждый отдельный лабораторный результат, а также окончательный расчетный результат, используя специальную формулу.
Многие центры сообщают каждый отдельный лабораторный результат, а также окончательный расчетный результат, используя специальную формулу.
Соотношение
Вы получите свои результаты в виде отношения, которое выражает шансы вашего ребенка иметь хромосомный дефект.
Например, риск 1 из 100 означает, что на каждые 100 женщин с таким результатом один ребенок будет иметь синдром Дауна, а 99 — нет. Риск 1 из 1200 означает, что на каждые 1200 женщин с таким результатом один ребенок будет иметь его, а 1199 — нет. Чем выше второе число, тем меньше риск.
Нормальные или ненормальные результаты
Вам также могут сказать, что ваши результаты являются «нормальными» или «ненормальными» для определенного состояния, в зависимости от того, находится ли соотношение ниже или выше указанного порогового значения.Например, некоторые тесты используют порог 1 из 250. Таким образом, результат 1 из 1200 будет считаться нормальным, потому что риск возникновения проблемы ниже 1 из 250. Соотношение 1 из 100 будет считаться ненормальным, потому что это риск выше 1 из 250.
Соотношение 1 из 100 будет считаться ненормальным, потому что это риск выше 1 из 250.
Помните, что нормальный результат скрининга (отрицательный результат скрининга) не является гарантией того, что у вашего ребенка нормальные хромосомы, но он предполагает, что проблема маловероятна. Точно так же ненормальный результат скрининга (положительный результат скрининга) не означает, что у вашего ребенка хромосомная проблема — просто у вашего ребенка больше шансов иметь такую проблему.Оказывается, что у большинства детей с положительным результатом скрининга проблем не возникает: только около трети детей с повышенным уровнем затылочной прозрачности обнаруживают хромосомные дефекты.
Насколько точен тест на затылочную прозрачность?
Одно только сканирование NT обнаружит от 70 до 80 процентов младенцев с DS (в зависимости от того, какое исследование вы смотрите). Уровень обнаружения при сканировании NT и анализе крови в первом триместре колеблется от 79 до 90 процентов. (Большинство тестов будет включать как сканирование NT, так и анализ крови.)
(Большинство тестов будет включать как сканирование NT, так и анализ крови.)
Это означает, что , а не , означает, что у ребенка с положительным результатом скрининга вероятность наличия DS составляет от 79 до 90 процентов. Это просто означает, что от 79 до 90 процентов детей с СД будут иметь результаты скрининга, достаточно подозрительные, чтобы рекомендовать диагностическое тестирование. И от 5 до 21 процента детей, у которых есть СД, будут определены как относящиеся к группе нормального риска, то есть результаты будут вводить в заблуждение.
Ложноотрицательный результат
Скрининговые тесты не идеальны. Они не выявляют все случаи СД, поэтому могут идентифицировать вашего ребенка как относящегося к группе низкого риска, хотя у них действительно есть СД.
Другими словами, если вы вынашиваете ребенка с DS, вероятность того, что комбинированный скрининг обнаружит аномалию и даст вам так называемый положительный результат, указывает на то, что рекомендуется дальнейшее обследование, составляет от 79 до 90 процентов.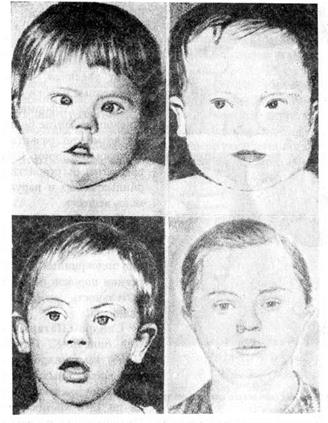 Но это также означает, что существует вероятность от 5 до 21 процента, что тесты пропустят DS и дадут вам отрицательный результат на экране.
Но это также означает, что существует вероятность от 5 до 21 процента, что тесты пропустят DS и дадут вам отрицательный результат на экране.
Это называется ложноотрицательным результатом и может побудить вас отказаться от диагностического тестирования, которое могло бы выявить проблему.
Ложноположительный результат
Эти тесты также дают 5% ложноположительных результатов. Ложноположительный результат — это результат, который предполагает, что у вашего ребенка повышенный риск СД или другого состояния, хотя на самом деле проблем нет.
Что произойдет, если при сканировании NT обнаружена проблема?
С помощью вашего терапевта или генетического консультанта вы захотите решить, указывают ли результаты на достаточно высокий риск того, что вы хотите пройти сердечно-сосудистую систему или амниоцентез для постановки окончательного диагноза.
Принимая решение, вам необходимо взвесить свою потребность в информации о состоянии вашего ребенка и небольшую вероятность того, что диагностическое обследование может вызвать выкидыш.
Если вы решите не проходить диагностическое обследование, вы можете получить больше информации о здоровье и развитии вашего ребенка, выполнив НИПТ (анализ крови, доступный для всех беременных женщин, начиная с 10 недели беременности), четырехкратный скрининг ( анализ крови во втором триместре) и подробное УЗИ в 18-20 недель.
С помощью этого ультразвукового исследования можно обнаружить «мягкие маркеры» хромосомных нарушений, такие как короткие конечности, яркая точка в сердце, светлый кишечник и определенные проблемы с почками. Он также может искать анатомические дефекты, такие как расщелина позвоночника.
Корреляция между затылочной прозрачностью и измерениями затылочных складок при синдроме Дауна и здоровых плодах — Мэймон — 2008 — Ультразвук в акушерстве и гинекологии
Введение
Избыток кожи в области шеи плода, характерный для людей с синдромом Дауна, может быть обнаружен с помощью ультразвука либо по увеличению затылочной прозрачности (NT) в первом триместре1, либо по увеличению затылочной складки (NF) во втором триместре2. Регулярное измерение толщины NT в сочетании с измерением в первом триместре материнской сыворотки крови плазменного протеина А (PAPP-A) и свободного β-хорионического гонадотропина человека (β-ХГЧ) является эффективным методом антенатального скрининга на синдром Дауна, но эффективность можно улучшить путем тестирования дополнительных маркеров во втором триместре3. Наиболее широко пропагандируемые стратегии последовательного скрининга этого типа основаны на сывороточных маркерах второго триместра, тестируемых на большинстве («поэтапно») или только у небольшой части («контингент») тех, кто прошел скрининг в первом триместре4.Однако на практике многие женщины также проходят последовательное ультразвуковое обследование с сканированием аномалий во втором триместре 5. Риск синдрома Дауна, оцененный по результатам их первого триместра, модифицируется отношением правдоподобия, полученным на основе результатов сканирования аномалий, которые включают толщину NF6. Этот расчет в значительной степени зависит от предположения, что маркеры первого триместра и результаты сканирования аномалий являются независимыми предикторами риска.
Регулярное измерение толщины NT в сочетании с измерением в первом триместре материнской сыворотки крови плазменного протеина А (PAPP-A) и свободного β-хорионического гонадотропина человека (β-ХГЧ) является эффективным методом антенатального скрининга на синдром Дауна, но эффективность можно улучшить путем тестирования дополнительных маркеров во втором триместре3. Наиболее широко пропагандируемые стратегии последовательного скрининга этого типа основаны на сывороточных маркерах второго триместра, тестируемых на большинстве («поэтапно») или только у небольшой части («контингент») тех, кто прошел скрининг в первом триместре4.Однако на практике многие женщины также проходят последовательное ультразвуковое обследование с сканированием аномалий во втором триместре 5. Риск синдрома Дауна, оцененный по результатам их первого триместра, модифицируется отношением правдоподобия, полученным на основе результатов сканирования аномалий, которые включают толщину NF6. Этот расчет в значительной степени зависит от предположения, что маркеры первого триместра и результаты сканирования аномалий являются независимыми предикторами риска. Тем не менее, несмотря на широко распространенную практику рутинного измерения NT и NF, очень мало известно о корреляции между этими двумя сонографическими маркерами.
Тем не менее, несмотря на широко распространенную практику рутинного измерения NT и NF, очень мало известно о корреляции между этими двумя сонографическими маркерами.
Salomon et al. 7 сообщили, что не было значительной связи между NT и NF среди 529 нормальных беременностей, но не дали коэффициента корреляции. Pandya et al. 8 опубликовали измерения NT и NF у шести плодов с синдромом Дауна, но не предоставили достаточной информации для оценки корреляции. Таким образом, это исследование было направлено на сбор серии, в которой коэффициенты корреляции для NT и NF можно было бы оценить как для синдрома Дауна, так и для здоровых плодов.
Методы
В период с октября 2005 г. по май 2007 г. последовательная серия женщин с нормальным плодом дважды проходила ультразвуковое исследование, выполненное одним оператором (R.M.). При первом посещении между 11 и 13 + 6 неделями беременности NT измеряли в соответствии с опубликованными критериями Фонда медицины плода1.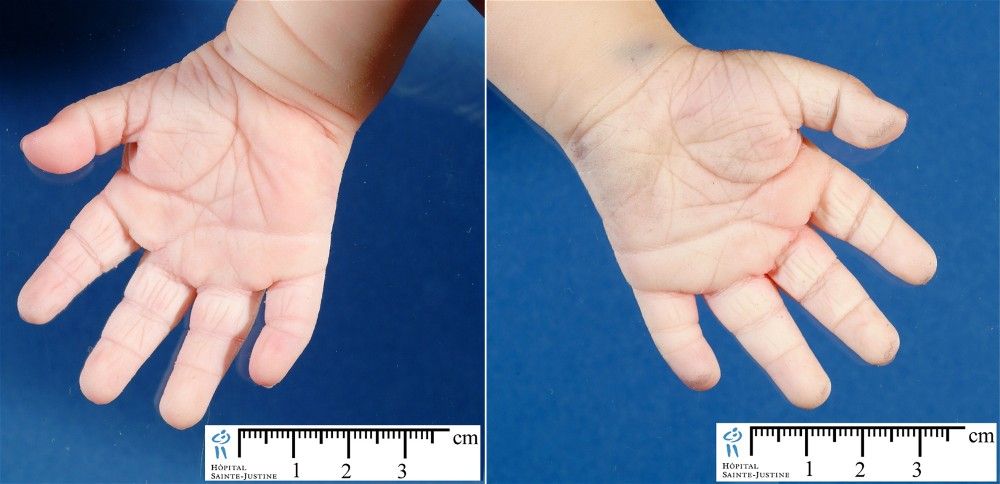 Во время второго визита NF определяли в соответствии с опубликованными критериями2, 9. В общей сложности 224 одноплодных беременности имели нормальную анатомию плода и адекватное количество околоплодных вод и соответствовали тем же критериям исключения, что и в нашем предыдущем исследовании10.Женщин регулярно сканировали для определения жизнеспособности и биометрии плода, а также для исключения аномалий плода. Информированное согласие было получено на оба ультразвуковых исследования.
Во время второго визита NF определяли в соответствии с опубликованными критериями2, 9. В общей сложности 224 одноплодных беременности имели нормальную анатомию плода и адекватное количество околоплодных вод и соответствовали тем же критериям исключения, что и в нашем предыдущем исследовании10.Женщин регулярно сканировали для определения жизнеспособности и биометрии плода, а также для исключения аномалий плода. Информированное согласие было получено на оба ультразвуковых исследования.
За тот же период 19 беременных женщин, которые ранее прошли NT сканирование и вынашивали плод с синдромом Дауна, были направлены в наше дородовое сонографическое отделение во втором триместре для прерывания беременности. Предыдущее изображение было использовано для проверки измерения NT R.M.с использованием опубликованных критериев 11. Все ультразвуковые изображения были признаны отличными (8–9 баллов) или приемлемыми (4–7 баллов) в соответствии с критериями Германа11. Пренатальный диагноз был поставлен с помощью амниоцентеза в 17 случаях и биопсии ворсин хориона в двух.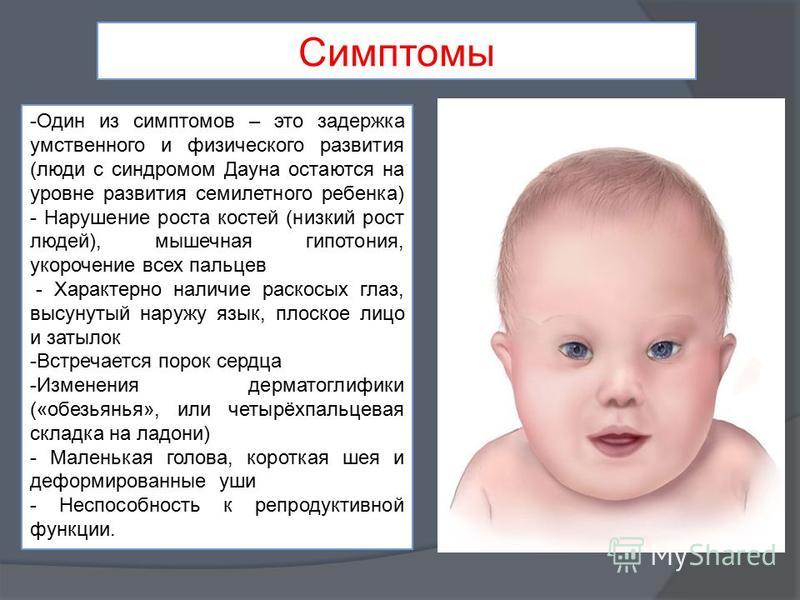 Показанием для процедуры было увеличение только NT в семи случаях и повышение риска на основе возраста и / или биохимических маркеров в остальных.
Показанием для процедуры было увеличение только NT в семи случаях и повышение риска на основе возраста и / или биохимических маркеров в остальных.
Непосредственно перед прерыванием каждая женщина была просканирована Р.М. для определения местоположения плаценты, жизнеспособности плода и биометрии, в том числе NF. Виды и измерения были записаны путем распечатки в виде термопечати. Для обработки данных были включены только удовлетворительные изображения. Ультразвуковое сканирование выполнялось с помощью различных ультразвуковых аппаратов от разных производителей, все из которых были оснащены трансвагинальным датчиком на 5–7,5 МГц с фокусным диапазоном 6 см от наконечника датчика и / или трансабдоминальным датчиком на 3,5–5 МГц.
Измерения как NT, так и NF были выражены как кратные гестационному медиане незатронутых беременностей (MoM) на основе регрессии.Чтобы вычислить нормальные медианы NF, серия была расширена, чтобы включить дополнительно 125 женщин, у которых были измерения NF только в течение периода исследования. Гестационный возраст рассчитывали на основании ультразвуковой биометрии плода. Зависящие от беременности медианы для NT и NF показаны на рисунке 1. Коэффициенты корреляции были рассчитаны на основе логарифмически преобразованных значений после исключения выбросов, превышающих 3 SD из медианы.
Гестационный возраст рассчитывали на основании ультразвуковой биометрии плода. Зависящие от беременности медианы для NT и NF показаны на рисунке 1. Коэффициенты корреляции были рассчитаны на основе логарифмически преобразованных значений после исключения выбросов, превышающих 3 SD из медианы.
Измерения медианы затылочной полупрозрачности (NT) (от 11 до 13 + 6 недель) и затылочной складки (NF) (от 14 до 28 недель) у здоровых беременностей для каждой завершенной гестационной недели (или в группах недель, когда данных недостаточно), показывающие количество беременностей для каждой точки данных.
Эффективность различных стратегий скрининга синдрома Дауна с использованием NT, PAPP-A и свободного β-hCG в сочетании с NF была оценена с помощью моделирования по Гауссу12. Параметрами модели были среднее значение и стандартное отклонение для каждого маркера, а также корреляция между маркерами при нормальной беременности и беременностях с синдромом Дауна. Опубликованные метааналитические оценки использовались для NT на 11 неделе и биохимических маркеров на 10 неделе13, а метаанализ NF14 был обновлен, чтобы включить текущую серию, за исключением того, что SD синдрома Дауна оценивался методом адаптации15.Использовалось гауссовское возрастное распределение матерей со средним значением 27 и стандартным отклонением 5,5 года16. Для каждой политики скрининга модель использовалась для прогнозирования частоты выявления, то есть доли беременностей с синдромом Дауна с риском выше порогового значения, для фиксированной частоты ложноположительных результатов, то есть доли незатронутых беременностей с высоким риском.
Опубликованные метааналитические оценки использовались для NT на 11 неделе и биохимических маркеров на 10 неделе13, а метаанализ NF14 был обновлен, чтобы включить текущую серию, за исключением того, что SD синдрома Дауна оценивался методом адаптации15.Использовалось гауссовское возрастное распределение матерей со средним значением 27 и стандартным отклонением 5,5 года16. Для каждой политики скрининга модель использовалась для прогнозирования частоты выявления, то есть доли беременностей с синдромом Дауна с риском выше порогового значения, для фиксированной частоты ложноположительных результатов, то есть доли незатронутых беременностей с высоким риском.
Результаты
В таблице 1 показаны параметры распределения NT и NF при синдроме Дауна и здоровых беременностях. Значения NF были статистически значимо выше среди пораженных беременностей по сравнению с незатронутыми беременностями со средним значением 1.538 мес ( P <0,0001, критерий суммы рангов Вилкоксона, двусторонний). Хотя эта разница в значениях NF между затронутыми и незатронутыми беременностями была меньше, чем разница в значениях NT (медиана MoM NT для пораженных беременностей, 1,844, P <0,0001), SD были ниже, и дискриминационная сила двух маркеров была аналогичной. . Это может быть измерено расстоянием Махаланобиса - разницей в логарифмических медианах, деленной на среднее стандартное отклонение, - которое составило около 2 для обоих маркеров.
Хотя эта разница в значениях NF между затронутыми и незатронутыми беременностями была меньше, чем разница в значениях NT (медиана MoM NT для пораженных беременностей, 1,844, P <0,0001), SD были ниже, и дискриминационная сила двух маркеров была аналогичной. . Это может быть измерено расстоянием Махаланобиса - разницей в логарифмических медианах, деленной на среднее стандартное отклонение, - которое составило около 2 для обоих маркеров.
| Параметр | Синдром Дауна | Без изменений |
|---|---|---|
| n | 19 | 224 |
| Прозрачность затылочной кости | ||
| GA (в неделях, медиана) | 12 + 3 | 12 + 3 |
| Медиана (м / м) | 1.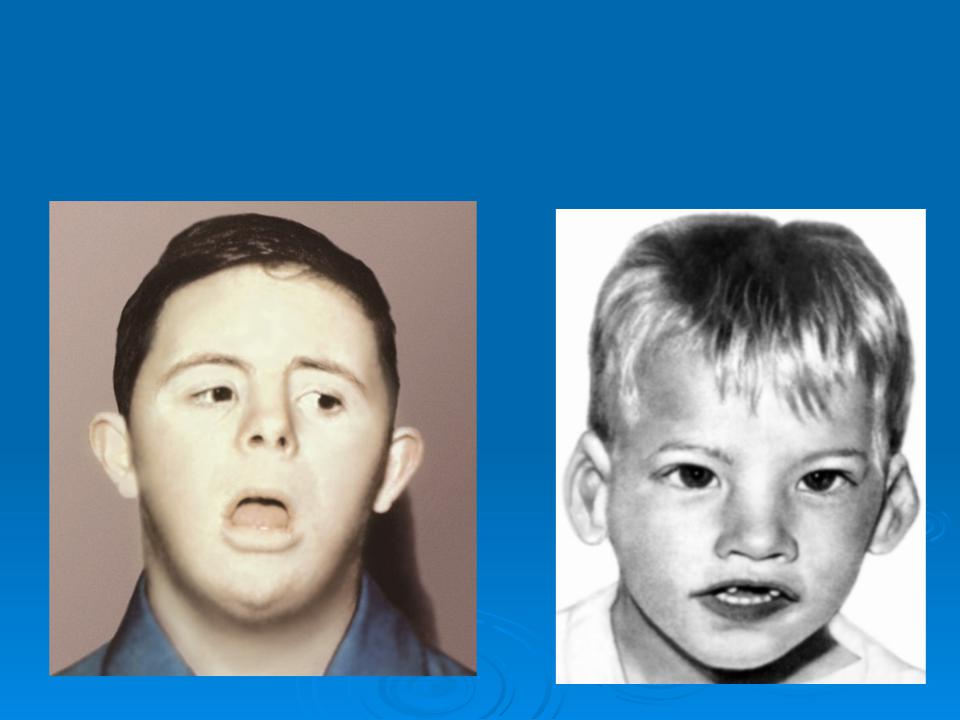 844 844 | 1,003 |
| журнал 10 SD | 0,160 | 0,124 |
| Затылочная складка | ||
| GA (в неделях, медиана) | 19 + 4 | 16 + 5 |
| Медиана (м / м) | 1.538 | 0,990 |
| журнал 10 SD | 0,100 | 0,084 |
| Корреляция NT – NF | 0,076 ( P = 0,76) | — 0. 021 ( P = 0,76) 021 ( P = 0,76) |
- Кратные медианы (MoM) были рассчитаны на основе регрессированных медиан гестационного возраста в днях (x): NT = 0,952662 — 0,0293347x + 0,000388307x 2 ; NF = — 2,57877 + 0,0588049x — 0,0000x 2 . GA, срок беременности.
Не было статистически значимой корреляции между NT и NF ни при синдроме Дауна ( r = 0.076, P = 0,76) или незатронутые ( r = — 0,021, P = 0,76) плоды (рисунок 2). Индивидуальные значения NT и NF у плодов с синдромом Дауна приведены в таблице 2. Для 10 случаев с NT <2 MoM среднее значение NF составило 1,65 MoM, что незначительно отличается от такового для девяти с NT> 2 MoM, медиана которых составила 1,51 мес ( P = 0,97, критерий суммы рангов Вилкоксона, двусторонний).
Связь между значениями затылочной полупрозрачности (NT) и затылочной складки (NF) при синдроме Дауна (a, n = 19) и незатронутых (b, n = 224) беременностях.
Таблица 2. Индивидуальные значения затылочной полупрозрачности (NT) и затылочной складки (NF) при 19 беременностях с синдромом Дауна| GA (недели) | NT (м / м) | GA (недели) | NF (м / м) |
|---|---|---|---|
| 11 + 3 | 2.016 | 19 + 4 | 1,348 |
| 11 + 5 | 1,295 | 20 + 1 | 1,279 |
| 12 + 1 | 1. 289 289 | 19 + 6 | 1,896 |
| 12 + 1 | 2,846 | 18 + 3 | 1,512 |
| 12 + 1 | 3.084 | 15 + 0 | 1,538 |
| 12 + 2 | 1,613 | 18 + 4 | 1,864 |
| 12 + 2 | 1.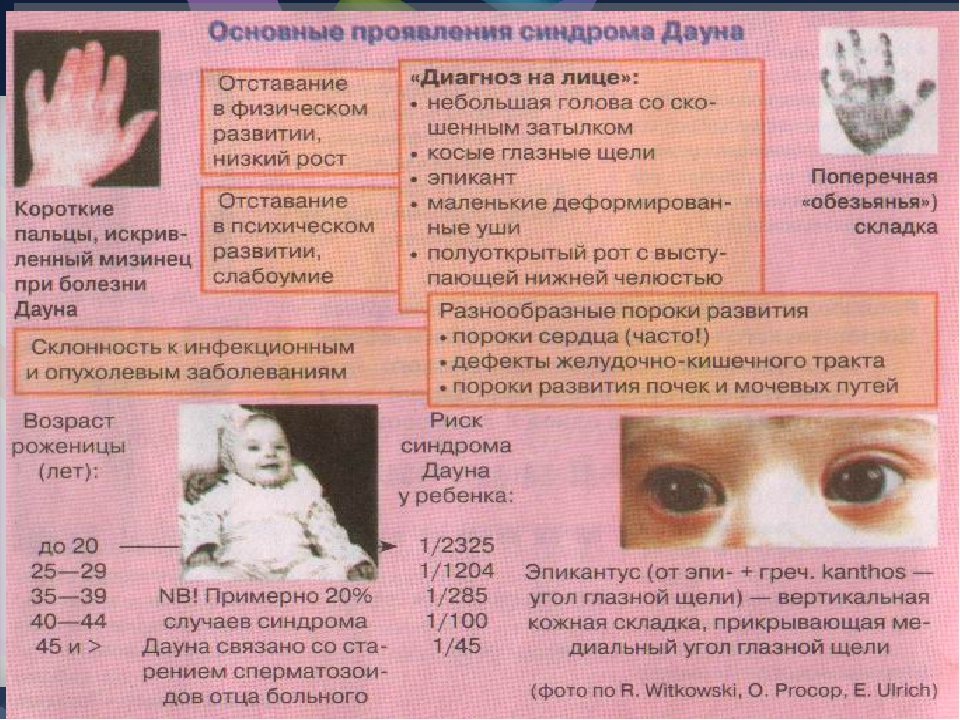 844 844 | 18 + 6 | 1,274 |
| 12 + 2 | 1,844 | 20 + 0 | 1,596 |
| 12 + 3 | 1.493 | 21 + 4 | 1.886 |
| 12 + 3 | 3,508 | 15 + 0 | 1,961 |
| 12 + 4 | 1.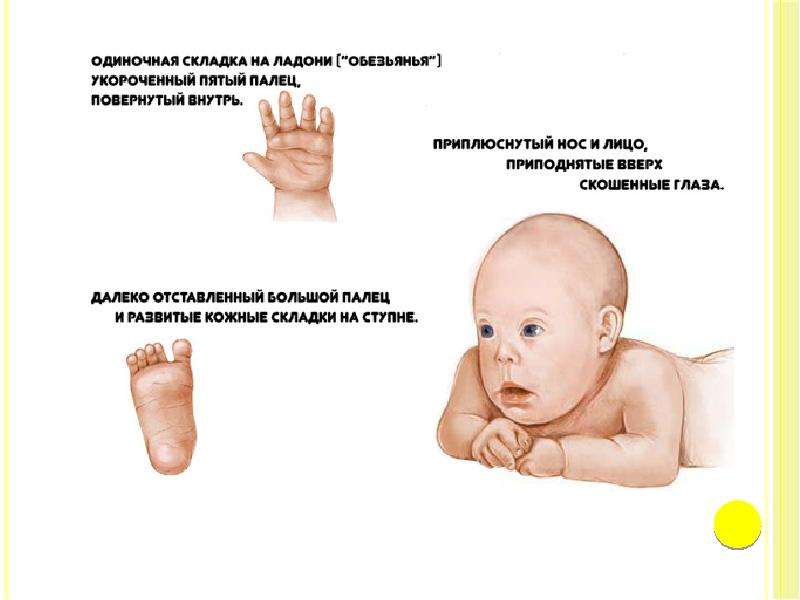 306 306 | 20 + 5 | 1,072 |
| 12 + 4 | 1,523 | 18 + 5 | 1.706 |
| 12 + 4 | 2.467 | 15 + 1 | 2,083 |
| 12 + 4 | 2,902 | 15 + 6 | 1,128 |
| 12 + 5 | 1. 199 199 | 21 + 2 | 1,125 |
| 12 + 5 | 2,257 | 21 + 5 | 1,614 |
| 12 + 6 | 2.195 | 20 + 0 | 1,390 |
| 13 + 0 | 1.201 | 20 + 0 | 2,034 |
| 13 + 4 | 2.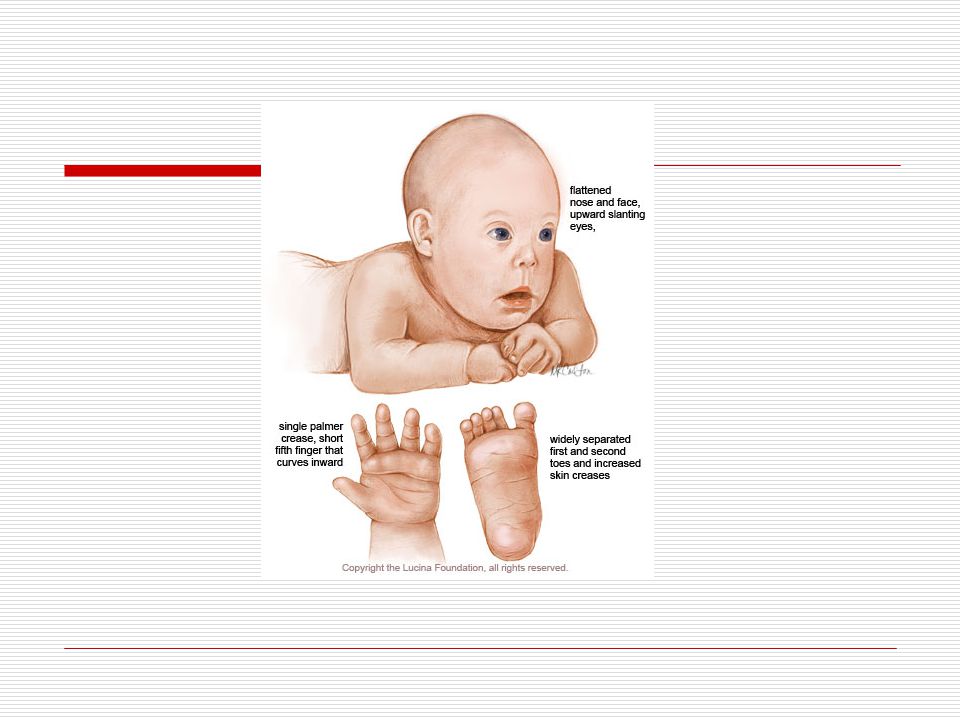 275 275 | 16 + 2 | 1,355 |
- GA — срок беременности; М / м, кратные медиане.
Гестационный возраст, при котором определялась НФ, в пораженных случаях в среднем был почти на 3 недели позже, чем в контрольной группе.Увеличенное время задержки между двумя тестами могло ослабить любую потенциальную корреляцию между NT и NF при пораженных беременностях. Однако не было доказательств связи между уровнями NF и временем задержки. Для 11 случаев, исследованных с интервалом менее 50 дней, среднее значение NF составило 1,54 мес, тогда как для восьми случаев с большим временем запаздывания оно составило 1,47 мес ( P = 0,35, критерий суммы рангов Вилкоксона, двусторонний).
Расширение опубликованного метаанализа параметров NF для включения текущих результатов дало средневзвешенное значение для 259 беременностей с синдромом Дауна из 1.46 мес. Средневзвешенная разница в дисперсии log 10 MoM между синдромом Дауна и протекающими беременностями составила 0,00583, поэтому адаптированное SD для синдрома Дауна в текущей серии составило 0,114 (квадратный корень из 0,084 2 + 0,00583).
В таблице 3 показаны результаты статистического моделирования при условии отсутствия корреляции между NF и маркерами первого триместра. Прогнозируется, что последовательные стратегии, основанные на добавлении измерения NF во втором триместре к NT, PAPP-A и свободному β-hCG в первом триместре, приведут к значительному увеличению частоты выявления.Регулярное измерение NF во всех беременностях в сочетании со скринингом в первом триместре вместо расчета риска только по результатам первого триместра («неразглашение») дало увеличение частоты выявления на 7–11% в зависимости от количества ложноположительных результатов. Поэтапный скрининг с пороговым значением 1 из 50 в первом триместре дал почти те же результаты, что и комбинированный стандартный скрининг на НФ и в первом триместре, и имел преимущество в 66% раннего выявления. Условный скрининг с НФ, ограниченный 11% женщин с пограничным риском в первом триместре в диапазоне 1 из 50–1500, привел к увеличению частоты выявления на 4–10% по сравнению с одним скринингом в первом триместре.Моделирование с наблюдаемыми коэффициентами корреляции NT – NF мало повлияло на прогнозируемую частоту: максимум на 1% увеличение скорости обнаружения для данной частоты ложных срабатываний.
Поэтапный скрининг с пороговым значением 1 из 50 в первом триместре дал почти те же результаты, что и комбинированный стандартный скрининг на НФ и в первом триместре, и имел преимущество в 66% раннего выявления. Условный скрининг с НФ, ограниченный 11% женщин с пограничным риском в первом триместре в диапазоне 1 из 50–1500, привел к увеличению частоты выявления на 4–10% по сравнению с одним скринингом в первом триместре.Моделирование с наблюдаемыми коэффициентами корреляции NT – NF мало повлияло на прогнозируемую частоту: максимум на 1% увеличение скорости обнаружения для данной частоты ложных срабатываний.
| Политика | Уровень обнаружения (%) для фиксированного количества ложных срабатываний: | Частота ложных срабатываний (%) для фиксированного уровня обнаружения: | ||||
|---|---|---|---|---|---|---|
| 1% | 3% | 5% | 75% | 85% | 95% | |
| NT, PAPP-A и свободный β-ХГЧ | 74 | 83 | 87 | 1. 2 2 | 3,8 | 18 |
| только NF | 45 | 58 | 65 | 10 | 22 | 52 |
| NT, PAPP-A, свободный β-ХГЧ и NF | 85 | 92 | 94 | 0.2 | 0,9 | 6,4 |
| Пошаговый NF * | 85 | 92 | 94 | 0,5 | 1.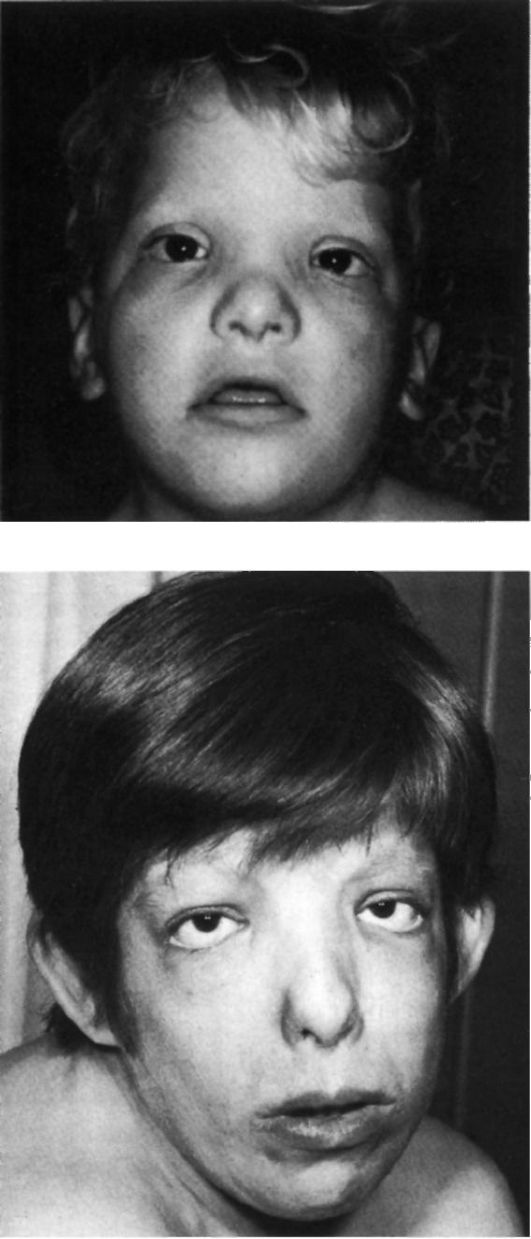 0 0 | 6,4 |
| Условный НФ † | 84 | 89 | 91 | 0,5 | 1,2 | 16 |
Обсуждение
Наше исследование показывает, что ультразвуковые измерения NT в первом триместре и во втором триместре NF являются независимыми детерминантами риска синдрома Дауна.Единственная другая опубликованная серия парных измерений NT и NF у плодов с синдромом Дауна включала шесть случаев, диагностированных пренатально из-за повышенного NT, родители которых решили продолжить беременность8. Измерения NT и NF были представлены в мм, и для каждого обследования была указана полная неделя беременности. Использование медиан для конкретных беременностей в нашем исследовании для расчета MoM и добавление результатов к нашим собственным дало коэффициент корреляции -0,10 ( P = 0,63). В то время как Salomon et al. 7 сообщили, что не было значимой связи между 529 нормальными беременностями, когда уровни были скорректированы с учетом гестации ( P = 0,52) без определения коэффициента корреляции, график разброса значений был похож на наш собственный (Рисунок 2).
Измерения NT и NF были представлены в мм, и для каждого обследования была указана полная неделя беременности. Использование медиан для конкретных беременностей в нашем исследовании для расчета MoM и добавление результатов к нашим собственным дало коэффициент корреляции -0,10 ( P = 0,63). В то время как Salomon et al. 7 сообщили, что не было значимой связи между 529 нормальными беременностями, когда уровни были скорректированы с учетом гестации ( P = 0,52) без определения коэффициента корреляции, график разброса значений был похож на наш собственный (Рисунок 2).
Поскольку представленные здесь результаты были основаны в основном на относительно небольшой серии затронутых беременностей, необходимо рассмотреть возможность систематической ошибки отбора. Случаи с синдромом Дауна обязательно были выборочными из-за характера нашего подразделения как справочного центра.Тем не менее, мы полагаем, что эти беременности являются репрезентативными для синдрома Дауна в зоне охвата. В нашем центре прерывание беременности проводится путем дилатации и эвакуации (D&E) до гестации 22 недели17, поэтому большинство женщин с положительными результатами скрининга в первом триместре предпочитают подождать несколько недель для получения дополнительной информации, прежде чем рассматривать инвазивную пренатальную диагностику. . Поскольку у значительной части женщин с беременностью с синдромом Дауна в первом триместре будут положительные результаты, у нас была возможность получить биометрию плода в середине беременности, включая результаты NF, на беспристрастной серии.
В нашем центре прерывание беременности проводится путем дилатации и эвакуации (D&E) до гестации 22 недели17, поэтому большинство женщин с положительными результатами скрининга в первом триместре предпочитают подождать несколько недель для получения дополнительной информации, прежде чем рассматривать инвазивную пренатальную диагностику. . Поскольку у значительной части женщин с беременностью с синдромом Дауна в первом триместре будут положительные результаты, у нас была возможность получить биометрию плода в середине беременности, включая результаты NF, на беспристрастной серии.
Еще одним ограничением исследования было то, что кариотип синдрома Дауна был известен во время сканирования NF. Это могло повлиять на результаты НФ. Однако средний уровень NF (1,538 мес.) Близок к среднему значению из всех ранее опубликованных рядов вместе взятых (1,46 мес.). Кроме того, оператор не был слепым к результату NT, но это вряд ли повлияло на результаты, поскольку смещение искусственно создало бы положительную корреляцию, и ничего не было обнаружено. Плоды с синдромом Дауна в этой серии были от беременностей, направленных на прерывание беременности во втором триместре. Некоторым пациентам с чрезвычайно высокими значениями NT или даже генерализованным отеком, вероятно, было предложено прерывание беременности на более ранних сроках, и они не были бы направлены. Возможно, что у этих плодов также были бы чрезвычайно высокие значения NF, но такие беременности, как правило, не являются кандидатами для сканирования NF во втором триместре. Таким образом, тот факт, что мы не включили такие случаи, не окажет практического влияния на наши прогнозы относительно уровней выявления различных политик последовательного скрининга.То же самое можно сказать и о плодах с синдромом Дауна, у которых произошел выкидыш в период между NT-сканированием и запланированной датой амниоцентеза.
Плоды с синдромом Дауна в этой серии были от беременностей, направленных на прерывание беременности во втором триместре. Некоторым пациентам с чрезвычайно высокими значениями NT или даже генерализованным отеком, вероятно, было предложено прерывание беременности на более ранних сроках, и они не были бы направлены. Возможно, что у этих плодов также были бы чрезвычайно высокие значения NF, но такие беременности, как правило, не являются кандидатами для сканирования NF во втором триместре. Таким образом, тот факт, что мы не включили такие случаи, не окажет практического влияния на наши прогнозы относительно уровней выявления различных политик последовательного скрининга.То же самое можно сказать и о плодах с синдромом Дауна, у которых произошел выкидыш в период между NT-сканированием и запланированной датой амниоцентеза.
Тот факт, что не было корреляции между NT и NF, означает, что механизм, лежащий в основе этих повышенных значений при беременностях с синдромом Дауна, отличается для этих двух маркеров. Большинство беременностей с синдромом Дауна, а также беременностей с другими типами анеуплоидии имеют уровни NT выше 95 -го центиля здоровых беременностей1, 18, 19.Ультрасонографические и патологоанатомические морфологические исследования предполагают три основные причины увеличения толщины NT у анеуплоидных или эуплоидных плодов: (1) сердечная недостаточность; (2) различные типы аномалий, обнаруженные во внеклеточном матриксе затылочной кожи; (3) аномальное лимфатическое развитие 20. Между 10 и 14 неделями беременности, когда лимфатическая система плода развивается и периферическое сопротивление плаценты высокое, существует короткая возможность обнаружить скопление жидкости. Через 14 недель лимфатическая система, вероятно, достаточно развита, чтобы отводить лишнюю жидкость, а изменения плацентарного кровообращения приведут к падению периферического сопротивления.Таким образом, по прошествии этого времени многие аномалии, вызывающие накопление жидкости, могут, по-видимому, исправить себя и, таким образом, могут остаться незамеченными при измерении NT21.
Большинство беременностей с синдромом Дауна, а также беременностей с другими типами анеуплоидии имеют уровни NT выше 95 -го центиля здоровых беременностей1, 18, 19.Ультрасонографические и патологоанатомические морфологические исследования предполагают три основные причины увеличения толщины NT у анеуплоидных или эуплоидных плодов: (1) сердечная недостаточность; (2) различные типы аномалий, обнаруженные во внеклеточном матриксе затылочной кожи; (3) аномальное лимфатическое развитие 20. Между 10 и 14 неделями беременности, когда лимфатическая система плода развивается и периферическое сопротивление плаценты высокое, существует короткая возможность обнаружить скопление жидкости. Через 14 недель лимфатическая система, вероятно, достаточно развита, чтобы отводить лишнюю жидкость, а изменения плацентарного кровообращения приведут к падению периферического сопротивления.Таким образом, по прошествии этого времени многие аномалии, вызывающие накопление жидкости, могут, по-видимому, исправить себя и, таким образом, могут остаться незамеченными при измерении NT21.
В середине беременности около одной трети плодов с синдромом Дауна имеют толщину NF> 6 мм9, но патофизиологические и анатомические исследования плодов с повышенным NF были менее информативными, чем исследования плодов с повышенным NT. В одном исследовании 11% плодов с увеличенным NF или кистозной гигромой без перегородки имели дополнительные структурные аномалии, в основном сердечно-сосудистые22.Джонсон и др. 23 предположил, что отек затылочной кости в первом триместре и утолщение затылочной кожи в середине беременности являются частью континуума, приводящего к образованию перепонок на шее у людей с синдромом Дауна. Однако, хотя оба пренатальных признака могут сохраняться на протяжении всей беременности, у некоторых плодов с синдромом Дауна было зарегистрировано спонтанное разрешение NT8 и NF24. Наше собственное предположение состоит в том, что, хотя перепончатая шея является признаком синдрома Дауна, NT и NF во многих случаях могут представлять различную основную этиологию как у нормальных, так и у плодов с синдромом Дауна.
Практическое значение наших результатов состоит в том, что последовательный скрининг между триместрами с использованием измерения NT с сывороточными маркерами или без них с последующим измерением NF может быть упрощен. Поскольку нет корреляции между NT и NF и нет связи между маркерами сыворотки в первом триместре и NF, расчет риска прост. Риск, основанный на скрининге первого триместра (1 из n ), выраженный как вероятность (1: ( n — 1)), можно умножить на отношение правдоподобия (LR) из результата NF, чтобы получить окончательный результат. шансы (LR: ( n — 1)) или риск (1 в ( n — 1) / LR + 1).LR для отдельного NF-MoM выводится из модели Гаусса: 0,74e y , y = 32,39x 2 + 12,62x — 1,03 и x = log 10 MoM. Например, если NF составляет 1,5 мМ, x = 0,176, y = 2,194 и LR = 6,6. Таким образом, если риск, основанный на скрининге в первом триместре, составляет 1 из 562 или 1: 561, окончательная вероятность будет 1: 85 (6,6: 561), риск — 1 из 86.
В этой статье мы рассмотрели влияние различных стратегий скрининга синдрома Дауна, включающих измерение NF.Однако во многих регионах ультразвуковое исследование аномалий является рутинным на сроке беременности 18–20 недель, и в этих обстоятельствах увеличенная толщина НФ, скажем, более 6 мм, часто рассматривается сама по себе как фактор риска анеуплоидии6. Использование наших результатов и применение вышеуказанной формулы к возрастному риску или риску, полученному в результате скрининга, обеспечит лучшую интерпретацию результатов сонографии.
Список литературы
- 1Snijders RJM, Noble PL, Sebire NJ, Souka A, Nicolaides KH.Многоцентровый проект в Великобритании по оценке риска трисомии 21 в зависимости от возраста матери и толщины воротниковой зоны на 10–14 неделе беременности. Lancet 1998; 352: 343–346.

- 2Benacerraf BR, Gelman R, Frigoletto FD Jr. Сонографическая идентификация плодов во втором триместре с синдромом Дауна. N Engl J Med 1987; 317: 1371–1376.
- 3 Американский колледж акушеров и гинекологов.Скрининг на хромосомные аномалии плода. Бюллетень практики ACOG № 77. Obstet Gynecol 2007; 109: 217–227.
- 4Cuckle H, Benn P, Wright D. Скрининг синдрома Дауна в первом и / или втором триместре: модель прогнозировала производительность с использованием параметров метаанализа. Семин Перинатол 2005; 29: 252– 257.
- 5Rozenberg P, Bussivres L, Chevret S, Bernard JP, Malagrida L, Cuckle H, Chabry C, Durand-Zaleski I, Bidat L, Lacroix I, Moulis M, Roger M, Jacquemot MC, Bault JP, Boukobza P, Boccara P , Vialat F, Giudicelli Y, Ville Y.
 Скрининг на синдром Дауна с использованием комбинированного скрининга в первом триместре с последующим вторым ультразвуковым обследованием в неотобранной популяции. Am J Obstet Gynecol 2006; 195: 1379–1387.
Скрининг на синдром Дауна с использованием комбинированного скрининга в первом триместре с последующим вторым ультразвуковым обследованием в неотобранной популяции. Am J Obstet Gynecol 2006; 195: 1379–1387. - 6Nicolaides KH. Сканирование 11–13 + 6 недель. Фонд медицины плода: Лондон, 2004 г.
- 7Саломон Л.Дж., Бернар Дж. П., Топин П., Бенар С., Вилле Ю.Связь между NT на 11–14 неделе и затылочной складкой на 20–24 неделе беременности. Ультразвуковой акушерский гинеколь 2001; 18: 636–637.
- 8Pandya PP, Snijders RJM, Johnson S, Nicolaides KH. Естественная история трисомии 21 плода с увеличенной толщиной затылочной кости. Ультразвуковой акушерский гинеколь 1995; 5: 381–383.

- 9Benacerraf BR, Frigoletto FD Jr.Затылочная складка мягких тканей у плода во втором триместре: стандарты нормальных измерений по сравнению с таковыми при синдроме Дауна. Am J Obstet Gynecol 1987; 157: 1146–1149.
- 10Товбин Дж., Маймон Р., Товбин Л., Дризен Э., Буковский И., Герман А. Пренатальные возрастные контрольные интервалы для измерения всех пяти пальцев руки плода. Ультразвуковой акушерский гинеколь 2002; 19: 583– 587.
- 11Herman A, Maymon R, Dreazen E, Caspi E, Bukovsky I, Weinraub Z.Аудит затылочной прозрачности: новый метод оценки изображений. Ультразвуковой акушерский гинеколь 1998; 12: 398–403.
- 12Ройстон П.
 , Томпсон С.Г. Модельный скрининг по риску применительно к синдрому Дауна. Stat Med 1992; 11: 257– 268.
, Томпсон С.Г. Модельный скрининг по риску применительно к синдрому Дауна. Stat Med 1992; 11: 257– 268. - 13Cuckle HS, Мэлоун Ф.Д., Райт Д., Каник Дж. А., Портер Т.Ф., Ниберг Д.А., Комсток СН, Сааде Г.Р., Берковиц Р.Л., Феррейра Дж.С., Дугофф Л., Крейго С.Д., Тимор И.Е., Карр С.Р., Вулф Х.М., Д’Алтон Массачусетс для Консорциума исследований FaSTER.Условный скрининг на синдром Дауна — результат исследования FaSTER. Prenat Diagn 2008; 28: 89–94.
- 14Borrell A, Mercade I, Casals E, Borobio V, Seres A, Soler A, Fortuny A, Cuckle H. Сочетание толщины затылочной складки плода с биохимией второго триместра для скрининга трисомии 21. Ultrasound Obstet Gynecol 2007; 30: 941–945.
- 15Цабл HS.
 Улучшены параметры оценки риска при скрининге синдрома Дауна. Prenat Diagn 1995; 15: 1057– 1065.
Улучшены параметры оценки риска при скрининге синдрома Дауна. Prenat Diagn 1995; 15: 1057– 1065. - 16Cuckle H, Aitken D, Spencer K, Senior B, Standing S, Goodburn S. Стандартизация по возрасту для мониторинга показателей в программах скрининга синдрома Дауна. Prenat Diagn 2004; 24: 851–856.
- 17Шнайдер Д., Гальперин Р., Лангер Р., Каспи Э., Буковский И.Аборт в возрасте 18–22 недель путем дилатации и опорожнения ламинарии. Obstet Gynecol 1996; 88: 412–414.
- 18Souka AP, Krampl E, Bakalis S, Heath V, Nicolaides KH. Исход беременности у хромосомно нормальных плодов с повышенной затылочной прозрачностью в первом триместре. Ультразвуковой акушерский гинеколь 2001; 18: 9–17.

- 19Hyett JA.Повышенная прозрачность воротниковой зоны у плодов с нормальным кариотипом. Prenat Diagn 2002; 22: 864–868.
- 20Haak MC, van Vugt JMG. Патофизиология повышенной затылочной прозрачности: обзор литературы. Обновление Hum Reprod 2003; 9: 175– 184.
- 21Бергер А. Что такое полупрозрачность затылочной кости плода? BMJ 1999; 318: 81.
- 22Циммер Э.З., Друган А., Офир С., Блейзер С., Бронштейн М. Ультразвуковая визуализация аномалий шеи плода: последствия для риска анеуплоидии и структурных аномалий. Prenat Diagn 1997; 17: 1055– 1058.
- 23Johnson MP, Johnson A, Holzgreve W.
 , Isada NB, Wapner RJ, Treadwell MC, Heeger S, Evans MI. Простая гигрома первого триместра: причина и исход. Am J Obstet Gynecol 1993; 168: 156–161.
, Isada NB, Wapner RJ, Treadwell MC, Heeger S, Evans MI. Простая гигрома первого триместра: причина и исход. Am J Obstet Gynecol 1993; 168: 156–161. - 24Bromley B, Benacerraf BR. Разрешение затылочной складки у плода во втором триместре: не обязательно обнадеживает. J Ultrasound Med 1995; 14: 253–255.
Хромосомных аномалий: трисомия 21 (синдром Дауна) | NCBDDD
Основные результаты трисомии 21 (см.рис.52):
Физические признаки — включают наклонные глазные щели, плоскую переносицу и среднюю часть лица, снижение мышечного тонуса (гипотония), более широкое пространство между первым и вторым пальцами стопы («сандаловая щель»), нистагм, брахицефалия, изгиб пятого пальца (клинодактилия). ), узкое небо, перевернутая спираль уха (особенно с маленьким ухом), короткая шея с избыточной кожей на задней части шеи, широкие и короткие руки и ноги и единственная поперечная складка на ладони.
Аномальный кариотип — примерно 95% случаев являются результатом хромосомного нерасхождения 21-й хромосомы (47, XX, + 21 или 47, XY, + 21) при зачатии.Транслокационная трисомия 21 (2% случаев) часто является семейной и обычно затрагивает хромосомы 14 и 21. Мозаицизм встречается примерно в 2% случаев (постзиготическая неразрывность или, реже, в результате трисомического спасения). В 1% случаев дополнительный материал 21 хромосомы возникает в результате других перестроек.
Диагностика
Пренатальный. Трисомия 21 может быть диагностирована путем прямого анализа хромосом плода, кариотипа или микроматрицы ДНК, полученной при амниоцентезе, пробе ворсин хориона или чрескожном заборе пробы пуповинной крови.Используйте стандартные операционные процедуры, чтобы решить, принимать ли пренатальный диагноз без послеродового подтверждения (например, в случаях прерывания беременности или неисследованной гибели плода).
Послеродовой. Трисомию 21 можно строго заподозрить или диагностировать клинически в неонатальном периоде, распознавая типичные физические черты. Клинический диагноз должен быть подтвержден генетическим тестированием (обычно кариотипом крови или ткани младенца).
Трисомию 21 можно строго заподозрить или диагностировать клинически в неонатальном периоде, распознавая типичные физические черты. Клинический диагноз должен быть подтвержден генетическим тестированием (обычно кариотипом крови или ткани младенца).
Клинико-эпидемиологические заметки
Основные пороки развития, связанные с синдромом Дауна, включают, среди прочего:
- пороки сердца (примерно в 50% случаев, особенно дефекты эндокардиальной подушки)
- Атрезии желудочно-кишечного тракта (атрезия двенадцатиперстной кишки или пищевода)
- позвоночных аномалий.
Младенцы с синдромом Дауна могут иметь множество других проблем со здоровьем и развитием, например:
- гипотиреоз
- Проблемы со зрением и слухом (например, катаракта)
- умственная отсталость различной степени.
Дополнительные клинические советы:
- Для диагностики рассмотрите физические черты, имеющие наибольшую диагностическую ценность.

- Кариотип необходим для консультирования и оценки риска рецидива (риск будущих беременностей).
- Ищите сопутствующие аномалии, в частности, определенные подтипы пороков сердца, такие как атриовентрикулярный канал.
Нейровизуализационная оценка при синдроме Дауна: иллюстрированный обзор | Insights into Imaging
Синдром Моямоя
Синдром Моямоя — редкая артериопатия, характеризующаяся прогрессирующим стенозом верхушек внутричерепных внутренних сонных артерий (ВСА), а также проксимальных отделов передней и средней церебральных артерий. В ответ на это уменьшение артериального кровотока в мозг обычно развивается сеть коллатеральных сосудов.На церебральной ангиографии эти коллатеральные сосуды выглядят как «клубы дыма», что в переводе с японского означает «моямоя», отсюда и название этого синдрома [44].
Ангиографические аномалии, видимые на портрете моямоя, являются последним путем, общим для различных врожденных и приобретенных заболеваний. Таким образом, термин «синдром моямоя» вместо «болезнь моямоя» применяется всякий раз, когда у пациента имеется хорошо известное исходное состояние, такое как СД. Что касается синдрома моямоя, почти 4% страдают СД, из них около 10% моложе 15 лет [45].Синдром Моямоя также наблюдается в связи с нейрофиброматозом 1 типа, серповидно-клеточной анемией, а также аутоиммунными заболеваниями и предшествующей лучевой терапией в области головы и шеи [44].
Таким образом, термин «синдром моямоя» вместо «болезнь моямоя» применяется всякий раз, когда у пациента имеется хорошо известное исходное состояние, такое как СД. Что касается синдрома моямоя, почти 4% страдают СД, из них около 10% моложе 15 лет [45].Синдром Моямоя также наблюдается в связи с нейрофиброматозом 1 типа, серповидно-клеточной анемией, а также аутоиммунными заболеваниями и предшествующей лучевой терапией в области головы и шеи [44].
Пациенты с болезнью или синдромом моямоя могут иметь признаки и симптомы, возникающие в результате ишемических повреждений, недостаточного кровоснабжения и / или геморрагических осложнений из-за хрупких коллатеральных сосудов. Сообщается, что у большинства взрослых и детей есть ишемические повреждения, хотя частота кровотечений примерно в семь раз выше у взрослых пациентов (20% против 3%) [44].У детей с моейямойей геморрагические проявления возникают крайне редко; у них обычно возникают преходящие ишемические атаки, острые ишемические инсульты (68%) [46], а также головные боли [44].
Визуализирующая оценка пациента с подозрением на синдром моямоя включает КТ и / или МРТ головного мозга с ангиографией и, в отдельных случаях, также цифровую вычитающую ангиографию (DSA). На КТ можно выявить гиподензивные области, соответствующие ишемическим инсультам, которые чаще встречаются на территориях водоразделов, глубоком сером и белом веществе и перивентрикулярных зонах [44].КТ головного мозга также может легко отобразить острые кровотечения из аномальных коллатералей; основными местами кровотечения являются таламусы, базальные ганглии, желудочковая система и медиальная височная область. На МРТ обычно лучше идентифицируются острые и / или старые ишемические или геморрагические инсульты (рис. 16). Еще одна типичная особенность изображения, которую можно увидеть на МРТ в случаях мойямоя, — это так называемый признак плюща . Он представлен линейными или криволинейными участками лептоменингеальной гиперинтенсивности в последовательностях восстановления с инверсией, ослабленной жидкостью (FLAIR) (рис. 17), что, вероятно, связано с медленным током в лептоменингеальных коллатералях. Лентикулостриатные коллатерали также можно увидеть в обычных МР-последовательностях у пациентов с мойямойей в виде многочисленных небольших сетчатых пустот в сильвиевых трещинах, таламусе и базальных ганглиях, особенно на DP / T2 (Рис. 16).
17), что, вероятно, связано с медленным током в лептоменингеальных коллатералях. Лентикулостриатные коллатерали также можно увидеть в обычных МР-последовательностях у пациентов с мойямойей в виде многочисленных небольших сетчатых пустот в сильвиевых трещинах, таламусе и базальных ганглиях, особенно на DP / T2 (Рис. 16).
Осевой T2 * ( a ) и T2 / TSE ( b ) 46-летнего пациента с синдромом Дауна с признаками старого геморрагического инсульта с поражением левой таламо-капсульной области .Обратите внимание на заметные пустоты для потока из коллатеральных сосудов, вовлекающие базальные цистерны и горизонтальные сегменты сильвиевых трещин. Эти особенности предполагают ассоциированный синдром моямоя, который был подтвержден в ангиографических исследованиях (не показаны). в области отсутствия нормального подавления FLAIR CSF в кортикальных бороздах. Этот признак, вероятно, свидетельствует о медленном кровотоке в лептоменингеальных коллатералях. Обследование проводилось без общей анестезии.
Обследование проводилось без общей анестезии.
Ангиографические исследования, включая КТ-ангиографию (КТА) и МР-ангиографию (МРА) (рис. 18), демонстрируют типичные особенности этого состояния, а именно сужение / окклюзию ВСА, среднего и переднего церебрального отдела. артерии, а также аномальные коллатеральные сосуды, описанные ранее. Церебральный DSA по-прежнему является золотым стандартом диагностики, а также ценным для характеристики анатомии и потока сосудов, вовлеченных в процесс (рис.19) [44], и это выполняется специально, когда рассматривается хирургическое лечение.
Рис. 18Трехмерная реконструкция МРТ-ангиографии (метод времени пролета) 46-летнего пациента с синдромом Дауна, иллюстрирующая окклюзию левой внутренней сонной артерии (ВСА) и стеноз супраклиноидного сегмента правой ВСА, а также субокклюзии правой передней мозговой артерии (ПМА). Левая ПМА и средняя мозговая артерия не изображены. Также вокруг базальных цистерн имеется множество тонких аномальных коллатеральных сосудов; эти данные совместимы с синдромом моямоя, который, как известно, очень часто встречается в этой популяции
Рис. 19
19 Церебральная ангиография у 46-летнего пациента с синдромом Дауна с паттерном моямоя. a Вид спереди, инъекция в правую внутреннюю сонную артерию, демонстрирующая окклюзию правой передней мозговой артерии с сетью коллатеральных сосудов (сосудов моямоя) в надселлярной цистерне с восстановлением артериального кровотока передней мозговой артерии дистально. b Вид сбоку, инъекция левой внутренней сонной артерии, демонстрирующая сильное сужение этой артерии, которая заканчивается на кавернозном сегменте, где артериальный поток расходится к менингогипофизарному стволу с анастомозом с глазной артерией и дуральными ветвями средней менингеальной артерии, формирование сети коллатеральных капилляров, типичных для синдрома моямоя
МРТ-исследования перфузии в моямоя, включая исследования цереброваскулярной реактивности и гемодинамического резерва на основе МРТ, находятся в стадии интенсивных исследований и могут сыграть центральную роль в будущей клинической оценке и ведении этих пациентов [ 47,48,49,50,51,52].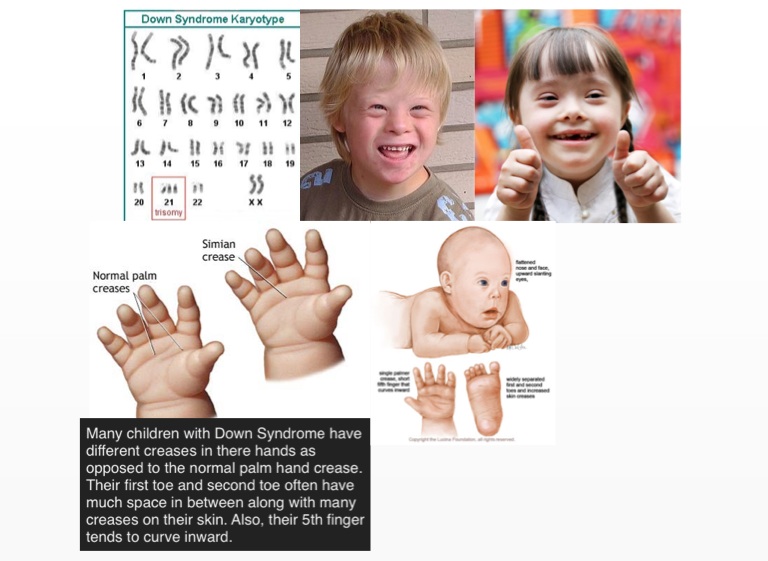
Что касается протоколов скрининга на синдром моямоя у пациентов с СД и другими предрасполагающими заболеваниями, данные класса I, подтверждающие эту практику, отсутствуют. Однако в частном случае пациентов с СД, что довольно часто встречается в педиатрической практике, есть некоторые данные класса III, подтверждающие проспективный неинвазивный скрининг на синдром моямоя [44]. Тем не менее, особое внимание следует уделять стандартным последовательностям МРТ головного мозга у всех пациентов с СД, чтобы выявить признаки, указывающие на это сосудистое заболевание, как описано ранее, и дополнить исследование ангиографическими последовательностями всякий раз, когда на основании этих изображений возникает подозрение.
Лечение церебральной реваскуляризацией у пациентов с СД рекомендуется только тщательно отобранным пациентам [51]. Современные методы лечения не способны лечить первичный процесс болезни; вместо этого они действуют, предотвращая возникновение ишемических повреждений, работая на улучшение кровотока в нездоровом полушарии головного мозга. В литературе, включая последние рекомендации Американской кардиологической ассоциации [52], хирургическая реваскуляризация рассматривается как основной вариант лечения.Описаны различные хирургические методы, направленные на предотвращение дополнительного ишемического повреждения за счет улучшения коллатерального кровотока, обычно за счет наружного кровообращения сонной артерии [44].
В литературе, включая последние рекомендации Американской кардиологической ассоциации [52], хирургическая реваскуляризация рассматривается как основной вариант лечения.Описаны различные хирургические методы, направленные на предотвращение дополнительного ишемического повреждения за счет улучшения коллатерального кровотока, обычно за счет наружного кровообращения сонной артерии [44].
Аберрантная подключичная артерия
Аберрантная правая подключичная артерия (ARSA), также известная как lusoria arteria , является редким сосудистым заболеванием, при котором правая подключичная артерия вместо первой ветви дуги аорты (с формированием правой общей сонной артерии брахиоцефальный ствол) возникает изолированно как четвертая ветвь после начала левой подключичной артерии, а затем поворачивает назад, чтобы достичь правой стороны.
В недавней литературе было высказано предположение, что пренатальная идентификация ARSA заметно увеличивается у DS плода с распространенностью от 19 до 36% [53]. Это может быть полезным ультразвуковым маркером DS при скринингах в первом триместре, хотя обычно не выполняется. Кроме того, тестирование кариотипа плода, когда этот результат присутствует как единичный результат, все еще остается дискуссионным вопросом [54]; тем не менее, это рекомендуется при наличии фонового риска или при наличии дополнительных маркеров [55].
Это может быть полезным ультразвуковым маркером DS при скринингах в первом триместре, хотя обычно не выполняется. Кроме того, тестирование кариотипа плода, когда этот результат присутствует как единичный результат, все еще остается дискуссионным вопросом [54]; тем не менее, это рекомендуется при наличии фонового риска или при наличии дополнительных маркеров [55].
ARSA можно легко выявить в ангиографических исследованиях, а именно при МРА и КТА (рис. 20). Этот нормальный вариант следует оценить и сообщить о нем, поскольку он может привести к проблемам с кормлением у пациентов с СД из-за сдавления пищевода аномальной артерией. Однако наличие ARSA не обязательно приводит к затруднениям с кормлением, и хирургическое лечение следует рассматривать только у тщательно отобранных пациентов [53].
Рис. 20Трехмерная реконструкция КТ-ангиографии надаортальных стволов 49-летнего пациента с синдромом Дауна, изображающая аберрантную правую подключичную артерию
Будущие направления нейровизуализации в DS
Комбинация Некоторые неврологические особенности у пациентов с СД, такие как нарушение речи, познания, обучения и памяти, привели к интенсивным исследованиям в области развития нервной системы у этих пациентов. Действительно, помимо объемных изменений, у пациентов с СД, вероятно, также наблюдаются структурные и функциональные аномалии головного мозга, которые могут быть дополнительно охарактеризованы передовыми методами нейровизуализации.
Действительно, помимо объемных изменений, у пациентов с СД, вероятно, также наблюдаются структурные и функциональные аномалии головного мозга, которые могут быть дополнительно охарактеризованы передовыми методами нейровизуализации.
Исследования МР-спектроскопии у пациентов с СД с деменцией или без нее показали повышенный пик миоинозитола, но без отклонений от нормы креатина или N -ацетиласпартата [9]. С другой стороны, функциональная МРТ, связанная с заданием (фМРТ), показала сниженную активацию в языковых областях и отличительные отношения между активацией и зрительно-пространственными возможностями у пациентов с СД по сравнению с контролем [56,57,58].
В последнее время возник интерес к потенциальным модификациям анатомических связей при этом синдроме. Функциональная возможность подключения к МРТ (fcMRI) основана на предположении, что функционально связанные области мозга имеют синхронизированные во времени колебания сигнала, зависящего от уровня кислорода в крови (ЖИРНЫЙ) [58]. Следовательно, оценивая временную связь между областями мозга, fcMRI может схематизировать анатомию функциональной сети. В опубликованном в литературе исследовании о связности мозга у пациентов с СД сообщается о широко распространенной повышенной синхронности между областями мозга с временным паттерном, который не был связан со стимулами окружающей среды; вместо этого он был характерен для одного пациента с DS.Это может быть результатом плохих или несуществующих отрицательных связей между различными областями мозга, а также сокращения междугородных связей. Эти данные свидетельствуют о незрелом развитии связности мозга у пациентов с СД, а также о сниженной способности включать информацию, которая происходит из отдаленных областей мозга, в логически организованные сети [9].
Следовательно, оценивая временную связь между областями мозга, fcMRI может схематизировать анатомию функциональной сети. В опубликованном в литературе исследовании о связности мозга у пациентов с СД сообщается о широко распространенной повышенной синхронности между областями мозга с временным паттерном, который не был связан со стимулами окружающей среды; вместо этого он был характерен для одного пациента с DS.Это может быть результатом плохих или несуществующих отрицательных связей между различными областями мозга, а также сокращения междугородных связей. Эти данные свидетельствуют о незрелом развитии связности мозга у пациентов с СД, а также о сниженной способности включать информацию, которая происходит из отдаленных областей мозга, в логически организованные сети [9].
Визуализация тензора диффузии (DTI) — это неинвазивное МРТ-исследование, используемое для характеристики структуры трактов белого вещества in vivo путем количественного определения диффузии молекул воды, и оно становится широко распространенным инструментом для оценки структурной связанности.

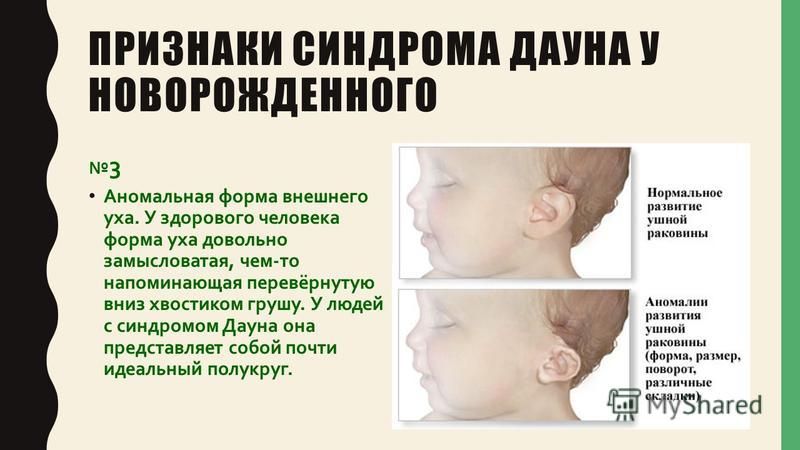
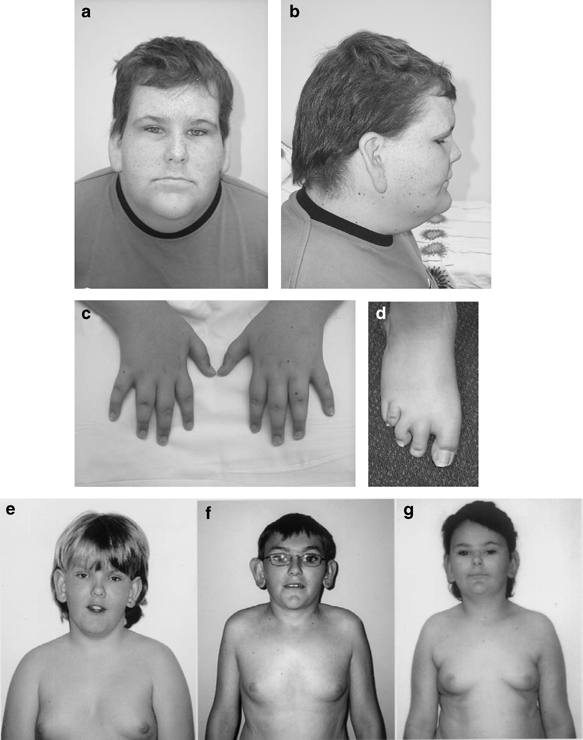 После 40 лет у больных синдромом Дауна повышен риск развития слабоумия.
После 40 лет у больных синдромом Дауна повышен риск развития слабоумия. Если носителем является мать, риск рождения ребенка с синдромом Дауна сост
Если носителем является мать, риск рождения ребенка с синдромом Дауна сост Филадельфия: Wolters Kluwer Health.
Филадельфия: Wolters Kluwer Health.


 Скрининг на синдром Дауна с использованием комбинированного скрининга в первом триместре с последующим вторым ультразвуковым обследованием в неотобранной популяции. Am J Obstet Gynecol 2006; 195: 1379–1387.
Скрининг на синдром Дауна с использованием комбинированного скрининга в первом триместре с последующим вторым ультразвуковым обследованием в неотобранной популяции. Am J Obstet Gynecol 2006; 195: 1379–1387.
 , Томпсон С.Г. Модельный скрининг по риску применительно к синдрому Дауна. Stat Med 1992; 11: 257– 268.
, Томпсон С.Г. Модельный скрининг по риску применительно к синдрому Дауна. Stat Med 1992; 11: 257– 268. Улучшены параметры оценки риска при скрининге синдрома Дауна. Prenat Diagn 1995; 15: 1057– 1065.
Улучшены параметры оценки риска при скрининге синдрома Дауна. Prenat Diagn 1995; 15: 1057– 1065.
 , Isada NB, Wapner RJ, Treadwell MC, Heeger S, Evans MI. Простая гигрома первого триместра: причина и исход. Am J Obstet Gynecol 1993; 168: 156–161.
, Isada NB, Wapner RJ, Treadwell MC, Heeger S, Evans MI. Простая гигрома первого триместра: причина и исход. Am J Obstet Gynecol 1993; 168: 156–161.