Обследование новорожденных на 5 наследственных заболеваний — Красноярский краевой медико-генетический центр
Скрининг новорожденных проводится для выявления некоторых наследственных болезней, которые не проявляются при рождении, но в последующем приводят к тяжелым нарушениям развития, умственной отсталости и даже смерти. Обнаружение этих заболеваний в доклинической стадии и раннее назначение лечения препятствуют развитию заболевания и дают возможность сделать жизнь таких детей полноценной.
Процедура скрининга очень проста. Новорожденному перед выпиской из родильного дома (доношенным детям на 4 сутки жизни, недоношенным на 7 сутки) из пятки берется несколько капель крови на особую фильтровальную бумагу. Бумага с пятнами крови высушивается и направляется в лабораторию центра медицинской генетики, где с помощью различных лабораторных тестов проводятся анализы. Одни и те же образцы крови могут быть использованы для диагностики разных наследственных заболеваний.
Результаты тестирования поступают к врачу-генетику медико-генетического центра.
При обнаружении у ребенка одного из тестируемых заболеваний, которое еще не проявилось клинически, врач срочно назначает соответствующее лечение. Раннее и тщательно проводимое лечение позволит не допустить развертывания признаков болезни и даст возможность ребенку, а затем и взрослому человеку, быть здоровым.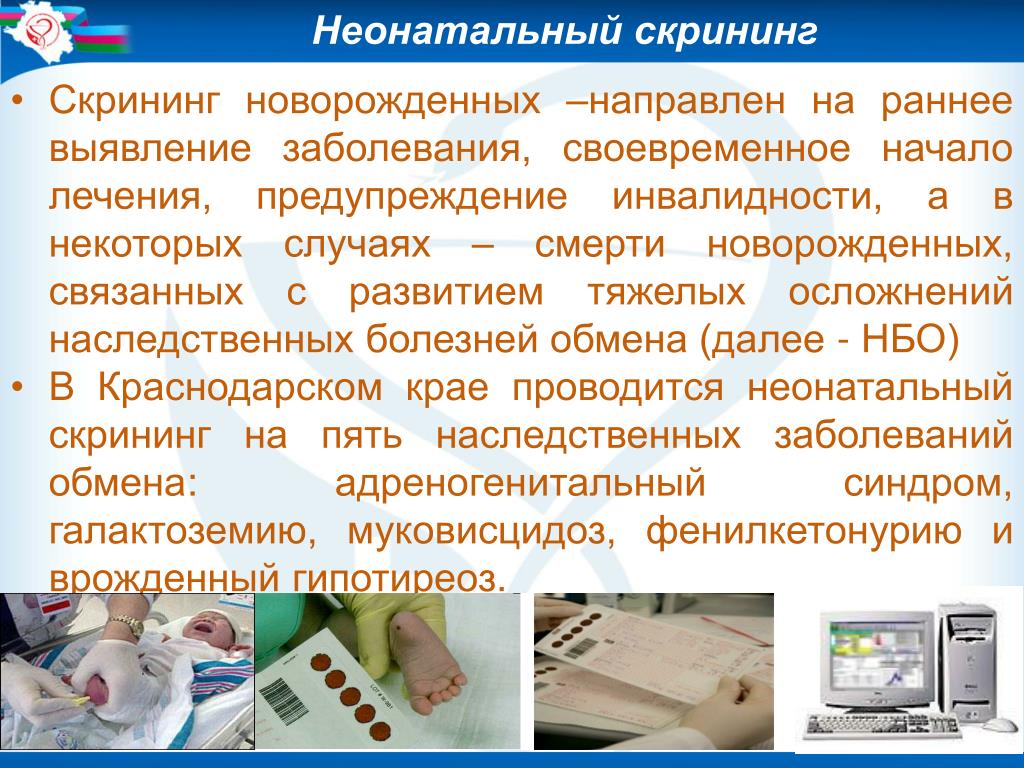
В нашей стране проводится массовое обследование новорожденных на пять наследственных болезней.
Фенилкетонурия
Заболевание обусловлено отсутствием или сниженной активностью фермента, который в норме расщепляет аминокислоту фенилаланин. Эта аминокислота содержится в подавляющем большинстве видов белковой пищи. Без лечения фенилаланин накапливается в крови и приводит, в первую очередь, к повреждению мозга, судорогам, умственной отсталости. Такие симптомы могут быть предупреждены благодаря раннему назначению специального диетического лечения.
Врожденный гипотиреоз
Заболевание связано с недостаточностью гормонов щитовидной железы, которая приводит к отставанию в росте, нарушению развития мозга и другим клиническим проявлениям. Если врожденный гипотиреоз обнаружен во время скрининга новорожденных, то назначенный врачом прием гормонов щитовидной железы позволяет полностью предотвратить развитие заболевания.
Галактоземия
Заболевание, при котором нарушено превращение галактозы, присутствующей в молоке, в глюкозу, использующуюся тканями ребенка в качестве энергетического ресурса. Галактоземия может быть причиной смерти младенца или слепоты и умственной отсталости в будущем. Лечение заключается в полном исключении молока и всех других молочных продуктов из диеты ребенка.
Галактоземия может быть причиной смерти младенца или слепоты и умственной отсталости в будущем. Лечение заключается в полном исключении молока и всех других молочных продуктов из диеты ребенка.
Адрено-генитальный синдром
Группа патологических состояний, обусловленных недостаточностью гормонов, вырабатываемых корой надпочечников. Это приводит к нарушению развития половых органов и в тяжелых случаях может обусловить потерю соли почками и явиться причиной смерти. Прием недостающих гормонов в течение жизни останавливает развитие болезни.
Муковисцидоз
Заболевание, при котором патология проявляется в разных органах из-за того, что слизь и секрет, вырабатываемые клетками легких, поджелудочной железы и других органов, становятся густыми и вязкими, что может привести к тяжелым нарушениям функции легких, проблемам с пищеварением и к нарушениям роста. Раннее обнаружение заболевания и его раннее лечение может помочь уменьшить эти проявления заболевания.
Выявление этих тяжелых заболеваний у новорожденных и своевременное назначение профилактического лечения позволит дать семье и обществу полноценных людей.
Уважаемые мамы и папы, проследите, чтобы у вашего ребенка взяли несколько капель крови из пятки для тестирования на перечисленные заболевания.
Сообщайте точный адрес, где будет находиться ребенок после выписки из родильного дома, для того, чтобы с вами было легко связаться.
Неонатальный скрининг — анализ, который спасает жизнь
02.06.2020
Неонатальный скрининг — это обследование малыша на пять наследственных заболеваний, которые представляют серьезную угрозу жизни и здоровью ребенка.
Обследование проводится на такие болезни как: врожденный гипотиреоз, муковисцидоз, фенилкетонурия, адреногенитальный синдром, галактоземия. Раннее выявление этих заболеваний позволяет врачу вовремя назначить необходимое дообследование, лечение или специализированную диету.
Остановимся немного подобнее на каждом из этих заболеваний.
ВРОЖДЕННЫЙ ГИПОТИРЕОЗ — наследственная патология щитовидной железы, которая может привести к отставанию в физическом развитии и тяжелой умственной неполноценности. На сегодняшний день, своевременно диагностированный гипотиреоз хорошо поддается гормональной терапии. Распространенность 1 случай на 2 000 – 5 000 населения.
На сегодняшний день, своевременно диагностированный гипотиреоз хорошо поддается гормональной терапии. Распространенность 1 случай на 2 000 – 5 000 населения.
МУКОВИСЦИДОЗ — одно из наиболее распространенных наследственных заболеваний. Проявляется нарушением функции всех органов, которые выделяют слизь, сильным сгущением секрета — в первую очередь в легких и пищеварительном тракте, что приводит к поражениям органов дыхания, печени, желудочно-кишечного тракта и других систем организма. Поддается лечению. Распространенность заболевания 1 случай на 5 000-7 000 населения.
ФЕНИЛКЕТОНУРИЯ — наследственное нарушение обмена аминокислот, в частности фенилаланина. Без специального лечения может привести к тяжелому поражению центральной нервной системы — но, к счастью, при своевременной диагностике патологических изменений можно полностью избежать. Распространенность 1 случай на 8 000-10 000 населения.
АДРЕНОГЕНИТАЛЬНЫЙ СИНДРОМ — группа нарушений, связанных с избыточной секрецией гормонов коры надпочечников.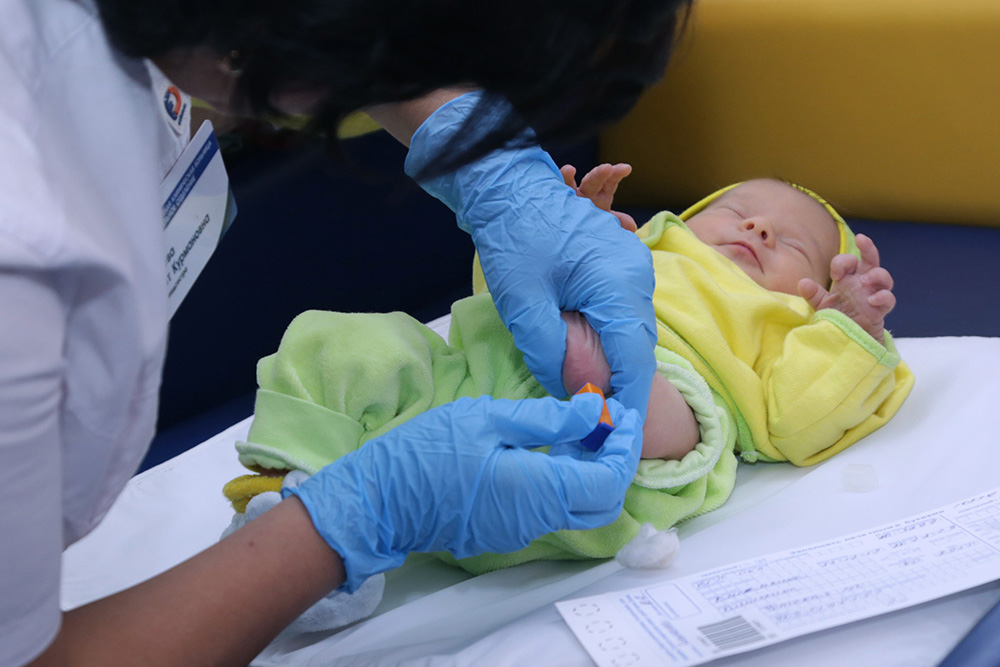
ГАЛАКТОЗЕМИЯ — заболевание, при котором диагностируется нарушение обмена углеводов, в организме ребенка постепенно накапливаются токсичные продукты «неправильного» обмена, что приводит к интоксикации. Со временем, развивается тяжелые патологии печени, замедляется умственное и физическое развитие, ухудшается зрение. Чтобы избежать подобных проявлений, ребенок с таким заболеванием должен начать получать специализированное питание с первых дней жизни. Распространенность 1 случай на 20 000-30 000 населения.
В рамках неонатального скрининга эти пять заболеваний включены еще и потому, что при ранней диагностике их можно вылечить, или, по крайней мере, значительно облегчить последствия и тяжесть течения процесса.

Как проводится данное обследование?
Обычно кровь на анализ берут у малышей, родившихся в срок не ранее 4-го дня жизни, недоношенным деткам тест проводится не ранее 7-го дня жизни. Но точная дата обследования может существенно меняться в зависимости от обстоятельств. Такое раннее обследование объяснимо тем, что некоторые генетически обусловленные болезни могут проявляться в первые недели жизни и крайне важно вовремя диагностировать их, чтобы начать необходимую терапию, с целью минимизировать риски тяжелых последствий заболевания.
Чтобы результаты теста были максимально точными, кровь следует сдавать натощак, через 3 часа после последнего кормления ребенка (у новорожденных перед очередным кормлением).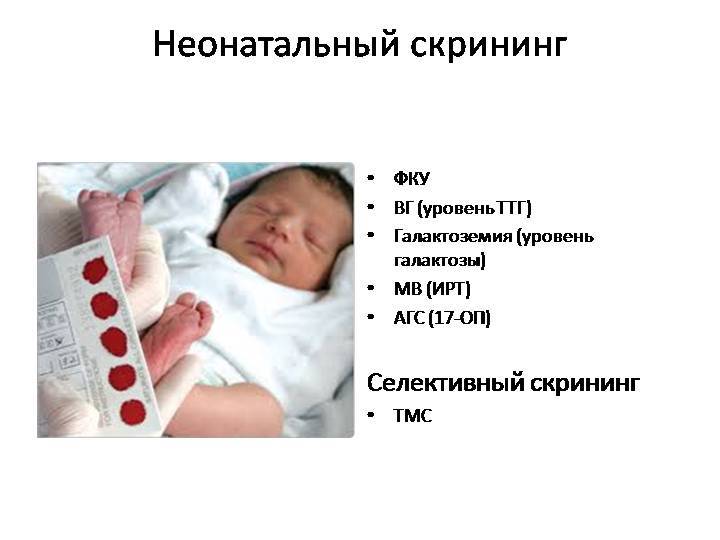
Скрининг на наследственные заболевания зачастую является единственным способом быстро и своевременно выявить опасные заболевания. Анализ позволяет сохранить самое ценное — здоровье ребенка!
В Детском Диагностическом центре появилась уникальная возможность сдать анализ крови на 5 наследственных заболеваний. Подробнее
Возврат к списку
Неонатальный скрининг новорожденных: анализ, который спасает жизнь
В Московском центре неонатального скрининга, функционирующем в Морозовской детской больнице, ежегодно более 100 000 новорожденных проходят диагностику на тяжелые наследственные заболевания.
Исследование включает в себя тестирование 11 врожденных болезней: муковисцидоз, галактоземия, врожденная дисфункция коры надпочечников, врожденный гипотиреоз, фенилкетонурия, глутаровая ацидурия тип 1, тирозинемия тип 1, лейциноз, метилмалоновая/пропионовая ацидурия, недостаточность биотинидазы, недостаточность среднецепочечной ацилКоА дегидрогеназы жирных кислот.
«Отсутствие родственников с врожденной и наследственной патологией, к сожалению, не является гарантом рождения здорового ребенка, поэтому важно, чтобы родители не отказывались от проведения исследований. Наследственные заболевания представляют серьезную угрозу для здоровья и жизни детей. Благодаря ранней диагностике и вовремя начатому лечению малышу можно помочь справиться с тяжелыми проявлениями недуга. Наиболее ранний способ диагностики врожденных нарушений обмена веществ — неонатальный скрининг новорожденных. Он позволяет выявить опасную болезнь до появления симптомов, тем самым предотвратив развитие угрожающих жизни осложнений», — отметила заведующий медико-генетическим отделением Морозовской детской больницы, врач-генетик Татьяна Кекеева.
Как сообщила врач, анализ крови собирается у всех новорожденных в родильных домах города. Образцы крови из пяточки детей берут по истечении трех полных суток с момента рождения и направляют на исследование в Московский центр неонатального скрининга.
«Если признаков заболеваний не выявлено, результаты анализов не направляются ни в роддом, ни родителям новорожденного. Если выявлено повышение определенных показателей, ребенку показан немедленный повторный анализ. В случае выявления превышения показателей и в повторном анализе, наши сотрудники связываются с медицинским учреждением или с родителями малыша и приглашают их пройти уточняющую диагностику», — рассказала Татьяна Кекеева.
При подтверждении диагноза ребенок с наследственным заболеванием наблюдается у врача специалиста Морозовской больницы до 18 лет. Пациентам назначаются специализированные лекарственные препараты и лечебное питание, выписываются льготные рецепты.
Московский центр неонатального скрининга работает более пяти лет. Здесь анализируются данные обо всех родившихся в Москве детях с наследственными болезнями обмена, что позволяет оперативно выявить заболевание и своевременно назначить терапию.
Кроме того, специалисты центра консультируют детей в случае подозрения на другую моногенную патологию, хромосомные нарушения и проводят семейные консультации при подготовке к беременности и во время беременности (оценка рисков развития заболеваний у плода).
Прием проводится в рамках ОМС по направлению из поликлиники по месту жительства (форма 057/У-04), а также в рамках платных медицинских услуг. Обратиться в центр можно по телефонам: +7 (495) 695-01-71, +7 (495) 959-87-74 и электронной почте [email protected].
Береги смолоду: в России предложили расширить скрининг новорожденных | Статьи
В России планируется расширить неонатальный скрининг до 36 заболеваний, сообщил на днях премьер-министр Михаил Мишустин. По его словам, это позволит существенно снизить младенческую смертность и дополнительно спасать около 1 тыс. детей ежегодно. Такой скрининг позволяет выявить генетические наследственные заболевания у новорожденных, на сегодняшний день в России пока проводятся обследования на пять генетических нарушений. Расширение программ такого рода в перспективе поможет спасти тысячи детей. Подробности — в материале «Известий».
«Снизить младенческую смертность»
Премьер-министр Михаил Мишустин поддержал расширение программ неонатального скрининга до 36 заболеваний. На сегодняшний день новорожденных в России обследуют только на пять распространенных наследственных заболеваний.
На сегодняшний день новорожденных в России обследуют только на пять распространенных наследственных заболеваний.
— Сейчас у нас идет четвертый год Десятилетия детства, которое проходит по инициативе президента России. Утвержденный правительством план его основных мероприятий включает целый блок мер, которые направлены на укрепление здоровья детей, и главным приоритетом здесь является своевременное выявление заболеваний и их лечение на ранней стадии.
Фото: РИА Новости/Александр Кондратюк
Для этого, подчеркнул премьер, необходимо расширять неонатальный скрининг. «Уже 15 лет большинство малышей сразу после рождения в роддоме бесплатно обследуют на пять наследственных заболеваний. За все время такие тесты прошли более 20 млн детей. Заболевания выявлены примерно у 15 тыс. И ранняя диагностика серьезно помогла вовремя назначить им лечение, остановить болезнь или ее тяжелые последствия. Возможности медицины постоянно растут. Появляются новые тесты, новые методики, новые технологии. И методики скрининга после родов должны включать гораздо большее число заболеваний. Считаю необходимым в разы расширить его и у нас. Это позволит существенно снизить младенческую смертность, дополнительно спасать около тысячи детей ежегодно», — сообщил он.
Появляются новые тесты, новые методики, новые технологии. И методики скрининга после родов должны включать гораздо большее число заболеваний. Считаю необходимым в разы расширить его и у нас. Это позволит существенно снизить младенческую смертность, дополнительно спасать около тысячи детей ежегодно», — сообщил он.
Премьер-министр поручил Минфину подготовить предложения по финансированию мероприятий для расширения неонатального скрининга, а Минпромторгу проработать вопрос организации производства реагентов для осуществления таких исследований.
Сохранить здоровыми и социальными
В России неонатальный скрининг начали делать еще в 1993 году: тогда обследования проводились всего на два заболевания. С 2006 года и по настоящее время скрининг проводится на пять генетических нарушений, в результате их выявляют примерно у 1 тыс. детей ежегодно, благодаря чему возникает основа для проведения своевременной ранней профилактики и терапии, сообщил в ходе совещания по совершенствованию медицинской помощи детям директор Института репродуктивной генетики НМИЦ АГП имени В.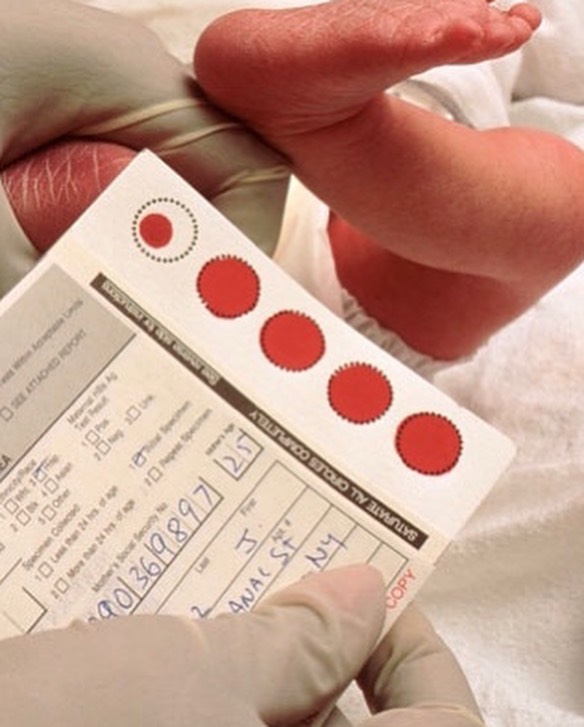 И. Кулакова Дмитрий Трофимов.
И. Кулакова Дмитрий Трофимов.
Фото: РИА Новости/Владимир Астапкович
Пока что в России предусмотрено обследование новорожденных на следующие наследственные заболевания: фенилкетонурия, муковисцидоз, врожденный гипотиреоз, адреногенитальный синдром и галактоземия. Существуют генетические заболевания, при ранней диагностике которых еще до клинических проявлений мы можем начать терапию, исключить какие-то продукты, как при галактоземии (заболевание, связанное с нехваткой ферментов для переработки галактозы. — «Известий»), и вести специализированный контроль для того, чтобы уменьшить тяжесть риска, объяснила в разговоре с «Известиями» неонатолог, доктор медицинских наук Елена Кешишян.
— И мы можем сохранить эту группу детей вполне здоровыми и социальными. Встает вопрос о том, что есть такие редкие, так называемые орфанные, заболевания, которые являются генетически врожденными, но проявляются поздно, и тогда, когда они уже проявились, лечить уже мало что можно. Самый типичный пример, который сегодня у всех на устах, — это спинальная мышечная атрофия (СМА). Это генетическое заболевание, которое проявляется не всегда в раннем возрасте. Оно может начать проявляться в месяц, два, три, четыре. Но на сегодняшний день есть генные препараты, и если такой препарат ввести еще до того, как появились клинические признаки только по генетическому анализу, который нам даст скрининг, то мы можем получить абсолютно здорового ребенка с минимальными изменениями, которые не повлияют на его социальную жизнь.
Самый типичный пример, который сегодня у всех на устах, — это спинальная мышечная атрофия (СМА). Это генетическое заболевание, которое проявляется не всегда в раннем возрасте. Оно может начать проявляться в месяц, два, три, четыре. Но на сегодняшний день есть генные препараты, и если такой препарат ввести еще до того, как появились клинические признаки только по генетическому анализу, который нам даст скрининг, то мы можем получить абсолютно здорового ребенка с минимальными изменениями, которые не повлияют на его социальную жизнь.
Не дожидаясь клинических симптомов
Расширение скрининга до 36 заболеваний необходимо для того, чтобы выявлять детей с тяжелыми заболеваниями до клинической стадии, то есть до того момента, когда появляются симптомы и когда лечение уже может быть неэффективным, подчеркнул в разговоре с «Известиями» директор Медико-генетического научного центра имени академика Н.П. Бочкова, главный внештатный специалист по медицинской генетике Минздрава России Сергей Куцев.
Фото: РИА Новости/Антон Денисов
— Во всех развитых странах есть массовые обследования всех новорожденных на 30–40 заболеваний. Это все наследственные заболевания, то есть генетически детерминированные, и для них есть лечение. Большая группа — это наследственные болезни обмена веществ, и в основном лечение там происходит за счет специализированных продуктов лечебного питания. Тем не менее также туда входит, например, СМА. Поскольку сейчас дети обеспечиваются лечением за счет средств фонда «Круг добра», то мы, конечно, надеемся на то, что раннее выявление, до появления клинических симптомов и назначения патогенетических препаратов, которых сейчас три, будет обеспечивать сохранение жизни и здоровья этих детей.
Говорить о том, что расширение скрининга будет гарантировать полное излечение от любого наследственного заболевания, конечно, нельзя, однако это точно поможет многим детям, отмечает главный научный сотрудник отдела геномной медицины НИИ акушерства, гинекологии и репродуктологии (АГиР) им. Д.О. Отта, главный специалист Санкт-Петербурга и Северо-Западного региона РФ по медицинской генетике Владислав Баранов.
Д.О. Отта, главный специалист Санкт-Петербурга и Северо-Западного региона РФ по медицинской генетике Владислав Баранов.
— В случае ужасного диагноза СМА, если лечение было начато до шести месяцев после рождения, то оно может почти полностью ликвидировать этот дефект, потому что лечебным препаратом служит сам ген, который поломан у больного ребенка. Печаль в том, что если начать лечение после шести месяцев, то клетки, которые должен лечить введенный ген, просто отмирают, лечить просто нечего. Именно поэтому в случае этого заболевания важен неонатальный скрининг: если лечить в год или после, то обычно происходит облегчение, но не излечение, потому что клетки, которые не имели продукта этого гена, уже погибли. Но тут правильно будет сказать, что каждое заболевание требует своей проработки, своего лечения, и эффективность будет различна.
Фото: РИА Новости/Сергей Красноухов
В целом же, как сообщал Дмитрий Трофимов, реализация данных мер позволит снизить младенческую смертность по крайней мере на 15%.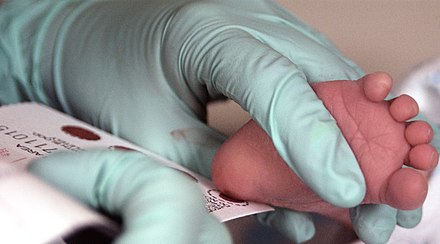 «При этом за 10 лет будет сохранено более 9 тыс. детских жизней. Семьи смогут при дальнейшем планировании семьи получить необходимую квалифицированную медико-генетическую помощь. Также снизится нагрузка на стационары, отделения реанимации», — отмечал он.
«При этом за 10 лет будет сохранено более 9 тыс. детских жизней. Семьи смогут при дальнейшем планировании семьи получить необходимую квалифицированную медико-генетическую помощь. Также снизится нагрузка на стационары, отделения реанимации», — отмечал он.
Деньги и кадры решают всё
Все врачи сходятся в одном: расширение такого скрининга потребует не только немалых финансовых вложений, но и серьезной подготовки специалистов. Так, эта программа требует внедрения тандемной масс-спектрометрии, отмечает Сергей Куцев.
— Это метод, который позволяет определять концентрацию ряда метаболитов и поставить тот или иной диагноз. И, конечно, это требует инвестиций от государства для приобретения соответствующего оборудования, реагентов, расходного материала, обучения врачей и проведения исследований, а также ведения пациентов, которые будут выявляться в результате этого скрининга. Это тоже не так просто, потому что выявленные случаи всегда требуют еще определенного молекулярно-генетического исследования, чтобы выявить мутацию в определенных генах, которые отвечают за развитие этих заболеваний.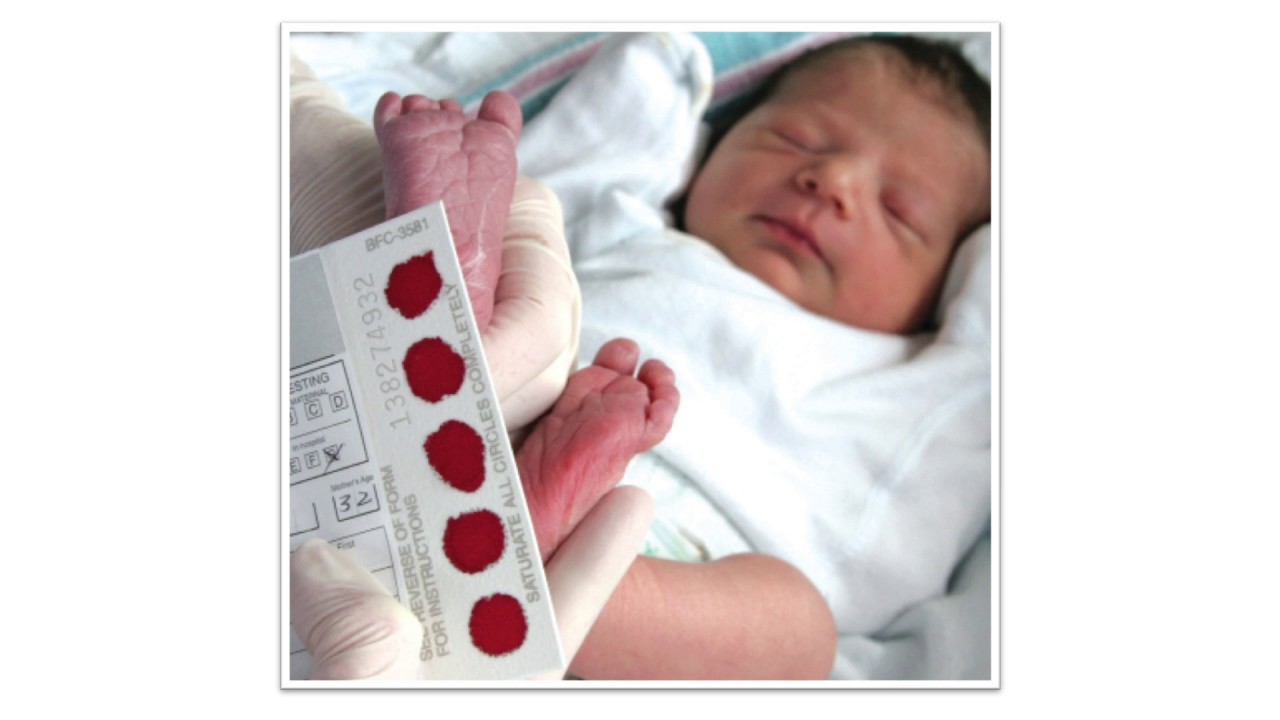
Фото: РИА Новости/Кирилл Брага
С этим согласен и Владислав Баранов. «Я думаю, что это чрезвычайно важно для здравоохранения и профилактики различных тяжелых болезней. Но необходимо учитывать, что за этим последуют очень серьезные денежные траты. Пока у нас было пять заболеваний, на которые ведется массовый неонатальный скрининг. Если их увеличить до 36, то, конечно, будет существенно больше выявляться больных, и увеличится потребность в лекарствах», — отметил он.
Расширение программ неонатального скрининга, возможно, будет происходить постепенно, потому что для этого необходимо провести большую организационную работу, считает Елена Кешишян. «Но если мы будем постепенно расширять до 10–15 таких заболеваний, а потом и до 36, то можно сказать, что в будущем мы спасем миллион детей от тяжелой инвалидности», — заключила она.
Зачем расширяется программа скрининга новорожденных на редкие заболевания
С 2022 года расширяется программа неонатального скрининга на выявление редких заболеваний — новорожденных будут тестировать не на пять, как сейчас, а на 36 наследственных патологий — это поможет на самой ранней стадии выявлять тяжелейшие патологии дополнительно у нескольких тысяч младенцев. Как будет работать эта программа, с какими сложностями сталкиваются врачи, оказывая помощь таким детям, «Российской газете» рассказал директор Медико-генетического научного центра имени академика Н.П. Бочкова, главный внештатный специалист по медицинской генетике Минздрава России, член-корреспондент РАН Сергей Куцев.
Как будет работать эта программа, с какими сложностями сталкиваются врачи, оказывая помощь таким детям, «Российской газете» рассказал директор Медико-генетического научного центра имени академика Н.П. Бочкова, главный внештатный специалист по медицинской генетике Минздрава России, член-корреспондент РАН Сергей Куцев.
Сергей Иванович, если разрешите, первый вопрос о коронавирусе. COVID-19 у всех протекает по-разному: у кого-то почти или вовсе незаметно, а другим необходим кислород в реанимационном отделении. Предрасположенность или, наоборот, невосприимчивость к этой инфекции может быть заложена в наших генах? Что говорит наука?
Сергей Куцев: За этот год, что мы живем с этой новой инфекцией, проведено уже много исследований на эту тему. Ученые пытаются понять, почему одни, находясь в контакте с заболевшим, не заражаются, а другие — подхватывают вирус и болеют тяжело. В сущности, это такие же исследования, как попытка выявить генетическую предрасположенность к частым заболеваниям, например спорадическим формам рака, сердечно-сосудистым, сахарному диабету и так далее.
При этом надо понимать, что как частые заболевания, которые я назвал, так и инфекционные — тот же COVID-19, — развиваются под воздействием многих факторов. Конечно, всегда есть какая-то генетическая компонента, которая будет предрасполагать к развитию того или иного заболевания, но ее доля, если мы говорим не о наследственных заболеваниях, не велика. Влияние генома можно попытаться установить в результате научных исследований, когда сравниваются две когорты — заболевших и не заболевших. Но это невозможно использовать для индивидуального прогноза — для расчета риска для конкретного человека. Нельзя сказать: у тебя такой генотип и ты будешь болеть. А если другой генотип — болеть не будешь.
Относительно COVID-19 мы уже понимаем, что если у пациента есть патология легких, например легочный фиброз, то однозначно у него будет тяжелое течение заболевания.
Возможно, у человека нет генетической предрасположенности к коронавирусу, но у него ожирение, диабет, он курит — тут опять можно с уверенностью ожидать тяжелого течения. Но описать такие риски с точки зрения генетики человека — не получится.
Но описать такие риски с точки зрения генетики человека — не получится.
Но сейчас коммерческие лаборатории предлагают расшифровать геном и выдать «билет» в счастливое будущее — дать прогноз по возможному развитию разных болезней и, соответственно, рекомендации по их профилактике. Получается, это шарлатанство?
Сергей Куцев: Важно понимать, о каких именно заболеваниях идет речь. С позиции медицинской генетики есть хромосомные заболевания — когда изменяется структура или количество хромосом, и это можно увидеть даже в микроскоп. Классический пример — синдром Дауна, который возникает из-за лишней 21-й хромосомы. Вторая большая группа — это моногенные заболевания. Они связаны с изменением структуры гена, его мутацией. Измененный ген перестает контролировать выработку необходимых организму ферментов, и возникает заболевание. Одно из самых распространенных — фенилкетонурия. Есть митохондриальные болезни — есть такие органеллы в клетках, в которых есть своя ДНК.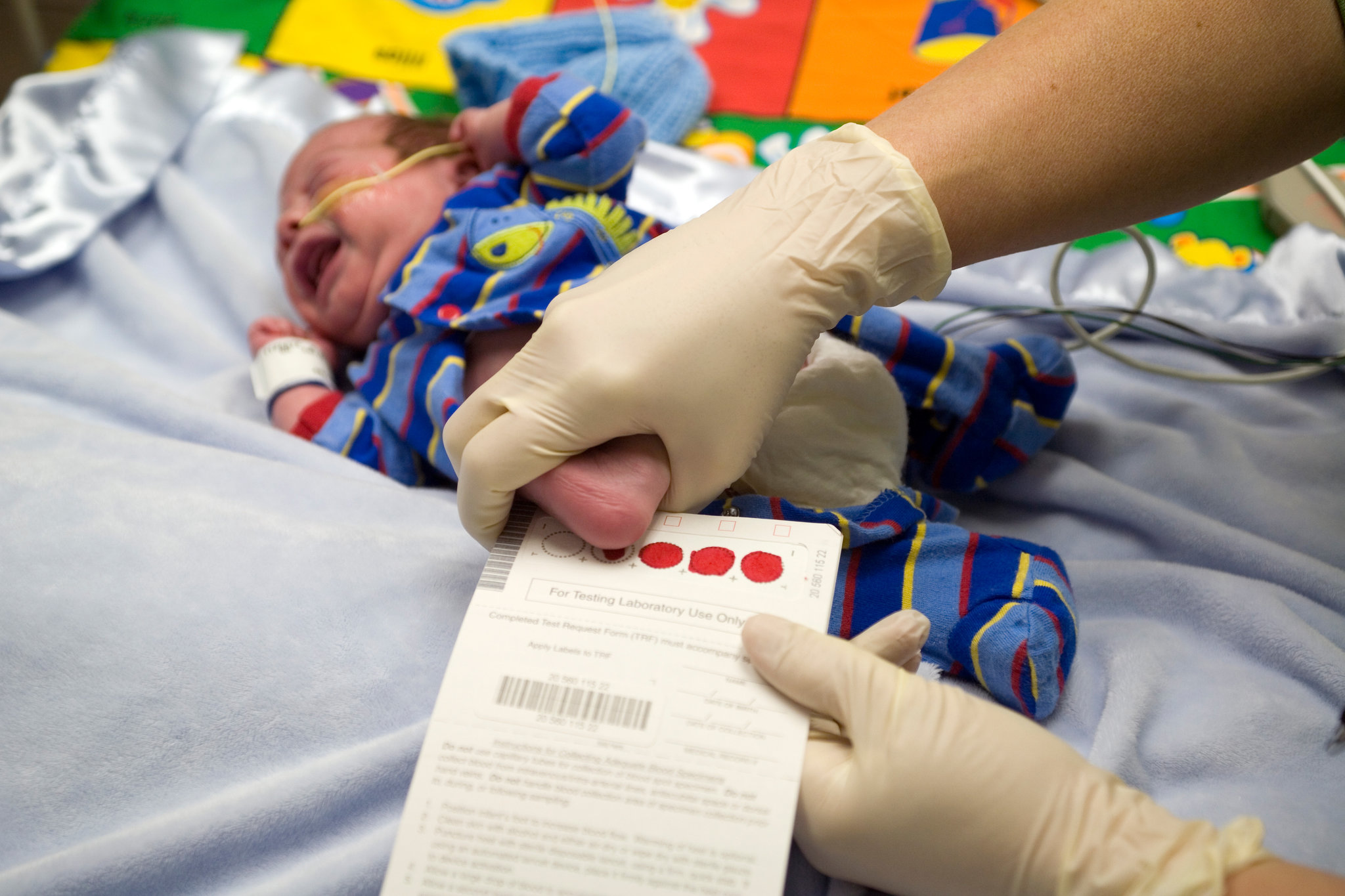 Наконец, есть генетические болезни соматических клеток — изменяется генетический аппарат клеток какой-то ткани, и возникает онкологическое заболевание.
Наконец, есть генетические болезни соматических клеток — изменяется генетический аппарат клеток какой-то ткани, и возникает онкологическое заболевание.
Такого рода заболевания, многие из них, мы умеем диагностировать (для этого и нужен неонатальный скрининг). Или, найдя поломку в геноме, предсказать, что велик риск развития заболевания в будущем — известный пример с Анджелиной Джоли.
В первом случае ранняя диагностика помогает начать лечение сразу же, еще до его клинических проявлений. Во втором — можно принять профилактические меры. Например, для наследственных форм рака необходим другой мониторинг, другая частота обследований.
И совсем другое дело, когда коммерческие клиники предлагают посмотреть геном для того, чтобы понять, как лучше питаться, каким спортом заниматься или даже какую профессию выбрать на будущее. Вот это все — из разряда развлекательной генетики, которая совершенно не имеет под собой научной основы.
Почему обследование на наследственные заболевания нужно проводить сразу после рождения?
Сергей Куцев: 90% наследственных синдромов клинически проявляются в детском возрасте, до 18 лет, а примерно половина — уже на первом году жизни. Для многих из них существует специфическое лечение. Собственно, мы и проводим скрининг на те заболевания, которые умеем лечить.
Для многих из них существует специфическое лечение. Собственно, мы и проводим скрининг на те заболевания, которые умеем лечить.
Со следующего года всех только что появившихся на свет младенцев будут проверять уже на 36 наследственных заболеваний, а не на пять, как сейчас
Причем иногда это лечение не требует больших затрат, если не упустить время. Например, для фенилкетонурии главное — диетотерапия. У таких детей имеется мутация в гене, которая кодирует выработку фермента, необходимого для метаболизации аминокислоты фенилаланин. Дефицит фермента приводит к тому, что аминокислота накапливается в организме и повреждают головной мозг. Значит, нужно исключить эту аминокислоту из питания, причем как можно раньше, буквально в течение первых недель жизни ребенка. Такому малышу даже грудное молоко противопоказано — в нем также содержится эта аминокислота. Если же питание не скорректировать, у ребенка развивается тяжелая умственная отсталость, неврологические нарушения. Поэтому все дети с фенилкетонурией получают специализированное лечебное питание.
Для лечения этого заболевания разработан и ферментный препарат. Но его можно применять только с 15 лет. Это позволит расширить диету. Пока в России это лекарство не зарегистрировано. Но в принципе ферментозаместительная терапия применяется для лечения заболеваний обмена довольно широко. Если есть дефект гена, кодирующего какой-то фермент, значит, нужно вводить этот фермент искусственно. Так лечат мукополисахаридозы, а также болезнь Гоше — тяжелейшее заболевание, поражающее печень, селезенку, костную ткань. Когда научились синтезировать необходимые ферменты и стали их применять, получили потрясающие результаты в помощи таким больным.
Недавно вице-премьер Татьяна Голикова объявила, что со следующего года скрининг новорожденных будут выполнять уже на 36 заболеваний, а не на пять, как сейчас. Какие это заболевания?
Сергей Куцев: Прежде всего — наследственные болезни обмена, это большая группа, 30 заболеваний. Кроме них, в список включена спинально-мышечная атрофия (СМА), а также первичные иммунодефициты. Это очень хороший скрининг, мы будем впереди многих стран Европы.
Это очень хороший скрининг, мы будем впереди многих стран Европы.
У нас два варианта подхода к лечению наследственных заболеваний. Первый: мы массово обследуем всех новорожденных, выявляем больных и начинаем лечение. Второй: ранняя диагностика по клинической симптоматике, то есть когда у ребенка уже начинает проявляться заболевание. Очевидно, что второй путь менее эффективный.
Расширение скрининга стало возможно потому, что появились современные методы диагностики. Благодаря этому мы можем начать лечение рано, еще до того, как болезнь наносит серьезный урон организму. В результате дети имеют возможность нормально расти, развиваться, жить полноценной жизнью.
Очевидно, что проведение массового скрининга — ведь тестировать будут всех новорожденных без исключения — требует огромной подготовительной работы?
Сергей Куцев: Да, это так. Нужно написать клинические рекомендации, разработать стандарты оказания медицинской помощи. Закупить необходимое оборудование.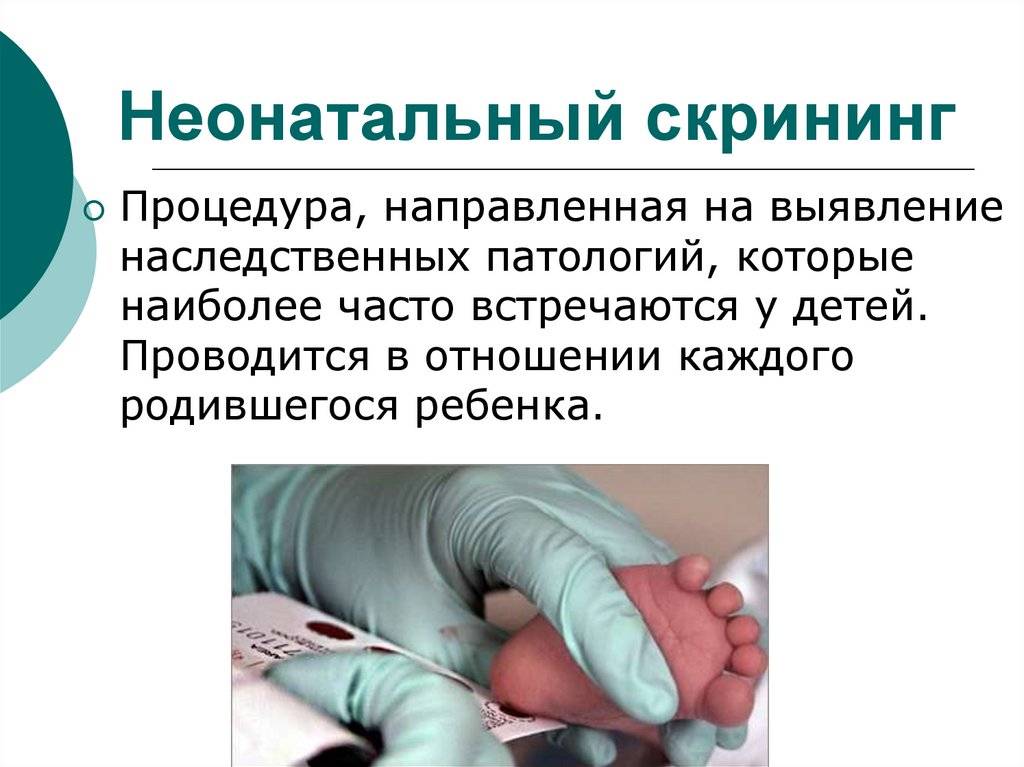 Обучить врачей, как генетиков, которые ведут прием пациентов, так и лабораторных генетиков, которые будут проводить тестирование.
Обучить врачей, как генетиков, которые ведут прием пациентов, так и лабораторных генетиков, которые будут проводить тестирование.
Скрининг — это не просто система выявления заболеваний, но и организация помощи. Мы должны четко сказать нашим пациентам: где будут обследовать ребенка, где его будут лечить, как он будет получать лечебное питание и лекарства.
Это действительно важно, потому что наследственное заболевание — это история на всю жизнь. При этом лечение некоторых из них, взять ту же СМА — стоит безумных денег. Как решить проблему финансирования?
Сергей Куцев: Лечение редких заболеваний было тяжким бременем для бюджетов регионов. Это абсолютно правильное решение — программа «14 высокозатратных нозологий», по которой лекарствами обеспечивают за счет федерального бюджета.
Еще один важный шаг — у нас был создан фонд «Круг добра» по инициативе президента. Этот фонд закрывает очень проблемные, очень затратные направления. В частности, обеспечивает лечение детям со СМА, закупает для них очень дорогие препараты. Я вхожу в экспертный совет этого фонда, вижу, как выстраивается его работа. И я уверен, что постепенно с его помощью мы закроем практически все проблемы, которые есть у пациентов с редкими заболеваниями. Сейчас «Круг добра» обеспечивает лечение больных детей по 19 нозологиям. В плане еще порядка 20, для которых есть лечение.
Я вхожу в экспертный совет этого фонда, вижу, как выстраивается его работа. И я уверен, что постепенно с его помощью мы закроем практически все проблемы, которые есть у пациентов с редкими заболеваниями. Сейчас «Круг добра» обеспечивает лечение больных детей по 19 нозологиям. В плане еще порядка 20, для которых есть лечение.
То есть количество заболеваний, которые подпадают под обеспечение фонда, гораздо шире, чем по программе высокозатратных нозологий.
Кроме того, фонд обеспечивает детей лекарствами, которые еще не зарегистрированы в России?
Сергей Куцев: Это очень важно, потому что обеспечивает доступ наших детей к инновационным препаратам, которые только-только появились, доказали свою эффективность и были одобрены регуляторами в развитых странах.
По приходу этих препаратов в Россию есть сложности?
Сергей Куцев: Поскольку это орфанные препараты, для их регистрации не требуется проведения клинических исследований в России.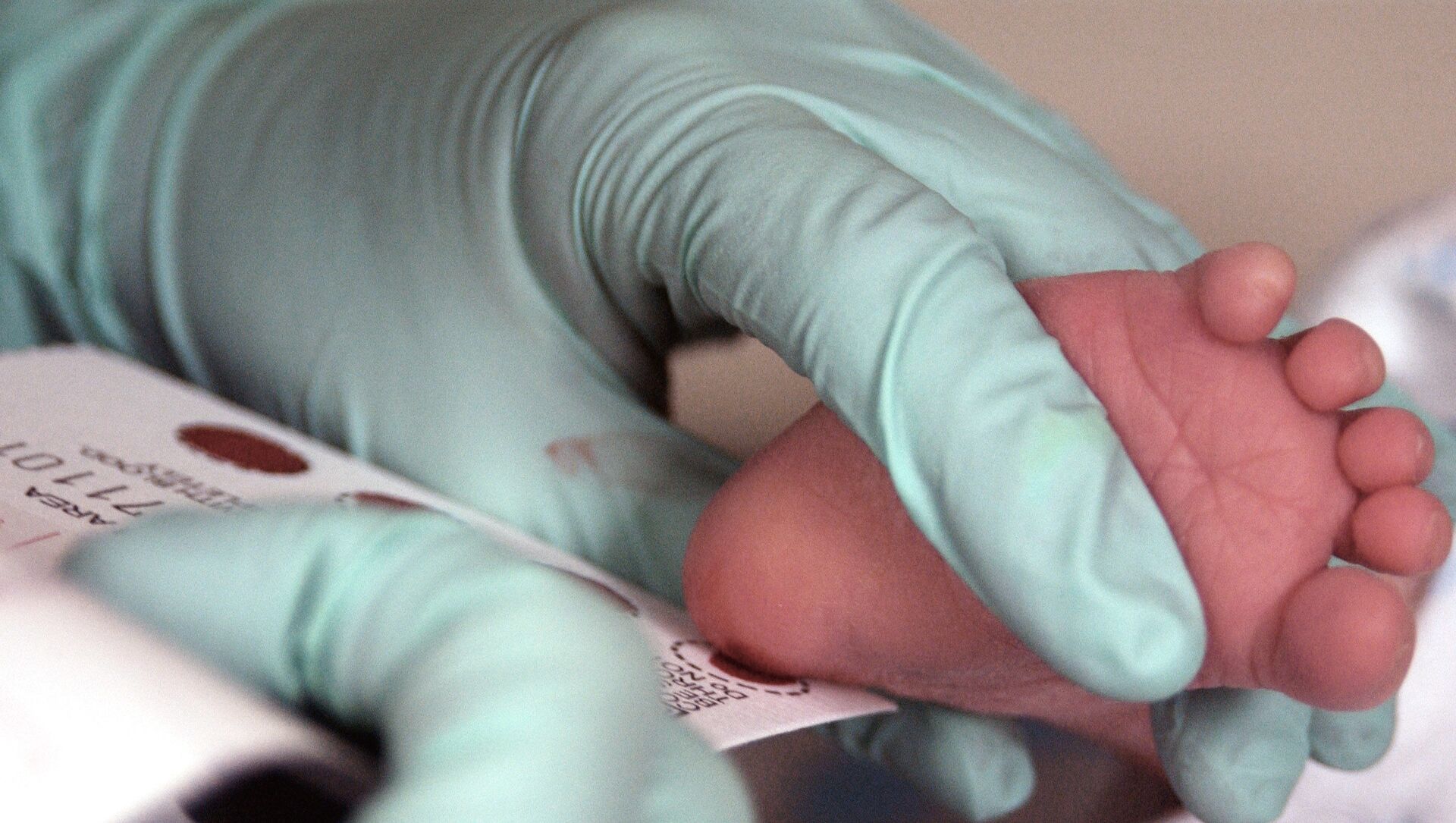 Принимаются к вниманию результаты исследований в других странах. Хотя мы всегда очень приветствуем, чтобы хотя бы один исследовательский медицинский центр был и в нашей стране.
Принимаются к вниманию результаты исследований в других странах. Хотя мы всегда очень приветствуем, чтобы хотя бы один исследовательский медицинский центр был и в нашей стране.
Потому что когда экспертный совет принимает решение о включении того или иного препарата в клинические рекомендации, важно иметь полную информацию, насколько он эффективен. Эта задача упрощается, когда наши врачи участвует в клинических испытаниях. Поэтому мы призываем все фармкомпании, разрабатывающие орфанные препараты, включать российские центры для проведения клинических исследований.
Орфанные препараты предназначены очень ограниченному кругу пациентов, а разработка их — это огромные вложения, поэтому они не могут быть дешевыми. Но иногда, как в случае с той же СМА, стоимость просто заоблачная. О чем говорить, если одна инъекция стоит 1,5 миллиона долларов… Есть ли возможность влиять на ценовую политику производителей?
Сергей Куцев: Это проблема не только для нашей страны. Возможность только одна: это переговоры. Руководство фонда «Круг добра», департамент лекарственного обеспечения минздрава, руководство казенного федерального учреждения, которое осуществляет закупки для программы «14 ВЗН», — все они с помощью ФАС вступают в переговоры с представителями производителей и договариваются о снижении цены.
Возможность только одна: это переговоры. Руководство фонда «Круг добра», департамент лекарственного обеспечения минздрава, руководство казенного федерального учреждения, которое осуществляет закупки для программы «14 ВЗН», — все они с помощью ФАС вступают в переговоры с представителями производителей и договариваются о снижении цены.
На самом деле это единственно верный подход, и он работает, фармкомпании идут навстречу и снижают цены. Но говорить о кардинальном уменьшении стоимости не представляется возможным. Потому что если «передавить» — производитель может просто уйти с нашего рынка.
Как вы относитесь к практике принудительного лицензирования? Некоторые наши российские фармкомпании разрабатывают копии препаратов для лечения редких заболеваний и готовы вывести их на рынок еще до истечения срока патентной защиты. Это оправданный подход?
Сергей Куцев: Если компания-производитель оригинального препарата не идет навстречу, соглашаясь на закупки по приемлемой стоимости, то я считаю, что государство вправе использовать такой механизм, как принудительное лицензирование.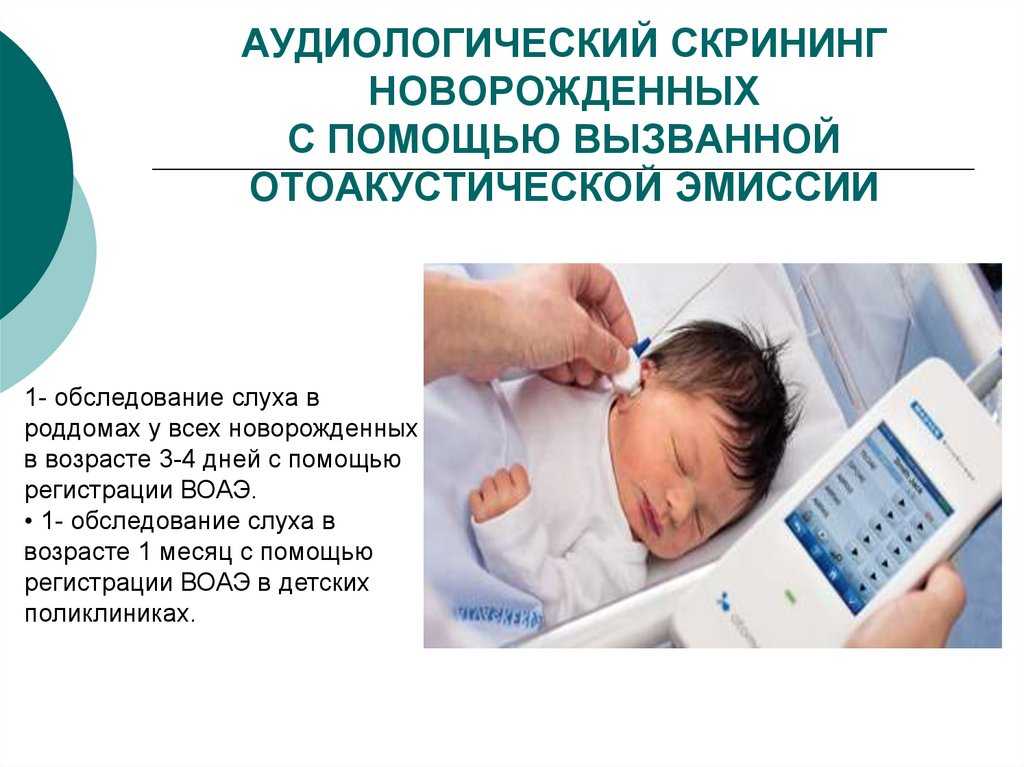 Потому что речь идет о здоровье детей, которые нуждаются в таких препаратах.
Потому что речь идет о здоровье детей, которые нуждаются в таких препаратах.
Когда появляются российские аналоги зарубежных инновационных препаратов и государство начинает их закупать, заменяя импортные, это часто приводит к конфликтам с пациентскими сообществами, с родителями больных детей. Нашей фарме многие по-прежнему не доверяют. Вот, например, недавний случай в Новосибирске, когда мама мальчика с синдромом Хантера публично выступила против назначения врачей — о переводе ребенка с одного препарата на другой. Такие вещи происходят нередко — что с этим делать?
Сергей Куцев: Что касается подобных конфликтов, я вообще не понимаю, как это возможно. Назначается препарат — он зарегистрирован в России, проверен, показал свою эффективность. Больной ребенок получает этот часто очень дорогой препарат бесплатно. Где тут повод для возражений, выставления каких-то требований?
За рубежом, если доктор назначает больному лекарство, никому в голову не приходит оспаривать назначение, требовать заменить препарат. Вот, к примеру, в Швейцарии, очень не бедной стране, не так давно полностью заменили на дженерики оригинальные факторы свертываемости крови для лечения гемофилии. Все это спокойно восприняли.
Вот, к примеру, в Швейцарии, очень не бедной стране, не так давно полностью заменили на дженерики оригинальные факторы свертываемости крови для лечения гемофилии. Все это спокойно восприняли.
Наверно, тут у родителей ребенка два мотива: недоверие к российским препаратам (если импортный заменяют на наш) и в принципе нежелание замены: вдруг ребенку станет хуже? Ну, к тому же копии обычно дешевле оригинальных лекарств. И родители могут думать: раз дешевле, значит хуже…
Сергей Куцев: В данной ситуации нужно учитывать, что речь идет не только о том, чтобы выполнить желание пациента. У государства есть и экономические мотивы. Дженерики действительно дешевле оригинальных препаратов, но по лечебному эффекту сопоставимы с ними. Поэтому сейчас практически все страны, даже такие богатые, как, например, Германия, стараются уменьшить расходы на лекарства, отдавая предпочтение дженерикам, когда это возможно.
Говорить при этом, что, закупая такие лекарства ради экономии бюджета, пациентам будут предлагать непроверенные или не соответствующие требованиям препараты — это абсурд. Конечно, такого нет.
Конечно, такого нет.
Если говорить о случае в Новосибирске, там речь идет даже не о дженерике, а о препарате с точно таким же механизмом действия, таким же профилем безопасности. И это не российское лекарство. Препарат эффективный, в других государствах его закупают и применяют. И позиция мамы тут, откровенно говоря, неконструктивная.
Но меня беспокоит, что у нас подобные врачебные решения подаются в СМИ в негативном ключе. Почему в таких случаях все заранее считают, что правы родители, а не врачи, для меня загадка.
Понятно, что семье, где тяжелобольной ребенок, всегда сочувствуют.
Сергей Куцев: Конечно, сочувствуют, это понятно. И все же я настаиваю: когда речь идет о таких сложных, тяжелых заболеваниях, должны решать врачи. Решения по таким пациентам принимают коллегиально. Если консилиум посчитал, что это, а не другое, лекарство следует назначить, то родители должны это принимать. Иначе нарушаются права ребенка на лечение.
Расширение скрининга стало возможно потому, что появились современные методы диагностики.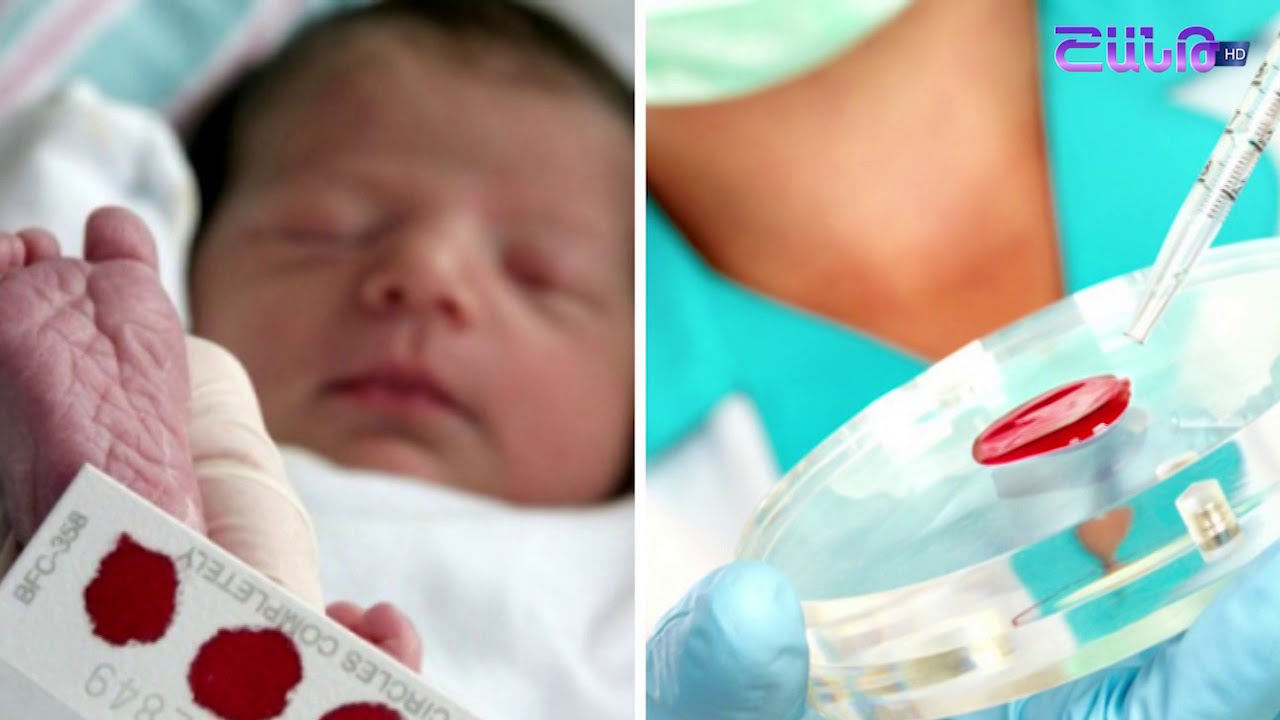 Благодаря этому мы можем начать лечение рано, еще до того, как болезнь заявит о себе
Благодаря этому мы можем начать лечение рано, еще до того, как болезнь заявит о себе
Тут мы как общество встаем перед вопросом — как быть с инициативами и мнением пациентов о том, какую назначать терапию. Вопрос сложный. С одной стороны — у человека есть право принимать решения в отношении своего здоровья или здоровья своего ребенка. С другой стороны — будет ли это решение правильным? Мы постоянно сталкиваемся с низким уровнем грамотности населения в медицинских вопросах.
Возьмем пример прививочной кампании — почему у нас в стране такой высокий процент «отказников», выше, чем в других странах? Почему не удается переубедить людей, что вакцинация сейчас жизненно необходима? Где-то принимают решительные меры, как в Израиле, как в Европе — где без прививки не пускают выехать из страны, не разрешают посещать общественные места. Понятно, что ситуация требует жесткого подхода. Но мне думается, важнее не запрещать или грубо, «в лоб» агитировать, а давать максимально полную и объективную информацию о вакцинах и вакцинации.
А в нашей области — лечении сложнейших генетических заболеваний — вопрос выбора оптимальной терапии ключевой, и тут интеллектуальная нагрузка на врача, требования к его компетенции очень высоки. Врачи учатся и стажируются десятки лет, это энциклопедические знания и колоссальный опыт. И оспаривать их решения, почитав непонятные источники в интернете, — ну, куда это годится?
Ключевой вопрос
Понятно, что мама больного ребенка зациклена на нем, она хочет, она требует самого лучшего из возможных (а порой и невозможных) вариантов лечения. Как ее переубедить, что назначение — правильное?
Сергей Куцев: Знаете, приведу пример, что сейчас происходит с детьми, больными СМА. Пример вопиющий. Государство полностью за счет фонда «Круг добра» обеспечило всех детей со СМА двумя зарегистрированными препаратами. При этом есть третий — новейший препарат золгенсма, о котором так много говорят. Один укол стоимостью 1,5 миллиона долларов — и ребенок выздоравливает. Родители часто требуют назначить своим детям именно это лекарство. И невозможно втолковать им, что этот один укол необходимо сделать в первые недели жизни ребенка. Если ему уже полтора-два года, то, к сожалению, нейроны уже погибают, и применять это лекарство бесполезно, поздно. Мнение врачебного сообщества, результаты клинических исследований по раннему применению золгенсмы игнорируются…
Родители часто требуют назначить своим детям именно это лекарство. И невозможно втолковать им, что этот один укол необходимо сделать в первые недели жизни ребенка. Если ему уже полтора-два года, то, к сожалению, нейроны уже погибают, и применять это лекарство бесполезно, поздно. Мнение врачебного сообщества, результаты клинических исследований по раннему применению золгенсмы игнорируются…
А в результате этот препарат получили 50 детей, но сейчас некоторые родители требуют назначить другое лечение, потому что ожидаемого улучшения не последовало.
Очень больная тема. Понимаешь мать, которая хватается за соломинку: а вдруг все-таки поможет? И понимаешь врачей, которые не имеют права выкидывать огромные деньги, назначая дорогой препарат больному, которому он априори не поможет, в то время как эта же ампула спасет другого ребенка…
Сергей Куцев: Я убежден, что многочисленные жалобы, выступления, требования — когда это не обосновано ничем — это неправильно, нельзя такое допускать. Не надо воспринимать систему принятия решений по нашим пациентам как чистую бюрократию.
Не надо воспринимать систему принятия решений по нашим пациентам как чистую бюрократию.
Если бы это было так — разве бы выделили из бюджета огромные суммы, в которые обходится поддержка качества жизни каждого пациента со сложным, неизлечимым диагнозом? Разве поиски способов финансирования, подключение разных источников, создание фонда «Круг добра» не говорит о том, что проблемой занимаются на самом высоком уровне? Наконец, расширение программы скрининга — разве не говорит о том же самом?
Государство уже столько сделало для наших пациентов! У нас две трети стран Европы не могут себе позволить такое обеспечение, такой уровень медицинской помощи детям с орфанными недугами.
Со следующего года начнется скрининг на СМА. Будем выявлять новорожденных со спинально-мышечной атрофией с первых дней жизни, и мы очень надеемся, что они будут получать золгенсму сразу же. И у них будет хороший результат.
Часто задаваемые вопросы — МАУЗ Детская городская клиническая больница №8 МАУЗ Детская городская клиническая больница №8
Как правильно кормить ребенка?
- Возьмите малыша на руки и примите удобное положение.

- Выдавите из соска каплю молока и проведите соском по нижней губе малыша.
- Дождитесь, пока малыш широко откроет ротик.
- Вложите сосок ему в рот так, чтобы нижняя губа была низко под соском.
- Проверьте, чтобы малыш правильно захватил грудь: его губы вывернуты наружу и захватывают ореолу.
- Вам не должно быть больно пока малыш сосет грудь.
Что малыш должен делать в 1 месяц? (нормальное психо-эмоциональное, речевое и моторное развитие доношенного новорожденного)
- Плачем озвучивает свои эмоции и нужды, успокаивается, когда его берут на руки.
- Ручки и ножки согнуты, а кисти легко сжаты в кулачки. Лежа на животе поворачивает головку набок, пытается ее приподнять.
- Задерживает взгляд на вашем лице, на предметах находящихся на расстоянии 30 см от его глаз. Поворачивает голову в сторону света.
- Начинает улыбаться.
Как правильно ухаживать за кожей новорожденного дома?
- Ежедневно купайте ребенка.

- Регулярно меняйте подгузники, обязательно подмывайте после дефекации.
- Используйте детский крем под подгузник при возникновении покраснения и раздражения кожи.
- Регулярно 1-2 раза в день устраивайте воздушные ванны – убедитесь, что у Вашего ребенка хорошее настроение и что в комнате достаточно тепло (минимум 21-22 С), разденьте его, положите на пеленку и дайте ему возможность полежать 5-10 минут без одежды.
- Для ухода за кожей используйте специальную детскую косметику. Не используйте детские масла после купания, так как они создают на поверхности кожи защитную пленку и затрудняют кожное дыхание у малыша.
- Не перегревайте и не переохлаждайте малыша.
Как правильно ухаживать за ногтевыми пластинками малыша?
- Ногти ребенка должны быть аккуратно подстрижены, при этом на пальчиках рук ногти следует оставлять закругленными, а на ножка – подстригать ровно.
- Подстригать ногти лучше во время сна : во-первых, это безопасно, а во –вторых, быстро и просто.

Что нужно делать при срыгиваниях?
- Первое, на что стоит обратить внимание, – это положение тела ребенка при кормлении. Необходимо кормить ребенка в положении сидя, удерживая его под углом 45-60 градусов.
- Удерживать ребенка в вертикальном положении после кормления следует не менее 20-30 минут.
- При кормлении грудью ребенок должен полностью захватывать сосок и околососковый кружок.
- При кормлении смесью обратите внимание на количество смеси в соске: необходимо чтобы там было как можно меньше воздуха, для этого держите бутылочку под углом.
- Не перекармливайте малыша. Особенно часто перекорм наблюдается при смешанном кормлении.
Если укусил клещ, что делать?
- При укусе клеща необходимо обратиться в детский травмпункт по адресу ул. Ленина,38(режим работы круглосуточно) или детскую поликлинику к инфекционисту в будние дни для удаления клеща.
- Клеща сдать на исследование на инфекции.
- Начать прием антибиотиков ( пенициллины, цефалоспорины 2-3 поколения, макролиды) на 5-7 дней.

- При положительном результате клеща на КЭ введение иммуоглобулина обязательно впервые 72 ч с момента укуса , в дозе 1мл на 10 кг веса в титре 1:80 или 1:160.
- Термометрия ежедневно 2 раза в день до 1 месяца, осмотр инфекциониста или педиатра 1 раз в неделю, при необходимости чаще.
Какая схема вакцинации против клещевого энцефалита?
- Вне сезона заболеваемости вакцинация разрешена с 1 года по схеме 0-1(3)-9 (12) мес , затем ревакцинация каждые 3 года( Энцепур детский ,ФСМЕ-Иммун Инжект).
- Первую и вторую прививку предпочтительно проводить в зимние и весенние месяцы.
Что делать, чтобы не заразиться менингитом?
- Соблюдать личную гигиену.
- Не пить сырую воду из – под крана, обрабатывать фрукты и овощи кипятком.
- Не купаться в водоемах, официально не разрешенных для купания.
Нужно ли прививаться от гриппа, и с какого возраста?
- Вакцинировать детей необходимо вне сезона заболеваемости для профилактики , снижения риска заболевания Гриппа , снижения риска осложнений заболевания.

- Вакцинация детей разрешена с 6 месяцев ( Гриппол +) .
Нужно ли соблюдать диету при острых респираторных заболеваниях?
- Необходимо соблюдать гипоаллергенную диету (исключить цитрусовые, сладости, орехи, соки, ягоды, молочные продукты) для предотвращения острых аллергических реакций на фоне приема лекарственных препаратов.
В какие дни можно сдать общий анализ крови?
- Забор крови на общий анализ поликлиническим пациентам осуществляется в 114 кабинете по расписанию: понедельник, среда, пятница прием больных детей, четверг – прием здорового ребенка. Вторник – выездной день (профосмотры).
Где можно получить ответы анализов?
- Ответы лабораторных исследований поликлинических пациентов забираются сотрудником регистратуры поликлиники, где их и можно получить, либо они вклеиваются в историю развития ребенка.
Как сдавать кровь на сахар грудным детям?
- Дети грудного возраста, не могущие выдержать голод, могут сдавать кровь на глюкозу через 2 часа после еды в часы приема (8:00-10:00).
 Более старшим детям желательно осуществлять данное исследование натощак, допускается питье несладкой кипяченой воды.
Более старшим детям желательно осуществлять данное исследование натощак, допускается питье несладкой кипяченой воды.
Что такое скрининг новорожденного (неонатальный скрининг)?
- Неонатальный скрининг – это бесплатное массовое обследование новорожденных малышей в первые дни жизни на наличие некоторых генетических заболеваний. Это своеобразный подарок каждому новому члену общества, гарантированный государством. Он позволяет выявить тяжелые (в плане последствий) заболевания, когда еще проявлений этих болезней у ребенка нет.
- В России по рекомендации Всемирной организации здравоохранения проводят скрининг новорожденных уже пятнадцать лет. Сейчас скрининг дает возможность обследовать малышей на пять генетических патологий. Их перечень: фенилкетонурия, муковисцидоз, врожденный гипотиреоз, адреногенитальный синдром, галактоземия.
Когда проводят неонатальный скрининг?
- Новорожденным на 4-е сутки назначают забор крови из пятки. Скрининг детям, поспешившим появиться на свет раньше положенного срока, проводят на 7-е сутки.
 Если ребенка выписали из роддома раньше, например, на 3-и сутки, то забор крови проводят в поликлинике. Анализ необходимо брать натощак, не раньше, чем через 3 часа последнего приема пищи.
Если ребенка выписали из роддома раньше, например, на 3-и сутки, то забор крови проводят в поликлинике. Анализ необходимо брать натощак, не раньше, чем через 3 часа последнего приема пищи. - Ранняя диагностика, когда забор крови у новорожденного провели раньше третьих суток, часто дает ложноположительные или ложноотрицательные результаты. Поэтому оптимальным периодом обследования малышей считают четвертые сутки жизни.
Как проводят неонатальный скрининг?
- Забор периферической крови проводят из пятки малыша. Это позволяет получить нужный объем крови для обследования. Обычный забор крови из пальчика здесь не подходит. Место прокола предварительно обрабатывают антисептиком. Прокол делают не глубже 2 мм. Каплю крови наносят на специальную фильтровальную часть тест-бланка, где очерчены пять кружочков (по одному на каждое заболевание). При этом кровь должна пропитать бумагу насквозь. В дальнейшем медико-генетическая лаборатория будет на основе сухого пятна крови определять наличие заболевания у ребенка.
 Анализ делается в течение десяти дней. Тест-бланк имеет еще другую (паспортную) часть. В ней указываются личные данные ребенка, телефоны и адреса, по которым можно связаться с ними и/или с учреждением, где будет наблюдаться ребенок после выписки. К заполнению этих данных нужно подойти крайне серьезно и внимательно. В противном случае положительный ответ обследования о наличие болезни может вовремя не найти адресата. И будет упущено время.
Анализ делается в течение десяти дней. Тест-бланк имеет еще другую (паспортную) часть. В ней указываются личные данные ребенка, телефоны и адреса, по которым можно связаться с ними и/или с учреждением, где будет наблюдаться ребенок после выписки. К заполнению этих данных нужно подойти крайне серьезно и внимательно. В противном случае положительный ответ обследования о наличие болезни может вовремя не найти адресата. И будет упущено время.
Что дает неонатальный скрининг?
- Довольно раннее обследование дает возможность выявить генетические болезни обмена веществ на доклиническом этапе. То есть, когда нет никаких проявлений патологии. Вместе с тем, если в этот период своевременно начато лечение, то шансы на благоприятный исход болезни гораздо выше.
Можно ли отказаться от скрининга, если родители здоровы?
- Это очень частый вопрос родителей, которые беспокоятся о том, что у их крошки берут «целую кучу» анализов. А они при этом вполне здоровые родители.
 Так вот, все вышеописанные болезни наследуются по аутосомно-рецессивному типу. То есть, когда родители здоровы, но являются носителями дефектного гена. Само по себе носительство таких генов не приводит к развитию болезни. Да и вообще никак не проявляется. А вот если такие носители встречаются и передают ребенку каждый по дефектному гену, то ребенок родится больным. Именно комбинация двух дефектных генов – от папы и от мамы – проявляется заболеванием. Поэтому видимое здоровье родителей не может гарантировать рождение полностью здорового малыша. Хочется уточнить, что не нужно проявлять напрасного беспокойства и отказываться от скрининга. Нельзя лишать ребенка возможности быстро выявить практически неизлечимые и быстро прогрессирующие болезни.
Так вот, все вышеописанные болезни наследуются по аутосомно-рецессивному типу. То есть, когда родители здоровы, но являются носителями дефектного гена. Само по себе носительство таких генов не приводит к развитию болезни. Да и вообще никак не проявляется. А вот если такие носители встречаются и передают ребенку каждый по дефектному гену, то ребенок родится больным. Именно комбинация двух дефектных генов – от папы и от мамы – проявляется заболеванием. Поэтому видимое здоровье родителей не может гарантировать рождение полностью здорового малыша. Хочется уточнить, что не нужно проявлять напрасного беспокойства и отказываться от скрининга. Нельзя лишать ребенка возможности быстро выявить практически неизлечимые и быстро прогрессирующие болезни.
Как и когда узнавать результаты неонатального скрининга?
- Результаты скрининга будут готовы через десять дней. В случае отрицательного ответа (то есть, все в порядке) родителям не сообщается лично результат генетического тестирования.
 Положительный результат (выявлена проблема по какому-либо из заболеваний) сообщается незамедлительно родителям и в медучреждение, где наблюдается малыш. Поэтому, если вам результаты скрининга не сообщили, это не значит, что про вас забыли или потеряли ваш анализ. Сложившаяся система скрининга не имеет возможности предоставить результаты лично всем и каждому. Беспокоиться по этому поводу совсем не нужно. Наоборот, если вас не побеспокоили звонком или письмом из генетической консультации, нужно радоваться.
Положительный результат (выявлена проблема по какому-либо из заболеваний) сообщается незамедлительно родителям и в медучреждение, где наблюдается малыш. Поэтому, если вам результаты скрининга не сообщили, это не значит, что про вас забыли или потеряли ваш анализ. Сложившаяся система скрининга не имеет возможности предоставить результаты лично всем и каждому. Беспокоиться по этому поводу совсем не нужно. Наоборот, если вас не побеспокоили звонком или письмом из генетической консультации, нужно радоваться.
Что такое аудиологический скрининг?
- С 2008 года в России всем новорожденным проводят аудиологический скрининг. Это обследование позволяет определить функцию слуха у малышей. Проводят его на 4-е сутки жизни . Процедура не имеет противопоказаний. Абсолютно безболезненный и не несущий угрозу для здоровья младенца метод позволяет определить нарушения слуха на самых ранних этапах развития младенца.
- Тогда, когда родители и врачи еще имеют в запасе время, чтобы предпринять меры по улучшению слуха малыша.
 Ведь доказано, что коррекция слуха до трехмесячного возраста малыша дает возможность нормального развития речи у ребенка. Первые полгода жизни малыша процесс речевого развития проходит самый интенсивный этап, несмотря на то, что внешне это практически не проявляется.
Ведь доказано, что коррекция слуха до трехмесячного возраста малыша дает возможность нормального развития речи у ребенка. Первые полгода жизни малыша процесс речевого развития проходит самый интенсивный этап, несмотря на то, что внешне это практически не проявляется.
Техника проведения аудиологического скрининга?
- Суть метода заключается в воздействии на определенный отдел внутреннего уха – улитку. Именно она отвечает за восприятие и распознавание звука. Врач использует электроакустический зонд, который имеет микроскопический сверхчувствительный микрофон. Сам зонд соединен с монитором, на котором фиксируется результат проведенной процедуры. Зонд вставляется в наружный слуховой проход ребенку. Прибор посылает звуки разной частоты, подобно щелчкам и фиксирует колебания волосковых клеток в улитке уха. Важным моментом является то, что во время проведения обследования малыш должен находиться в полной тишине. Лучше, когда малыш будет спать. При этом даже сосание пустышки в момент процедуры недопустимо.

- На этом первый этап скрининга завершен. Детям, которые прошли его успешно, второй этап скрининга не нужен. За исключением детей из группы риска. Группа риска – это дети, у которых:
отягощенная наследственность по тугоухости;
недоношенность; маловесность;
асфиксия (кислородное голодание) в родах;
гестоз или тяжелый токсикоз матери во время беременности;
прием ототоксичных антибиотиков матерью при беременности. - Такие малыши, вне зависимости от результатов первого этапа скрининга, должны повторно пройти скрининг до 3 месяцев. Ведь тугоухость зачастую развивается постепенно.
При получении сомнительного или неудовлетворительного результата обследования в роддоме ребенок направляется на повторное обследование в возрасте 1-1,5 месяца в условиях поликлиники. - При подтверждении проблем со слухом малыш направляется в сурдологический центр, где специалисты обследуют и подскажут пути решения нарушений слуха у малютки. Ведь только своевременная диагностика и незамедлительное лечение дает шанс детям с тугоухостью расти и развиваться также как их сверстники.

Charité – Universitätsmedizin Berlin: 404
Die von Ihnen angeforderte Seite konnte leider nicht gefunden werden.
The page you are looking for was not found.
запрашиваемая вами страница не найдена.
Dies kann mehrere Ursachen haben:
- Sie sind über einen veralteten Link hierher gekommen.
Der Webauftritt der Charité wurde im November 2015 komplett überarbeitet. - Die Seite, die Sie aufgerufen haben, ist veraltet und daher vom Server genommen worden.
- Sie haben sich beim Eingeben der Adresse vertippt oder haben die Groß- und Kleinschreibung nicht genau übernommen.
Sie können folgendes tun, um die gewünschten Informationen dennoch zu erhalten:
- Gehen Sie auf unsere Startseite, um von dort auf die von Ihnen gesuchte Seite zu gelangen.
- Benutzen sie die Suche (rechts oben), um die von Ihnen gewünschten Informationen zu finden.
Unser Server hat diesen Fehler protokolliert und wir werden ihn gegebenenfalls reparieren.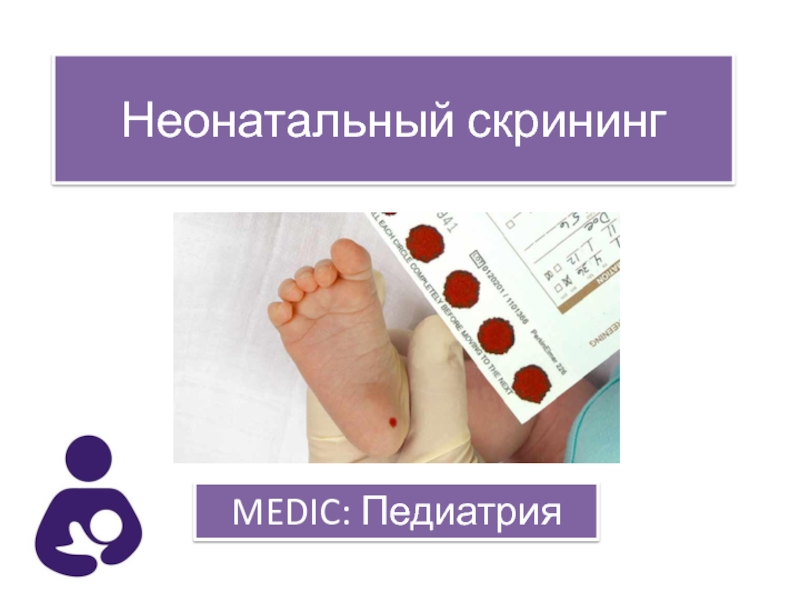
Bei Fragen wenden Sie sich bitte an unseren Webmaster.
Error 404 — The page you are looking for was not found
This error message could have the following reasons:
- The page you tried to call was out of date and we removed it from the server.
The website of the Charité has been relaunched in November 2015. - You typed in the address incorrectly or did not match the case exactly.
You can do the following to get the information you are looking for:
- Go to our homepage to access the page, you are looking for from there.
- Search for your keyword (see upper right corner) to find the information you are looking for.
The error has been logged and will be fixed if necessary.
Please contact our webmaster if you need further assistance.
Ошибка 404: запрашиваемая вами страница не найдена.
Это может быть вызвано следующим:
- Вы использовали устаревшую ссылку.

Интернет-ресурс Шарите был полностью переработан в начале ноября 2015 года. - Запрашиваемая вами страница устарела и удалена с сервера.
- Вы ошиблись при вводе адреса страницы или использовали неверный регистр.
Чтобы получить необходимую информацию, вы можете сделать следующее:
- Перейдите на главную страницу, а оттуда перейдите на желаемую страницу.
- Воспользуйтесь поиском (справа вверху), чтобы найти нужную вам информацию.
Наш сервер занес ошибку в протокол, и мы постараемся исправить ее.
При возникновении вопросов обратитесь к веб-администратору.
Врожденный гипотиреоз (для родителей) — Nemours KidsHealth
Что такое щитовидная железа?
Щитовидная железа представляет собой небольшую железу под кожей и мышцами на передней части шеи, в том месте, где будет лежать галстук-бабочка.
Он коричневато-красный, с левой и правой половинками (называемыми лепестками), которые выглядят как крылья бабочки. Он весит меньше унции, но помогает организму выполнять многие функции, например получать энергию из пищи, расти и проходить половое развитие.
Он весит меньше унции, но помогает организму выполнять многие функции, например получать энергию из пищи, расти и проходить половое развитие.
Что такое гипотиреоз?
Гипотиреоз (или пониженная активность щитовидной железы ) — это когда щитовидная железа не вырабатывает достаточного количества некоторых важных гормонов. Это заставляет организм медленнее расходовать энергию, а химическая активность (обмен веществ) в клетках замедляется.
Гипотиреоз является распространенным заболеванием, особенно у взрослых женщин.
Что такое врожденный гипотиреоз?
У детей тоже может быть гипотиреоз.Когда ребенок рождается с ним, это называется врожденным гипотиреозом .
У других детей он развивается позже, обычно в позднем детстве или в подростковом возрасте. Большинство этих случаев вызвано вирусом
. аутоиммунное заболевание тиреоидит Хашимото.Каковы признаки и симптомы врожденного гипотиреоза?
Ранние признаки врожденного гипотиреоза у ребенка включают:
- желтуха (пожелтение кожи или глаз)
- спать дольше или чаще, чем обычно
- запор
- большое мягкое пятно (родничок) на голове
- большой опухший язык
- слабый («вялый») мышечный тонус
- отек вокруг глаз
- плохой или медленный рост
- холодная бледная кожа
- большой живот с торчащим пупком
Без лечения у детей с врожденным гипотиреозом может развиться необратимая умственная отсталость. У них также может быть плохой аппетит и проблемы с дыханием.
У них также может быть плохой аппетит и проблемы с дыханием.
Что вызывает врожденный гипотиреоз?
Большинство случаев врожденного гипотиреоза происходит из-за неправильного формирования щитовидной железы у ребенка во время беременности. При рождении у ребенка может вообще отсутствовать щитовидная железа или иметь небольшую, частично развитую железу. Почему это происходит, часто неизвестно, но в некоторых случаях это генетическое заболевание.
Реже щитовидная железа ребенка полностью развилась, но не может вырабатывать нормальное количество гормонов щитовидной железы.Обычно это связано с генетической проблемой. Другие дети, рожденные от тех же родителей, имеют 1 из 4 шансов иметь такую же проблему со щитовидной железой.
Как диагностируется врожденный гипотиреоз?
Очень важно своевременно диагностировать и лечить гипотиреоз. Таким образом, тестирование щитовидной железы проводится у всех младенцев при рождении в рамках обычного скрининга новорожденных..png)
Образец крови из пятки проверяется на наличие:
- низкий уровень Т4 (тироксина), гормона, вырабатываемого щитовидной железой, который помогает контролировать обмен веществ и рост
- высокий уровень ТТГ (тиреотропного гормона), вырабатываемый гипофиздля стимуляции щитовидной железы и увеличения выработки ею тиреоидных гормонов
Если результаты скринингового теста новорожденных не соответствуют норме, для подтверждения диагноза проводятся другие анализы крови.Иногда врачи назначают визуализирующие исследования, такие как УЗИ или сканирование щитовидной железы, чтобы получить больше информации.
Как лечится врожденный гипотиреоз?
Ребенку с гипотиреозом будут принимать гормоны щитовидной железы, чтобы компенсировать то, что щитовидная железа не может вырабатывать. Большинству детей необходимо принимать лекарство всю оставшуюся жизнь.
Некоторые младенцы рождаются с временным гипотиреозом. Это может быть вызвано такими вещами, как преждевременные роды, заболевание щитовидной железы у матери или лекарства, которые мать принимала во время беременности. Эта форма гипотиреоза обычно проходит сама по себе в первые недели или месяцы жизни.
Эта форма гипотиреоза обычно проходит сама по себе в первые недели или месяцы жизни.
Как я могу помочь своему ребенку?
Если у вашего ребенка гипотиреоз, очень важно давать гормоны щитовидной железы в соответствии с указаниями врача.
Если ваш ребенок слишком мал, чтобы разжевать или проглотить таблетку, раздавите ее и смешайте с небольшим количеством воды, детской смеси, не содержащей сои, или грудного молока. Убедитесь, что ваш ребенок выпивает всю жидкость. Некоторые таблетки гормонов щитовидной железы легче растворяются в жидкости, чем другие, поэтому поговорите со своим врачом, если у вас возникли проблемы с этим.
Некоторые детские смеси (особенно соевые смеси), лекарства и минеральные добавки (например, кальций и железо) могут препятствовать всасыванию препаратов щитовидной железы. Проконсультируйтесь со своим врачом о том, как и когда давать другие лекарства или добавки, пока ваш ребенок принимает гормоны щитовидной железы.
Что еще я должен знать?
Ваш врач будет регулярно осматривать вашего ребенка, чтобы убедиться, что лекарство работает, и изменять дозу по мере роста вашего ребенка. Обязательно посещайте все последующие визиты к врачу.
Обязательно посещайте все последующие визиты к врачу.
У детей с врожденным гипотиреозом иногда могут развиваться проблемы со слухом. Если у вас есть какие-либо опасения по поводу слуха или развития речи вашего ребенка, поговорите со своим врачом.
Мочевая болезнь кленового сиропа (для родителей)
Что такое кленовый сироп?
Болезнь мочи с кленовым сиропом (MSUD) — это редкое нарушение обмена веществ, с которым рождаются некоторые младенцы. Это вызвано дефектом ферментов, расщепляющих некоторые аминокислоты.
У большинства новорожденных в Соединенных Штатах кровь проверяют на MSUD в рамках скрининга новорожденных. Это позволяет врачам сразу начать лечение, обычно со специальной диетой, чтобы предотвратить проблемы.
Каковы признаки и симптомы заболевания мочи кленовым сиропом?
У новорожденных с MSUD моча или ушная сера пахнут сладко, как кленовый сироп. Они также могут:
- есть проблемы с кормлением
- рвота
- быть суетливым или раздражительным
- пронзительно кричать
- имеют низкий уровень энергии и очень хотят спать
У младенца или ребенка с MSUD также может быть:
- проблемы с ростом и набором веса
- необычные движения мышц и напряжение мышц
- задержки развития
- изъятия
Что вызывает заболевание мочи кленовым сиропом?
Аминокислоты помогают детям расти и развиваться. Организм использует их для производства белков. В МСУД три аминокислоты — лейцин, изолейцин и валин — не расщепляются. Эти аминокислоты и их побочные продукты затем накапливаются в крови, повреждая мозг и другие органы.
Организм использует их для производства белков. В МСУД три аминокислоты — лейцин, изолейцин и валин — не расщепляются. Эти аминокислоты и их побочные продукты затем накапливаются в крови, повреждая мозг и другие органы.
MSUD возникает, когда происходит изменение (мутация) в генах, которые производят ферменты, расщепляющие эти три аминокислоты, содержащиеся в пище.
Чтобы иметь MSUD, ребенок должен унаследовать два измененных гена MSUD, по одному от каждого родителя. Родители, у которых есть один измененный ген, не имеют никаких симптомов, но могут передать ген своим детям.В США MSUD чаще всего встречается в некоторых общинах меннонитов.
Как диагностируется заболевание мочи кленовым сиропом?
В США врачи проводят анализ крови для проверки младенцев на MSUD в рамках скрининга новорожденных.
У детей с более легкими формами MSUD не может быть диагностирован, пока они не станут старше и не начнут проявляться симптомы. Если врачи подозревают MSUD, они проверяют уровень аминокислот в крови и других кислот в моче.
Врач может порекомендовать генетическое тестирование, если ребенок родился в семье с историей MSUD.
Как лечится кленовый сироп?
Основным методом лечения MSUD является низкобелковая диета с низким уровнем трех аминокислот. Младенцы с MSUD должны быть переведены на специальную смесь как можно раньше. Затем они всю оставшуюся жизнь будут соблюдать специальную диету. Некоторым также необходимо принимать пищевые добавки. Соблюдение этой диеты поможет предотвратить проблемы, связанные с MSUD.
Ваш врач будет регулярно проверять уровень аминокислот в крови вашего ребенка.Работа с командой здравоохранения, включая диетолога, который специализируется на нарушениях обмена веществ, таких как MSUD, может помочь сохранить эти уровни в приемлемом диапазоне.
Врачи могут порекомендовать трансплантацию печени некоторым детям с тяжелым MSUD.
Когда я должен позвонить врачу?
Болезнь кленового сиропа поддается лечению при раннем обнаружении. Врачи будут внимательно наблюдать за детьми, у которых он есть.
Врачи будут внимательно наблюдать за детьми, у которых он есть.
У некоторых людей с MSUD могут быть эпизоды метаболического криза. Они вызваны стрессом, например:
- болезнь
- травма
- упражнение
- долгое время без еды
Немедленно позвоните своему врачу, если ваш ребенок заболел, у него жар, он плохо ест или очень хочет спать, или если вы заметили проблемы с равновесием, трудности при ходьбе или изменения в поведении.
Что еще я должен знать?
Поскольку MSUD является генетическим заболеванием, вы можете поговорить с консультантом-генетиком о тестировании других членов семьи и узнать, как MUSD протекает в семьях. Вы также можете найти дополнительную информацию и поддержку в Интернете по телефону:
Скрининг новорожденных — Департамент здравоохранения штата Миссисипи
Скрининг новорожденных проверяет младенцев на наличие наследственных заболеваний, которые могут угрожать здоровью или благополучию вашего нового ребенка.
Генетические нарушения включают врожденные дефекты и врожденные нарушения обмена веществ, с которыми может родиться ваш ребенок.Генетические нарушения не лечатся. Однако их можно лечить, чтобы уменьшить их влияние на вашего ребенка на протяжении всей его или ее жизни. Скрининг новорожденных может выявить многие типы генетических нарушений на ранней стадии, чтобы лечение было наиболее эффективным.
Генетическая консультация предлагается родителям детей с генетическими нарушениями. Врач объяснит, что такое генетические нарушения, как работает генетическое тестирование и как понять результаты, чтобы помочь спланировать будущее вашего ребенка.
Скрининг новорожденных
Скрининг новорожденных — это анализ крови, позволяющий выявить наиболее распространенные генетические нарушения.Младенцы могут быть проверены вскоре после рождения, чтобы обнаружить и устранить любые проблемы как можно скорее.
Ранний скрининг — единственный способ обнаружить эти расстройства и предотвратить постоянное
ущерб вашему ребенку .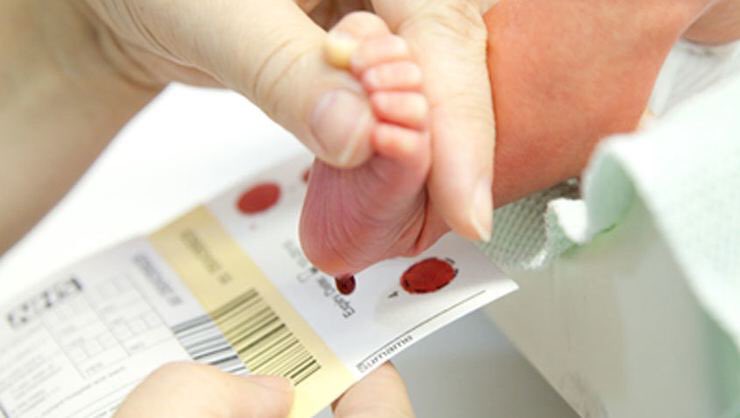 Раннее выявление означает, что можно начать лечение, которое поможет вашему ребенку вести нормальную жизнь.
Раннее выявление означает, что можно начать лечение, которое поможет вашему ребенку вести нормальную жизнь.
Что мы тестируем
Мы проверяем новорожденных из Миссисипи на широкий спектр генетических нарушений.
Ежегодно в рамках программы скрининга новорожденных публикуется сводка за пять лет о генетических нарушениях, обнаруженных у младенцев из Миссисипи в результате скрининга новорожденных.
Следующие родильные дома получили признание за достижение уровня ошибок менее 1% при сборе образцов для скрининга новорожденных. Их тяжелая работа и постоянные усилия установили стандарт для других родильных домов в штате.
Врожденные дефекты
Врожденные дефекты являются основной причиной смерти в первый год жизни. Хотя все причины врожденных дефектов неизвестны, некоторые врожденные дефекты можно предотвратить. Миссисипи ведет реестр врожденных дефектов, чтобы отслеживать и лучше понимать врожденные дефекты в штате.
Вопросы и ответы
Что такое скрининг новорожденных?
Скрининг новорожденных — это анализ небольшого образца крови, который проводится у новорожденных перед их выпиской из больницы. Скрининг проводится перед выпиской, чтобы как можно скорее выявить серьезные заболевания, которые могут потребовать особого ухода или дальнейшего тестирования.
Скрининг проводится перед выпиской, чтобы как можно скорее выявить серьезные заболевания, которые могут потребовать особого ухода или дальнейшего тестирования.
Зачем моему ребенку проходить обследование?
Заболевания, на наличие которых ваш ребенок будет обследован, встречаются редко.Однако некоторые из них также очень серьезны и могут привести к умственной отсталости или смерти, если их не лечить. Младенцы с этими состояниями кажутся нормальными при рождении. Только со временем это состояние влияет на умственное или физическое развитие ребенка, вызывая другие проблемы со здоровьем, которые могут привести к необратимому повреждению. Скрининг новорожденных помогает выявить детей, нуждающихся в лечении, например, в медикаментозном лечении или специальной диете.
Скрининговые тесты новорожденных надежны, но не всегда могут выявить расстройство.Если ваш ребенок болен, поговорите с врачом ребенка как можно скорее.
Мой ребенок выглядит здоровым. Скрининг все еще необходим?
ДА! Большинство младенцев с заболеванием, обнаруженным при скрининге новорожденных, не проявляют признаков заболевания сразу после рождения. Скрининг обычно позволяет выявить проблему до того, как ребенок заболеет, и вовремя оказать специальную медицинскую помощь.
Скрининг обычно позволяет выявить проблему до того, как ребенок заболеет, и вовремя оказать специальную медицинскую помощь.
Должен ли я давать разрешение на обследование моего ребенка на эти заболевания?
№Закон (Статут штата Миссисипи 41-21-201) требует, чтобы все дети, рожденные в штате Миссисипи, перед выпиской из больницы проходили обследование, независимо от возраста ребенка или статуса кормления. Единственная юридическая причина для того, чтобы не взять образец для скрининга, — это возражение родителей против такого тестирования по религиозным причинам.
Могу ли я отказаться от проверочного теста?
Как родитель, вы можете отказаться от скрининга новорожденных только в том случае, если ваши религиозные убеждения и обычаи не позволяют это тестирование. Если вы отказываетесь от обследования вашего ребенка, вас могут попросить подписать форму, в которой будет указано, что вы отказались от обследования вашего ребенка на эти очень серьезные заболевания. Эта форма войдет в медицинскую карту вашего ребенка.
Эта форма войдет в медицинскую карту вашего ребенка.
Взимается ли плата за скрининговый тест?
Да. Небольшая плата взимается с больницы, где родился ваш ребенок.
Являются ли генетические нарушения серьезными?
Некоторые генетические нарушения являются серьезными; некоторые даже опасны для жизни. Другие замедляют физическое развитие или вызывают умственную отсталость. К сожалению, у большинства младенцев с этими расстройствами поначалу не наблюдается явных признаков заболевания. Хорошая новость заключается в том, что правильный скрининг при рождении может выявить эти проблемы на ранней стадии.При ранней диагностике и лечении некоторые генетические заболевания часто можно эффективно лечить.
На какие заболевания в настоящее время проверяют в штате Миссисипи?
Когда и как проводится скрининговый тест?
Некоторые генетические нарушения являются серьезными; некоторые даже опасны для жизни. Другие замедляют физическое развитие или вызывают умственную отсталость.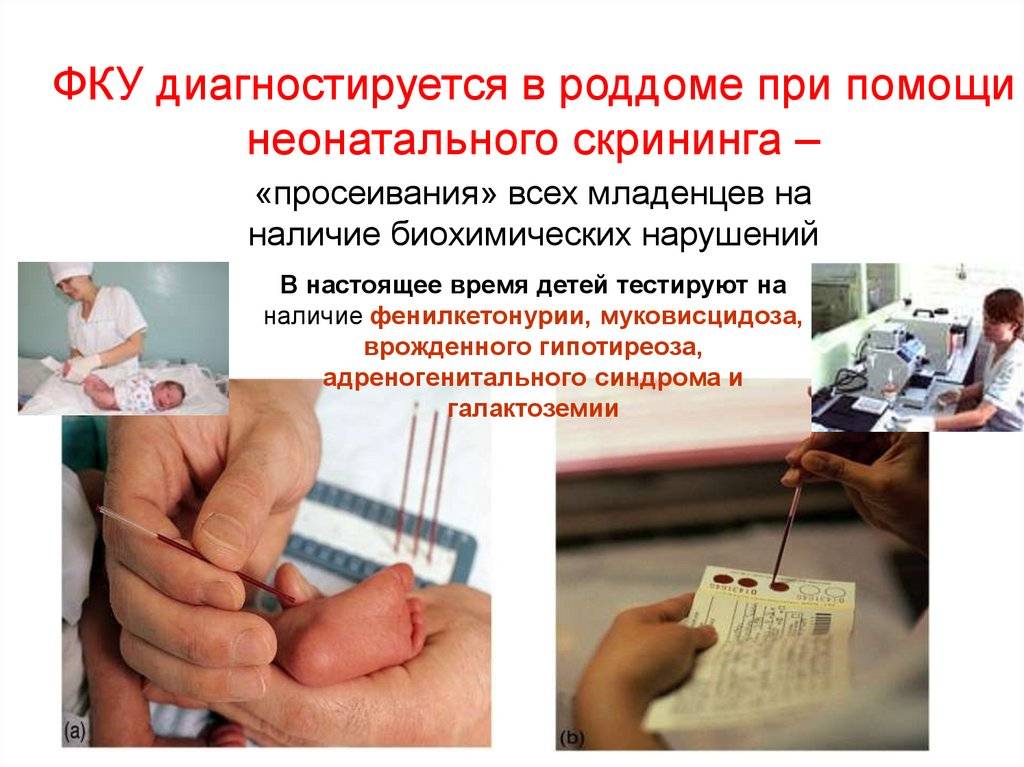 К сожалению, у большинства младенцев с этими расстройствами поначалу не наблюдается явных признаков заболевания. Хорошая новость заключается в том, что правильный скрининг при рождении может выявить эти проблемы на ранней стадии.При ранней диагностике и лечении некоторые генетические заболевания часто можно эффективно лечить.
К сожалению, у большинства младенцев с этими расстройствами поначалу не наблюдается явных признаков заболевания. Хорошая новость заключается в том, что правильный скрининг при рождении может выявить эти проблемы на ранней стадии.При ранней диагностике и лечении некоторые генетические заболевания часто можно эффективно лечить.
Образец для скрининга обычно собирают в возрасте от 24 до 48 часов. Несколько капель крови берут, прокалывая пятку ребенка и капая кровь на специальную карточку для скрининга новорожденных, которую отправляют в скрининговую лабораторию.
Сообщат ли мне результаты обследования новорожденных?
Результаты отправлены по почте в роддом. Зарегистрированный врач будет уведомлен о любых аномальных результатах скрининга новорожденных Департаментом здравоохранения штата Миссисипи.Очень важно, чтобы в больнице была указана правильная фамилия родителей, фактический адрес и рабочий номер телефона. Врач вашего ребенка может запросить результаты скрининга вашего ребенка в больнице или позвонить в Программу генетических услуг Департамента здравоохранения штата Миссисипи, чтобы получить результаты скрининга. Спросите врача вашего ребенка о результатах скрининга при первом осмотре ребенка.
Спросите врача вашего ребенка о результатах скрининга при первом осмотре ребенка.
Если запрашивается повторный скрининг, означает ли это, что у моего ребенка может быть заболевание?
Не обязательно.Существует несколько причин, по которым может потребоваться повторный скрининг. Если скрининг проведен неправильно, потребуется повторный тест. Если образец крови взят слишком рано, необходим повторный скрининг. Необходимость повторного тестирования по этим причинам не означает, что с вашим ребенком что-то не так; это означает, что необходим еще один образец, чтобы скрининг можно было провести должным образом.
Если первый скрининг показал отклонения от нормы в отношении одного из состояний, может потребоваться второй, подтверждающий скрининг. Ненормальный результат скринингового теста , а не означает, что у вашего ребенка есть проблемы.Скрининг выявляет тех детей, которым может потребоваться более конкретное тестирование для точного выявления расстройства. Этот второй, подтверждающий тест показывает, действительно ли есть ли у вашего ребенка заболевание.
Этот второй, подтверждающий тест показывает, действительно ли есть ли у вашего ребенка заболевание.
Можно ли вылечить эти состояния?
Лекарство от этих состояний неизвестно. Серьезные последствия этих состояний можно уменьшить с помощью специальной диеты, медицинского лечения или другого вмешательства, если оно начато на ранней стадии.
Если у моего ребенка есть одно из этих состояний, значит ли это, что мои будущие дети также будут затронуты?
Ваш врач может обсудить это с вами или направить вас к специалисту.Эти специалисты располагают информацией о конкретном заболевании и о том, как оно передается по наследству. Они могут помочь вам понять любой риск для ваших будущих детей.
Какова частота этих заболеваний в штате Миссисипи?
См. наш Отчет о скрининге новорожденных за 2003–2008 гг.
У моего новорожденного положительный результат теста на кистозный фиброз. Что это значит?
Большинство новорожденных с положительным тестом имеют , а не муковисцидоз. У Фонда кистозного фиброза есть раздел вопросов и ответов, который отвечает на большинство распространенных вопросов о скрининге на муковисцидоз и о заболевании:
У Фонда кистозного фиброза есть раздел вопросов и ответов, который отвечает на большинство распространенных вопросов о скрининге на муковисцидоз и о заболевании:
Узнать больше
Дополнительная информация
Сопутствующие услуги
Ссылки на другие ресурсы
Мы хотим услышать от вас о потребностях и программах охраны здоровья матери и ребенка в штате Миссисипи.Найдите минутку, чтобы поделиться своими идеями и опасениями с нами.
Отправьте нам сообщение »
ОБМ Генетика | Скрининг новорожденных на генетические заболевания: обзор текущих и будущих приложений
Открытый доступ ОбзорДамьен Бувье 1 , Ив Жигер 2, 3, *
1. Кафедра биохимии и молекулярной генетики, CHU Клермон-Ферран, Клермон-Ферран, Франция, и Университет Клермон-Овернь, медицинский факультет, CNRS 6293, INSERM 1103, GReD, Клермон-Ферран, Франция
2. Centre de Recherche du CHU de Québec-Université Laval, Квебек, Канада
Centre de Recherche du CHU de Québec-Université Laval, Квебек, Канада
3. Кафедра молекулярной биологии, медицинской биохимии и патологии, медицинский факультет, Университет Лаваля, Квебек, Канада
* Корреспонденция: Ив Жигер
Академический редактор: Джоан Трегер-Синодинос и Франсуа Руссо
Специальный выпуск: Генетический скрининг
Получено: 01 июля 2019 г. | Принято: 04 сентября 2019 г. | Опубликовано: 6 сентября 2019 г.
OBM Genetics 2019 , Том 3, Выпуск 3, doi:10.21926/обм.генет.13
Рекомендуемая ссылка: Bouvier D, Giguère Y. Скрининг новорожденных на генетические заболевания: обзор текущих и будущих приложений. ОБМ Генетика 2019 ;3(3):14; doi:10.21926/obm.genet.13.
© 2019 авторами. Это статья с открытым доступом, распространяемая на условиях лицензии Creative Commons by Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе или в любом формате при условии правильного цитирования оригинальной работы.
Скрининг новорожденных (NBS) на врожденные нарушения метаболизма (IEM) был введен более 50 лет назад с тестированием фенилкетонурии (PKU) с использованием пятен крови, нанесенных на фильтровальную бумагу после укола из пятки. NBS направлена на раннее выявление наследственных заболеваний после рождения, при которых клиническое ведение и предсимптоматическое лечение значительно снизят заболеваемость и смертность. В то время как NBS для некоторых других расстройств был внедрен в некоторых конкретных юрисдикциях в последующие десятилетия, именно с введением тандемной масс-спектрометрии (MSMS) к концу 1990-х годов действительно произошло расширение NBS.MSMS оказала огромное влияние на NBS, но привела к неоднородности панели расстройств NBS между юрисдикциями, которые вводили новые условия с разной скоростью, используя разные процессы принятия решений. В дополнение к заболеваниям, тестируемым с помощью MSMS, многие программы включают другие наследственные заболевания с использованием различных методологий тестирования, включая кистозный фиброз (CF), серповидно-клеточную анемию (SCD), в то время как некоторые другие заболевания были недавно введены в некоторых юрисдикциях или находятся на рассмотрении, например как тяжелый комбинированный иммунодефицит (SCID), лизосомные болезни накопления и X-сцепленная адренолейкодистрофия (X-ALD). Поскольку стоимость тестирования ДНК снижается, будущее NBS неизбежно будет включать в себя секвенирование генома, которое предоставит возможность обнаруживать, лечить и предотвращать более серьезные заболевания с ранним началом в интересах новорожденных, при условии, что органы общественного здравоохранения примут решение об этом. этические и политические вопросы, такие как идентификация варианта неизвестного значения и раскрытие случайных находок. Наконец, несмотря на текущие захватывающие технологические достижения в области NBS в Северном полушарии, мы не должны закрывать глаза на то, что, несмотря на различные инициативы, около двух третей новорожденных, родившихся в районах с низким уровнем ресурсов, все еще ждут доступа к NBS .
Поскольку стоимость тестирования ДНК снижается, будущее NBS неизбежно будет включать в себя секвенирование генома, которое предоставит возможность обнаруживать, лечить и предотвращать более серьезные заболевания с ранним началом в интересах новорожденных, при условии, что органы общественного здравоохранения примут решение об этом. этические и политические вопросы, такие как идентификация варианта неизвестного значения и раскрытие случайных находок. Наконец, несмотря на текущие захватывающие технологические достижения в области NBS в Северном полушарии, мы не должны закрывать глаза на то, что, несмотря на различные инициативы, около двух третей новорожденных, родившихся в районах с низким уровнем ресурсов, все еще ждут доступа к NBS .
Скрининг новорожденных; генетические заболевания; секвенирование нового поколения; малоресурсные районы
1. Скрининг новорожденных тогда и сейчас: обзор В 1961 году доктор Роберт Гатри описал метод тестирования новорожденных на фенилкетонурию (ФКУ). Первое заболевание, выявленное при скрининге, ФКУ, представляет собой редкий, рецессивно наследуемый дефицит фермента фенилаланингидроксилазы, который обычно приводит к тяжелой умственной отсталости, если его не лечить с раннего младенчества [-1].Доктор Гатри предложил простой метод отбора проб крови, который включал измерение фенилаланина в образцах крови пяточной палочки, высушенных на фильтровальной бумаге. Преимущества высушенных пятен крови на фильтровальной бумаге заключаются в том, что сбор образцов становится проще, а логистические аспекты, связанные с хранением образцов и их отправкой почтовыми службами в центральную лабораторию для тестирования, могут быть относительно ограничены без необходимости использования холодильника или сухого льда []. 2 ].
Первое заболевание, выявленное при скрининге, ФКУ, представляет собой редкий, рецессивно наследуемый дефицит фермента фенилаланингидроксилазы, который обычно приводит к тяжелой умственной отсталости, если его не лечить с раннего младенчества [-1].Доктор Гатри предложил простой метод отбора проб крови, который включал измерение фенилаланина в образцах крови пяточной палочки, высушенных на фильтровальной бумаге. Преимущества высушенных пятен крови на фильтровальной бумаге заключаются в том, что сбор образцов становится проще, а логистические аспекты, связанные с хранением образцов и их отправкой почтовыми службами в центральную лабораторию для тестирования, могут быть относительно ограничены без необходимости использования холодильника или сухого льда []. 2 ].
Быстро штаты США сотрудничали во внедрении всеобщего скрининга, и уже в 1963 г. было обследовано более 400 000 новорожденных из 29 штатов, что выявило 37 случаев ФКУ.Все больные дети получали диету с низким содержанием фенилаланина к возрасту 1 месяца, и была четко показана целесообразность массового скрининга [ 3 ]. К 1965 г. скрининг новорожденных (NBS) в США проводился в 32 штатах, в том числе в 27 штатах был введен обязательный скрининг [ 4 ]. В последующие годы многие другие страны западного мира внедрили скрининг новорожденных на ФКУ. Следующий прорыв в скрининге новорожденных произошел в 1975 г., когда Жан Дюссо опубликовал метод скрининга новорожденных на врожденный гипотиреоз (ВГ) с использованием той же фильтровальной бумаги, что и при ФКУ [ 5 ].Большинство развитых стран внедрили скрининг на ФКУ и ВГ в 1970-х годах.
К 1965 г. скрининг новорожденных (NBS) в США проводился в 32 штатах, в том числе в 27 штатах был введен обязательный скрининг [ 4 ]. В последующие годы многие другие страны западного мира внедрили скрининг новорожденных на ФКУ. Следующий прорыв в скрининге новорожденных произошел в 1975 г., когда Жан Дюссо опубликовал метод скрининга новорожденных на врожденный гипотиреоз (ВГ) с использованием той же фильтровальной бумаги, что и при ФКУ [ 5 ].Большинство развитых стран внедрили скрининг на ФКУ и ВГ в 1970-х годах.
В течение следующих двух десятилетий было очень мало инициатив по добавлению других заболеваний в программы NBS, таких как врожденная гиперплазия коры надпочечников (CAH), гемоглобинопатии, дефицит биотинидазы и муковисцидоз (CF) [ 6 ]. Некоторые из дополнительных расстройств, добавленных в ограниченную панель NBS, включали те, для которых была высокая распространенность в соответствующей юрисдикции. Например, NBS для лечения наследственной тирозинемии типа 1 (HT1) из-за дефицита фумарилацетоацетатгидроксилазы была добавлена в 1970 году в Квебеке, где генетический эффект основателя во франко-канадской популяции привел к увеличению распространенности заболевания [7].Сначала HT1 был проверен с помощью измерения тирозина, но в конечном итоге сукцинилацетона, побочного продукта, который оказался более чувствительным и специфичным и стал скрининговым тестом уровня 1 st для HT1.
Например, NBS для лечения наследственной тирозинемии типа 1 (HT1) из-за дефицита фумарилацетоацетатгидроксилазы была добавлена в 1970 году в Квебеке, где генетический эффект основателя во франко-канадской популяции привел к увеличению распространенности заболевания [7].Сначала HT1 был проверен с помощью измерения тирозина, но в конечном итоге сукцинилацетона, побочного продукта, который оказался более чувствительным и специфичным и стал скрининговым тестом уровня 1 st для HT1.
В 1990-х годах разработка тандемной масс-спектрометрии с ионизацией электрораспылением (МСМС), технологии мультиплексной платформы, позволяющей проводить скрининг нескольких аналитов из одной капли крови и, таким образом, одновременно обнаруживать многие редкие наследственные заболевания после всего одной единственной инъекции в прибор, привела к к массовому расширению NBS [ 8 ].С тех пор во многих юрисдикциях постепенно осуществлялся собственный процесс принятия решений о расширении NBS, что привело к созданию разнородных панелей по расстройствам NBS. Некоторые страны приняли очень консервативный подход, включив лишь несколько заболеваний, в то время как другие значительно увеличили количество состояний, подлежащих скринингу, до более чем 30 в своей панели NBS. Еще больше усложняет ситуацию тот факт, что в некоторых странах, таких как США и Канада, нет программ NBS, утвержденных на национальном уровне, поскольку они подпадают под территориальные (штаты, провинции и т. д.) юрисдикции, каждая из которых может следовать своим собственным процессам расширения NBS.Однако в Соединенных Штатах, чтобы уменьшить неоднородность между штатами между панелями NBS по расстройствам, что вызвало обеспокоенность групп защиты справедливости [ 9 ], Консультативный комитет министра здравоохранения и социальных служб по наследственным расстройствам у новорожденных и детей (SACHDNC) поручил Американскому колледжу медицинской генетики предоставить секретарю национальные рекомендации NBS для рекомендуемой единообразной группы скрининга (RUSP): из 88 оцененных состояний это привело к принятию ядра из 29 состояний, подлежащих скринингу, и 25 состояний.
Некоторые страны приняли очень консервативный подход, включив лишь несколько заболеваний, в то время как другие значительно увеличили количество состояний, подлежащих скринингу, до более чем 30 в своей панели NBS. Еще больше усложняет ситуацию тот факт, что в некоторых странах, таких как США и Канада, нет программ NBS, утвержденных на национальном уровне, поскольку они подпадают под территориальные (штаты, провинции и т. д.) юрисдикции, каждая из которых может следовать своим собственным процессам расширения NBS.Однако в Соединенных Штатах, чтобы уменьшить неоднородность между штатами между панелями NBS по расстройствам, что вызвало обеспокоенность групп защиты справедливости [ 9 ], Консультативный комитет министра здравоохранения и социальных служб по наследственным расстройствам у новорожденных и детей (SACHDNC) поручил Американскому колледжу медицинской генетики предоставить секретарю национальные рекомендации NBS для рекомендуемой единообразной группы скрининга (RUSP): из 88 оцененных состояний это привело к принятию ядра из 29 состояний, подлежащих скринингу, и 25 состояний. вторичные целевые условия [ 10 ].Принятие RUSP в США привело к значительной гармонизации, хотя используемая методология обсуждалась [ 11 , 12 ]. Начиная с начальной версии, другие состояния, такие как тяжелый комбинированный иммунодефицит (SCID) [ 13 ] [ 14 ], X-сцепленная адренолейкодистрофия, критический врожденный порок сердца (CCHD) [ 15 ] (выполняется с помощью пульсоксиметрии ), болезнь Помпе и мукополисахаридоз I типа (MPS I), а также спинальную мышечную атрофию из-за гомозиготной делеции экзона 7 в SMN1 и скрининг слуха новорожденных [ 16 ] были включены в основные состояния RUSP, которые теперь представляет 35 условий [ 17 ].
вторичные целевые условия [ 10 ].Принятие RUSP в США привело к значительной гармонизации, хотя используемая методология обсуждалась [ 11 , 12 ]. Начиная с начальной версии, другие состояния, такие как тяжелый комбинированный иммунодефицит (SCID) [ 13 ] [ 14 ], X-сцепленная адренолейкодистрофия, критический врожденный порок сердца (CCHD) [ 15 ] (выполняется с помощью пульсоксиметрии ), болезнь Помпе и мукополисахаридоз I типа (MPS I), а также спинальную мышечную атрофию из-за гомозиготной делеции экзона 7 в SMN1 и скрининг слуха новорожденных [ 16 ] были включены в основные состояния RUSP, которые теперь представляет 35 условий [ 17 ].
Следует отметить, что методы скрининга лизосомных заболеваний также быстро развиваются. Тандемный масс-спектрометрический анализ, в котором ферментативная активность 9 лизосомальных ферментов (α-глюкозидаза, α-галактозидаза А, α-I-идуронидаза, кислая сфингомиелиназа, кислая β-глюкоцереброзидаза, галактоцереброзидаза, идуронат-2-сульфатаза, N-ацетил- галактозамин-6-сульфатаза, N-ацетилгалактозамин-4-сульфатаза) была разработана для скрининга болезни Помпе, болезни Фабри, болезни Гурлера, болезни Нимана-Пика-А/В, болезни Гоше, болезни Краббе, мукополисахаридоза II, IVA и VI , соответственно [ 18 ]. Пероксисомальные заболевания, такие как Х-сцепленная адренолейкодистрофия, также изучаются с помощью ЖХ-МСМС [ 19 ]. Некоторые состояния, такие как мышечная дистрофия Дюшенна, не включены в основные состояния RUSP, но подлежат скринингу у новорожденных в некоторых юрисдикциях [ 20 ]. Одобренные методы лечения мышечной дистрофии Дюшенна могут изменить естественное течение этого заболевания [ 21 ]. Чтобы избежать задержки диагностики и обеспечить оптимальное лечение, необходимо раннее выявление пациентов с помощью NBS.
Пероксисомальные заболевания, такие как Х-сцепленная адренолейкодистрофия, также изучаются с помощью ЖХ-МСМС [ 19 ]. Некоторые состояния, такие как мышечная дистрофия Дюшенна, не включены в основные состояния RUSP, но подлежат скринингу у новорожденных в некоторых юрисдикциях [ 20 ]. Одобренные методы лечения мышечной дистрофии Дюшенна могут изменить естественное течение этого заболевания [ 21 ]. Чтобы избежать задержки диагностики и обеспечить оптимальное лечение, необходимо раннее выявление пациентов с помощью NBS.
Если рекомендации ACMG и оказали какое-то влияние на процесс принятия решений за пределами США, они не получили поддержки во всем мире, скорее всего, потому, что разные юрисдикции оценивают актуальность условий, которые должны быть введены в их программы NBS, под разными углами, что приводит к различным интерпретации подобных критериев. В своем отчете Всемирной организации здравоохранения за 1968 г. Уилсон и Юнгнер определили 10 принципов и методов скрининга населения, которыми можно руководствоваться при выборе состояний, подходящих для скрининга (таблица 1) [ 22 ].Популяционный скрининг направлен на выявление расстройств, отвечающих тем критериям, которые в основном основаны на тяжести и естественном течении расстройства, способности выявить состояние на ранней досимптомной стадии с помощью приемлемого теста и доступности приемлемого лечения. Кроме того, они рассмотрели влияние скрининга на стоимость выявления случаев заболевания, которая должна быть экономически сбалансирована по отношению к медицинским расходам. Учитывая многочисленные технологические достижения, появившиеся с тех пор и сделавшие скрининг все более важной и противоречивой темой, обновленный отчет ВОЗ был опубликован через сорок лет после того, как были изложены классические критерии Вильсона и Юнгнера [ 23 ].Критерии ВОЗ не были специально направлены на генетическое применение и скрининг новорожденных, но они выдержали испытание временем.
Уилсон и Юнгнер определили 10 принципов и методов скрининга населения, которыми можно руководствоваться при выборе состояний, подходящих для скрининга (таблица 1) [ 22 ].Популяционный скрининг направлен на выявление расстройств, отвечающих тем критериям, которые в основном основаны на тяжести и естественном течении расстройства, способности выявить состояние на ранней досимптомной стадии с помощью приемлемого теста и доступности приемлемого лечения. Кроме того, они рассмотрели влияние скрининга на стоимость выявления случаев заболевания, которая должна быть экономически сбалансирована по отношению к медицинским расходам. Учитывая многочисленные технологические достижения, появившиеся с тех пор и сделавшие скрининг все более важной и противоречивой темой, обновленный отчет ВОЗ был опубликован через сорок лет после того, как были изложены классические критерии Вильсона и Юнгнера [ 23 ].Критерии ВОЗ не были специально направлены на генетическое применение и скрининг новорожденных, но они выдержали испытание временем. Хотя существует широкий консенсус в отношении этих популяционных критериев скрининга, существует вариабельность их интерпретации. Как упоминалось Wilcken и Wiley относительно NBS, на самом деле существует мало веских доказательств преимуществ скрининга [ 6 ], что, вероятно, объясняет, по крайней мере, в значительной части, различия в оценке релевантности состояний, подлежащих обследованию. между разными территориями [ 24 ].Необходимо учитывать не только преимущества, но и потенциальный вред для каждого состояния, добавленного в панель NBS, а именно увеличение ложноположительных результатов, ведущих к ненужным вмешательствам, а также потенциальный психологический стресс родителей и потенциальное искажение родительского восприятия о ребенка, в то время как расширенный скрининг может привести к появлению так называемых «пациентов в ожидании», то есть лиц с генетическим диагнозом, которые остаются бессимптомными в течение многих лет или десятилетий [ 25 ].
Хотя существует широкий консенсус в отношении этих популяционных критериев скрининга, существует вариабельность их интерпретации. Как упоминалось Wilcken и Wiley относительно NBS, на самом деле существует мало веских доказательств преимуществ скрининга [ 6 ], что, вероятно, объясняет, по крайней мере, в значительной части, различия в оценке релевантности состояний, подлежащих обследованию. между разными территориями [ 24 ].Необходимо учитывать не только преимущества, но и потенциальный вред для каждого состояния, добавленного в панель NBS, а именно увеличение ложноположительных результатов, ведущих к ненужным вмешательствам, а также потенциальный психологический стресс родителей и потенциальное искажение родительского восприятия о ребенка, в то время как расширенный скрининг может привести к появлению так называемых «пациентов в ожидании», то есть лиц с генетическим диагнозом, которые остаются бессимптомными в течение многих лет или десятилетий [ 25 ]. После проведения систематического обзора мировой литературы по критериям NBS Jansen et al. пришел к выводу, что, несмотря на общие черты, программы NBS используют разные подходы для изучения одних и тех же вопросов политики, в том числе: бенефициар NBS, определение критериев, способ оценки условий, уровень требуемых доказательств и рекомендации после оценки, что потенциально может привести к увеличение различий между программами NBS на международном уровне [ 26 ].
После проведения систематического обзора мировой литературы по критериям NBS Jansen et al. пришел к выводу, что, несмотря на общие черты, программы NBS используют разные подходы для изучения одних и тех же вопросов политики, в том числе: бенефициар NBS, определение критериев, способ оценки условий, уровень требуемых доказательств и рекомендации после оценки, что потенциально может привести к увеличение различий между программами NBS на международном уровне [ 26 ].
Таблица 1 Краткое изложение критериев скрининга Вильсона и Юнгнера 1968 г. [ 22 ] (обновлено Andermann et al. в 2008 году [ 23 ]).
Таблица 1Основные критерии Вильсона и Юнгнера для Скрининг |
• Состояние является серьезной проблемой для здоровья • Доступно приемлемое лечение • Доступные средства диагностики и лечения • Знание естественного течения болезни • Пресимптоматическое вмешательство улучшает результаты • Простой и недорогой тест с отличными характеристиками • Доступные ресурсы для последующего наблюдения за положительными лицами • Программа, приемлемая для населения • Разработка политики программы • Стоимость выявления случаев заболевания приемлема |
 Секвенирование следующего поколения в области NBS: потенциал и проблемы
Секвенирование следующего поколения в области NBS: потенциал и проблемы В связи с недавним секвенированием всего генома человека [ 27 , 28 ] генетический скрининг предлагается в качестве основной возможности для преобразования генетических и геномных достижений в улучшение здоровья населения [ 29 , 30 ]. Секвенирование следующего поколения (NGS) уже начало трансформировать генетику, и клиническое применение генетического секвенирования уже показало уменьшение диагностической одиссеи как у взрослых, так и у детей [ 31 , 32 ] и сокращение пребывания отделений интенсивной терапии в критических состояниях. больные дети [ 33 ].С уменьшением затрат и появлением новых технологических платформ для генотипирования и секвенирования растет интерес к использованию молекулярного тестирования для NBS. Тем не менее, ДНК-тестирование уже введено в NBS в течение нескольких лет для некоторых заболеваний. Например, в большинстве программ, выполняющих NBS при муковисцидозе, используется панель мутаций CFTR в качестве теста второго уровня после повышения уровня иммунореактивного трипсина. Принимая во внимание возможность проведения ДНК-тестирования с помощью фильтровальной бумаги в сочетании со снижением затрат на ДНК-тестирование, растет интерес к более широкому включению технологий ДНК-тестирования в NBS, что значительно расширит возможности выявления редких, но разрушительных заболеваний, но также повысит некоторые этические соображения.
Например, в большинстве программ, выполняющих NBS при муковисцидозе, используется панель мутаций CFTR в качестве теста второго уровня после повышения уровня иммунореактивного трипсина. Принимая во внимание возможность проведения ДНК-тестирования с помощью фильтровальной бумаги в сочетании со снижением затрат на ДНК-тестирование, растет интерес к более широкому включению технологий ДНК-тестирования в NBS, что значительно расширит возможности выявления редких, но разрушительных заболеваний, но также повысит некоторые этические соображения.
Опять же, генное тестирование используется в качестве теста уровня 2 и после положительного биохимического скрининга (т. е. муковисцидоза в большинстве программ NBS, предлагающих NBS для лечения муковисцидоза) и как часть диагностического подтверждения многих состояний. Тем не менее, пока нет генетических состояний, проверенных с помощью секвенирования генов 1 st tier. Теоретически целевая NGS уровня 1 st позволит систематически секвенировать панель генов для выявления всех состояний панели NBS, которые будут обнаружены при рождении.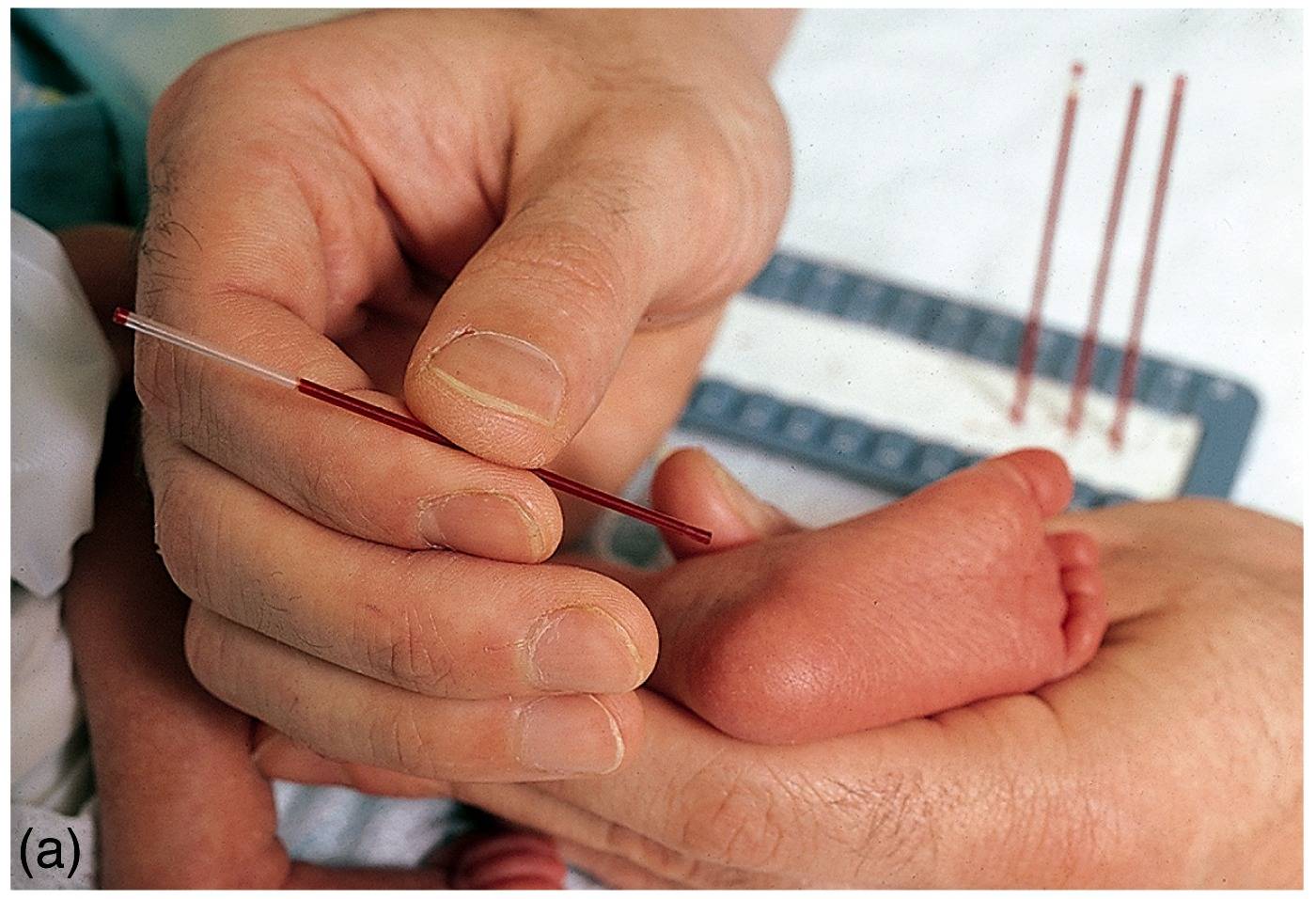 Например, без учета 3 патологий, скрининга слуха у новорожденных, критического врожденного порока сердца и врожденного гипотиреоза (для которого существует большая генетическая гетерогенность) [ 34 ], это будет представлять собой панель из 57 генов при применении рекомендованной ACMG. «основная панель» (табл. 2). Однако чем сложнее генетически состояние, тем более предпочтительным будет биохимический подход, при условии, что последний является высокочувствительным и специфичным. Кроме того, некоторые биохимические тесты и маркеры могут выявить более одного состояния.Например, повышение уровня фенилаланина может быть вызвано классической фенилкетонурией из-за дефекта фенилаланингидроксилазы, но может также распутывать дефицит метаболизма тетрагидробиоптерина [ 35 ]. Точно так же повышение уровня 17-гидроксипрогестерона может быть вызвано дефицитом 21-гидроксилазы, а также дефицитом других ферментов стероидогенеза.
Например, без учета 3 патологий, скрининга слуха у новорожденных, критического врожденного порока сердца и врожденного гипотиреоза (для которого существует большая генетическая гетерогенность) [ 34 ], это будет представлять собой панель из 57 генов при применении рекомендованной ACMG. «основная панель» (табл. 2). Однако чем сложнее генетически состояние, тем более предпочтительным будет биохимический подход, при условии, что последний является высокочувствительным и специфичным. Кроме того, некоторые биохимические тесты и маркеры могут выявить более одного состояния.Например, повышение уровня фенилаланина может быть вызвано классической фенилкетонурией из-за дефекта фенилаланингидроксилазы, но может также распутывать дефицит метаболизма тетрагидробиоптерина [ 35 ]. Точно так же повышение уровня 17-гидроксипрогестерона может быть вызвано дефицитом 21-гидроксилазы, а также дефицитом других ферментов стероидогенеза.
Таблица 2 Основные гены, участвующие в основной панели заболеваний, выявляемых при рождении, согласно экспертной группе ACMG по скринингу новорожденных (HGNC, Комитет по номенклатуре генов HUGO).
Таблица 2 Основные гены, участвующие в основной панели заболеваний, выявляемых при рождении, согласно экспертной группе ACMG по скринингу новорожденных (HGNC, Комитет по номенклатуре генов HUGO).
Группа состояний | Состояние | Символ гена, одобренный HGNC (OMIM) |
Органические ацидемии | Изовалериановая ацидемия | IVD (607036) |
Глутаровая ацидемия I типа | ГЦДХ (608801) | |
3-OH 3-Ch4 глутаровая ацидурия | HMGCL (613898) | |
Дефицит голокарбоксилазсинтазы | ГВУ (609018) | |
Метилмалоновая ацидемия (дефицит мутазы) | ММУТ (609058) | |
Дефицит 3-метилкротонил-КоА-карбоксилазы | MCCC1 (609010), MCCC2 (609014) | |
Метилмалоновая ацидемия (кобаламиновые расстройства) | MMAA (607481), MMAB (607568), MMADHC (611935) | |
Пропионовая ацидемия | PCCA (232000), PCCB (232050) | |
Дефицит β-кетотиолазы | ACAT1 (607809) | |
Дефицит биотинидазы | БТД (609019) | |
Нарушения метаболизма жирных кислот | Дефицит ацил-КоА-дегидрогеназы со средней длиной цепи | АКАДМ (607008 ) |
Дефицит ацил-КоА-дегидрогеназы с очень длинной цепью | АКАДВЛ ( 609575) | |
Дефицит длинноцепочечной L-3-OH ацил-КоА-дегидрогеназы | ХАДХА (600890) | |
Дефицит трифункционального белка | ХАДХБ (143450) | |
Дефект поглощения карнитина | SLC22A5 (603377) | |
Дефект транспорта карнитина | CPT1A (600528), SLC25A20 (613698), CPT2 (600650) | |
Нарушения метаболизма аминокислот | Фенилкетонурия | ПАУ (612349) |
Болезнь кленового сиропа (моча) | BCKDHA (608348), BCKDHB (248611), DBT (248610), PPM1K (611065) | |
Гомоцистинурия (из-за дефицита CBS) | ЦБС (613381) | |
Цитруллинемия | АСС1 (603470) | |
Аргиноянтарная ацидемия | Над уровнем моря (608310) | |
Тирозинемия I типа | ФАГ (613871) | |
Гемоглобинопатии | Серповидноклеточная анемия (заболевание Hb SS) | ХББ (141900) |
Hb S/β-талассемия | ||
Hb S/C болезнь | ||
Эндокринопатия | Врожденный гипотиреоз | DUOX2 (606759), DUOXA2 (612772), PAX8 (167415), TG (188450), TPO (606765), TSHR (603372), IYD (612025)… |
Врожденная гиперплазия надпочечников (дефицит 21-гидроксилазы) | CYP21A2 (613815) | |
Другие нарушения обмена веществ | Болезнь накопления гликогена II типа (Помпе) | ГАА (606800) |
Мукополисахаридоз типа 1 | IDUA (252800) | |
Х-сцепленная адренолейкодистрофия | ABCD1 (300371) | |
Классическая галактоземия | ГАЛТ (606999) | |
Другие | Спинальная мышечная атрофия вследствие гомозиготной делеции экзона 7 в SMN1 | СМН1 (600354) |
Проверка слуха новорожденных | / | |
Кистозный фиброз | CFTR (602421) | |
Критический врожденный порок сердца | / | |
Тяжелые комбинированные иммунодефициты | ADA (608958), CARD11 (607210), CD247 (186780), CD3D (186790), CD3E (186830), CORO1A (605000), CTPS1 (123860), DCLRE1C (605988), IKBKB (603258), IL2RG (308380) ), IL7R (146661), JAK3 (600173), LAT (602354), LCK (153390), PRKDC (600899), PTPRC (151460), RAG1 (179615), RAG2 (179616) |
В недавнем отчете Yang et al. выполнил систематический NGS у новорожденных с положительным биохимическим скринингом с помощью MSMS из трех областей провинции Цзянсу, выполняя NBS для 27 врожденных ошибок метаболизма (IEM). В течение четырех лет у 536 008 новорожденных был положительный результат скрининга на тандемный РС 1 -го уровня с последующим повторным тестированием на МСМС и целевым секвенированием 306 генов, связанных с IEM, из расширенной панели наследственных метаболических заболеваний. В общей сложности 1033 новорожденных были протестированы с помощью NGS, после чего был проведен проверочный анализ с помощью секвенирования по Сэнгеру положительных результатов.Они идентифицировали гены, вызывающие заболевание, в 194 случаях с общей заболеваемостью 1:2763, что было выше, чем сообщалось ранее, и предполагалось, что NGS позволил выявить дополнительные случаи [ 36 ]. Аминоацидопатии составили 43,5% случаев, в то время как органические ацидемии — 34,8%, нарушения окисления жирных кислот — 21,7%.
выполнил систематический NGS у новорожденных с положительным биохимическим скринингом с помощью MSMS из трех областей провинции Цзянсу, выполняя NBS для 27 врожденных ошибок метаболизма (IEM). В течение четырех лет у 536 008 новорожденных был положительный результат скрининга на тандемный РС 1 -го уровня с последующим повторным тестированием на МСМС и целевым секвенированием 306 генов, связанных с IEM, из расширенной панели наследственных метаболических заболеваний. В общей сложности 1033 новорожденных были протестированы с помощью NGS, после чего был проведен проверочный анализ с помощью секвенирования по Сэнгеру положительных результатов.Они идентифицировали гены, вызывающие заболевание, в 194 случаях с общей заболеваемостью 1:2763, что было выше, чем сообщалось ранее, и предполагалось, что NGS позволил выявить дополнительные случаи [ 36 ]. Аминоацидопатии составили 43,5% случаев, в то время как органические ацидемии — 34,8%, нарушения окисления жирных кислот — 21,7%. В большинстве случаев требовалось клиническое вмешательство и регулярное наблюдение, и лишь несколько случаев на момент публикации протекали бессимптомно. Долгосрочное наблюдение должно позволить скорректировать условия и гены, которые будут включены как часть панели генов в рутинную NBS.
В большинстве случаев требовалось клиническое вмешательство и регулярное наблюдение, и лишь несколько случаев на момент публикации протекали бессимптомно. Долгосрочное наблюдение должно позволить скорректировать условия и гены, которые будут включены как часть панели генов в рутинную NBS.
Высокая производительность технологии NGS, позволяющей проводить параллельное секвенирование миллионов молекул ДНК, потенциально может увеличить количество подлежащих скринингу врожденных аномалий, фактически до гораздо более высокого порядка, наблюдаемого с появлением тандемной МС. . В этом контексте должны быть разработаны и протестированы методы выбора соответствующих условий, которые должны быть представлены в составе NGS-панели NBS. Имея это в виду, Milko et al. недавно разработал основанный на возрасте метод полуколичественной оценки для оценки релевантности введения новых генетических состояний в панель NBS с использованием геномного секвенирования [ 37 ]. Их модель в основном основывалась на основных критериях скрининга для оценки клинической действенности (тяжесть заболевания, вероятность клинических проявлений, приемлемость и эффективность вмешательства, общее знание связи ген-заболевание) [ 38 ]. Это позволило им идентифицировать 822 пары ген-заболевание, из которых 466 были классифицированы как детское начало с высокой клинической эффективностью, в то время как другие 245 пар ген-заболевание считались малоэффективными или неэффективными в детском возрасте. Следует отметить, что валидация их метода для надежного определения педиатрической клинической действенности проводилась путем сравнения того, как выполнялись условия 1 ry и 2 ry RUSP [ 39 ] и условия, разработанные в рамках проекта BabySeq [ 40 ]. с их подходом.Как и ожидалось, корреляции не были идеальными, но они отражали более низкую клиническую действенность 2 ry по сравнению с 1 ry RUSP, причем большее количество последних относилось к категории высокой клинической действенности.
Их модель в основном основывалась на основных критериях скрининга для оценки клинической действенности (тяжесть заболевания, вероятность клинических проявлений, приемлемость и эффективность вмешательства, общее знание связи ген-заболевание) [ 38 ]. Это позволило им идентифицировать 822 пары ген-заболевание, из которых 466 были классифицированы как детское начало с высокой клинической эффективностью, в то время как другие 245 пар ген-заболевание считались малоэффективными или неэффективными в детском возрасте. Следует отметить, что валидация их метода для надежного определения педиатрической клинической действенности проводилась путем сравнения того, как выполнялись условия 1 ry и 2 ry RUSP [ 39 ] и условия, разработанные в рамках проекта BabySeq [ 40 ]. с их подходом.Как и ожидалось, корреляции не были идеальными, но они отражали более низкую клиническую действенность 2 ry по сравнению с 1 ry RUSP, причем большее количество последних относилось к категории высокой клинической действенности.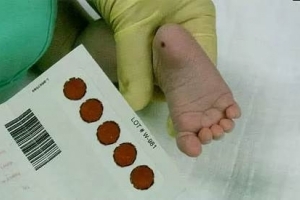 Сравнение с проектами BabySeq, которые классифицировали свои пары ген-заболевание по достоверности ассоциации ген-заболевание, самому раннему зарегистрированному возрасту начала заболевания и пенетрантности, позволило прийти к консенсусу в отношении идентификации 292 состояний, которые потенциально могут быть введены в NGS NBS-панель и еще 125 опционально для раскрытия [ 37 ].Учитывая, что польза NBS для многих из 466 пар заболеваний еще не доказана, было бы разумно применить строгую классификацию, ограничивающую NGS NBS только для заболеваний, демонстрирующих окончательную или сильную клиническую достоверность, на основе схемы ClinGen [ 41 ]. Следует отметить, что такие подходы, основанные на геноме, могут помочь в процессе принятия решений о спорной релевантности таких состояний, как 3-метилкротонилглицинурия, которые уже входят в группу NBS многих юрисдикций.
Сравнение с проектами BabySeq, которые классифицировали свои пары ген-заболевание по достоверности ассоциации ген-заболевание, самому раннему зарегистрированному возрасту начала заболевания и пенетрантности, позволило прийти к консенсусу в отношении идентификации 292 состояний, которые потенциально могут быть введены в NGS NBS-панель и еще 125 опционально для раскрытия [ 37 ].Учитывая, что польза NBS для многих из 466 пар заболеваний еще не доказана, было бы разумно применить строгую классификацию, ограничивающую NGS NBS только для заболеваний, демонстрирующих окончательную или сильную клиническую достоверность, на основе схемы ClinGen [ 41 ]. Следует отметить, что такие подходы, основанные на геноме, могут помочь в процессе принятия решений о спорной релевантности таких состояний, как 3-метилкротонилглицинурия, которые уже входят в группу NBS многих юрисдикций.
Разрыв между технологическими возможностями NGS и возможностями предоставления соответствующих услуг системами общественного здравоохранения заставляет расширять программы скрининга, часто до того, как будут созданы адекватные нормативные рамки [ 42 , 43 , 44 ] . Действительно, опасения в основном связаны с психологическими и физическими последствиями широкого генетического тестирования у бессимптомных детей, такими как тревога родителей в связи с наличием неопределенных результатов, потеря конфиденциальности и социальная стигматизация [ 25 , 45 , 46 , 47 , 48 ]. Таким образом, это предмет интенсивных дебатов, особенно в отсутствие соответствующего медицинского вмешательства. Генерация геномной информации, не вся из которой понятна, потенциально приводит к значительным рискам, связанным с обнародованием случайных находок и вариантов неизвестной значимости (VUS).Эта новая парадигма, созданная введением NGS в NBS, должна быть принята во внимание соответствующей структурой общественного здравоохранения, как это рекомендовано Friedman et al . [ 44 ]. В то время как некоторые уже предлагают, чтобы программы NBS включали или даже заменяли их текущий подход геномным секвенированием [ 49 , 50 ], следует внедрить методы, основанные на доказательствах, чтобы информировать процесс принятия решений и учитывать такие параметры, как распространенность и пенетрантность состояния, ложноположительные результаты, клинический исход после вмешательств, психологическое воздействие на семьи и затраты.
Действительно, опасения в основном связаны с психологическими и физическими последствиями широкого генетического тестирования у бессимптомных детей, такими как тревога родителей в связи с наличием неопределенных результатов, потеря конфиденциальности и социальная стигматизация [ 25 , 45 , 46 , 47 , 48 ]. Таким образом, это предмет интенсивных дебатов, особенно в отсутствие соответствующего медицинского вмешательства. Генерация геномной информации, не вся из которой понятна, потенциально приводит к значительным рискам, связанным с обнародованием случайных находок и вариантов неизвестной значимости (VUS).Эта новая парадигма, созданная введением NGS в NBS, должна быть принята во внимание соответствующей структурой общественного здравоохранения, как это рекомендовано Friedman et al . [ 44 ]. В то время как некоторые уже предлагают, чтобы программы NBS включали или даже заменяли их текущий подход геномным секвенированием [ 49 , 50 ], следует внедрить методы, основанные на доказательствах, чтобы информировать процесс принятия решений и учитывать такие параметры, как распространенность и пенетрантность состояния, ложноположительные результаты, клинический исход после вмешательств, психологическое воздействие на семьи и затраты. В случае NBS в центре внимания должны быть наилучшие интересы ребенка и, следовательно, выявление состояний, при которых своевременные вмешательства или профилактика предотвратят значительный вред здоровью ребенка, а не генетическая информация, которая потенциально может выявить более поздние расстройства, которые может понадобиться медицинская помощь. В противном случае имело бы место отрицание автономии личности. Внедрение NGS в NBS несет в себе огромный потенциал для лучшего выявления детей с генетическими нарушениями и улучшения результатов, но также ставит важные этические проблемы.Неудивительно, что она является предметом активных дискуссий и споров.
В случае NBS в центре внимания должны быть наилучшие интересы ребенка и, следовательно, выявление состояний, при которых своевременные вмешательства или профилактика предотвратят значительный вред здоровью ребенка, а не генетическая информация, которая потенциально может выявить более поздние расстройства, которые может понадобиться медицинская помощь. В противном случае имело бы место отрицание автономии личности. Внедрение NGS в NBS несет в себе огромный потенциал для лучшего выявления детей с генетическими нарушениями и улучшения результатов, но также ставит важные этические проблемы.Неудивительно, что она является предметом активных дискуссий и споров.
Даже если NBS считается одним из основных направлений общественного здравоохранения [ 51 ], к сожалению, многие страны с ограниченными ресурсами не имеют структурированной национальной программы. В то время как частота врожденных нарушений оценивается в 8 миллионов рождений в год во всем мире, только одна треть новорожденных получает NBS как минимум по одному врожденному заболеванию [ 52 ]. В дополнение к нехватке финансирования и специализированных человеческих ресурсов, сторонники NBS сталкиваются со многими препятствиями на пути внедрения NBS. Кроме того, централизованная модель НБС, основанная на отправке документов для сбора в центральную лабораторию НБС, может оказаться непригодной в этих областях. В отсутствие структурированной системы общественного здравоохранения, которая может обеспечить эффективную помощь и последующее наблюдение за новорожденными с положительным результатом скрининга, NBS может оказаться нежизнеспособной.
В дополнение к нехватке финансирования и специализированных человеческих ресурсов, сторонники NBS сталкиваются со многими препятствиями на пути внедрения NBS. Кроме того, централизованная модель НБС, основанная на отправке документов для сбора в центральную лабораторию НБС, может оказаться непригодной в этих областях. В отсутствие структурированной системы общественного здравоохранения, которая может обеспечить эффективную помощь и последующее наблюдение за новорожденными с положительным результатом скрининга, NBS может оказаться нежизнеспособной.
Действительно, НБС включает в себя целый ряд мероприятий и последовательность действий, это не только испытательная лаборатория.Сбор и транспортировка крови в центральную лабораторию, последующие исследования и лечение лиц с аномальными результатами требуют наличия структурированной системы общественного здравоохранения и адекватной инфраструктуры. Кроме того, разные реалии отдаленных и городских районов затрудняют реализацию единой программы НБС. Это было подчеркнуто в Индии, где было предложено ввести NBS для выявления врожденного гипотиреоза только в сельской местности, в то время как скрининг на врожденный гипотиреоз (ВГ), врожденную гиперплазию коры надпочечников (ВГКН) и дефицит Г6ФД следует проводить в городских районах, при этом тандемная масс-спектроскопия зарезервированы только для расследования случаев высокого риска.Это справедливо для большинства развивающихся стран [ 53 ].
Это было подчеркнуто в Индии, где было предложено ввести NBS для выявления врожденного гипотиреоза только в сельской местности, в то время как скрининг на врожденный гипотиреоз (ВГ), врожденную гиперплазию коры надпочечников (ВГКН) и дефицит Г6ФД следует проводить в городских районах, при этом тандемная масс-спектроскопия зарезервированы только для расследования случаев высокого риска.Это справедливо для большинства развивающихся стран [ 53 ].
Кроме того, органы здравоохранения могут не рассматривать NBS редких состояний, за исключением серповидно-клеточной анемии для некоторых территорий, в качестве приоритетных. Это, возможно, будет смягчено по мере того, как будет оказываться помощь большему количеству новорожденных и детей, страдающих от более распространенных заболеваний. По-видимому, скрининг на генетические нарушения и врожденные дефекты становится актуальным, когда младенческая смертность падает ниже 40 на 1000 живорожденных [ 54 ], и становится приоритетом общественного здравоохранения, когда национальный показатель младенческой смертности падает до однозначных цифр, т. е.е. менее 10 на 1000 живорождений [ 54 , 55 ]. Однако различия в генетическом фоне популяции неизбежно приведут к различиям в панели NBS. Действительно, если NBS для СН и некоторых врожденных нарушений метаболизма окажется рентабельным в странах северного полушария, скрининг нарушений, таких как нарушения гемоглобина и дефицит глюкозо-6-фосфатдегидрогеназы, может в конечном итоге оказаться экономически эффективным в суб- Сахарская Африка, Индия и Юго-Восточная Азия, где распространены эти расстройства.
е.е. менее 10 на 1000 живорождений [ 54 , 55 ]. Однако различия в генетическом фоне популяции неизбежно приведут к различиям в панели NBS. Действительно, если NBS для СН и некоторых врожденных нарушений метаболизма окажется рентабельным в странах северного полушария, скрининг нарушений, таких как нарушения гемоглобина и дефицит глюкозо-6-фосфатдегидрогеназы, может в конечном итоге оказаться экономически эффективным в суб- Сахарская Африка, Индия и Юго-Восточная Азия, где распространены эти расстройства.
Наконец, как предложили Therrell и Padilla, следует уделять больше внимания оказанию медицинской помощи (POC), используя преимущества скрининга слуха новорожденных и скрининга критических врожденных пороков сердца, проводимого у постели больного [ 56 ]. Очевидные преимущества должны быть достигнуты за счет интеграции этих модальностей NBS в более комплексную инфраструктуру NBS. Пилотные проекты следует продолжать осуществлять в районах с ограниченными ресурсами с использованием стратегии, интегрированной с текущей клинической помощью, возможно, начиная с нарушений гемоглобина, со специализированным опытом, сосредоточенным вокруг одной генетической службы, и с целью оценки снижения генетического бремени.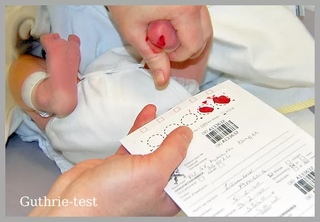 , затраты-выгоды и препятствия на пути внедрения, чтобы помочь обеспечить эффективную NBS.Однако, к сожалению, в последних рекомендациях ВОЗ по охране здоровья новорожденных, опубликованных в мае 2017 г., NBS не упоминается в укреплении здоровья новорожденных [ 57 ]. Недавно [ 56 ] был тщательно проанализирован прогресс во внедрении NBS в развивающихся странах по всему миру.
, затраты-выгоды и препятствия на пути внедрения, чтобы помочь обеспечить эффективную NBS.Однако, к сожалению, в последних рекомендациях ВОЗ по охране здоровья новорожденных, опубликованных в мае 2017 г., NBS не упоминается в укреплении здоровья новорожденных [ 57 ]. Недавно [ 56 ] был тщательно проанализирован прогресс во внедрении NBS в развивающихся странах по всему миру.
NBS считается крупным достижением общественного здравоохранения в 20 90 292 90 293 веке. NBS, проводимая в течение 1 st нескольких дней жизни путем забора капли крови на фильтровальную бумагу с последующим анализом крови, может предотвратить заболеваемость и смертность от тяжелых состояний.Программы NBS эволюционировали от скрининга одного или нескольких заболеваний до потенциально более 50 состояний благодаря расширенным возможностям масс-спектрометрии для одновременного выявления нескольких заболеваний с высокой чувствительностью всего за одно введение образца в прибор. Тем не менее, в панели NBS, предлагаемой различными юрисдикциями, по-прежнему существует значительная неоднородность, отчасти из-за различий в популяционной генетике, а также в различных подходах и интерпретации критериев скрининга ВОЗ и процесса принятия решений в условиях дефицита данных. при заболеваниях, которые по отдельности редки.
Тем не менее, в панели NBS, предлагаемой различными юрисдикциями, по-прежнему существует значительная неоднородность, отчасти из-за различий в популяционной генетике, а также в различных подходах и интерпретации критериев скрининга ВОЗ и процесса принятия решений в условиях дефицита данных. при заболеваниях, которые по отдельности редки.
После волны крупномасштабного расширения NBS в 2000-х годах во многих юрисдикциях, вызванного введением MSMS, внедрение высокопроизводительной NGS, которая уже начала трансформировать клиническую генетику, может вывести область NBS на новый уровень. . Широкомасштабное секвенирование всего генома выявит еще один набор редких неонатальных, но разрушительных расстройств, для которых доступны предсимптоматические вмешательства. Он также может предотвратить ошибочный диагноз, сократить задержку в постановке диагноза, облегчить раннее вмешательство и улучшить диагностику.Однако данных о большинстве ИЭМ, которые могут иметь весьма вариабельные клинические проявления, недостаточно. Включение технологии NGS в панели NBS потребует строгого процесса принятия решений, в котором будут учитываться надежные методы, основанные на фактических данных, из крупномасштабных исследований. Важно отметить, что этические проблемы, связанные с генерацией геномной информации, большую часть которой мы до сих пор не понимаем клинического значения, необходимо будет решить. Поскольку «слишком много скрининга — это плохой скрининг», необходимо учитывать баланс между пользой и вредом при оценке способности NGS улучшать уход за детьми.Его не должны тормозить поспешные, небрежные и потенциально опасные процессы принятия решений.
Включение технологии NGS в панели NBS потребует строгого процесса принятия решений, в котором будут учитываться надежные методы, основанные на фактических данных, из крупномасштабных исследований. Важно отметить, что этические проблемы, связанные с генерацией геномной информации, большую часть которой мы до сих пор не понимаем клинического значения, необходимо будет решить. Поскольку «слишком много скрининга — это плохой скрининг», необходимо учитывать баланс между пользой и вредом при оценке способности NGS улучшать уход за детьми.Его не должны тормозить поспешные, небрежные и потенциально опасные процессы принятия решений.
Наконец, несмотря на то, что около двух третей младенцев во всем мире рождаются в районах с ограниченными ресурсами, где до сих пор нет инфраструктуры NBS, несколько инициатив во всем мире демонстрируют многообещающие результаты, но также сталкиваются со многими препятствиями на пути реализации и обеспечения устойчивости. Было бы жаль осознавать, что северное полушарие продолжает применять технологические достижения на благо новорожденных и детей, а также населения в целом, в то время как районы с низким уровнем ресурсов все еще пытаются внедрить базовую инфраструктуру NBS.
YG разработал план рукописи. YG и DB написали первоначальную версию рукописи и согласны с ее окончательной версией.
Конкурирующие интересыАвторы заявляют, что у них нет конкурирующих интересов.
Каталожные номера
- Гатри Р.Скрининг крови на фенилкетонурию. ДЖАМА. 1961 год; 178: 863. [Перекрестная ссылка]
- Гатри Р., Сузи А. Простой метод фенилаланина для выявления фенилкетонурии в больших группах новорожденных. Педиатрия. 1963 год; 32: 338-343.
- Гатри Р., Уитни С.Выявление фенилкетонурии у новорожденного как рутинная госпитальная процедура. В. Вашингтон; 1964.
- Броско Дж.
 П., Пол Д. Б.. Политическая история ФКУ: размышления о 50-летнем скрининге новорожденных. Педиатрия. 2013; 132: 987-989. [Перекрестная ссылка]
П., Пол Д. Б.. Политическая история ФКУ: размышления о 50-летнем скрининге новорожденных. Педиатрия. 2013; 132: 987-989. [Перекрестная ссылка] - Dussault JH, Coulombe P, Laberge C, Letarte J, Guyda H, Khoury K.Предварительный отчет о программе массового скрининга неонатального гипотиреоза. J Педиатр. 1975 год; 86: 670-674. [Перекрестная ссылка]
- Wilcken B, Wiley V. Пятьдесят лет скрининга новорожденных. J Педиатр Здоровье ребенка. 2015 г.; 51: 103-107. [Перекрестная ссылка]
- Лаберж С.Наследственная тирозинемия у франко-канадского изолята. Am J Hum Genet. 1969 год; 21: 36-45.
- Чейс Д.Х., Калас Т.А., Нейлор Э.В. Использование тандемной масс-спектрометрии для мультианалитического скрининга высушенных образцов крови новорожденных. Клин Хим. 2003, 49: 1797-1817. [Перекрестная ссылка]
- Пол ДБ.
 Защита интересов пациентов при скрининге новорожденных: непрерывность и прерывность. Am J Med Genet C Semin Med Genet. 2008 г.; 148: 8-14. [Перекрестная ссылка]
Защита интересов пациентов при скрининге новорожденных: непрерывность и прерывность. Am J Med Genet C Semin Med Genet. 2008 г.; 148: 8-14. [Перекрестная ссылка] - Экспертная группа по скринингу новорожденных Американского колледжа медицинской генетики. Скрининг новорожденных: к единой панели и системе скрининга. Генет Мед. 2006 г.; 8: 1С-252С.
- Боткин Дж. Р., Клейтон Э. В., Фост Н. С., Берк В., Мюррей Т. Х., Бейли М. А. и другие.Технология скрининга новорожденных: действуйте с осторожностью. Педиатрия. 2006 г.; 117: 1793-1799. [Перекрестная ссылка]
- Натович М. Скрининг новорожденных — установление политики защиты, основанной на фактических данных. N Engl J Med. 2005 г.; 353: 867-870. [Перекрестная ссылка]
- Пак Дж. М. Неонатальный скрининг на тяжелый комбинированный иммунодефицит.Curr Opin Педиатр.
 2011 г.; 23: 667-673. [Перекрестная ссылка]
2011 г.; 23: 667-673. [Перекрестная ссылка] - Гелеске Т. Рекомендовано добавить SCID в единую панель скрининга новорожденных. В: Новости ААП. об. 31; 2010: 22.
- Глайдвелл Дж., Гросс С.Д., Риле-Коларуссо Т., Пинто Н., Хадсон Дж., Даскалов Р. и соавт.Действия в поддержку скрининга новорожденных на критические врожденные пороки сердца — США, 2011–2018 гг. MMWR Morb Mortal Wkly Rep. 2019; 68: 107-111. [Перекрестная ссылка]
- Дедхия К., Грэм Э., Парк А. Потеря слуха и неудачная проверка слуха у новорожденных. Клин Перинатол. 2018; 45: 629-643. [Перекрестная ссылка]
- Федеральные консультативные комитеты.Рекомендуемая единая экранирующая панель. 2019. Доступно по адресу: https://www.hrsa.gov/advisory-committees/heritable-disorders/rusp/index.html
- .
Спасил З.
 , Татипака Х., Барсенас М., Скотт Ч.Р., Туречек Ф., Гелб М.Х. Высокопроизводительный анализ 9 лизосомальных ферментов для скрининга новорожденных. Клин Хим. 2013; 59: 502-511. [Перекрестная ссылка]
, Татипака Х., Барсенас М., Скотт Ч.Р., Туречек Ф., Гелб М.Х. Высокопроизводительный анализ 9 лизосомальных ферментов для скрининга новорожденных. Клин Хим. 2013; 59: 502-511. [Перекрестная ссылка] - Масима Р., Танака М., Сакаи Э., Накадзима Х., Кумагаи Т., Косуга М. и др.Селективное обнаружение лизофосфатидилхолина в высохших пятнах крови для диагностики адренолейкодистрофии методом ЖХ-МС/МС. Mol Genet Metab Rep. 2016; 7: 16-19. [Перекрестная ссылка]
- Gatheridge MA, Kwon JM, Mendell JM, Scheuerbrandt G, Moat SJ, Eyskens F, et al. Выявление положительных и ложноотрицательных результатов, не связанных с мышечной дистрофией Дюшенна, в программах скрининга новорожденных на предшествующую мышечную дистрофию Дюшенна: обзор.ДЖАМА Нейрол. 2016; 73: 111-116. [Перекрестная ссылка]
- Ke Q, Zhao ZY, Mendell JR, Baker M, Wiley V, Kwon JM и др. Прогресс в лечении и скрининге новорожденных на мышечную дистрофию Дюшенна и спинальную мышечную атрофию.
 Мир J Педиатр. 2019; 15: 219-225. [Перекрестная ссылка]
Мир J Педиатр. 2019; 15: 219-225. [Перекрестная ссылка] - Уилсон Дж., Юнгнер Г.Принципы и практика скрининга заболеваний. В. Женева: ВОЗ; 1968.
- Андерманн А., Бланкерт И., Бошан С., Дери В. Пересматривая Уилсона и Юнгнера в геномную эпоху: обзор критериев скрининга за последние 40 лет. Всемирный орган здравоохранения Быка. 2008 г.; 86: 317-319. [Перекрестная ссылка]
- Поллит Р.Дж.Представляем новые экраны: почему мы все делаем разные вещи? J Наследовать Metab Dis. 2007, 30: 423-429. [Перекрестная ссылка]
- Росс Л.Ф., Саал Х.М., Дэвид К.Л., Андерсон Р.Р., Американская академия психологии, Американский колледж медицины и др. Технический отчет: Этические и политические вопросы генетического тестирования и скрининга детей. Генет Мед. 2013; 15: 234-245. [Перекрестная ссылка]
- Янсен М.
 Э., Меттерник-Джонс С.К., Листер К.Дж.Международные различия в оценке условий для скрининга пятен крови новорожденных: обзор научной литературы и программных документов. Eur J Hum Genet. 2016; 25: 10-16. [Перекрестная ссылка]
Э., Меттерник-Джонс С.К., Листер К.Дж.Международные различия в оценке условий для скрининга пятен крови новорожденных: обзор научной литературы и программных документов. Eur J Hum Genet. 2016; 25: 10-16. [Перекрестная ссылка] - Ландер Э.С., Линтон Л.М., Биррен Б., Нусбаум С., Зоди М.С., Болдуин Дж. и др. Начальная последовательность и анализ человеческого генома. Природа. 2001 г.; 409: 860-921. [Перекрестная ссылка]
- Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, et al.Последовательность генома человека. Наука. 2001 г.; 291: 1304-1351. [Перекрестная ссылка]
- Белл Дж. Новая генетика в клинической практике. БМЖ. 1998 год; 316: 618-620. [Перекрестная ссылка]
- Хури М.Дж., Маккейб Л.Л., Маккейб Э.Р. Скрининг населения в эпоху геномной медицины.N Engl J Med. 2003 г.; 348: 50-58. [Перекрестная ссылка]
- Сплинтер К.
 , Адамс Д.Р., Бачино К.А., Беллен Х.Дж., Бернштейн Дж.А., Читл-Ярвела А.М. и соавт. Влияние генетической диагностики на пациентов с ранее не диагностированным заболеванием. N Engl J Med. 2018; 379: 2131-2139. [Перекрестная ссылка]
, Адамс Д.Р., Бачино К.А., Беллен Х.Дж., Бернштейн Дж.А., Читл-Ярвела А.М. и соавт. Влияние генетической диагностики на пациентов с ранее не диагностированным заболеванием. N Engl J Med. 2018; 379: 2131-2139. [Перекрестная ссылка] - Yang Y, Muzny DM, Reid JG, Bainbridge MN, Willis A, Ward PA, et al.Клиническое полноэкзомное секвенирование для диагностики менделевских расстройств. N Engl J Med. 2013; 369: 1502-1511. [Перекрестная ссылка]
- Петрикин Дж. Э., Какичи Дж. А., Кларк М. М., Уиллиг Л. К., Суини Н. М., Фэрроу Э. Г. и соавт. Рандомизированное контролируемое исследование NSIGHT1: быстрое полногеномное секвенирование для ускоренной этиологической диагностики у тяжелобольных младенцев. NPJ Геном Мед. 2018; 3: 6. [Перекрестная ссылка]
- Черелла К.Э., Васснер А.Дж.Врожденный гипотиреоз: понимание патогенеза и лечения. Int J Pediatr Endocrinol.
 2017; 2017: 11. [Перекрестная ссылка]
2017; 2017: 11. [Перекрестная ссылка] - Блау Н., Хеннерманн Дж. Б., Лангенбек У., Лихтер-Конеки У. Диагностика, классификация и генетика дефицита фенилкетонурии и тетрагидробиоптерина (Bh5). Мол Жене Метаб. 2011 г.; 104: С2-С9. [Перекрестная ссылка]
- Ян И, Ван Л, Ван Б, Лю С, Ю Б, Ван Т.Применение секвенирования следующего поколения после тандемной масс-спектрометрии для расширения скрининга новорожденных на врожденные нарушения метаболизма: многоцентровое исследование. Фронт Жене. 2019; 10: 86. [Перекрестная ссылка]
- Милко Л.В., О’Дэниел Дж.М., ДеКристо Д.М., Кроули С.Б., Форман АКМ, Уоллес К.Е. и др. Основанная на возрасте основа для оценки секвенирования в масштабе генома приводит к скринингу новорожденных.J Педиатр. 2019; 209: 68-76. [Перекрестная ссылка]
- Берг Дж.С., Форман А.К., О’Дэниел Дж.
 М., Букер Дж.К., Боше Л., Кэри Т. и др. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Генет Мед. 2016; 18: 467-475. [Перекрестная ссылка]
М., Букер Дж.К., Боше Л., Кэри Т. и др. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Генет Мед. 2016; 18: 467-475. [Перекрестная ссылка] - Кемпер А.Р., Грин Н.С., Калонж Н., Лам В.К., Комо А.М., Гольденберг А.Дж. и др.Процесс принятия решений для состояний, номинированных в рекомендуемую единую скрининговую группу: Заявление Консультативного комитета секретаря Министерства здравоохранения и социальных служб США по наследственным заболеваниям у новорожденных и детей. Генет Мед. 2014; 16: 183-187. [Перекрестная ссылка]
- Ceyhan-Birsoy O, Machini K, Lebo MS, Yu TW, Agrawal PB, Parad RB, et al. Кураторский список генов для сообщения результатов геномного секвенирования новорожденных.Генет Мед. 2017; 19: 809-818. [Перекрестная ссылка]
- Странде Н.Т., Риггс Э.
 Р., Бьюкенен А.Х., Джейхан-Бирсой О., ДиСтефано М., Дуайт С.С. и др. Оценка клинической достоверности ассоциаций генов и заболеваний: основанная на доказательствах структура, разработанная с помощью ресурса клинического генома. Am J Hum Genet. 2017; 100: 895-906. [Перекрестная ссылка]
Р., Бьюкенен А.Х., Джейхан-Бирсой О., ДиСтефано М., Дуайт С.С. и др. Оценка клинической достоверности ассоциаций генов и заболеваний: основанная на доказательствах структура, разработанная с помощью ресурса клинического генома. Am J Hum Genet. 2017; 100: 895-906. [Перекрестная ссылка] - Кауферт П.А.Политика здравоохранения и новая генетика. соц. мед. 2000 г.; 51: 821-829. [Перекрестная ссылка]
- Нопперс Б.М., Хиртл М., Гласс К.С. Политический форум: Генетические технологии. Коммерциализация генетических исследований и государственная политика. Наука. 1999 г.; 286: 2277-2278. [Перекрестная ссылка]
- Friedman JM, Cornel MC, Goldenberg AJ, Lister KJ, Senecal K, Vears DF, et al.Геномный скрининг новорожденных: соображения и рекомендации в отношении политики общественного здравоохранения. BMC Med Genomics. 2017; 10: 9. [Перекрестная ссылка]
- Берг Дж.
 С., Агравал П.Б., Бейли Д.Б., мл., Беггс А.Х., Бреннер С.Е., Брауэр А.М. и др. Секвенирование новорожденных в геномной медицине и здравоохранении. Педиатрия. 2017; 139: e20162252. [Перекрестная ссылка]
С., Агравал П.Б., Бейли Д.Б., мл., Беггс А.Х., Бреннер С.Е., Брауэр А.М. и др. Секвенирование новорожденных в геномной медицине и здравоохранении. Педиатрия. 2017; 139: e20162252. [Перекрестная ссылка] - Бодиан Д.Л., Кляйн Э., Айер Р.К., Вонг В.С., Котиял П., Штауффер Д. и др.Полезность полногеномного секвенирования для выявления нарушений скрининга новорожденных в популяционной когорте из 1696 новорожденных. Генет Мед. 2016; 18: 221-230. [Перекрестная ссылка]
- Эванс Дж. П., Берг Дж. С., Олшан А. Ф., Магнусон Т., Ример Б. К. Мы обследуем новорожденных, не так ли? Реализация перспектив геномики общественного здравоохранения. Генет Мед. 2013; 15: 332-334. [Перекрестная ссылка]
- Льюис М.А., Пакуин Р.С., Рош М.И., Фурберг Р.Д., Рини С., Берг Дж.С. и соавт.Поддержка решений родителей о геномном секвенировании для скрининга новорожденных: помощь в принятии решений NC NEXUS.
 Педиатрия. 2016; 137: С16-С23. [Перекрестная ссылка]
Педиатрия. 2016; 137: С16-С23. [Перекрестная ссылка] - Бомер Ф., Фаскель С., д’Отреп С., Жосс С., Дидеберг В., Сегерс К. и др. Пилотное исследование нового поколения по скринингу новорожденных: NGS на высохших пятнах крови выявляет причинные мутации у пациентов с наследственными метаболическими заболеваниями.Научный представитель 2017; 7: 17641. [Перекрестная ссылка]
- Франческатто Л., Кацанис Н. Скрининг новорожденных и эра медицинской геномики. Семин Перинатол. 2015 г.; 39: 617-622. [Перекрестная ссылка]
- Центры по контролю и профилактике заболеваний (CDC). Десять великих достижений в области общественного здравоохранения — США, 2001–2010 гг.MMWR Morb Mortal Wkly Rep. 2011; 60: 619-623.
- Howson CP, Cedergren B, Giugliani R, Huhtinen P, Padilla CD, Palubiak CS, et al. Всеобщий скрининг новорожденных: план действий.
 Мол Жене Метаб. 2018; 124: 177-183. [Перекрестная ссылка]
Мол Жене Метаб. 2018; 124: 177-183. [Перекрестная ссылка] - Верма IC, Пури РД.Глобальное бремя генетических заболеваний и роль генетического скрининга. Semin Fetal Neonatal Med. 2015 г.; 20: 354-363. [Перекрестная ссылка]
- Модель Б., Кулиев А. История генетики сообществ: вклад нарушений гемоглобина. Сообщество Генет. 1998 год; 1: 3-11. [Перекрестная ссылка]
- Террелл Б.Л., Падилла К.Д., Лебер Дж.Г., Кнайссер И., Саадалла А., Боррахо Г.Дж. и др.Текущее состояние скрининга новорожденных в мире: 2015. Семин Перинатол. 2015 г.; 39: 171-187. [Перекрестная ссылка]
- Террелл Б.Л., младший, Падилья CD. Скрининг новорожденных в развивающихся странах. Curr Opin Педиатр. 2018; 30: 734-739. [Перекрестная ссылка]
- Всемирная организация здравоохранения.
 Рекомендации ВОЗ по охране здоровья новорожденных, одобренные Комитетом по рассмотрению рекомендаций. В.; Май 2017 г.
Рекомендации ВОЗ по охране здоровья новорожденных, одобренные Комитетом по рассмотрению рекомендаций. В.; Май 2017 г.
Раннее выявление, диагностика и лечение посредством скрининга новорожденных
Келси Джордж | май 2021
КРАТКИЙ ОБЗОР ВАЖНЫХ ПРОБЛЕМ ДНЯ
Раннее выявление определенных состояний с помощью скрининга новорожденных может предотвратить тяжелые когнитивные и физические нарушения и даже смерть.Каждый год около 4 миллионов детей в США проходят скрининг на врожденные заболевания с использованием пяточной палочки для взятия образца крови, пульсоксиметрии для проверки уровня кислорода в крови и проверки слуха. Эти тесты выявили около 12 900 детей с редкими заболеваниями, такими как муковисцидоз, серповидно-клеточная анемия, врожденный гипотиреоз и потеря слуха. Процесс скрининга помогает медицинским работникам выявлять и лечить заболевания до появления симптомов.
ДЫК?
- Национальная рекомендуемая унифицированная панель скрининга включает 35 основных состояний и 26 вторичных состояний, рекомендуемых для программ скрининга новорожденных.

- Государственные программы скрининга новорожденных охватывают около 4 миллионов детей и ежегодно выявляют около 12 900 детей с расстройством скрининга новорожденных.
- В большинстве штатов взимается плата в размере от 30 до 203 долларов США за обследования новорожденных, которые обычно покрываются частным медицинским страхованием, Medicaid или Программой медицинского страхования детей.
В каждом штате есть собственная программа скрининга новорожденных, и каждый штат решает, какие состояния включать в панели скрининга. Чтобы определить, какие условия включить, федеральные и государственные консультативные комитеты изучают, если:
- Необходим скрининг.
- Без своевременного лечения существует значительный риск инвалидности или смерти.
- Эффективное лечение возможно.
- Лечение более эффективно в период новорожденности, чем в более позднем возрасте.
- Лечение и консультации широко доступны.
- Польза для общества превышает затраты на скрининг.

Многие панели скрининга новорожденных включают редкие заболевания и состояния, что позволяет младенцам и их семьям получить лечение, потенциально спасающее жизнь.Диагностика и лечение этих состояний ограничены и дороги, и стоят до сотен тысяч долларов в год. При принятии решения о том, какие состояния включить, штаты уравновешивают расходы на скрининг новорожденных и лечение редких заболеваний для программ штата и семей Medicaid с расходами на невыявленные и нелеченные редкие заболевания, которые могут привести к долгосрочной инвалидности или смерти. Например, Вашингтон обнаружил, что скрининг на тяжелый комбинированный иммунодефицит значительно снижает как смертность, так и медицинские расходы, посчитав экономически эффективным включение в государственную программу скрининга новорожденных.
Федеральное действие
Секретарь Министерства здравоохранения и социальных служб США дает основанные на фактических данных рекомендации через Рекомендованную единую группу скрининга (RUSP), список из 35 основных состояний, которые каждому штату рекомендуется включать в свою программу скрининга новорожденных, и 26 вторичных состояний, которые могут быть обнаружены путем скрининга основных состояний. Консультативный комитет по наследственным заболеваниям новорожденных и детей (ACHDNC), созданный в соответствии с Законом об общественном здравоохранении, рекомендует секретарю включить расстройства в RUSP.Матрица решений комитета по расширению скрининга новорожденных включает оценку преимуществ скрининга и возможности внедрения скрининга на уровне штата. Самым последним заболеванием, добавленным в RUSP, была спинальная мышечная атрофия (СМА) в 2018 году.
Консультативный комитет по наследственным заболеваниям новорожденных и детей (ACHDNC), созданный в соответствии с Законом об общественном здравоохранении, рекомендует секретарю включить расстройства в RUSP.Матрица решений комитета по расширению скрининга новорожденных включает оценку преимуществ скрининга и возможности внедрения скрининга на уровне штата. Самым последним заболеванием, добавленным в RUSP, была спинальная мышечная атрофия (СМА) в 2018 году.
Действия государства
Руководствуясь федеральными рекомендациями, штаты определяют расстройства в своих программах скрининга новорожденных и финансируют расходы на лабораторию, последующее наблюдение и управление программой. Все штаты требуют скрининга новорожденных и включают большинство состояний, рекомендованных в RUSP, но штатам может потребоваться несколько лет, чтобы полностью реализовать новые рекомендации.Государства иногда добавляют в панель беспорядок, не рекомендованный RUSP. Нью-Йорк стал первым штатом, в котором в 2006 году был проведен скрининг на болезнь Краббе, но в 2009 году ACHDNC проголосовал за то, чтобы не добавлять его в RUSP без дополнительной информации о типах заболевания, методах скрининга и эффективности лечения.
Процесс добавления новых заболеваний в панель скрининга новорожденных зависит от штата. Некоторые штаты устанавливают условия в законодательном порядке, в то время как другие требуют одобрения департамента здравоохранения штата или консультативного совета.Небраска добавила SMA, а Южная Каролина добавила болезнь Краббе в свои группы скрининга новорожденных в соответствии с законодательством в 2019 и 2020 годах соответственно. Луизиана в резолюции призвала свой департамент здравоохранения изучить затраты и преимущества добавления мукополисахаридоза типа I и болезни Помпе в свою панель скрининга. Орегон учредил Консультативный совет по скринингу пятен крови новорожденных в соответствии с законодательством в 2019 году, который рассматривал возможность добавления СМА в группу штата по скринингу новорожденных в 2020 году, но не достиг консенсуса, необходимого для одобрения этого добавления.Вирджиния требует, чтобы министерство здравоохранения раз в два года пересматривало национальные рекомендации и консультировалось с Консультативным комитетом по генетике Вирджинии по поводу изменений в его основной группе наследственных заболеваний и генетических заболеваний для скрининга новорожденных.
Дополнительные ресурсы
Финансирование и оплата программ скрининга новорожденных также различаются. Большинство штатов используют платный подход к финансированию программ скрининга новорожденных, чтобы обеспечить стабильные потоки доходов и покрыть расходы на лабораторию, последующее наблюдение и управление программой.Родильные дома и больницы либо выставляют счета напрямую, либо включают плату за скрининг новорожденных в расходы по беременности и родам, которые обычно покрываются частным медицинским страхованием, Medicaid или Программой медицинского страхования детей. ACA требует, чтобы планы медицинского страхования покрывали обследования, включенные в RUSP, но некоторые штаты устанавливают свои собственные требования к покрытию. Округ Колумбия требует, чтобы индивидуальные и групповые планы медицинского страхования покрывали расходы на обследование новорожденных. Северная Каролина взимает с больниц плату за скрининг новорожденных, чтобы покрыть стоимость лабораторных услуг для обработки результатов. Юта также взимает плату с больниц и добавило требование о том, чтобы Medicaid и план медицинского обслуживания государственных служащих покрывали генетическое тестирование на состояния в рамках программы скрининга новорожденных. В 2018 году в Колорадо был создан фонд скрининга новорожденных и генетического консультирования для покрытия расходов, связанных с скринингом новорожденных, последующим уходом, генетическим консультированием и образовательными программами.
Юта также взимает плату с больниц и добавило требование о том, чтобы Medicaid и план медицинского обслуживания государственных служащих покрывали генетическое тестирование на состояния в рамках программы скрининга новорожденных. В 2018 году в Колорадо был создан фонд скрининга новорожденных и генетического консультирования для покрытия расходов, связанных с скринингом новорожденных, последующим уходом, генетическим консультированием и образовательными программами.
Скрининг-тесты выявляют младенцев, у которых может быть определенное заболевание, но не могут диагностировать это состояние. Новорожденных с положительным результатом скрининга направляют к профильным поставщикам медицинских услуг для диагностического тестирования — для подтверждения или исключения состояния — и лечения, если оно доступно.Государственные органы здравоохранения играют важную роль в последующем наблюдении за семьями, используя системы отслеживания заболеваний и дополнительные программы поддержки, чтобы новорожденные получали необходимую им помощь.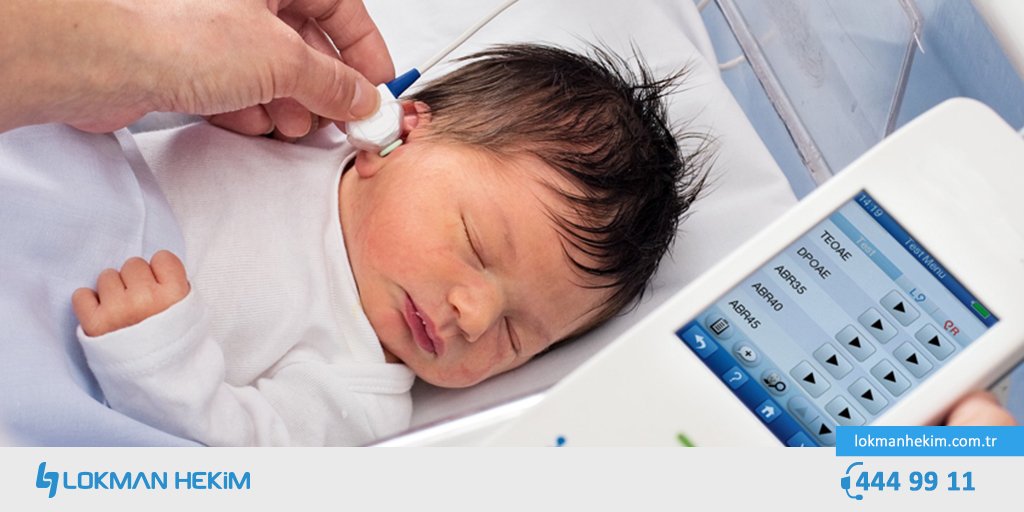 Индиана разрешила использовать свой реестр данных иммунизации для хранения и публикации информации о скрининге новорожденных, которую ведет отделение, чтобы облегчить доступ для поставщиков и пациентов. Пенсильвания учредила Программу скрининга и наблюдения новорожденных, чтобы усилить услуги последующего наблюдения, такие как направление к специалистам, подтверждающее тестирование, оценка и диагностика детей с аномальными или неубедительными результатами скрининга.Мэриленд добавил поддержку семьям через консультационные и образовательные услуги после положительного результата теста новорожденного на серповидно-клеточную анемию.
Индиана разрешила использовать свой реестр данных иммунизации для хранения и публикации информации о скрининге новорожденных, которую ведет отделение, чтобы облегчить доступ для поставщиков и пациентов. Пенсильвания учредила Программу скрининга и наблюдения новорожденных, чтобы усилить услуги последующего наблюдения, такие как направление к специалистам, подтверждающее тестирование, оценка и диагностика детей с аномальными или неубедительными результатами скрининга.Мэриленд добавил поддержку семьям через консультационные и образовательные услуги после положительного результата теста новорожденного на серповидно-клеточную анемию.
принципов программ геномного скрининга новорожденных: систематический обзор | Генетика и геномика | Открытие сети JAMA
Ключевые моментыВопрос Основываясь на имеющихся данных, как должна быть разработана и реализована программа геномного скрининга новорожденных (gNBS)?
Находки В этом систематическом обзоре было выявлено 36 соответствующих статей, чтобы проинформировать о важных моментах, которые следует учитывать при разработке программы gNBS.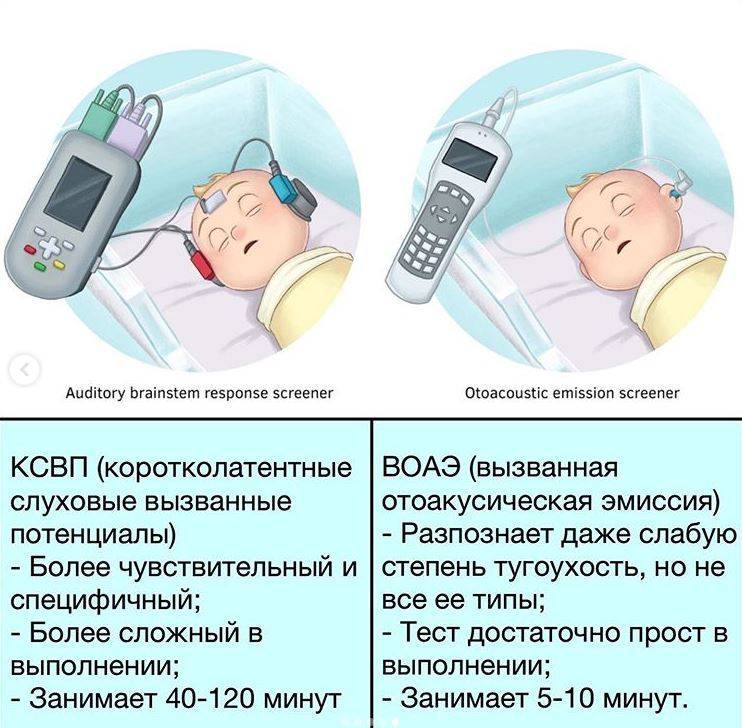 Они касались родительского интереса и интереса к тестированию; отбор генов; клиническая достоверность и полезность; и этические, правовые и социальные последствия.
Они касались родительского интереса и интереса к тестированию; отбор генов; клиническая достоверность и полезность; и этические, правовые и социальные последствия.
Значение Полученные данные свидетельствуют о том, что gNBS следует внедрять с ключевыми соображениями, касающимися выбора, гибкого согласия и прозрачного выбора генов и заболеваний, максимизируя достоверность и полезность, сводя к минимуму неопределенность и отражая этические ценности общества.
Важность Геномный скрининг новорожденных (gNBS) может оптимизировать здоровье и благополучие детей и семей.Программы скрининга должны быть доказательными, приемлемыми и полезными.
Цели Определить, что было обнаружено после отчетов о первых пилотных проектах gNBS, и предоставить краткое изложение ключевых моментов для разработки gNBS.
Обзор доказательств 14 апреля 2021 г. был проведен систематический обзор литературы, в ходе которого было выявлено 36 статей, в которых рассматривались следующие вопросы: (1) в чем заключается интерес и каково будет использование gNBS? (2) какие заболевания и гены следует включить? (3) какова действительность и полезность gNBS? и (4) каковы этические, правовые и социальные последствия? Статьи включались только в том случае, если они давали новые доказательства; все мнения были исключены.
Находки В 36 включенных статьях наблюдалась высокая согласованность, за исключением включения генных заболеваний, которое сильно варьировало. Основными выводами были необходимость равного доступа, соответствующих учебных материалов и информированного и гибкого согласия. Процесс отбора генов для тестирования должен быть прозрачным и отражать то, что родители ценят достоверность прогноза, а не практическую пользу. Данные следует анализировать таким образом, чтобы свести к минимуму неопределенность и случайные выводы.Расширение традиционного скрининга новорожденных (tNBS) для выявления более опасных для жизни и излечимых заболеваний необходимо уравновешивать сложностью получения согласия родителей новорожденных на геномное тестирование, а также риском того, что общее использование tNBS может снизиться. В литературе отражено, что право ребенка на самоопределение следует ценить больше, чем возможность всей семьи получить пользу от геномного теста новорожденного.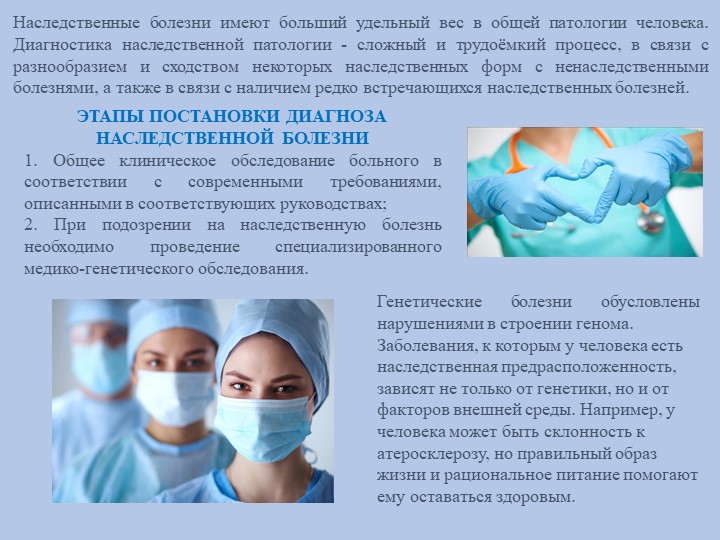
Выводы и актуальность Результаты этого систематического обзора показывают, что внедрение gNBS потребует тонкого подхода.В наших знаниях есть пробелы, такие как мнения различных групп населения, возможности систем здравоохранения и экономические последствия для здоровья. Крайне важно тщательно оценить результаты и обеспечить возможность развития программ для получения максимальной выгоды.
Геномика изменила картину генетики человека, применив ее ко всем медицинским специальностям на всех этапах жизни. Эта технология используется для улучшения показателей диагностики, понимания прогноза заболевания и разработки новых методов лечения. 1 ,2 Хотя концепция прецизионной медицины превратилась в реальную цель индивидуального здравоохранения, остаются вопросы о возможности и этичности использования геномики на благо общественного здравоохранения. 3
Геномика в период новорожденности в качестве скринингового теста для бессимптомных детей может выявить сотни заболеваний, которые, хотя и редки по отдельности, в совокупности ложатся тяжелым бременем на здоровье и экономику населения. 4 Кроме того, геномные образцы новорожденных можно повторно анализировать на протяжении всей жизни для постоянного скрининга или в зависимости от клинической необходимости. Традиционный скрининг новорожденных (tNBS) основывался на принципах, изложенных Wilson и Junger 5 в 1960-х годах, когда появились программы скрининга, нацеленные на тяжелые и излечимые педиатрические состояния. Несмотря на то, что количество проверяемых состояний увеличилось, принципы, по которым отбираются состояния, остались прежними. Использование геномного секвенирования для NBS (gNBS) не обязательно соответствует этим критериям, поскольку оно дает возможность скрининга как неизлечимых, так и взрослых заболеваний.
4 Кроме того, геномные образцы новорожденных можно повторно анализировать на протяжении всей жизни для постоянного скрининга или в зависимости от клинической необходимости. Традиционный скрининг новорожденных (tNBS) основывался на принципах, изложенных Wilson и Junger 5 в 1960-х годах, когда появились программы скрининга, нацеленные на тяжелые и излечимые педиатрические состояния. Несмотря на то, что количество проверяемых состояний увеличилось, принципы, по которым отбираются состояния, остались прежними. Использование геномного секвенирования для NBS (gNBS) не обязательно соответствует этим критериям, поскольку оно дает возможность скрининга как неизлечимых, так и взрослых заболеваний.
В ответ на это в 2008 г. была опубликована новая интерпретация критериев NBS с учетом генетики. 6 Среди этих критериев не упоминается лечение, но вводятся концепции информированного выбора и равного доступа. Позже, в 2011 г., Центры по контролю и профилактике заболеваний США (CDC) опубликовали инструмент ACCE, основу для оценки использования генетических тестов в здоровой популяции, включающую 4 ключевых области аналитической достоверности; клиническая достоверность; клиническая полезность; и этические, правовые и социальные последствия (ЭЛСИ). 7 В 2018 г. был проведен систематический обзор литературы NBS 8 для уточнения критериев с учетом современных взглядов, но конкретно геномика в нем не рассматривалась.
7 В 2018 г. был проведен систематический обзор литературы NBS 8 для уточнения критериев с учетом современных взглядов, но конкретно геномика в нем не рассматривалась.
Геномика добавляет сложности и риска NBS. Наиболее часто упоминаются необходимость обучения и согласия, риск потери автономии ребенка, генетическая дискриминация, снижение вовлеченности в программы tNBS, бремя вариантов с неопределенной значимостью (VUS) и заболеваний со сниженной пенетрантностью, стоимостью и хранением. и конфиденциальность данных. 9 ,10 Но также упоминаются преимущества, такие как возможность выявления большего количества заболеваний, предоставление детям доступа к профилактическим медицинским мерам и укрепление здоровья всей семьи. 11
Недавно появились данные, исследующие различные аспекты gNBS. 12 ,13 В частности, были завершены первые исследования, предлагающие фактическое тестирование новорожденных, 14 ,15 обеспечивающие понимание, которое дополняет более широкий массив гипотетических и лабораторных исследований. Здесь мы обобщаем литературу, содержащую новые данные о gNBS, и на их основе приводим практические соображения по разработке программы gNBS, в частности, отражая существующие критерии NBS и ACCE.
Здесь мы обобщаем литературу, содержащую новые данные о gNBS, и на их основе приводим практические соображения по разработке программы gNBS, в частности, отражая существующие критерии NBS и ACCE.
14 апреля 2021 г. был проведен поиск литературы в онлайн-базах данных, включая PubMed, OVID MEDLINE, OVID Embase и ProQuest. Поиск проводился для всех типов исследований, опубликованных на английском языке, с использованием заголовков MeSH и ключевых слов: ( Неонатальный Скрининг ) И ( Геном, Человек/ геном/ или экзом/ ) ИЛИ ( анализ последовательности, ДНК/ или анализ мутаций ДНК/ ) ИЛИ ( геномика/или проект генома человека/ ) ИЛИ ( анализ последовательности/ или высокопроизводительное секвенирование нуклеотидов / или аннотация молекулярной последовательности / ).Статьи проверялись по заголовку и аннотации на релевантность. Затем полнотекстовые статьи оценивались на соответствие требованиям. Списки литературы всех включенных статей, отвечающих критериям, были пересмотрены для определения дополнительных статей для включения.
Были установлены критерии включения, которые включали оригинальные исследования, посвященные 4 ключевым областям исследования: (1) родительский интерес и понимание, (2) заболевание и селекция генов, (3) достоверность и полезность и (4) ELSI. Мы исключили тезисы конференций.Мнения также были исключены на том основании, что они не содержали новых доказательств. Список идентифицированных статей представлен в электронной таблице 1 в Приложении. Кроме того, статьи, посвященные геномному секвенированию в качестве теста второго уровня для отслеживания существующих результатов NBS, были исключены на том основании, что они представляют геномику для диагностических целей. 10 Включает литературу по NBS при муковисцидозе. Также были исключены статьи об альтернативных генетических технологиях, таких как целевые микрочипы, эксцизионные круги Т-клеточных рецепторов (TREC) и полногеномные ассоциативные исследования (GWAS).Эти технологии либо применяются к определенным группам заболеваний (например, TREC для выявления иммунодефицита), либо обеспечивают скрининг восприимчивости (например, GWAS для выявления вероятности развития диабета 1 типа). Эти анализы поднимают вопросы, отличные от тех, которые возникают при рассмотрении геномного секвенирования моногенных заболеваний. Наконец, мы исключили статьи, оценивающие возможность использования хранящихся высушенных образцов пятен крови для выделения ДНК, поскольку мы определили, что возможность секвенирования ДНК, извлеченной из небольших количеств крови или слюны, вытеснила актуальность этого метода как метода.
Эти анализы поднимают вопросы, отличные от тех, которые возникают при рассмотрении геномного секвенирования моногенных заболеваний. Наконец, мы исключили статьи, оценивающие возможность использования хранящихся высушенных образцов пятен крови для выделения ДНК, поскольку мы определили, что возможность секвенирования ДНК, извлеченной из небольших количеств крови или слюны, вытеснила актуальность этого метода как метода.
Данные были извлечены по стандартной форме из всех исследований в соответствии с руководством по отчетности «Предпочтительные элементы отчетности для систематических обзоров и метаанализов» (PRISMA). 16 Записанная информация включала первого автора, год публикации, место, план исследования, размер выборки, изучаемую популяцию, объем и метод тестирования, показатели результатов, основные результаты, а также сильные и слабые стороны исследования (таблица 2 в Приложении). .
Блок-схема процесса обзора литературы представлена на рисунке 1.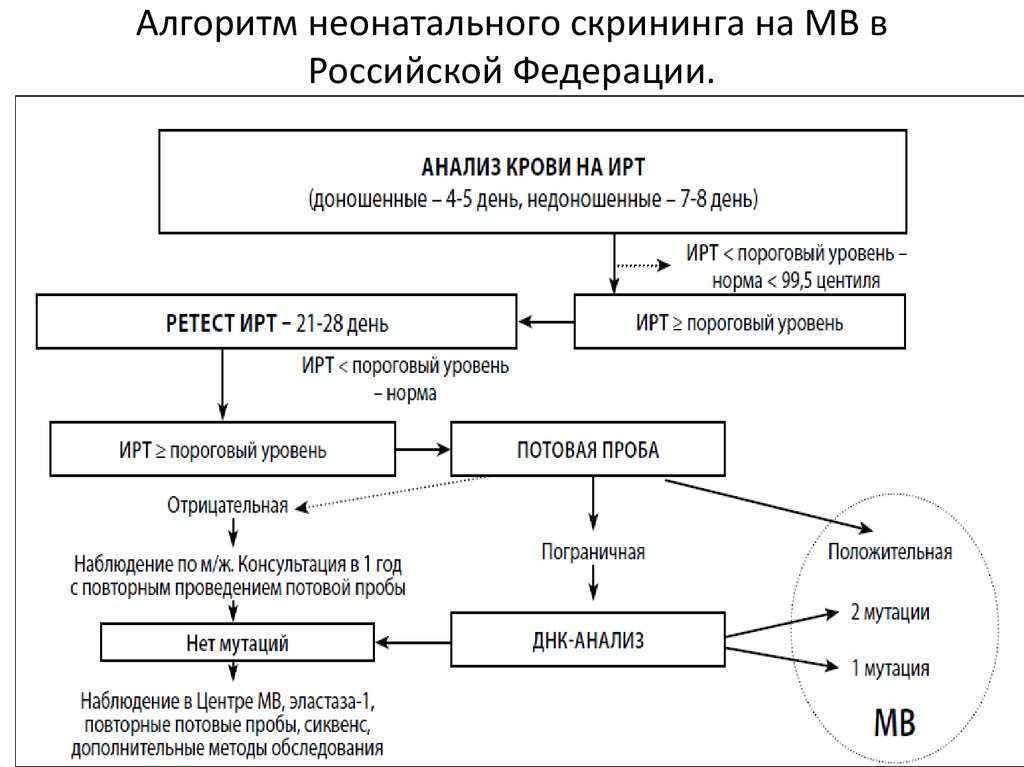 Стратегия поиска дала 650 статей. После того, как записи были проверены на актуальность и удалены дубликаты, 143 записи остались для оценки. Всего было исключено 107 записей, осталось 36 исследований. Они были объединены в 4 категории, как подробно описано в таблице и резюмированы ниже. 14 ,15,17 -33,35 -51
Стратегия поиска дала 650 статей. После того, как записи были проверены на актуальность и удалены дубликаты, 143 записи остались для оценки. Всего было исключено 107 записей, осталось 36 исследований. Они были объединены в 4 категории, как подробно описано в таблице и резюмированы ниже. 14 ,15,17 -33,35 -51
Родительский интерес и понимание
Четырнадцать статей 15 ,17 -30 посвящены интересам родителей и населения к gNBS.Двенадцать исследований 17 -24,26 -29 использовали гипотетическое предложение gNBS, из которых 9 исследований 17 -19,23 ,24,26 -9 методология и 3 исследования 20 -22 использовали интервью. В двух исследованиях 15 ,30 было предложено геномное секвенирование новорожденных и изучалось отношение родителей и мотивация для принятия или отказа от тестирования. В выборку вошли родители в целом, родители новорожденных, беременные пары, взрослое население в целом и медицинские работники.В каждом исследовании большинство респондентов были белыми женщинами.
В выборку вошли родители в целом, родители новорожденных, беременные пары, взрослое население в целом и медицинские работники.В каждом исследовании большинство респондентов были белыми женщинами.
Включение генов и болезней
В трех исследованиях 31 -33 подробно рассматривались процессы выбора генов и/или условий для тестирования в gNBS. Эти статьи взяты из 2 исследований в США; NC NEXUS и Babyseq. Они использовали разные подходы к курированию генов и пришли к разным спискам для gNBS: BabySeq с 954 генами по сравнению с 292 генами для NC NEXUS, не все из которых были оценены группой BabySeq, и наоборот.В одном исследовании 35 оценивались списки генов gNBS, предназначенные непосредственно для потребителей.
Десять исследований 14 ,36 -44 рассматривали обоснованность и полезность использования геномного секвенирования для дополнения или замены tNBS. Четыре исследования 36 ,37,43 ,44 изучали использование геномного тестирования с целевым анализом для дополнения tNBS. Только в 3 исследованиях 14 ,41 ,44 была протестирована когорта здоровых младенцев, в то время как в остальных были отобраны когорты с результатами tNBS.В двух исследованиях , 39, , , 41, использовалась автоматизация первого прохода для выявления патогенных и вероятно патогенных вариантов. Одно исследование 43 представляло собой смоделированную модель gNBS для синдромов предрасположенности к раку.
Четыре исследования 36 ,37,43 ,44 изучали использование геномного тестирования с целевым анализом для дополнения tNBS. Только в 3 исследованиях 14 ,41 ,44 была протестирована когорта здоровых младенцев, в то время как в остальных были отобраны когорты с результатами tNBS.В двух исследованиях , 39, , , 41, использовалась автоматизация первого прохода для выявления патогенных и вероятно патогенных вариантов. Одно исследование 43 представляло собой смоделированную модель gNBS для синдромов предрасположенности к раку.
Было выявлено семь статей 45 -51 , которые оценивали ELSI. Два исследования 45 ,52 представили экспертные рекомендации, рекомендации и соображения по этическим аспектам gNBS в целом, полученные на основе консенсуса групп лиц, обладающих опытом в соответствующих областях геномики и этики. В одной статье 46 был проведен обзор литературы, чтобы определить, как оценивать психосоциальные результаты их исследования в gNBS (BabySeq). В трех статьях , 48, , , 51, , , 53, использовались тематические исследования для выделения и определения важных этических соображений, особенно в отношении объема возвращенных результатов. Два из этих 51 ,53 были примерно одинаковыми случаями из исследования Babyseq и представляли разные аргументы в отношении этического подхода к gNBS. В одном исследовании 49 изучалась правовая база, правила и конституционные основы существующих программ NBS в США, а также то, как gNBS может вписаться в них или оспорить их.
В одной статье 46 был проведен обзор литературы, чтобы определить, как оценивать психосоциальные результаты их исследования в gNBS (BabySeq). В трех статьях , 48, , , 51, , , 53, использовались тематические исследования для выделения и определения важных этических соображений, особенно в отношении объема возвращенных результатов. Два из этих 51 ,53 были примерно одинаковыми случаями из исследования Babyseq и представляли разные аргументы в отношении этического подхода к gNBS. В одном исследовании 49 изучалась правовая база, правила и конституционные основы существующих программ NBS в США, а также то, как gNBS может вписаться в них или оспорить их.
На основе 4 выявленных областей мы составили сводку рекомендаций по программе gNBS. Они показаны на рис. 2.
Родительский интерес и использование gNBS
Был отмечен высокий уровень интереса (>60%) как к гипотетическим, так и к фактическим предложениям gNBS; тем не менее, были значительные различия в желаемом объеме возвращаемых результатов. В то время как родительская поддержка расширения NBS для наблюдения за неизлечимыми расстройствами была обнаружена, 18 ,24 поддержка выявления генетических факторов риска заболевания была меньше. 54 Последовательно, наибольшее значение придавалось тому, является ли тест точным для прогнозирования заболевания. 54 ,55 Кроме того, в то время как родители в подавляющем большинстве хотели активного участия в согласии, 28 ,29 были доказательства того, что введение gNBS и необходимость более подробного согласия снизят участие в tNBS. 17 ,20 ,21 Это является аргументом против интеграции геномного тестирования в существующие программы NBS, поскольку оно может причинить вред из-за более низкого охвата, что приведет к пропущенному диагнозу излечимых состояний. Кроме того, в поддержку отделения gNBS от tNBS, 1 исследование 15 показало, что получение дополнительной геномной информации в режиме реального времени было самым низким у родителей с младенцами младше 3 месяцев.
В то время как родительская поддержка расширения NBS для наблюдения за неизлечимыми расстройствами была обнаружена, 18 ,24 поддержка выявления генетических факторов риска заболевания была меньше. 54 Последовательно, наибольшее значение придавалось тому, является ли тест точным для прогнозирования заболевания. 54 ,55 Кроме того, в то время как родители в подавляющем большинстве хотели активного участия в согласии, 28 ,29 были доказательства того, что введение gNBS и необходимость более подробного согласия снизят участие в tNBS. 17 ,20 ,21 Это является аргументом против интеграции геномного тестирования в существующие программы NBS, поскольку оно может причинить вред из-за более низкого охвата, что приведет к пропущенному диагнозу излечимых состояний. Кроме того, в поддержку отделения gNBS от tNBS, 1 исследование 15 показало, что получение дополнительной геномной информации в режиме реального времени было самым низким у родителей с младенцами младше 3 месяцев. Однако примечательно, что в исследовании, в котором gNBS предлагалось в течение 48 часов после рождения, ни один из родителей не отказался от tNBS, что указывает на то, что опасения по поводу того, что gNBS может повлиять на использование программ tNBS, могут быть необоснованными. 26 В другой когорте, за которой наблюдали в течение 2 лет, уровень интереса к gNBS оставался высоким, при этом интерес со временем возрастал среди родителей, которые беспокоились о здоровье своего ребенка. 26 ,27
Однако примечательно, что в исследовании, в котором gNBS предлагалось в течение 48 часов после рождения, ни один из родителей не отказался от tNBS, что указывает на то, что опасения по поводу того, что gNBS может повлиять на использование программ tNBS, могут быть необоснованными. 26 В другой когорте, за которой наблюдали в течение 2 лет, уровень интереса к gNBS оставался высоким, при этом интерес со временем возрастал среди родителей, которые беспокоились о здоровье своего ребенка. 26 ,27
В пользу предложения gNBS отдельно от tNBS говорит признанная потребность в обучении и информированном согласии, что поднималось в многочисленных качественных исследованиях. 20 Несмотря на положения об образовании, родители могут не полностью осознавать возможность неопределенности, которую может вызвать геномное тестирование.Несколько исследований выявили важность использования средств принятия решений для повышения уровня образования и понимания геномного тестирования. 23 ,55 Образовательные ресурсы в идеале должны быть интерактивными и адаптируемыми, чтобы обеспечить гибкое согласие. Исторически сложилось так, что очное генетическое консультирование считалось оптимальным подходом; однако, с более широким использованием информационных технологий, более вероятно, что эти ресурсы станут передовой линией предоставления информации в программах скрининга населения.
23 ,55 Образовательные ресурсы в идеале должны быть интерактивными и адаптируемыми, чтобы обеспечить гибкое согласие. Исторически сложилось так, что очное генетическое консультирование считалось оптимальным подходом; однако, с более широким использованием информационных технологий, более вероятно, что эти ресурсы станут передовой линией предоставления информации в программах скрининга населения.
В одном исследовании 25 изучались мнения медицинских работников, работающих в этой области. Выяснилось, что медицинские работники в основном согласны с мнением родителей, т. е. в том, что информированное согласие необходимо и что gNBS не должно быть обязательным или исключать, как это делается во многих странах.
Фактическое потребление было одинаковым в 2 исследованиях, в которых родителям предлагали gNBS, т. е. 67% (268 из 402) 30 и 68% (72 из 106), 15 , несмотря на то, что это были разные когорты, причем 1 включал комбинацию здоровых младенцев и младенцев с очень тяжелыми заболеваниями, поступивших в отделение интенсивной терапии новорожденных 30 , а другое включает в себя системно здоровых детей с врожденной глухотой. 15 Сходство между этими исследованиями заключается в том, что оба уже дали согласие участников на исследование, и поэтому эти результаты нельзя обобщать.
15 Сходство между этими исследованиями заключается в том, что оба уже дали согласие участников на исследование, и поэтому эти результаты нельзя обобщать.
Таким образом, общественное мнение о gNBS в основном поддерживает его введение и предпосылку расширения того, что ожидается от tNBS. Сопоставленные данные предполагают отход от требования доступности лечения для всех состояний. Также признается важность личной полезности для семей и отдельных лиц, которая все чаще учитывается при принятии решений в области здравоохранения и не всегда согласуется с клинической полезностью. 34 ,56
Отбор генов и условий
Объем gNBS является важным фактором при его оценке. В литературе нет единого мнения о том, какие заболевания и гены следует включать. Имеющиеся данные свидетельствуют о том, что родители ценят точность тестов и знание состояния, 54 ,55 указывая на то, что ассоциация с заболеванием и пенетрантность могут считаться приоритетом над действенностью. Все чаще можно использовать общие платформы с открытым исходным кодом для обеспечения согласованности анализа списка генов. 57
Все чаще можно использовать общие платформы с открытым исходным кодом для обеспечения согласованности анализа списка генов. 57
Группа NC NEXUS 31 ,33 использовала показатель, который генерировал оценку для каждой пары ген-заболевание, отражающую эффективность медицинских действий. Они объединили этот показатель с возрастом начала этого состояния, чтобы объединить пары ген-заболевание. Первый бин включал состояния, которые проявляются в детстве и требуют медицинского вмешательства, и поэтому были сочтены подходящими для gNBS.Затем они использовали эту метрику для оценки пригодности gNBS, предназначенных непосредственно для потребителя. 35 В отличие от этого, группа BabySeq 32 начала с подсчета доказательств связи между геном и заболеванием, а затем оценила гены по возрасту начала заболевания и имеющимся данным о пенетрантности. В результате было выделено 3 категории для анализа: «Категория A: гены, включенные в отчет о секвенировании генома новорожденных (NGSR) с окончательными или убедительными доказательствами того, что они вызывают расстройство с высокой пенетрантностью, дебютирующее в детском возрасте. Категория B: гены, включенные в NGSR на основе активности в детстве.Категория C: гены, которые не соответствуют критериям для возврата в NGSR». 32 Обе группы согласились с тем, что прозрачный процесс выбора генов и сообщения о них необходим.
Категория B: гены, включенные в NGSR на основе активности в детстве.Категория C: гены, которые не соответствуют критериям для возврата в NGSR». 32 Обе группы согласились с тем, что прозрачный процесс выбора генов и сообщения о них необходим.
Многие другие исследования 15 ,39 -41 включали детали того, как они создавали списки генов для анализа в методах. Они сильно различались в зависимости от критериев, выбранных исследовательской группой.
Клиническая достоверность и полезность
Семь исследований изучали клиническую достоверность gNBS по сравнению с tNBS путем изучения когорт, у которых были результаты по tNBS.Они обнаружили, что добавление gNBS приводило к более ранней и быстрой диагностике, но не превосходило ее с точки зрения чувствительности и специфичности. Было показано, что gNBS особенно полезен у нездоровых новорожденных, тогда как результаты tNBS трудно интерпретировать. 36 ,37 Только 3 исследования 14 ,41 ,44 тестировали когорты здоровых младенцев и снова подтвердили идею о том, что tNBS и gNBS дополняют друг друга, с перекрывающейся чувствительностью и специфичностью.Другие исследования , 38, , , 42, изучали, может ли gNBS заменить tNBS, и пришли к выводу, что сложность результатов VUS, а также сложность их интерпретации без биохимических данных делают замену неосуществимой. Предложения по решению этой проблемы включали усиление интеграции между клиницистом и лабораторией, чтобы сделать интерпретацию вариантов более точной и, следовательно, привести к меньшему количеству результатов VUS 38 или обнаружению только патогенных вариантов, 42 , что также повышает аналитическую достоверность.
Было показано, что gNBS особенно полезен у нездоровых новорожденных, тогда как результаты tNBS трудно интерпретировать. 36 ,37 Только 3 исследования 14 ,41 ,44 тестировали когорты здоровых младенцев и снова подтвердили идею о том, что tNBS и gNBS дополняют друг друга, с перекрывающейся чувствительностью и специфичностью.Другие исследования , 38, , , 42, изучали, может ли gNBS заменить tNBS, и пришли к выводу, что сложность результатов VUS, а также сложность их интерпретации без биохимических данных делают замену неосуществимой. Предложения по решению этой проблемы включали усиление интеграции между клиницистом и лабораторией, чтобы сделать интерпретацию вариантов более точной и, следовательно, привести к меньшему количеству результатов VUS 38 или обнаружению только патогенных вариантов, 42 , что также повышает аналитическую достоверность.
Что касается клинической пользы, существует некоторый консенсус в отношении того, что анализ целевой панели генов предпочтительнее широкого геномного секвенирования, что снижает потенциальный вред от обнаружения VUS и случайных находок.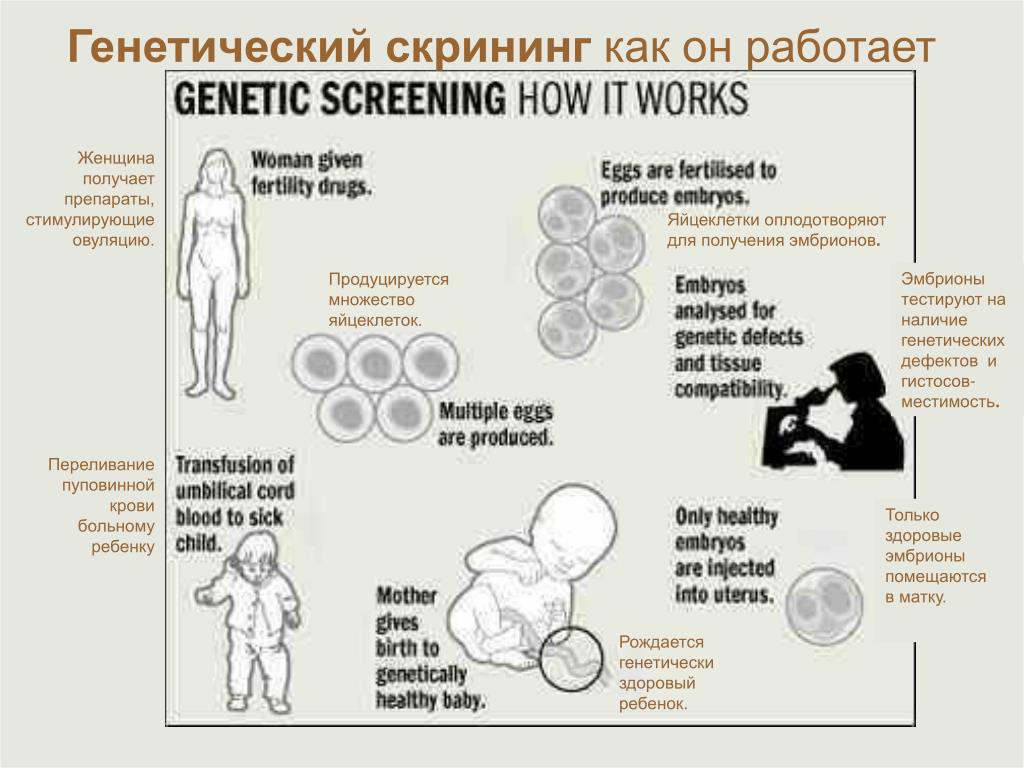 39 ,40 Два исследования 39 ,41 использовали автоматизацию первого прохода для выявления патогенных и вероятно патогенных вариантов и пришли к выводу, что это повысило эффективность и рентабельность.
39 ,40 Два исследования 39 ,41 использовали автоматизацию первого прохода для выявления патогенных и вероятно патогенных вариантов и пришли к выводу, что это повысило эффективность и рентабельность.
В нескольких статьях 39 ,40,42 ,43 было обнаружено, что gNBS значительно увеличивает число детей, диагностированных благодаря способности выявлять нарушения без биохимического теста, с отсроченным началом или легким фенотипом, которые, вероятно, пропущен с текущим скринингом.В отношении таких заболеваний, как иммунодефицитные состояния и синдромы предрасположенности к раку, постулируется экономия средств системы здравоохранения в долгосрочной перспективе.
Полезность — клиническую или личную — бывает трудно измерить, особенно в одно время, как показано в 1 исследовании 14 , в котором у нескольких младенцев был выявлен патогенный или вероятно патогенный вариант гена кардиомиопатии со сниженной пенетрантностью. Без долгосрочного наблюдения за большими когортами трудно предсказать положительное и отрицательное влияние такого типа результатов на отдельных лиц, семьи и медицинскую систему.
Без долгосрочного наблюдения за большими когортами трудно предсказать положительное и отрицательное влияние такого типа результатов на отдельных лиц, семьи и медицинскую систему.
Выводы, сделанные из литературы, заключаются в том, что геномное тестирование в настоящее время не превосходит tNBS с точки зрения чувствительности, специфичности или экономической эффективности и, следовательно, не должно рассматриваться в качестве замены. Скорее, его следует рассматривать как дополнительный или независимый способ доступа к прецизионной медицинской помощи для отдельных лиц. Важным соображением является разделение предложений gNBS и tNBS, чтобы не ставить под угрозу успех и эффективность tNBS. Это необходимо сопоставить с пользой увеличения диапазона состояний, которые можно обнаружить в периоде новорожденности, включая те, которые соответствуют традиционным критериям излечимости в раннем возрасте, такие как иммунодефициты.Предоставление адекватной информации и ресурсов для родителей, чтобы они могли принять участие, если они сочтут это полезным для своих обстоятельств и убеждений, будет важным компонентом любой программы.
В литературе существует консенсус в отношении некоторых ELSI. Одним из них является важность минимизации психологического вреда и стресса для родителей. Потенциальный подход заключается в использовании целевого анализа, 45 ,46,52 , тем самым снижая результаты VUS и идентифицируя варианты в генах с пониженной пенетрантностью.Другой способ — включить подробное информированное согласие, чтобы родители могли понимать потенциальные риски и давали согласие только в том случае, если польза для них перевешивает потенциальный вред. 45 ,47 ,48 Однако было также подчеркнуто, что больший выбор не обязательно означает лучший и что более сложный выбор может подорвать понимание, тем самым ставя под угрозу принятие информированных решений. 45
В одной статье 49 оценивалась текущая правовая база США, в соответствии с которой работает tNBS, и применялась она к gNBS. Он пришел к выводу, что геномное тестирование следует использовать только для целенаправленного подтверждения результатов tNBS и что дальнейшее раскрытие геномных данных новорожденных родителям потребует специальных процедур согласия и/или юридических уточнений.
Он пришел к выводу, что геномное тестирование следует использовать только для целенаправленного подтверждения результатов tNBS и что дальнейшее раскрытие геномных данных новорожденных родителям потребует специальных процедур согласия и/или юридических уточнений.
В трех исследованиях 48 ,50 ,51 использовались отдельные случаи, чтобы выделить этические и моральные вопросы, поднятые gNBS, что помогло контекстуализировать соображения. Одним из спорных вопросов является смещение целей NBS не только для ребенка, но и для всей семьи.Этот вопрос широко обсуждался, и большинство заинтересованных сторон придавали наивысшее значение этическому принципу права ребенка на самоопределение выше соображений семьи. 45 ,47 ,51 Основной проблемой является отсутствие эмпирических данных о вреде или пользе, 46 при этом большая часть литературы по ЭЛСИ основана на мнении экспертов. Это ключевая область оценки внедрения gNBS.
Ограничения этих выводов заключаются в том, что литература отражает точку зрения белых, женщин и людей с более высоким социально-экономическим статусом, и что в данных требуется больше разнообразия.Кроме того, системы здравоохранения во всем мире имеют разные возможности NBS, что снижает возможность обобщения этих результатов. Кроме того, отсутствуют исследования, посвященные нагрузке на рабочую силу, экономику здравоохранения и хранение данных. Выводы, сделанные из этого обзора, являются предметом развивающихся исследований, которые активно ведутся в этой области.
Литература предоставила информацию о соображениях и структуре программы gNBS, подчеркнув необходимость тонкого подхода.Благодаря достижениям в области технологий и гибкости подхода программа gNBS достижима и потенциально может принести значительную пользу населению. В этом обзоре были представлены доказательства и практическое резюме, на которых основывалась разработка программы. Независимо от того, как предлагается программа gNBS, важно тщательно оценить результаты и процессы и убедиться, что она способна развиваться для удовлетворения потребностей населения, которому она служит. 59
Независимо от того, как предлагается программа gNBS, важно тщательно оценить результаты и процессы и убедиться, что она способна развиваться для удовлетворения потребностей населения, которому она служит. 59
Принято к публикации: 21 апреля 2021 г.
Опубликовано: 20 июля 2021 г. doi:10.1001/jamanetworkopen.2021.14336
Открытый доступ: Это статья в открытом доступе, распространяемая на условиях лицензии CC-BY. © 2021 Дауни Л. и др. Открытие сети JAMA .
Автор, ответственный за переписку: Дэвид Дж. Амор, доктор философии, Детский научно-исследовательский институт Мердока, MCRI, Flemington Rd, Parkville, Victoria, Australia 3052 ([email protected]).
Вклад авторов: Доктор Дауни имел полный доступ ко всем данным исследования и берет на себя ответственность за целостность данных и точность анализа данных.
Концепция и дизайн: Все авторы.
Сбор, анализ или интерпретация данных: Все авторы.
Составление рукописи: Дауни, Холлидей.
Критическая проверка рукописи на наличие важного интеллектуального содержания: Все авторы.
Статистический анализ: Дауни.
Получено финансирование: Любовь.
Административная, техническая или материальная поддержка: Любовь.
Контроль: Холлидей, Льюис, Амор.
Раскрытие информации о конфликте интересов: Доктор Амор сообщил о получении грантов от Melbourne Genomics Health Alliance во время проведения исследования, а также от Национального совета по здравоохранению и медицинским исследованиям Австралии, Фонда исследований Прадера-Вилли, Фонда Прадера-Вилли. Исследовательский фонд Австралии, Детский фонд финансовых рынков и Национальные институты здравоохранения вне представленной работы.Других раскрытий не поступало.
1.Кларк ММ, Старк Z, Фарнеш Л, и другие. Метаанализ диагностической и клинической пользы секвенирования генома и экзома и хромосомного микрочипа у детей с подозрением на генетические заболевания. NPJ Genom Med . 2018;3:16. doi: 10.1038/s41525-018-0053-8PubMedGoogle ScholarCrossref 2.Ikawa
Ю, Миччио
А, Магрин
Е, Квятковски
JL, Ривелла
С, Каваццана
М.Генная терапия гемоглобинопатий: прогресс и будущие задачи. Хум Мол Жене . 2019;28(R1):R24-R30. doi:10.1093/hmg/ddz172PubMedGoogle ScholarCrossref 3.Johnston
Дж, Лантос
JD, Гольденберг
А, Чен
Ф, Паренс
Э, Кениг
БА; члены Консультативного совета по этике и политике NSIGHT. Секвенирование новорожденных: призыв к тонкому использованию геномных технологий. Респ. центр Гастингса . 2018;48(доп.2):S2-S6. дои: 10.1002/хаст.874PubMedGoogle ScholarCrossref 6.Андерманн
А, Бланкерт
Я, Бошан
С, Дери
В.
Метаанализ диагностической и клинической пользы секвенирования генома и экзома и хромосомного микрочипа у детей с подозрением на генетические заболевания. NPJ Genom Med . 2018;3:16. doi: 10.1038/s41525-018-0053-8PubMedGoogle ScholarCrossref 2.Ikawa
Ю, Миччио
А, Магрин
Е, Квятковски
JL, Ривелла
С, Каваццана
М.Генная терапия гемоглобинопатий: прогресс и будущие задачи. Хум Мол Жене . 2019;28(R1):R24-R30. doi:10.1093/hmg/ddz172PubMedGoogle ScholarCrossref 3.Johnston
Дж, Лантос
JD, Гольденберг
А, Чен
Ф, Паренс
Э, Кениг
БА; члены Консультативного совета по этике и политике NSIGHT. Секвенирование новорожденных: призыв к тонкому использованию геномных технологий. Респ. центр Гастингса . 2018;48(доп.2):S2-S6. дои: 10.1002/хаст.874PubMedGoogle ScholarCrossref 6.Андерманн
А, Бланкерт
Я, Бошан
С, Дери
В. Возвращение к Уилсону и Юнгнеру в геномную эпоху: обзор критериев скрининга за последние 40 лет. Бык Всемирный орган здравоохранения . 2008;86(4):317-319. doi:10.2471/BLT.07.050112PubMedGoogle ScholarCrossref 7.Becker
Ф, ван Эль
CG, Ибаррета
Д,
и другие. Генетическое тестирование и распространенные расстройства в системе общественного здравоохранения: как оценить актуальность и возможности: справочный документ к рекомендациям ESHG по генетическому тестированию и распространенным расстройствам. Eur J Hum Genet . 2011;19(доп.1):S6-S44. doi:10.1038/ejhg.2010.249PubMedGoogle ScholarCrossref 8.Dobrow
MJ, Хагенс
Ви, Чейф
Р, Салливан
Т, Рабенек
Л. Сводные принципы скрининга, основанные на систематическом обзоре и процессе консенсуса. CMAJ . 2018;190(14):E422-E429. doi:10.1503/cmaj.171154PubMedGoogle ScholarCrossref 14.
Возвращение к Уилсону и Юнгнеру в геномную эпоху: обзор критериев скрининга за последние 40 лет. Бык Всемирный орган здравоохранения . 2008;86(4):317-319. doi:10.2471/BLT.07.050112PubMedGoogle ScholarCrossref 7.Becker
Ф, ван Эль
CG, Ибаррета
Д,
и другие. Генетическое тестирование и распространенные расстройства в системе общественного здравоохранения: как оценить актуальность и возможности: справочный документ к рекомендациям ESHG по генетическому тестированию и распространенным расстройствам. Eur J Hum Genet . 2011;19(доп.1):S6-S44. doi:10.1038/ejhg.2010.249PubMedGoogle ScholarCrossref 8.Dobrow
MJ, Хагенс
Ви, Чейф
Р, Салливан
Т, Рабенек
Л. Сводные принципы скрининга, основанные на систематическом обзоре и процессе консенсуса. CMAJ . 2018;190(14):E422-E429. doi:10.1503/cmaj.171154PubMedGoogle ScholarCrossref 14. Джейхан-Бирсой
О, Мюрри
JB, Машини
К,
и другие; Команда проекта BabySeq.Интерпретация результатов геномного секвенирования у здоровых и больных новорожденных: результаты проекта BabySeq. Am J Hum Genet . 2019;104(1):76-93. doi:10.1016/j.ajhg.2018.11.016PubMedGoogle ScholarCrossref 15.Downie
Л, Холлидей
Дж, Льюис
С,
и другие. Секвенирование экзома у новорожденных с врожденной глухотой как модель для геномного скрининга новорожденных: проект Baby Beyond Hearing. Genet Med . 2020;22(5):937-944. doi:10.1038/s41436-019-0745-1PubMedGoogle ScholarCrossref 16.Мохер
Д, Либерати
А, Тецлафф
Дж., Альтман
ДГ; Группа ПРИЗМА. Предпочтительные элементы отчетности для систематических обзоров и метаанализов: заявление PRISMA. PLoS Med . 2009;6(7):e1000097. doi:10.1371/journal.pmed.1000097PubMedGoogle Scholar20.
Джейхан-Бирсой
О, Мюрри
JB, Машини
К,
и другие; Команда проекта BabySeq.Интерпретация результатов геномного секвенирования у здоровых и больных новорожденных: результаты проекта BabySeq. Am J Hum Genet . 2019;104(1):76-93. doi:10.1016/j.ajhg.2018.11.016PubMedGoogle ScholarCrossref 15.Downie
Л, Холлидей
Дж, Льюис
С,
и другие. Секвенирование экзома у новорожденных с врожденной глухотой как модель для геномного скрининга новорожденных: проект Baby Beyond Hearing. Genet Med . 2020;22(5):937-944. doi:10.1038/s41436-019-0745-1PubMedGoogle ScholarCrossref 16.Мохер
Д, Либерати
А, Тецлафф
Дж., Альтман
ДГ; Группа ПРИЗМА. Предпочтительные элементы отчетности для систематических обзоров и метаанализов: заявление PRISMA. PLoS Med . 2009;6(7):e1000097. doi:10.1371/journal.pmed.1000097PubMedGoogle Scholar20. Joseph
Г, Чен
Ф, Харрис-Вай
Джей, Пак
ДжМ, Янг
С, Кениг
БА. Взгляд родителей на расширенный скрининг новорожденных с использованием полногеномного секвенирования. Педиатрия .2016;137(доп.1):S36-S46. doi:10.1542/peds.2015-3731HPubMedGoogle ScholarCrossref 21.Kerruish
Н. Опыт родителей через 12 лет после скрининга новорожденных на генетическую предрасположенность к диабету 1 типа и их отношение к секвенированию всего генома у новорожденных. Genet Med . 2016;18(3):249-258. doi: 10.1038/gim.2015.73PubMedGoogle ScholarCrossref 23.Paquin
RS, Пейнадо
С, Льюис
Массачусетс,
и другие. Теоретико-поведенческая оценка прояснения ценностей родительских убеждений и намерений в отношении секвенирования генома для новорожденных. Социально-медицинская служба . 2018;2021;271:112037. doi:10.
Joseph
Г, Чен
Ф, Харрис-Вай
Джей, Пак
ДжМ, Янг
С, Кениг
БА. Взгляд родителей на расширенный скрининг новорожденных с использованием полногеномного секвенирования. Педиатрия .2016;137(доп.1):S36-S46. doi:10.1542/peds.2015-3731HPubMedGoogle ScholarCrossref 21.Kerruish
Н. Опыт родителей через 12 лет после скрининга новорожденных на генетическую предрасположенность к диабету 1 типа и их отношение к секвенированию всего генома у новорожденных. Genet Med . 2016;18(3):249-258. doi: 10.1038/gim.2015.73PubMedGoogle ScholarCrossref 23.Paquin
RS, Пейнадо
С, Льюис
Массачусетс,
и другие. Теоретико-поведенческая оценка прояснения ценностей родительских убеждений и намерений в отношении секвенирования генома для новорожденных. Социально-медицинская служба . 2018;2021;271:112037. doi:10. 1016/j.socscimed.2018.11.017PubMedGoogle Scholar27.Waisbren
SE, Вейперт
СМ, Уолш
RC, Петти
CR, Зеленый
РК. Психосоциальные факторы, влияющие на родительский интерес к геномному секвенированию новорожденных. Педиатрия . 2016;137(доп.1):S30-S35. doi:10.1542/peds.2015-3731GPubMedGoogle ScholarCrossref 28.Etchegary
Х, Дикс
Е, зеленый
Дж., Ходжкинсон
К., Пуллман
Д, Парфри
П.Интерес к генетическому тестированию новорожденных: опрос будущих родителей и широкой общественности. Биомаркеры Genet Test Mol . 2012;16(5):353-358. doi:10.1089/gtmb.2011.0221PubMedGoogle ScholarCrossref 30.Genetti
Калифорния, Шварц
ТС, Робинзон
Джо,
и другие; Команда проекта BabySeq. Родительский интерес к геномному секвенированию новорожденных: опыт зачисления в проект BabySeq. Genet Med .
1016/j.socscimed.2018.11.017PubMedGoogle Scholar27.Waisbren
SE, Вейперт
СМ, Уолш
RC, Петти
CR, Зеленый
РК. Психосоциальные факторы, влияющие на родительский интерес к геномному секвенированию новорожденных. Педиатрия . 2016;137(доп.1):S30-S35. doi:10.1542/peds.2015-3731GPubMedGoogle ScholarCrossref 28.Etchegary
Х, Дикс
Е, зеленый
Дж., Ходжкинсон
К., Пуллман
Д, Парфри
П.Интерес к генетическому тестированию новорожденных: опрос будущих родителей и широкой общественности. Биомаркеры Genet Test Mol . 2012;16(5):353-358. doi:10.1089/gtmb.2011.0221PubMedGoogle ScholarCrossref 30.Genetti
Калифорния, Шварц
ТС, Робинзон
Джо,
и другие; Команда проекта BabySeq. Родительский интерес к геномному секвенированию новорожденных: опыт зачисления в проект BabySeq. Genet Med . 2019;21(3):622-630. doi: 10.1038/s41436-018-0105-6PubMedGoogle ScholarCrossref 31.Берг
JS, мастер
АК, О’Дэниел
ДжМ,
и другие. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Genet Med . 2016;18(5):467-475. doi: 10.1038/gim.2015.104PubMedGoogle ScholarCrossref 35.DeCristo
ДМ, Милко
Л.В., О’Дэниел
ДжМ,
и другие. Практичность коммерческих лабораторных панелей секвенирования для скрининга новорожденных и важность прозрачности для принятия решений родителями. Геном Мед . 2021;13(1):50. doi:10.1186/s13073-021-00867-1PubMedGoogle ScholarCrossref 36.Ko
ДжМ, Парк
КС, Кан
Й,
и другие. Новый интегрированный рабочий процесс скрининга новорожденных может обеспечить быстрый доступ к дифференциальной диагностике и подтверждению наследственных метаболических заболеваний.
2019;21(3):622-630. doi: 10.1038/s41436-018-0105-6PubMedGoogle ScholarCrossref 31.Берг
JS, мастер
АК, О’Дэниел
ДжМ,
и другие. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Genet Med . 2016;18(5):467-475. doi: 10.1038/gim.2015.104PubMedGoogle ScholarCrossref 35.DeCristo
ДМ, Милко
Л.В., О’Дэниел
ДжМ,
и другие. Практичность коммерческих лабораторных панелей секвенирования для скрининга новорожденных и важность прозрачности для принятия решений родителями. Геном Мед . 2021;13(1):50. doi:10.1186/s13073-021-00867-1PubMedGoogle ScholarCrossref 36.Ko
ДжМ, Парк
КС, Кан
Й,
и другие. Новый интегрированный рабочий процесс скрининга новорожденных может обеспечить быстрый доступ к дифференциальной диагностике и подтверждению наследственных метаболических заболеваний. Йонсей Мед J . 2018;59(5):652-661. doi:10.3349/ymj.2018.59.5.652PubMedGoogle ScholarCrossref 38.Narravula
А, Гарбер
КБ, Аскри
SH, Хегде
М, зал
пл.Варианты с неопределенной значимостью при скрининге новорожденных: значение для крупномасштабного секвенирования генома. Genet Med . 2017;19(1):77-82. doi: 10.1038/gim.2016.67PubMedGoogle ScholarCrossref 39.Pavey
А.Р., Бодиан
DL, Вильбу
Т,
и другие. Использование геномного секвенирования для популяционного скрининга иммунодефицитов у новорожденных. Genet Med . 2017;19(12):1367-1375. doi:10.1038/gim.2017.57PubMedGoogle ScholarCrossref 40.Bhattacharjee
А, Сокольский
Т, Вайман
СК,
и другие.Разработка подтверждающих ДНК и диагностических тестов высокого риска для новорожденных с использованием целевого секвенирования ДНК нового поколения.
Йонсей Мед J . 2018;59(5):652-661. doi:10.3349/ymj.2018.59.5.652PubMedGoogle ScholarCrossref 38.Narravula
А, Гарбер
КБ, Аскри
SH, Хегде
М, зал
пл.Варианты с неопределенной значимостью при скрининге новорожденных: значение для крупномасштабного секвенирования генома. Genet Med . 2017;19(1):77-82. doi: 10.1038/gim.2016.67PubMedGoogle ScholarCrossref 39.Pavey
А.Р., Бодиан
DL, Вильбу
Т,
и другие. Использование геномного секвенирования для популяционного скрининга иммунодефицитов у новорожденных. Genet Med . 2017;19(12):1367-1375. doi:10.1038/gim.2017.57PubMedGoogle ScholarCrossref 40.Bhattacharjee
А, Сокольский
Т, Вайман
СК,
и другие.Разработка подтверждающих ДНК и диагностических тестов высокого риска для новорожденных с использованием целевого секвенирования ДНК нового поколения.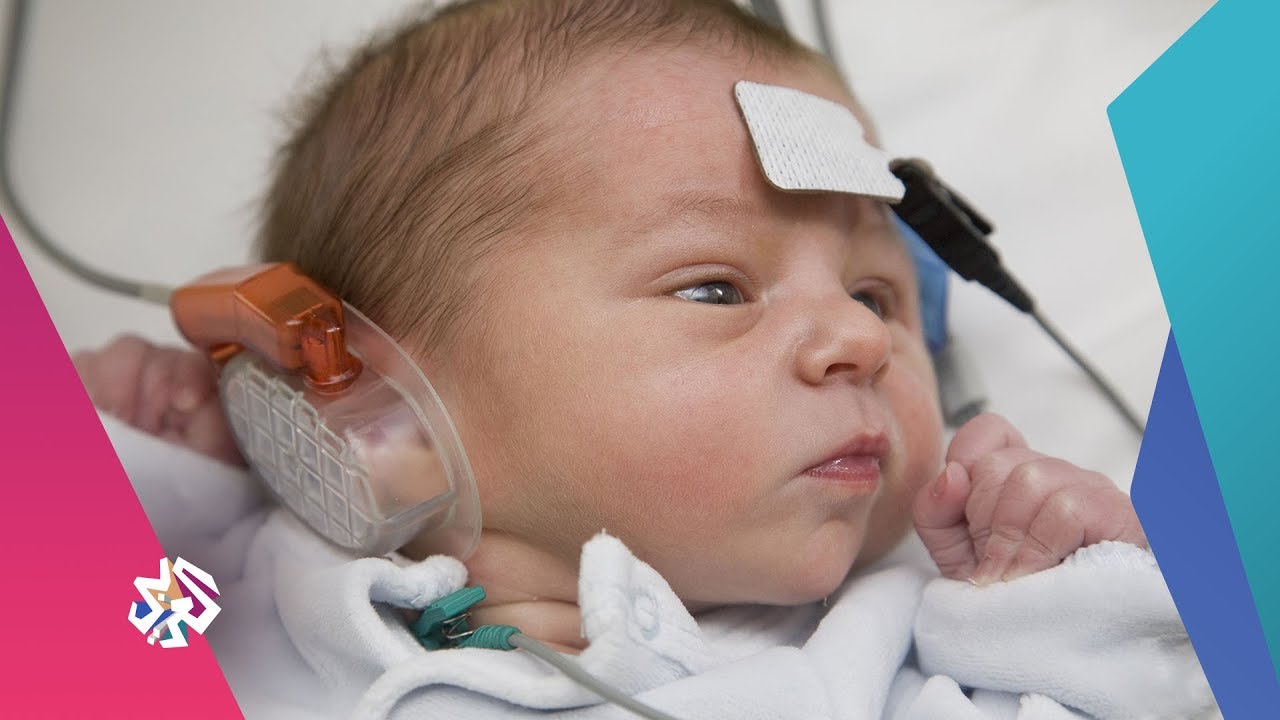 Genet Med . 2015;17(5):337-347. doi: 10.1038/gim.2014.117PubMedGoogle ScholarCrossref 41.Bodian
Д.Л., Клейн
Э, Айер
РК,
и другие. Полезность полногеномного секвенирования для выявления нарушений скрининга новорожденных в популяционной когорте из 1696 новорожденных. Genet Med . 2016;18(3):221-230. doi:10.1038/gim.2015.111PubMedGoogle ScholarCrossref 42.Соломон
BD, Пинеда-Альварес
DE, Медведь
К.А., Малликин
Джей Си, Эванс
Дж. П.; Программа сравнительного секвенирования NISC. Применение геномного анализа для скрининга новорожденных. Мол Синдромол . 2012;3(2):59-67. doi:10.1159/000341253PubMedGoogle ScholarCrossref 44.Wojcik
МХ, Чжан
Т, Джейхан-Бирсой
О,
и другие; Команда проекта BabySeq. Несоответствие результатов между обычным скринингом новорожденных и геномным секвенированием в проекте BabySeq.
Genet Med . 2015;17(5):337-347. doi: 10.1038/gim.2014.117PubMedGoogle ScholarCrossref 41.Bodian
Д.Л., Клейн
Э, Айер
РК,
и другие. Полезность полногеномного секвенирования для выявления нарушений скрининга новорожденных в популяционной когорте из 1696 новорожденных. Genet Med . 2016;18(3):221-230. doi:10.1038/gim.2015.111PubMedGoogle ScholarCrossref 42.Соломон
BD, Пинеда-Альварес
DE, Медведь
К.А., Малликин
Джей Си, Эванс
Дж. П.; Программа сравнительного секвенирования NISC. Применение геномного анализа для скрининга новорожденных. Мол Синдромол . 2012;3(2):59-67. doi:10.1159/000341253PubMedGoogle ScholarCrossref 44.Wojcik
МХ, Чжан
Т, Джейхан-Бирсой
О,
и другие; Команда проекта BabySeq. Несоответствие результатов между обычным скринингом новорожденных и геномным секвенированием в проекте BabySeq. Genet Med . 2021. doi:10.1038/s41436-021-01146-5PubMedGoogle Scholar45.Bunnik
Э.М., де Йонг
А, Нейсингх
Н, де Верт
ГМВР. Новая генетика и информированное согласие: дифференцированный выбор для сохранения автономии. Биоэтика . 2013;27(6):348-355. doi:10.1111/bioe.12030PubMedGoogle ScholarCrossref 47.Friedman
Дж. М., Корнел
МС, Гольденберг
Эй Джей, Листер
KJ, Сенекаль
К, Вирс
ДФ; Рабочая группа по регулированию и этике Глобального альянса по геномике и здравоохранению Целевая группа по педиатрии.Геномный скрининг новорожденных: соображения и рекомендации политики общественного здравоохранения. BMC Med Genomics . 2017;10(1):9. doi: 10.1186/s12920-017-0247-4PubMedGoogle ScholarCrossref 50.Holm
И.А., Макгуайр
А, Перейра
С, Рем
Н, зеленый
RC, Беггс
АХ; Команда проекта BabySeq.
Genet Med . 2021. doi:10.1038/s41436-021-01146-5PubMedGoogle Scholar45.Bunnik
Э.М., де Йонг
А, Нейсингх
Н, де Верт
ГМВР. Новая генетика и информированное согласие: дифференцированный выбор для сохранения автономии. Биоэтика . 2013;27(6):348-355. doi:10.1111/bioe.12030PubMedGoogle ScholarCrossref 47.Friedman
Дж. М., Корнел
МС, Гольденберг
Эй Джей, Листер
KJ, Сенекаль
К, Вирс
ДФ; Рабочая группа по регулированию и этике Глобального альянса по геномике и здравоохранению Целевая группа по педиатрии.Геномный скрининг новорожденных: соображения и рекомендации политики общественного здравоохранения. BMC Med Genomics . 2017;10(1):9. doi: 10.1186/s12920-017-0247-4PubMedGoogle ScholarCrossref 50.Holm
И.А., Макгуайр
А, Перейра
С, Рем
Н, зеленый
RC, Беггс
АХ; Команда проекта BabySeq. Возвращение геномного результата для состояния, возникшего во взрослом возрасте, родителям новорожденного: выводы из проекта BabySeq. Педиатрия . 2019;143(доп.1):S37-S43.doi: 10.1542/peds.2018-1099HPubMedGoogle ScholarCrossref 56.Carmichael
Н, Ципис
Дж., Виндмюллер
Г, Мандель
Л, Эстрелла
Э. «Больно ли будет?»: влияние диагностической одиссеи на детей и их семьи. Дж. Жене Каунс . 2015;24(2):325-335. doi: 10.1007/s10897-014-9773-9PubMedGoogle ScholarCrossref 58.Cabello
JF, Новоа
Ф, Хафф
ХВ, Коломбо
М. Расширенный скрининг новорожденных и секвенирование генома в Латинской Америке и вытекающие из этого соображения социальной справедливости и этики. Скрининг новорожденных Int J . 2021;7(1):6. doi:10.3390/ijns7010006PubMedGoogle ScholarCrossref
Возвращение геномного результата для состояния, возникшего во взрослом возрасте, родителям новорожденного: выводы из проекта BabySeq. Педиатрия . 2019;143(доп.1):S37-S43.doi: 10.1542/peds.2018-1099HPubMedGoogle ScholarCrossref 56.Carmichael
Н, Ципис
Дж., Виндмюллер
Г, Мандель
Л, Эстрелла
Э. «Больно ли будет?»: влияние диагностической одиссеи на детей и их семьи. Дж. Жене Каунс . 2015;24(2):325-335. doi: 10.1007/s10897-014-9773-9PubMedGoogle ScholarCrossref 58.Cabello
JF, Новоа
Ф, Хафф
ХВ, Коломбо
М. Расширенный скрининг новорожденных и секвенирование генома в Латинской Америке и вытекающие из этого соображения социальной справедливости и этики. Скрининг новорожденных Int J . 2021;7(1):6. doi:10.3390/ijns7010006PubMedGoogle ScholarCrossrefГенетический скрининг новорожденных
Все младенцы, рожденные в штате Теннесси, должны иметь образцы для скрининга новорожденных, представленные в лабораторию штата Теннесси для проверки на наличие определенных генетических заболеваний. Если результаты анализов отклоняются от нормы, Департамент здравоохранения связывается с лечащим врачом ребенка, чтобы инициировать повторное тестирование, подтверждение и лечение у специалиста, если это необходимо.Ранняя диагностика и лечение могут иметь значение для ребенка, ведущего относительно нормальную жизнь, или для ребенка с более значительной задержкой развития; долгосрочные потребности в медицинской помощи или даже смерть. Это скрининговый тест, на который могут повлиять возраст ребенка, состояние здоровья или лечения на момент взятия образцов; качества и количества образца или других переменных и может не выявить всех пораженных младенцев. Возможность ложноотрицательных или ложноположительных результатов всегда следует учитывать при скрининге новорожденных на предмет метаболических нарушений.
Если результаты анализов отклоняются от нормы, Департамент здравоохранения связывается с лечащим врачом ребенка, чтобы инициировать повторное тестирование, подтверждение и лечение у специалиста, если это необходимо.Ранняя диагностика и лечение могут иметь значение для ребенка, ведущего относительно нормальную жизнь, или для ребенка с более значительной задержкой развития; долгосрочные потребности в медицинской помощи или даже смерть. Это скрининговый тест, на который могут повлиять возраст ребенка, состояние здоровья или лечения на момент взятия образцов; качества и количества образца или других переменных и может не выявить всех пораженных младенцев. Возможность ложноотрицательных или ложноположительных результатов всегда следует учитывать при скрининге новорожденных на предмет метаболических нарушений.
Для получения полного списка заболеваний, выявленных на панели скрининга новорожденных, щелкните здесь.
Доступ к службамПеред выпиской из больницы у всех младенцев, родившихся в штате Теннесси, должна быть собрана фильтровальная бумага для скрининга новорожденных. Анализы могут потребоваться повторить по ряду причин, в том числе из-за неправильного забора крови, переливания крови младенцу, забора образца, когда ребенку было меньше 24 часов, или при наличии признаков возможного заболевания.Родители могут обратиться к врачу ребенка или в местный отдел здравоохранения, чтобы запланировать последующее тестирование. В Теннесси действует комплексная генетическая программа, которая обеспечивает доступ к генетическому скринингу, диагностическому тестированию и консультационным услугам для отдельных лиц и семей, страдающих генетическими заболеваниями или подверженных риску их возникновения.
Для получения дополнительной информации свяжитесь с отделом скрининга новорожденных. Телефон: (615) 532-8462
Бесплатный номер: (855) 202-1357
Факс: (615) 532-8555
Электронная почта: [email protected]






 Более старшим детям желательно осуществлять данное исследование натощак, допускается питье несладкой кипяченой воды.
Более старшим детям желательно осуществлять данное исследование натощак, допускается питье несладкой кипяченой воды. Если ребенка выписали из роддома раньше, например, на 3-и сутки, то забор крови проводят в поликлинике. Анализ необходимо брать натощак, не раньше, чем через 3 часа последнего приема пищи.
Если ребенка выписали из роддома раньше, например, на 3-и сутки, то забор крови проводят в поликлинике. Анализ необходимо брать натощак, не раньше, чем через 3 часа последнего приема пищи. Анализ делается в течение десяти дней. Тест-бланк имеет еще другую (паспортную) часть. В ней указываются личные данные ребенка, телефоны и адреса, по которым можно связаться с ними и/или с учреждением, где будет наблюдаться ребенок после выписки. К заполнению этих данных нужно подойти крайне серьезно и внимательно. В противном случае положительный ответ обследования о наличие болезни может вовремя не найти адресата. И будет упущено время.
Анализ делается в течение десяти дней. Тест-бланк имеет еще другую (паспортную) часть. В ней указываются личные данные ребенка, телефоны и адреса, по которым можно связаться с ними и/или с учреждением, где будет наблюдаться ребенок после выписки. К заполнению этих данных нужно подойти крайне серьезно и внимательно. В противном случае положительный ответ обследования о наличие болезни может вовремя не найти адресата. И будет упущено время. Так вот, все вышеописанные болезни наследуются по аутосомно-рецессивному типу. То есть, когда родители здоровы, но являются носителями дефектного гена. Само по себе носительство таких генов не приводит к развитию болезни. Да и вообще никак не проявляется. А вот если такие носители встречаются и передают ребенку каждый по дефектному гену, то ребенок родится больным. Именно комбинация двух дефектных генов – от папы и от мамы – проявляется заболеванием. Поэтому видимое здоровье родителей не может гарантировать рождение полностью здорового малыша. Хочется уточнить, что не нужно проявлять напрасного беспокойства и отказываться от скрининга. Нельзя лишать ребенка возможности быстро выявить практически неизлечимые и быстро прогрессирующие болезни.
Так вот, все вышеописанные болезни наследуются по аутосомно-рецессивному типу. То есть, когда родители здоровы, но являются носителями дефектного гена. Само по себе носительство таких генов не приводит к развитию болезни. Да и вообще никак не проявляется. А вот если такие носители встречаются и передают ребенку каждый по дефектному гену, то ребенок родится больным. Именно комбинация двух дефектных генов – от папы и от мамы – проявляется заболеванием. Поэтому видимое здоровье родителей не может гарантировать рождение полностью здорового малыша. Хочется уточнить, что не нужно проявлять напрасного беспокойства и отказываться от скрининга. Нельзя лишать ребенка возможности быстро выявить практически неизлечимые и быстро прогрессирующие болезни. Положительный результат (выявлена проблема по какому-либо из заболеваний) сообщается незамедлительно родителям и в медучреждение, где наблюдается малыш. Поэтому, если вам результаты скрининга не сообщили, это не значит, что про вас забыли или потеряли ваш анализ. Сложившаяся система скрининга не имеет возможности предоставить результаты лично всем и каждому. Беспокоиться по этому поводу совсем не нужно. Наоборот, если вас не побеспокоили звонком или письмом из генетической консультации, нужно радоваться.
Положительный результат (выявлена проблема по какому-либо из заболеваний) сообщается незамедлительно родителям и в медучреждение, где наблюдается малыш. Поэтому, если вам результаты скрининга не сообщили, это не значит, что про вас забыли или потеряли ваш анализ. Сложившаяся система скрининга не имеет возможности предоставить результаты лично всем и каждому. Беспокоиться по этому поводу совсем не нужно. Наоборот, если вас не побеспокоили звонком или письмом из генетической консультации, нужно радоваться. Ведь доказано, что коррекция слуха до трехмесячного возраста малыша дает возможность нормального развития речи у ребенка. Первые полгода жизни малыша процесс речевого развития проходит самый интенсивный этап, несмотря на то, что внешне это практически не проявляется.
Ведь доказано, что коррекция слуха до трехмесячного возраста малыша дает возможность нормального развития речи у ребенка. Первые полгода жизни малыша процесс речевого развития проходит самый интенсивный этап, несмотря на то, что внешне это практически не проявляется.

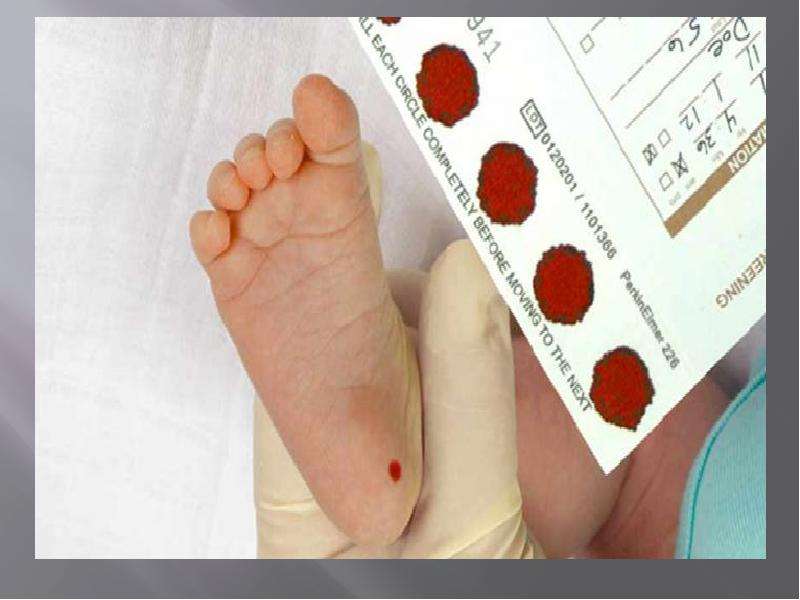
 П., Пол Д. Б.. Политическая история ФКУ: размышления о 50-летнем скрининге новорожденных. Педиатрия. 2013; 132: 987-989. [Перекрестная ссылка]
П., Пол Д. Б.. Политическая история ФКУ: размышления о 50-летнем скрининге новорожденных. Педиатрия. 2013; 132: 987-989. [Перекрестная ссылка] Защита интересов пациентов при скрининге новорожденных: непрерывность и прерывность. Am J Med Genet C Semin Med Genet. 2008 г.; 148: 8-14. [Перекрестная ссылка]
Защита интересов пациентов при скрининге новорожденных: непрерывность и прерывность. Am J Med Genet C Semin Med Genet. 2008 г.; 148: 8-14. [Перекрестная ссылка] 2011 г.; 23: 667-673. [Перекрестная ссылка]
2011 г.; 23: 667-673. [Перекрестная ссылка] , Татипака Х., Барсенас М., Скотт Ч.Р., Туречек Ф., Гелб М.Х. Высокопроизводительный анализ 9 лизосомальных ферментов для скрининга новорожденных. Клин Хим. 2013; 59: 502-511. [Перекрестная ссылка]
, Татипака Х., Барсенас М., Скотт Ч.Р., Туречек Ф., Гелб М.Х. Высокопроизводительный анализ 9 лизосомальных ферментов для скрининга новорожденных. Клин Хим. 2013; 59: 502-511. [Перекрестная ссылка] Мир J Педиатр. 2019; 15: 219-225. [Перекрестная ссылка]
Мир J Педиатр. 2019; 15: 219-225. [Перекрестная ссылка]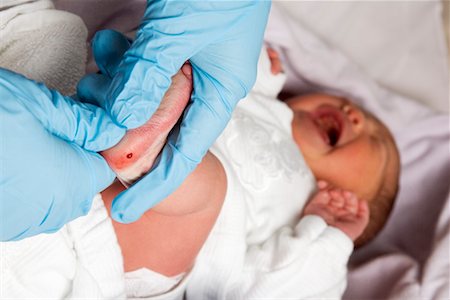 Э., Меттерник-Джонс С.К., Листер К.Дж.Международные различия в оценке условий для скрининга пятен крови новорожденных: обзор научной литературы и программных документов. Eur J Hum Genet. 2016; 25: 10-16. [Перекрестная ссылка]
Э., Меттерник-Джонс С.К., Листер К.Дж.Международные различия в оценке условий для скрининга пятен крови новорожденных: обзор научной литературы и программных документов. Eur J Hum Genet. 2016; 25: 10-16. [Перекрестная ссылка] , Адамс Д.Р., Бачино К.А., Беллен Х.Дж., Бернштейн Дж.А., Читл-Ярвела А.М. и соавт. Влияние генетической диагностики на пациентов с ранее не диагностированным заболеванием. N Engl J Med. 2018; 379: 2131-2139. [Перекрестная ссылка]
, Адамс Д.Р., Бачино К.А., Беллен Х.Дж., Бернштейн Дж.А., Читл-Ярвела А.М. и соавт. Влияние генетической диагностики на пациентов с ранее не диагностированным заболеванием. N Engl J Med. 2018; 379: 2131-2139. [Перекрестная ссылка]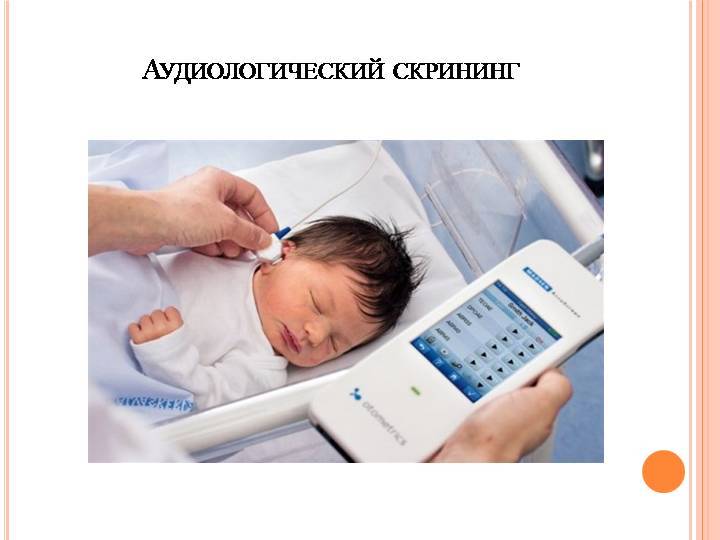 2017; 2017: 11. [Перекрестная ссылка]
2017; 2017: 11. [Перекрестная ссылка] М., Букер Дж.К., Боше Л., Кэри Т. и др. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Генет Мед. 2016; 18: 467-475. [Перекрестная ссылка]
М., Букер Дж.К., Боше Л., Кэри Т. и др. Полуколичественный показатель для оценки клинической действенности случайных или вторичных результатов секвенирования в масштабе генома. Генет Мед. 2016; 18: 467-475. [Перекрестная ссылка]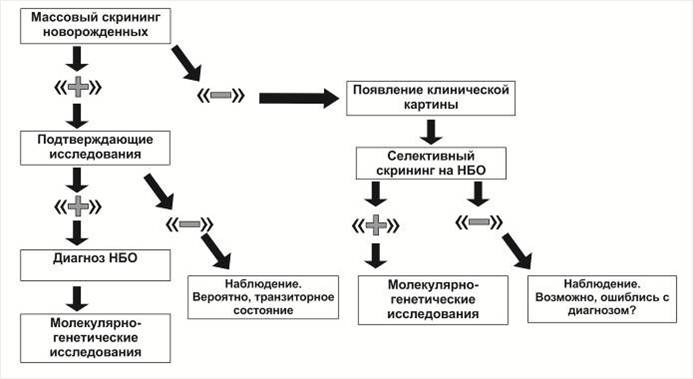 Р., Бьюкенен А.Х., Джейхан-Бирсой О., ДиСтефано М., Дуайт С.С. и др. Оценка клинической достоверности ассоциаций генов и заболеваний: основанная на доказательствах структура, разработанная с помощью ресурса клинического генома. Am J Hum Genet. 2017; 100: 895-906. [Перекрестная ссылка]
Р., Бьюкенен А.Х., Джейхан-Бирсой О., ДиСтефано М., Дуайт С.С. и др. Оценка клинической достоверности ассоциаций генов и заболеваний: основанная на доказательствах структура, разработанная с помощью ресурса клинического генома. Am J Hum Genet. 2017; 100: 895-906. [Перекрестная ссылка] С., Агравал П.Б., Бейли Д.Б., мл., Беггс А.Х., Бреннер С.Е., Брауэр А.М. и др. Секвенирование новорожденных в геномной медицине и здравоохранении. Педиатрия. 2017; 139: e20162252. [Перекрестная ссылка]
С., Агравал П.Б., Бейли Д.Б., мл., Беггс А.Х., Бреннер С.Е., Брауэр А.М. и др. Секвенирование новорожденных в геномной медицине и здравоохранении. Педиатрия. 2017; 139: e20162252. [Перекрестная ссылка] Педиатрия. 2016; 137: С16-С23. [Перекрестная ссылка]
Педиатрия. 2016; 137: С16-С23. [Перекрестная ссылка] Мол Жене Метаб. 2018; 124: 177-183. [Перекрестная ссылка]
Мол Жене Метаб. 2018; 124: 177-183. [Перекрестная ссылка] Рекомендации ВОЗ по охране здоровья новорожденных, одобренные Комитетом по рассмотрению рекомендаций. В.; Май 2017 г.
Рекомендации ВОЗ по охране здоровья новорожденных, одобренные Комитетом по рассмотрению рекомендаций. В.; Май 2017 г.
