Изменения гемостаза у беременных с нарушениями углеводного обмена | Бондарь
Аннотация
В данном обзоре сравниваются изменения коагуляционного и сосудисто-тромбоцитарного гемостаза при физиологической беременности с состоянием гемостаза у беременных с нарушениями углеводного обмена (сахарный диабет 1 типа, сахарный диабет 2 типа, гестационный сахарный диабет).
Ключевые слова
сахарный диабет, беременность, сосудисто-тромбоцитарный гемостаз, коагуляционный гемостаз, эн- дотелиальная дисфункция
Для цитирования:
Бондарь И.А., Малышева А.С. Изменения гемостаза у беременных с нарушениями углеводного обмена. Сахарный диабет. 2013;16(2):77-81. https://doi. org/10.14341/2072-0351-3760
org/10.14341/2072-0351-3760
For citation:
Bondar’ I.A., Malysheva A.S. Alterations in hemostasis associated with pregnancy in patients with glycemic disorders. Diabetes mellitus. 2013;16(2):77-81. (In Russ.) https://doi.org/10.14341/2072-0351-3760
Различными типами сахарного диабета (СД) страдают около 14% беременных женщин [1]. В настоящее время отмечается рост данной патологии во время беременности, и, несмотря на проводимые профилактические мероприятия, тенденции к снижению распространенности СД у беременных не наблюдается [1]. Беременные с СД относятся к группе высокого риска в акушерстве и заслуживают особого внимания при ведении беременности [1]. Во всем мире отмечается рост числа беременных с гестационным СД (ГСД).
Цель обзора: рассмотреть особенности нарушений гемостаза при физиологической беременности и беременности на фоне синдрома гипергликемии: СД 1 типа (СД1), СД 2 типа (СД2), ГСД.
Залогом физиологического течения беременности является нормальное функционирование системы сосудисто-тромбоцитарного и коагуляционного звеньев гемостаза. При патологической беременности, в частности, у беременных с нарушениями углеводного обмена, возникают изменения физиологических адаптационных механизмов к предстоящей кровопотере в родах [4].
Сосудисто-тромбоцитарный гемостаз первым страдает при любых отклонениях от течения нормальной беременности. Доказано, что при физиологической беременности гемокоагуляционные изменения, связанные с гестационным процессом, поддерживаются фетоплацентарным комплексом [5, 6]. Изменения гемостаза во время беременности являются адаптационным процессом [5], который заключается, главным образом, в возрастании тромбоцитарной активности в III триместре, усилении прокоагулянтных свойств эндотелия, увеличении содержания факторов свертывания крови IX, VIII, VII, X, V, фибриногена, D-димера (специфический продукт расщепления плазмином поперечно-сшитого (нерастворимого) фибрина), снижении концентрации протеина S (витамин К-зависимый одноцепочечный плазменный гликопротеин, является кофактором протеина С) и непосредственно перед родами наблюдается снижение концентрации антитромбина (ингибитор реакций каскада процессов коагуляции) [7]. Уже с 12 недели гестации начинает повышаться концентрация фибриногена плазмы [8].
Т.П. Бондарь и соавт. в 2012 г. выполнено исследование плазменного гемостаза у 152 здоровых беременных. Полученные результаты свидетельствовали об увеличении концентрации фибриногена в плазме до родов и в первые сутки после родов на 80% и его постепенном снижении к пятому дню, незначительном укорочении протромбинового времени и повышении протромбинового индекса до родов, в первые и пятые сутки после родов, в сравнении с показателями в III триместре беременности.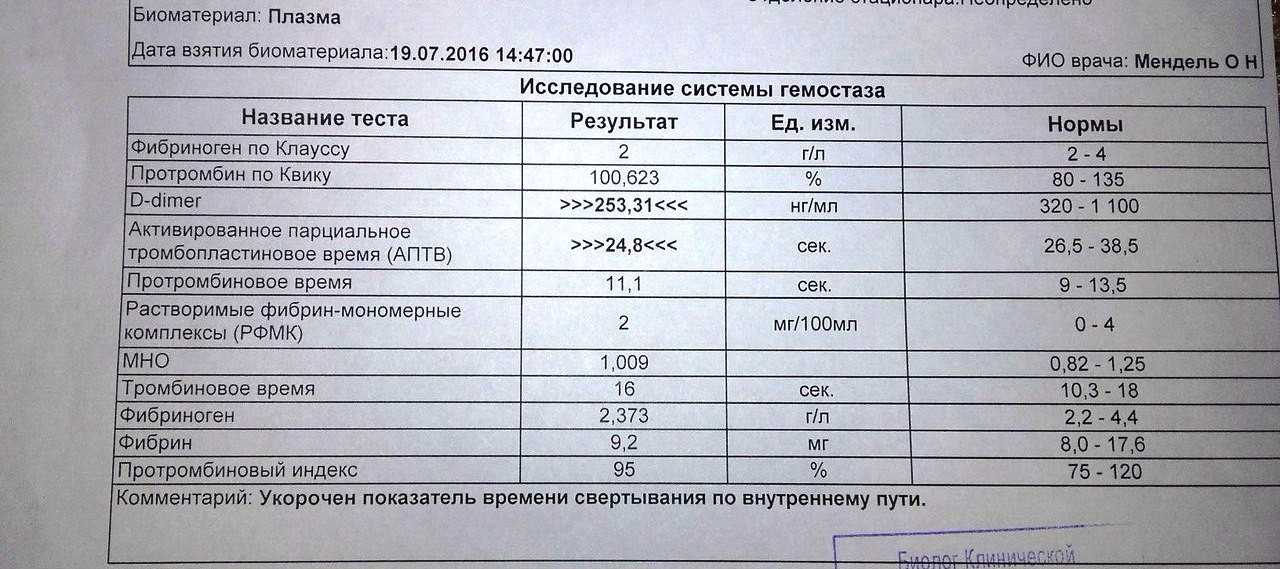
Основными структурно-функциональными единицами первичного звена гемостаза являются тромбоциты и эндотелий кровеносных сосудов. Эндотелий предотвращает контактную активацию факторов свертывания крови, обладает способностью поддерживать вазомоторный баланс и сосудисто-тканевой гемостаз за счет аутокринных и эндокринных влияний [16, 17]. Эндотелий продуцирует простациклин (PGI2) – основной ингибитор внешнего пути активации коагуляционного гемостаза; тромбомодулин модулирует тонус гладкомышечных элементов сосудистой стенки [18]. Основным модулятором большинства функций эндотелия считается оксид азота (NO) – самый мощный из всех известных вазодилататоров. На ранней стадии дисфункции эндотелия уровень NO повышается, что говорит о компенсаторной реакции организма, при истощении компенсаторных возможностей организма – снижается. Гипопродукция NO может возникать под действием высоких концентраций глюкозы, липопротеидов низкой плотности и ишемии, что приводит к повышению тонуса сосудов и свертываемости крови. Дисфункция эндотелия приводит к нарушению микроциркуляции и повышенной склонности к тромбообразованию за счет снижения тромборезистентности эндотелия [19] и играет ключевую роль в развитии острых (инфаркт миокарда, инсульт) и хронических осложнений СД [20]. По данным Н.Н.Петрищева, нарушения эндотелия заключаются в дисбалансе между медиаторами, обеспечивающими в норме оптимальное течение всех эндотелийзависимых процессов, таких как: регуляция системы кровообращения, участие в поддержании сосудистого тонуса, гемостаза, иммунного ответа, миграции клеток крови в сосудистую стенку, синтезе факторов воспаления и их ингибиторов, осуществление барьерной функции [21].
Эндотелий продуцирует простациклин (PGI2) – основной ингибитор внешнего пути активации коагуляционного гемостаза; тромбомодулин модулирует тонус гладкомышечных элементов сосудистой стенки [18]. Основным модулятором большинства функций эндотелия считается оксид азота (NO) – самый мощный из всех известных вазодилататоров. На ранней стадии дисфункции эндотелия уровень NO повышается, что говорит о компенсаторной реакции организма, при истощении компенсаторных возможностей организма – снижается. Гипопродукция NO может возникать под действием высоких концентраций глюкозы, липопротеидов низкой плотности и ишемии, что приводит к повышению тонуса сосудов и свертываемости крови. Дисфункция эндотелия приводит к нарушению микроциркуляции и повышенной склонности к тромбообразованию за счет снижения тромборезистентности эндотелия [19] и играет ключевую роль в развитии острых (инфаркт миокарда, инсульт) и хронических осложнений СД [20]. По данным Н.Н.Петрищева, нарушения эндотелия заключаются в дисбалансе между медиаторами, обеспечивающими в норме оптимальное течение всех эндотелийзависимых процессов, таких как: регуляция системы кровообращения, участие в поддержании сосудистого тонуса, гемостаза, иммунного ответа, миграции клеток крови в сосудистую стенку, синтезе факторов воспаления и их ингибиторов, осуществление барьерной функции [21].
Существует нитрит-редуктазная (L-аргинин/оксид азота) система регенерации оксида азота, роль которой возрастает при дефиците кислорода. Именно этой системе в настоящее время отводится ведущая вазорегуляторная роль в период гестации. Известно, что при нормально протекающей беременности возрастает активность ренин-ангиотензин-альдостероновой системы (РААС), что способствует увеличению плазмы и общего объема воды в организме. На фоне активации РААС у беременных отмечается снижение общего периферического сопротивления (ОПСС) и АД, что объясняют как снижением у беременных ответа на вазоконстрикторные пептиды и амины, так и интенсификацией системы L-аргинин/оксид азота, обусловленной повышением уровней плацентарного лактогена, эстрогенов, пролактина, прогестерона [30].
Другой важной структурно-функциональной единицей гемостаза являются тромбоциты. Как известно, тромбоциты – это безъядерные фрагменты цитоплазмы мегакариоцитов, имеющие множество функций и сложный метаболизм. Тромбоциты накапливают и секретируют протеины – фибриноген, фактор Виллебранда, тромбоксан А2 (TrA2), 4-й тромбоцитарный фактор, β-тромбоглобулин (β-ТG) и тромбоцитарный фактор роста [17]. Антикоагулянтный потенциал эндотелия способствует циркуляции тромбоцитов в неактивном состоянии при физиологической беременности. При нарушении антикоагулянтного потенциала эндотелия происходит адгезия тромбоцитов к поврежденному участку и их последующая активация [33]. На протяжении беременности отмечается уменьшение количества тромбоцитов, связанное с увеличением объема циркулирующей крови во время беременности и нахождением тромбоцитов в маточно-плацентарном кровотоке [34]. Во время гестационного процесса количество тромбоцитов не выходит за рамки физиологической нормы и к 40-й неделе беременности уровень тромбоцитов достигает 195±4,3×109/л, при этом отмечено уменьшение продолжительности жизни тромбоцитов [35].
Как известно, тромбоциты – это безъядерные фрагменты цитоплазмы мегакариоцитов, имеющие множество функций и сложный метаболизм. Тромбоциты накапливают и секретируют протеины – фибриноген, фактор Виллебранда, тромбоксан А2 (TrA2), 4-й тромбоцитарный фактор, β-тромбоглобулин (β-ТG) и тромбоцитарный фактор роста [17]. Антикоагулянтный потенциал эндотелия способствует циркуляции тромбоцитов в неактивном состоянии при физиологической беременности. При нарушении антикоагулянтного потенциала эндотелия происходит адгезия тромбоцитов к поврежденному участку и их последующая активация [33]. На протяжении беременности отмечается уменьшение количества тромбоцитов, связанное с увеличением объема циркулирующей крови во время беременности и нахождением тромбоцитов в маточно-плацентарном кровотоке [34]. Во время гестационного процесса количество тромбоцитов не выходит за рамки физиологической нормы и к 40-й неделе беременности уровень тромбоцитов достигает 195±4,3×109/л, при этом отмечено уменьшение продолжительности жизни тромбоцитов [35].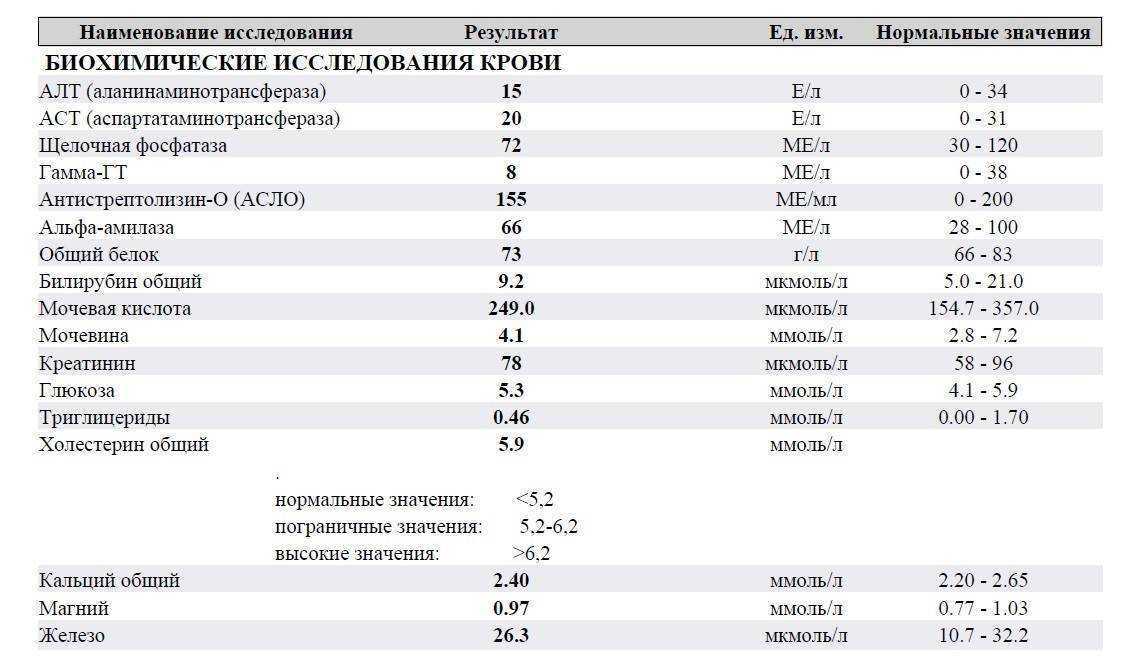 Wallaschofski H. и соавт. [36] объясняют снижение числа тромбоцитов при физиологической беременности агрегацией тромбоцитов, которая происходит под влиянием прогестерона и пролактина. Эти гормоны способны вызывать агрегацию тромбоцитов без добавления индукторов агрегации. Подобная активность тромбоцитов отмечена Лифенко Р.А. в I–II триместрах, когда агрегация тромбоцитов практически соответствует показателям у небеременных женщин во II фазу менструального цикла, но к III триместру этот показатель может снижаться [37]. Механизмы повышения агрегации тромбоцитов при сахарном диабете у беременных остаются не вполне ясными. Доказано, что увеличение функциональной активности тромбоцитов сопровождается возрастанием содержания кальция в цитоплазме, что индуцирует биосинтез тромбоксана кровяными пластинками, повышая их агрегацию [20].
Wallaschofski H. и соавт. [36] объясняют снижение числа тромбоцитов при физиологической беременности агрегацией тромбоцитов, которая происходит под влиянием прогестерона и пролактина. Эти гормоны способны вызывать агрегацию тромбоцитов без добавления индукторов агрегации. Подобная активность тромбоцитов отмечена Лифенко Р.А. в I–II триместрах, когда агрегация тромбоцитов практически соответствует показателям у небеременных женщин во II фазу менструального цикла, но к III триместру этот показатель может снижаться [37]. Механизмы повышения агрегации тромбоцитов при сахарном диабете у беременных остаются не вполне ясными. Доказано, что увеличение функциональной активности тромбоцитов сопровождается возрастанием содержания кальция в цитоплазме, что индуцирует биосинтез тромбоксана кровяными пластинками, повышая их агрегацию [20].
Одним из факторов, влияющих на активацию эндотелиальной дисфункции, является гомоцистеин (ГЦ) [38]. Гипергомоцистеинемия (ГГЦ) может приводить к осложнениям беременности, повышению коагуляционного потенциала крови и нарушению функции эндотелия сосудов [38]. ГГЦ напрямую связана с угнетением синтеза тромбомодулина, понижением активности антитромбина III и эндогенного гепарина, а также с активацией выработки тромбоксана А2, что вызывает микротромбообразование и нарушение микроциркуляции. Эти изменения играют существенную роль в патологии спиральных артерий плаценты и развитии акушерских осложнений, связанных с изменением маточно-плацентарного кровообращения [38].
ГГЦ напрямую связана с угнетением синтеза тромбомодулина, понижением активности антитромбина III и эндогенного гепарина, а также с активацией выработки тромбоксана А2, что вызывает микротромбообразование и нарушение микроциркуляции. Эти изменения играют существенную роль в патологии спиральных артерий плаценты и развитии акушерских осложнений, связанных с изменением маточно-плацентарного кровообращения [38].
Гипергликемия является наиболее важным фактором дисфункции эндотелия. Механизмы повреждающего действия гипергликемии на сосудистое русло многообразны. Гипергликемия вызывает образование конечных продуктов гликирования белков (КПГ), которые накапливаются в тканях и приводят к активации окислительного стресса [39, 40]. Взаимодействие КПГ со своими рецепторами ведет к увеличению тромбомодулина и также активирует рецепторы интерлейкина-1, фактора некроза опухоли альфа (TNF-α) и ростовых факторов, что вызывает миграцию и пролиферацию гладкомышечных клеток [41]. Морфологические изменения сосудистого эндотелия при эндотелиальной дисфункции на фоне диабета характеризуются усилением адгезии лейкоцитов, тромбоцитов и отложением фибрина на поверхности эндотелия, повышенной пролиферацией эндотелиоцитов, увеличением количества многоядерных клеток эндотелия, утолщением базальной мембраны, увеличением площади поверхности эндотелиоцитов, повышенной текучестью их мембран и увеличением проницаемости капиллярной стенки [21, 42].
По литературным данным, первые признаки эндотелиальной дисфункции у больных СД1 появляются через 5–6 лет от начала заболевания. По данным И.П. Роговой, развитие тяжелой эндотелиальной дисфункции, нарушения тромбоцитарного гемостаза возникают рано, уже при длительности СД1 до 5 лет, и сопровождаются гиперкоагуляцией [43]. Снижение количества тромбоцитов, наблюдаемое при НbА1с более 7,0%, сопровождается повышением агрегации тромбоцитов с АДФ и адреналином, что связано с гликозилированием белков тромбоцитарной мембраны, активацией метаболизма арахидоновой кислоты, приводящих к повышенной активности тромбоцитов. При СД изменяется не только функциональная активность тромбоцитов, но и повышаются факторы коагуляции, уменьшается фибринолитическая активность плазмы, повышается концентрация фибриногена, возрастают протромбиновый индекс и показатель гематокрита [44].
Как известно, возникновение осложнений у беременных с СД1 связывают с гемостатическими и микроциркулярными нарушениями, возникающими вследствие локального образования микросгустков [45, 46], что приводит к развитию дистресса плода, тяжелым формам позднего гестоза, способствует прогрессированию сосудистых осложнений диабета, обуславливает высокую перинатальную заболеваемость и смертность, повышает риск инвалидизации женщин после родов [4]. По данным исследования A. Bronisz и соавт., при обследовании 31 беременной женщины с диабетом и 24 здоровых беременных было выявлено, что у беременных с СД1 без микроангиопатий и хорошим метаболическим контролем, уровень фибриногена и тканевого активатора плазминогена, а также изменения в активности ингибитора активатора плазминогена-1 аналогичны тем, которые встречаются при физиологической беременности. Состояние системы гемостаза у беременных с СД1 в большей мере определяется уровнем гипергликемии, чем длительностью патологического процесса и содержанием холестерина (ХС) [47]. Отмечено, что степень риска гиперкоагуляции у беременных с СД1 зависит от степени нарушения углеводного обмена (НbА1с выше 7,0%), липидного обмена (ХС более 6,5 ммоль/л) и наличия альбуминурии (30–300 мг/сутки) [46]. В настоящее время доказано, что независимо от глубины нарушений углеводного обмена, даже при незначительной гипергликемии мать находится в зоне высокого риска по развитию диабетической фетопатии [48].
По данным исследования A. Bronisz и соавт., при обследовании 31 беременной женщины с диабетом и 24 здоровых беременных было выявлено, что у беременных с СД1 без микроангиопатий и хорошим метаболическим контролем, уровень фибриногена и тканевого активатора плазминогена, а также изменения в активности ингибитора активатора плазминогена-1 аналогичны тем, которые встречаются при физиологической беременности. Состояние системы гемостаза у беременных с СД1 в большей мере определяется уровнем гипергликемии, чем длительностью патологического процесса и содержанием холестерина (ХС) [47]. Отмечено, что степень риска гиперкоагуляции у беременных с СД1 зависит от степени нарушения углеводного обмена (НbА1с выше 7,0%), липидного обмена (ХС более 6,5 ммоль/л) и наличия альбуминурии (30–300 мг/сутки) [46]. В настоящее время доказано, что независимо от глубины нарушений углеводного обмена, даже при незначительной гипергликемии мать находится в зоне высокого риска по развитию диабетической фетопатии [48]. В связи с высокой распространенностью нарушений углеводного обмена у беременных, большой интерес представляет изучение нарушений системы гемостаза у беременных с ГСД. Однако, подобных работ мало.
В связи с высокой распространенностью нарушений углеводного обмена у беременных, большой интерес представляет изучение нарушений системы гемостаза у беременных с ГСД. Однако, подобных работ мало.
A.G. Gader и соавт. при исследовании системы гемостаза у 152 беременных с ГСД и 100 женщин с физиологической беременностью в III триместре беременности отметили, что изменения гемостаза на фоне ГСД характеризуются более высоким уровнем фибриногена, протеина S, по сравнению с нормальной беременностью [49]. Bin Liu и соавт. [50] показали, что при ГСД при гипергликемии в ворсинах плаценты запускается синтез белка аннексина А2, который в дальнейшем влияет на фибринолиз. У беременных с СД аннексин А2 приводит к повышению активности плазмина и, таким образом, препятствует тромбообразованию [51] (путем связывания тканевого активатора плазминогена и плазминогена [52]).
Таким образом, по данным литературы, у беременных с нарушениями углеводного обмена преобладают нарушения сосудисто-тромбоцитарного гемостаза, которые играют ведущую роль в развитии диабетической фетопатии, приводят к значительным нарушениям адаптации новорожденных в раннем постнатальном периоде.
Авторы декларируют отсутствие двойственности (конфликта) интересов при написании данной статьи.
1. Джобава Э.М., Аминтаева Л.А., Алиева Д.Н. Эндотелиальная дисфункция: гомоцистеин и оксид азота у беременных высо- кого риска. Современные подходы к терапии. Роль фолиевой кислоты. Проблемы репродукции. 2010; (6):98–103.
2. Дедов И.И., Краснопольский В.И., Сухих Г.Т., от имени рабочей группы. Проект Российского консенсуса Гестационный сахарный диабет: диагностика, лечение, послеродовое наблюдение. Сахарный диабет. 2012;(2):6–12.
3. Болотская ЛЛ, Есаян РМ, Олейник ОВ. 6-й международный симпозиум «Диабет и беременность» Зальцбург, Австрия, 23–26 марта 2011 года. Сахарный диабет. 2011;(2):131.
4. Березницкая А.Г., Воронин К.В. Состояние системы гемостаза у беременных с сахарным диабетом 1 типа. Таврический медико-биологический вестник. 2012; 15(2 часть 1):34–36.
5. Макацария А.Д., Бицадзе В.О., Акиньшина С.В. Тромбозы и тромбоэмболии в акушерско-гинекологической клинике: Молекулярно-генетические механизмы и стратегия профилактики тромбоэмболических осложнений. Руководство для врачей. М: ООО «Медицинское информационное агентство»; 2007. 1064 с.
Руководство для врачей. М: ООО «Медицинское информационное агентство»; 2007. 1064 с.
6. Lockwood CJ, Murk W, Kayisli UA, Buchwalder LF, Huang ST, Funai EF, Krikun G, Schatz F. Progestin and thrombin regulate tissue factor expression in human tern decidual cells. J Clin Endocrinol Metab. 2009 Jun;94(6):2164–2170. DOI: http://dx.doi.org/10.1210/jc.2009-0065
7. Баркаган З.С., Котовщикова Е.Ф., Сердюк Г.В. Тромбофилии и пути совершенствования антитромботической профилактики и терапии при беременности. Сибирский медицинский журнал. 2004;(5):62–68.
8. Hui C, Lili M, Libin C, Rui Z, Fang G, Ling G, Jianping Z. Changes in coagulation and hemodynamics during pregnancy: a prospective longitudinal study of 58 cases. Arch Gynecol Obstet. 2012 May;285(5):1231–1236. DOI: http://dx.doi.org/10.1007/s00404-011-2137-x
9. Серов В.Н., Макарация А.Д. Тромботические и геморрагические осложнения в акушерстве. Москва: Медицина; 1987.288 c.
10. Полякова В.А., Галян С.Л., Леонова О. П. К механизму связи перекисного окисления липидов и гемостаза. Научный вестник ТГМА. 1999; (2):38–42.
П. К механизму связи перекисного окисления липидов и гемостаза. Научный вестник ТГМА. 1999; (2):38–42.
11. Шаповалов П.Я. Влияние эстрогенов и гестагенов на гемостаз в эксперименте. В книге: Влияние эстроген-гестагенных препаратов на гемостаз при клиническом применении в гинекологии. Тюмень;1999. С. 34–36.
12. Баркаган З.С. Уроки ДВС-синдрома: основные закономерности патогенеза, развития ведущих субсиндромов и обоснование однонаправленной контролируемой терапии. Проблемы физиологии и патологии системы гемостаза: Труды проблемной комиссии при межведомственном научном совете по гематологии и трансфузиологии РАМН. Барнаул; 2000. С.143–147.
13. Brenner B. Haemostatic changes in pregnancy. Thromb Res. 2004;114(5–6):409–414.
14. Liu XH, Jiang YM, Shi H, Yue XA, Wang YF, Yang H. Prospective, sequential, longitudinal study of coagulation changes during pregnancy in Chinese women. Int J Gynaecol Obstet. 2009 Jun;105(3):240–243. DOI: http://dx.doi.org/10.1016/j.ijgo.2009.01. 035
035
15. Бондарь Т.П., Муратова А.Ю., Цатурян Е.О. Динамика показателей плазменного гемостаза у женщин с тромбогенными осложнениями беременности и родов. Саратовский научномедицинский журнал. 2012; 8(3):720–723.
16. Esper RJ, Nordaby RA, Vilariño JO, Paragano A, Cacharrón JL, Machado RA. Endothelial dysfunction: a comprehensive appraisal. Cardiovasc Diabetol. 2006 Feb 23;5:4.
17. Ефремов А.П., Самсонова Е.Н., Пустоветова М.Г., Сафронов И.Д. Патология системы гемостаза. Новосибирск; 2011. С. 6–7.
18. Сидельникова В.М., Кирющенков П.А. Гемостаз и беременность. М: Триада – Х; 2004. 208 с.
19. Власова С.П., Ильченко М.Ю., Казакова Е.Б., Калакутский Л.И., Комарова М.В., Лебедев П.А., Лебедева Е.П., Максимова Л.Н., Соболева Е.В. Дисфункция эндотелия и артериальная гипертензия. Самарский Государственный Медицинский Университет. «ОФОРТ». Самара; 2010. С. 8–11.
20. Меньщикова Е.Б., Зенков Н.К., Ланкин В.З., Бондарь И.А., Труфакин В.А. Окислительный стресс: Патологические состояния и заболевания.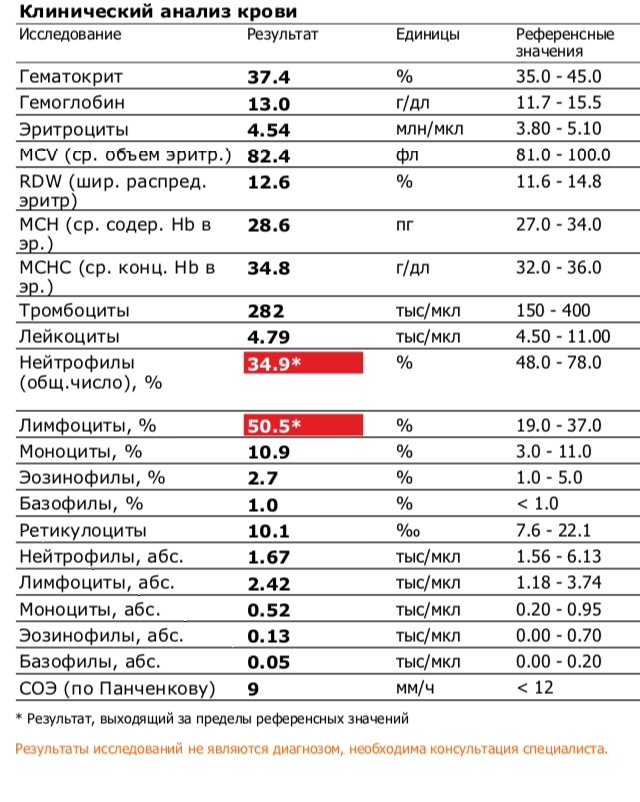 Новосибирск: АРТА; 2008. С. 110–121.
Новосибирск: АРТА; 2008. С. 110–121.
21. Петрищев НН. Дисфункция эндотелия. Ст-Петербург; 2003. С. 34–114.
22. Вотякова О.И., Рывкин А.И., Тонеева А.Ю. Функциональные особенности эндотелиальной выстилки сосудов у детей с сахарным диабетом 1 типа. Вестник новых медицинских технологий. 2006; XIII(1):166–167.
23. Демидова Т.Ю., Аметов А.С., Смагина Л.В. Моксонидин в коррекции метаболических нарушений и эндотелиальной дисфункции у больных сахарным диабетом 2 типа, ассоциированным с артериальной гипертензией.Consilium medicum. 2006; 10(4):21–30.
24. Germain SJ, Sacks GP, Sooranna SR,Sargent IL, Redman CW. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast micro particles. J Immunol. 2007 May 1;178(9):5949–5956.
25. Мондоева С.С., Суханова Г.А., Подзолкова Н.М. Эндотелиальная дисфункция – дополнительный фактор развития синдрома потери плода у пациенток с тромбофилией. Пути коррекции. Проблемы репродукции. 2009; (6):65–67.
2009; (6):65–67.
26. Трунов А.Н., Пекарев О.Г., Горбенко О.М., Шваюк А.П., Обухова О.О., Шубина В.И., Трунова Л.А. Нарушения баланса цитокинов и активность перекисного окисления липидов при позднем гестозе. Бюллетень сибирского отделения Российской академии медицинских наук. 2011; 31(1):78–82.
27. Chaouat G, Ledée-Bataille N, Dubanchet S. Imbalance of serum T helper 1- and 2-type cytokines in preeclampsia and gestational hypertension. Reprod Biomed Online. 2007; 14 (2):256–266.
28. Маянская С.Д., Антонов А.Р., Попова А.А., Гребенкина И.А. Ранние маркеры дисфункции эндотелия в динамике развития артериальной гипертонии у лиц молодого возраста. Казанский медицинский журнал. 2009; 90(1):32–37.
29. Черкашин Д.В. Клиническое значение и коррекция эндотелиальной дисфункции. Клинические лекции. [20 нояб. 2008]. Режим доступа: www.cardiosite.ru.
30. Ли О.А. Оценка эндотелийзависимой вазодилатации у беременных с метаболическим синдромом. Вестник Санкт- Петербургского Университета.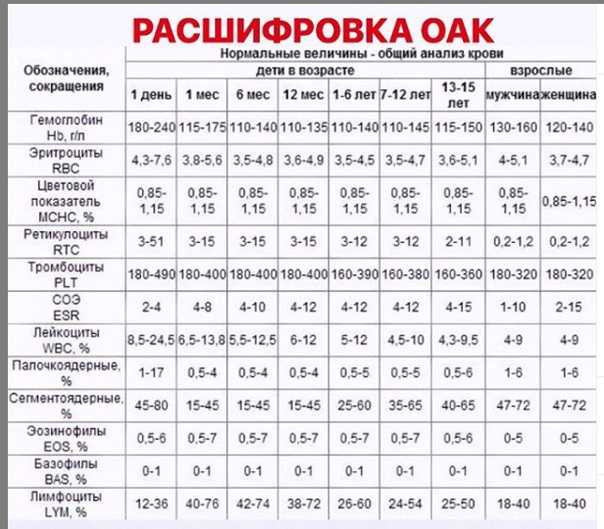 Акушерство и Гинекология. 2009; 11(2):183–192.
Акушерство и Гинекология. 2009; 11(2):183–192.
31. Мычка В.Г., Чазова Н.В., Флегонтова В.Е., Нижник В.Е. Преддиабет, диабет типа 2 и сердечно-сосудистая патология. Фарматека. 2007; (11):30–35.
32. Соколов Е.И., Манухин И.Б., Мочалов А.А., Невзоров О.Б. Нарушение в системе гемостаза и его коррекция у беременных с метаболическим синдромом. Лечащий врач. 2011; (3):43–47.
33. Макацария А.Д., Мищенко А.Л., Бицадзе В.О., Маров С.В. Синдром диссеминированного внутрисосудистого свертывания крови в акушерской практике. М: Триада-Х; 2002. С. 52–336.
34. Justus B, Siegert G, Tieber O. Changes in the blood coagulation and fibrinolysis system in the course of normal pregnancy. ZtrblGynacol. 2002; 114(4): 165–170.
35. Яговкина Н.В., Хлыбова С.В., Циркин В.И. Спонтанная агрегация тромбоцитов при физиологической и осложненной гестозом беременности. Нижегородский медицинский журнал. 2006; (6):116–118.
36. Wallaschofski H, Kobsar A, Sokolova O, Siegemund A, Stepan H, Faber R, Eigenthaler M, Lohmann T. Differences in platelet activation by prolactin and leptin. Horm Metab Res. 2004 Jul;36(7):453–457.
Differences in platelet activation by prolactin and leptin. Horm Metab Res. 2004 Jul;36(7):453–457.
37. Лифенко Р.А., Гаспарян С.А., Чотчаева С.М. Особенности морфофункционального статуса тромбоцитов в структуре синдрома гестационной дизадаптации системы гемостаза. Сб. «Цитометрия в медицине и биологии: фундаментальные и прикладные аспекты». Москва; 2009. С. 55–56.
38. Абрамченко В.В. Фармакотерапия гестоза. Ст-Петербург: Спецлит; 2005. 84 с.
39. Pallardo LF, Herranz L, Martin-Vaquero P, Garcia-Ingelmo T, Grande C, Jañez M. Impaired fasting glucose and impaired glucose tolerance in women with prior gestational diabetes are associated with a different cardiovascular profile. Diabetes Care. 2003 Aug;26(8):2318–2322.
40. Conway DL, Langer O. Effects of new criteria for type 2 diabetes on the rate of postpartum glucose intolerance in women with gestational diabetes. Am J Obstet Gynecol. 1999 Sep;181(3):610–614.
41. Аметов А.С., Соловьева О.Л. Сердечно-сосудистые осложнения при сахарном диабете: патогенез и пути коррекции. Русский медицинский журнал. 2011; (27):1694–1699.
Русский медицинский журнал. 2011; (27):1694–1699.
42. Федорова М.В., Краснопольский В.И., Петрухин В.А. Сахарный диабет, беременность и диабетическая фетопатия. М; 2001. с. 37–82.
43. Рогова И.П. Влияние клинико-биохимических, генетических, гемостатических факторов на развитие диабетической нефропатии у больных сахарного диабета 1 типа. Автореферат на соискание ученой степени к.м.н. Новосибирский государственный медицинский университет. Новосибирск; 2006. С. 5–20.
44. Кретова Е.Ю. Нарушения системы гемостаза в различные возрастные периоды у больных сахарным диабетом [диссертация]. Сибирский государственный медицинский университет. Томск; 2008.
45. Атаманов В.М., Яковлева Г.Я., Терещенко И.В. Нарушение системы гемостаза при сахарном диабете. Омский научный вестник. 2003; (3):58–62.
46. Киричук В.Ф., Ребров А.П., Россошанская С.И. Функции эндотелия сосудистой стенки. Тромбоз, гемостаз и реология. 2005; (2):23–29.
47. Bronisz A, Rosc D, Bronisz M, Szymanski W, Junik R. Coagulation and fibrinolysis variables in pregnant women with type 1 diabetes mellitus. Med Sci Monit. 2008 Nov;14(11):CR574–579.
Coagulation and fibrinolysis variables in pregnant women with type 1 diabetes mellitus. Med Sci Monit. 2008 Nov;14(11):CR574–579.
48. Краснопольский В.И., Петрухин В.А., Бурумкулова Ф.Ф. Гестационный диабет: новый взгляд на старую проблему. Акушерство и гинекология. 2010; (2):3–6.
49. Gader AG, Khashoggi TY, Habib F, Awadallah SB. Haemostatic and cytokine changes in gestational diabetes mellitus. Gynecol Endocrinol. 2011 May;27(5):356–360. DOI: http://dx.doi.org/10.3109/09513590.2010.495241
50. Liu B, Xu Y, Voss C, Qiu FH, Zhao MZ, Liu YD, Nie J, Wang ZL. Altered Protein Expression in Gestational Diabetes Mellitus Placentas Provides Insight into Insulin Resistance and Coagulation/ Fibrinolysis Pathways. PLoS One. 2012;7(9):e44701. DOI: http://dx.doi.org/10.1371/journal.pone.0044701
51. Ishii H, Yoshida M, Hajjar KA, Tanaka A, Yasukochi Y, Shimokado K, Numano F. Potential role of recombinant annexin II in diabetic vascular injury. Ann N Y Acad Sci. 2001 Dec;947:308–311.
52. Falcone DJ, Borth W, Khan KM, Hajjar KA. Plasminogenmediated matrix invasion and degradation by macrophages is dependent on surface expression of annexin II. Blood. 2001 Feb 1;97(3):777–784.
Об авторах
Ирина Аркадьевна Бондарь
ГБОУ ВПО Новосибирский государственный медицинский университет, Новосибирск
д.м.н., проф., зав. кафедрой эндокринологии
Анна Сергеевна Малышева
ГБОУ ВПО Новосибирский государственный медицинский университет, Новосибирск
аспирант кафедры эндокринологии
Идиопатическая тромбоцитопеническая пурпура и беременность: возможности современной медицины
Идиопатическая тромбоцитопеническая пурпура и беременность: возможности современной медицины
Представляем интересные клинические случаи ведения и исходов беременности у двух пациенток с идиопатической тромбоцитопенической пурпурой (ИТП).
Идиопатическая тромбоцитопеническая пурпура — это аутоиммунное заболевание, которое характеризуется стойким снижением уровня тромбоцитов — клеток крови, участвующих в процессе тромбообразования. Вследствие иммунного конфликта образуются антитела, которые связываются с тромбоцитами и вызывают их преждевременное разрушение в особых тканях организма (ретикулоэндотелиальной системы), особенно в селезенке. Во многих случаях удаление селезенки (спленэктомия) является терапией выбора в случаях, когда медикаментозное лечение неэффективно, но всегда требует особого внимания у беременных пациенток, ведь врачи несут двойную ответственность — за жизнь матери и ребенка.
Обе пациентки наблюдались во время беременности в женской консультации филиала ГКБ №52. Сразу при первом обращении пациентки были консультированы врачом-гематологом, который оценил течение заболевания, провел необходимые диагностические мероприятия и наметил тактику ведения в период беременности и родов. В течение беременности женщины госпитализировались в гинекологический стационар и отделение патологии беременности (ОПБ) с угрозой преждевременных родов; получали гормональную терапию, курсы иммуноглобулина человеческого нормального с непродолжительным клиническим эффектом (умеренным, преходящим ростом уровня тромбоцитов). Перед родами (на сроках беременности 35-36 у одной и 37-38 недель у другой) женщины были госпитализированы в ОПБ родильного дома филиала ГКБ №52 для оценки акушерской и гематологической ситуации и решения вопроса о сроках и методе родоразрешения. По данным УЗИ, у обеих пациенток плод развивался соответственно гестационному сроку, признаков внутриутробного страдания плода не выявлено.
Перед родами (на сроках беременности 35-36 у одной и 37-38 недель у другой) женщины были госпитализированы в ОПБ родильного дома филиала ГКБ №52 для оценки акушерской и гематологической ситуации и решения вопроса о сроках и методе родоразрешения. По данным УЗИ, у обеих пациенток плод развивался соответственно гестационному сроку, признаков внутриутробного страдания плода не выявлено.
После курса лечения в условиях ОПБ были проведены мультидисциплинарные консилиумы с участием акушера-гинеколога, гематолога, хирурга, анестезиолога-реаниматолога. В обоих случаях заключение специалистов было сходным: учитывая доношенный срок беременности, низкий уровень тромбоцитов, высокий риск развития послеродового кровотечения, решено в каждом случае родоразрешить беременную путем операции кесарева сечения; симультанно с оперативным родоразрешением, после завершения кесарева сечения выполнить с лечебной целью спленэктомию лапароскопическим доступом. Показанием к спленэктомии явилось наличие идиопатической тромбоцитопенической пурпуры хронического течения, устойчивой к стандартной терапии кортикостероидами и иммуноглобулином.
Операция проведена двумя бригадами: первым этапом кесарево сечение бригадой акушеров-гинекологов, вторым — лапароскопическая спленэктомия бригадой хирургов. Послеоперационный период протекал в условиях отделения реанимации и интенсивной терапии и 1-го хирургического отделения, без осложнений. К проводимому лечению дополнительно было назначено введение больших доз человеческого нормального иммуноглобулина для подавления образования антител к тромбоцитам; получен хороший ответ — рост уровня тромбоцитов до нормальных значений. Послеоперационный мультидисциплинарный консилиум установил, что оперативное лечение ИТП у обеих пациенток эффективно, и родильницы могут быть выписаны домой одновременно с малышами.
Лапароскопическая спленэктомия, наряду с традиционными преимуществами лапароскопических операций, позволяет существенно снизить уровень инфекционных и геморрагических послеоперационных осложнений, присущих пациентам с гематологическими и аутоиммунными заболеваниями, сократить сроки восстановления и добиться лучших результатов лечения в меньшие сроки. Это и явилось основанием для выбора лапароскопического доступа.
Это и явилось основанием для выбора лапароскопического доступа.
Важная особенность описанной ситуации – контроль системы гемостаза. Высокий риск акушерского кровотечения (у пациенток с ИТП) в сочетании с высокой вероятностью тромбообразования в раннем послеоперационном периоде (после спленэктомии) делает состояние гемостаза непредсказуемым. Решение вопроса – мониторинг гемостаза с помощью интегральной методики – тромбоэластографии и конечно, опыт и профессионализм нашей гемостазиологической службы.
Ведение беременности и родов у пациенток с различными гематологическими заболеваниями — специфика нашего родильного дома: за полтора года работы был накоплен опыт благополучного родоразрешения 7 пациенток с ИТП. У 5 беременных роды были оперативными, двое родили через естественные родовые пути. Ни в одном из случаев роды и послеродовый период не осложнились кровотечением, во всех случаях родились здоровые малыши.
Слияние акушерских стационаров и клинических больниц, проведенное руководством нашего города в последние годы, позволило создать крупные многопрофильные центры, способные решать практически любые проблемы беременных женщин. Так и в нашей ежедневной практике слаженная, высокопрофессиональная работа врачей разных специальностей решает самые сложные клинические задачи и дарит молодым женщинам счастье быть мамой.
Так и в нашей ежедневной практике слаженная, высокопрофессиональная работа врачей разных специальностей решает самые сложные клинические задачи и дарит молодым женщинам счастье быть мамой.
Выраженный скачок количества тромбоцитов в раннем послеродовом периоде у пациентки с эссенциальной тромбоцитемией
На этой странице <40 лет. В отличие от других миелопролиферативных новообразований ЭТ чаще встречается у женщин. Мы столкнулись с 38-летней женщиной с диагнозом ЭТ, у которой было повышено количество тромбоцитов на ранних сроках беременности. Ее количество тромбоцитов превысило 1500 × 10 9 /л при поздних сроках беременности; был введен интерферон, но он не дал адекватного ответа. Ей сделали экстренное кесарево сечение на 37 неделе беременности. Хотя ее количество тромбоцитов было 1000 × 10 9 /л сразу после родов, оно заметно увеличилось до 3271× 10 9 /л приблизительно через 2 недели. Возобновлена циторедуктивная терапия; последующее течение было без осложнений. В нескольких обзорных статьях указано, что, поскольку количество тромбоцитов у пациенток может снова увеличиться до уровня беременности или восстановиться после родов, при необходимости следует назначать циторедуктивную терапию. Однако информации о том, когда необходимы терапевтические вмешательства и как их проводить, недостаточно. Остается неизвестным, уменьшится ли количество тромбоцитов через некоторое время без лечения, если оно восстановится. Мы надеемся, что рекомендации по ведению будут установлены путем сбора подробных данных о послеродовом периоде, а также во время беременности.
В нескольких обзорных статьях указано, что, поскольку количество тромбоцитов у пациенток может снова увеличиться до уровня беременности или восстановиться после родов, при необходимости следует назначать циторедуктивную терапию. Однако информации о том, когда необходимы терапевтические вмешательства и как их проводить, недостаточно. Остается неизвестным, уменьшится ли количество тромбоцитов через некоторое время без лечения, если оно восстановится. Мы надеемся, что рекомендации по ведению будут установлены путем сбора подробных данных о послеродовом периоде, а также во время беременности.
1. Введение
Эссенциальная тромбоцитемия (ЭТ) возникает преимущественно у пожилых людей, но примерно 20% пациентов моложе 40 лет [1]. В отличие от других миелопролиферативных новообразований (МПН), ЭТ чаще встречается у женщин. Следовательно, встреча ЭТ у женщин репродуктивного возраста — не редкость. Беременность и роды могут способствовать развитию тромбоэмболии; таким образом, перинатальное ведение пациентов с ЭТ становится важной проблемой. Несмотря на консенсус экспертов и несколько руководств, описывающих ведение этих пациентов, сообщалось [2–6], в настоящее время в Японии нет четких руководств [7]. Некоторые из вышеупомянутых руководств рекомендуют терапию интерфероном (ИФН) беременным женщинам с ЭТ, которые подвержены высокому риску потери беременности. Однако IFN не одобрен для пациентов с ЭТ в Японии. Кроме того, поскольку ЭТ может вызывать тромботические явления, особенно в послеродовом периоде, низкомолекулярный гепарин обычно вводят в течение 6 недель после родов в Европе и США. Однако он также не показан для такого использования в Японии. Согласно вышеупомянутым и другим рекомендациям, количество тромбоцитов у пациентов с ЭТ увеличивается после родов [3–6], но многие аспекты, касающиеся времени и степени восстановления, остаются неизвестными. В нескольких руководствах, в том числе в японских руководствах [7], упоминается оптимальный интервал анализа крови и терапевтические стратегии.
Несмотря на консенсус экспертов и несколько руководств, описывающих ведение этих пациентов, сообщалось [2–6], в настоящее время в Японии нет четких руководств [7]. Некоторые из вышеупомянутых руководств рекомендуют терапию интерфероном (ИФН) беременным женщинам с ЭТ, которые подвержены высокому риску потери беременности. Однако IFN не одобрен для пациентов с ЭТ в Японии. Кроме того, поскольку ЭТ может вызывать тромботические явления, особенно в послеродовом периоде, низкомолекулярный гепарин обычно вводят в течение 6 недель после родов в Европе и США. Однако он также не показан для такого использования в Японии. Согласно вышеупомянутым и другим рекомендациям, количество тромбоцитов у пациентов с ЭТ увеличивается после родов [3–6], но многие аспекты, касающиеся времени и степени восстановления, остаются неизвестными. В нескольких руководствах, в том числе в японских руководствах [7], упоминается оптимальный интервал анализа крови и терапевтические стратегии.
Мы представляем случай, когда терапию ИФН назначали, когда количество тромбоцитов превышало 1500 × 10 9 /л на поздних сроках беременности. В данном случае количество тромбоцитов снизилось примерно до 1000 × 10 9 /л сразу после родов, и циторедуктивная терапия была прекращена. Однако примерно через 2 недели количество тромбоцитов заметно восстановилось.
В данном случае количество тромбоцитов снизилось примерно до 1000 × 10 9 /л сразу после родов, и циторедуктивная терапия была прекращена. Однако примерно через 2 недели количество тромбоцитов заметно восстановилось.
2. Описание случая
Пациентка, 38-летняя женщина, была направлена в нашу больницу приблизительно на 7 неделе беременности по поводу повышенного уровня тромбоцитов, обнаруженного во время пренатального осмотра. Она родила своего первого ребенка через естественные родовые пути на 40-й неделе беременности 8 лет назад, а второго ребенка — в 39 лет.недель беременности на 5 лет раньше. Никаких отклонений в перинатальном периоде обеих беременностей не наблюдалось, и пациентка, и ее дети были здоровы. У нее не было в анамнезе тромбоза или сердечно-сосудистых факторов риска, таких как сахарный диабет, гипертония или дислипидемия, и она не курила. Во время ее визита физикальное обследование не выявило каких-либо аномалий или спленомегалии. Анализы крови показали количество лейкоцитов 11,4 × 10 9 /л, уровень гемоглобина 14,0 г/дл, уровень гематокрита 40,3%, количество тромбоцитов 1074 × 10 9 /л, и активность кофактора ристоцетина фактора фон Виллебранда (vWFRCo) 49% (таблица 1). На 9 неделе гестации выполнена биопсия костного мозга, которая выявила нормоцеллюлярный костный мозг с повышенным количеством крупных и гигантских мегакариоцитов и отсутствием признаков реактивного тромбоцитоза; был поставлен диагноз ЭТ. Было оценено наличие мутаций гена-драйвера, и пациент был отрицательным для всех мутаций Янус-киназы 2 (JAK2V617F), кальретикулина (CALR) и миелопролиферативного лейкоза (MPL), что предполагало, что у нее был так называемый тройной негативный ET.
На 9 неделе гестации выполнена биопсия костного мозга, которая выявила нормоцеллюлярный костный мозг с повышенным количеством крупных и гигантских мегакариоцитов и отсутствием признаков реактивного тромбоцитоза; был поставлен диагноз ЭТ. Было оценено наличие мутаций гена-драйвера, и пациент был отрицательным для всех мутаций Янус-киназы 2 (JAK2V617F), кальретикулина (CALR) и миелопролиферативного лейкоза (MPL), что предполагало, что у нее был так называемый тройной негативный ET.
Начат прием низких доз аспирина. Количество тромбоцитов снижалось по мере развития беременности. На 30-й неделе беременности количество тромбоцитов снизилось до 432 × 10 9 /л. Впоследствии количество тромбоцитов быстро восстановилось. На 34 неделе беременности он превысил 1500 × 10 9 /л, что свидетельствует о высоком риске (рис. 1). Мы предоставили достаточное объяснение пациентке и получили от нее информированное согласие. После одобрения этического комитета нашей больницы (Сумиферон ® Dainippon Sumitomo, Осака, Япония) вводили на сроке 34 недели и 2 дня беременности. ИФН α вводили в дозе 3 млн ЕД 3 раза/неделю на сроке 34 недели беременности и в дозе 6 млн ЕД 3 раза/неделю на сроке 35 недель. Снижение количества тромбоцитов было недостаточным; таким образом, вводили в дозе 6 миллионов единиц ежедневно, начиная с 36 недель, а затем суточную дозу увеличивали до 9 миллионов единиц. Несмотря на отсутствие нежелательных явлений, связанных с IFN α , количество тромбоцитов снизилось до 1229 × 10 9 /л. В конечном итоге пациентке было проведено экстренное кесарево сечение в 37 недель и 1 день гестации (низкие дозы аспирина были заменены на нефракционированный гепарин в 36 недель гестации).
ИФН α вводили в дозе 3 млн ЕД 3 раза/неделю на сроке 34 недели беременности и в дозе 6 млн ЕД 3 раза/неделю на сроке 35 недель. Снижение количества тромбоцитов было недостаточным; таким образом, вводили в дозе 6 миллионов единиц ежедневно, начиная с 36 недель, а затем суточную дозу увеличивали до 9 миллионов единиц. Несмотря на отсутствие нежелательных явлений, связанных с IFN α , количество тромбоцитов снизилось до 1229 × 10 9 /л. В конечном итоге пациентке было проведено экстренное кесарево сечение в 37 недель и 1 день гестации (низкие дозы аспирина были заменены на нефракционированный гепарин в 36 недель гестации).
Младенец весил 2581 г и имел оценку по шкале Апгар 7 баллов через 1 мин и 8 баллов через 5 мин. Несмотря на то, что у младенца было преходящее тахипноэ, и он был временно госпитализирован в отделение интенсивной терапии новорожденных, явных осложнений не было, и младенец был выписан из нашей больницы. Количество тромбоцитов у младенца при рождении было 317 × 10 9 /л. После родов матери начали давать низкомолекулярный гепарин, а также возобновили прием низких доз аспирина. Количество тромбоцитов у нее было примерно 1000 × 10 9 /л. Циторедуктивная терапия была временно прекращена, и мы позволили ей кормить грудью по ее просьбе. Через 18 дней после родов количество тромбоцитов у нее заметно увеличилось до 3271 × 10 9 /л, а уровень vWFRCo снизился до 31%. Похоже, она приобрела синдром фон Виллебранда; таким образом, мы определили, что у нее был высокий риск кровотечения. Введение низкомолекулярного гепарина и низких доз аспирина и грудное вскармливание было прекращено, и в качестве циторедуктивной терапии была начата гидроксимочевина. Примерно через 2 месяца после родов, когда количество тромбоцитов достигло контролируемого уровня, был добавлен анагрелид. Ее количество тромбоцитов хорошо контролировалось; таким образом, гидроксимочевина была прекращена примерно через 3 месяца использования. В настоящее время ее количество тромбоцитов контролируется примерно на уровне 400 × 10 9 .
После родов матери начали давать низкомолекулярный гепарин, а также возобновили прием низких доз аспирина. Количество тромбоцитов у нее было примерно 1000 × 10 9 /л. Циторедуктивная терапия была временно прекращена, и мы позволили ей кормить грудью по ее просьбе. Через 18 дней после родов количество тромбоцитов у нее заметно увеличилось до 3271 × 10 9 /л, а уровень vWFRCo снизился до 31%. Похоже, она приобрела синдром фон Виллебранда; таким образом, мы определили, что у нее был высокий риск кровотечения. Введение низкомолекулярного гепарина и низких доз аспирина и грудное вскармливание было прекращено, и в качестве циторедуктивной терапии была начата гидроксимочевина. Примерно через 2 месяца после родов, когда количество тромбоцитов достигло контролируемого уровня, был добавлен анагрелид. Ее количество тромбоцитов хорошо контролировалось; таким образом, гидроксимочевина была прекращена примерно через 3 месяца использования. В настоящее время ее количество тромбоцитов контролируется примерно на уровне 400 × 10 9 . 0007 9 /л с 1,0 мг/день анагрелида. Результаты теста на генные мутации после циторедуктивной терапии были отрицательными для семейства онкогенов TET номер 2 (TET2), дополнительных половых гребней типа 1 (ASXL1), изоцитратдегидрогеназы ½ (IDh2/2) и мутаций опухолевого белка p53 (TP53).
0007 9 /л с 1,0 мг/день анагрелида. Результаты теста на генные мутации после циторедуктивной терапии были отрицательными для семейства онкогенов TET номер 2 (TET2), дополнительных половых гребней типа 1 (ASXL1), изоцитратдегидрогеназы ½ (IDh2/2) и мутаций опухолевого белка p53 (TP53).
3. Обсуждение
Как беременность, так и ЭТ увеличивают риск тромбоза; таким образом, беременные женщины с ЭТ могут подвергаться более высокому риску тромбоза. Кроме того, различные осложнения, такие как инфаркт плаценты, задержка роста плода и потеря плода, могут повлиять не только на мать, но и на плод. Грейсшаммер и др. выявленные сообщения о случаях ≥9беременностей у ≥4 пациентов с ЭТ, которые были опубликованы в 2000 году и позже и проанализировали 10 отчетов о случаях, описывающих исходы беременности [4]. Согласно их анализу, живорождение у беременных с ЭТ составляло почти 70%; частота доношенных нормальных родов у беременных с ЭТ была ниже, чем у здоровых беременных, а частота самопроизвольных абортов и мертворождений была выше.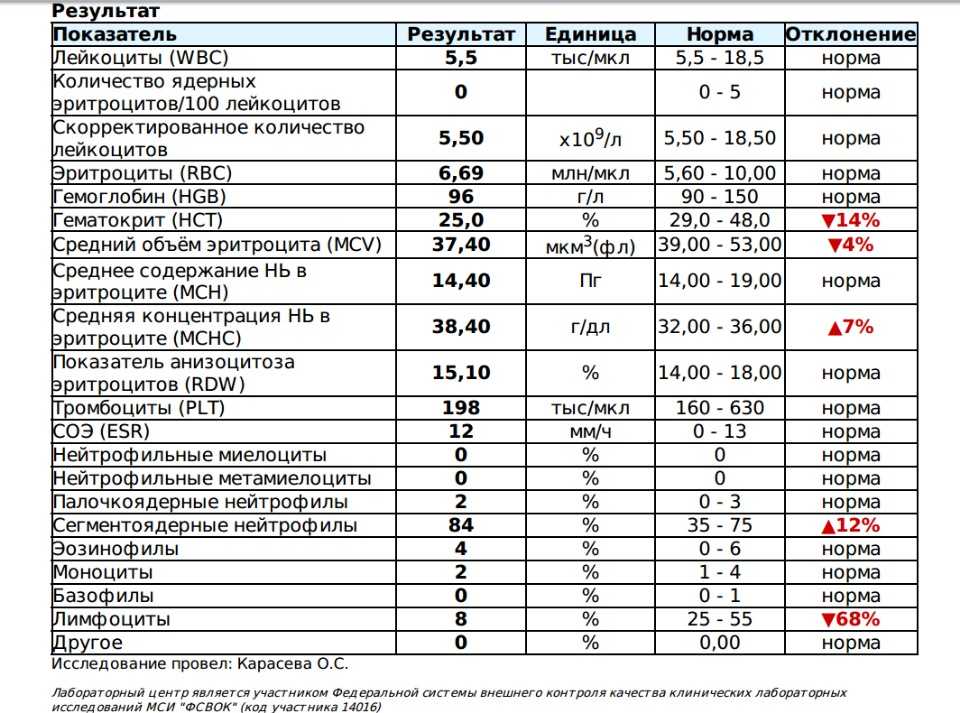 Эти выводы нельзя игнорировать. Беременность высокого риска у пациенток с МПН часто определяется на основе определений, разработанных Greiesshammer et al. [4] и European LeukemiaNet [2]. Кроме того, консенсус экспертов и несколько руководств рекомендуют использование при беременности с высоким риском [2–6], а в японских руководствах также указывается, что использование следует рассмотреть, хотя оно не покрывается Национальным медицинским страхованием [7]. В предыдущем ретроспективном исследовании сообщалось, что применение ИФН является независимым фактором, влияющим на частоту живорождения [8], а недавний систематический обзор и метаанализ беременных с МПН также показали, что применение ИФН связано с высокой частотой живорождения. скорость [9].
Эти выводы нельзя игнорировать. Беременность высокого риска у пациенток с МПН часто определяется на основе определений, разработанных Greiesshammer et al. [4] и European LeukemiaNet [2]. Кроме того, консенсус экспертов и несколько руководств рекомендуют использование при беременности с высоким риском [2–6], а в японских руководствах также указывается, что использование следует рассмотреть, хотя оно не покрывается Национальным медицинским страхованием [7]. В предыдущем ретроспективном исследовании сообщалось, что применение ИФН является независимым фактором, влияющим на частоту живорождения [8], а недавний систематический обзор и метаанализ беременных с МПН также показали, что применение ИФН связано с высокой частотой живорождения. скорость [9].
Основываясь на вышеизложенном, был использован у нашего пациента с соблюдением этических соображений; к сожалению, его эффект был недостаточным. Количество ее тромбоцитов быстро увеличилось примерно на 34 неделе беременности, несмотря на увеличение дозы; следовательно, период администрирования мог быть недостаточным. Эдахиро и др. сообщили, что медиана количества тромбоцитов снизилась примерно на 37% с 910 × 10 9 до 573 × 10 9 /л у семи пациенток через 2 месяца терапии, начатой после обнаружения беременности [10]. Поскольку наш пациент принимал препарат примерно 1 месяц, его действие могло быть недостаточным. Как правило, считается, что он оказывает благоприятное молекулярно-генетическое действие, поскольку может нацеливаться на клетки, положительные не только по мутациям JAK2V617F, но также по CALR и другим мутациям [11]. Однако отчет об использовании пегилированного препарата у пациентов с положительными мутациями CALR показал, что его молекулярно-генетические эффекты были ниже у пациентов с мутациями CALR и у пациентов с мутациями дополнительных генов, таких как TET2, ASXL1, IDh3 и TP53 [12]. Другими словами, чувствительность может различаться среди мутировавших клонов. Более того, небольшое исследование предполагает, что пациенты с тройным негативным ET могут быть более устойчивыми, чем пациенты с мутациями JAK2V617F или CALR [10].
Эдахиро и др. сообщили, что медиана количества тромбоцитов снизилась примерно на 37% с 910 × 10 9 до 573 × 10 9 /л у семи пациенток через 2 месяца терапии, начатой после обнаружения беременности [10]. Поскольку наш пациент принимал препарат примерно 1 месяц, его действие могло быть недостаточным. Как правило, считается, что он оказывает благоприятное молекулярно-генетическое действие, поскольку может нацеливаться на клетки, положительные не только по мутациям JAK2V617F, но также по CALR и другим мутациям [11]. Однако отчет об использовании пегилированного препарата у пациентов с положительными мутациями CALR показал, что его молекулярно-генетические эффекты были ниже у пациентов с мутациями CALR и у пациентов с мутациями дополнительных генов, таких как TET2, ASXL1, IDh3 и TP53 [12]. Другими словами, чувствительность может различаться среди мутировавших клонов. Более того, небольшое исследование предполагает, что пациенты с тройным негативным ET могут быть более устойчивыми, чем пациенты с мутациями JAK2V617F или CALR [10]. Согласно нашим тестам, у нашей пациентки не было никаких аномалий вышеупомянутых дополнительных генов, но у нее была тройная негативная ЭТ. Следовательно, последствия могли быть ограничены.
Согласно нашим тестам, у нашей пациентки не было никаких аномалий вышеупомянутых дополнительных генов, но у нее была тройная негативная ЭТ. Следовательно, последствия могли быть ограничены.
Наконец, мы хотели бы обсудить послеродовое восстановление числа тромбоцитов у нашей пациентки. В нескольких обзорных статьях указано, что, поскольку количество тромбоцитов у пациенток может снова увеличиться до уровня до беременности [13] или восстановиться после родов, при необходимости следует назначать циторедуктивную терапию [3–6]. Однако информации о том, когда необходимы терапевтические вмешательства и как их проводить, недостаточно. Остается неизвестным, уменьшится ли количество тромбоцитов через некоторое время без лечения, если оно восстановится. Согласно нашим поискам в англоязычной литературе, некоторые сообщения указывают на то, что никакой конкретной циторедуктивной терапии не требовалось после родов, в то время как в других сообщениях описываются случаи, когда пациентов лечили по поводу восстановления числа тромбоцитов [14–18]. Сакаи и др. сообщили о случае, когда количество тромбоцитов увеличилось до ≥1000 × 10 9 /л в течение 3 месяцев после родов и еще один случай увеличения числа тромбоцитов до ≥800 × 10 9 /л в течение 2 месяцев после родов. В первом случае была возобновлена циторедуктивная терапия [14]. Ивасита и др. сообщили о случае женщины, пункт 2, у которой количество тромбоцитов увеличилось до ≥2000 × 10 9 /л в течение 1–2 месяцев после родов при обеих беременностях, но снизилось примерно до 800 × 10 9 до 900 × 10 9 /L несколько месяцев спустя [15]. Хотя количество тромбоцитов до беременности влияет на послеродовое количество, в одном отчете упоминается увеличение количества тромбоцитов до максимума 3000 × 10 9 /л после доставки [19]. Тем не менее, мы не выявили в литературе ни одной пациентки с послеродовым повышением количества тромбоцитов, как у нашей пациентки. После беременности циторедуктивная терапия требуется редко, потому что молодые женщины часто относятся к группе низкого риска, согласно общепринятой классификации риска тромбоза [20].
Сакаи и др. сообщили о случае, когда количество тромбоцитов увеличилось до ≥1000 × 10 9 /л в течение 3 месяцев после родов и еще один случай увеличения числа тромбоцитов до ≥800 × 10 9 /л в течение 2 месяцев после родов. В первом случае была возобновлена циторедуктивная терапия [14]. Ивасита и др. сообщили о случае женщины, пункт 2, у которой количество тромбоцитов увеличилось до ≥2000 × 10 9 /л в течение 1–2 месяцев после родов при обеих беременностях, но снизилось примерно до 800 × 10 9 до 900 × 10 9 /L несколько месяцев спустя [15]. Хотя количество тромбоцитов до беременности влияет на послеродовое количество, в одном отчете упоминается увеличение количества тромбоцитов до максимума 3000 × 10 9 /л после доставки [19]. Тем не менее, мы не выявили в литературе ни одной пациентки с послеродовым повышением количества тромбоцитов, как у нашей пациентки. После беременности циторедуктивная терапия требуется редко, потому что молодые женщины часто относятся к группе низкого риска, согласно общепринятой классификации риска тромбоза [20]. Кроме того, ожидается, что решение о проведении циторедуктивной терапии будет зависеть от того, будет ли пациентка кормить грудью своего ребенка после родов. Таким образом, следует рассмотреть индивидуальное лечение. Хотя мы предполагаем, что лечение варьируется в зависимости от послеродового статуса пациенток, определенный консенсус экспертов указывает на то, что анализы крови следует подсчитывать через 6 недель после родов [3]. Однако следует проявлять осторожность, поскольку у некоторых женщин наблюдается восстановление числа тромбоцитов в течение 2–4 недель после родов, как у нашей пациентки и в вышеупомянутых случаях [16, 17].
Кроме того, ожидается, что решение о проведении циторедуктивной терапии будет зависеть от того, будет ли пациентка кормить грудью своего ребенка после родов. Таким образом, следует рассмотреть индивидуальное лечение. Хотя мы предполагаем, что лечение варьируется в зависимости от послеродового статуса пациенток, определенный консенсус экспертов указывает на то, что анализы крови следует подсчитывать через 6 недель после родов [3]. Однако следует проявлять осторожность, поскольку у некоторых женщин наблюдается восстановление числа тромбоцитов в течение 2–4 недель после родов, как у нашей пациентки и в вышеупомянутых случаях [16, 17].
В заключение, мы столкнулись с пациенткой, у которой вскоре после родов наблюдался заметный скачок количества тромбоцитов. Она возобновила циторедуктивную терапию; последующее течение протекло гладко, без каких-либо осложнений. Доказательства лечения беременных женщин с ЭТ ограничены. Мы надеемся, что рекомендации по ведению будут установлены путем сбора данных как во время беременности, так и подробных данных о послеродовом периоде.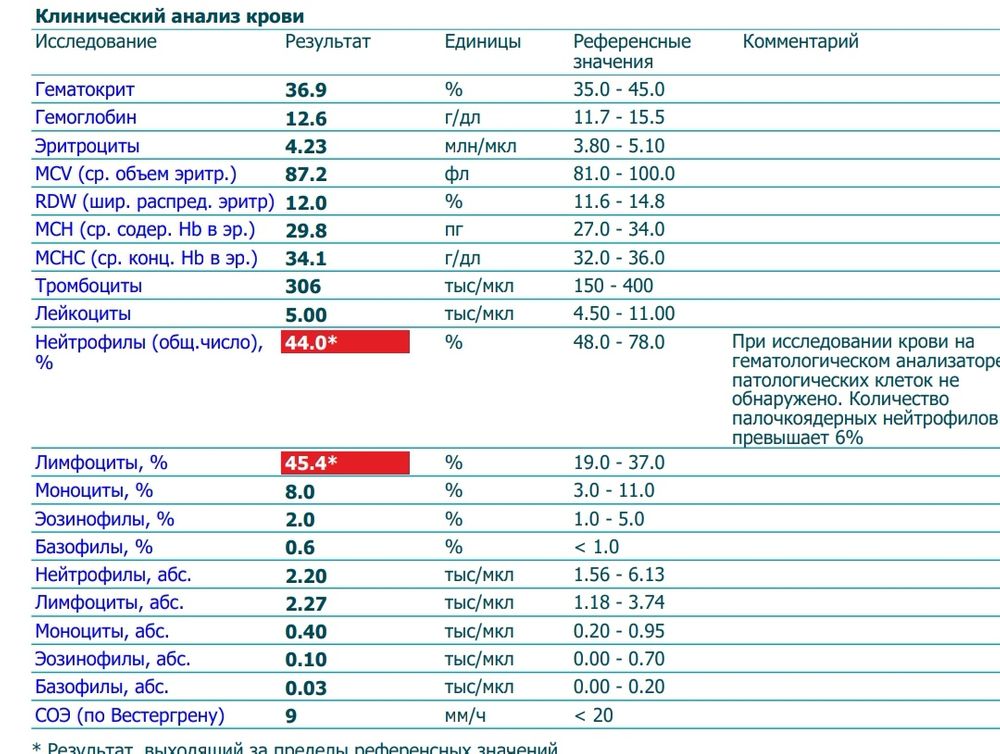
Доступность данных
В этом исследовании данные не использовались.
Конфликты интересов
Ёсинори Хашимото сообщает о получении гонораров от Takeda Pharmaceutical Co., Ltd. Другие авторы заявляют об отсутствии конфликта интересов.
Ссылки
R. J. Q. McNally, E. Roman и R. A. Cartwright, «Лейкемии и лимфомы: временные тенденции в Великобритании, 1984-93», Cancer Causes & Control , vol. 10, нет. 1, стр. 35–42, 1999.
Посмотреть по адресу:
Сайт издателя | Академия Google
T. Barbui, A. Tefferi, A.M. Vannucchi et al., «Классические миелопролиферативные новообразования с отсутствием филадельфийских хромосом: пересмотренные рекомендации по ведению из European LeukemiaNet», Leukemia , vol. 32, нет. 5, стр. 1057–1069, 2018.
Посмотреть по адресу:
Сайт издателя | Google Scholar
С.
 Э. Робинсон и С. Н. Харрисон, «Как мы лечим филадельфийско-негативные миелопролиферативные новообразования во время беременности», British Journal of Hematology , том. 189, нет. 4, стр. 625–634, 2020.
Э. Робинсон и С. Н. Харрисон, «Как мы лечим филадельфийско-негативные миелопролиферативные новообразования во время беременности», British Journal of Hematology , том. 189, нет. 4, стр. 625–634, 2020.Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Griesshammer, P. Sadjadian и K. Wille, «Современное ведение пациентов с BCR-ABL1-отрицательными миелопролиферативными новообразованиями во время беременности», Expert Review of Hematology , vol. 11, нет. 9, стр. 697–706, 2018 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
M. Griesshammer, S. Struve и T. Barbui, «Лечение филадельфийских негативных хронических миелопролиферативных заболеваний у беременных», стр. 9.0039 Обзоры крови , vol. 22, нет. 5, стр. 235–245, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C.
 Harrison, «Беременность и ее ведение при филадельфийских негативных миелопролиферативных заболеваниях», British Journal of Hematology , vol. 129, нет. 3, стр. 293–306, 2005.
Harrison, «Беременность и ее ведение при филадельфийских негативных миелопролиферативных заболеваниях», British Journal of Hematology , vol. 129, нет. 3, стр. 293–306, 2005.Посмотреть по адресу:
Сайт издателя | Google Scholar
К. Симода, Н. Такахаши, К. Кирито, Н. Ирияма, Т. Кавагути и М. Кизаки, «Практические рекомендации JSH по гематологическим злокачественным новообразованиям, 2018: I. лейкемия-4. хронический миелоидный лейкоз (ХМЛ)/миелопролиферативные новообразования (МПН)» Международный журнал гематологии , том. 112, нет. 3, стр. 268–291, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
L. Melillo, A. Tieghi, A. Candoni et al., «Исходы 122 беременностей у пациентов с эссенциальной тромбоцитемией: отчет из итальянского регистра», American Journal of Hematology , vol.
 84, нет. 10, стр. 636–640, 2009 г.
84, нет. 10, стр. 636–640, 2009 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Д. Мейз, С. Кази, В. Гупта и др., «Связь лечения миелопролиферативных новообразований во время беременности с частотой рождаемости и материнскими исходами: систематический обзор и метаанализ», JAMA Network Open , vol. 2, нет. 10, идентификатор статьи e1912666, 2019 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Y. Edahiro, H. Yasuda, A. Gotoh et al., «Терапия интерфероном беременных с эссенциальной тромбоцитемией в Японии», International Journal of Hematology , vol. 113, нет. 1, с. 106, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Quintás-Cardama, O. Abdel-Wahab, T.
 Manshouri et al., «Молекулярный анализ пациентов с истинной полицитемией или эссенциальной тромбоцитемией, получающих пегилированный интерферон-2а», Кровь , том. 122, нет. 6, стр. 893–901, 2013.
Manshouri et al., «Молекулярный анализ пациентов с истинной полицитемией или эссенциальной тромбоцитемией, получающих пегилированный интерферон-2а», Кровь , том. 122, нет. 6, стр. 893–901, 2013.Посмотреть по адресу:
Сайт издателя | Google Scholar
E. Verger, B. Cassinat, A. Chauveau et al., «Клинический и молекулярный ответ на терапию интерфероном у пациентов с эссенциальной тромбоцитемией с мутациями CALR», Blood , vol. 126, нет. 24, стр. 2585–2591, 2015.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J. Lapoirie, A. Contis, A. Guy et al., «Ведение и исходы 27 беременностей у женщин с миелопролиферативными новообразованиями», Журнал медицины матери и плода и новорожденного , том. 33, нет. 1, стр. 49–56, 2020.
Посмотреть по адресу:
Сайт издателя | Google Scholar
K.
 Sakai, A. Ueda, M. Hasegawa и Y. Ueda, «Эффективность и безопасность альфа-интерферона при эссенциальной тромбоцитемии во время беременности: два случая и обзор литературы», International Journal of Hematology , том. 108, нет. 2, стр. 203–207, 2018 г.
Sakai, A. Ueda, M. Hasegawa и Y. Ueda, «Эффективность и безопасность альфа-интерферона при эссенциальной тромбоцитемии во время беременности: два случая и обзор литературы», International Journal of Hematology , том. 108, нет. 2, стр. 203–207, 2018 г.Посмотреть по адресу:
Сайт издателя | Академия Google
T. Iwashita, M. Fujitani, Y. Yamamoto, T. Katsurada и Y. Yoshida, «Лечение альфа-интерфероном эссенциальной тромбоцитемии во время беременности», Internal Medicine , vol. 45, нет. 20, стр. 1161–1164, 2006.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Н. Сингх, С. Кумар, К. К. Рой, В. Шарма и А. Джалак, «Успешный исход для матери и плода в редком случае эссенциальной тромбоцитемии при беременности с использованием интерферона альфа», Тромбоциты , об. 23, нет.
 4, стр. 319–321, 2012 г.
4, стр. 319–321, 2012 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
P. Martinelli, V. Martinelli, A. Agangi et al., «Лечение альфа-интерфероном беременных женщин, страдающих эссенциальной тромбоцитемией: отчеты о клинических случаях и обзор», American Journal of Obstetrics and Gynecology , vol. . 191, нет. 6, стр. 2016–2020, 2004.
Посмотреть по адресу:
Сайт издателя | Академия Google
Y. Kanda, S. Chiba, Y. Tanaka et al., «Серийные уровни тромбопоэтина в сыворотке у беременной женщины с эссенциальной тромбоцитемией», British Journal of Hematology , vol. 105, нет. 1, стр. 271–273, 1999.
Посмотреть по адресу:
Сайт издателя | Google Scholar
C. A. Wright and A. Tefferi, «Опыт одного учреждения с 43 беременностями при эссенциальной тромбоцитемии», European Journal of Hematology , vol.
 66, нет. 3, стр. 152–159, 2001.
66, нет. 3, стр. 152–159, 2001.Посмотреть по адресу:
Сайт издателя | Google Scholar
Y. Hashimoto, H. Nakamae, T. Tanaka et al., «Подтверждение предыдущих прогностических моделей тромбоза и исследование модифицированных моделей у пациентов с эссенциальной тромбоцитемией», European Journal of Hematology , vol. 101, нет. 4, стр. 508–513, 2018 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Copyright
Copyright © 2021 Yoshinori Hashimoto et al. Это статья с открытым доступом, распространяемая в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего цитирования оригинальной работы.
Я беременна и уровень тромбоцитов у меня 400000.
 Это нормально? Я беременна, и уровень тромбоцитов у меня 400 000. Это нормально?
Это нормально? Я беременна, и уровень тромбоцитов у меня 400 000. Это нормально? Пресс
Введите
искать
iCliniq / Ответы / Гематология / Высокий уровень тромбоцитов / Я беременна, и у меня уровень тромбоцитов 400 000. Это нормально?
Ответил
Д-р Сугреев Сингх
и с медицинской точки зрения проверено командой медицинского обзора
iCliniq.
Это премиум вопрос-ответ , опубликованный 04 мая 2022 г.
Вопрос пациента
Здравствуйте, доктор,
Мне 32 года, я беременна на восьмом месяце. У меня не было никаких проблем, за исключением того, что врач сказал нам сделать анализ крови на восьмом месяце беременности, и, увидев 400 000 тромбоцитов, они сказали нам посетить врача. После таблеток железа все ценности пошли отлично этой осенью. Но после прекращения их приема во время беременности они вернулись к прежнему уровню прямо сейчас. Так стоит ли беспокоиться о 400 000 тромбоцитов и 11,8 г/дл гемоглобина?
Так стоит ли беспокоиться о 400 000 тромбоцитов и 11,8 г/дл гемоглобина?
Ответил доктор Сугриев Сингх
#
Привет,
Добро пожаловать на icliniq.com.
Спасибо за письмо, и я понимаю вашу озабоченность. Вам не о чем беспокоиться, я просмотрел ваши отчеты, и они абсолютно безупречны (вложения удалены для защиты личности пациента ). Количество тромбоцитов до 450 000 считается нормальным. Теперь ваши отчеты в норме. Если у вас есть какие-либо симптомы, пожалуйста, дайте мне знать. Сколько недель вы беременны? Пожалуйста, дайте мне знать, чтобы я мог сказать вам, нужно ли вам продолжать железный планшет или нет.
Спасибо.
Был ли этот ответ полезен?
|
Те же симптомы не означают, что у вас такая же проблема. Обратитесь к врачу прямо сейчас!
Доктор Сугриев Сингх
Опыт: 2 + лет
Терапия
Связанные вопросы:
Быстро снижаются гемоглобин, эритроциты и лейкоциты. Что может быть причиной?
Что может быть причиной?
Эти отчеты исключат гемолитическую анемию, которая вызывает гемолиз, приводящий к быстрому снижению гемоглобина … Необходимо провести DCT крови (прямой тест Кумбса), чтобы выявить аутоиммунную гемолитическую анемию …… Читать полностью
Каковы причины высокого уровня тромбоцитов?
.. число выше нормального диапазона. Причин такого повышенного количества тромбоцитов много. Это требует дальнейших исследований, включая генетические тесты. Такие состояния, как эссенциальный тромбоцитоз, можно рассматривать с учетом доступной информации из… Читать полностью
Мой уровень тромбоцитов, мочевой кислоты, SGOT и SGPT не в порядке. Как я могу лечиться?
.. объясните вышеперечисленное один за другим.
Ваш средний объем тромбоцитов больше, а CHCM (средняя концентрация гемоглобина в клетках) низка; однако это не имеет клинического значения, что требует лечения.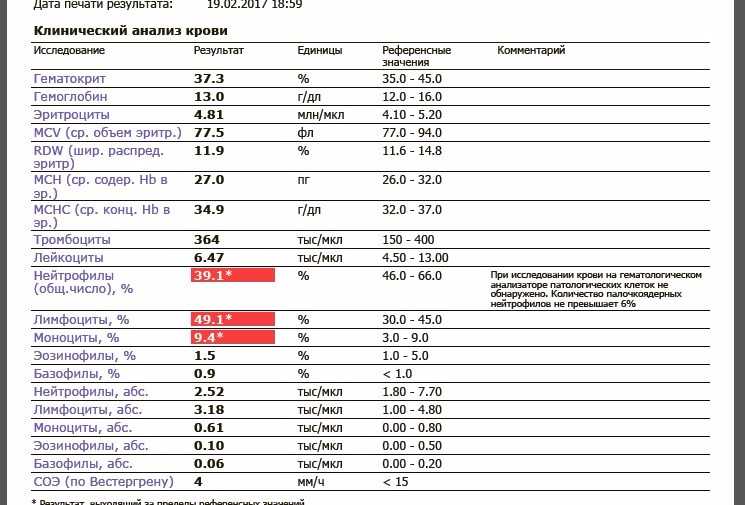 Ваш SGOT (сывороточная глутаминовая щавелевоуксусная трансаминаза) и S… Читать полностью
Ваш SGOT (сывороточная глутаминовая щавелевоуксусная трансаминаза) и S… Читать полностью
Также читайте ответы от:
- Высокий уровень тромбоцитов
- Гемоглобин
- Количество тромбоцитов
Всестороннее медицинское второе мнение. Отправьте свое дело
Читайте также
Влияние COVID-19 на сексуальное здоровье женщин
Женщины пострадали и все еще сталкиваются с последствиями коронавируса для своего сексуального здоровья. Подробнее о импа… Подробнее»
Синдром запястного канала при беременности
Синдром запястного канала при беременности возникает, когда нерв, иннервирующий руку, сдавливается на уровне предплечья из-за… Читать подробнее»
Разорвать связь — Синдром раздраженного кишечника и избыточный бактериальный рост
Избыток бактерий в кишечнике вызывает синдром раздраженного кишечника (СРК).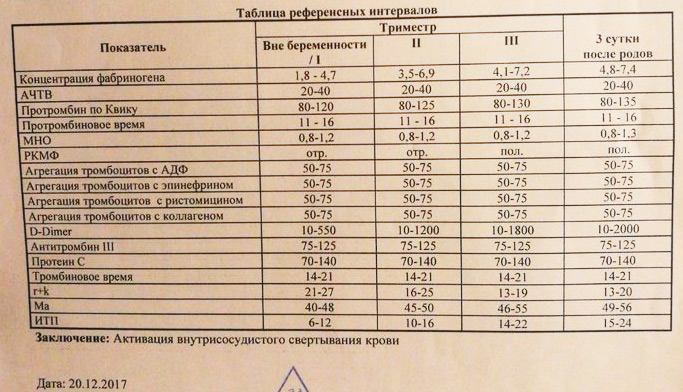 Прочтите статью ниже, чтобы узнать больше о … Подробнее »
Прочтите статью ниже, чтобы узнать больше о … Подробнее »
Задать вопрос о здоровье врачу онлайн?
Спросите гематолога сейчас* гарантированный ответ в течение 4 часов.
- Новый пользователь
- Существующий пользователь
Электронная почта
Пароль
Показать
Забыли пароль?
Отказ от ответственности: Никакой контент, опубликованный на этом веб-сайте, не предназначен для замены профессиональной медицинской диагностики, консультации или лечения квалифицированным врачом. Обратитесь за советом к своему врачу или другому квалифицированному медицинскому работнику, если у вас возникнут вопросы относительно ваших симптомов и состояния здоровья, чтобы поставить полный медицинский диагноз. Не откладывайте и не пренебрегайте обращением за профессиональной медицинской консультацией из-за того, что вы прочитали на этом сайте.

 Э. Робинсон и С. Н. Харрисон, «Как мы лечим филадельфийско-негативные миелопролиферативные новообразования во время беременности», British Journal of Hematology , том. 189, нет. 4, стр. 625–634, 2020.
Э. Робинсон и С. Н. Харрисон, «Как мы лечим филадельфийско-негативные миелопролиферативные новообразования во время беременности», British Journal of Hematology , том. 189, нет. 4, стр. 625–634, 2020. Harrison, «Беременность и ее ведение при филадельфийских негативных миелопролиферативных заболеваниях», British Journal of Hematology , vol. 129, нет. 3, стр. 293–306, 2005.
Harrison, «Беременность и ее ведение при филадельфийских негативных миелопролиферативных заболеваниях», British Journal of Hematology , vol. 129, нет. 3, стр. 293–306, 2005. 84, нет. 10, стр. 636–640, 2009 г.
84, нет. 10, стр. 636–640, 2009 г. Manshouri et al., «Молекулярный анализ пациентов с истинной полицитемией или эссенциальной тромбоцитемией, получающих пегилированный интерферон-2а», Кровь , том. 122, нет. 6, стр. 893–901, 2013.
Manshouri et al., «Молекулярный анализ пациентов с истинной полицитемией или эссенциальной тромбоцитемией, получающих пегилированный интерферон-2а», Кровь , том. 122, нет. 6, стр. 893–901, 2013.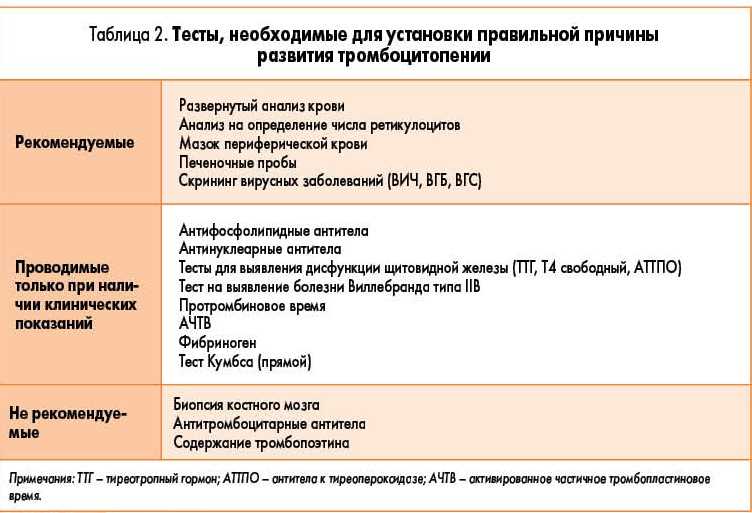 Sakai, A. Ueda, M. Hasegawa и Y. Ueda, «Эффективность и безопасность альфа-интерферона при эссенциальной тромбоцитемии во время беременности: два случая и обзор литературы», International Journal of Hematology , том. 108, нет. 2, стр. 203–207, 2018 г.
Sakai, A. Ueda, M. Hasegawa и Y. Ueda, «Эффективность и безопасность альфа-интерферона при эссенциальной тромбоцитемии во время беременности: два случая и обзор литературы», International Journal of Hematology , том. 108, нет. 2, стр. 203–207, 2018 г. 4, стр. 319–321, 2012 г.
4, стр. 319–321, 2012 г. 66, нет. 3, стр. 152–159, 2001.
66, нет. 3, стр. 152–159, 2001.