Энтеровирусная инфекция. Причины, симптомы, диагностика и лечение заболевания.
Энтеровирусы – представляют собой довольно многочисленную группу вирусов, которые состоят из рибонуклеиновой кислоты (РНК) и белка. Наиболее известными являются полиовирусы – которые являются причиной возникновения такого заболевания как паралитический полиомиелит (широко известный как полиомиелит). Менее известными, но более распространенными являются неполиомиелитные энтеровирусы — Эховирусы и вирусы Коксаки.
Считается что паралитический полиомиелит полностью ликвидирован благодаря вакцинации. Причиной огромного количества заболеваний, вызванных энтеровирусами, являются Эховирусы и вирусы Коксаки, на сегодняшний день насчитывается около 64 различных штаммов (видов) энтеровируса, которые вызывают заболевания у людей более 70% инфекций вызвано только лишь 10 штаммами. Любой человек может быть заражен энтеровирусной инфекцией, которая является возбудителем более миллиарда заболеваний по всему миру.
Заболеваниям вызываемым Энтеровирусами в большей степени подвержены дети и подростки, причем чем меньше возраст, тем опаснее может протекать заболевание.
Тревожность факта об энтеровирусах заключается в том, что они способны распространяться в различных органах и способны сохраняться в организме человека в течение многих лет — что может привести к продолжительной болезни после первичного инфицирования.
Причины энтеровирусной инфекции
Энтеровирусы – названы так, потому что после возникновения инфекции они размножаются первоначально в желудочно-кишечном тракте. Несмотря на это, они обычно не вызывают кишечных симптомов, чаще всего они активно распространяются и вызывают симптомы и заболевания таких органов как: сердце, кожа, легкие, головной и спинной мозг и др.
Вирусы, как правило, делятся на те, которые используют ДНК (дезоксирибонуклеиновую кислоту) или РНК в качестве своего генетического материала — все энтеровирусы являются РНК-вирусами. Энтеровирусы являются частью большой группы вирусов, известных как пикорнавирусы. Это слово происходит от сочетания «пико» (с испанского — означает «немного»), и РНК (рибонуклеиновая кислота, важный компонент генетического материала).
Принято считать, что Энтеровирусы делятся на 3 основные группы:
- Полиовирусы (3 штамма)
- Эховирусы (28 штаммов)
- Вирусы Коксаки (Коксаки А – 23 штамма, Коксаки Б – 6 штаммов)
Энтеровирусы — не входящие ни в одну из групп (4 штамма)
Энтеровирусы встречаются во всем мире, но инфицирование чаще всего происходит в районах с низким уровнем гигиены и высокой перенаселенностью. Вирус чаще всего передается фекально-оральным путем, а также через загрязненную пищу или воду. Попадание в организм некоторых штаммов вируса воздушно-капельным путем может привести к респираторным заболеваниям.
Энтеровирус чаще всего попадает в организм человека через желудочно-кишечный тракт (ЖКТ) или дыхательные пути. Попадая в ЖКТ вирусы останавливаются в местных лимфатических узлах где они начинают первую стадию размножения. Примерно на третий день после инфицирования вирусы попадают в кровоток и начинают циркулировать по организму. На 3-7й день вирусы с кровью могут попасть в системы органов где может начаться вторая стадия размножения и как следствие вызвать различные заболевания. Производство антител к вирусу происходит в течении первых 7-10и дней.
Известно что вирус Коксаки, чаше всего начинает активно размножаться и вызывает заболевания попадая в такие ткани и органы как: глотка (ангина), кожа (вирусная пузырчатка полости рта и конечностей), миокард (миокардит) и мозговые оболочки (асептический менингит).
Эховирус — активно размножается и вызывает заболевания попадая в такие ткани и органы как: печень (некроз печени), миокард, кожа (вирусные экзантемы), мозговые оболочки (асептический менингит), легкие и надпочечники.
Симптомы и признаки энтеровирусной инфекции
Симптомы и признаки энтеровируса
Неполиомиелитные Энтеровирусы вызывают огромное количество случаев инфицирования в год. Более 90% этих случаев протекает либо бессимптомно, либо вызывает неспецифическое лихорадочное заболевание. Обычно спектр симптомов очень большой, но в большинстве случаев он практически всегда включают: лихорадку (повышение температуры тела до 39-40°С), общая слабость, головная боль, мышечная боль и желудочно-кишечные симптомы.
Возможные симптомы описаны ниже:
- Насморк и заложенность носа и его пазух, боль в носу, боль в горле, боль в ушах, затруднение глотания, потеря обоняния или вкуса.

- Тошнота, расстройство желудка, рефлюкс, вздутие живота, верхняя и нижняя боли в животе, судороги, запоры, чередующиеся с диареей.
- Стремительная потеря веса из-за нарушения пищеварения и уменьшенного потребления калорий или увеличение веса из-за неактивности.
- Онемение в конечностях, подергивание мышц и спазмы. Могут наблюдаться покалывание лица и онемение.
- Различные виды головной боли (острые, ноющие, пульсирующие).
- Боли в костях, мышцах и суставах. Боль в ногах является довольно распространенным явлением.
- Боль и стеснение в груди, сердцебиение.
- Кашель, одышка, свистящее дыхание.
- Нарушение сердечного ритма (аритмии) или тахикардия (учащенное сердцебиение)
- Перемежающаяся лихорадка — характеризующаяся быстрым, значительным повышением температуры (38-40°С), которая держится несколько часов, а затем сменяется быстрым её падением до нормальных значений), озноб и сильная ночная потливость.
- Нарушение репродуктивной функции а также боль в области яичек.
 Боль в области таза.
Боль в области таза. - Затуманенное зрение, снижение остроты зрения.
- Пузырьки или изъязвления в ротовой полости, глотке и у женщин во влагалище/ шейке матки.
- Психологические проблемы – тревожные состояния или депрессии.
- Проблемы с концентрацией внимания. Когнитивные проблемы, краткосрочные проблемы с памятью.
- Нарушение сна.
- Судороги возникают редко, но случаются.
- Увеличение лимфатических узлов в области шеи и в подмышечных впадинах
- Сыпь
- Подозрение на энтеровирусные инфекции должно возникнуть, если одни и те же симптомы повторяются каждый месяц.
Нельзя говорить о каких-то специфических симптомах характерных для всей группы энтеровирусов помимо перечисленных выше, но можно сгруппировать симптомы проявляющиеся при осложнениях энтеровирусной инфекции:
- Энтеровирусная лихорадка (летний грипп) — наиболее распространенная форма энтеровирусной инфекции, начинается с внезапного повышения температуры, температура обычно держится в пределах 38.

- Герпетическая ангина — У таких пациентов появляются болезненные пузырьки, наполненные светлой жидкостью на задней стенке глотки и миндалинах, пузырьки обычно окружены каемкой красного цвета. Этим повреждениям сопутствуют лихорадка, боль в горле, боль при глотании (одинофагия). Матери могут заметить у детей нежелание принимать пищу из-за болезненных язв. Возбудителем чаще всего является вирус Коксаки группы А и, иногда, вирус Коксаки группы В. Ангина является самоограниченным заболеванием, и его симптомы длятся 3-7 дней.
- Вирусная пузырчатка полости рта и конечностей — проявляется везикулярной сыпью (маленькие пузырьки, заполненные жидкостью которые возвышаются над поверхностью кожи) в ротоглотке, на ладонях, подошвах и в области между пальцами у малышей и детей школьного возраста.
 Пузырьки в ротовой полости обычно не болезненны. Часто у пациентов наблюдается лихорадка в течение 1-2 дней и мелкие красные пятна на коже рук и ног (характерная вирусная экзантема). Поражения чаще всего встречаются на поверхности кожи в нижней части рук и ног. Наиболее распространенным возбудителем является вирус Коксаки группы А.
Пузырьки в ротовой полости обычно не болезненны. Часто у пациентов наблюдается лихорадка в течение 1-2 дней и мелкие красные пятна на коже рук и ног (характерная вирусная экзантема). Поражения чаще всего встречаются на поверхности кожи в нижней части рук и ног. Наиболее распространенным возбудителем является вирус Коксаки группы А. - Вирусные экзантемы — Частой причиной обращений в отделения неотложной помощи являются вирусные экзантемы, похожие на сыпи как при краснухе или розеоле; происходят в летние месяцы. Эти экзантемы возникают у детей в возрасте до 5 лет и благоприятно проходят в течение 3-5 дней. Возбудителями являются, как правило, Эховирусы.
- Плевродиния (болезнь Борнхольм, грипп дьявола) — Вызывает тяжелые мышечные боли в области груди и живота. Эти резкие боли обостряются при дыхании или кашле и связаны с обильным потоотделением. Судорожные мышечные боли длятся 15-30 минут у детей и подростков. Состояние может имитировать серьезные хирургические симптомы и может вызвать периодические приступы затруднения дыхания.
 Эти симптомы сопровождаются лихорадкой, головной болью, резким снижением веса, тошнотой и рвотой. Симптомы длятся в течение 2 дней. Вирус Коксаки B3 и B5 поражают межреберные мышцы, вызывая эти пугающие, но редкие вспышки.
Эти симптомы сопровождаются лихорадкой, головной болью, резким снижением веса, тошнотой и рвотой. Симптомы длятся в течение 2 дней. Вирус Коксаки B3 и B5 поражают межреберные мышцы, вызывая эти пугающие, но редкие вспышки. - Миокардит и/или перикардит — включает в себя инфекции сердечной мышцы (миокарда) и покрытия вокруг сердца (перикард). Младенцы и дети дошкольного возраста являются наиболее чувствительными к данному заболеванию, и по некоторым причинам, более чем две трети из случаев приходится на мужской пол. Заболевание обычно начинается как инфекция верхних дыхательных путей с кашлем, одышкой и лихорадкой. Может развиться боль в груди, сильная одышка, нарушения сердечного ритма и сердечная недостаточность.
- Острый геморрагический конъюнктивит – подразумевает вирусную инфекцию конъюнктивы глаза, которая представляет собой покрытие вокруг глаз. Характерны такие симптомы как: боль, затуманенное зрение, снижение остроты зрения, светобоязнь и выделения из глаз. Головная боль и лихорадка проявляется лишь у одного из пяти пациентов.
 Заболевание протекает 10 дней.
Заболевание протекает 10 дней. - Асептический менингоэнцефалит – является хорошо известным синдромом, вызванным Энтеровирусами. На самом деле, энтеровирусы ответственны примерно за 90% случаев асептического менингита, и чаще всего поражают детей и подростков. Для него характерны головная боль, лихорадка, отказ от света и глазная боль. Могут быть выражены такие симптомы как сонливость, боль в горле, кашель, боль в мышцах и сыпь. Иногда инфицируются не только мозговые оболочки, но и сама ткань мозга, вызывая энцефалит. Болезнь проходит примерно через неделю, а необратимые повреждения являются нетипичными. Энтеровирусы могут также вызывать синдром Гийена-Барре, который предполагает слабость и паралич конечностей и реже дыхательной мускулатуры.
Диагностика энтеровирусной инфекции
В большинстве случаев, диагноз ставится на основании характерных симптомов, вызванных вирусом, истории болезни и физикального обследования. Специфические исследования необходимы для того чтобы определить возбудителя инфекции, так как это будет сильно влиять на подход к лечению (если возбудитель заболевания вирус, то не потребуется антибиотикотерапия), а также в случае развития осложнений.
Лабораторные исследования:
- Серология — серологическое исследование крови может выявить увеличение количества антител выработанных организмом для борьбы с энтеровирусом в острые и реконвалесцентные (период выздоровления) периоды болезни. Это диагностическое исследование может определить только вирус Коксаки B 1-6 и Эховирусы 6, 7, 9, 11, и 30. Другие известные энтеровирусы не могут быть идентифицированы при помощи этого теста. Отрицательное серологическое исследование не обязательно может означать отсутствие энтеровирусов.
- Полимеразная цепная реакция (ПЦР) — Этот тест высокочувствителен и специфичен для обнаружения энтеровирусных РНК в образцах спинномозговой жидкости, с чувствительностью 100% и специфичностью 97% определяется возбудитель заболевания. ПЦР дает быстрые результаты. ПЦР тестирование крови может определить вирус только у 30% пациентов с синдромом хронической усталости (миалгическим энцефаломиелитом).
- Сердечные энзимы и тропонин I – анализ крови который направлен на определение уровня специфических сердечных энзимов и тропонина 1, которые указывают при высоком своем содержании в крови на повреждения мышц сердца.
 Содержание тропонина I в сыворотке в норме 0—0,5 нг/мл. Проводится при
Содержание тропонина I в сыворотке в норме 0—0,5 нг/мл. Проводится при - Анализ спинномозговой жидкости – проводится при появлении симптомов поражения головного и спинного мозга и их оболочек. При помощи пункции у пациента делается забор небольшого количества жидкости из спиномозгового канала в стерильных условиях. У пациентов с асептическим менингитом показывает умеренное повышение уровня содержания лейкоцитов. Уровень глюкозы в норме или слегка понижен, в то время как уровень белка в норме или несколько повышен.
- Полимеразная цепная реакция с обратной транскриптазой (ОТ-ПЦР) — Этот тест предназначен для обнаружения общих генетических участков РНК у большинства энтеровирусов. Результаты могут быть доступны в течение 24 часов, что делает обнаружение более чувствительным (95%), более специфичным (97%) и эффективным. Этот тест одобрен для диагностики энтеровирусного менингита. Наилучшие результаты получают при использовании спиномозговой жидкости для исследования. При использовании других жидкостей организма, таких как кал, мокрота и слизь из дыхательных путей и крови, данный метод показывает не столь хорошие результаты.

Инструментальные исследования
- Рентгенография грудной клетки — У пациентов с миоперикардитом, рентгенография грудной клетки может выявить кардиомегалию (увеличение сердца в объеме) после перикардита или сердечного расширения. При плевродинии результаты рентгенограммы грудной клетки в норме.
- Электроэнцефалография — Этот тест может быть использован для оценки степени и тяжести заболевания у больных энцефалитом.
- Эхокардиография – назначается пациентам с подозрением на миокардит, исследование может показать нарушения движения стенок камер сердца. В тяжелых случаях данный метод может выявить острое расширение желудочка и снижение фракции выброса.
- Офтальмологический осмотр при помощи щелевой лампы – У больных острым геморрагическим конъюнктивитом, эрозии роговицы могут быть выявлены с помощью флуоресцентного пятна. Энтеровирус 70 и вирус Коксаки A24 может быть выделен из мазков конъюнктивы в течение первых 3 дней после заражения.

Лечение энтеровирусной инфекции
В большинстве случаев Энтеровирусная инфекция протекает без осложнений и не требует какого-либо специфического лечения. Основой является симптоматическое и поддерживающее лечение. Постельный режим, обильное питье, витамины, в случае высокой температуры жаропонижающие. Никакой специфической диеты на данный момент не существует для пациентов с энтеровирусной инфекцией. Не существует никакого специфического противовирусного лечения, такого как вакцинация, для лечения и предотвращения неполиомиелитной энтеровирусной инфекции.
ПРИ ВОЗНИКНОВЕНИИ ПОДОБНЫХ СИМПТОМОВ, ВАМ НЕОБХОДИМО СРОЧНО ОБРАТИТЬСЯ К ВРАЧУ!
Профилактика
В настоящее время ни одна вакцина не является действенной против неполиомиелитных энтеровирусов. Общая гигиена и частое мытье рук эффективны в снижении распространения этих вирусов. Если мыло, и чистая вода не доступны, используйте «дезинфицирующее средство для рук» на спиртовой основе.
Важно отметить, что грудное молоко содержит антитела, которые могут защитить новорожденных.
| Общая информация Выявление специфических антител класса IgM к вирусу Коксаки указывает на острый период заболевания. Для подтверждения диагноза необходимо исследовать парные сыворотки в первые дни и через 2 недели от начала заболевания. В пользу острой инфекции свидетельствует увеличение титра антител не менее, чем в 4 раза. Вируса Коксаки вызывает инфекционный процесс – энтеровирусный стоматит с экзантемой. Основные симптомы: повышение температуры до 39°С, диарея, общее недомогание, боль в мышцах, головная боль, образование маленьких болезненных пузырьков и язвочек на руках, ногах и во рту. Время от заражения до развития первых симптомов составляет от 2 до 10 дней. Путь передачи вируса Коксаки — воздушно-капельный и фекально-оральный, то есть посредством зараженной пищи. В редких случаях наблюдается вертикальный путь передачи от матери плоду.
|
В тверском Роспотребнадзоре предупредили о вирусе Коксаки
Как сообщают в региональном отделении Роспотребнадзора, вирусы Коксаки, которые обычно циркулировали летом, в этом году проявили себя в ноябре. Это связано с распространением коронавируса. Именно по этой причине и грипп начали выявлять уже в августе.
Роспотребнадзор напоминает, что заболевания, вызванные вирусами Коксаки, относятся к группе энтеровирусных инфекций, широко распространенных в большинстве стран, включая Российскую Федерацию.
Заражаются энтеровирусами от человека-носителя. Возбудитель в окружающую среду передаётся с испражнениями или воздушно-капельным путём. Человек может быть заразным до 5 месяцев.
Возбудитель инфекции может до двух месяцев оставаться жизнеспособным в воде, на поверхности предметов, на продуктах, а в замороженном состоянии — до нескольких лет.
Группа риска
В группе риска по заражению вирусами Коксаки: отдыхающие в местах, где зафиксированы случаи заболевания; дети, особенно, новорождённые; люди старше 60 лет; люди с иммунодефицитными состояниями (онкологические больные, ВИЧ-инфицированные).
Симптомы
Вирус Коксаки может вызывать самые разнообразные симптомы. Около половины заразившихся переносят инфекцию бессимптомно. У других внезапно появляется лихорадка, головные и мышечные боли, боль в горле, тошнота, болевые ощущения в животе.
Заболевший инфекцией, вызванной вирусами Коксаки, может не иметь других симптомов кроме лихорадки.
Существует две группы вирусов Коксаки: А (24 серотипа) и B (6 серотипов).
Инфицирование вирусами Коксаки А, как правило, проявляется высыпаниями на коже, поражением верхних дыхательных путей, стоматитом и герпангиной (появлением пузырьков на слизистой оболочке полости рта и на миндалинах), конъюнктивитом, склеритом, диареей, возможно развитие менингита.
Вирусы Коксаки В чаще поражают сердце, плевру, печень, поджелудочную железу, нередко становятся причиной выраженного болевого синдрома в животе, в грудной клетке, сыпи. Большинство заболевших — дети до 15 лет.
Всем известная комбинация симптомов «рука-нога-рот» может быть вызвана вирусами Коксаки А5, А9, А10, А16, В1, В3. В соответствии с названием, у пациентов обнаруживают болезненные пузырьки в полости рта, на задней стенке горла, на ладонях и подошвах стоп, реже — на задней поверхности голеней, бедер, ягодиц. Высыпания становятся заметны обычно через 1-2 дня после появления первых симптомов, не отличающихся от большинства ОРВИ, — повышения температуры тела, ломоты и болей в мышцах, головной боли, першения в горле. Коксаки В (6 типов) — вызывают воспаление сердечной мышцы, печени, что сопровождается головными болями, болями в животе, лихорадкой, которые могут длиться до 20 дней.
Один и тот же серотип может передаваться от одного человека к другому с развитием разной симптоматики.
Осложнения
Иногда вирусы вызывают достаточно серьёзные осложнения, требующие госпитализации. Например, вирусный менингит, энцефалит, миокардит. В таких случаях заражение может закончиться летально.
Перенесенная инфекция Коксаки у беременных может вызывать врожденные пороки развития сердечно-сосудистой, мочеполовой и пищеварительной систем у новорожденного. Энтеровирусы могут быть причиной развития тяжелой инфекции центральной нервной системы у новорожденных, следствием которой может стать летальный исход
Когда необходимо обратиться к врачу?
Поводом для обращения к врачу служат: повышение температуры тела отсутствие аппетита, рвота, диарея, затрудненное дыхание, судороги, необычная сонливость, ребенок жалуется на боль в груди или животе, высыпания на коже или во рту, сильная боль в горле, сильная головная боль, особенно сопровождающаяся рвотой, спутанностью сознания или необычной сонливостью, ригидность затылочных мышц (сложно наклонить голову вперед), покраснение, воспаление глаз.
При наличии одного или нескольких перечисленных симптомов необходимо как можно скорее обратиться к врачу. В случаях развития судорог, при необычной сонливости, спутанности сознания, сильных болях в груди или в животе, сильной головной боли, сопровождающейся рвотой, ригидности затылочных мышц, — нужно немедленно вызвать бригаду скорой помощи.
Как не заразиться
Специфическая профилактика инфекции, вызванной вирусом Коксаки, не разработана. Соблюдение правил личной и общественной гигиены позволят свести к минимуму риск заражения.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter
6. Методы выделения энтеровирусов в культурах клеток / КонсультантПлюс
6. Методы выделения энтеровирусов в культурах клеток
Исследование полученных элюатов на энтеровирусы проводят в культуре ткани в соответствии с документом «Руководство по вирусологическим исследованиям полиомиелита», рекомендованным Всемирной организацией здравоохранения (1998). При этом следует отметить, что для выделения вирусов используют максимально возможный полученный элюат (кроме 1 мл, заложенного на хранение, и объема, используемого для исследования в ИФА и ПЦР). Для выделения вирусов используют следующие культуры тканей: RD, Hep-2, BGM и другие чувствительные к энтеровирусам линии клеток.
При этом следует отметить, что для выделения вирусов используют максимально возможный полученный элюат (кроме 1 мл, заложенного на хранение, и объема, используемого для исследования в ИФА и ПЦР). Для выделения вирусов используют следующие культуры тканей: RD, Hep-2, BGM и другие чувствительные к энтеровирусам линии клеток.
Перевиваемые культуры клеток RD, Hep-2 (Cincinnatti), BGM наиболее пригодны для проведения лабораторных исследований и позволяют выделять достаточно широкий спектр энтеровирусов, которые могут присутствовать в водных объектах окружающей среды.
Культура клеток RD, происходящая из человеческой рабдомиосаркомы, обладает высокой чувствительностью к вирусам полиомиелита, многим типам вируса ECHO, некоторым вирусам Коксаки А. Вирусы полиомиелита и вирусы Коксаки В хорошо размножаются в культуре клеток Нер-2, полученной из эпидермоидной карциномы человека. Культура клеток BGM — перевиваемая культура клеток почек африканской зеленой мартышки — чувствительна к вирусам полиомиелита и вирусам Коксаки В. Использование, по крайней мере, двух культур позволяет выявлять, возможно, больший спектр вирусов, а комбинация клеток, обладающих различной чувствительностью к различным энтеровирусам, может помочь при идентификации выделенного цитопатогенного агента. Чрезвычайно полезным является поддержание и использование в лабораторных исследованиях культуры клеток L20B. Эта культура клеток создана на основе мышиной линии L-клеток, в которую экспрессированы человеческие рецепторы к полиовирусу. Она позволяет селективно выделять только полиовирусы, что делает ее незаменимой культурой при идентификации выделенных цитопатогенных агентов для разделения смесей вирусов. Чувствительность культур клеток к различным энтеровирусам представлена в табл. 2.
Использование, по крайней мере, двух культур позволяет выявлять, возможно, больший спектр вирусов, а комбинация клеток, обладающих различной чувствительностью к различным энтеровирусам, может помочь при идентификации выделенного цитопатогенного агента. Чрезвычайно полезным является поддержание и использование в лабораторных исследованиях культуры клеток L20B. Эта культура клеток создана на основе мышиной линии L-клеток, в которую экспрессированы человеческие рецепторы к полиовирусу. Она позволяет селективно выделять только полиовирусы, что делает ее незаменимой культурой при идентификации выделенных цитопатогенных агентов для разделения смесей вирусов. Чувствительность культур клеток к различным энтеровирусам представлена в табл. 2.
Открыть полный текст документа
Страница статьи : Российский онкологический журнал
Weinstein J.L., Katzenstein H.M., Cohn S.L. Advances in the diagnosis and treatment of neuroblastoma. Oncologist. 2003; 8(3): 278-92.
Oncologist. 2003; 8(3): 278-92.
Toyoda H., Yin J, Mueller S, Wimmer E., Cello J. Oncolytic treatment and cure of neuroblastoma by a novel attenuated poliovirus in a novel poliovirus-susceptible animal model. Cancer Res. 2007; 67(6): 2857-64.
Parikh N.S., Currier M.A., Mahller Y.Y., Adams L.C., Di Pasquale B., Collins M.H. Oncolytic herpes simplex virus mutants are more efficacious than wild-type adenovirus Type 5 for the treatment of high-risk neuroblastomas in preclinical models. Pediatr. Blood Cancer. 2005; 44(5): 469-78.
Pesonen S., Helin H., Nokisalmi P., Escutenaire S., Ribacka C., Sarkioja M., Cerullo V. Oncolytic adenovirus treatment of a patient with refractory neuroblastoma. Acta Oncol. 2010; 49(1): 120-2.
Garcia-Castro J., Alemany R., Cascalló M., Martínez-Quintanilla J., Arriero Mdel M., Lassaletta A. Treatment of metastatic neuroblastoma with systemic oncolytic virotherapy delivered by autologous mesenchymal stem cells: an exploratory study. Cancer Gene Ther. 2010; 17(7): 476-83.
2010; 17(7): 476-83.
Miyamoto S., Inoue H., Nakamura T., Yamada M., Sakamoto C., Urata Y., Okazaki T. Coxsackievirus B3 is an oncolytic virus with immunostimulatory properties that is active against lung adenocarcinoma. Cancer Res. 2012; 72(10): 2609-21.
Чумаков П.М., Морозова В.В., Бабкин И.В., Байков И.К., Нетесов С.В., Тикунова Н.В. Онколитические энтеровирусы. Молекулярная биология. 2012; 46(5): 712-25.
Skelding K.A., Barry R.D., Shafren D.R. Systemic targeting of metastatic human breast tumor xenografts by Coxsackievirus A21. Breast Cancer Res. Treat. 2009; 113(1): 21-30.
Haley E.S., Au G.G., Carlton B.R., Barry R.D., Shafren D.R. Regional administration of oncolytic Echovirus 1 as a novel therapy for the peritoneal dissemination of gastric cancer. J. Mol. Med. 2009; 87(4): 385-99.
Shafren D.R., Sylvester D., Johansson E.S., Campbell I.G., Barry R.D. Oncolysis of human ovarian cancers by echovirus type 1. Int. J. Cancer. 2005; 115(2): 320-8.
Doniņa S. , Strēle I., Proboka G., Auziņš J., Alberts P., Jonsson B. Adapted ECHO-7 virus Rigvir immunotherapy (oncolytic virotherapy) prolongs survival in melanoma patients after surgical excision of the tumour in a retrospective study. Melanoma Res. 2015; 25(5): 421.
, Strēle I., Proboka G., Auziņš J., Alberts P., Jonsson B. Adapted ECHO-7 virus Rigvir immunotherapy (oncolytic virotherapy) prolongs survival in melanoma patients after surgical excision of the tumour in a retrospective study. Melanoma Res. 2015; 25(5): 421.
Seitsonen J.J., Shakeel S., Susi P., Pandurangan A.P., Sinkovits R.S., Hyvönen H. Structural analysis of coxsackievirus A7 reveals conformational changes associated with uncoating. J. Virol. 2012; 86(13): 7207-15.
Mahy B.W. J. The Dictionary of Virology. Atlanta: Academic Press; 2009.
Нетёсов С.В., Кочнева Г.В., Локтев В.Б., Святченко В.А., Сергеев А.Н., Терновой В.А. и др. Онколитические вирусы: достижения и проблемы. Эпидемиология и санитария. 2011;(3): 10-7.
Сейбиль В.Б., Малышкина Л.П. Проблема ликвидации полиомиелита как инфекции требует иного решения. В кн.: Труды Института полиомиелита и вирусных энцефалитов имени М.П. Чумакова РАМН. Медицинская вирусология. М.; 2014; 28(1): 30-6.
Трещалина, Е.М. Коллекция штаммов опухолей человека / Под ред. М.И. Давыдова. М.: Практическая медицина; 2009: 88-90.
Коллекция штаммов опухолей человека / Под ред. М.И. Давыдова. М.: Практическая медицина; 2009: 88-90.
Сосновцева А.О., Липатова А.В., Гриненко Н.Ф., Баклаушев В.П., Чумаков П.М., Чехонин В.П. Чувствительность клеток глиомы С6, несущих полиовирусный рецептор человека к онколитическим полиовирусам. Бюл. экспер. биол. 2016; 161(6): 780-4.
Трещалина Е.М. Методические рекомендации по доклиническому изучению противоопухолевой активности лекарственных средств. В кн.: Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К.; 2012; Ч. 1.: 642-57.
Европейская конвенция по защите позвоночных животных, используемых для экспериментальных и других научных целей, ЕЭС, Страсбург. 1985. Ланималогия. 1993; (1): 29.
Большаков О.П., Незнанов Н.Г., Бабаханян Р.В. Дидактические и этические аспекты проведения исследований на биомоделях и на лабораторных животных. ВОЗ. 2000. Рекомендации комитетам по этике, проводящим экспертизу биомедицинских исследований. Качественная клиническая практика. 2002; (9): 24-8.
Качественная клиническая практика. 2002; (9): 24-8.
вирусов Коксаки: история вопроса, патофизиология, эпидемиология
Лим Б.К., Цзюй Э.С., Лаосский Д.Х., Юн Ш., Ли Й.Дж., Ким Д.К. и др. Разработка системы диагностики энтеровирусов для диагностики вирусного миокардита у человека. Микробиол Иммунол . 2013 Апрель 57 (4): 281-7. [Медлайн].
Muehlenbachs A, Bhatnagar J, Zaki SR. Тканевый тропизм, патология и патогенез энтеровирусной инфекции. Дж. Патол . 2014 11 сентября [Medline].
Kadambari S, Bukasa A, Okike IO, Pebody R, Brown D, Gallimore C.Энтеровирусные инфекции в Англии и Уэльсе, 2000-2011 гг .: влияние расширенной молекулярной диагностики. Clin Microbiol Infect . 2014 г. 4 июля [Medline].
Хецуриани Н. , Ламонте А., Оберсте М.С. и др. Неонатальные энтеровирусные инфекции, зарегистрированные в национальной системе эпиднадзора за энтеровирусами в США, 1983–2003 гг. Pediatr Infect Dis J . 2006 25 октября (10): 889-93. [Медлайн].
, Ламонте А., Оберсте М.С. и др. Неонатальные энтеровирусные инфекции, зарегистрированные в национальной системе эпиднадзора за энтеровирусами в США, 1983–2003 гг. Pediatr Infect Dis J . 2006 25 октября (10): 889-93. [Медлайн].
Стюарт К.Л., Чу Е.Ю., Introcaso CE, Шаффер А., Джеймс В.Д.Заболевание рук и ног, вызванное вирусом Коксаки А6. JAMA Dermatol . 2013 декабрь 149 (12): 1419-21. [Медлайн].
Кинг Р.Л., Лорч С.А., Коэн Д.М. и др. Регулярное тестирование спинномозговой жидкости с энтеровирусной полимеразной цепной реакцией сокращает количество госпитализаций и использование антибиотиков у младенцев в возрасте 90 дней и младше. Педиатрия . 2007 Сентябрь 120 (3): 489-96. [Медлайн].
Шифф GM, Шервуд младший. Клиническая активность плеконарила при экспериментально индуцированной респираторной инфекции, вызванной вирусом Коксаки А21. J Заразить Dis . 2000 Январь 181 (1): 20-6. [Медлайн].
J Заразить Dis . 2000 Январь 181 (1): 20-6. [Медлайн].
Брунетти Л., ДеСантис ER. Лечение вирусного миокардита, вызванного вирусом Коксаки B. Am J Health Syst Pharm . 2008 15 января. 65 (2): 132-7. [Медлайн].
Юэ-Чун Л., ЛиШа Г., Цзян-Хуа Р., Пэн-Линь Ю., Цзя-Фэн Л., Цзи-Фей Т. и др. Защитные эффекты карведилола на мышиной модели с вирусным миокардитом, индуцированным вирусом Коксаки В3. J Cardiovas Pharmacol .Янв / 2008. 51: 92-98. [Медлайн].
Shi L, Xiong H, He J, et al. Противовирусная активность арбидола против вируса гриппа A, респираторно-синцитиального вируса, риновируса, вируса Коксаки и аденовируса in vitro и in vivo. Arch Virol . 2007. 152 (8): 1447-55. [Медлайн].
Ang LW, Koh BK, Chan KP, Chua LT, James L, Goh KT. Эпидемиология и борьба с болезнями рук, ящура и рта в Сингапуре, 2001-2007 гг. Ann Acad Med Singapore .2009 Февраль 38 (2): 106-12. [Медлайн].
Эпидемиология и борьба с болезнями рук, ящура и рта в Сингапуре, 2001-2007 гг. Ann Acad Med Singapore .2009 Февраль 38 (2): 106-12. [Медлайн].
Bergman I, Painter MJ, Wald ER, et al. Исход у детей с энтеровирусным менингитом первого года жизни. J Педиатр . 1987 май. 110 (5): 705-9. [Медлайн].
Берлин Л.Е., Рорабо М.Л., Хелдрих Ф. и др. Асептический менингит у детей младше 2 лет: диагностика и этиология. J Заразить Dis . 1993 Октябрь 168 (4): 888-92. [Медлайн].
Cheung CT, Deisher TA, Luo H, et al.Нейтрализующее лечение анти-4-1BBL улучшает сердечную функцию при вирусном миокардите. Лаб Инвест . 2007 Июль 87 (7): 651-61. [Медлайн].
Даган Р., Жениста Ж.А., Менегус М.А. Связь клинических проявлений, лабораторных данных и серотипов вируса с наличием менингита у госпитализированных младенцев с энтеровирусной инфекцией. J Педиатр . 1988 декабрь 113 (6): 975-8. [Медлайн].
J Педиатр . 1988 декабрь 113 (6): 975-8. [Медлайн].
Даган Р., Менегус Массачусетс. Комбинация четырех типов клеток для быстрого обнаружения энтеровирусов в клинических образцах. J Med Virol . 1986 июля 19 (3): 219-28. [Медлайн].
Дульбекко Р., Гинзберг Х. Вирусология . 2-е изд. 1988. 207-209.
Эпиднадзор за энтеровирусами — США, 2002-2004 гг. MMWR Morb Mortal Wkly Rep . 2006 17 февраля. 55 (6): 153-6. [Медлайн].
Джайдан Х., Хобер Д. Роль вируса Коксаки B4 в патогенезе диабета 1 типа. Метаб. Диабета . 2008, декабрь 34 (6, часть 1): 537-48.[Медлайн].
Джениста Дж. А., Пауэлл КР, Менегус Массачусетс. Эпидемиология неонатальной энтеровирусной инфекции. J Педиатр . 1984 Май. 104 (5): 685-90. [Медлайн].
J Педиатр . 1984 Май. 104 (5): 685-90. [Медлайн].
Левинсон В., Явец Э. Медицинская микробиология и иммунология: экспертиза и проверка совета . 6-е изд. Нью-Йорк, штат Нью-Йорк: McGraw Hill Text; 2000. 238-239.
Мао Ц., Ван И, Яо Х, Бянь Л., Ву Х, Сюй М. и др. Вирус Коксаки A16: эпидемиология, диагностика и вакцина. Hum Vaccin Immunother . 2014 10 февраля (2): 360-7. [Медлайн].
Modlin JF. Вирусы Коксаки, эховирусы, новые энтеровирусы и пареховирусы. Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета . 7-е изд. Филадельфия, Пенсильвания: Черчилль-Ливингстон; 2009. 2353-2365.
Мур М. Центры по контролю за заболеваниями. Энтеровирусное заболевание в США, 1970–1979 гг. J Заразить Dis . 1982 июл. 146 (1): 103-8. [Медлайн].
1982 июл. 146 (1): 103-8. [Медлайн].
Моренс Д.М., Палланш Массачусетс. Эпидемиология. Инфекции, вызванные энтеровирусами человека . 1995. 1:
Морган Н.Г., Ричардсон С.Дж. Энтеровирусы как возбудители диабета 1 типа: незавершенные дела или безнадежное дело ?. Trends Endocrinol Metab . 2014 28 августа. [Medline].
Палланш М.А., Андерсон Л.Дж. Вирус Коксаки, эховирус и другие энтеровирусы. Горбач С.Л., изд. Инфекционные болезни .2-е изд. Филадельфия, Пенсильвания: WB Saunders Co; 1998. 2164-2170.
Piqueur MA, Verstrepen WA, Bruynseels P, Mertens AH. Улучшение анализа RT-PCR в реальном времени для обнаружения РНК энтеровируса. Вирол J . 2009 г. 7 июля, 6:95. [Медлайн]. [Полный текст].
Richer MJ, Horwitz MS.Инфекция, вызванная вирусом Коксаки, как фактор окружающей среды в этиологии диабета 1 типа. Аутоиммунная Ред. . 2009 июн.8 (7): 611-5. [Медлайн].
Рорабо М.Л., Берлин Л.Е., Хелдрих Ф. и др. Асептический менингит у детей младше 2 лет: острые заболевания и неврологические осложнения. Педиатрия . 1993 августа 92 (2): 206-11. [Медлайн].
Rotbart HA. Терапия Плеконарилом потенциально опасных для жизни энтеровирусных инфекций. 36-е ежегодное собрание Американского общества инфекционистов . 1998.
Rotbart HA. Плеконарил для лечения энтеровирусных и риновирусных инфекций. Инфекция Мед . 2000. 17: 488.
Инфекция Мед . 2000. 17: 488.
Rotbart HA. Лечение пикорнавирусных инфекций. Противовирусное средство . 2002 Февраль 53 (2): 83-98. [Медлайн].
Rotbart HA, Ahmed A, Hickey S, et al. Диагностика энтеровирусной инфекции методом полимеразной цепной реакции на нескольких типах образцов. Pediatr Infect Dis J . 1997 г., 16 (4): 409-11. [Медлайн].
Rotbart HA, McCracken GH Jr, Whitley RJ и др. Клиническое значение энтеровирусов при тяжелых летних фебрильных заболеваниях детей. Pediatr Infect Dis J . 1999 18 октября (10): 869-74. [Медлайн].
Rotbart HA, Webster AD. Лечение потенциально опасных для жизни энтеровирусных инфекций с помощью плеконарила. Clin Infect Dis . 2001 15 января.32 (2): 228-35. [Медлайн].
Заутер П., Хобер Д. Механизмы и результаты антителозависимого усиления вирусных инфекций и роль в патогенезе заболеваний, вызванных вирусом Коксаки B. Микробы заражают . 2009 г., 11 (4): 443-51. [Медлайн].
Сойер М.Х., Голландия Д., Эйнтаблиан Н. и др. Диагностика энтеровирусной инфекции центральной нервной системы с помощью полимеразной цепной реакции во время крупной общественной вспышки. Pediatr Infect Dis J .1994 13 марта (3): 177-82. [Медлайн].
Тебрюгге М., Кертис Н. Энтеровирусные инфекции у новорожденных. Semin Fetal Neonatal Med . 2009 14 августа (4): 222-7. [Медлайн].
Ворошилова М.К., Чумаков М.П. Полиомиелитоподобные свойства вирусов AB-IV группы Коксаки A7. Прог Мед Вирол . 1959. 2: 106.
Йунг В.С., Роулинсон В.Д., Крейг М.Э. Энтеровирусная инфекция и сахарный диабет 1 типа: систематический обзор и метаанализ наблюдательных молекулярных исследований. BMJ . 3 февраля 2011. 342: 1-9. [Медлайн]. [Полный текст].
Teo FM, Chu JJ. Диагностика энтеровирусов человека, вызывающих заболевания рук, ягодиц и рта. Expert Rev Anti Infect Ther . 2016. 14 (5): 443-5.[Медлайн].
Луго Д., Крогстад П. Энтеровирусы в начале 21 века: новые проявления и проблемы. Curr Opin Pediatr . 2016 28 февраля (1): 107-13. [Медлайн].
Борсанёва М., Кубасчикова Л., Сармирова С., Вари С. Г., Бопегамейдж С. Оценка метода взятия мазков без транспортной среды вируса для ПЦР-диагностики инфекций, вызванных вирусом Коксаки. Дж. Вироловые методы . 2018 Апрель 254: 18-20. [Медлайн].
Эспозито С., Принципи Н. Заболевания рук, ящура: современные знания о клинических проявлениях, эпидемиологии, этиологии и профилактике. евро J Clin Microbiol Infect Dis . 2018 марта 37 (3): 391-398. [Медлайн].
Кокс Б., Левент Ф. Болезни рук, ног и рта. JAMA . 2018 декабря 18, 320 (23): 2492. [Медлайн].
Garmaroudi FS, Marchant D, Hendry R, Luo H, Yang D, Ye X и др. Репликация и патогенез вируса Коксаки В3. Микробиол будущего . 2015. 10 (4): 629-53. [Медлайн].
Репликация и патогенез вируса Коксаки В3. Микробиол будущего . 2015. 10 (4): 629-53. [Медлайн].
Харвала Х., Броберг Э., Беншоп К. и др. Рекомендации по диагностике и характеристике энтеровирусов в Европе и за ее пределами. Дж. Клин Вирол . 2018 Апрель 101: 11-17. [Медлайн].
Шабани А., Макванди М., Самарбафзаде А., Теймури А., Расти М., Карами С. и др. Инфекция эховирусом 30 и вирусом Коксаки A9 среди новорожденных с сепсисом в Иране. Иран Дж. Микробиол . 2018 10 августа (4): 258-265. [Медлайн].
Ван М., Рен Кью, Чжан З., Чжан Л., Карр М.Дж., Ли Дж. И др. Быстрое определение генотипов энтеровирусов ящура, кисты и рта с помощью мультиплексной ПЦР. Дж. Вироловые методы . 2018 25 августа 8. 7-12. [Медлайн].
CDC. Неполиомиелитный энтеровирус: вспышки и эпиднадзор. CDC. Доступно по адресу https://www.cdc.gov/non-polio-enterovirus/outbreaks-surveillance.html. 14 ноября 2018 г .; Доступ: 6 декабря 2019 г.
Неполиомиелитный энтеровирус: вспышки и эпиднадзор. CDC. Доступно по адресу https://www.cdc.gov/non-polio-enterovirus/outbreaks-surveillance.html. 14 ноября 2018 г .; Доступ: 6 декабря 2019 г.
CDC. Неполиомиелитный энтеровирус: для медицинских работников. CDC. Доступно по адресу https://www.cdc.gov/non-polio-enterovirus/hcp.html. 14 ноября 2018 г .; Дата обращения: 6 декабря 2019 г.
CDC. Острый вялый миелит: исследование AFM. CDC. Доступно по адресу https://www.cdc.gov/acute-flaccid-myelitis/afm-investigation.html. 4 ноября 2019 г .; Дата обращения: 6 декабря 2019 г.
The Pediatric Infectious Disease Journal
Заболевания рук, ящура (HFMD) обычно вызываются вирусом Коксаки (CoX) и часто встречаются у детей. 1 С 1998 г. мы наблюдаем летальные случаи энтеровирусной инфекции на Тайване, в основном связанной с энтеровирусом 71 (EV71) у младенцев. 2 Инфекция EV71 стала эндемическим заболеванием в этом регионе, с периодическими всплесками заболеваемости. На основании вспышки на Тайване в 1998 году инфекция CoX A16 обычно купируется самостоятельно без сопутствующего летального исхода. С 1960 года в литературе было зарегистрировано только два смертельных случая. 3, 4 Мы сообщаем здесь о смертельном случае инфекции CoX A16 у 15-месячного мальчика.
2 Инфекция EV71 стала эндемическим заболеванием в этом регионе, с периодическими всплесками заболеваемости. На основании вспышки на Тайване в 1998 году инфекция CoX A16 обычно купируется самостоятельно без сопутствующего летального исхода. С 1960 года в литературе было зарегистрировано только два смертельных случая. 3, 4 Мы сообщаем здесь о смертельном случае инфекции CoX A16 у 15-месячного мальчика.
Отчет о болезни.
15-месячный мальчик был госпитализирован в госпиталь Тайваньского национального университета с приступами шока. Периодическая высокая температура, связанная с недостаточным пероральным приемом пищи, наблюдалась в течение 3 дней. На второй день местный врач заметил множество мелких язв и пузырьков на задней стенке глотки. Между тем на его руках, ногах и ягодицах были обнаружены небольшие пузырьки. Его врач диагностировал болезнь рук, ящура и рта и прописал симптоматические лекарства.Тем не менее плохая активность, аппетит и лихорадка сохранялись. На третьи сутки болезни отмечены внезапная потеря сознания, пристальное внимание и тонические судороги. При поступлении наблюдались слабый пульс, цианоз губ. Он был интубирован и переведен в наше детское отделение интенсивной терапии для дальнейшего лечения.
На третьи сутки болезни отмечены внезапная потеря сознания, пристальное внимание и тонические судороги. При поступлении наблюдались слабый пульс, цианоз губ. Он был интубирован и переведен в наше детское отделение интенсивной терапии для дальнейшего лечения.
При поступлении пульс 187 уд / мин, артериальное давление 64/32 мм рт. Уровень его сознания постепенно ухудшался. Слышны мелкие хрипы и хрипы в основании обоих легких.Его печень и селезенка не пальпируются.
Стандартные лабораторные исследования были нормальными, включая: уровень натрия в сыворотке 132 ммоль / л; калий 5,09 ммоль / л; хлорид, 104 ммоль / л; и нормальный анализ мочи, за исключением того, что белок в моче составлял 100 мг / дл; сахар в моче — 0,25 г / дл. Отклонения от нормы в анализах крови представляли собой повышенное количество лейкоцитов до 21 540 / мкл с полосовыми клетками 8%, сегментными клетками 40% и лимфоцитами 48%. Уровень глюкозы в крови составил 390 мг / дл. Исходная креатинкиназа составляла 183 ед / л; креатинкиназа-миокардиальная связка — 34. 5 ед / л и тропонин-I был 16,2 нг / мл. Слабая сократимость сердца была обнаружена при эхографии сердца. Заподозрено тяжелый миокардит. Люмбальная пункция показала плеоцитоз. Количество клеток спинномозговой жидкости составило 158, а количество лимфоцитов / нейтрофилов — 111/47. Его кровь и посевы спинномозговой жидкости были стерильными. Рентгенограмма грудной клетки показала пограничную кардиомегалию с перихилярным застоем легочных полей.
5 ед / л и тропонин-I был 16,2 нг / мл. Слабая сократимость сердца была обнаружена при эхографии сердца. Заподозрено тяжелый миокардит. Люмбальная пункция показала плеоцитоз. Количество клеток спинномозговой жидкости составило 158, а количество лимфоцитов / нейтрофилов — 111/47. Его кровь и посевы спинномозговой жидкости были стерильными. Рентгенограмма грудной клетки показала пограничную кардиомегалию с перихилярным застоем легочных полей.
Ему давали инотропные агенты (дофамин, добутамин, норадреналин, адреналин) и часто вводили жидкости, но его артериальное давление оставалось низким (среднее артериальное давление ~ 40 мм рт.ст.) и не реагировало на эти лекарства.Последующие рентгенограммы грудной клетки показали прогрессирующую кардиомегалию и застой в полях легких. На четвертый день болезни ребенку была проведена экстракорпоральная мембранная оксигенация. Иммуноглобулин внутривенно вводили в течение 2 дней (1 г / кг / день). Отмечено прогрессирующее расширение зрачков и олигурия. Он умер на шестой день болезни.
Он умер на шестой день болезни.
Культуры вируса из горла и прямой кишки дали энтеровирус. Этот штамм был подтвержден как вирус Коксаки А16 флуоресценцией моноклональных антител и стандартным тестом нейтрализации. 5
Обсуждение.
HFMD — распространенное заболевание у детей и может быть связано с вирусами Коксаки A16, A5, A9, A10, B2, B5 и энтеровирусом 71. 1, 6–12 CoX A16 — часто встречающийся патоген в случаях HFMD, и его клиническое течение обычно протекает без осложнений, с полным выздоровлением. 6 Большинство случаев заболевания происходит летом и осенью, а инкубационный период составляет от 4 до 6 дней. Инфекция очень заразна. 13 Литературный поиск выявил только два смертельных случая у младенцев с 1963 года. 3, 4
В 1963 г. Райт и др. 3 представили смертельный случай 10-месячной девочки с респираторной инфекцией, завершившейся тяжелой сердечной недостаточностью. CoX A16 был изолирован из кишечника, но не из миокарда. Тяжелый воспалительный процесс в миокарде был зарегистрирован на микроскопических срезах при вскрытии. Второй случай произошел с 7-месячным мальчиком с хрюканьем и язвами на языке. 4 Пациент умер через 4 дня после появления клинических проявлений раздражительности, респираторной недостаточности, тахикардии, цианоза и судорог.Макропатология предполагала энцефалит и миокардит, и CoX A16 был выделен из миокарда, крови и содержимого кишечника.
CoX A16 был изолирован из кишечника, но не из миокарда. Тяжелый воспалительный процесс в миокарде был зарегистрирован на микроскопических срезах при вскрытии. Второй случай произошел с 7-месячным мальчиком с хрюканьем и язвами на языке. 4 Пациент умер через 4 дня после появления клинических проявлений раздражительности, респираторной недостаточности, тахикардии, цианоза и судорог.Макропатология предполагала энцефалит и миокардит, и CoX A16 был выделен из миокарда, крови и содержимого кишечника.
Клинические проявления фатальной инфекции CoX A 16, наблюдаемые у нашего пациента и двух случаев из медицинской литературы, аналогичны таковым для инфекции Коксаки Вируса B, 14 , встречающейся в основном у новорожденных. Летальные случаи инфицирования вирусом Коксаки А у младенцев случаются редко.
После вспышки на Тайване в 1998 г. EV71 был единственным наиболее заметным патогеном, связанным с тяжелой заболеваемостью или смертностью. 2 Среди изолятов энтеровируса EV 71 и CoX A16 были двумя наиболее распространенными в то время, и они были связаны с аналогичными симптомами и признаками. 15 Однако болезнь EV71 была более тяжелой и имела серьезные осложнения, включая смерть, тогда как инфекция CoX A16 купировалась самостоятельно. 1, 15
15 Однако болезнь EV71 была более тяжелой и имела серьезные осложнения, включая смерть, тогда как инфекция CoX A16 купировалась самостоятельно. 1, 15
Миокардит, вызываемый вирусом Коксаки группы B, установлен. 16 С 1954 года вирусы Коксаки группы A, такие как A1, A4 и A9, были связаны с миокардитом. 17–19 эховирус, вирус Коксаки группы B и CoX A16, как сообщается, вызывают летальные исходы в неонатальном периоде. 20 Большинство инфекций, вызываемых ЦОГ A16, неосложнены или связаны только с асептическим менингитом. 9 Наш случай был представлен как фульминантный миокардит с трудноизлечимым шоком, редкое заболевание. Возможной причиной смерти нашего пациента стала недостаточность миокарда.
1. Chang LY, Lin TY, Hsu KH, et al. Клинические особенности и факторы риска отека легких после энтеровируса-71 заболевания рук, ног и рта.Lancet 1999; 353: 1682–6. 2. CDC. Смертность среди детей: вспышка болезней рук, ягодиц и рта: Тайвань, Китайская Республика, апрель – июль 1998 г. MMWR 1998; 47: 629–32.
3. Райт Х. Т., Посадка Б. Х., Леннетт Е. Х., Макалистер Р. М.. Смертельная инфекция у младенца, связанная с вирусом Коксаки группы A, тип 16. N Engl J Med 1963; 268: 1041–4.
4. Голдберг MF, McAdams AJ. Миокардит, возможно, вызванный вирусом Коксаки группы А, тип 16. J Pediatr 1963; 62: 762–5.5. Черри Д.Д., Ян К.Л. Синдром кисти, стопы и рта: отчет о шести случаях, вызванных вирусом Коксаки, группа А, тип 16. Педиатрия, 1966; 37: 637–43.
6. Барлин Л., Аврам Г., Павлов Е., Котор Ф. Расследование пяти случаев везикулярного энтеровирусного стоматита с экзантемой, вызванной вирусом Коксаки A5. Преподобный Рум Вирол 1994; 45: 3–9.
7. Foreschle JE, Nahmias AJ, Feorino PM, McCord G, Naib Z. Болезнь рук, ящура и рта (вирус Коксаки A16) в Атланте.Am J Dis Child 1967; 114: 278–83.
8. Бейкер Д.А., Филипс Калифорния. Смертельная болезнь рук и ягодиц у взрослого, вызываемая вирусом Коксаки A7. JAMA 1979; 242: 1065.
MMWR 1998; 47: 629–32.
3. Райт Х. Т., Посадка Б. Х., Леннетт Е. Х., Макалистер Р. М.. Смертельная инфекция у младенца, связанная с вирусом Коксаки группы A, тип 16. N Engl J Med 1963; 268: 1041–4.
4. Голдберг MF, McAdams AJ. Миокардит, возможно, вызванный вирусом Коксаки группы А, тип 16. J Pediatr 1963; 62: 762–5.5. Черри Д.Д., Ян К.Л. Синдром кисти, стопы и рта: отчет о шести случаях, вызванных вирусом Коксаки, группа А, тип 16. Педиатрия, 1966; 37: 637–43.
6. Барлин Л., Аврам Г., Павлов Е., Котор Ф. Расследование пяти случаев везикулярного энтеровирусного стоматита с экзантемой, вызванной вирусом Коксаки A5. Преподобный Рум Вирол 1994; 45: 3–9.
7. Foreschle JE, Nahmias AJ, Feorino PM, McCord G, Naib Z. Болезнь рук, ящура и рта (вирус Коксаки A16) в Атланте.Am J Dis Child 1967; 114: 278–83.
8. Бейкер Д.А., Филипс Калифорния. Смертельная болезнь рук и ягодиц у взрослого, вызываемая вирусом Коксаки A7. JAMA 1979; 242: 1065. 9. Hugghes RO, Robers C. Заболевания рук, ног и рта, связанные с вирусом Коксаки A9. Lancet 1972; 2: 751–2.
10. Итагаки А., Исихара Дж., Мочида К. и др. Кластерная вспышка болезни рук, ног и рта, вызванная вирусом Коксаки A10. Microbiol Immunol 1983; 27: 929–35.
11.Филипс, Калифорния, Аронсон, доктор медицины, Томкоу Дж, Филипс, штат Мэн. Энтеровирусы в Вермонте, 1969–1978: важная причина болезней в течение года. J Infect Dis 1980; 141: 162–4.
12. Ишимару Ю., Накано С., Ямаока К., Таками С. Вспышки заболеваний рук, ног и рта, вызванные энтеровирусом 71: высокая частота осложнений со стороны центральной нервной системы. Arch Dis Child 1980; 55: 583–8.
13. Черри Дж. Д., Нельсон Д.Б. Энтеровирусные инфекции: их эпидемиология и патогенез. Clin Pediatr 1966; 5: 659–64.14. Суссман М.Л., Штраус Л., Ходес Х.Л. Смертельная инфекция вируса Коксаки группы B у новорожденного: отчет о случае с результатами вскрытия трупа и краткий обзор литературы.
9. Hugghes RO, Robers C. Заболевания рук, ног и рта, связанные с вирусом Коксаки A9. Lancet 1972; 2: 751–2.
10. Итагаки А., Исихара Дж., Мочида К. и др. Кластерная вспышка болезни рук, ног и рта, вызванная вирусом Коксаки A10. Microbiol Immunol 1983; 27: 929–35.
11.Филипс, Калифорния, Аронсон, доктор медицины, Томкоу Дж, Филипс, штат Мэн. Энтеровирусы в Вермонте, 1969–1978: важная причина болезней в течение года. J Infect Dis 1980; 141: 162–4.
12. Ишимару Ю., Накано С., Ямаока К., Таками С. Вспышки заболеваний рук, ног и рта, вызванные энтеровирусом 71: высокая частота осложнений со стороны центральной нервной системы. Arch Dis Child 1980; 55: 583–8.
13. Черри Дж. Д., Нельсон Д.Б. Энтеровирусные инфекции: их эпидемиология и патогенез. Clin Pediatr 1966; 5: 659–64.14. Суссман М.Л., Штраус Л., Ходес Х.Л. Смертельная инфекция вируса Коксаки группы B у новорожденного: отчет о случае с результатами вскрытия трупа и краткий обзор литературы. J Dis Child 1959; 97: 483–92.
15. Chang LY, Lin TY, Huang YC, et al. Сравнение энтеровируса 71 и вируса Коксаки A16: клиническое заболевание во время тайваньской эпидемии энтеровируса, 1998 г. Pediatr Infect Dis J 1999; 18: 1092–6.
16. Берч Г.Е., Сан С.К., Чу К. и др. Интерстициальный миокардит и миокардит, вызванный вирусом Коксаки B, у младенцев и детей.JAMA 1968; 203: 1–8.
17. Хосиер Д.М., Ньютон В.А. Тяжелая инфекция Коксаки у младенцев и детей. AMA J Dis Child 1958; 96: 251–7.
18. Мовитт Э. Р., Леннетт Э. Х., Мангам Дж. Ф., Берк М., Боуман М. С.. Острый доброкачественный перикардит: отчет о двух случаях, связанных с вирусами Коксаки группы A и группы B. N Engl J Med 1958; 258: 1082–6.
19. Голд Э, Карвер Д.Х., Хенеберг Х., Адельсон Л., Роббинс ФК. Вирусная инфекция: возможная причина внезапной неожиданной смерти младенцев.N Engl J Med 1961; 264: 53–60.
20. Регитт Т.Г., Сутхолл Г.М., Кинг А., Ганди Г.
J Dis Child 1959; 97: 483–92.
15. Chang LY, Lin TY, Huang YC, et al. Сравнение энтеровируса 71 и вируса Коксаки A16: клиническое заболевание во время тайваньской эпидемии энтеровируса, 1998 г. Pediatr Infect Dis J 1999; 18: 1092–6.
16. Берч Г.Е., Сан С.К., Чу К. и др. Интерстициальный миокардит и миокардит, вызванный вирусом Коксаки B, у младенцев и детей.JAMA 1968; 203: 1–8.
17. Хосиер Д.М., Ньютон В.А. Тяжелая инфекция Коксаки у младенцев и детей. AMA J Dis Child 1958; 96: 251–7.
18. Мовитт Э. Р., Леннетт Э. Х., Мангам Дж. Ф., Берк М., Боуман М. С.. Острый доброкачественный перикардит: отчет о двух случаях, связанных с вирусами Коксаки группы A и группы B. N Engl J Med 1958; 258: 1082–6.
19. Голд Э, Карвер Д.Х., Хенеберг Х., Адельсон Л., Роббинс ФК. Вирусная инфекция: возможная причина внезапной неожиданной смерти младенцев.N Engl J Med 1961; 264: 53–60.
20. Регитт Т.Г., Сутхолл Г.М., Кинг А., Ганди Г. М. Смертельная инфекция эховирусом 7 во время вспышки в детском отделении особого ухода. J Infect 1989; 19: 229–36.
М. Смертельная инфекция эховирусом 7 во время вспышки в детском отделении особого ухода. J Infect 1989; 19: 229–36.Совместная циркуляция вирусов Коксаки A-6, A-10 и A-16 вызывает заболевание рук, ног и рта в городе Гуанчжоу, Китай | BMC Infectious Diseases
Li XW, Ni X, Qian SY, Wang Q, Jiang RM, Xu WB, Zhang YC, Yu GJ, Chen Q, Shang YX, et al. Китайское руководство по диагностике и лечению заболеваний рук, ящура и рта (издание 2018 г.).Мир J Pediatr. 2018; 14 (5): 437–47.
PubMed Статья Google Scholar
Эспозито С., Принципи Н. Болезни рук, ящура: современные знания о клинических проявлениях, эпидемиологии, этиологии и профилактике. Eur J Clin Microbiol Infect Dis. 2018; 37 (3): 391–8.
PubMed Статья Google Scholar
Xing W, Liao Q, Viboud C, Zhang J, Sun J, Wu JT, Chang Z, Liu F, Fang VJ, Zheng Y и др. Болезни рук, ягодиц и рта в Китае, 2008–2012 гг.: Эпидемиологическое исследование. Lancet Infect Dis. 2014; 14 (4): 308–18.
Болезни рук, ягодиц и рта в Китае, 2008–2012 гг.: Эпидемиологическое исследование. Lancet Infect Dis. 2014; 14 (4): 308–18.
PubMed PubMed Central Статья Google Scholar
Ooi MH, Wong SC, Lewthwaite P, Cardosa MJ, Solomon T. Клинические особенности, диагностика и лечение энтеровируса 71. Lancet Neurol. 2010. 9 (11): 1097–105.
PubMed Статья Google Scholar
Чанг Ю.К., Чен К.Х., Чен К.Т. Заболевания рук, ящура и герпангина, вызванные инфекциями энтеровируса A71: обзор молекулярной эпидемиологии энтеровируса A71, патогенеза и текущей разработки вакцины. Rev Inst Med Trop Сан-Паулу. 2018; 60: e70.
PubMed PubMed Central Статья CAS Google Scholar
Насри Д., Буслама Л., Пилле С., Бурле Т., Ауни М., Поццетто Б. Основное обоснование, современные методы и будущие направления молекулярного типирования энтеровируса человека. Эксперт Rev Mol Diagn. 2007. 7 (4): 419–34.
Эксперт Rev Mol Diagn. 2007. 7 (4): 419–34.
CAS PubMed Статья Google Scholar
Xie BY, Xu C, Xiong Q, Zhu M, Duan H, Wang YY, Zhang H, Ni XF, Wang LH, Li XW и др. Секвенирование генов и анализ вариабельных сайтов кодирующей области двух изолятов энтеровируса A71 с различными клиническими фенотипами. Заразить Genet Evol. 2016; 45: 83–9.
CAS PubMed Статья Google Scholar
Соломон Т., Льютуэйт П., Перера Д., Кардоса М.Дж., Макминн П., Оои М.Х. Вирусология, эпидемиология, патогенез и борьба с энтеровирусом 71. Lancet Infect Dis. 2010. 10 (11): 778–90.
PubMed Статья Google Scholar
Олсеп Дж., Флюетт Т.Х., Фостер Дж. Р. «Болезнь рук, ящура» в Бирмингеме в 1959 году. BMJ. 1960; 2 (5214): 1708–11.
CAS PubMed Статья Google Scholar

Hoang MTV, Nguyen TA, Tran TT, Vu TTH, Le NTN, Nguyen THN, Le THN, Nguyen TTH, Nguyen TH, Le NTN и др. Клинико-этиологическое исследование болезней рук, ящура и рта на юге Вьетнама, 2013-2015 гг. : Стационарные и амбулаторные пациенты. Int J Infect Dis. 2019; 80: 1–9.
PubMed PubMed Central Статья Google Scholar
Tan X, Li L, Zhang B, Jorba J, Su X, Ji T, Yang D, Lv L, Li J, Xu W. Молекулярная эпидемиология вируса Коксаки A6, связанного со вспышками на кистях, стопах и болезнь рта в Тяньцзине, Китай, в 2013 году.Arch Virol. 2015; 160 (4): 1097–104.
CAS PubMed PubMed Central Статья Google Scholar
Бянь Л., Ван И, Яо Х, Мао К., Сюй М., Лян З. Вирус Коксаки А6: новый появляющийся патоген, вызывающий вспышки болезней рук, ящура и рта во всем мире. Эксперт Rev Anti-Infect Ther. 2015; 13 (9): 1061–71.
CAS PubMed Статья Google Scholar

Chan LG, Parashar UD, Lye MS, Ong FGL, Zaki SR, Alexander JP, Ho KK, Han LL, Pallansch MA, Suleiman AB, et al. Смерть детей во время вспышки болезней рук, ног и рта в Сараваке, Малайзия: клинические и патологические характеристики болезни. Clin Infect Dis. 2000. 31 (3): 678–83.
CAS PubMed Статья Google Scholar
Пуэнпа Дж., Чиочансин Т., Линсуванон П., Корконг С., Тонгкомплеу С., Вичайваттана П., Theamboonlers А., Поовораван Ю.Заболевания рук, ног и рта, вызываемые вирусом Коксаки A6, Таиланд, 2012 г. Emerg Infect Dis. 2013. 19 (4): 641–3.
PubMed PubMed Central Статья Google Scholar
Фудзимото Т., Чикахира М., Йошида С., Эбира Х., Хасегава А., Тоцука А., Нисио О. Вспышка заболевания центральной нервной системы, связанного с болезнью рук, ног и рта, в Японии летом 2000 г .: обнаружение и молекулярная эпидемиология энтеровируса 71. Microbiol Immunol. 2002. 46 (9): 621–7.
Microbiol Immunol. 2002. 46 (9): 621–7.
CAS PubMed Статья Google Scholar
Ганоркар Н.Н., Патил П.Р., Тикуте С.С., Гопалкришна В. Генетическая характеристика штаммов энтеровирусов, выявленных при болезни рук, ящура (HFMD): появление субгенотипов B1c, C1, подлиния E2 CVA16, EV71 и CVA6 штаммы в Индии. Заразить Genet Evol. 2017; 54: 192–9.
CAS PubMed Статья Google Scholar
Zhang Y, Zhu Z, Yang W, Ren J, Tan X, Wang Y, Mao N, Xu S, Zhu S, Cui A, et al. Возникающий рекомбинантный энтеровирус человека 71 стал причиной вспышки ящура рук в 2008 году в городе Фуян в Китае. Вирол Дж. 2010; 7: 94.
PubMed PubMed Central Статья CAS Google Scholar
Zhang Y, Tan X-J, Wang H-Y, Yan D-M, Zhu S-L, Wang D-Y, Ji F, Wang X-J, Gao Y-J, Chen L, et al. Вспышка заболевания рук, ног и рта, связанного с субгенотипом C4 энтеровируса человека 71, в Шаньдуне, Китай. J Clin Virol. 2009. 44 (4): 262–7.
J Clin Virol. 2009. 44 (4): 262–7.
PubMed Статья Google Scholar
Бломквист С., Клемола П., Кайялайнен С., Паананен А., Симонен М.Л., Вуоринен Т., Ройвайнен М. Совместная циркуляция вирусов Коксаки А6 и А10 при вспышке болезни рук, ящура в Финляндии. J Clin Virol. 2010. 48 (1): 49–54.
CAS PubMed Статья Google Scholar
Миранд А., Хенкель С., Арчимбо С., Угетто С., Антона Д., Байи Д.Л., Пиг-Лафей Х.Вспышка болезни рук, ящура / герпангины, связанной с инфекциями вируса Коксаки A6 и A10, в 2010 г., Франция: крупное общегородское проспективное обсервационное исследование. Clin Microbiol Infect. 2012; 18 (5): E110–8.
CAS PubMed Статья Google Scholar
Fonseca MC, Sarmiento L, Resik S, Martínez Y, Hung LH, Morier L, Piñón A, Valdéz O, Kourí V, González G. Коксакивирус A6 и энтеровирус 71 вызывают заболевания рук, ящура на Кубе , 2011–2013 гг. Arch Virol. 2014. 159 (9): 2451–5.
Arch Virol. 2014. 159 (9): 2451–5.
CAS PubMed Статья Google Scholar
Ян X, Ли Y, Zhang C, Zhan W, Xie J, Hu S, Chai H, Liu P, Zhao H, Tang B и др. Клинические особенности и филогенетический анализ тяжелой формы ящура, вызываемой вирусом Коксаки A6. Заразить Genet Evol. 2020; 77: 104054.
CAS PubMed Статья Google Scholar
Chen M, He S, Yan Q, Xu X, Wu W, Ge S, Zhang S, Chen M, Xia N. Тяжелая болезнь рук, ящура, связанная с инфекциями, вызванными вирусом Коксаки A10, в Сямыне, Китай, в 2015 году. J Clin Virol . 2017; 93: 20–4.
PubMed Статья Google Scholar
Bian L, Gao F, Mao Q, Sun S, Wu X, Liu S, Yang X, Liang Z. Заболевания рук, ног и рта, связанные с вирусом Коксаки A10: более серьезные, чем кажется. Эксперт Rev Anti-Infect Ther.2019; 17 (4): 233–42.
CAS PubMed Статья Google Scholar
Ди Б, Чжан И, Се Х, Ли Х, Чен С, Дин П, Хэ П, Ван Д, Гэн Дж, Луо Л. и др. Циркуляция вируса Коксаки А6 при болезни рук и ног в Гуанчжоу, 2010-2012 гг. Вирол Дж. 2014; 11: 157.
PubMed PubMed Central Статья Google Scholar
Zou XN, Zhang XZ, Wang B, Qiu YT.Этиологический и эпидемиологический анализ заболеваний рук, ног и рта в городе Гуанчжоу: обзор 4753 случаев. Braz J Infect Dis. 2012. 16 (5): 457–65.
PubMed Статья Google Scholar
Цзэн Х., Лу Дж., Ян Ф, Лю Л., Чжэн Х., Ке Ц., Сун Т., Ли Х, Сунь Л., HSG провинции Гуандун. Растущая эпидемия болезней рук, ягодиц и рта, вызванная вирусом Коксаки-A6, Гуандун, Китай, 2017. J Inf Secur. 2018; 76 (2): 220–3.
Google Scholar
Hess AS, Hess JR. Понимание тестов ассоциации категориальных переменных: критерий хи-квадрат Пирсона и точный критерий Фишера. Переливание. 2017; 57 (4): 877–9.
PubMed Статья Google Scholar
Скин С.С., Банс К., Фримантл Н., Доре С.Дж., офтальмологическая статистика Г. Примечание 9: параметрические и непараметрические методы анализа данных.Br J Ophthalmol. 2016; 100 (7): 877–8.
PubMed Статья Google Scholar
Лю X-F, Sun X-M, Sun X-W, Yang Y-Q, Huang C-H, Wen H. Эпидемиологическое исследование болезней рук, ящура в районе Тунчжоу, Пекин, 2013-2017 гг. J Int Med Res. 2019; 47 (6): 2615–25.
PubMed PubMed Central Статья Google Scholar
Nix WA, Oberste MS, Pallansch MA.Чувствительная, семенная ПЦР-амплификация последовательностей VP1 для прямой идентификации всех серотипов энтеровирусов из исходных клинических образцов. J Clin Microbiol. 2006. 44 (8): 2698–704.
J Clin Microbiol. 2006. 44 (8): 2698–704.
CAS PubMed PubMed Central Статья Google Scholar
Ji H, Fan H, Lu PX, Zhang XF, Ai J, Shi C, Huo X, Bao CJ, Shan J, Jin Y. Наблюдение за тяжелыми заболеваниями рук, ног и рта с 2009 по 2015 годы в провинции Цзянсу: эпидемиология, этиология и бремя болезней.BMC Infect Dis. 2019; 19 (1): 79.
PubMed PubMed Central Статья CAS Google Scholar
Ларкин М.А., Блэкшилдс Г., Браун Н.П., Ченна Р., МакГеттиган П.А., МакВильям Х., Валентин Ф., Уоллес И.М., Вильм А., Лопес Р. и др. Clustal W и clustal X версии 2.0. Биоинформатика. 2007. 23 (21): 2947–8.
CAS Статья Google Scholar
Тамура К., Петерсон Д., Петерсон Н., Стечер Г., Ней М., Кумар С.MEGA5: анализ молекулярной эволюционной генетики с использованием методов максимального правдоподобия, эволюционного расстояния и максимальной экономии. Mol Biol Evol. 2011; 28 (10): 2731–9.
Mol Biol Evol. 2011; 28 (10): 2731–9.
CAS PubMed PubMed Central Статья Google Scholar
Munivenkatappa A, Yadav PD, Nyayanit DA, Majumdar TD, Sangal L, Jain S, Sinha DP, Shrivastava A, Mourya DT. Молекулярное разнообразие вируса Коксаки А10, циркулирующего в южном и северном регионах Индии [2009-17].Заразить Genet Evol. 2018; 66: 101–10.
CAS PubMed Статья Google Scholar
He SJ, Han JF, Ding XX, Wang YD, Qin CF. Характеристика энтеровируса 71 и вируса Коксаки A16, выделенных у пациентов с заболеваниями рук, ног и рта в Гуандуне, 2010 г. Int J Infect Dis. 2013; 17 (11): e1025–30.
PubMed Статья Google Scholar
Лю В., Ву С, Сюн Й, Ли Т., Вэнь З., Янь М, Цинь К., Лю И, Ву Дж.Совместная циркуляция и геномная рекомбинация вируса Коксаки A16 и энтеровируса 71 во время крупной вспышки болезни рук, ног и рта в Центральном Китае. PLoS One. 2014; 9 (4): e96051.
PLoS One. 2014; 9 (4): e96051.
PubMed PubMed Central Статья CAS Google Scholar
Хо М., Чен Э.Р., Сюй К.Х., Тву С.Дж., Чен К.Т., Цай С.Ф., Ван Дж.Р., Ши С.Р. Эпидемия энтеровирусной 71 инфекции на Тайване. Тайваньская рабочая группа по эпидемии энтеровируса. NEJM.1999; 341 (13): 929.
CAS PubMed Статья PubMed Central Google Scholar
Вен Й, Чен В., Хуанг М., Хе В., Чжэн К., Янь Ю. Эпидемиология и этиология заболеваний рук, ног и рта в провинции Фуцзянь, 2008-2014 гг. Arch Virol. 2017; 162 (2): 535–42.
CAS PubMed Статья Google Scholar
Takahashi S, Liao Q, Van Boeckel TP, Xing W, Sun J, Hsiao VY, Metcalf CJ, Chang Z, Liu F, Zhang J, et al.Болезни рук, ящура и рта в Китае: моделирование эпидемической динамики серотипов энтеровирусов и последствия для вакцинации. PLoS Med. 2016; 13 (2): e1001958.
PLoS Med. 2016; 13 (2): e1001958.
PubMed PubMed Central Статья Google Scholar
Fu X, Wan Z, Li Y, Hu Y, Jin X, Zhang C. Национальная эпидемиология и история эволюции четырех энтеровирусов, связанных с заболеваниями рук, ящура и рта, в Китае с 2008 по 2016 годы. Virol Sin. 2019; 35 (1): 21–33.
PubMed Статья CAS Google Scholar
Zhu F, Xu W, Xia J, Liang Z, Liu Y, Zhang X, Tan X, Wang L, Mao Q, Wu J и др. Эффективность, безопасность и иммуногенность вакцины против энтеровируса 71 в Китае. N Engl J Med. 2014. 370 (9): 818–28.
CAS PubMed Статья Google Scholar
Гарон Дж. Р., Оренштейн, Вашингтон. Мировой переход на вакцины против полиомиелита для плановой иммунизации.Ланцет. 2015; 386 (10011): 2375–7.
PubMed Статья Google Scholar
Лю Й, Ван Дж., Лю С., Ду Дж, Ван Л., Гу В, Сюй И, Цзо С., Сюй Э, Ань З. Внедрение инактивированной полиовирусной вакцины, ведущее к завершающему стратегическому плану ликвидации полиомиелита; Ханчжоу, Китай, 2010-2014 гг. Вакцина. 2017; 35 (9): 1281–6.
PubMed Статья Google Scholar
Цю Дж., Ян Й, Хуанг Л., Ван Л., Цзян Цз., Гун Дж., Ван В., Ван Х, Го С., Ли К. и др.Оценка иммуногенности и безопасности бивалентной пероральной полиовакцины типа 1 и 3 путем сравнения различных схем вакцинации против полиомиелита в Китае: рандомизированное контролируемое клиническое испытание не меньшей эффективности. Hum Vaccin Immunother. 2017; 13 (6): 1–10.
PubMed Статья Google Scholar
Peng Q, Xie M, Zhang Y, Liu Q, Li W, Li S, Ma Q, Lu X, Zhong B. Молекулярная эпидемиология энтеровирусов, связанных с болезнью рук, ящура и ротовой полости / герпангиной в Дунгуане , Китай, 2015.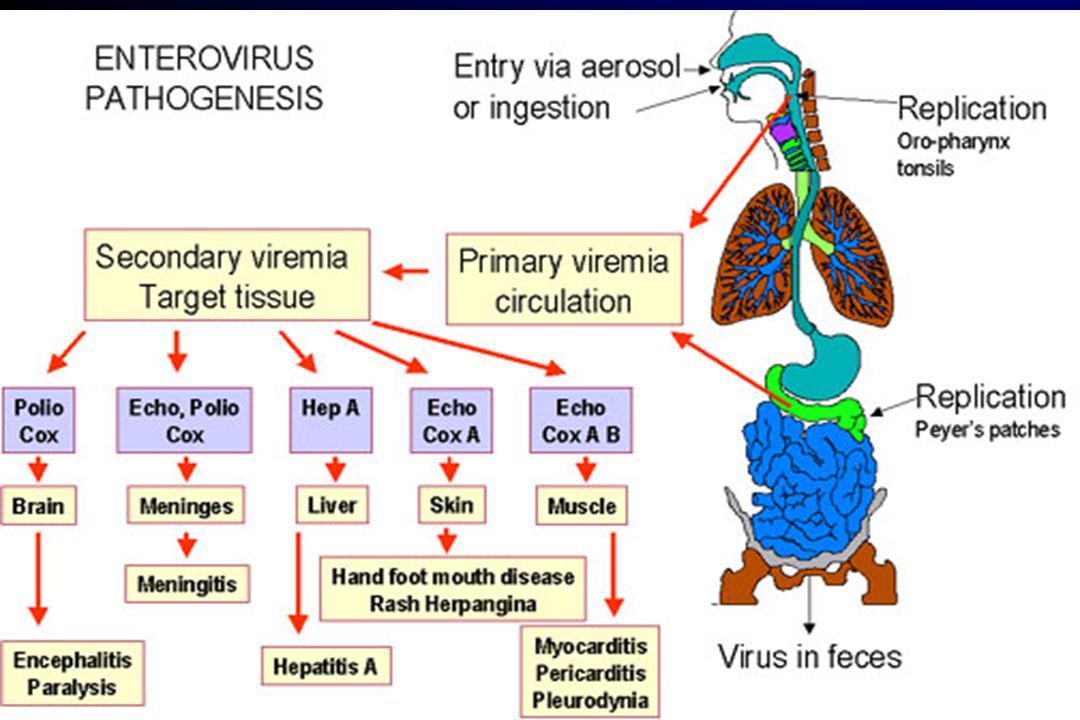 Arch Virol. 2016; 161 (12): 3463–71.
Arch Virol. 2016; 161 (12): 3463–71.
CAS PubMed Статья Google Scholar
Lim H, In HJ, Lee JA, Sik Yoo J, Lee SW, Chung GT, Choi YK, Chung JK, Cho SJ, Lee JW. Иммуногенность и защитный эффект инактивированной вакцины против вируса Коксаки А6, А10 и А16 против болезней рук, ног и рта. Вакцина. 2018; 36 (24): 3445–52.
CAS PubMed Статья Google Scholar
Хуан В.С., Хуанг Л.М., Као Ц.Л., Лу ЦИ, Шао П.Л., Ченг А.Л., Фан Т.Ю., Чи Х., Чанг Л.Й. Распространенность энтеровируса 71 и отсутствие доказательств перекрестной защиты антител энтеровируса 71 против других энтеровирусов у детей детского сада в городе Тайбэй. J Microbiol Immunol Infect. 2012. 45 (2): 96–101.
CAS PubMed Статья Google Scholar
Упала П., Апидечкул Т., Суттана В., Куллавонг Н., Таморнпарк Р. , Инта С. Молекулярная эпидемиология и клинические особенности заболеваний рук, ящура и рта в северном Таиланде в 2016 году: проспективное когортное исследование.BMC Infect Dis. 2018; 18 (1): 630.
, Инта С. Молекулярная эпидемиология и клинические особенности заболеваний рук, ящура и рта в северном Таиланде в 2016 году: проспективное когортное исследование.BMC Infect Dis. 2018; 18 (1): 630.
PubMed PubMed Central Статья Google Scholar
Чжан Дж., Сун Дж., Чанг З., Чжан В., Ван З., Фэн З. Характеристика заболеваний рук, стоп и рта в Китае в период с 2008 по 2009 гг. Biomed Environ Sci. 2011; 24 (3): 214–21.
PubMed Google Scholar
Ли Т., Янг З., Ди Б., Ван М. Ящер и ротовая полость рук и погодные факторы в Гуанчжоу, южный Китай.Эпидемиол Инфекция. 2014. 142 (8): 1741–50.
CAS PubMed Статья Google Scholar
Ван Дж., Тэн З., Цуй Х, Ли Ц., Пан Х, Чжэн И, Мао С., Ян И, Ву Л., Гуо Х и др. Эпидемиологический и серологический надзор за ящуром и ящуром в Шанхае, Китай, 2012-2016 гг. Emerg Microbes Infect. 2018; 7 (1): 8.
Emerg Microbes Infect. 2018; 7 (1): 8.
PubMed PubMed Central Google Scholar
Sun Z, Zhang G, Guo P, Liu J, Gao Q, Xu X, Gong L. Эпидемиологические характеристики, спектр патогенов и молекулярные характеристики вируса Коксаки A16 у пациентов с HFMD в Яньтае, Шаньдун, Китай, в период с 2011 по 2015 годы. Hum Vaccin Immunother. 2017; 13 (8): 1831–8.
PubMed PubMed Central Статья Google Scholar
Чен Х, Тан Х, Ли Дж, Джин И, Гонг Л, Хун М., Ши Й, Чжу С., Чжан Б., Чжан С. и др.Молекулярная эпидемиология вируса Коксаки A16: выявлены внутритипные и преобладающие интертипные рекомбинации. PLoS One. 2013; 8 (12): e82861.
PubMed PubMed Central Статья CAS Google Scholar
Yong W, Qiao M, Shi L, Wang X, Wang Y, Du X, He M, Ding J. Генетические характеристики вируса Коксаки A16, связанного с болезнью рук, ног и рта в Нанкине, Китай. J Infect Dev Ctries. 2016; 10 (2): 168–75.
J Infect Dev Ctries. 2016; 10 (2): 168–75.
PubMed Статья Google Scholar
Границы | Анализ генома изолятов вируса Коксаки А4, выявленных при заболеваниях рук, ног и рта в Шаньдуне, Китай,
Введение
Человеческие энтеровирусы (EV), вирусы с одноцепочечной РНК без оболочки, таксономически классифицируются по роду Enterovirus (Dalldorf, 1953), семейству Picornaviridae и состоят из четырех видов: EV-A, EV-B, EV-C и EV-D (Ноулз и др., 2012). Вирус Коксаки A4 (CVA4), представитель вида EV-A, в настоящее время состоит из 25 типов, включая распространенные возбудители энтеровируса A71 (EVA71) и вируса Коксаки A16 (CVA16), которые являются наиболее распространенными агентами, выделенными из педиатрических случаев заболевания кистью и стопой. — болезнь рта (HFMD), распространенное инфекционное заболевание среди детей, которое спорадически встречается во всем мире (Wang et al., 2017).
Штамм-прототип CVA4, High Point (инвентарный номер GenBank: AY421762), был впервые выделен из городских сточных вод во время вспышки полиомиелита в Северной Каролине, США, в 1948 году (Melnick, 1950; Oberste et al. , 2004). В Carey and Myers (1969) другой штамм CVA4 был выделен из сыворотки крови ребенка со смертельным исходом, отмеченным тяжелыми проявлениями центральной нервной системы. В Estrada Gonzalez and Mas (1977) было обнаружено, что CVA4 ассоциирован с возникновением острого полирадикулоневрита. Примечательно, что CVA4 также упоминался как патоген во вспышках HFMD (Hu et al., 2011). Связь между инфекцией CVA4 и герпангиной (Cai et al., 2015), синдромом кожно-слизистых лимфатических узлов (Ueda et al., 2015) и двусторонним идиопатическим васкулитом сетчатки (Mine et al., 2017). Эти клинические данные подчеркивают, что инфекции CVA4 представляют собой бремя болезней для глобального общественного здравоохранения, особенно для новорожденных и маленьких детей, что требует более глубокого понимания генетического разнообразия этого патогена.
, 2004). В Carey and Myers (1969) другой штамм CVA4 был выделен из сыворотки крови ребенка со смертельным исходом, отмеченным тяжелыми проявлениями центральной нервной системы. В Estrada Gonzalez and Mas (1977) было обнаружено, что CVA4 ассоциирован с возникновением острого полирадикулоневрита. Примечательно, что CVA4 также упоминался как патоген во вспышках HFMD (Hu et al., 2011). Связь между инфекцией CVA4 и герпангиной (Cai et al., 2015), синдромом кожно-слизистых лимфатических узлов (Ueda et al., 2015) и двусторонним идиопатическим васкулитом сетчатки (Mine et al., 2017). Эти клинические данные подчеркивают, что инфекции CVA4 представляют собой бремя болезней для глобального общественного здравоохранения, особенно для новорожденных и маленьких детей, что требует более глубокого понимания генетического разнообразия этого патогена.
Несколько полных геномов штаммов CVA4 были секвенированы до 2004 г. и были преимущественно из Азии и США (Oberste et al., 2004). Однако в 2004 и 2006 годах CVA4 вызвал две эпидемии HFMD на Тайване (Chu et al. , 2011). После 2006 г. большее количество штаммов CVA4 было выделено в Европе и Азии, в основном из Китая. Например, в семи образцах от пациентов с острым вялым параличом (ОВП) в провинции Шэньси, собранных в период с 2006 по 2010 год, была диагностирована инфекция CVA4 (Wang et al., 2016). С 2008 г. в клинических образцах из педиатрических случаев HFMD в материковом Китае, таких как Gansu (Liu et al., 2009), Шэньчжэнь (Hu et al., 2011; Cai et al., 2015), Гуандун (Zhen et al., 2014) и Пекин (Li et al., 2015).
, 2011). После 2006 г. большее количество штаммов CVA4 было выделено в Европе и Азии, в основном из Китая. Например, в семи образцах от пациентов с острым вялым параличом (ОВП) в провинции Шэньси, собранных в период с 2006 по 2010 год, была диагностирована инфекция CVA4 (Wang et al., 2016). С 2008 г. в клинических образцах из педиатрических случаев HFMD в материковом Китае, таких как Gansu (Liu et al., 2009), Шэньчжэнь (Hu et al., 2011; Cai et al., 2015), Гуандун (Zhen et al., 2014) и Пекин (Li et al., 2015).
Геном РНК CVA4 (~ 7434 нуклеотида) можно подразделить на 5′-нетранслируемую область (UTR), 3′-UTR и открытую рамку считывания (ORF) (~ 6606 нуклеотидов), кодирующую один полипротеин, содержащий четыре структурных белков ( VP4, VP2, VP3 и VP1 в области P1) и семь неструктурных белков ( 2A, 2B и 2C в области P2 и 3A, 3B, 3C и 3D в районе P3).Ген VP1 обычно используется для таксономической классификации типов EV в пределах рода Enterovirus (Palacios et al. , 2002). В настоящее время в базе данных GenBank доступно несколько полноразмерных последовательностей генома CVA4 ( n = 10), что ограничивает понимание эволюции генома CVA4 и требует более глубокого понимания генетического разнообразия этого патогена для обеспечения доказательной базы для рациональное развитие молекулярной диагностики, разработки лекарств и вакцин.
, 2002). В настоящее время в базе данных GenBank доступно несколько полноразмерных последовательностей генома CVA4 ( n = 10), что ограничивает понимание эволюции генома CVA4 и требует более глубокого понимания генетического разнообразия этого патогена для обеспечения доказательной базы для рациональное развитие молекулярной диагностики, разработки лекарств и вакцин.
В настоящем исследовании мы описываем полноразмерные последовательности генома ( n = 21) изолятов CVA4 от педиатрических пациентов с HFMD из провинции Шаньдун, Китай, идентифицированные между 2014 и 2016 годами, а также филогенетические и молекулярные характеристики последовательностей CVA4 VP1 ( n = 175). Эти результаты углубляют наше понимание разнообразия и эволюции CVA4 и имеют важное значение для снижения глобального бремени болезней, связанных с этим патогеном.
Материалы и методы
Клинические образцы
В этом исследовании образцы стула у детей младше 6 лет с HFMD были собраны в период с 2014 по 2016 годы, а клинические образцы с положительным результатом, лабораторно подтвержденные как инфекции, не связанные с EVA71 и CVA16, были любезно предоставлены Шаньдун. Центр по контролю и профилактике заболеваний.
Центр по контролю и профилактике заболеваний.
Выделение CVA4 и извлечение РНК из клинических образцов
Клетки рабдомиосаркомы человека (RD) выращивали в MEM (минимальная необходимая среда, Gibco) с добавлением 10% FBS (фетальная бычья сыворотка, Gibco), 50 МЕ / мл пенициллина и 50 мкг / мл стрептомицина. Образцы трижды размножали в клетках RD человека при 37 ° C во влажной атмосфере с 5% CO 2 .
Тотальную РНК экстрагировали из супернатанта RD после развития цитопатического эффекта (CPE) с использованием набора RNAiso Plus (TaKaRa, 9109).РНК подвергали обратной транскрипции в кДНК с использованием случайных гексамеров с помощью набора реагентов PrimeScript RT (TaKaRa, RR037A). Анализ ПЦР в реальном времени на основе TaqMan проводился для обнаружения присутствия ЭВ с использованием системы ПЦР в реальном времени ABI 7500, как описано ранее (Zhang et al., 2017a, b). EV-положительные образцы ( n = 21) были секвенированы с использованием платформы высокопроизводительного секвенирования MiSeq, и данные секвенирования были проанализированы с использованием программы CLC для получения полных последовательностей вирусного генома. Образцы без EVA71 и без CVA16 из случаев HFMD были дополнительно протестированы с помощью CVA4-специфичного ПЦР-анализа в реальном времени с использованием олигонуклеотидных праймеров и зонда, разработанного на основе гена VP1 прототипа штамма CVA4 (номер доступа в GenBank: AY421762): CVA4-F: TATGGGCTTTGTCCAACTCC, CVA4-R: GTCTAGGGACCCATGCCCTCACT, CVA4-зонд: FAM-TGGGGACATTTTCAGCTAGAGTTGTGAGCAAG-BHQ1.
Образцы без EVA71 и без CVA16 из случаев HFMD были дополнительно протестированы с помощью CVA4-специфичного ПЦР-анализа в реальном времени с использованием олигонуклеотидных праймеров и зонда, разработанного на основе гена VP1 прототипа штамма CVA4 (номер доступа в GenBank: AY421762): CVA4-F: TATGGGCTTTGTCCAACTCC, CVA4-R: GTCTAGGGACCCATGCCCTCACT, CVA4-зонд: FAM-TGGGGACATTTTCAGCTAGAGTTGTGAGCAAG-BHQ1.
Филогенетический анализ CVA4
Для филогенетического анализа из GenBank были загружены два набора данных, включающие все доступные полные геномные последовательности ( n = 10) и полноразмерные последовательности гена VP1 ( n = 154) штаммов CVA4.Множественное выравнивание последовательностей для двух наборов данных было выполнено с использованием Muscle (Edgar, 2004) вместе с секвенированными геномами Shandong CVA4 ( n = 21). Модель нуклеотидного замещения была выбрана с помощью jModeltest (Darriba et al., 2012), а общая модель обратимого времени (GTR) всегда была лучшей моделью для анализа обоих наборов данных. Филогенетический анализ двух наборов данных был проведен с использованием RAxML v8.1.6 (Stamatakis et al., 2005) с моделью нуклеотидных замен GTRGAMMA с 1000 повторениями начальной загрузки.Нуклеотидные и аминокислотные расстояния оценивали с помощью MEGA 5 (Tamura et al., 2011).
Филогенетический анализ двух наборов данных был проведен с использованием RAxML v8.1.6 (Stamatakis et al., 2005) с моделью нуклеотидных замен GTRGAMMA с 1000 повторениями начальной загрузки.Нуклеотидные и аминокислотные расстояния оценивали с помощью MEGA 5 (Tamura et al., 2011).
Генетическое разнообразие по генам полипротеина CVA4
Среднее попарное генетическое разнообразие геномов CVA4 было рассчитано с помощью Phylip со скользящим окном в 300 нуклеотидов и размером шага в 50 нуклеотидов (Faria et al., 2017). Чтобы определить, в каком сайте кодонов чаще всего встречаются нуклеотидные вариации, энтропия Шеннона (Sn) в положениях 1, 2 и 3 каждого кодона выровненных полипротеиновых генов и VP4, VP2, VP3, VP1, 2A , Гены 2B, 2C, 3A, 3B, 3C и 3D соответственно были рассчитаны, как сообщалось ранее (Ramirez et al., 2013). Обработка данных выполнялась в среде R с открытым исходным кодом (R Development Core Team, 2012) с использованием пакета ggplot2.
Эволюционная динамика глобальных штаммов CVA4
Для определения структуры, подобной молекулярным часам, в данных CVA4 VP1 , дерево максимального правдоподобия последовательностей гена VP1 , оцененных на предыдущем этапе, было использовано для изучения связи между дивергенцией последовательностей и временем выборки с помощью TempEst (Rambaut et al. al., 2016). Чтобы лучше понять эволюционную динамику CVA4, набор данных VP1 ( n = 175) был использован для оценки скорости нуклеотидных замен с использованием выборки методом Монте-Карло байесовской цепи Маркова (MCMC), реализованной в пакете BEAST v1.8.4 (Drummond и Рамбаут, 2007). Модель SRD09 была использована в качестве модели нуклеотидного замещения. Байесовский процесс MCMC выполнялся для 100 миллионов шагов с частотой дискретизации каждые 5000 шагов, и первые 10% шагов отбрасывались как выгорание.Чтобы выбрать лучшую комбинацию молекулярных часов и предшествующего дерева, использовались как выборка пути, так и выборка ступеньки (Baele et al. , 2012). Лучшей комбинацией моделей была предшествующая байесовская линия горизонта и некоррелированная расслабленная модель молекулярных часов с логарифмически нормально распределенными вариациями скоростей между ветвями (дополнительная таблица S1) (Drummond et al., 2005). Апостериорные распределения оценивались с помощью Tracer v1.6, где предполагаемый размер выборки (ESS) составлял не менее 200. Байесовское дерево максимального доверия (MCC) было сгенерировано с помощью TreeAnnotator v1.8.4, а затем визуализировали с помощью FigTree v1.4.3. Кроме того, мы выполнили байесовский анализ графика горизонта с помощью программы Tracer v1.6 для реконструкции эволюционной истории на основе 175 полноразмерных последовательностей гена VP1 штаммов CVA4.
, 2012). Лучшей комбинацией моделей была предшествующая байесовская линия горизонта и некоррелированная расслабленная модель молекулярных часов с логарифмически нормально распределенными вариациями скоростей между ветвями (дополнительная таблица S1) (Drummond et al., 2005). Апостериорные распределения оценивались с помощью Tracer v1.6, где предполагаемый размер выборки (ESS) составлял не менее 200. Байесовское дерево максимального доверия (MCC) было сгенерировано с помощью TreeAnnotator v1.8.4, а затем визуализировали с помощью FigTree v1.4.3. Кроме того, мы выполнили байесовский анализ графика горизонта с помощью программы Tracer v1.6 для реконструкции эволюционной истории на основе 175 полноразмерных последовательностей гена VP1 штаммов CVA4.
Результаты
Сводка набора данных
В этом исследовании в общей сложности 21 штамм CVA4 был выделен из образцов стула пациентов с HFMD в провинции Шаньдун, в том числе пять из Ляочэна, три из Хэцзэ, по два из Дэчжоу, Линьи, Вэйхай, Яньтай и отдельные образцы из Биньчжоу, Лайу и др. Тайан, Циндао и Жичжао (рис. 1 и дополнительная таблица S2).Полногеномные последовательности 21 изолята были депонированы в базу данных GenBank: MH086030-MH086050 (дополнительная таблица S2).
Тайан, Циндао и Жичжао (рис. 1 и дополнительная таблица S2).Полногеномные последовательности 21 изолята были депонированы в базу данных GenBank: MH086030-MH086050 (дополнительная таблица S2).
Рисунок 1. Филогенетическое дерево максимального правдоподобия последовательностей полного генома CVA4 ( n = 31). 21 изолят CVA4, описанный в этом исследовании, окрашен в розовый цвет, а узлы эталонных красителей, загруженных из GenBank, окрашены в сиреневый. Три клады (I, II и III) окрашены в синий, фиолетовый и светло-зеленый цвета, а штамм-прототип CVA4 High Point (AY421762) окрашен в красный цвет.
Десять полных геномов CVA4 в период с 1948 по 2015 год были общедоступны в GenBank, восемь штаммов из Китая и два из США. Полноразмерные последовательности гена CVA4 VP1 ( n = 175) штаммов также были извлечены. Они были изолированы от Азербайджанской Республики ( n = 1), Китая ( n = 145), Индии ( n = 8), Кении ( n = 1), России ( n = 15). ), Туркменистан ( n = 1) и США ( n = 4) (дополнительный рисунок S1), соответственно.Даты сбора варьировались с 1948 по 2016 год (дополнительный рисунок S1). Примечательно, что 94,9% ( n = 166) из них были отобраны с 2006 года, а 84,9% ( n = 141) были собраны из 16 провинций и городов Китая, включая Шаньдун ( n = 60), Сычуань ( n = 18), Пекин ( n = 14), Шанхай ( n = 11), Шэньчжэнь ( n = 9), Хунань ( n = 7), Юньнань ( n = 4) , Чунцин ( n = 4), Цзилинь ( n = 3), Нинся ( n = 2), Цзянсу ( n = 2), Хайнань ( n = 2), Гуандун ( n = 2), Аньхой ( n = 1), Хэнань ( n = 1) и Чжэцзян ( n = 1).
), Туркменистан ( n = 1) и США ( n = 4) (дополнительный рисунок S1), соответственно.Даты сбора варьировались с 1948 по 2016 год (дополнительный рисунок S1). Примечательно, что 94,9% ( n = 166) из них были отобраны с 2006 года, а 84,9% ( n = 141) были собраны из 16 провинций и городов Китая, включая Шаньдун ( n = 60), Сычуань ( n = 18), Пекин ( n = 14), Шанхай ( n = 11), Шэньчжэнь ( n = 9), Хунань ( n = 7), Юньнань ( n = 4) , Чунцин ( n = 4), Цзилинь ( n = 3), Нинся ( n = 2), Цзянсу ( n = 2), Хайнань ( n = 2), Гуандун ( n = 2), Аньхой ( n = 1), Хэнань ( n = 1) и Чжэцзян ( n = 1).
Филогенетическая характеристика CVA4
Филогенетический анализ 31 целого генома показал, что 21 изолят из настоящего исследования разделились на три строго поддерживаемые клады (рис. 1). 17 штаммов были расположены в основной кладе вместе с семью китайскими штаммами, собранными в период с 2008 по 2011 гг. Два изолята, SDLC / 16114 / China / 2016-05-08 и SDQD / QD384R / China / 2016-06-17, сгруппированы в одну независимую кладу а изоляты SDLY / 2014LY124R / China / 2014-04-23 и SDHZ / h437 / China / 2015-04-28, а также ранее описанные KP289442 / P1033 / 2013 / China / 2013 принадлежали к отдельной третьей кладе.Кроме того, 21 шаньдунский изолят имел более высокую гомологию нуклеотидных последовательностей с восемью ранее описанными китайскими штаммами (82,0–99,8%), чем с штаммом-прототипом High Point / United States / 1948 (77,8–79,3%) и американским штаммом 2015-OB2038. / TN / United States / 2015-04-16 (75,5–78,3%).
Два изолята, SDLC / 16114 / China / 2016-05-08 и SDQD / QD384R / China / 2016-06-17, сгруппированы в одну независимую кладу а изоляты SDLY / 2014LY124R / China / 2014-04-23 и SDHZ / h437 / China / 2015-04-28, а также ранее описанные KP289442 / P1033 / 2013 / China / 2013 принадлежали к отдельной третьей кладе.Кроме того, 21 шаньдунский изолят имел более высокую гомологию нуклеотидных последовательностей с восемью ранее описанными китайскими штаммами (82,0–99,8%), чем с штаммом-прототипом High Point / United States / 1948 (77,8–79,3%) и американским штаммом 2015-OB2038. / TN / United States / 2015-04-16 (75,5–78,3%).
В дереве максимального правдоподобия для генов VP1 (дополнительный рисунок S2) изоляты CVA4 были разделены на четыре высоко поддерживаемых генотипа: A ( n = 1), B ( n = 1), C ( n = 28) и D ( n = 145).Прототип штамма High Point, выделенный из США в 1948 году, был классифицирован как генотип A, а один изолят из Кении в 1999 году был обозначен как генотип B. Штаммы CVA4, расщепляющиеся с генотипом C, были собраны в России в 2006–2014 годах ( n = 14), Индия в 2010 г. ( n = 8), США в 1999 г. ( n = 1) и 2015 г. ( n = 1), провинция Сычуань, Китай в 2006 г. ( n = 1) и 2007 г. ( n = 1), Азербайджан ( n = 1) и Туркменистан ( n = 1), соответственно.Поразительно, но генотип D был преобладающим генотипом в Китае. Генотип D можно разделить на два субгенотипа с высокой степенью поддержки: D1 ( n = 5) и D2 ( n = 140). Более подробно, пять китайских штаммов, выделенных до 2006 года, принадлежали к субгенотипу D1, а остальные китайские штаммы сгруппированы в субгенотипе D2, включая 21 изолят, описанный в настоящем исследовании. Однако наши секвенированные штаммы не группировались вместе, а были вкраплены в субгенотип D2.Примечательно, что был один штамм CVA4 из России, KC879539 / 40238 / Russia / 2011, подпадающий под субгенотип D2 и обладающий высокой гомологией (97,5%) с KY978552 / 11142 / SD / China / 2011.
Штаммы CVA4, расщепляющиеся с генотипом C, были собраны в России в 2006–2014 годах ( n = 14), Индия в 2010 г. ( n = 8), США в 1999 г. ( n = 1) и 2015 г. ( n = 1), провинция Сычуань, Китай в 2006 г. ( n = 1) и 2007 г. ( n = 1), Азербайджан ( n = 1) и Туркменистан ( n = 1), соответственно.Поразительно, но генотип D был преобладающим генотипом в Китае. Генотип D можно разделить на два субгенотипа с высокой степенью поддержки: D1 ( n = 5) и D2 ( n = 140). Более подробно, пять китайских штаммов, выделенных до 2006 года, принадлежали к субгенотипу D1, а остальные китайские штаммы сгруппированы в субгенотипе D2, включая 21 изолят, описанный в настоящем исследовании. Однако наши секвенированные штаммы не группировались вместе, а были вкраплены в субгенотип D2.Примечательно, что был один штамм CVA4 из России, KC879539 / 40238 / Russia / 2011, подпадающий под субгенотип D2 и обладающий высокой гомологией (97,5%) с KY978552 / 11142 / SD / China / 2011.
Среднее значение между групповыми нуклеотидными и аминокислотными расстояниями составляло 21,8 и 2,4% (генотип CVA4 A против B), 22,5 и 2,8% (A против C), 21,7 и 2,3% (A против D), 28,9 и 2,6% (B против C), 28,0 и 2,9% (B против D) и 20,4 и 3,2% (C против D) соответственно. Кроме того, среднее расстояние между нуклеотидами (и аминокислотами) между группами D1 и D2 составляло 15.2% (2,2%). Средние нуклеотидные (и аминокислотные) расстояния в группах C и D составляли 13,2% (2,8%) и 6,0% (1,3%) соответственно, т.е. 15%. Средние нуклеотидные (и аминокислотные) расстояния в группах D1 и D2 составляли 10,4% (2,0%) и 5,3% (1,2%) соответственно.
Парное генетическое разнообразие вдоль генома CVA4
Используя анализ скользящих окон по геномам CVA4 ( n = 31), мы обнаружили, что попарное генетическое разнообразие в регионах P2 (включая гены 2A, 2B, и 2C, ) и P3 (включая 3A, 3B , 3C и 3D генов) был выше, чем в области P1 (включая гены VP4, VP2, VP3 и VP1 ) (рис. 2A).Кроме того, 3A, 3B и 3′-конец 3D показали более высокое попарное генетическое разнообразие, чем другие области гена. Ген полипротеина 21 генома CVA4 из настоящего исследования имел 82,6–99,2% гомологии нуклеотидной последовательности и соответствующую гомологию аминокислотной последовательности 97,1–99,9%, что позволяет предположить наличие многочисленных синонимичных мутаций. В соответствии с этим наблюдением, среднее значение Sn в третьей позиции кодонов гена полипротеина штаммов CVA4 было равно 0.224, что значительно выше, чем в положениях 1 и 2 кодонов (рис. 2B). Кроме того, средние значения Sn в третьей позиции кодонов генов 2B, 2C, 3A, 3C и 3D были значительно выше, чем у VP1, VP2, VP3 и VP4 . гены в области P1 (рисунок 2C).
2A).Кроме того, 3A, 3B и 3′-конец 3D показали более высокое попарное генетическое разнообразие, чем другие области гена. Ген полипротеина 21 генома CVA4 из настоящего исследования имел 82,6–99,2% гомологии нуклеотидной последовательности и соответствующую гомологию аминокислотной последовательности 97,1–99,9%, что позволяет предположить наличие многочисленных синонимичных мутаций. В соответствии с этим наблюдением, среднее значение Sn в третьей позиции кодонов гена полипротеина штаммов CVA4 было равно 0.224, что значительно выше, чем в положениях 1 и 2 кодонов (рис. 2B). Кроме того, средние значения Sn в третьей позиции кодонов генов 2B, 2C, 3A, 3C и 3D были значительно выше, чем у VP1, VP2, VP3 и VP4 . гены в области P1 (рисунок 2C).
Рисунок 2. Генетическое разнообразие генов полипротеина CVA4 ( n = 31). (A) Среднее попарное генетическое разнообразие всех генов полипротеина CVA4 было рассчитано с использованием скользящего окна в 300 нт с размером шага 50 нс.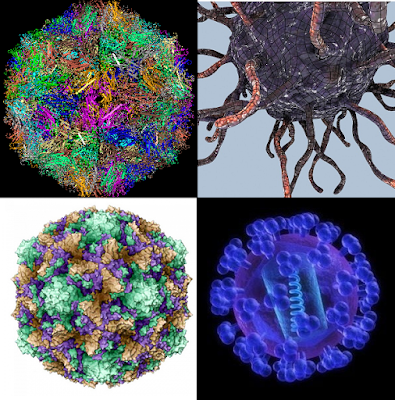 (B) Значения позиционной энтропии и значения Sn в разделах 1, 2 и 3 каждого кодона были оценены соответственно. ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона. (C) Значения Sn нуклеотидов в трех положениях кодонов были оценены в генах VP4, VP2, VP3, VP1, 2A, 2B, 2C, 3A, 3B, 3C и 3D соответственно. . ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона между генами 2B, 2C, 3A, 3C, 3D и генами VP4, VP2, VP3, VP1 соответственно.
(B) Значения позиционной энтропии и значения Sn в разделах 1, 2 и 3 каждого кодона были оценены соответственно. ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона. (C) Значения Sn нуклеотидов в трех положениях кодонов были оценены в генах VP4, VP2, VP3, VP1, 2A, 2B, 2C, 3A, 3B, 3C и 3D соответственно. . ∗∗∗ p -значение <0,001 в тесте суммы рангов Вилкоксона между генами 2B, 2C, 3A, 3C, 3D и генами VP4, VP2, VP3, VP1 соответственно.
Эволюционная динамика мирового CVA4
Байесовское филогенетическое дерево всех генов CVA4 VP1 ( n = 175), реконструированное с использованием модели наилучшего соответствия, выявило ту же топологию, что и филогенетическое дерево максимального правдоподобия (рис. 3). Анализ структуры молекулярных часов Tempest выявил сильную временную корреляцию в гене VP1 ( R 2 = 0,86). Средняя скорость нуклеотидных замен для генов CVA4 VP1 была оценена как 5. 12 × 10 -3 замен на участок / год (95% наивысшей апостериорной плотности (HPD): 4,45 × 10 -3 –5,81 × 10 -3 замен на участок / год). Примерно в 1941 году (95% HPD: 1931–1948) вирусы CVA4, по оценкам, разделялись на генотип A и общее происхождение генотипов B, C и D. Предполагалось, что генотип B отклонился от общего происхождения примерно в 1951 году. (95% HPD: 1933–1966), и, наконец, генотипы C и генотип D разошлись примерно в 1970 году (95% HPD: 1961–1977).Кроме того, генотип D был далее разделен на субгенотипы D1 и D2, которые произошли примерно в 1979 году (95% HPD: 1974–1985), и время до последнего общего предка (tMRCA) субгенотипа D2 можно было проследить. назад в 2001 г. (95% HPD: 1999–2003 гг.).
12 × 10 -3 замен на участок / год (95% наивысшей апостериорной плотности (HPD): 4,45 × 10 -3 –5,81 × 10 -3 замен на участок / год). Примерно в 1941 году (95% HPD: 1931–1948) вирусы CVA4, по оценкам, разделялись на генотип A и общее происхождение генотипов B, C и D. Предполагалось, что генотип B отклонился от общего происхождения примерно в 1951 году. (95% HPD: 1933–1966), и, наконец, генотипы C и генотип D разошлись примерно в 1970 году (95% HPD: 1961–1977).Кроме того, генотип D был далее разделен на субгенотипы D1 и D2, которые произошли примерно в 1979 году (95% HPD: 1974–1985), и время до последнего общего предка (tMRCA) субгенотипа D2 можно было проследить. назад в 2001 г. (95% HPD: 1999–2003 гг.).
Рисунок 3. Байесовский филогенетический анализ и демографическая реконструкция последовательности гена CVA4 VP1 (915 нт). (A) Байесовская филогения была проведена BEAST с предварительным байесовским деревом горизонта и расслабленной моделью молекулярных часов. (B) Ось x — это шкала времени (в годах), а ось y — эффективный размер популяции в логарифмической шкале Neτ. Толстая сплошная линия указывает средние оценки, а заштрихованная область указывает на 95% наивысшей апостериорной плотности.
(B) Ось x — это шкала времени (в годах), а ось y — эффективный размер популяции в логарифмической шкале Neτ. Толстая сплошная линия указывает средние оценки, а заштрихованная область указывает на 95% наивысшей апостериорной плотности.
Кроме того, мы выполнили байесовский анализ графика горизонта, чтобы восстановить демографическую историю CVA4 на основе последовательностей гена VP1 (рис. 3). Наши результаты показали, что эффективный размер популяции (аналог числа инфицированных особей) вируса CVA4 прошел пять основных стадий с момента описания прототипа штамма High Point в 1948 году (рис. 3).Первый этап охватывал период с 1948 по 2000 год, когда численность популяции была относительно постоянной, с признаками небольшого увеличения. На этом этапе генотипы B, C и D уже присутствовали до 1975 года, а также возникновение генотипа D1 в начале 1980-х и последующая совместная циркуляция генотипов B, C и субгенотипа D1. На втором этапе размер популяции резко и быстро уменьшился с 2000 г. до примерно середины 2003 г., возможно, из-за снижения распространенности генотипа B и субгенотипа D1 (или, возможно, отсутствия данных наблюдения), поскольку генотип C и субгенотип D2 разнообразились за этот период.Вскоре после середины 2003 г. численность популяции CVA4 резко и быстро росла до 2010 г., когда широко распространялись генотип C в России и Индии и субгенотип D2 в Китае. После 2010 г. произошло еще одно резкое и резкое уменьшение эффективного размера популяции, которое могло быть вызвано уменьшением распространенности генотипа C. С 2011 г. CVA4, по-видимому, вошел в стадию восстановления, и размер популяции снова стал стабильным с субгенотипом. D2 доминирует в Китае.
до примерно середины 2003 г., возможно, из-за снижения распространенности генотипа B и субгенотипа D1 (или, возможно, отсутствия данных наблюдения), поскольку генотип C и субгенотип D2 разнообразились за этот период.Вскоре после середины 2003 г. численность популяции CVA4 резко и быстро росла до 2010 г., когда широко распространялись генотип C в России и Индии и субгенотип D2 в Китае. После 2010 г. произошло еще одно резкое и резкое уменьшение эффективного размера популяции, которое могло быть вызвано уменьшением распространенности генотипа C. С 2011 г. CVA4, по-видимому, вошел в стадию восстановления, и размер популяции снова стал стабильным с субгенотипом. D2 доминирует в Китае.
Молекулярные характеристики
По сравнению с прототипом штамма CVA4 High Point, 40 аминокислотных замен были идентифицированы в полипротеине в> 75% наших изолятов, в том числе 1 в VP4 , 2 в VP2 , 2 в VP3 , 6 в VP1 , 6 дюймов 2A , 1 дюйм 2B , 5 дюймов 2C , 1 дюйм 3A , 3 дюйма 3C и 11 дюймов 3D (дополнительная таблица S3). В EVA71 ранее сообщалось, что 14 критических аминокислотных остатков и два генных мотива связаны с вирусной инфекционностью in vitro и in vivo (Таблица 1) (30–43).Интересно, что штаммы CVA4 содержали те же аминокислотные остатки в нескольких сайтах, что и штамм EVA71 BrCr, такие как остатки 37, 113 и 192 белка VP1 , 84, 82–86 и 154–156 белка Белка 3C и 73 и 363 белка 3D (таблица 1). Однако, в отличие от VP1 169L прототипа штамма EVA71, VP1 169F был обнаружен в High Point и в каждом из наших 21 изолята CVA4, что указывает на то, что CVA4, возможно, адаптировался для связывания с классом мышиного мусорщика. Участник B 2 (SCARB2) (Victorio et al., 2016). Примечательно, что были разные аминокислотные остатки на VP2 149 , VP1 97 , VP1 98 , VP1 123 , VP1 167 1 между EVA71 BrCr и штаммами CVA4, и VP1 145K наблюдалось среди наших изолятов CVA4.
В EVA71 ранее сообщалось, что 14 критических аминокислотных остатков и два генных мотива связаны с вирусной инфекционностью in vitro и in vivo (Таблица 1) (30–43).Интересно, что штаммы CVA4 содержали те же аминокислотные остатки в нескольких сайтах, что и штамм EVA71 BrCr, такие как остатки 37, 113 и 192 белка VP1 , 84, 82–86 и 154–156 белка Белка 3C и 73 и 363 белка 3D (таблица 1). Однако, в отличие от VP1 169L прототипа штамма EVA71, VP1 169F был обнаружен в High Point и в каждом из наших 21 изолята CVA4, что указывает на то, что CVA4, возможно, адаптировался для связывания с классом мышиного мусорщика. Участник B 2 (SCARB2) (Victorio et al., 2016). Примечательно, что были разные аминокислотные остатки на VP2 149 , VP1 97 , VP1 98 , VP1 123 , VP1 167 1 между EVA71 BrCr и штаммами CVA4, и VP1 145K наблюдалось среди наших изолятов CVA4.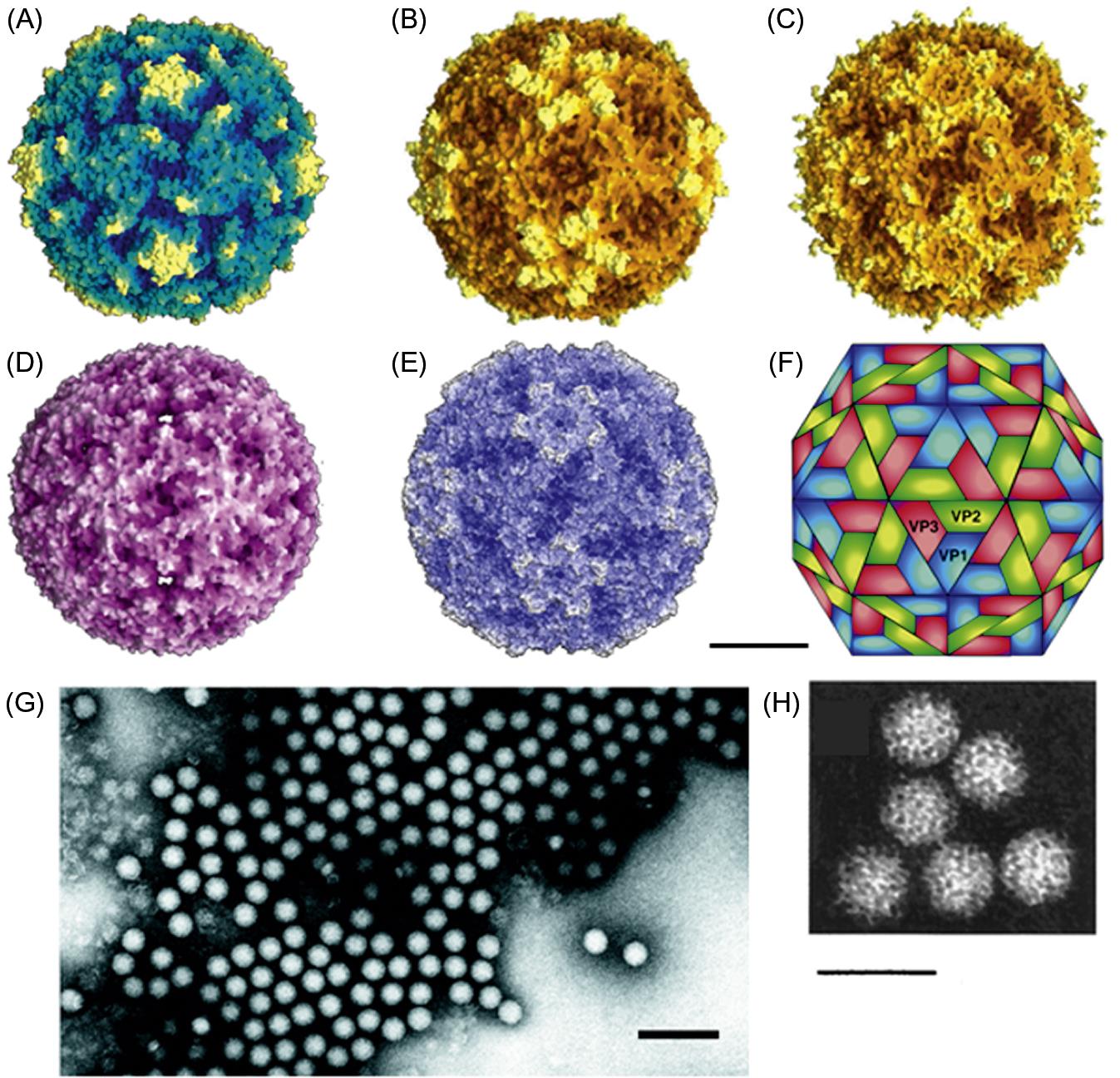
Таблица 1. Сравнение потенциальных критических аминокислотных остатков прототипов штаммов EV71 и CVA4 и 21 изолята, описанного в настоящем исследовании.
Обсуждение
Хотя EVA71 и CVA16 известны как основные возбудители HFMD в Китае, сообщалось, что ряд других видов EV-A, включая CVA6, CVA10, CVA2 и CVA4, связаны с HFMD. Кроме того, CVA4 также был одним из распространенных патогенов, связанных со случаями асептического менингита, герпетической ангины и вирусного миокардита (Carey and Myers, 1969; Estrada Gonzalez and Mas, 1977; Lee et al., 2014; Wang et al., 2016), что вызвало серьезную обеспокоенность общественным здоровьем и вызвало предположения о том, существует ли измененный тропизм или патогенность, связанная с этим типом сердечно-сосудистых заболеваний.Однако подробный анализ генома был проблематичным, потому что на сегодняшний день в базе данных GenBank было всего десять полных геномов CVA4 (Hu et al., 2011). Следовательно, молекулярно-эпидемиологическая характеристика CVA4 остается гораздо менее понятной из-за нехватки доступных геномных данных.
В этом исследовании мы описали 21 новый геном CVA4, выделенный от детей с HFMD, и выявили, что наши изоляты сгруппированы в три хорошо поддерживаемых клады на дереве максимального правдоподобия, оцененном с использованием полных геномов.Это говорит о том, что китайские вирусы CVA4 обладают определенным генетическим разнообразием, которое можно недооценить из-за ограниченности имеющихся данных эпиднадзора. Филогенетический анализ последовательностей гена VP1 показал, что штаммы CVA4 можно разделить на четыре отдельных генотипа, A-D, со средним генетическим расстоянием в пределах генотипа 0,00–13,2% и средним генетическим расстоянием между генотипами 20,4–28,9%. Следовательно, в соответствии с предыдущими отчетами (Rico-Hesse et al., 1987; Hu et al., 2011), различные генотипы CVA4 могут быть определены с> 15% нуклеотидного расстояния между генотипами в гене VP1 . Однако, в отличие от предыдущего отчета (Hu et al., 2011), штамм-прототип High Point образовал независимую ветвь как генотип А в нашей классификации. Подавляющее большинство китайских штаммов, включая 21 изолят в этом исследовании, принадлежали к генотипу D, и только два штамма, идентифицированные в провинции Сычуань в 2006 и 2007 годах, принадлежали к генотипу C.Кроме того, на основании имеющихся данных субгенотип D2, по-видимому, вытеснил D1 и стал преобладающим в Китае за предыдущее десятилетие.
Подавляющее большинство китайских штаммов, включая 21 изолят в этом исследовании, принадлежали к генотипу D, и только два штамма, идентифицированные в провинции Сычуань в 2006 и 2007 годах, принадлежали к генотипу C.Кроме того, на основании имеющихся данных субгенотип D2, по-видимому, вытеснил D1 и стал преобладающим в Китае за предыдущее десятилетие.
Дальнейший анализ показал, что мутации с большей вероятностью возникли в областях P2 и P3, кодирующих неструктурные белки, и в третьем положении кодонов, что согласуется с предыдущими сообщениями о том, что существует общий образец использования синонимичных кодонов для многих типов энтеровирусов ( Liu et al., 2011; Ma et al., 2014; Zhang et al., 2014; Su et al., 2017). Более того, ген VP1 был наиболее консервативной областью в нашем анализе, что позволяет предположить, что он может быть потенциальной мишенью для разработки чувствительного и специфичного к CVA4 диагностического анализа RT-qPCR, а также может быть эпитопом-кандидатом для разработки вакцин.
С середины 1950-х годов генетическое разнообразие CVA4 постепенно увеличивалось с 1948 по 1999 год и резко увеличивалось с середины 2003 по 2009 год, параллельно с увеличением распространенности CVA4 в Китае. Однако численность популяции, по оценкам, испытала более существенное сокращение в течение 1999 г., середины 2003 г. и с 2009 по 2011 г., чем в предыдущем отчете (Chen et al., 2018). Учитывая, что точность анализа демографической реконструкции чувствительна к выборке, определение резкого уменьшения размера популяции CVA4 в период с 1999 по середину 2003 года потребует дополнительных усилий по выборке. Следовательно, срочно необходим национальный надзор за различными энтеровирусами человека, вызывающими HFMD, для выяснения сложной эволюционной динамики и совместной циркуляции энтеровирусов, чтобы обеспечить доказательную базу для рациональных диагностических и профилактических подходов к снижению бремени болезней.
Средняя скорость эволюции гена CVA4 VP1 была оценена как 5,12 × 10 -3 замен на сайт в год, немного ниже, но в аналогичном диапазоне до 6,4 × 10 -3 замен на сайт в год. Чен и др. (2018). По нашим оценкам, общий предок известного CVA4 существовал приблизительно 75 лет назад, что также аналогично предыдущей оценке (71,8 года назад) (Tee et al., 2010). Интересно, что скорость эволюции EVA71 VP1 оценивается примерно в 4.6 × 10 -3 замен / сайт / год для обеих геногрупп B и C EVA71 (Tee et al., 2010; Chen et al., 2018). Скорость эволюции CVA6 оценивалась в 8,1 × 10 -3 замен / сайт / год (Puenpa et al., 2016), а CVA16 составляла 6,7 × 10 -3 замен / сайт / год (Zhao et al. ., 2016). Следовательно, CVA4, по-видимому, эволюционирует с той же скоростью, что и другие основные патогены HFMD, что заслуживает дальнейшего внимания.
Чен и др. (2018). По нашим оценкам, общий предок известного CVA4 существовал приблизительно 75 лет назад, что также аналогично предыдущей оценке (71,8 года назад) (Tee et al., 2010). Интересно, что скорость эволюции EVA71 VP1 оценивается примерно в 4.6 × 10 -3 замен / сайт / год для обеих геногрупп B и C EVA71 (Tee et al., 2010; Chen et al., 2018). Скорость эволюции CVA6 оценивалась в 8,1 × 10 -3 замен / сайт / год (Puenpa et al., 2016), а CVA16 составляла 6,7 × 10 -3 замен / сайт / год (Zhao et al. ., 2016). Следовательно, CVA4, по-видимому, эволюционирует с той же скоростью, что и другие основные патогены HFMD, что заслуживает дальнейшего внимания.
Вирус Коксаки А4 имел общие фенотип-ассоциированные аминокислотные замены по сравнению с прототипным штаммом EVA71, BrCr.Особо следует отметить, что VP1 169F , идентифицированный в EVA71, мог придавать вирусную связывающую способность рецептору SCARB2 млекопитающих, также обнаруженному в изолятах CVA4 (Yamayoshi et al.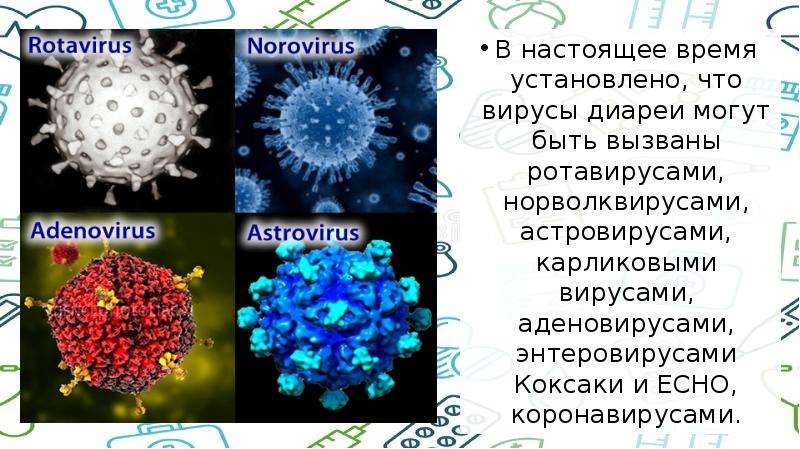 , 2012). Кроме того, у вирусов BrCr и CVA4 было несколько сайтов с разными аминокислотными мотивами. Однако следует отметить, что, хотя биологическая значимость этих сайтов со специфическими аминокислотными заменами была подтверждена в EVA71, они были идентифицированы путем сравнения последовательностей между CVA4 и EVA71. Следовательно, влияние этих критических аминокислот в CVA4 на связывание с рецептором , вирусная инфекционность, адаптация млекопитающих к репликации и патогенез требуют дальнейших исследований.
, 2012). Кроме того, у вирусов BrCr и CVA4 было несколько сайтов с разными аминокислотными мотивами. Однако следует отметить, что, хотя биологическая значимость этих сайтов со специфическими аминокислотными заменами была подтверждена в EVA71, они были идентифицированы путем сравнения последовательностей между CVA4 и EVA71. Следовательно, влияние этих критических аминокислот в CVA4 на связывание с рецептором , вирусная инфекционность, адаптация млекопитающих к репликации и патогенез требуют дальнейших исследований.
Кроме того, мы также обнаружили потенциальные события генетической рекомбинации в геномах CVA4 ( n = 31) с помощью программы обнаружения рекомбинации (RDP) v4.16 (Martin et al., 2015) и Simplot v3.5.1 (Hu et al. , 2011). Однако нам не удалось обнаружить убедительные события рекомбинации в 21 недавно секвенированном вирусе CVA4 (данные не показаны). В целом, похоже, что генетическая замена, а не рекомбинация, сыграла более важную роль в эволюции и диверсификации CVA4, несмотря на то, что события рекомбинации часто идентифицируются в других энтеровирусах человека (Hu et al. , 2011). Однако ограниченные данные эпиднадзора могли также привести к недооценке количества событий генетической рекомбинации в эволюции CVA4.
, 2011). Однако ограниченные данные эпиднадзора могли также привести к недооценке количества событий генетической рекомбинации в эволюции CVA4.
Таким образом, мы описали 21 новую последовательность генома CVA4, которая значительно обогатила доступные геномные данные для CVA4. Филогенетический анализ показал, что генотипы C, D1 и D2 совместно циркулировали в начале 2000-х годов, а теперь D2 вытеснил D1 и стал преобладающим субгенотипом в Китае. Генетическое разнообразие китайского CVA4 обнаруживается в регионах, кодирующих неструктурные белки, и в третьей позиции колебания кодонов.Напротив, меньше мутаций произошло в области гена VP1 , что делает ее оптимальной областью-кандидатом для разработки молекулярных анализов и потенциально в качестве консервативного эпитопа для вакцинации. Примечательно, что CVA4 может обладать более высокой аффинностью связывания с SCARB2 из-за замены L169F в белке VP1 , и то, как эта замена влияет на вирусную инфекционность и клинические исходы, следует исследовать в будущем. Помимо мониторинга EVA71 и CVA16, в Китае срочно необходим усиленный надзор за все более распространенными, а также вирулентными агентами, включая CVA4, для лучшего понимания динамики циркуляции и эволюции энтеровирусов человека, что предоставит бесценную информацию для диагностических и профилактических подходов к содержать болезнь.
Помимо мониторинга EVA71 и CVA16, в Китае срочно необходим усиленный надзор за все более распространенными, а также вирулентными агентами, включая CVA4, для лучшего понимания динамики циркуляции и эволюции энтеровирусов человека, что предоставит бесценную информацию для диагностических и профилактических подходов к содержать болезнь.
Авторские взносы
MW, JL и W-FS разработали исследование, участвовали во всех тестах и составили рукопись. M-XY, Y-WZ, S-JD и X-JW участвовали в сборе и тестировании образцов. TH, MC, SD, X-CZ, Z-JZ, HZ и Y-GT разработали исследование, внесли свой вклад в анализ результатов и подготовку исправленных версий рукописей. Все авторы прочитали и одобрили окончательную рукопись.
Финансирование
Работа поддержана Национальной программой исследований и разработок в области ключевых технологий Китая (проект №2017ZX10104001-006), Фонд естественных наук провинции Шаньдун (ZR2018PH034), Проекты развития медицины и здравоохранения провинции Шаньдун (2013WS0157 и 2017WS066), Муниципальная программа развития науки и технологий Тайань (2017NS0107) и Национальный фонд естественных наук Китая (81601773).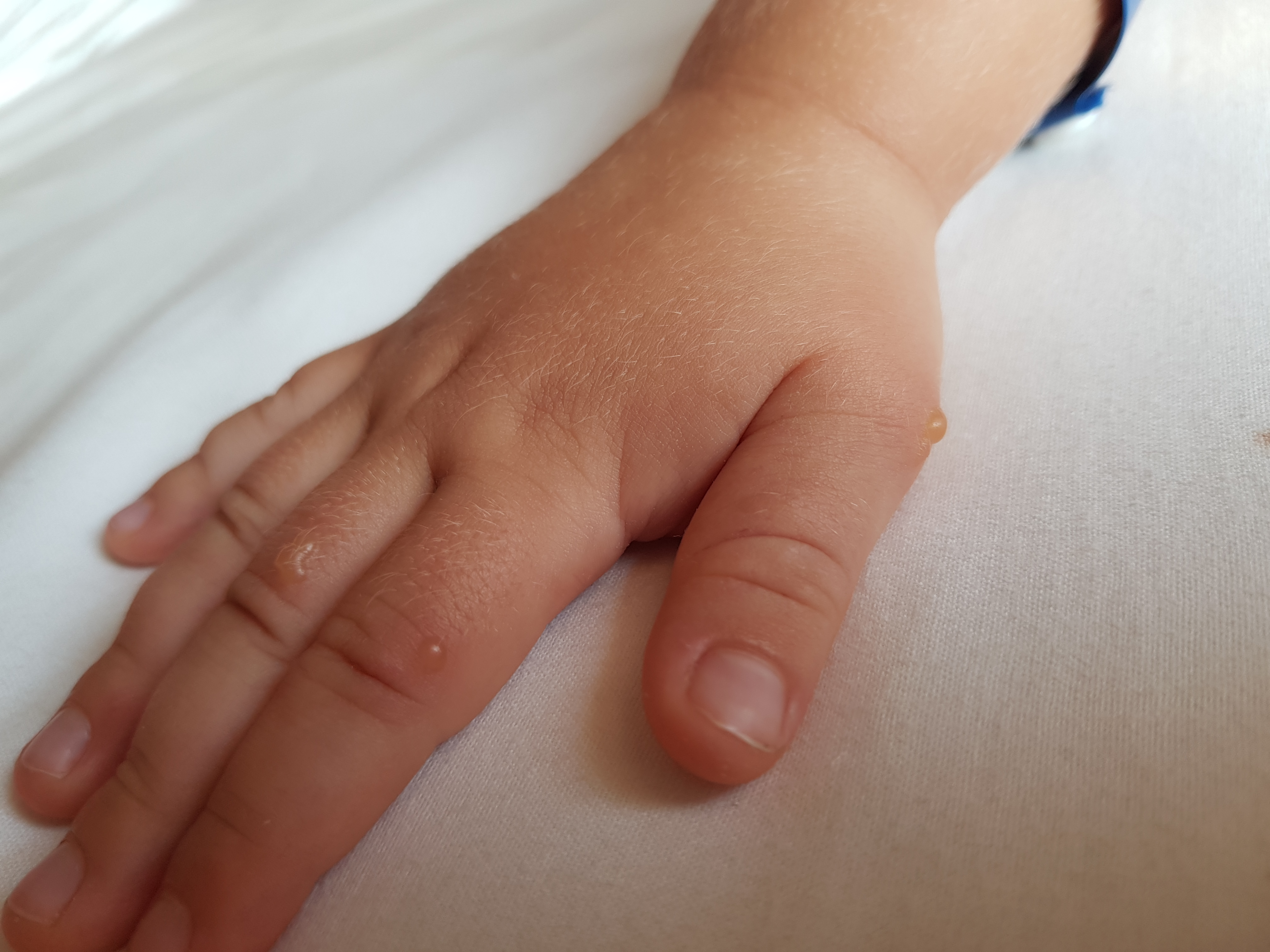 W-FS был поддержан программой стипендиатов Тайшань провинции Шаньдун (ts201511056).
W-FS был поддержан программой стипендиатов Тайшань провинции Шаньдун (ts201511056).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmicb.2019.01001/full#supplementary-material
Сноски
- http: /beast.bio.ed.ac.uk/Tracer
- http: /tree.bio.ed.ac.uk/software/figtree/
- www.picornaviridae.com
Список литературы
Арита, М., Симидзу, Х., Нагата, Н., Ами, Ю., Сузаки Ю., Сата Т. и др. (2005). Чувствительные к температуре мутанты энтеровируса 71 демонстрируют ослабление у яванских макак. J. Gen. Virol. 86 (Pt 5), 1391–1401. DOI: 10.1099 / vir. 0.80784-0
0.80784-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баэле, Г., Лемей, П., Бедфорд, Т., Рамбаут, А., Сушард, М. А., Алексеенко, А. В. (2012). Повышение точности сравнения моделей демографических и молекулярных часов с учетом филогенетической неопределенности. Мол. Биол. Evol. 29, 2157–2167. DOI: 10.1093 / molbev / mss084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цай, К., Яо, X., Чжо, Ф., Хэ, Ю. и Ян, Г. (2015). [Генная характеристика области VP1 вируса Коксаки A4 из случаев герпетической ангины в Шэньчжэне, Китай]. Чжунхуа И Сюэ За Чжи 95, 1226–1229.
PubMed Аннотация | Google Scholar
Кейн, Э. А., Монкла, Л. Х., Рондерос, М. Д., Фридрих, Т. К., и Осорио, Дж.Э. (2016). Единственная мутация в VP1 энтеровируса 71 ответственна за повышенную вирулентность и нейротропизм у взрослых мышей с дефицитом интерферона. J. Virol. 90, 8592–8604. DOI: 10.1128 / JVI.01370-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кэри Д. Э. и Майерс Р. М. (1969). Выделение вируса Коксаки типа A4 из сыворотки крови ребенка с быстро смертельным заболеванием с тяжелыми проявлениями центральной нервной системы. Индиан Дж.Med. Res. 57, 765–769.
Э. и Майерс Р. М. (1969). Выделение вируса Коксаки типа A4 из сыворотки крови ребенка с быстро смертельным заболеванием с тяжелыми проявлениями центральной нервной системы. Индиан Дж.Med. Res. 57, 765–769.
PubMed Аннотация | Google Scholar
Chen, P., Wang, H., Tao, Z., Xu, A., Lin, X., Zhou, N., et al. (2018). Множественные цепи передачи вируса Коксаки A4, одновременно циркулирующего в Китае и соседних странах в последние годы: филогенетический и пространственно-временной анализ на основе вирусологического надзора. Мол. Филогенет. Evol. 118, 23–31. DOI: 10.1016 / j.ympev.2017.09.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чу П.Ю., Лу, П. Л., Цай, Ю. Л., Си, Э., Яо, К. Ю., Чен, Ю. Х. и др. (2011). Пространственно-временной филогенетический анализ и молекулярная характеристика вируса Коксаки A4. Заражение. Genet. Evol. 11, 1426–1435. DOI: 10.1016 / j.meegid.2011.05.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чуа, Б. Х., Фуэктес, П., Сандерс, С. А., Николлс, П. К., и Макминн, П. К. (2008). Молекулярные основы адаптации мышей к энтеровирусу человека 71. J. Gen.Virol. 89 (Pt 7), 1622–1632. DOI: 10.1099 / vir.0.83676-0
Х., Фуэктес, П., Сандерс, С. А., Николлс, П. К., и Макминн, П. К. (2008). Молекулярные основы адаптации мышей к энтеровирусу человека 71. J. Gen.Virol. 89 (Pt 7), 1622–1632. DOI: 10.1099 / vir.0.83676-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cordey, S., Petty, T. J., Schibler, M., Martinez, Y., Gerlach, D., van Belle, S., et al. (2012). Идентификация сайт-специфических адаптаций, вызывающих повышенный тропизм нервных клеток во время инфицирования энтеровирусом человека 71. PLoS Pathog. 8: e1002826. DOI: 10.1371 / journal.ppat.1002826
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дальдорф, Г.(1953). Группа вирусов Коксаки. Ann. Акад. Sci. 56, 583–586. DOI: 10.1111 / j.1749-6632.1953.tb30251.x
CrossRef Полный текст | Google Scholar
Драммонд А. Дж., Рамбаут А., Шапиро Б. и Пибус О. Г. (2005). Байесовский объединенный вывод прошлой динамики популяции на основе молекулярных последовательностей. Мол. Биол. Evol. 22, 1185–1192. DOI: 10.1093 / molbev / msi103
Мол. Биол. Evol. 22, 1185–1192. DOI: 10.1093 / molbev / msi103
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эстрада Гонсалес, Р., и Мас, П. (1977). Вирусологические исследования при остром полирадикулоневрите ЛГБС-типа. Различные выводы в отношении вируса Коксаки A4. Neurol. Neurocir. Psiquiatr. 18 (2–3 приложения), 527–531.
PubMed Аннотация
Фариа, Н. Р., Квик, Дж., Кларо, И. М., Тезе, Дж., Де Хесус, Дж. Г., Джованетти, М. и др. (2017). Установление и скрытая передача вируса Зика в Бразилии и Америке. Природа 546, 406–410. DOI: 10.1038 / природа22401
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ху, Ю.F., Yang, F., Du, J., Dong, J., Zhang, T., Wu, Z.Q., et al. (2011). Полный анализ генома штаммов вируса Коксаки A2, A4, A5 и A10, выделенных у пациентов с заболеваниями рук, ног и рта в Китае, выявил частую рекомбинацию энтеровируса человека A. J. Clin. Microbiol. 49, 2426–2434. DOI: 10.1128 / JCM.00007-11
DOI: 10.1128 / JCM.00007-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуанг, С. В., Ван, Ю. Ф., Ю, К. К., Су, И. Дж. И Ван, Дж. Р. (2012). Мутации в капсидных белках VP2 и VP1 увеличивают инфекционность и летальность энтеровируса 71 для мышей за счет связывания вируса и увеличения накопления РНК. Вирусология 422, 132–143. DOI: 10.1016 / j.virol.2011.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Келли, Дж. Т., Де Колибус, Л., Эллиотт, Л., Фрай, Э. Э., Стюарт, Д. И., Роулендс, Д. Дж., И др. (2015). Сильные противовирусные агенты не вызывают генетически стабильных мутаций устойчивости ни в энтеровирусе 71, ни в вирусе Коксаки А16. Антивирь. Res. 124, 77–82. DOI: 10.1016 / j.antiviral.2015.10.006
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ноулз, Н.J., Hovi, T., Hyypiä, T., King, A.M.Q., Lindberg, A.M., Pallansch, M.A., et al. (2012). «Picornaviridae» в таксономии вирусов : классификация и номенклатура вирусов: девятый отчет Международного комитета по таксономии вирусов , ред. А. М. К. Кинг, М. Дж. Адамс, Э. Лефковиц и Э. Б. Карстенс (Сан-Диего, Калифорния: Эльзевьер).
А. М. К. Кинг, М. Дж. Адамс, Э. Лефковиц и Э. Б. Карстенс (Сан-Диего, Калифорния: Эльзевьер).
Google Scholar
Ли, К.Дж., Хуанг, Ю.С., Янг, С., Цао, К.С., Чен, К.Дж., Сие, Ю.С., и др. (2014). Клинические особенности инфекций, вызванных вирусом Коксаки A4, B3 и B4, у детей. PLoS One 9: e87391. DOI: 10.1371 / journal.pone.0087391
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж. С., Дун, Х. Г., Цинь, М., Се, З. П., Гао, Х. С., Ян, Дж. Й. и др. (2015). Вспышка лихорадочного заболевания, вызванного вирусом Коксаки A4, в детском саду в Пекине, Китай. Virol. J. 12:92. DOI: 10.1186 / s12985-015-0325-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Дж. Ф., Чжан Ю. и Ли Х.(2009). [Генетическая характеристика VP4-VP2 двух вирусов Коксаки A4, выделенных от пациентов с болезнью рук, ящура и рта]. Чжунго И Мяо Хэ Мянь И 15, 345–349.
PubMed Аннотация | Google Scholar
Лю, Ю. С., Чжоу, Дж. Х., Чен, Х. Т., Ма, Л. Н., Пейсак, З., Дин, Ю. З. и др. (2011). Характеристики использования синонимичных кодонов в вирусе энтеровируса 71 и влияние хозяина на вирус в структуре использования кодонов. Заражение. Genet. Evol. 11, 1168–1173.DOI: 10.1016 / j.meegid.2011.02.018
С., Чжоу, Дж. Х., Чен, Х. Т., Ма, Л. Н., Пейсак, З., Дин, Ю. З. и др. (2011). Характеристики использования синонимичных кодонов в вирусе энтеровируса 71 и влияние хозяина на вирус в структуре использования кодонов. Заражение. Genet. Evol. 11, 1168–1173.DOI: 10.1016 / j.meegid.2011.02.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, М. Р., Хуэй, Л., Ван, М. Л., Тан, Ю., Чанг, Ю. В., Цзя, К. Х. и др. (2014). Общая картина использования кодонов энтеровируса 71. Genet. Мол. Res. 13, 336–343. DOI: 10.4238 / 2014.January.21.1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин Д. П., Мюррелл Б., Голден М., Хосал А. и Мухир Б. (2015). RDP4: обнаружение и анализ паттернов рекомбинации в вирусных геномах. Virus Evol. 1: vev003. DOI: 10.1093 / ve / vev003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мельник, Дж. Л. (1950). Исследования вирусов Коксаки; свойства, иммунологические аспекты и распространение в природе.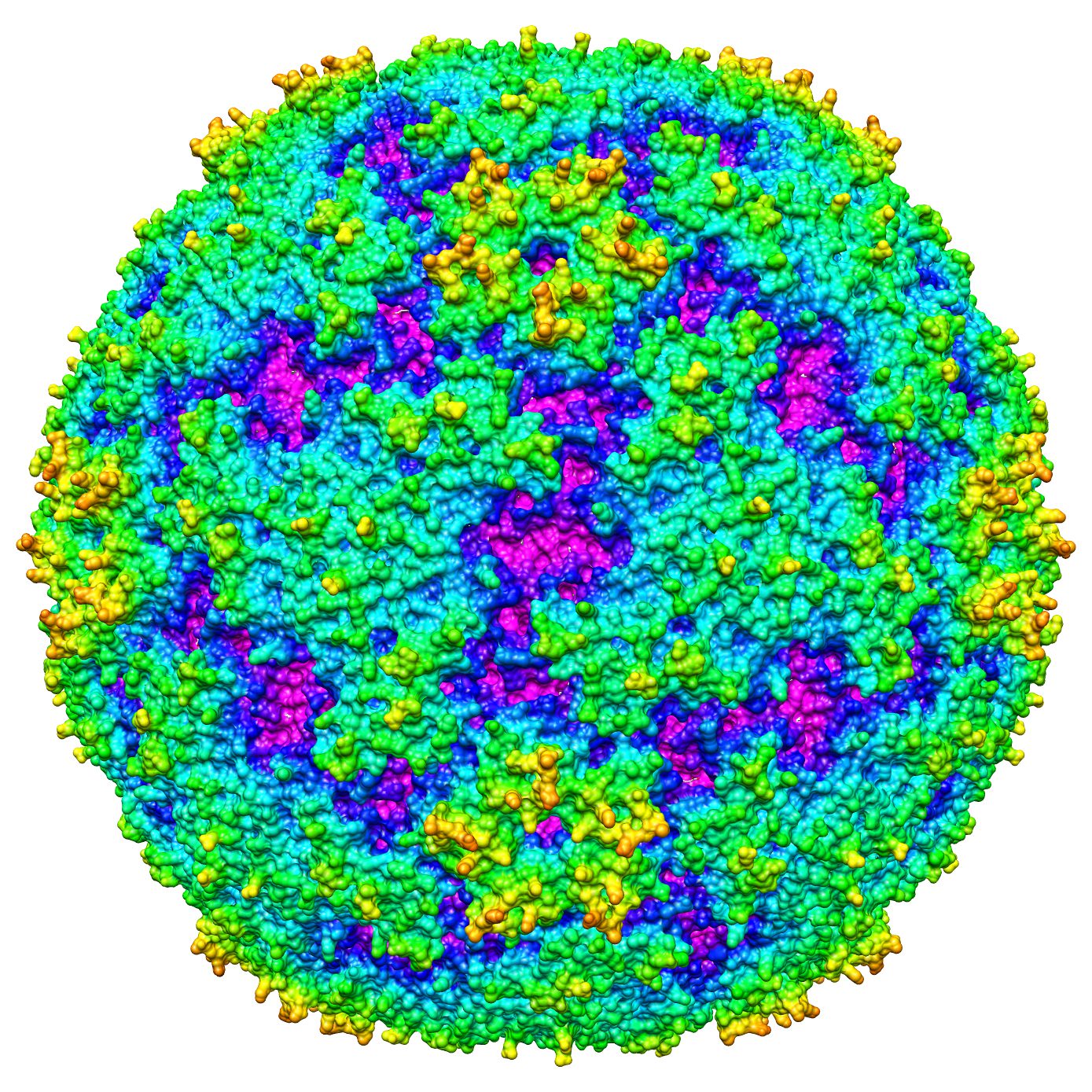 Бык. Акад. Med. 26, 342–356.
Бык. Акад. Med. 26, 342–356.
PubMed Аннотация | Google Scholar
Mine, I., Taguchi, M., Sakurai, Y., and Takeuchi, M. (2017). Двусторонний идиопатический васкулит сетчатки после инфицирования вирусом Коксаки A4: отчет о болезни. BMC Ophthalmol. 17: 128. DOI: 10.1186 / s12886-017-0523-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миямура, К., Нисимура, Ю., Або, М., Вакита, Т., и Симидзу, Х. (2011). Адаптивные мутации в геномах штамма энтеровируса 71 после инфицирования клеток мыши, экспрессирующих лиганд-1 гликопротеина Р-селектина человека. J. Gen. Virol. 92 (Pt 2), 287–291. DOI: 10.1099 / vir.0.022418-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нисимура, Ю., Ли, Х., Хафенштейн, С., Катаока, К., Вакита, Т., Бергельсон, Дж. М. и др. (2013). Связывание энтеровируса 71 с PSGL-1 на лейкоцитах: VP1-145 действует как молекулярный переключатель, контролирующий взаимодействие рецепторов. PLoS Pathog. 9: e1003511. DOI: 10.1371 / journal.ppat.1003511
PLoS Pathog. 9: e1003511. DOI: 10.1371 / journal.ppat.1003511
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Оберсте, М.С., Пенаранда, С., Махер, К., и Палланш, М.А. (2004). Полные последовательности генома всех представителей вида Энтеровирус человека А. J. Gen. Virol. 85 (Pt 6), 1597–1607. DOI: 10.1099 / vir.0.79789-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Паласиос, Г., Касас, И., Тенорио, А., Фрейре, К. (2002). Молекулярная идентификация энтеровируса путем анализа частичной области генома VP1 различными методами. J. Clin. Microbiol. 40, 182–192. DOI: 10.1128 / jcm.40.1.182-192.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пуэнпа, Дж., Vongpunsawad, S., Osterback, R., Waris, M., Eriksson, E., Albert, J., et al. (2016). Молекулярная эпидемиология и эволюция вируса Коксаки человека A6. J. Gen. Virol. 97, 3225–3231. DOI: 10.1099 / jgv.0.000619
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Основная группа разработчиков R (2012 г. ). R: Язык и среда для статистических вычислений . Вена: Фонд R для статистических вычислений.
). R: Язык и среда для статистических вычислений . Вена: Фонд R для статистических вычислений.
Google Scholar
Рамбаут, А., Лам, Т. Т., Макс Карвалью, Л., и Пибус, О. Г. (2016). Изучение временной структуры гетерохронных последовательностей с помощью TempEst (ранее Path-O-Gen). Virus Evol. 2: vew007. DOI: 10.1093 / ve / vew007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рамирес К., Грегори Дж., Бути М., Табернеро Д., Камос С., Касильяс Р. и др. (2013). Сравнительное исследование сверхглубокого пиросеквенирования и клонирования для количественного анализа квазивидов вируса с использованием инфекции вируса гепатита В в качестве модели. Антивирь. Res. 98, 273–283. DOI: 10.1016 / j.antiviral.2013.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рико-Гессе, Р., Палланш, М. А., Ноттай, Б. К., и Кью, О. М. (1987). Географическое распространение генотипов дикого полиовируса типа 1. Вирусология 160, 311–322. DOI: 10.1016 / 0042-6822 (87)-8
Вирусология 160, 311–322. DOI: 10.1016 / 0042-6822 (87)-8
CrossRef Полный текст | Google Scholar
Ши, С. Р., Чанг, К., Чен, Т. К., Ву, К. Н., Сюй, Дж. Т., Ли, Дж.C., et al. (2004a). Мутации в доменах KFRDI и VGK протеазы 3C энтеровируса 71 влияют на его РНК-связывание и протеолитическую активность. J. Biomed. Sci. 11, 239–248. DOI: 10.1159 / 000076036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ши, С. Р., Цай, М. К., Ценг, С. Н., Вон, К. Ф., Шиа, К. С., Ли, В. Т. и др. (2004b). Мутация в капсидном белке VP1 энтеровируса 71 придает устойчивость к ингибирующим эффектам пиридилимидазолидинона. Антимикробный.Агенты Chemother. 48, 3523–3529. DOI: 10.1128 / AAC.48.9.3523-3529.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стаматакис А., Людвиг Т. и Мейер Х. (2005). RAxML-III: быстрая программа для вывода больших филогенетических деревьев на основе максимального правдоподобия. Биоинформатика 21, 456–463. DOI: 10.1093 / биоинформатика / bti191
Биоинформатика 21, 456–463. DOI: 10.1093 / биоинформатика / bti191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Су, В., Ли, X., Чен, М., Дай, В., Сан, С., Wang, S., et al. (2017). Анализ использования синонимичных кодонов вирусов болезней рук, ящура: сравнительное исследование вируса Коксаки A6, A10, A16 и энтеровируса 71 с 2008 по 2015 годы. Infect. Genet. Evol. 53, 212–217. DOI: 10.1016 / j.meegid.2017.06.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тамура, К., Петерсон, Д., Петерсон, Н., Стечер, Г., Ней, М., и Кумар, С. (2011). MEGA5: анализ молекулярной эволюционной генетики с использованием методов максимального правдоподобия, эволюционного расстояния и максимальной экономии. Мол. Биол. Evol. 28, 2731–2739. DOI: 10.1093 / molbev / msr121
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ти, К. К., Лам, Т. Т., Чан, Ю. Ф., Библия, Дж. М., Камарулзаман, А.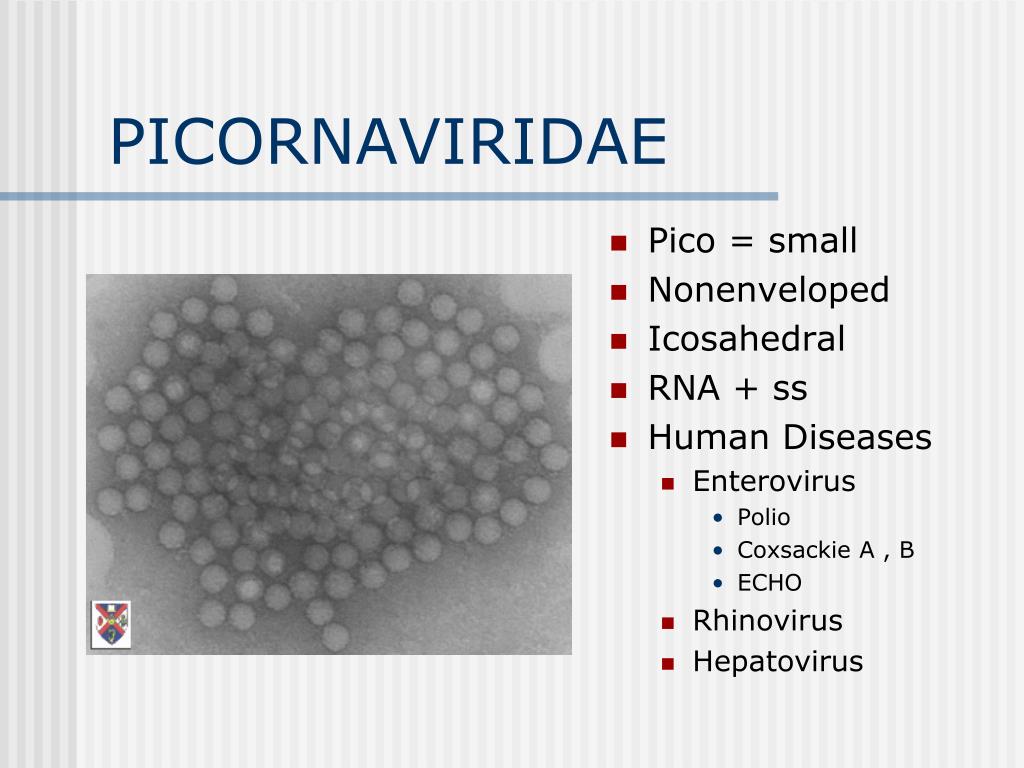 , Тонг, К. Ю. и др. (2010). Эволюционная генетика энтеровируса человека 71: происхождение, популяционная динамика, естественный отбор и сезонная периодичность гена VP1. J. Virol. 84, 3339–3350. DOI: 10.1128 / JVI.01019-09
, Тонг, К. Ю. и др. (2010). Эволюционная генетика энтеровируса человека 71: происхождение, популяционная динамика, естественный отбор и сезонная периодичность гена VP1. J. Virol. 84, 3339–3350. DOI: 10.1128 / JVI.01019-09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Целигка, Е.Д., Собо, К., Стоппини, Л., Каньо, В., Абдул, Ф., Пиуз, И. и др. (2018). Мутация VP1, приобретенная во время диссеминированной инфекции энтеровируса 71, придает способность связывать гепарансульфат и модулирует тропизм ex vivo. PLoS Pathog. 14: e1007190. DOI: 10.1371 / journal.ppat.1007190
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уэда, Ю., Кензака, Т., Нода, А., Ямамото, Ю., и Мацумура, М. (2015). Болезнь Кавасаки у взрослых (синдром кожно-слизистых лимфатических узлов) и сопутствующая инфекция, вызванная вирусом Коксаки A4: отчет о клиническом случае. Внутр. Med. Case Rep. J. 8, 225–230. DOI: 10.2147 / IMCRJ.S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Викторио, К. Б., Сюй, Ю., Нг, К., Мэн, Т., Чоу, В. Т., и Чуа, К. Б. (2016). Совместное действие аминокислот 98E, 145A и 169F VP1 в продуктивной инфекции линий мышиных клеток энтеровирусом 71 (штамм BS). Emerg. Микробы заражают. 5: e60. DOI: 10.1038 / emi.2016.56
Б., Сюй, Ю., Нг, К., Мэн, Т., Чоу, В. Т., и Чуа, К. Б. (2016). Совместное действие аминокислот 98E, 145A и 169F VP1 в продуктивной инфекции линий мышиных клеток энтеровирусом 71 (штамм BS). Emerg. Микробы заражают. 5: e60. DOI: 10.1038 / emi.2016.56
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван, Д., Xu, Y., Zhang, Y., Zhu, S., Si, Y., Yan, D., et al. (2016). [Генетические характеристики вируса Коксаки группы А типа 4, выделенного от пациентов с острым вялым параличом в Шэньси, Китай]. Бинг Ду Сюэ Бао 32, 145–149.
PubMed Аннотация | Google Scholar
Wang, J., Hu, T., Sun, D., Ding, S., Carr, M.J., Xing, W., et al. (2017). Эпидемиологические характеристики болезней рук, ног и рта в Шаньдуне, Китай, 2009-2016 гг. Sci. Реп. 7: 8900. DOI: 10.1038 / s41598-017-y, мы выполнили байесовский sk09196-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ямаёси, С., Иидзука, С., Ямасита, Т. , Минагава, Х., Мизута, К., Окамото, М., и др. (2012). SCARB2-зависимая инфекция человека, вызванная вирусом Коксаки А7, А14 и А16 и энтеровирусом 71. J. Virol. 86, 5686–5696. DOI: 10.1128 / JVI.00020-12
, Минагава, Х., Мизута, К., Окамото, М., и др. (2012). SCARB2-зависимая инфекция человека, вызванная вирусом Коксаки А7, А14 и А16 и энтеровирусом 71. J. Virol. 86, 5686–5696. DOI: 10.1128 / JVI.00020-12
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зайни, З., Макминн, П. (2012).Одиночная мутация в капсидном протеине VP1 (Q145E) штамма геногруппы C4 энтеровируса 71 человека генерирует вирулентный фенотип мыши. J. Gen. Virol. 93 (Pt 9), 1935–1940. DOI: 10.1099 / vir.0.043893-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zaini, Z., Phuektes, P., and McMinn, P. (2012). Мышиная адаптация штамма подгеногруппы B5 энтеровируса 71 человека связана с заменой нового лизина на глутаминовую кислоту в положении 244 в белке VP1. Virus Res. 167, 86–96. DOI: 10.1016 / j.virusres.2012.04.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, H., Cao, H.W., Li, F.Q., Pan, Z. Y., Wu, Z.J., Wang, Y.H., et al. (2014). Анализ использования синонимичных кодонов в энтеровирусе 71. Вирусная болезнь 25, 243–248. DOI: 10.1007 / s13337-014-0215-y
Y., Wu, Z.J., Wang, Y.H., et al. (2014). Анализ использования синонимичных кодонов в энтеровирусе 71. Вирусная болезнь 25, 243–248. DOI: 10.1007 / s13337-014-0215-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Z., Dong, Z., Li, J., Carr, M.J., Zhuang, D., Wang, J., et al. (2017а). Защитная эффективность инактивированной формальдегидом цельновирусной вакцины и противовирусных препаратов на мышиной модели инфекции Коксаки вируса a10. J. Virol. 91: e00333-17. DOI: 10.1128 / JVI.00333-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, Z., Dong, Z., Wei, Q., Carr, M.J., Li, J., Ding, S., et al. (2017b). Модель инфекции Коксаки вируса А6 на неонатальных мышах для оценки противовирусной эффективности и эффективности вакцины. Дж.Virol. 91: e02450-16. DOI: 10.1128 / JVI.02450-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Г., Чжан, X., Ван, К., Ван, Г. , и Ли, Ф. (2016). Характеристика последовательности VP1 изолятов вируса Коксаки А16 байесовским эволюционным методом. Virol. J. 13: 130. DOI: 10.1186 / s12985-016-0578-3
, и Ли, Ф. (2016). Характеристика последовательности VP1 изолятов вируса Коксаки А16 байесовским эволюционным методом. Virol. J. 13: 130. DOI: 10.1186 / s12985-016-0578-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhen, R., Zhang, Y., Xie, H., Chen, C., Geng, J., He, P., et al.(2014). [Анализ последовательности области VP1 вируса Коксаки A4 и вируса Коксаки A10 в городе Гуанчжоу, 2010-2012 гг.]. Чжунхуа Юй Фанг И Сюэ За Чжи 48, 445–450.
PubMed Аннотация | Google Scholar
Coxsackievirus | Краткие медицинские знания
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК
вирус
Вирус
Вирусы — это инфекционные облигатные внутриклеточные паразиты, состоящие из ядра нуклеиновой кислоты, окруженного белковым капсидом.Вирусы могут быть голыми (без оболочки) или с оболочкой. Классификация вирусов сложна и основана на многих факторах, включая тип и структуру нуклеоида и капсида, наличие оболочки, цикл репликации и диапазон хозяев.
Вирусология: Обзорная идентификация:
РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК
вирус
Вирус
Вирусы — это инфекционные облигатные внутриклеточные паразиты, состоящие из ядра нуклеиновой кислоты, окруженного белковым капсидом.Вирусы могут быть голыми (без оболочки) или с оболочкой. Классификация вирусов сложна и основана на многих факторах, включая тип и структуру нуклеоида и капсида, наличие оболочки, цикл репликации и диапазон хозяев.
Вирусология: Обзорная идентификация:
Вирусы можно классифицировать по-разному. Однако большинство вирусов будет иметь геном, образованный либо
ДНК
ДНК
Молекула ДНК является хранилищем наследуемой генетической информации.У человека ДНК содержится в 23 парах хромосом в ядре. Молекула обеспечивает базовую матрицу для репликации генетической информации, транскрипции РНК и биосинтеза белка, чтобы способствовать клеточной функции и выживанию. Типы и структура ДНК или
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина).
Типы и структура ДНК или
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина).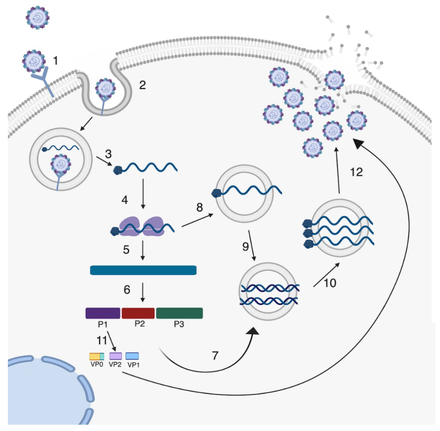 РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК. Геном вирусов может быть дополнительно охарактеризован как одноцепочечный, так и двухцепочечный.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК. «Обернутые» вирусы покрыты тонким слоем
клеточная мембрана
Клеточная мембрана
Клеточная мембрана (также известная как плазматическая мембрана или плазмалемма) — это биологическая мембрана, которая отделяет содержимое клетки от внешней среды.
РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК. Геном вирусов может быть дополнительно охарактеризован как одноцепочечный, так и двухцепочечный.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК. «Обернутые» вирусы покрыты тонким слоем
клеточная мембрана
Клеточная мембрана
Клеточная мембрана (также известная как плазматическая мембрана или плазмалемма) — это биологическая мембрана, которая отделяет содержимое клетки от внешней среды. Клеточная мембрана состоит из фосфолипидного бислоя и белков, которые защищают клеточную ДНК и опосредуют обмен ионами и молекулами.
Клетка: клеточная мембрана (обычно берется из клетки-хозяина). Если шерсть отсутствует, вирусы называют «голыми» вирусами. Вирусы с одноцепочечным геномом являются вирусами с «позитивным смыслом», если геном непосредственно используется в качестве мессенджера.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК (мРНК), которая транслируется в белки.
Клеточная мембрана состоит из фосфолипидного бислоя и белков, которые защищают клеточную ДНК и опосредуют обмен ионами и молекулами.
Клетка: клеточная мембрана (обычно берется из клетки-хозяина). Если шерсть отсутствует, вирусы называют «голыми» вирусами. Вирусы с одноцепочечным геномом являются вирусами с «позитивным смыслом», если геном непосредственно используется в качестве мессенджера.
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК (мРНК), которая транслируется в белки. «Негативные» одноцепочечные вирусы используют
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК зависят от
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина).
«Негативные» одноцепочечные вирусы используют
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК зависят от
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина).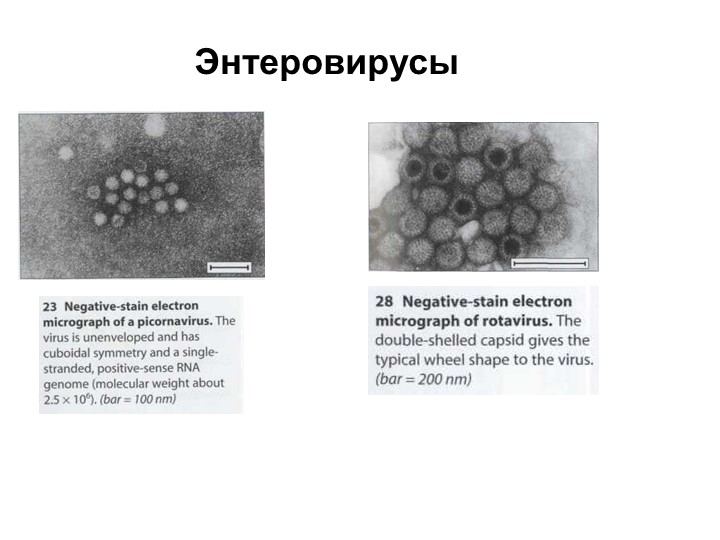 РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК полимераза, вирусный фермент, для транскрипции своего генома в мессенджер
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК.
РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК полимераза, вирусный фермент, для транскрипции своего генома в мессенджер
РНК
РНК
Рибонуклеиновая кислота (РНК), как и дезоксирибонуклеиновая кислота (ДНК), представляет собой полимер нуклеотидов, который необходим для синтеза клеточного белка.В отличие от ДНК, РНК представляет собой одноцепочечную структуру, содержащую рибозу (вместо дезоксирибозы) и основание урацила (вместо тимина). РНК обычно выполняет инструкции, закодированные в ДНК, но также выполняет различные некодирующие функции.
Типы и структура РНК.
Они почти такие же неприятные, как звучат! — Уважаемый Pandemic
У вашего ребенка младше 5 лет насморк сопровождается общей тенденцией к абсолютному и нехарактерному несчастью? Разве они не хотят ничего, кроме как ныть и пить холодное молоко круглосуточно?
Коксаки! Нет, это не ругань; это название семейства вирусов, и оно может быть причиной ваших несчастий.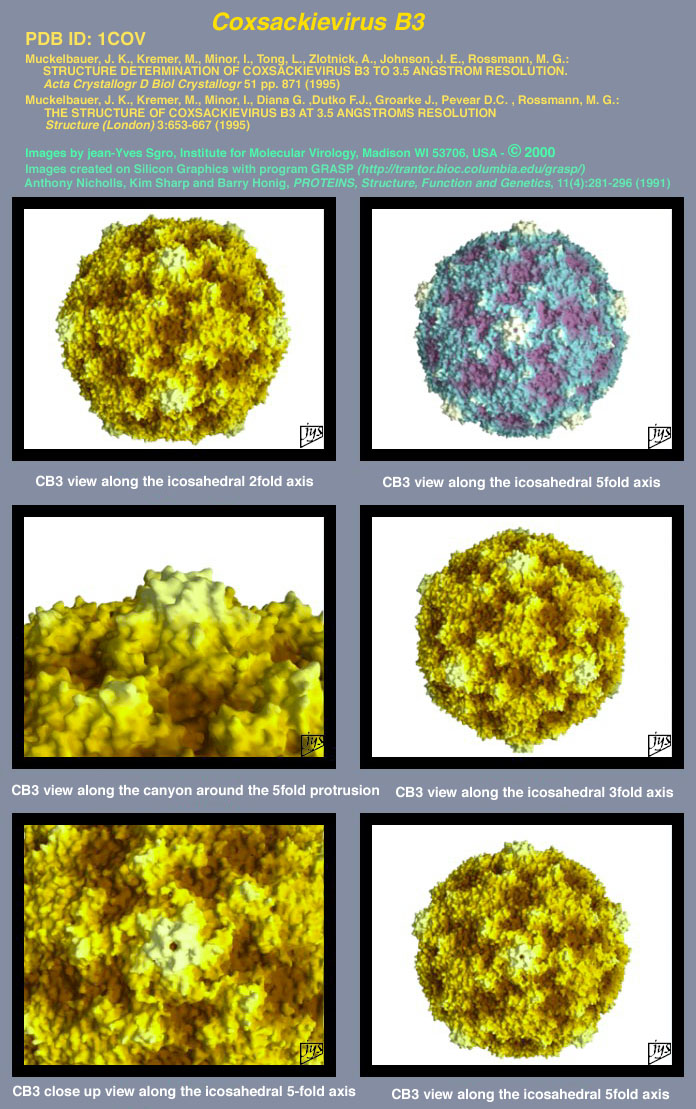 Вирус Коксаки — еще одна из многих причин простуды. Они также вызывают болезнь рук и ног (также известную как HFMD), которая очень распространена среди детей младшего возраста в условиях группового ухода, например, дневного ухода.
Вирус Коксаки — еще одна из многих причин простуды. Они также вызывают болезнь рук и ног (также известную как HFMD), которая очень распространена среди детей младшего возраста в условиях группового ухода, например, дневного ухода.
Типичные симптомы HFMD начинаются с раздражительности и снижения аппетита. За этим следуют легкая лихорадка и насморк, боль в горле, усиление раздражительности и, наконец, через 7–10 дней после появления симптомов — характерная болезненная сыпь с волдырями на ступнях, руках и во рту. После того, как сыпь рассосется, некоторые несчастные дети могут потерять ногти на руках или ногах.
Обычно HFMD означает пару недель мучений для маленьких детей и их родителей. Однако в редких случаях инфекция Коксаки может вызвать острый миокардит (опасный отек сердца) или серьезную инфекцию головного мозга (вирусный менингит). Взрослые тоже могут заболеть этим заболеванием, хотя симптомы часто менее серьезны и редко включают сыпь. Считается, что взрослые менее восприимчивы, потому что к тому времени, когда мы становимся взрослыми, мы уже подверглись воздействию многих вирусов этого семейства и у нас уже есть иммунитет.
Вирусы Коксаки являются частью семейства вирусов, называемых энтеровирусами. Самый известный представитель этого семейства — полиовирусы, но есть и многие другие. Эти вирусы часто распространяются так, как мы вежливо называем «фекально-оральным путем». Значит, какашки во рту. Ага. Вот почему мытье рук важно, люди. В некоторых случаях эти вирусы также могут передаваться воздушно-капельным путем или при прикосновении к волдырям инфицированного человека, а затем засовывании рук в рот.
Вирусы Коксаки и другие энтеровирусы, не связанные с полиомиелитом, очень часто встречаются у маленьких детей.Небольшие вспышки часто регистрируются в учреждениях по уходу за детьми, таких как детские сады, особенно летом и осенью.
Если вы дедушка или бабушка, читая это и думаете: «Я пропустил записку? У моего ребенка такого никогда не было… »Вы правы. 40 лет назад HFMD был гораздо менее распространен, чем сегодня. Со временем они становятся хуже. Мы не знаем, почему вспышки обычно случаются летом и осенью; и, как и грипп, трудно предсказать, какой подтип будет преобладать в каждом сезоне.
Вирусы Коксаки бывают двух видов, называемых группами A и B.Группа A включает вирус, который чаще всего вызывает заболевание рук, ног и рта в Соединенных Штатах, под названием A16. Однако некоторые другие штаммы (особенно A6 и близкий к нему энтеровирус 71) доминируют в других частях мира, особенно в Азии. Эти штаммы также вызывают HFMD, но с большей вероятностью вызывают серьезные симптомы, включая опасные для жизни сердечные и неврологические проблемы.
Вирусы Коксаки типа B, называемые CVB, менее распространены и более загадочны. Инфекция CVB — наиболее частая причина вирусного менингита.Инфекция CVB также связана с диабетом 1 типа и глютеновой болезнью. Хотя никто, кажется, не понимает, почему это так, эпидемиологические данные указывают на связь, и эксперименты на мышах также показали причинную связь. Вспышки CVB часто возникают одновременно с другим энтеровирусом в семье, называемым эховирусом.
Вакцины против вирусов Коксаки нет, но есть по крайней мере одна вакцина, которая проходит испытания на людях, нацеленных на несколько штаммов вирусов Коксаки типа B.
Пока вакцина не доступна, наша лучшая защита от Коксаки — это чистые руки.Мойте руки водой с мылом в течение 20 секунд, особенно после смены подгузников, посещения туалета, кашля / чихания и перед едой. Поощряйте детей также часто мыть руки.
Для любопытных вирусы Коксаки были названы в честь одноименного города, где они были впервые изолированы в 1947 году: Коксаки, Нью-Йорк, США. Их выделил исследователь по имени Гилберт Дальдорф. Дальдорф искал причину полиомиелита, когда выделил другой энтеровирус. Он был одним из первых, кто обнаружил, насколько полезными могут быть мыши для выделения и изучения вируса.
Справочные материалы и ресурсы CDC по заболеваниям рук, ног и рта
Об истоках названия
О перспективах и проблемах вакцины, с 2015 г.
Выполняется фаза 1 клинических испытаний вакцины CVB
Ссылка на оригинальный пост в FB
Coxsackievirus AKA Объяснение болезни рук / ног / рта — Потомакская педиатрия | Rockville, MD
Это очень страшное слово для обозначения болезни, которую нужно избегать!
Вирус Коксаки — это вирус, который обитает в нашем пищеварительном тракте.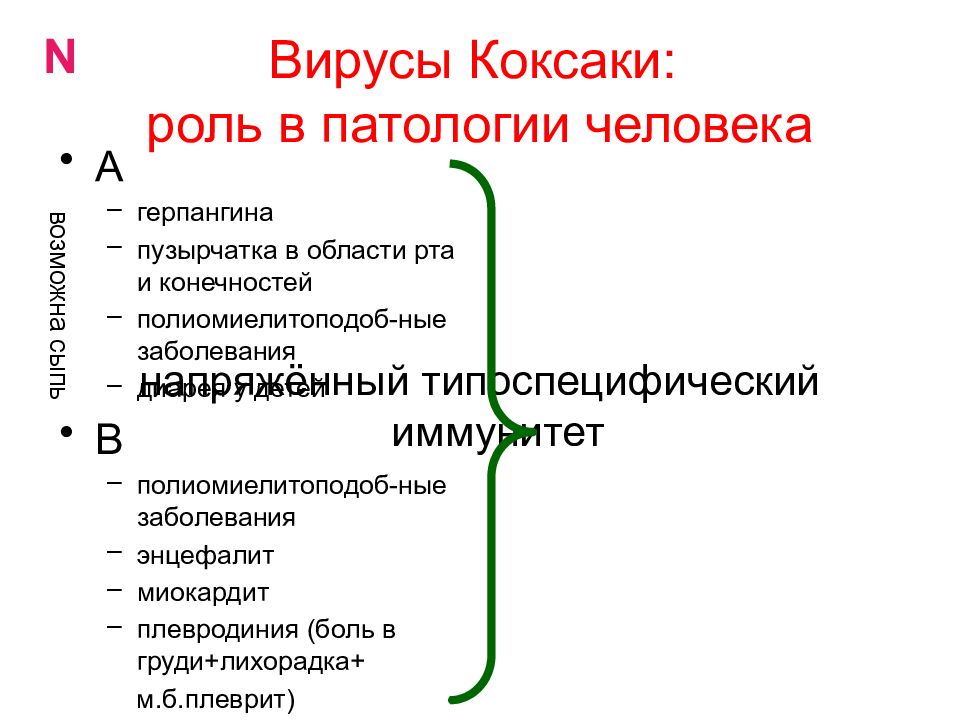 Вирус может передаваться от человека к человеку; обычно с немытыми руками и поверхностями, загрязненными фекалиями (вирус может жить на поверхности в течение нескольких дней — юк!) Он также может распространяться через капли жидкости в воздухе после чихания или кашля.
Вирус может передаваться от человека к человеку; обычно с немытыми руками и поверхностями, загрязненными фекалиями (вирус может жить на поверхности в течение нескольких дней — юк!) Он также может распространяться через капли жидкости в воздухе после чихания или кашля.
Большинство случаев заражения Коксаки происходит летом и осенью, но вспышки могут происходить круглый год. Коксаки может вызывать легкие симптомы гриппа и обычно проходит без какого-либо лечения. Вирус легко распространяется в группах, таких как школа, детские сады и летние лагеря.После заражения вы наиболее заразны в первую неделю болезни.
Признаки и симптомы
Коксаки может вызывать множество различных симптомов. У некоторых детей симптомы отсутствуют, но у других может развиться внезапная высокая температура, головная боль, боли в мышцах, боль в горле, боль в животе и / или тошнота. В большинстве случаев лихорадка Коксаки держится 3 дня. Коксаки также может вызывать болезненные красные волдыри на горле, языке, деснах, твердом небе, на внутренней стороне щек, а также на ладонях и подошвах ног.
Профилактика
Не существует вакцины для предотвращения вируса Коксаки, и поскольку это вирус, антибиотики не помогают при лечении болезни.
Мытье рук — лучшая защита. Напоминайте всем членам вашей семьи о необходимости часто мыть руки, особенно после посещения туалета! И да, папа и мама тоже могут заразиться вирусом!
Лечение
Хотя лекарств для лечения Коксаки нет, некоторые лекарства можно использовать для облегчения симптомов.Ибупрофен и ацетаминофен можно использовать для облегчения боли, связанной с симптомами. Большинство детей полностью выздоравливают через несколько дней без какого-либо лечения. Обязательно предлагайте много жидкости, чтобы предотвратить обезвоживание.
Кроме того, вы можете смешать в равных частях жидкий Детский Бенадрил с Маалоксом или Миланту для создания «Волшебной жидкости для полоскания рта» Просто дозируйте в зависимости от веса ребенка и таблицы дозирования Бенадрила на нашем веб-сайте.


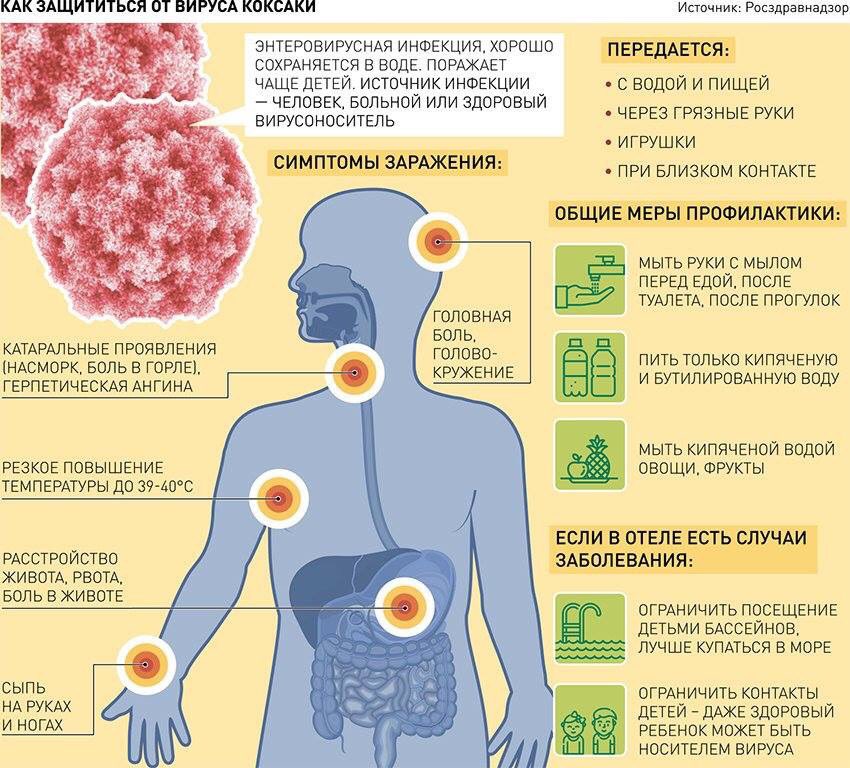 Боль в области таза.
Боль в области таза.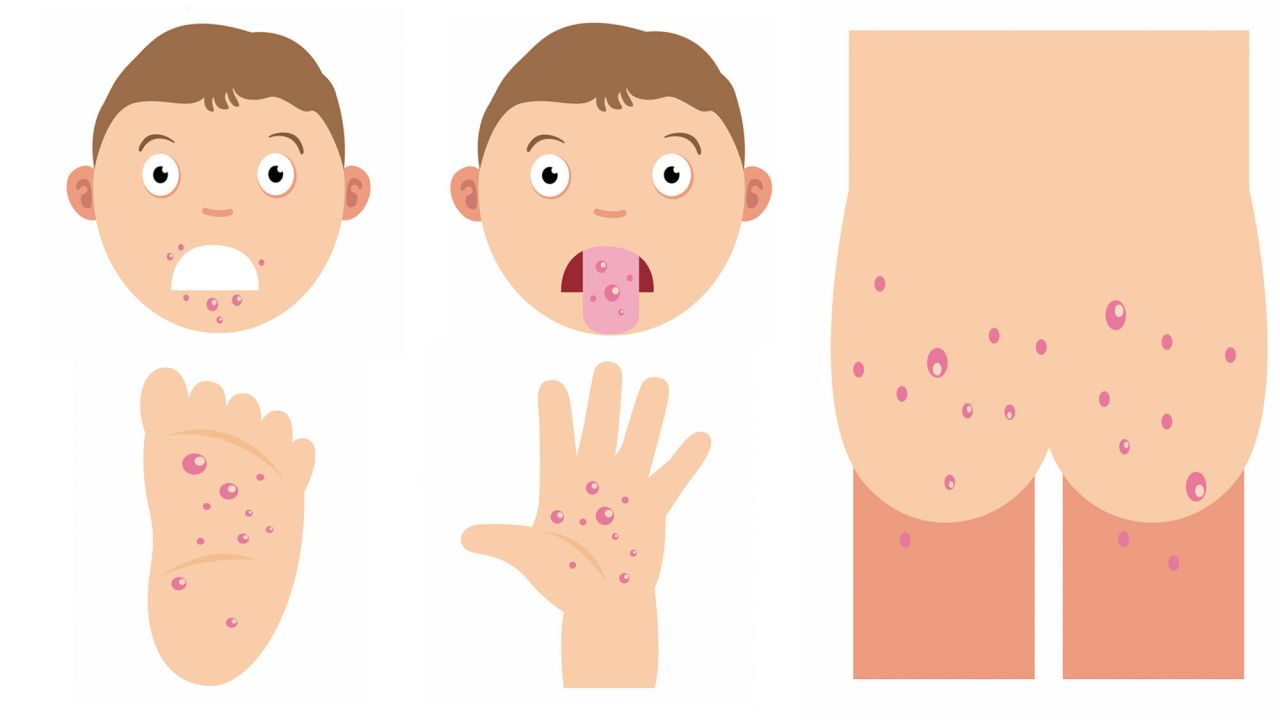
 Пузырьки в ротовой полости обычно не болезненны. Часто у пациентов наблюдается лихорадка в течение 1-2 дней и мелкие красные пятна на коже рук и ног (характерная вирусная экзантема). Поражения чаще всего встречаются на поверхности кожи в нижней части рук и ног. Наиболее распространенным возбудителем является вирус Коксаки группы А.
Пузырьки в ротовой полости обычно не болезненны. Часто у пациентов наблюдается лихорадка в течение 1-2 дней и мелкие красные пятна на коже рук и ног (характерная вирусная экзантема). Поражения чаще всего встречаются на поверхности кожи в нижней части рук и ног. Наиболее распространенным возбудителем является вирус Коксаки группы А. Эти симптомы сопровождаются лихорадкой, головной болью, резким снижением веса, тошнотой и рвотой. Симптомы длятся в течение 2 дней. Вирус Коксаки B3 и B5 поражают межреберные мышцы, вызывая эти пугающие, но редкие вспышки.
Эти симптомы сопровождаются лихорадкой, головной болью, резким снижением веса, тошнотой и рвотой. Симптомы длятся в течение 2 дней. Вирус Коксаки B3 и B5 поражают межреберные мышцы, вызывая эти пугающие, но редкие вспышки.  Заболевание протекает 10 дней.
Заболевание протекает 10 дней.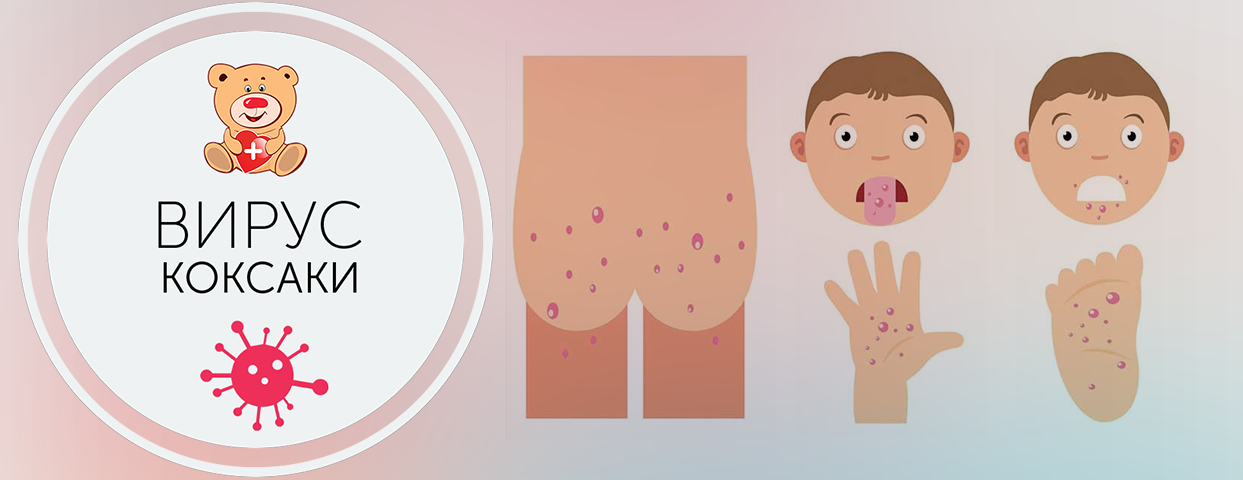 Содержание тропонина I в сыворотке в норме 0—0,5 нг/мл. Проводится при
Содержание тропонина I в сыворотке в норме 0—0,5 нг/мл. Проводится при

 Самый благоприятный период для развития вируса — лето. Поражает в основном детей в возрасте от 3 до 10 лет. Инфицирование в более старшем возрасте может иметь тяжелую форму. Инфекционный процесс преимущественно протекает благоприятно. Очень редко наблюдается развитие вялых параличей, оболочек головного мозга. При инфицировании взрослых этот вирус обычно проявляется воспалением горла, миндалин и простудой. Вирусы Коксаки вызывают такие заболевания как: везикулярный фарингит, менингит, энцефалит, болезнь рук, ног и рта, воспаление сердца и печени, острый геморрагический конъюнктивит. Инфицирование во время беременности приводит к повреждению плода. У лиц с низкой устойчивостью к вирусам Коксаки, они могут присутствовать в организме даже после инфекции и вызвать такие хронические заболевания как: воспаление кишечника, артрит, рецидивирующий перикардит, поражение центральной нервной системы. После перенесенной инфекции устойчивый иммунитет не формируется.
Самый благоприятный период для развития вируса — лето. Поражает в основном детей в возрасте от 3 до 10 лет. Инфицирование в более старшем возрасте может иметь тяжелую форму. Инфекционный процесс преимущественно протекает благоприятно. Очень редко наблюдается развитие вялых параличей, оболочек головного мозга. При инфицировании взрослых этот вирус обычно проявляется воспалением горла, миндалин и простудой. Вирусы Коксаки вызывают такие заболевания как: везикулярный фарингит, менингит, энцефалит, болезнь рук, ног и рта, воспаление сердца и печени, острый геморрагический конъюнктивит. Инфицирование во время беременности приводит к повреждению плода. У лиц с низкой устойчивостью к вирусам Коксаки, они могут присутствовать в организме даже после инфекции и вызвать такие хронические заболевания как: воспаление кишечника, артрит, рецидивирующий перикардит, поражение центральной нервной системы. После перенесенной инфекции устойчивый иммунитет не формируется.