Молекула — хлорид — натрий
Молекула — хлорид — натрий
Cтраница 1
Молекулы хлорида натрия NaCI существуют только в парообразном состоянии. [1]
Молекулы хлорида натрия NaCl существуют только в парообразном состоянии. В твердом ( кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. [2]
Молекулы хлорида натрия NaCi существуют только в парообразном состоянии. В твердом ( кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. [3]
В молекуле хлорида натрия электронная пара локализована на атоме хлора. [4]
Рассмотрим образование молекул хлорида натрия. Во внешнем слое у иона натрия 8 электронов, и он приобретает устойчивую восьмиэлектронную конфигурацию ближайшего инертного газа неона. Атом хлора, получив электрон, становится отрицательным ионом ( анионом) и приобретает устойчивую конфигурацию инертного газа аргона. [5]
Как известно, молекула хлорида натрия состоит из двух, а молекула хлорида бария — из трех атомов, и Аррениус пришел к мысли, что при растворении в растворителях, подобных воде, определенная часть молекул распадается на отдельные атомы. Более того, поскольку эти распавшиеся молекулы проводят электрический ток ( в то время как молекулы, подобные молекуле сахара, не распадаются и не проводят электрический ток), Аррениус предположил, что молекулы распадаются ( или диссоциируют) не на обычные атомы, а на атомы, несущие электрический заряд. [6]
Очевидно, что молекулы хлорида натрия при их растворении в воде делятся на какие-то части. Зная, что молекула не может подвергаться механическому делению на две маленькие молекулы того же хлорида натрия, мы должны искать какое-то иное объяснение ненормально большому давлению. [7]
Следовательно, при растворении 1000 молекул хлорида натрия в растворе появляется 1 000 свободно движущихся ионов натрия и 1 000 свободно движущихся ионов хлора. Таким образом, общее число частиц в 1 мл раствора составляет 2000; отсюда следует, что раствор хлорида натрия должен обнаруживать двойное осмотическое давление, двойное понижение температуры замерзания и двойное повышение температуры кипения. [9]
Где локализована электронная пара в молекуле хлорида натрия. [10]
И с атомом газообразного хлора, когда образуется молекула хлорида натрия NaCl. Атом натрия теряет свой валентный электрон и переходит в состояние иона с одним положительным зарядом; этот электрон захватывается атомом хлора, и последний переходит в состояние иона хлора с одним отрицательным зарядом. [12]
Таким образом, можно сказать, что в молекуле хлорида натрия электронная пара принадлежит атому хлора. [13]
Два атома натрия, соединяясь с молекулой хлора, образуют 2 молекулы хлорида натрия. [14]
Два атома натрия, соединяясь с молекулой хлора, образуют две молекулы хлорида натрия. [15]
Страницы: 1 2 3
Формула хлорида натрия в химии
Определение и формула хлорида натрия
Формула –
Молярная масса равна г/моль.
Физические свойства – в отсутствие примесей прозрачные бесцветные кристаллы с кубической гранецентрированной решеткой.
Слабогигроскопичный, гигроскопичность резко повышается в присутствии естественных примесей, например солей магния.
Плавится и кипит без разложения.
Умеренно растворяется в воде (не гидролизуется).
Растворимость слабо зависит от температуры, но сильно снижается в присутствии соляной кислоты, гидроксида натрия, хлоридов металлов.
Растворяется в жидком аммиаке.
Хлорид натрия является главной составной частью природных залежей каменной соли, сильвинита, рапы соляных озер.
Химические свойства хлорида натрия
- Хлорид натрия вступает в реакции обмена с кислотами:
- Взаимодействует с солями. Необходимое условие протекания реакции: выпадение осадка нерастворимой соли:
- Проявляет слабые восстановительные свойства:
Получение
Хлорид натрия можно получить реакцией обмена:
При взаимодействии карбоната натрия и соляной кислоты:
При действии соляной кислоты на металлический натрий:
Применение
Хлорид натрия является важнейшим пищевым продуктом, служит для консервирования мяса. — один из главных видов химического сырья и применяется для получения , , соды, сульфата натрия.
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
Молекула — хлорид — натрий
Молекула — хлорид — натрий
Cтраница 2
Теперь мы можем высказать третье предположение, что при растворении в воде каждая молекула хлорида натрия распадается на два иона. [17]
Так, атом хлора, сталкиваясь с молекулой натрия, образует атом натрия и молекулу хлорида натрия с возбужденным колебательным уровнем. Молекула, в которой энергия колебаний повышена, сталкивается с атомом натрия, и в результате получается молекула хлорида уже в нормальном ( невозбужденном) состоянии и возбужденный атом натрия. Его возбуждение имеет иной характер: возбуждаются электроны, переходящие на более высокие уровни. Избыточная энергия рассеивается в процессе флуоресценции возбужденных атомов. [18]
Так как ионы натрия и хлора несут противоположные заряды, то они притягиваются друг к другу, образуя единую частицу — молекулу хлорида натрия. [19]
В кристаллической решетке соседние ионы Na и С1 — по сравнению с изолированной молекулой NaCl обладают меньшим числом степеней свободы, поэтому тепловую энергию молекулы хлорида натрия можно рассматривать как ее максимальное значение для пары противоположно заряженных ионов в решетке. К запас ее тепловой энергии составляет 8 68 кДж — моль -, из которой всего лишь около 2 5 кДж — моль — приходится на колебательную энергию, непосредственно вызывающую распад молекул. Это количество термической энергии слишком мало по сравнению с тем, которое надо затратить на разрушение кристаллической решетки ( 762 кДж — моль -), чтобы обеспечить сколько-нибудь заметную диссоциацию хлорида натрия на ионы. [20]
В кристаллической решетке соседние ионы Na и С1 — по сравнению с изолированной молекулой NaCl обладают меньшим числом степеней свободы, поэтому тепловую энергию молекулы хлорида натрия можно рассматривать как ее максимальное значение для пары противоположно заряженных ионов в решетке. К запас ее тепловой энергии составляет 8 68 кДж — моль-1, из которой всего лишь около 2 5 кДж — моль-1 приходится на колебательную энергию, непосредственно вызывающую распад молекул. Это количество термической энергии слишком мало по сравнению с тем, которое надо затратить на разрушение кристаллической решетки ( 762 кДж — моль-1), чтобы обеспечить сколько-нибудь заметную диссоциацию хлорида натрия на ионы. [21]
Если же ионам дать свободу передвижения, расплавив кристаллы или растворив их в воде, полученный расплав или раствор будет проводить ток. Молекула хлорида натрия
Сложными веществами — называются такие, молекулы которых образованы атомами различных элементов. Например, молекула хлорида натрия ( поваренная соль) образована атомш натрия и атомом хлора; молекула воды — двумя атомами водорода и одним атомом кислорода. [24]
Но ведь известно, что механически молекулы не могут делиться на половины. Тогда мы предположим, что молекулы хлорида натрия разделились на атом натрия и атом хлора. [26]
Химическая формула не всегда отражает реально существующие частицы. Например, не доказано существование молекул хлорида натрия как таковых ни в твердом состоянии, ни в водных растворах. Скорее всего это соединение состоит из ионов натрия и хлорид-ионов, и нельзя сказать, что какой-либо из ионов просто связан с другим ионом в молекулу. Тем не менее формула NaCl удобна для стехиометрических расчетов и используется в-них. Необходимо также подчеркнуть, что химическая формула часто относится лишь к основной форме вещества. Например, вода, в жидком состоянии помимо молекул Н2О в небольшом количестве содержит такие соединения, как НзО, ОН, H Oz и несомненно другие. Химическая формула Н2О в этом случае отражает доминирующее соединение, что совершенно достаточно для химических расчетов, но лишь приблизительно описывает действительный состав реального вещества. [27]
Объяснение рекомендуется начать с краткого вступления, в котором напомнить учащимся, что диссоциация на ионы происходит под влиянием молекул воды и в растворах кислот, щелочей, солей присутствуют не молекулы этих соединений, а их ионы. В качестве примера можно привести соли соляной или серной кислоты. Например, молекулы хлоридов натрия, калия, бария, магния в растворе диссоциированы на ионы металла и хлорид-ионы. Если к раствору каждой из этих солей прибавить несколько капель раствора нитрата серебра, то во всех случаях выпадает белый осадок хлорида серебра. Из уравнений реакций, написанных в ионной форме, видно, что образование этого осадка возможно, если только во всех растворах присутствует хлорид-ион. [28]
Согласно современным воззрениям, кристаллическая решетка электролита состоит из ионов, а не из молекул. Иными словами, принимается, что твердые электролиты нацело диссоциированы. Кристалл поваренной соли состоит, таким образом, не из молекул хлорида натрия, а только из ионов натрия и хлора. Каждый ион в кристалле окружен ионами с противоположным зарядом, количество которых определяется координационным числом. Ионы в кристалле находятся под действием кулоновских сил притяжения, величина которых зависит от относительных ионных зарядов и расстояний между ними. Отсюда следует, что на поверхности кристалла на ион действуют меньшие силы притяжения, чем внутри. [29]
Страницы: 1 2 3
www.ngpedia.ru
Натрий молекула двухатомная — Справочник химика 21
Записать С12 пришлось потому, что газообразный хлор состоит из двухатомных молекул, а не из свободных атомов хлора. Кристаллическим хлорид натрия (рис. 1-5) состоит из ионов натрия и хлора, упакованных в трехмерную решетку таким образом, что каждый положительный ион N3 окружен с четырех сторон, а также сверху и снизу отрицательными ионами С1 , а каждый ион С1 точно таким же образом окружен шестью ближайшими соседними ионами Ыа . Подобное расположение положительных и отрицательных зарядов обладает очень большой устойчивостью. [c.30]При высоких температурах вопрос об основном стандартном состоянии элемента во многих случаях существенно усложняется и выбор его становится еще более условным. Пары серы, селена, фосфора, мышьяка, натрия, калия и некоторых других элементов обладают сложным молекулярным составом, который меняется с температурой. Так, в парах серы содержатся в равновесии молекулы 82, 5б, 83 и другие относительное содержание их зависит от температуры и давления. В подобных случаях чаще всего целесообразно принять в качестве основного стандартного состояния элемента газ, состоящий из молекул одинакового состава. Так, в настоящее время в качестве основного состояния для серы и фосфора иногда принимают газ с двухатомными молекулами, а для лития, натрия и калия — газ с одноатомными молекулами. При наличии необходимых данных расчет свойств реального газа не представляет затруднений. [c.24]
Учение о химической связи должно ответить на вопросы почему атомы объединяются в молекулы, кристаллы Почему химические соединения имеют тот или иной состав, то или иное строение Почему, например, атомы водорода объединяются в двухатомные молекулы, атомы углерода образуют кристалл алмаза, а атомы натрия и хлора — ионный кристалл хлорида натрия [c.41]
Однако реакцию можно провести и так, чтобы к каждой молекуле кетона присоединялся только один атом водорода это происходит, например, в тех случаях, когда на кетон в сильнощелочном растворе осторожно действуют натрием, амальгамой натрия или амальгамой магния. При. этом образуются пина коны — двухатомные дитретичные спирты с расположенными рядом гидроксильными группами. Реакция называется пинаконовым восстановлением [c.220]
Известно, что значение первой энергии ионизации атома щелочного элемента, например натрия или калия, выше, чем для двухатомной молекулы, например Ыаг или Кз- Дайте возможное объяснение этому факту, используя энергетическую диаграмму образования химической связи по методу молекулярных орбиталей. [c.67]
В зависимости от соотношения теплот диссоциации и теплот испарения (или сублимации) и от других параметров процесса в одних случаях может преобладать влияние давления, и частицы в насыщенном паре с повышением температуры будут в среднем более сложными, в других (или в другой области температуры) — может преобладать влияние изменения температуры, и частицы в насыщенном паре с повышением температуры будут становиться в среднем менее сложными. Так, в парах металлического натрия при невысоких температурах содержатся почти исключительно одноатомные молекулы, но с повышением температуры (примерно до 2000 К) содержание двухатомных молекул возрастает (рис. 80). В парах же фторида лития при температурах от 900 до 1600 К относительное содержание двойных молекул (LiF) 2 по расчетным данным уменьшается от 60 до 40% (мол.) над кристаллическим LiF и до 20% (мол.) над расплавом LiF около его температуры кипения. [c.236]
Отличие двухатомной молекулы от бесконечного кристалла можно продемонстрировать, вычислив энергию кулоновского притяжения зарядов в обеих системах. Если принять межатомное расстояние в обоих случаях равным Н, то потенциальная энергия взаимодействия зарядов е в молекуле равна— кристалле, однако, каждый ион натрия с зарядом +е окружен шестью ионами хлора с зарядами —е, находящимися от него на расстоянии R, двенадцатью ионами натрия с зарядами +е, находящимися на расстоянии восемью ионами хлора, расположенными на расстоянии ] 3 , и т. д. Потенциальная энергия взаимодействия иона натрия со всеми его соседями, таким образом, равна [c.332]
В табл. 1.1 приведены заимствованные из 22 значения параметров (13е я X для различных двухатомных молекул и рассчитанные с помощью формулы (8) энергии диссоциации. Сопоставление с экспериментально измеренными значениями прочности связей показывает, что двухчленная формула (5) и вытекающие из нее выражения пригодны лишь для приблизительной оценки энергий диссоциации. Тем не менее они правильно передают тенденцию в изменении прочности связи при переходе от одной молекулы к другой. Рассчитанные с помощью (5) значения хотя и завышены, но в среднем не более чем на 20— 30%. Для некоторых молекул (например, водорода, хлора, моноксида углерода, хлорида натрия) они отличаются от экспериментально измеренных энергий диссоциации еще меньше. При этом форма дна потенциальных кривых, очевидно, должна передаваться гораздо лучше, чем полученные экстраполяцией к точке схождения колебательных уровней значения прочности связей. Это обстоятельство весьма существенно, поскольку для реакций с перераспределением реагирующих связей без полного разрыва их наиболее важно правильное описание как раз формы нижних участков потенциальных кривых. [c.19]
Особенности цепных реакций можно выяснить на таком примере. Смесь водорода с хлором при комнатных температурах, как известно, на рассеянном свету может не взаимодействовать практически неограниченное время, так как двухатомные молекулы водорода и хлора достаточно прочны. Однако если ввести в такую смесь платиновую пластинку с активной поверхностью, пары металлического натрия (калия) в небольшом количестве или осветить смесь прямым солнечным светом, то она прореагирует весьма активно в форме взрыва. Рассмотрим, как действуют пары натрия. При обычных температурах молекулы паров натрия преимущественно одноатомны. Атомы натрия очень активны в химическом отношении и легко вступают во взаимодействие с молекулами хлора по уравнению [c.161]
В стандартном состоянии хлор представляет собой газообразные двухатомные молекулы. Поэтому энергия, требующаяся для получения газообразных атомов, равна половине энергии ковалентной связи хлор — хлор (разд. 2.7), т. е. АЯ [Х(г)] = = /2 (С1—С1). Таким образом, в случае хлорида натрия уравнение (3.12) переходит в [c.82]
Электролиты при растворении в воде распадаются (диссоциируют) на ионы — положительные и отрицательные. Свойства ионов совершенно иные, чем у образовавших их атомов. Например, атомы металлического натрия На энергично разлагают воду с выделением водорода, в то время как натрий-ионы Ка» воду не разлагают. Атомы хлора О образуют двухатомные молекулы, которые имеют желто-зеленый цвет и резкий запах. Хлорид-ионы О — бесцветны и не имеют запаха. Ионы водорода Н окрашивают синий лакмус в красный цвет. Но это свойство отсутствует у атомов водорода Н. [c.90]
По химическим свойствам с хлором сходны бром, йод и фтор. Бром. Химический знак брома Вг, его атомный вес равен 80. Молекула брома Вг2 является двухатомной. В природе бром встречается в воде некоторых озер и буровых скважин в виде бромистого натрия, бромистого калия и бромистого магния. [c.82]
Свойства ионов совершенно отличны от свойств образовавших их атомов. Так, атомы металлического натрия Na энергично разлагают воду с выделением водорода, но его ионы Na+ воду не разлагают атомы хлора С1 образуют двухатомные молекулы, ядовитые и с резким запахом, хлорид-ионы 1 не ядовиты и запаха не имеют ионы водорода Н+ окрашивают синий лакмус в красный цвет, тогда как у атомов водорода Н это свойство отсутствует. [c.98]
Так же, как в случае лития, равновесный с конденсированной фазой пар над металлическим натрием состоит из одно-и двухатомных молекул. Доля двухатомных молекул в паре натрия несколько больше, чем у лития. Однако при определении давления пара натрия методами, связанными с использованием при расчетах молекулярного веса, ошибка, вносимая в результаты употреблением молекулярного веса, равного атомному, очень мала и ею можно пренебречь [233, 281]. [c.105]
В более сложных случаях необходимо различать общий характер молекулы и характер отдельных связей. Решающее значение для первого имеет обычно налич.ие или отсутствие иоиов. Если они есть, рассматриваемое вещество ведет себя аналогично построенным на простейших ионных молекул, в противном случае— подобно состоящим из простейших полярных или неполярных. Например, в SO3 ионных связей нет, и точка его плавления лежит при 17 °С, Напротив, в N32804 связи натрия с кислородом иониые, и соль эта плавится лишь нри 882 С. Характер отдельных связей сложного соединения может быть грубо намечен (аналогично случаю двухатомных молекул), если известны свойства входящих в его состав элементов и порядок сочетания их атомов друг с другом. [c.81]
Щеяочные металлы. Характеристика элементов 1А-группы. Сопоставление некоторых физических и химических свойств натрия и лития, с одной стороны, и элементов подгруппы калия — с другой, свидетельствует о том, что натрий ближе к собственно щелочным металлам (подгруппа калия). Поэтому второй типический элемент не выделен в отдельный параграф, чтобы не создавалось впечатление искусственного отделения его от собственно щелочных металлов. В ряду Ка—Сз наблюдается плавное изменение плотности, температур плавления и кипения, а также энергий диссоциации двухатомных молекул Эз и стандартных электродных потенциалов в водных раствор 1Х. Общим для всех щелочных металлов является ярко выраженная электроположительность и химическая активность вследствие больших величин радиусов, малых значений ионизационных потенциалов и ОЭО. Ниже приведены некоторые свойства элементов и простых веществ IА-группы [c.307]
Например, люлекула воды содержит дза атома водорода и один атом кислорода и обладает характерными химическими свойствами индивидуального вещества воды. Даже отдельные молекулы воды, содержащиеся в ее парах, будут реагировать с оксидом натрия. Химически.м путем можно разложить воду иа водород и кислород, прп этом образуются двухатомные молекулы водорода и кислорода, ХилМнческие свойства последних будут иными, нежели химические свойства. молекулы воды. Атомы же кислорода и водорода при разложении воды, как и при всяко.. хнмическо-м превращении, сохранятся — они лишь войдут в состав других молекул. [c.16]
В связи с этим в. Н. Кондратьев и М. С. Зискин [138] высказали точку зре1иш, согласно которой эффективность тушения флуоресценции определяется силами химического взаимодействия возбужденной и тушащей частиц, мерой которых является тепловой эффект возможной химической реакции между этими частицами. В. Н. Кондратьев и М, С. Зис-кии на примере тушения флуоресценции натрия показали, что между тушащим действием различных газов и тепловым эффектом соответствующих химических процессов имеется монотонная зависимость. Распространение рассматриваемой точки зрения на другие системы показывает, однако, что эта зависимость, по-вндимому, ограничивается лишь сходными частицами (например, двухатомными молекулами), из чего нужно заключить, что одним из факторов, определяющих эффективность туше- [c.370]
Первыми из таких сложных радикалов были радикал аммония, исследованный в 1808 г. Дэви и Берцелиусом, и радикал циан, описанный Гей-Люссаком в 1815 г. Квази-металлический характер радикала аммония был установлен Берцелиусом и Понтином , которые получили амальгаму аммония при электролизе раствора аммониевой соли с применением ртутного катода. Тот же самый продукт был получен Дэви при обработке аммониевой соли амальгамой натрия или калия. Гей-Люссак убедительно доказал, что радикал циан, N, ведет себя аналогично галоидам. При нагревании цианида ртути он получил газообразный циан (СМ)г . Не зная, что даже галогены образуют газообразные двухатомные молекулы, например СЬ, он считал газообразный циан свободным сложным радикалом. В результате развития органической химии в течение первой половины девятнадцатого века были описаны некоторые сложные радикалы. Считалось, что многие из них мол[c.9]
Элементарное вещество натрий при комнатной температуре представляет собой мягкий бе.пый металл. Он состоит из атомов, правильно расположенных и образующих структуру (рис. 53), аналогичную описанной выше структуре меди, но н0 идентичную ей. Элементарное вещество хлор представляет собо11 зеленовато-желтый газ, состоящий из двухатомных молекул С12- Металлический натрий горит в хлоре и образует новое вещество, хлористый натрий (обычную поваренную соль) свойства этого соединения совершенно отличны от свойств обоих веществ, из которых оно получено. [c.74]
Отметив аналогию галогенидов калия, натрия, лития и серебра с закисью ртути и меди, Канниццаро принял для них формулу МХ, где М представляет металл, а X — галоген. Относительно многих других металлов, таких, как кальций, барий, магний, цинк, свинец, олово, железо, марганец н др., Канниццаро доказывает, что они образуют галогениды формулы MXg. На основании удельных теплоемкостей элементов он приписывает этим металлам атомные веса, вдвое большие принятых Жераром. Часть Очерка , в которой обсуждаются атомные веса металлов, сравнимых с двухатомными органическими радикалами, хорошо разработана заключительные соображения таковы 1) Все формулы, данные Берцелиусом оксисолям двухатомных металлических радикалов, одинаковы с формулами, мною предложенными как для кислот одноосновных, так и для двухосновных… 2) Все мои формулы также соответствуют формулам Берцелиуса для всех сульфатов и аналогичных солей, если ввести в них изменения, предложенные Реньо, т. е. считать, что количество металла, содержаш егося в молекулах сульфатов калия, серебра, закисной ртути и закисной меди, равно двум атомам и, наоборот, количество металла, содержащегося в молекулах сульфатов окисной ртути, окисной меди, свинца, цинка, кальция, бария и др., равно только одному атому. 3) Формулы, мною предложенные для образованных одноосновной кислотой оксисолей калия, натрия, серебра, водорода этила и всех других аналогичных одноатомных радикалов, равны половине формул, предложенных Берцелиусом и видоизмененных Реньо, т. е. каждая молекула этих оксисолей содержит в своем составе половину молекулы безводной кислоты и половину молекулы окисла металла. 4) Формулы Жерара совпадают с предложенными мною для солей калия, натрия, серебра, водорода, метила и всех других одноатомных радикалов, но не для солей цинка, свинца, кальция, бария и других первичных окислов металлов, поскольку Жерар считал необходимым проводить для всех металлов аналогию с водородом, что, как я показал, ошибочно . [c.215]
Притяжение между двумя одинаковыми атомами хлора с образованием двухатомной молекулы может быть объяснено с помощью уже рассмотренной атомной модели. Число электронов в атоме хлора, равное 17, на единицу меньше, чем в устойчивом атоме аргона. Каждый атом может достигнуть строения аргона, если он воспользуется одним из электронов другого атома, т, е. есл15 два нз тридцати четырех электронов будут одновременно принадлежать каждому из двух атомов. Такие два электрона образуют связь между атомами. Это предположение высказал в 1916 г. Льюис, хотя в то время и не было ясно, как могут два электрона одновременно принадлежать двум атомам. Современный взгляд на двухэлектронную связь будет изложен ниже. Уже указывалось, что при обычных условиях атом С1 не является наиболее устойчивой формой элемента н что он стремится достигнуть аргоновой конфигурации, образуя одну двухэлектронную связь со вторым атомом. Он может достигнуть этого путем образования подобных связей с атомами других элементов, и действительно, хлор соединяется со многими элементами при помощи двухэлектронной связи. Очевидно, что есть и другой путь достижения аргоновой конфигурации, а именно — приобретение лишнего электрона с образованием иона С1 . С другой стороны, такой атом, как натрий, может достигнуть аргоновой конфигурации, теряя один электрон. Поэтому при помещении натрия в газообразный хлор происходит переход электронов от натрия к хлору >с образованием ионов Ыа+ и С1 , Между такими противоположно [c.55]
Уже отмечалось, что атомы в таких простых солях, как НаС1, удерживают друг друга ионными связями. Простая двухатомная молекула N3 — С1 существует в парах хлористого натрия, однако изучить ее структуру нелегко. В разбавленных растворах НаС1 между ионами Ка+ и С1 нет связей, так как каждый ион окружев [c.60]
Полоужение отдельных элементов, а иногда и групп элементов, устанавливалось не сразу, а по мере развития периодического закона. В свое время оживленную дискуссию вызвало размещение водорода в периодической системе. По некоторым химическим свойствам поведе-ние водорода напоминает поведение щелочного металла. По аналогии со щелочными металлами водород образует сольватированные катионы например, натрий образует Ма» » НдО, а водород—Н НзО. Гидрат юка водорода очень прочен и получил название гидроксония, его соычно обозначают НзО . Некоторые системы водород — металл (мсталлэподобные гидриды) напоминают металлические сплавы. Все этл л другие подобные соображения побуждали рассматривать водород кал аналог щелочных металлов и помещать его в периодической системе Б первую группу. Такой точки зрения придерживался и Д. И. Менделеев, располагая водород над литием. Позже было обращено внимание на большое сходство водорода со свойствами галогенов. Подобно последним водород образует двухатомные молекулы На. При взаимо- [c.52]
Элементарной ячейкой хлористого натрия является куб, шесть вершин которого заняты ионами натрия и хлора. В образующейся кристаллической решетке каждый ион натрия окружен шестью ионами хлора, противоположными.ему по знаку электрического заряда, а каждый ион хлора окружен шестью ионами натрия. При таком чередующемся расположении частиц представление о том, что кристалл состоит из молекул ЫаС1 не имеет смысла. Действительно, мы не можем считать, что какой-либо ион, например натрия, связан с вполне определенным из окружающих его шести ионов хлора и образует с ним двухатомную молекулу. Очевидно, что все шесть ионов хлора имеют совершенно одинаковые связи с ионом натрия. То же самое можно сказать о любом ионе хлора, окруженном шестью ионами натрия. Связь между ионами натрия и хлора в кристалле хлористого натрия осуществляется вследствие электростатического притяжения между разноименными зарядами, которое не зависит от направления и характеризуется сферической симметрией. Сила, связывающая два противоположно заряженных иона, определяется законом Кулона [c.110]
Инертные одноатомные газы имеют очень малые поперечные сечения дезактивации Ыа(З Р), тогда как для всех исследованных многоатомных молекул поперечное сечение по порядку величины равно газокинетическому. Ниже показано, что это не связано с переходом энергии в возбуждение внутренних степеней свободы многоатомных молекул. В табл. 4.14 приведены поперечные сечения тушения для ряда двухатомных молекул, полученные на основании данных Принсгейма [5]. В каждом случае для выбранного колебательного уровня процесс тушения сопровождается выделением энергии, причем нет оснований предполагать, что при тушении возбуждаются колебательные уровни, энергия которых больше энергии возбуждения натрия, так как наблюдаемые сечения слишком велики для этого. Только в молекуле Ог имеются электронно-возбужденные состояния, расположенные по энергии ниже состояния Ыа(32Р). Соотношения между поперечным сечением тушения и минимальной энергией, не перехо- [c.293]
Следует отметить, что ионный характер связи должен увеличиваться в бесконечном кристалле по сравнению с двухатомной молекулой. В простой кубической решетке кристалла Na l каждый атом натрия испытывает притяжение не менее шести атомов хлора, а каждый атом хлора — притяжение не менее шести атомов натрия. Отсюда следует, что единственный внешний электрон (35) каждого из атомов Na должен, по-видимо-му, перейти на соседние атомы хлора и что по сравнению с молекулой ионный характер кристалла более выражен. [c.34]
Еще в 1898 г. Эйнхорн описал реакцию фосгенас о-, м и п-ди-оксибензолами. При применении резорцина и гидрохинона были получены полимерные продукты, которые в то время детально не исследовались. Реакция осуществлялась при взаимодействии водного раствора соответствующего фенолята натрия с толуоль-ным раствором фосгена. По другому варианту фосген пропускали через пиридиновый раствор двухатомного фенола. Полученный полимер не содержал хлора, тогда как при проведении реакции в гетерогенной фаза продукт поликонденсации содержал на конце молекулы полимера хлорангидридные группы. [c.48]
Величина отношения теплоемкостей в значительной степени зависит от количества атомов в молекулах продуктов реакции, а поэтому топливо, продукты реакции которого имеют пр ост1з1е молекулы создает бхэльшую скорость струи но храв-нению с топливом, продуктами реакции которого являются более сложные молекулы. Так, например, двухатомный фтористый натрий, имеющий теплоту образования всего 1870 кал/г, яо отношение теплсемкостей 1,286, создает большую теоретическую скорость истечения струи, чЬм пятиатомный четырехфтористый кремний с ДЛ ое= 00 кал/г, но со значением -х, равным лишь 1,083. [c.77]
Схема, характеризующая электронное поглощение двухатомной молекулы, показана на рис. 9.13. Кривая потенциальной энергии, относящаяся к основному состоянию , аналогична по своей форме кривой, характеризующей зависимость энергии от к ежъядерного расстояния для ионов натрия и хлора, приведенной на рис. 1.2. Наиболее устойчивой является комбинация с межатомным расстоянием а, которому соответствует минимум энергии на кривой основного состояния. Для такой молекулы должно существовать несколько возбужденных электронных состояний. На рис. 9.13 показана кривая только для одного из них, а именно возбужденного состояния с наименьшей энергией. Если молекула подвергается облучению, энергия которого соответствует вертикальной линии, показанной на рис. 9,13, то происходит поглощение излучения, сопровождающееся переходом электрона из основного состояния в возбужденное. На рисунке [c.516]
Так, электростатическое взаимодействие в вакууме катиона Ма+ и аниона С1″ приводит к образованию существующей в парах двухатомной молекулы Ма+С1. Взаимодействие этих молекул приводит к их конденсации и образованию ионных кристаллов хлорида натрия МаС1. И в молекуле Ма+С1 , и в кристаллах МаС1 почти не происходит обобществления электронов атом натрия почти полностью отдает свой электрон атому хлора. Оба атома при этом приобретают устойчивые электронные конфигурации благородных газов. [c.147]
Специфические отклонения химических свойств лития и натрия от характеристик их тяжелых аналогов могут быть обоснованы количественно [39, 66 и др.]. На рис. 19, а представлено изменение важнейших физикохимических характеристик щелочных металлов с возрастанием атомного номера. Совершенно отчетливо проявляется немонотонность изменения всех свойств, заключающаяся в резком изломе всех кривых, приходящемся на калий. Действительно, такой излом наблюдается в ходе изменения атомных объемов и радиусов, ионизационных потенциалов, термодинамических характеристик, теплот гидратации, подвижностей ионов в электролитах, энергиях диссоцрхации двухатомных молекул и т. д. [c.83]
chem21.info
Натрий хлорид, строение кристалла — Справочник химика 21
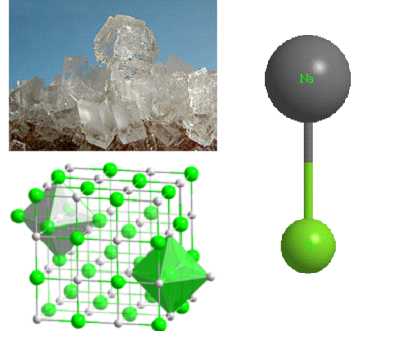
| Рис. 1.1. Строение кристалла хлорида натрия |  |
Ионная связь, обусловленная электростатическим взаимодействием, является не направленной. Ионы с противоположными зарядами притягиваются друг к другу независимо от их положения. Поэтому строение таких кристаллов определяется только геометрическими факторами — числом различных ионов и их радиусами. На рис. Х1П.2 показано строение кристалла хлорида натрия, в котором каждый ион N3+ окружен шестью ионами С1 . В свою очередь, каждый ион С1 окружен [c.161]
Учение о химической связи должно ответить на вопросы почему атомы объединяются в молекулы, кристаллы Почему химические соединения имеют тот или иной состав, то или иное строение Почему, например, атомы водорода объединяются в двухатомные молекулы, атомы углерода образуют кристалл алмаза, а атомы натрия и хлора — ионный кристалл хлорида натрия [c.41]
Охарактеризовать строение кристаллов хлорида натрия и хлорида цезия. [c.301]
Из структуры кристалла хлорида натрия видно, что числовое соотношение атомов натрия и атомов хлора в твердом хлориде натрия равно 1 1 таким же это отношение является и для газообразного хлорида натрия, что определяется строением молекул данного вещества в газообразном состоянии. Из строения молекул воды следует, что числовое отношение атомов водорода и атомов кислорода равно 2 1. Строго определенное строение кристаллов и молекул обусловливается определенными атомными отношениями элементов, входящих в состав веществ. [c.75]
Кристалл хлорида натрия имеет кубическое кристаллическое строение с ац = 5,628 А. В каждой кристаллической ячейке имеется четыре атома натрия (иона натрия) с координатами ООО Ячейка содержит также четыре атома хлора (иона хлора) с координатами [c.41]
В соединениях часто к.ч- равно 3, 4 и 6. Например, в кристалле хлорида натрия, в котором попеременно расположены ионы Na+ и С1 , к. ч. для обоих ионоа одинаково и равно шести. Для ионов, имеющих аналогичное электронное строение, к. ч., как правило, возрастает с увеличением размера иона. Это можно показать на примере анионов кислородсодержащих кислот элементов подгруппы IVA. В соответствии с увеличением размера Э+ в ионах ( +Юз) -, (31+Ю4) — и [5п+ (ОН)б] . — к. ч. Э+ равны соответственно 3, 4 и 6. [c.51]
Большинство твердых веществ имеет кристаллическое строение. Иногда образцы твердого вещества представляют собой монокристаллы, например такие, как кубические кристаллы хлорида натрия в поваренной соли. Некоторые кристаллы достигают очень больших размеров известны природные кристаллы минералов диаметром в несколько метров. [c.31]
Если вы когда-нибудь внимательно рассматривали кристаллы, вас наверняка должно было заинтересовать, что внутри них заставляет атомы или молекулы располагаться в таком совершенном порядке. Обычная соль, которую мы добавляем в пищу, состоит из почти идеальных кубиков с еще более поразительными формами можно познакомиться, выращивая большие кристаллы путем выпаривания растворов различных веществ. Кристаллы интересовали ученых. уже давно, и о внутреннем строении некоторых из них, как, например, хлорида натрия, они догадывались достаточно правильно еще до появления современных методов исследования, основанных на использовании дифракции рентгеновских лучей, и других высокоэффективных методов структурного анализа. [c.168]
В соединениях наиболее часто встречаются координационные числа 3, 4 и 6. Например, в кристалле хлорида натрия, в котором попеременно расположены ионы Ма+ и С1 , координационное число для обоих ионов одинаково и равно шести (см. стр. 265). Для ионов, имеющих аналогичное электронное строение, координационное число, как правило, возрастает с увеличением размера иона это можно показать на примере анионов кислородсодержащих кислот элементов основной подгруппы IV группы. В соответствии с увеличением размера Э+ в ионах (С+Юз) «, (51+Ю4) -и [5п+ (ОН)б координационные числа Э+ равны соответственно 3, 4 и 6. [c.91]
Гемин образует почти черные блестящие иглообразные кристаллы, имеет молекулярную формулу Сз4Нз2С1РеМ404, причем хлорид-ион входит в состав вещества при действии хлорида натрия. Установление строения этого вещества длилось свыше сорока лет (Кюстер, Вильштеттер, Г. Фишер). Важные ключевые сведения дал анализ смесей пиррольных соединений, которые образуются при восстановлении гемина иодистым водородом, а также окисление гемина в гематиновую кислоту [c.611]
Взаимодействие ионов щелочных металлов с ионами хлора носит совершенно иной характер. Прежде всего не удается установить присутствия недиссоциированных молекул в водных растворах уменьшение молекулярной электропроводности может быть, как мы видели выше, объяснено и иным путем. При упаривании раствора газ не выделяется, как в случае хлористого водорода, а остается соль в кристаллическом состоянии, и требуются сравнительно очень высокие температуры, чтобы перевести ее в газообразное состояние. Хотя в этом и заключается характерное различие между кристаллами типа хлористого натрия и кристаллами затвердевшего хлористого водорода и других газообразных или легко летучих при обычной температуре соединений, но все же ранее по аналогии предполагали, что кристаллы типа Na l построены из молекул соответствующих соединений. Недостатком этого представления было то, что на его основе нельзя было объяснить характерное различие в летучестях этих веществ. В дальнейшем эти представления были опровергнуты определением строения кристаллов рентгенографическим способом, показавшим, что кристаллы хлоридов щелочных металлов, так же как и других типичных солей, построены не из молекул, а непосредственно из ионов, образующих эти соединения. [c.230]
Объясните значительное различие в энергии химической сая )и н молекуле и кристалле хлорида натрия исходя из их строения. Какое агрегатное состояние — газовое или кристаллическое более характерно для Na I в обычных условиях [c.122]
При некоторых условиях (оптимальная концентрация исходных растворов, скорость смешения и т. д.) кристаллы Ag l имеют коллоидные размеры, осадок не выпадает и образуется золь. На рис. 12.3 очень схематично Показано строение его частицы в случае избытка хлорида натрия. Центральная часть частицы — ядро — представляет собой кристалл Ag l, в узлах кубической решетки которого находятся положительно заряженные ионы серебра и отрицательные ионы хлора. На поверхности этого кристалла могут адсорбироваться имеющиеся в растворе ионы Na+, NOa и l- (при избытке Na l). [c.260]
Если представить, что между газообразными молекулами воды нет никаких сил взаимодействия, то для достижения этим газом плотности льда при 0 С потребовалось бы давление около 1,27-10 Па. Если такое же допущение сделать в отношении молекул Na l, то для их сжатия до плотности кристаллов хлорида натрия (ii.j = 2,17 кг/м ), потребовалось бы давление около 2,23- Ю Па. При таком же допущении и температуре 210° С для конденсации молекулярного кислорода нужно было бы всего 2,08-10 Па. Приведенные примеры свидетельствуют о том, что переход от газообразного состояния к конденсированному связан с затратой энергии, а следовательно, н с изменением строения этого вещества. Общие положения учения о химической связи остаются справедливыми и по отношению к жидким и твердым веществам, но требуют учета ряда дополнительных факторов, характерных только для конденсированного состояния. Поэтому для полноты представлений о строении вещества необходимо рассмотреть, особенности строения конденсированных сред и в первую очередь кристаллов. [c.318]
Кристалл хлорида натрия имеет кубическое кристаллическое строение с а = 562,8 пм, В каждой структурной единице (элементарной ячейке) имеется четыре атома натрия с координатами О О 0 О /а /г /г О /г Чй Ч2 О, а также четыре атома хлора с координатами Ч2 Ч2 /2 Ч2 О 0 О Ч2 0 О О /г. Начертите схе1му структурной единицы (элементарной кубической ячейки) с указанием положения отдельных атомов. Сколько ближайших соседних атомов имеет каждый атом Каковы расстояния между соседними атомами Какой маогогравник они образуют (Такой тип расположения атомов, называемый типом хлорида натрия, обычно присущ солям.) [c.47]
Если вещество немолекулярного строения образует ионную кристаллическую решетку, например МаС1, его формульной единицей будет условная частица, состоящая из одного иона Ма» и одного иона СГ. Она является условной потому, что в кристалле хлорида натрия нет молекул МаС1, т. к. он состоит из ионов. Но весь этот кристалл можно условно разделить на группы ионов, в каждой из которых будет 1 ион Ма» и 1 ион СГ. Следовательно, формульной единицей хлорида натрия является условная частица, состоящая из 2-х ионов. [c.5]
В качестве примера кристаллических веществ, внутренняя структура которых отвечает ионной решетке, рассмотрим хлорид натрия. На рисунке 7-6, А дана схема строения элементарной ячейки этого вещества. Принимая сферическую форму ионов с определенными эффективными радиусами, внутреннюю структуру кристалла Na следует представить себе как плотную упаковку шаров различного радиуса. Так, эффективный радиус катиона натрия равен 0,098 нм, а аниона хлора—0,181 нм (радиус катиона, как правило, меньше радиуса аниона). На рисунке 7-0, Б представлена структура Na l в виде модели, в которой соблюдены соотношения размеров ноноз при их плотной упаковке. [c.143]
Свойства веществ — это их характерные качества. Рассмотрим, например, хлорид натрия — обычную поваренную соль. Это вещество известно в разных формах в виде мелких крупинок столовой соли, в виде кристаллов диаметром 2—3 мм, используемых для регенерации водоумягчающих минералов или применяемых в смеси со льдом при изготовлении мороженого, наконец, в виде кристаллов природной каменной соли диаметром 5 см и более несмотря на кажущееся различие этих образцов соли, важнейшие их свойства одни и те же. В любом случае кристаллы, будь они мелкими или крупными, ограничены квадратными или прямоугольными гранями разного размера, причем углы между смежными гранями всегда прямые. Для кристаллов характерно различие свойств в разных направлениях, в частности образование граней, ребер и углов. Различные кристаллы соли имеют одинаковое строение при разрушении кристаллы всегда раскалываютх я вдоль плоскостей, параллельных естественным граням образующиеся при этом мелкие кристаллы подобны исходным крупным кристаллам. Самые разнообразные образцы имеют один и тот же соленый вкус. Их растворимость одинакова при комнатной температуре (18 °С) в 100 г воды растворяется 35,86 г соли. Плотность соли (отношение «массы к объему) также одинакова 2,163 г см . [c.17]
Разность между значениями энтальпии образования МН(г.) и МН(к.) равна теплоте сублимации данного кристалла. Для гидридов щелочных металлов это большие количества энергии так, для LiH энергия сублимации составляет 128—(—90) =218 кДж-моль» . Это значение намного больше энергии вандерваальсова притяжения молекул LiH, и, следова тельно, можно сделать вывод, что данный кристалл имеет не молекулярное, а ионное строение со структурой, аналогичной структуре галогенидов щелочных металлов. Методом дифракции рентгеновских лучей удалось установить, что гидриды щелочных металлов содержат гидридный ион Н» они имеют структуру кристалла хлорида натрия с координационным числом 6 для М и Н . При электролизе расплавленных гидридов на аноде выделяется молекулярный водород. [c.548]
chem21.info
Натрия хлорид свойства — Справочник химика 21
Кислотам противостоит группа веществ, называемых основани ями. (Сильные основания получили название щелочей.) Эти вещества имеют горький вкус, химически активны, меняют цвета-красителей, но на противоположные по сравнению с кислотами и т. д. Растворы кислот нейтрализуют растворы оснований. Другими словами, смесь кислоты и основания, взятых в определенной соотношении, не проявляет свойств ни кислоты, ни основания. Эта смесь представляет собой раствор соли, которая обычно химически значительно менее активна, чем кислота или основание. Таким образом, при смешении соответствующих количеств раство- ров сильной и едкой кислоты (соляной кислоты) с сильной и едкой щелочью (гидроксидом натрия) получается раствор хлорида натрия, т. е. обыкновенной поваренной соли. [c.53]Важнейшее химическое свойство оснований — способность образовывать соли с кислотами. Наиример, при взаимодействии перечисленных оснований с соляной кислотой получаются хлористые соли соответствующих металлов —. хлориды натрия или меди [c.41]
Разница в константах обмена отдельных галогенид-ионов, как отмечалось в гл. 3, значительно больше, чем, например, для ионов отдельных щелочных металлов. Иодид-ион сорбируется так сильно, что его трудно десорбировать. Для вымывания этого иона из колонки используют иногда мягкое окисление до свободного иода. С другой стороны, фторид-ион сорбируется очень слабо, слабее других анионов фторид-ион вымывается из колонки соляной кислотой или гидроокисью натрия. Это свойство фторид-иона является большим преимуществом, так как дает возможность определять фтор фотометрическим методом по реакции маскирования комплекса циркония с ализарином или ализарин-комплексоном, которому мешают многие ионы (см. гл. 5). Методом анионного обмена при промывании колонки концентрированным раствором соляной кислоты [671 или буферным раствором аммиака с хлоридом аммония [68] фтор может быть отделен от железа, алюминия и фосфора. При промывании колонки гидроокисью натрия фтор отделяется от силиката, алюмината [69] и фосфата (при этом фтор вымывается первым). [c.216]
Так, хлорид натрия обладает свойством превращаться в процессе электролитического разложения в мягкий металл натрий и зеленовато-желтый газ хлор. Водный раствор хлорида натрия обладает также свойством давать белый осадок при добавлении раствора нитрата серебра хлориду натрия присущи и многие другие химические свойства. [c.19]
При отверждении эпоксидных смол полиаминами большое значение имеет содержание в них хлора > Хлор в эпоксидных смолах может быть в виде свободного (ионного) и связанного (органического). Присутствие ионного хлора обусловлено недостаточной отмывкой смолы от хлорида натрия. Хлориды оказывают влияние на механизм отверждения. Свойства отвержденных смол зависят от содержания хлора в смоле. Ион хлора может блокировать атом азота в третичном амине, применяемом для отверждения. [c.218]
Свойства жидкостей Хлорид натрия Хлорид калия Вода Бензол [c.8]
В процессе исследования восстановительных свойств реагента борогидрид натрия — хлорид алюминия автор наблюдал,, что олефины используют один эквивалент гидрида из реагента. Проверка показала, что олефин быстро превращается реагентом при комнатной температуре в органоборан [43]. [c.185]
Каждое вещество обычно образует кристаллы совершенно определенной формы. Например, хлорид натрия кристаллизуется в форме кубов (рис. 59, а), квасцы в форме октаэдров (рис. 59,6), нитрат натрия в форме призм (рис. 59, в) и т. д. Кристаллическая форма — одио из характерных свойств вещества. [c.159]
Атомы, соединяясь друг с другом, образуют молекулы. При образовании молекул атомы сохраняют свою индивидуальность, несмотря на то, что они при этих процессах испытывают некоторые изменения. Например, атом натрия, соединяясь с атомом хлора, образует молекулу хлорида натрия. Реагирующие атомы сохраняют свою индивидуальность в молекуле хлорида натрия, хотя свойства обоих атомов резко изменились. [c.23]
A) Несмешанные синтетические органические красящие вещества (как химически определенные, так и химически неопределенные соединения) и синтетические органические красящие вещества, разбавленные веществами, которые не обладают красящими свойствами (например, безводный сульфат натрия, хлорид натрия, декстрин, крахмал), для снижения или доведения их красящей способности до стандартной. Добавление небольших количеств поверхностно-активных продуктов для усиления проникновения и фиксации красителя не влияет на классификацию красящего вещества. Красящее вещество, соответствующее этим описаниям, обычно бывает в форме порошка, кристаллов, паст и т.д. [c.280]
Н. С. Полуэктов предложил косвенный каталитический метод определения рения, который основан на свойстве рениевой кислоты и ее солей каталитически ускорять восстановление теллурата натрия хлоридом олова (И) до элементарного теллура. При прочих равных условиях количество восстановленного теллура пропорционально концентрации [c.347]
В тех случаях, когда не требуется существенно изменять физико-механические свойства и условия обработки фотоматериалов не сильно отличаются от стандартных (например, при обработке в жаркое время года, т. е. при повышенной температуре растворов и промывной воды), для повышения прочности фотографических слоев достаточно уменьшить набухаемость желатины. Для этого перед проявлением фотоматериал помещают в раствор какой-либо фотографически инертной соли — сульфата магния, сульфата натрия, хлорида лития и др. (концентрация 20—i 40 г/л). Эти же соли в количестве 15—30 г/л можно ввести в проявитель или другой обрабатывающий раствор, чтобы не проделывать дополнительную операцию. [c.241]
Попов А.И., Кривобок В.И., Шевчук В.Г Влияние хлорида натрия на свойства водных растворов диэтиленгликоля. // Реф.сб. Сер. Подготовка и переработка газа и газового конденсата . вып.З, -М. ВНИИЭГазпром, 1979. [c.37]
Периодическое изменение свойств элементов представлено в периодической таблице современного вида. При расположении элементов в порядке возрастания атомных номеров и группировке на основании общих свойств они образуют семь горизонтальных рядов, называемых периодами. Каждый вертикальный столбец — группа элементов — содержит элементы с близкими свойствами. Группа лития (Ы), состоит, например, из шести элементов. Все эти элементы — крайне реакционноспособные металлы, образующие хлориды и оксиды общей формулы ЭС1 и Э2О соответственно. Так же, как хлорид натрия, все хлориды и оксиды этих элементов — ионные соединения. В противоположность этому группа гелия, расположенная по правому краю таблицы, состоит из крайне инертных элементов (к настоящему времени известны соединения только ксенона и криптона). Элементы группы гелия известны под названием благородные газы. [c.127]
Однако применение метода однотипных реакций в этом случае ограничивается тем, что такие реакции всегда связаны с изменением валентного состояния элементов, а аналогия в свойствах элементов может не распространяться на разные валентные состояния. Так, ионы натрия и калия, содержащиеся в их хлоридах (не будем усложнять вопроса рассмотрением величины их эффективного заряда), обладая устойчивой конфигурацией электронной оболочки, переходят в возбужденные состояния только при очень высоких температурах. А свободные атомы натрия и калия вследствие на личия в них слабо связанного электрона возбуждаются при уме ренно высоких и довольно различных температурах (см. рис. V, 4) [c.183]
Доказать наличие положительно и отрицательно заряженных компонентов в простых неорганических соединениях типа хлорида натрия со временем, действительно, удалось (см. гл. 12). Однако распространить это на органические соединения оказалось значительно сложнее. Так, Берцелиус должен был настойчиво утверждать, что радикалы состоят только из углерода и водорода, причем углерод заряжен отрицательно, а водород — положительно. Он считал, что радикал бензоил (С,НбО) не содержит и не может содержать кислород, который искажает действие, оказываемое этим радикалом. Берцелиус был также уверен, что замещение отрицательно заряженного компонента на положительно заряженный обязательно приведет к резкому изменению свойств соединения. [c.78]
Система может быть гомогенной (однородной) или гетерогенной (неоднородной). Вводя понятия гомогенной или гетерогенной системы, сразу же сталкиваемся с понятием фазы. Иногда достаточно определить фазу как часть системы, которая отделена от других частей поверхностями раздела и механически отделима от них. Это определение фазы будет исчерпывающим, если она непрерывна. Если фаза прерывна, например совокупность кристаллов хлорида натрия или ртути, разлитой на поверхности, под фазой понимают совокупность телесных комплексов, обладающих одинаковым химическим составом и термодинамическими свойствами. [c.183]
Огнегасительные свойства воды повышают, растворяя в ней такие соли, как двууглекислый натрий, хлорид натрия, хлорид кальция, хлорид алюминия. При тушении волокнистых веществ и материалов для улучшения смачиваемости в воду добавляют поверхностно-активные вещества (смачиватели) типа сульфано-лов, сульфанатов и др. [c.220]
Н. С. Полуэктов 3 предложил косвенный каталитический метод определения рения, который основан на свойстве рениевой кислоты и ее солей каталитически ускорять восстановление теллурата натрия хлоридом олова (II) до элементарного теллура. При прочих равных условиях количество восстановленного теллура пропорционально концентрации рения, которую можно определить, измерив светопоглощение коллоидного раствора теллура, после введения в него защитного коллоида. Этим методом можно ч)нределять от 0,001 до 0,1 мпг рения с точностью 10—20%, Молибден мешает определению. Азотная кислота подавляет реакцию. Другие кислоты также влияют на интенсивность окраски. Доп. перев. [c.380]
Полиакрилонитрил представляет собой порошок белого цвета или аморфную массу, легко растираемую в порошок. В отличие от других акриловых полимеров полиакрилонитрил не растворяется в обычных растворителях. Он растворяется в диметил-формамиде и концентрированных растворах некоторых неорганических солей — хлорида цинка, рода-нидов натрия и кальция, бромида лития и др. Полинак имеет относительно высокую теплостойкость. При нагревании в атмосфере азота до 200 °С свойства полиакрилонитрила не изменяются, при 220— 230 °С он размягчается и одновременно разлагается с выделением аммиака, а при 270 °С — с выделением цианистого водорода. В случае продолжительного нагревания при более низких температурах (до 100 °С) изменяется окраска полимера, уменьшается его растворимость. [c.47]
Реагентная коагуляция состоит в предварительном введении в очищаемую жидкость особых реагентов (коагулянтов), обеспечивающих перевод в осадок коллоидных и дисперсных примесей и загрязнений (посторонние масла, продукты деструкции СОЖ и жизнедеятельности микрооргаииз ,юв и др.). Коагулянты представляют собой соединения, способные гидролизоваться в воде с образованием хлопьевидных структур, обладающих высокими адсорбционными и адгезионными свойствами. Коллоидные частицы загрязнений, сталкиваясь с хлопьями гидролизованного коагулянта, прилипают к ним или механически захватываются рыхлыми агрегатами хлопьев и вместе с ними выпадают в осадок или отфильтровываются. В качестве коагулянтов используются сульфат алюминия, алюминат натрия, хлорид железа, сульфат железа, квасцы алюмокалиевые и др. Технология применения коагулянтов изложена в работе [26]. При очистке СОЖ в ВДр- [c.153]
Морыганов и Ростовцев изучали зависимость субстантивных свойств анилида, ж-нитроанилида и п-анизидида -оксинафтойной кислоты (Нафтолы А5, А5—В5 и АЗ—КЬ) от условий нафтолирования , например от количества щелочи, температ> ры, добавки спирта, пиридина, формальдегида и защитных коллоидов. Они нашли, что изменение количества щелочи от 3—4 до 12—14 молей на моль нафтола в очень малой степени сказывается на субстантивности нафтолятов. При этом, для Нафтолов АЗ и АЗ—ВЗ характерно наличие небольшого максимума адсорбции, который не наблюдается у Нафтола АЗ—КЬ. Доба1Вка ализаринового масла, как правило, повышает субстантивность нафтолов в щелочном растворе, напротив, добавление спирта, пиридина, желатины и клея понижает ее. Добавление соли резко повышает субстантивность нафтолов , в то время как формальдегид понижает субстантивность Нафтолов АЗ и АЗ—КЬ, однако повышает субстантивность Нафтола АЗ—ВЗ. С повышением температуры субстантивность нафтолов падает. По данным Набара и сотрудников, адсорбция нафтолов увеличивается, достигает максимума и затем падает при добавлении возрастающих количеств едкого натра, хлоридов, сульфата или фосфата, а также мыла. Было найдено, что скорость адсорбции больше при высокой температуре, чем при низкой. [c.770]
Близость свойств натрия и лития обусловливает их взаимозамещаемость в организме. В связи с этим при избыточном введении ионов натрия или лития в организм они способны эквивалентно замещать друг друга. На этом основано введение натрия хлорида при отравлении солями лития. В соответствии с принципом Ле Шателье равновесие между ионами натрия и лития в организме сдвигается в направлении выведения ионов что приводит к снижению его концентрации и достижению лечебного эффекта. Известные примеры влияния взаимозамещения натрия и лития на активность ферментативных процессов показывают, что в четырех случаях из пяти натрий является синергистом лития и только в одном случае антагонистом. [c.233]
Основное свойство полиэтиленоксидов состоит в том, что они обладают выраженным дегидратирующим (поглощающим влагу) действием на ткани, которое по силе превосходит 10% раствор натрия хлорида в 20 раз, а по времени действия — в 10 раз (рис. 19.1). В силу высокой способности к гидратации полиэтиленоксидный гель активно абсорбирует раневой экссудат, а вместе с ним и микробные токсины, продукты распада тканей, а также различные биологически активные вещества — липосомальные ферменты и другие медиаторы воспалительного процесса, обрывая таким образом его прогрессирующее течение. [c.236]
С 1810 г. Гей-Люссак и Тенар работали над цианидом водорода H N, который, как они показали, представляет собой кислоту, хотя и не содержит кислорода. (Это открытие, как и открытие Дэви установившего примерно в то же время, что хлорид водорода — кислота, опровергали представление Лавуазье о том, что кислород является характерным элементом кислот.) Гей-Люссак и Тенар обнаружили, что группа N (цианидная группа) может переходить от соединения к соединению, не разлагаясь на отдельные атомы углерода и азота. Группа N ведет себя во многом как единичный атом хлора или брома, поэтому цианид натрия Na N имеет некоторые общие свойства с хлоридом натрия Na l и бромидом натрия NaBr . [c.76]
Щелочные металлы в природе. Получение и свойства щелочных металлов. Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. Натрий и калнй принадлежат к распространенным элементам содержание каждого из них в земной коре равно приблизительно 2% (масс.). Оба металла входят в состав различных минералов и горных пород силикатного типа. Хлорид натрия содержится в морской воде, а также образует мощные отложения каменной соли во многих местах земного шара. В верхних слоях этих отложений иногда содержатся довольно значительные количества калия, преимущественно в виде хлорида илн двойных солей с натрием и магнием. Однако большие скопления солей калия, имеющие промышленное значение, встречаются редко. Наиболее важными из них являются соликамские месторождения в СССР, стассфуртские в ГДР и эльзасские — во Франции. Залежи натриевой селитры находятся в Чили. В воде многих озер содержится сода. Наконец, огромные количества сульфата натрия находятся в заливе Кара-Богаз-Гол Каспийского моря, где эта соль в зимние месяцы толстым слое.м осаждается на дне. [c.562]
Некоторые вещества не проявляют ни основных, ни кислотных свойств, поэтому их называют нейтральными. Вода, хлорид натрия (Na l), обычный сахар (сахароза 12h32O11) — примеры нейтральных соединений. [c.66]
По причинам медицинского характера людям с высоким давлением крови рекомендуют ограничить содержание ионов натрия в пище. Хлорид калия служит доступным заменителем обычной поваренной соли Na l. Напишите формулу хлорида калия. Почему его свойства напоминают свойства хлорида натрия [c.134]
Исследовано влияние количества и свойств растворенных солей на разделение суспензий глинистых сланцев [220]. Опыты проведены с применением анионоактнвного, катионоактивного и неионогенного флокулянтов в присутствии хлоридов натрия, кальция и магния, карбонатов натрия, кальция и магния, сульфатов натрия, магния, железа и алюминия при концентрации 100—5000 ч. на 1 млн. Установлено, что эффективность действия флокулянтов зависит от концентрации и валентности ионов солей, причем влияние этих факторов на каждый флокулянт различно. [c.196]
Характерной особенностью кристаллов является анизотропия, или векториальность, свойств, т. е. неодиЕШКовость механических, тепловых, электрических, оптических свойств но различным направлениям. Например, если из кубического кристалла хлорида натрия вырезать два бруска — один перпендикулярно граням куба, другой по диагонали одной из граней — и испытать их иа разрыв, то окажется, что для разрыва второго бруска потребуется сила вдвое большая, чем для разрыва первого бруска. Анизотропия проявляется и в других свойствах кристаллов (теплопроводность, электрическая проводимость, поляризация света и пр.). В отличие от кристаллов аморфные тела, подобно жидкостям, и ю-тропны, т. е. их свойства проявляются одинаково, независимо от направления, в котором они измеряются. [c.68]
chem21.info
Какая связь в хлориде натрия
Какой тип связи у хлорида меди?
Ионная кристаллическая решётка, ионная связь
Химическая связь между катионами и анионами, обусловленная их взаимным притяжением, называется. Схема образования ионной связи в хлориде натрия 35.
В каком состоянии NaCl(поваренная соль) состоит из отдельных молекул. Ответ по-объемнее.
Перманганат калия плюс хлорид натрия. Какие продукты получаться?
Ядовитый газ хлор и ещё несколько несъедобных продуктов!
Рассмотренная нами схема образования ионов показывает, как между атомом натрия и атомом фтора образуется химическая связь, которую называют ионной.Прокомментируйте схему образования ионной связи в хлориде кальция
Какая масса осадка образуется при взаимодействии 600г хлорида кальция с 200г фосфата натрия?
3CaCl2+2Na3PO4 = Ca3(PO4)2 + 6NaCl
Молярная масса хлорида кальция 40+2*35,5=111 г/моль
Фосфата натрия 3*23+31+4*16=164
Фосфата кальция 3*40+2*31+8*16=310
Хлорида кальция взяли 600/111=5,4 моль
Фосфата натрия 200/164=1,22 моль
Соотношение их в реакции 3/2, поскольку 5,4/1,22>3/2, значит, полностью прореагирует фосфат натрия и считаем по нему. Если фосфата натрия 1.22 моль, то фосфата кальция получится 1,22/2=0,61 моль, а его масса равна 0,61*310=189.1 грамм
Хлори д на трия химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий. Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является.
Помогите с химией пж! при действии нитрата серебра на хлорид натрия какой осадок выпадает?
Какой тип связи имеют вещества 1) NaCL 2) CL2 3) h3O
Ионная, ковалентная неполярная, ковалентная полярная
Оглавление. Состав. Форма выпуска. Фармакологическое действие. Показания к применению. Натрия хлорид инструкция по применению. Хлорид натрия 10 — инструкция по применению. Хлорид натрия 9 — инструкция по применению. Противопоказания. Побочные действия.
В молекуле какого вещества химическая связь имеет ионный характер ?
Оксид
Синонимы обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, натриевая соль соляной кислоты, Sodium chloride, NaCl, хлористый натрий, галит.При растворении в воде, связи хлорида натрия распадаются и образуются Na , Cl-ионы, которые…
Например — хлорид натрия (поваренная соль)
Какой тип химической связи в молекулах NaCl, N2, h4P. Определите степень окисления элементов в соединениях.
NaCl — ионное соединение, образовано ионной связью, то есть связью между ионами Na(+) и Cl(-).
N2 — молекула азота образована неполярной ковалентной связью, поэтому степень окисления азота равна (0).
Н3Р — молекула фосфина образована ковалентной полярной связью, поэтому степень окисления Н (+1),у фосфора Р (-3).
НАТРИЯ ХЛОРИД . Natrii chloridum. Синонимы хлористый натрий, поваренная соль. Свойства.Повышение концентрации раствора до 3-5 % в 10-20 раз увеличивает содержание натрия хлорида в межтканевой жидкости.
NaCl связь ионная, так как они сильно различаются электроотрицательностью.
N2 связь ковалентная, неполярная, так как атомы образующие молекулу имеют одинаковую электроотрицательность
Н3Р связь ковалентная полярная, так как молекула образована атомами неметаллов, с разной электроотрицательностью
Гидролиз хлорида натрия.
Ты тролль и вопрос твой бессмысленный. Гидролиз это что такое?
Хлорид натрия можно гидролизовать паром, перегретым выше 500 С.
Частицы хлористого натрия проникают через слой льда на поверхность дорожного покрытия, что, в результате, ослабляет связь междуСоздание оптимальных смесей хлоридов натрия и кальция позволит применять препарат при более низких температурах, чем хлористый натрий.
Даже если считать что перепутали «гидролиз» с электролизом (речь ведь идет о электродах) , то красной жидкости не получается. На медных электродах получается что-то зеленое и мутное. Проверено на практике.
Ну таки да, хлорид натрия — соль сильной кислоты и сильного основания, и гидролизу не поддается.
Получилась у тебя безводная закись меди.
На катоде происходит разложение воды с образованием водорода и щелочи:
К (-): 2h3O + 2e = h3 + 2OH(-).
В щелочной среде возрастает перенапряжение на аноде. Поэтому медь растворяется только до одновалентного иона. :
А (+): Сu(0) -e = Cu(+).
Закись меди образуется вследствие смешение анолита с католитом, то есть:
2Cu(+) + 2OH(-) = Cu2O + h3O.
Чтобы запустить процесс, электролит нужно греть, там рабочий диапазон температур 70-80 градусов. С другой стороны, если ты на клеммы подал ток с розетки на кухне (а ты именно так и сделал) , то ничего удивительного.
P.S.: Хлор бы здесь точно не получился ).
Какая масса осадка сульфата бария образуется при взаимодействии хлорида бария 3,5 моль сульфата натрия?
Помогите какая связь — ковалентная или ионная — в веществах: поваренная соль; вода; оксид; серы; хлорид алюминия?
HCLh3O,SOH-ковалентная полярная, ALCL-ионная
Для чего необходим хлористый натрий? Об этом вы узнаете из материалов представленной статьи. Состав, описание и упаковка.Как говорилось выше, хлористый натрий содержит в себе такой действующий элемент, как натрия хлорид.
В каком количестве воды следует растворить 30 Г хлорида натрия для получения 7% раствора
1. Зная массу вещества и массовую долю — находите массу раствора.
2. Из массы раствора вычитаете массу соли, это и будет количество воды в г.
А В результате взаимодействия растворов нитрата алюминия и сульфида натрия образуются гидроксид алюминияДля определения массовой доли хлорида алюминия в полученном растворе необходимо знать массу образовавшегося хлорида алюминия и массу раствора
В какой массе воды нужно растоворить 25 г. Хлорида натрия, для получения 0,15 м Раствор соли
2800 примерно
Международное наименование — sodium chloride-vial. Состав и форма выпуска. Раствор для инфузий прозрачный, бесцветный. В 1 л содержится натрия хлорид — 9 г. Вспомогательные вещества вода д и — до 1 л.
Какая масса хлорида натрия и какая масса воды необходима для приготовления 800 г 20 %-ного раствора NaCl?
Какая масса хлорида натрия, содержащего 5% примесей, потребуется для осаждения 0,2 моль нитрата серебра из раствора
Какую среду имеет водный раствор фосфат натрия, карбонат калия, хлорид цинка, сульфат натрия
Щелочную, щелочную, кислую, нейтральную.
SODIUM CHLORIDE латинской название активного вещества НАТРИЯ ХЛОРИД. Коды ATX B05XA31 Электролиты в комбинации с другими препаратами B05D Растворы для перитонеального диализа B05AA07 Hydroxyethylstarch B05AA05 Dextran B05BB Растворы…
Помогите срочно какой тип химической связи в Nh3,NaCl
Какая масса осадка, образуется при сливани хлорида меди с раствором гидроксида натрия массой 36г.?
CuCl2 +2NaOH=Cu(OH)2+2NaCl
36/40=0,9 моль гидроокиси
Осадка по молям в 2 раза меньше образовалось, т. е. 0,45 моль
0,45 *97,6 (молекулярная масса гидрооксида меди) =43,92 грамма
Ответ 43,92 грамма
Sodium Chloride Натрия хлорид инструкция и применениеРусское названиеНатрия хлоридЛатинское название вещества Натрия хлоридФармакологическая группа вещества Натрия хлоридРегуляторы водно-электролитного баланса и КЩСВспомогательные вещества…
Какой вид химической связи в nacl
Ионная, образованная ионами металла и неметалла:)
Натрий хлорид. Что Вам необходимо знать о натрия хлориде. Получаете ли Вы достаточно питательных веществ, для того чтобы удовлетворить потребности своего организма? Каковы функции натрия хлорида в организме?
Типичная ионная
Какую связь имеют молекулы хлорида натрия, воды, фторида кальция, озона, аммиака, сероводорода брома?
1) Соединения, образовавшиеся путем притяжения ионов, называются гетерополярными, или ионными. (FrF – самое типичное ионное соединение, NaCl- хлорид натрия) . Образование таких соединений получается из атомов, резко отличающихся по значению электроотрицательности, в результате перехода электронов от атомов одних элементов к другим.
2) Ковалентная неполярная связьвозникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
3) Ковалентная полярная связьвозникает между атомами различных неметаллов (HCl, CO2, N2O) – электронное облако связи смещается к атому с большей электроотрицательностью.
4) В 80-х годах XIX в. М. А. Ильинскийи Н. Н. Бекетовустановили, что атом водорода, соединенный с атомом фтора, кислорода или азота, способен образовывать еще одну дополнительную связь – то есть некоторые водородосодер-жащие группы атомов образуют химическую связь, электроотрицательные атомы которой входят в состав молекулы. Этот вид связи получил название водородная связь.
(modernlib.ru/books…olga/spargka…)
Основным способом получения гидроксида натрия является электролиз водного раствора хлорида натрия. В ходе электролиза на катоде разряжаются ионы водорода и одновременно вблизи.
Составьте схемы процессов электролиза расплава и раствора хлорида натрия. Какое практическое значение имеют эти процессы
В обоих случаях на аноде выделяется хлор. Однако расплав соли на катоде даст металлический натрий, а раствор — водород + NaOH. Какое практическое значение — решайте сами.
ПЛОТНОСТЬ РАСТВОРОВ ХЛОРИДА НАТРИЯ NaCl ПРИ 200C.
Хлорид натрия — натрий +хлор2 (электролиз расплава) (Значение — получение простых веществ — которых нет в природе в таком виде)
2 воды + хлорид натрия — водород2 + хлор2 = гидроксид натрия
Купрум 2 гидрооксид +натрий хлорид=…. какие вещества получатся???
Никаких новых не получится, они не будут реагировать между собой
Ветеринарные препараты. Ветеринария болезни. Заболевания животных, правила иразведения и ухода за ними, о симптомах наиболее часто встречающихся болезней и мерах их предупреждения.
dsrodnichok.ru
