Цитомегаловирус (ЦМВ) или вирус герпеса 5 типа, – ДНК-содержащий вирус Cytomegalovirus hominis семейства Herpesviridae. Цитомегаловирусная инфекция (ЦМВИ) человека – хроническая антропонозная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса и клинических проявлений – от латентной инфекции до клинически выраженного генерализованного заболевания. Отличительными особенностями инфекции являются возможность ЦМВ персистировать во многих органах и способность его к инфицированию практически всех клеток организма человека, что предопределяет многообразие клинических проявлений, как при врожденной, так и приобретенной формах инфекции. ЦМВ рассматривается в качестве основного возбудителя внутриутробной инфекции, имеющей самые различные исходы: от инфицирования без реализации инфекции, формирования пороков развития и заболевания новорожденных до гибели плода и мертворождения. ЦМВ широко распространен, но из-за того что инфицирование, как правило, протекает бессимптомно, большинство заразившихся не подозревают о том, что они носители вируса. Иногда заболевание напоминает инфекционный мононуклеоз: повышается температура, болит горло, увеличиваются лимфатические узлы. В дальнейшем ЦМВ сохраняется внутри клеток в неактивном состоянии. Но если организм окажется ослаблен, то вирус снова начнет размножаться. Беременной особенно важно знать, была ли она заражена ЦМВ в прошлом. Именно это определяет, опасен ли вирус для плода и новорожденного ребенка. Если женщина раньше уже была заражена, то риск для ребенка минимален. |
Анализ cytomegalovirus igm – сдать по цене 490 руб. в Москве
Описание
Цитомегаловирус (ЦМВ) принадлежит к семейству герпесвирусов (5 тип) и входит в группу TORCH инфекций, которые не опасны для человека со здоровым иммунитетом, но сопряжены с определенным риском для будущего ребенка, если первичное инфицирование матери произошло во время беременности.
По данным серологических исследований цитомегаловирусом инфицированы более 70% взрослого населения России . В большинстве случаев иммунная система подавляет активность возбудителя заболевания, заразившийся человек может не подозревать об инфекции. Несмотря на бессимптомное течение, вирус не выводится из организма и сохраняется в клетках в неактивном состоянии пожизненно. Если иммунитет ослаблен, возможно обострение латентной цитомегаловирусной инфекции (ЦМВИ).
При контакте иммунной системы с цитомегаловирусом вырабатываются несколько классов антител — IgG, IgM, IgA и др. Антитела IgM обнаруживаются в крови раньше других, они появляются на 5 – 7 день после инфицирования и сохраняются в крови в среднем около 1,5 месяцев после заражения (в отдельных случаях до полугода). Определение титра IgM играет важную роль в диагностике первичной ЦМВИ, особенно во время беременности.
Методика исследования
Иммунохемилюминесцентный анализ, ИХЛА
Единицы измерения
Индекс позитивности (the cut-off index), рассчитанный путем измерения соотношения signal/cutoff (S/CO).
Материал для исследования
- Сыворотка крови
Для исследования на IgM к цитомегаловирусу используется сыворотка, выделенная из венозной крови. Забор крови в лаборатории производится с использованием закрытых одноразовых вакуумных систем. Процедура выполняется быстро и безболезненно.
Интерпретировать результаты анализа может только врач с учетом анамнеза и данных других исследований.
Информация на странице не предназначена для самодиагностики и самолечения.
Проконсультируйтесь с лечащим врачом.
В какое время лучше сдавать кровь из вены
Желательно сдавать кровь в интервале с 8:00 до 11:00 часов утра после 8 – 12 часового ночного голодания (натощак). Вы можете сдать кровь и в другое время суток — главное, чтобы со времени последнего легкого приема пищи прошло не менее 4 – 5 часов.
Какие факторы могут повлиять на результат анализа
- Прием препаратов-иммуносупрессоров;
- Иммунодефицитные состояния.

Уровень IgM и IgG может быть ниже, чем ожидается при острой форме ЦМВИ, из-за слабого иммунного ответа.
Интерпретация результатов
Анализ на антитела IgM к цитомегаловирусу – качественный / полуколичественный. Оценивается соотношение S/CO (signal/cutoff). Референсные значения: 0 — 0,7 .
- Отрицательный результат <0,9
Антитела IgM к цитомегаловирусу не выявлены. Отрицательный результат позволяет с высокой вероятностью исключить инфицирование в период за 3 – 4 недели до анализа. - Сомнительный результат 0,9-1,1
Обнаружены антитела класса IgM к цитомегаловирусу, возможно первичное заражение ЦМВИ или реактивация инфекции в организме. Чтобы более точно оценить вероятность первичного инфицирования, при выявлении антител IgM рекомендуется провести анализ на авидность IgG антител к цитомегаловирусу.
Антитела к цитомегаловирусу класса IgM и IgG в крови.
 Цитомегаловирус, обнаружение ДНК
Цитомегаловирус, обнаружение ДНКЗначение анализа
Антитела к цитомегаловирусу IgM являются показателями впервые возникшей инфекции или указывают на обострение уже имеющейся. Антитела IgG к цитомегаловирусу (CMV, ЦМВ) также помогают определить первичную инфекцию или осуществлять динамическое наблюдение при подтверждённом диагнозе ЦМВ. Например, при тяжёлой вирусной инфекции антитела IgG к цитомегаловирусу (CMV, ЦМВ) вырабатываются медленно.
Антитела IgG к цитомегаловирусу (CMV, ЦМВ), которые определяются последовательно и многократно у новорожденных, позволяют отличить врождённую инфекцию от заражения уже после родов. Если антитела IgG к цитомегаловирусу (CMV, ЦМВ) нарастают по титру во время беременности, её искусственное прерывание иногда бывает единственным решением. Если же антитела IgG к цитомегаловирусу (CMV, ЦМВ) обнаружены, но титры их во время беременности не нарастают, то оснований для тревоги нет.
Анализ на антитела к цитомегаловирусу: расшифровка
Антитела IgG и IgM к цитомегаловирусу (CMV, ЦМВ) важно определять при подготовке к зачатию, у беременных женщин и при наличии признаков иммунодефицита.
Если антитела IgG к цитомегаловирусу (CMV, ЦМВ) колеблются в пределах значений от 0 до 6 Ед/мл, значит инфекция отсутствует, либо заражение произошло не позже 3-4 недель назад. Этот показатель указывает и на невозможность внутриутробной инфекции (если не обнаружено IgM).
Если анализ на антитела к цитомегаловирусу IgG положительный и выше 6 Ед/мл, или обнаружены IgM, можно говорить об острой инфекции. Анализ на антитела к цитомегаловирусу IgG положительный указывает также на вероятность появления внутриутробной инфекции.
ЦМВ — антитела к цитомегаловирусу
Anti-CMV-IgG (Антитела класса IgG к цитомегаловирусу, ЦМВ, CMV)ЦМВ — антитела к цитомегаловирусу — инфекция, диагностика, лечение — описание диагностики, показания к выполнению, расшифровка результатов.
Anti-CMV-IgG (Антитела класса IgG к цитомегаловирусу, ЦМВ, CMV) – антитела, которые образуются клетками иммунной системы в ответ на проникновение в организм цитомегаловируса.
Цитомегаловирус — представитель семейства вирусов герпеса. Он может существовать в организме человека всю жизнь. ЦМВ присутствует в слюне, крови, моче, семенной жидкости, грудном молоке. Передаётся ЦМВ через слюну пользовании общими столовыми приборами или при поцелуях; половым путём; при грудном вскармливании от матери к ребёнку ; при переливании крови.
Поэтому у женщин детородного возраста цитомегаловирус обнаруживается в 80% случаев. При нормально функционирующей иммунной системе ЦМВ не проявляет себя никакими симптомами, некоторые переносят цитомегаловирусную инфекцию как обычную ОРВИ. Другими словами, наличие вируса в организме не влечёт за собой болезнь, большинство людей, инфицированных ЦМВ, не болеет им. На фоне ослабленного иммунитета вирус проникает в различные органы, вызывая клинические проявления болезни – гепатит, колит, пневмонию, эзофагит.
Для беременной женщины и плода опасно лишь заражение, наступившее во время беременности. Вирус проникает к плоду через плаценту, наиболее опасно инфицирование в первых 12 недель беременности, во время формирования основных органов и систем будущего ребёнка.
Заражение беременной женщины также протекает бессимптомно, нет признаков инфицирования плода цитомегаловирусом, которые бы обнаруживались при ультразвуковом исследовании. Единственный способ определить присутствие вируса в организме – обнаружение антител к нему в крови.
Антитела класса IgG (Anti-CMV-IgG) образуются в первые недели после заражения цитомегаловирусом и остаются на всю жизнь. Поэтому обнаружение их в крови женщины указывает на текущую цитомегаловирусную инфекцию или на перенесённую в прошлом ЦМВ-инфекцию.
Инфицирование ЦМВ на ранних сроках беременности приводит к самопроизвольному прерыванию беременности. Заражение после 12 недели чаще приводит к внутриутробному инфицированию и поражению определенных органов, что проявляется у ребёнка после рождения: поражение печени (фетальный гепатит), нарушение слуха, петехии, микроцефалия, малый вес при рождении.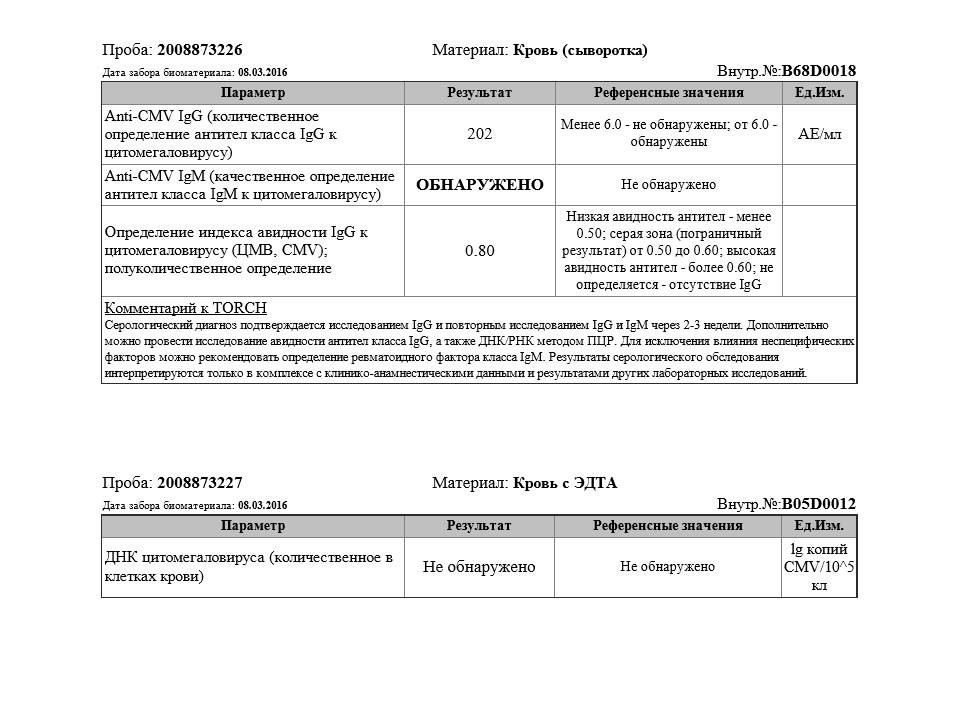 Лабораторно врождённая ЦМВ-инфекция проявляется повышенным билирубином, низким содержанием тромбоцитов. Обнаружение постоянного уровня антител Anti-CMV-IgG указывает, что плод был заражен во время беременности, а увеличение их концентрации в динамике характерно для инфицирования в родах или послеродовом периоде.
Лабораторно врождённая ЦМВ-инфекция проявляется повышенным билирубином, низким содержанием тромбоцитов. Обнаружение постоянного уровня антител Anti-CMV-IgG указывает, что плод был заражен во время беременности, а увеличение их концентрации в динамике характерно для инфицирования в родах или послеродовом периоде.
Если во время планирования беременности у женщины обнаружены антитела к ЦМВ, повторное исследование не требуется. В случае, когда до наступления беременности антитела к ЦМВ не выявлялись, следует определять их один раз в месяц, чтобы своевременно определить первичное заражение, самое опасное для будущего ребёнка.
Если Anti-CMV-IgG обнаруживаются в крови беременной женщины, а при последующих анализах их титр нарастает, это указывает на прогрессирование цитомегаловирусной инфекции. В данной ситуации возможно рассмотрение вопроса об искусственном прерывании беременности.
Полностью удалить вирус из организма человека невозможно, однако грамотное применение лекарственных препаратов позволяет максимально удерживать инфекцию в «спящем» состоянии.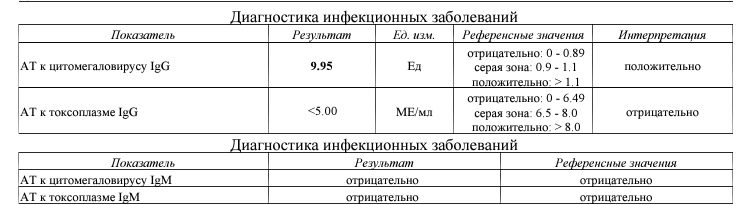
Цитомегаловирусная инфекция относится к группе TORCH-инфекций (название формируется из первых букв латинских названий болезней — Toxoplasma, Rubella, Cytomegalovirus, Herpes), которые представляют опасность для развития ребёнка, если заражение ими происходит после наступления беременности.
Показания к выполнению анализа
ЦМВПланирование беременности.
Обследование беременных женщин.
Невынашивание беременности.
Признаки внутриутробного инфицирования плода.
Угнетение иммунной системы при ВИЧ-инфекции, злокачественных опухолях, приёме цитостатиков.
Увеличение печени и селезёнки неясной этиологии.
Атипичная пневмония у детей.
Лихорадка неясного происхождения.
Подготовка к исследованию
От последнего приёма пищи до взятия крови временной промежуток должен быть более восьми часов.
Накануне исключить из рациона питания жирные продукты, не принимать спиртные напитки.
За 1 час перед взятием крови на анализ нельзя курить.
Не рекомендуется сдавать кровь сразу после выполнения флюорографии, рентгенографии, УЗИ, физиотерапевтических процедур.
Кровь на исследование сдают утром натощак, исключается даже чай или кофе.
Допустимо пить обычную воду.
За 20-30 минут до исследования пациенту рекомендован эмоциональный и физический покой.
Материал для исследования
Венозная кровь.
Расшифровка результатов анализа на
ЦМВНорма: антитела класса IgG к цитомегаловирусу отсутствуют.
- Отсутствует инфицирование цитомегаловирусом.
- Инфицирование цитомегаловирусом произошло 2-3 недели назад, но антитела класса ещё не образовались. Необходима оценка уровня антител класса IgM и повторное определение IgG через 2 недели.
Обнаружение антител Anti-CMV-IgG:
- Первичное заражение цитомегаловирусом (с момента заражения прошло 2-3 недели).
- Перенесённая ранее ЦМВ-инфекция.

- Обострение ЦМВ-инфекции на фоне ослабленного иммунитета.
- Носительство цитомегаловируса.
Обнаружение антител иммуноглобулина G к антигенам цитомегаловируса методом иммуноферментного анализа с захватом антител.
J Clin Microbiol. 1986 декабрь; 24(6): 998–1003.
Эта статья была процитирована другими статьями в PMC.Abstract
Описан иммуноферментный анализ с захватом антител (ИФА), в котором используется антиген, меченный пероксидазой хрена, для обнаружения антител иммуноглобулина G (IgG) к цитомегаловирусу (ЦМВ). Планшет для микротитрования покрывали античеловеческим IgG и последовательно инкубировали с образцами сыворотки, меченым ферментом антигеном ЦМВ, полученным из ядер клеток, инфицированных ЦМВ, и субстратом.Содержание антител CMV IgG определяли спектрофотометрически и выражали как оптическую плотность. Кроме того, для выявления каких-либо неспецифических реакций все сыворотки тестировали против меченого ферментом контрольного антигена, полученного из ядер неинфицированных клеток. Проблема с неспецифическими реакциями была небольшой, и ее удалось обойти путем добавления к конъюгатам немеченого контрольного антигена. Для эпидемиологических исследований тест не был столь чувствительным, как другие серологические тесты. С другой стороны, ИФА с захватом антител IgG был высокочувствительным для выявления серологического гуморального ответа у пациентов с первичной и рецидивирующей ЦМВ-инфекцией.Таким образом, одна положительная сыворотка оставалась положительной при разведении сыворотки 1:10(7). Специфичность теста была продемонстрирована блокирующим экспериментом и тестированием 126 сывороток с положительной фиксацией комплемента, из которых 97% были положительными. Отмечалась довольно хорошая корреляция между тестом связывания комплемента и иммуноферментным методом захвата антител IgG (rs = 0,79, P менее 0,001). Этот тест особенно полезен, когда тесты на антитела к ЦМВ классов IgM, IgA и IgE проводятся с помощью аналогичных ИФА с захватом антител, поскольку используются одна и та же процедура и конъюгат.
Проблема с неспецифическими реакциями была небольшой, и ее удалось обойти путем добавления к конъюгатам немеченого контрольного антигена. Для эпидемиологических исследований тест не был столь чувствительным, как другие серологические тесты. С другой стороны, ИФА с захватом антител IgG был высокочувствительным для выявления серологического гуморального ответа у пациентов с первичной и рецидивирующей ЦМВ-инфекцией.Таким образом, одна положительная сыворотка оставалась положительной при разведении сыворотки 1:10(7). Специфичность теста была продемонстрирована блокирующим экспериментом и тестированием 126 сывороток с положительной фиксацией комплемента, из которых 97% были положительными. Отмечалась довольно хорошая корреляция между тестом связывания комплемента и иммуноферментным методом захвата антител IgG (rs = 0,79, P менее 0,001). Этот тест особенно полезен, когда тесты на антитела к ЦМВ классов IgM, IgA и IgE проводятся с помощью аналогичных ИФА с захватом антител, поскольку используются одна и та же процедура и конъюгат.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (1.1M) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Selected References .
Избранные ссылки
Эти ссылки находятся в PubMed. Возможно, это не полный список литературы из этой статьи.
- Андерсен ХК.Связывающие комплемент и вируснейтрализующие антитела при цитомегаловирусной инфекции в сравнении с гомологичным и гетерологичным антигеном. Acta Pathol Microbiol Scand B Microbiol Immunol. 1970; 78 (4): 504–508. [PubMed] [Google Scholar]
- Andersen P, Andersen HK. Гладкомышечные антитела и другие тканевые антитела при цитомегаловирусной инфекции. Клин Эксп Иммунол. 1975 окт; 22 (1): 22–29. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- Bonfanti C, Meurman O, Halonen P.
 Обнаружение специфического антитела иммуноглобулина M к вирусу краснухи с использованием меченого ферментом антигена.Дж. Клин Микробиол. 1985 июнь; 21 (6): 963–968. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Обнаружение специфического антитела иммуноглобулина M к вирусу краснухи с использованием меченого ферментом антигена.Дж. Клин Микробиол. 1985 июнь; 21 (6): 963–968. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Booth JC, Hannington G, Tryhorn Y, Stern H. Антитело IgM, связывающее комплемент к цитомегаловирусу. J Med Virol. 1980;5(3):183–193. [PubMed] [Google Scholar]
- Cappel R, de Cuyper F, de Braekeleer J. Быстрое определение антител IgG и IgM к цитомегаловирусу с помощью твердофазного иммуноферментного анализа (ELISA). Арх Вирол. 1978;58(3):253–258. [PubMed] [Google Scholar]
- Gut JP, Spiess C, Schmitt S, Kirn A.Экспресс-диагностика острой паротитной инфекции с помощью прямого иммуноферментного анализа с захватом антител иммуноглобулина М с меченым антигеном. Дж. Клин Микробиол. 1985 март; 21 (3): 346–352. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hekker AC, Brand-Saathof B, Vis J, Meijers RC. Непрямой иммунофлуоресцентный тест для выявления антител IgM к цитомегаловирусу.
 J заразить дис. 1979 г., октябрь; 140 (4): 596–600. [PubMed] [Google Scholar]
J заразить дис. 1979 г., октябрь; 140 (4): 596–600. [PubMed] [Google Scholar] - Kangro HO, Booth JC, Bakir TM, Tryhorn Y, Sutherland S. Обнаружение антител IgM против цитомегаловируса: сравнение двух радиоиммуноанализов, твердофазного иммуноферментного анализа и иммунофлуоресцентного теста на антитела.J Med Virol. 1984;14(1):73–80. [PubMed] [Google Scholar]
- Kiefer DJ, Phelps DA, Halbert SP. Нормализованный иммуноферментный анализ для определения антител иммуноглобулина G к цитомегаловирусу. Дж. Клин Микробиол. 1983 г., июль; 18 (1): 33–39. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Линде Г.А., Хаммарстрем Л., Перссон М.А., Смит С.И., Сундквист В.А., Варен Б. Вирус-специфическая активность антител различных подклассов иммуноглобулинов G и A при цитомегаловирусных инфекциях. Заразить иммун.1983 г., октябрь; 42 (1): 237–244. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Meurman OH, Ziola BR. Вмешательство ревматоидного фактора класса IgM в твердофазный радиоиммуноанализ специфичных к краснухе антител IgM.
 Джей Клин Патол. 1978 г., май; 31 (5): 483–487. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Патол. 1978 г., май; 31 (5): 483–487. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Naot Y, Barnett EV, Remington JS. Способ предотвращения ложноположительных результатов иммуноферментных анализов иммуноглобулина М из-за присутствия как ревматоидного фактора, так и антинуклеарных антител.Дж. Клин Микробиол. 1981 г., июль; 14 (1): 73–78. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Subba Rao PV, McCartney-Francis NL, Metcalfe DD. МикроИФА на авидин-биотин для быстрого измерения общего и аллерген-специфического IgE человека. Дж Иммунол Методы. 1983 г., 25 февраля; 57 (1–3): 71–85. [PubMed] [Google Scholar]
- Robertson PW, Kertesz V, Cloonan MJ. Устранение ложноположительных реакций иммуноглобулина М-флуоресцентных антител к цитомегаловирусу с фракциями иммуноглобулина М сыворотки. Дж. Клин Микробиол.1977 г., август; 6 (2): 174–175. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- Салонен Э.М., Вахери А., Суни Дж., Вагер О. Ревматоидный фактор при острых вирусных инфекциях: вмешательство в определение антител IgM, IgG и IgA в иммуноферментном анализе.
 J заразить дис. 1980 г., август; 142 (2): 250–255. [PubMed] [Google Scholar]
J заразить дис. 1980 г., август; 142 (2): 250–255. [PubMed] [Google Scholar] - Саров И., Андерсен П., Андерсен Х.К. Иммуноферментный анализ (ИФА) для определения антител IgG к цитомегаловирусу человека. Acta Pathol Microbiol Scand B.1980 г., февраль; 88 (1): 1–9. [PubMed] [Google Scholar]
- Schmitz H, Doerr HW, Kampa D, Vogt A. Твердофазный иммуноферментный анализ на антитела иммуноглобулина М к цитомегаловирусу. Дж. Клин Микробиол. 1977 г., июнь; 5 (6): 629–634. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- Schmitz H, von Deimling U, Flehmig B. Обнаружение антител IgM к цитомегаловирусу (CMV) с использованием меченого ферментом антигена (ELA). Джей Ген Вирол. 1980 г., сен; 50 (1): 59–68. [PubMed] [Google Scholar]
- Torfason EG, Källander C, Halonen P.Твердофазный радиоиммуноанализ сывороточных антител IgG, IgM и IgA к цитомегаловирусу. J Med Virol. 1981;7(2):85–96. [PubMed] [Google Scholar]
- van Loon AM, Heessen FW, van der Logt JT, van der Veen J.
 Прямой иммуноферментный анализ, в котором используется антиген, меченный пероксидазой, для определения антител иммуноглобулина М к цитомегаловирусу. Дж. Клин Микробиол. 1981 март; 13 (3): 416–422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Прямой иммуноферментный анализ, в котором используется антиген, меченный пероксидазой, для определения антител иммуноглобулина М к цитомегаловирусу. Дж. Клин Микробиол. 1981 март; 13 (3): 416–422. [Бесплатная статья PMC] [PubMed] [Google Scholar] - van Loon AM, van der Logt JT, Heessen FW, van der Veen J.Количественное определение антител иммуноглобулина Е к цитомегаловирусу с помощью иммуноферментного анализа с захватом антител. Дж. Клин Микробиол. 1985 апр; 21 (4): 558–561. [Статья бесплатно PMC] [PubMed] [Google Scholar]
- van Loon AM, van der Logt JT, van der Veen J. Иммуноферментный анализ для измерения антител против цитомегаловируса и вируса краснухи в одном разведении сыворотки. Джей Клин Патол. 1981 г., июнь; 34 (6): 665–669. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Вейторп М.Твердофазный ИФА против IgM для выявления специфических антител IgM к краснухе. Acta Pathol Microbiol Scand B. 1981 Apr; 89 (2): 123–128. [PubMed] [Google Scholar]
Статьи из Journal of Clinical Microbiology предоставлены здесь с разрешения Американского общества микробиологии (ASM)
Обнаружение антител к цитомегаловирусу с помощью биосенсора на основе эллипсометрии изображений
Аннотация
Фон
Цитомегаловирус (ЦМВ) является наиболее распространенной инфекционной причиной умственной отсталости у новорожденных в развитых странах. Существует острая необходимость в создании метода раннего выявления и высокопроизводительного скрининга ЦМВ-инфекции с использованием портативных устройств обнаружения.
Существует острая необходимость в создании метода раннего выявления и высокопроизводительного скрининга ЦМВ-инфекции с использованием портативных устройств обнаружения.
Методы
Сообщается о методе анализа антител для обнаружения и идентификации антител ЦМВ в сыворотке с использованием биосенсора на основе эллипсометрии с высоким пространственным разрешением (BIE). Антиген CMV (CMV-3A) иммобилизовали на кремниевых пластинах и использовали для захвата антител CMV в сыворотке. Антитело против иммуноглобулина G человека (анти-IgG) использовали для подтверждения антитела IgG против CMV, захваченного CMV-3A.
Результаты
Наши результаты показывают, что этот анализ является быстрым и специфичным для идентификации антител IgG против ЦМВ. Кроме того, сыворотку пациента количественно оценивали с использованием метода стандартной кривой, и количественные результаты согласовывались с твердофазным иммуноферментным анализом. Чувствительность обнаружения антител к ЦМВ методом BIE достигала 0,01 МЕ/мл.
Выводы
Этот новый биосенсор может быть ценным диагностическим инструментом для анализа антител IgG против ЦМВ во время скрининга инфекции ЦМВ.
Образец цитирования: Sun H, Qi C, Niu Y, Kang T, Wei Y, Jin G, et al. (2015) Обнаружение антител к цитомегаловирусу с помощью биосенсора на основе эллипсометрии изображений. ПЛОС ОДИН 10(8): e0136253. https://doi.org/10.1371/journal.pone.0136253
Редактор: Gotthard Kunze, IPK, ГЕРМАНИЯ
Поступила в редакцию: 3 апреля 2015 г.; Принято: 3 августа 2015 г.; Опубликовано: 21 августа 2015 г.
Авторское право: © 2015 Sun et al.Эта статья находится в открытом доступе и распространяется в соответствии с лицензией Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах документ и его вспомогательные информационные файлы.
Финансирование: Лабораторная работа авторов поддерживается грантами Яньтайского фонда развития науки и техники (2012128), Молодежного фонда преподавателей Медицинского университета Биньчжоу, Национального фонда естественных наук (81202516), Природного фонда провинции Шаньдун. Научный фонд (ZR2013HL039), План развития науки и технологий Шаньдунской академии медицинских наук (2014-08 гг.), Специальный фонд агронаучных исследований в общественных интересах (201303045), Национальный проект разработки ключевых научных инструментов и оборудования Китая (2012YQ0), Национальная программа фундаментальных исследований (Проект 973) Китая (2009CB320300), Национальная программа фундаментальных исследований Китая (2009CB320302), Национальная программа развития исследований в области высоких технологий Китая (2008AA02Z419), Международная программа научно-технического сотрудничества Китая (2012DFG31880), Проекты китайско-португальского научно-технического сотрудничества на 2010–2015 гг. , Национальный фонд естественных наук Китая. (21305147) и Проект по разработке приборов Китайской академии наук (KJCX2-YW-M04, KJCX2-YW-M03).
, Национальный фонд естественных наук Китая. (21305147) и Проект по разработке приборов Китайской академии наук (KJCX2-YW-M04, KJCX2-YW-M03).
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
ЦМВ является наиболее распространенной инфекционной причиной умственной отсталости у новорожденных в развитых странах [1]. Выявление антител к ЦМВ эффективно для систематического скрининга на ЦМВ-инфекцию [2]. Например, анализ авидности иммуноглобулина G (IgG) ЦМВ может помочь отличить первичную ЦМВ-инфекцию от непервичной [3-5]. Основными иммунными методами, используемыми для обнаружения антител к ЦМВ, являются: иммуноферментный анализ (ИФА) [6], Elecsys [7], электрохемилюминесцентный иммуноанализ (ECLIA) [8], иммунофлуоресцентный анализ (ИФА) [9], проточная цитометрия (FCM). ) [10] и иммуноблоты [11].Кроме того, были разработаны новые иммунные методы обнаружения антител к ЦМВ, такие как иммуноанализ хемилюминесцентных микрочастиц (CMIA) [12] и белковые микрочипы [13, 14]. Однако эти методы имеют присущие им ограничения, такие как продолжительность тестирования, потребность в дорогостоящем оборудовании, специальных навыках, низкая чувствительность и сложные процессы подготовки образцов. Например, обычный ИФА по-прежнему является основным диагностическим тестом на ЦМВ, и доступны коммерческие наборы ИФА для ЦМВ.Хотя ИФА часто используется в качестве сравнительного метода для обнаружения антител к ЦМВ [13], к его очевидным недостаткам относятся необходимость метки-индикатора, промывка планшета, непрямой формат обнаружения и продолжительность времени, необходимого для тестирования. Таким образом, срочно необходим быстрый, простой, прямой и высокопроизводительный метод обнаружения антител к ЦМВ.
Однако эти методы имеют присущие им ограничения, такие как продолжительность тестирования, потребность в дорогостоящем оборудовании, специальных навыках, низкая чувствительность и сложные процессы подготовки образцов. Например, обычный ИФА по-прежнему является основным диагностическим тестом на ЦМВ, и доступны коммерческие наборы ИФА для ЦМВ.Хотя ИФА часто используется в качестве сравнительного метода для обнаружения антител к ЦМВ [13], к его очевидным недостаткам относятся необходимость метки-индикатора, промывка планшета, непрямой формат обнаружения и продолжительность времени, необходимого для тестирования. Таким образом, срочно необходим быстрый, простой, прямой и высокопроизводительный метод обнаружения антител к ЦМВ.
Первый биосенсор на основе визуализирующей эллипсометрии (BIE) был разработан в 1995 г. [15,16]. По сравнению с описанными выше методами преимущества BIE очевидны, и . г ., высокопроизводительный мультиплексный анализ и количественное экспресс-тестирование без меток. Предыдущие приложения BIE в основном были сосредоточены на биомедицинских областях [17,18], таких как высокопроизводительная диагностика маркера вируса гепатита B (HBV) [19,20], обнаружение вируса птичьего гриппа (AIV) [21] и антитела против выявления тяжелого острого респираторного синдрома (ТОРС) [22]. Таким образом, биосенсорная технология предлагает важные инструменты для диагностики заболеваний. Таким образом, недавно были разработаны новые приложения, в том числе для анализа взаимодействия между тропомиозиновыми аллергенами и антителами [23] и взаимодействия между растворимыми белками рецептора прикрепления фактора, чувствительного к N-этилмалеимиду (SNARE) [24].Однако до настоящего времени BIE не применялся для обнаружения антител ЦМВ, особенно для идентификации антител IgG и IgM к ЦМВ.
Предыдущие приложения BIE в основном были сосредоточены на биомедицинских областях [17,18], таких как высокопроизводительная диагностика маркера вируса гепатита B (HBV) [19,20], обнаружение вируса птичьего гриппа (AIV) [21] и антитела против выявления тяжелого острого респираторного синдрома (ТОРС) [22]. Таким образом, биосенсорная технология предлагает важные инструменты для диагностики заболеваний. Таким образом, недавно были разработаны новые приложения, в том числе для анализа взаимодействия между тропомиозиновыми аллергенами и антителами [23] и взаимодействия между растворимыми белками рецептора прикрепления фактора, чувствительного к N-этилмалеимиду (SNARE) [24].Однако до настоящего времени BIE не применялся для обнаружения антител ЦМВ, особенно для идентификации антител IgG и IgM к ЦМВ.
Целью данного исследования было выявление антител против CMV-3A в сыворотке пациентов с помощью микрочипа BIE с CMV-3A, а также специфическое выявление захваченных антител IgG против CMV. Антитела против ЦМВ качественно определяли с помощью BIE, а затем к области с захваченным антителом ЦМВ добавляли козье антитело против IgG человека (анти-IgG) для подтверждения антитела IgG против ЦМВ.Стандартная кривая, представляющая различные градиенты концентрации, также была построена для количественного определения антител к ЦМВ. Таким образом, концентрацию антител к ЦМВ в сыворотке определяли количественно с помощью BIE, а затем сравнивали с помощью ELISA.
Антитела против ЦМВ качественно определяли с помощью BIE, а затем к области с захваченным антителом ЦМВ добавляли козье антитело против IgG человека (анти-IgG) для подтверждения антитела IgG против ЦМВ.Стандартная кривая, представляющая различные градиенты концентрации, также была построена для количественного определения антител к ЦМВ. Таким образом, концентрацию антител к ЦМВ в сыворотке определяли количественно с помощью BIE, а затем сравнивали с помощью ELISA.
Материалы и методы
Материалы и реактивы
Кремниевые пластины были приобретены в Главном научно-исследовательском институте цветных металлов (Китай). N-гидроксисукцинимид (NHS) и гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC), твин-20, бычий сывороточный альбумин (BSA), IgG и блокирующий буфер (10×, B6429 ) были приобретены компанией Sigma.Анти-IgG и козье антитело против человеческого IgM (анти-IgM) были приобретены у Beijing Bo Sheng Bio-technology Co. Ltd. CMV-3A были приобретены у GalaxyBio.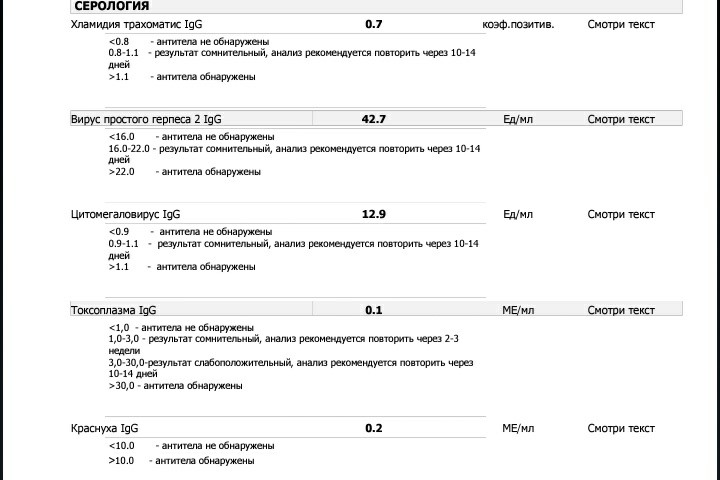 CMV-3A представляет собой слияние трех сегментов Pp150, Gp52 и Pp65, которые имеют сильные эпитопы антигенности. Слияние нескольких эпитопов повышает чувствительность/специфичность и снижает число ложноотрицательных результатов. Таким образом, CMV-3A использовали в качестве лиганда в анализе BIE. Очищенное антитело CMV (Pp65, C-Term, Rabbit, 1 мг/мл) было приобретено в Antibodies-online.ком. Образцы сыворотки пациентов были приобретены в больнице QiLu Университета Шаньдун, а клиническая информация указана в таблице A в файле S2.
CMV-3A представляет собой слияние трех сегментов Pp150, Gp52 и Pp65, которые имеют сильные эпитопы антигенности. Слияние нескольких эпитопов повышает чувствительность/специфичность и снижает число ложноотрицательных результатов. Таким образом, CMV-3A использовали в качестве лиганда в анализе BIE. Очищенное антитело CMV (Pp65, C-Term, Rabbit, 1 мг/мл) было приобретено в Antibodies-online.ком. Образцы сыворотки пациентов были приобретены в больнице QiLu Университета Шаньдун, а клиническая информация указана в таблице A в файле S2.
TORCH ELISA, используемые для анализа образцов сыворотки, были приобретены у MEDSON Inc. Процесс обнаружения и анализ выполнялись в соответствии с инструкциями производителя. Микропланшеты покрывали нативными антигенами ЦМВ, высокоочищали центрифугированием в градиенте сахарозы и инактивировали. Твердую фазу сначала обрабатывали разведенным образцом, после чего молекулы IgG к ЦМВ захватывались антигенами, если они присутствовали.После отмывания всех других компонентов образца связанные молекулы анти-ЦМВ IgG выявляли добавлением специфических поликлональных анти-H-IgG антител, меченных пероксидазой (HRP) во второй инкубации. Фермент, захваченный твердой фазой, воздействуя на смесь субстрат/хромоген, генерирует оптический сигнал, пропорциональный количеству анти-ЦМВ IgG-антител, присутствующих в образце. Калибровочная кривая, откалиброванная по первому международному стандарту ВОЗ, позволяет количественно определить антитела IgG у пациента.
Фермент, захваченный твердой фазой, воздействуя на смесь субстрат/хромоген, генерирует оптический сигнал, пропорциональный количеству анти-ЦМВ IgG-антител, присутствующих в образце. Калибровочная кривая, откалиброванная по первому международному стандарту ВОЗ, позволяет количественно определить антитела IgG у пациента.
NE готовили с использованием NHS (0,05 М) и EDC (0,2 М) в деионизированной воде (18,3 МОм·см) из системы Milli-Q plus (Millipore, Bedford, MA). Фосфатно-солевой буфер (PBS) готовили из 140 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4 и 1,8 мМ KH 2 PO 4 (pH 7,3) в деионизированной воде. Буфер PBST готовили с 1% Tween-20 в PBS. CMV-3A (0,1 мг/мл) готовили с PBST. BSA (10 мг/мл) готовили с PBST. Блокирующий реагент представлял собой смесь 1:1 (объем:объем) 10 мг/мл БСА и 10× блокирующего буфера.Очищенные антитела ЦМВ, IgG, анти-IgG и анти-IgM разводили до концентрации 0,1 мг/мл с помощью PBST. Образцы сыворотки разбавляли, как указано, с помощью PBST для качественного или количественного обнаружения.
Принцип BIE
BIE сочетает в себе эллипсометрию визуализации с высоким пространственным разрешением (рис. A в файле S1) с микрожидкостной системой (рис. B в файле S1) для анализа биомолекулярного взаимодействия [25].
Микрожидкостная система используется для формирования рисунка поверхности и создания массивов, а также для доставки раствора, иммобилизации лиганда и захвата мишени [26].Микрожидкостная система состоит из четырех основных частей: планшета для образцов, многоклеточного массива, микроканалов и насосов. Массив из нескольких ячеек был сформирован, когда модельная форма из полидиметилсилоксана (PDMS) контактировала с поверхностью кремниевой подложки, каждая ячейка имела вход и выход для прохождения раствора. Физический размер каждой ячейки составлял ~1,5×1×0,5 мм 3 . Входные микроканалы помещали в пластину для образцов, а выходные микроканалы соединяли с насосами (ISM939, ISMATEC, Швейцария. www.ismatec.com), предлагающий отрицательное давление. Простые соединения каналов можно использовать в последовательном или параллельном форматах для одновременного анализа одной или нескольких проб.
Простые соединения каналов можно использовать в последовательном или параллельном форматах для одновременного анализа одной или нескольких проб.
— это метод отображения для ультратонких пленок и характеристик поверхности [27], который используется для считывания и анализа массивов белков, созданных микрожидкостными системами. Падающая волна поляризованного света облучает образец в виде зондирующего луча и тем самым модифицируется, в результате чего получается отражающий или пропускающий луч, способный нести информацию о образце, такую как толщина белкового слоя.Когда для определения толщины слоя используется эллипсометрия изображений, интенсивность отражения представлена в оттенках серого, а изменение толщины слоя приводит к изменению значения в оттенках серого. Если показатель преломления неизменен, значение шкалы серого прямо пропорционально толщине белкового слоя в диапазоне от 0 до 30 нм, i . е ., I = kd, где I — интенсивность света, d — толщина слоя [28]. В этих условиях k является константой и может быть определено по слою белка с известными оттенками серого и известной толщиной [29].Также существует зависимость между поверхностной концентрацией и толщиной пленки: поверхностная концентрация (мкг/см 2 )≈K×d, где K = 0,12 [27]. Таким образом, значение шкалы серого напрямую отражает толщину слоя и поверхностную концентрацию. Чем выше значение шкалы серого, тем толще слой и выше поверхностная концентрация.
В этих условиях k является константой и может быть определено по слою белка с известными оттенками серого и известной толщиной [29].Также существует зависимость между поверхностной концентрацией и толщиной пленки: поверхностная концентрация (мкг/см 2 )≈K×d, где K = 0,12 [27]. Таким образом, значение шкалы серого напрямую отражает толщину слоя и поверхностную концентрацию. Чем выше значение шкалы серого, тем толще слой и выше поверхностная концентрация.
Модификация поверхности
Кремниевые пластины разрезали на прямоугольники 20×10 мм 2 и промывали деионизированной водой. После замачивания в растворе пираньи (30% H 2 O 2 :98% H 2 SO 4 = 1:3, об./об.) в течение 30 мин для увеличения количества силанольных групп на поверхности пластины , и ополаскивая деионизированной водой и этанолом, пластины замачивали в смеси 3-аминопропилтриэтоксисилана (АПТЭС) и абсолютного этанола (АПТЭС:абсолютный этанол = 1:10, объем/объем) и инкубировали в течение 2 ч при осторожном перемешивании. .Реакция АПТЭС с силанольными группами поверхности приводит к ковалентной иммобилизации -O-Si(OH) 2 -(CH 2 ) 3 -NH 2 с образованием слоя плотно упакованных аминогрупп на поверхность. После трехкратной промывки абсолютным этанолом пластины инкубировали в насыщенном растворе янтарного ангидрида в этаноле в течение ≥ 3 ч при осторожном перемешивании. CH 2 CH 2 COOCO-группа янтарного ангидрида реагирует с -NH 2 -O-Si(OH) 2 -(CH 2 ) 3 -NH 2 группа иммобилизованы на поверхности, образуя карбоксильные группы (-(CH 2 ) 3 NH-CO-(CH 2 ) 2 -COOH).После приготовления пластины хранили в этаноле.
.Реакция АПТЭС с силанольными группами поверхности приводит к ковалентной иммобилизации -O-Si(OH) 2 -(CH 2 ) 3 -NH 2 с образованием слоя плотно упакованных аминогрупп на поверхность. После трехкратной промывки абсолютным этанолом пластины инкубировали в насыщенном растворе янтарного ангидрида в этаноле в течение ≥ 3 ч при осторожном перемешивании. CH 2 CH 2 COOCO-группа янтарного ангидрида реагирует с -NH 2 -O-Si(OH) 2 -(CH 2 ) 3 -NH 2 группа иммобилизованы на поверхности, образуя карбоксильные группы (-(CH 2 ) 3 NH-CO-(CH 2 ) 2 -COOH).После приготовления пластины хранили в этаноле.
Процедура обнаружения ЦМВ
В качестве подложки использовались модифицированные выше кремниевые пластины. Кусок кремниевой пластины помещали на микрожидкостную форму микрожидкостной системы таким образом, чтобы поверхности пластин были структурированы с образованием небольших правильных ячеек в формате массива. Затем карбоксильные группы активировали путем закачки 10 мкл НЭ в каждую ячейку со скоростью потока 5 мкл/мин и пропускали через поверхность пластины.В присутствии NHS EDC переносит карбоксильные группы на сложный эфир Sulfo-NHS, который реагирует с аминогруппами белков, иммобилизуя белки на поверхности. Далее лиганд иммобилизовали: в каждую клетку закачивали CMV-3A в качестве лиганда или зонда (10 мкл на ячейку со скоростью 1 мкл/мин). В-третьих, блокирование происходило путем закачки блокирующего реагента в каждую ячейку (50 мкл на ячейку при скорости 1 мкл/мин) и пропускания его через каждую область лиганда. Таким образом, была сформирована сенсорная поверхность матрицы с CMV-3A для улавливания антител CMV. В-четвертых, цели были обнаружены.PBST использовали в качестве холостого контроля (50 мкл на ячейку при 1 мкл/мин) и очищенное антитело ЦМВ в качестве положительного контроля (50 мкл на ячейку при 1 мкл/мин) путем закачки их в несколько отдельных клеток. Одновременно в оставшиеся клетки также закачивали образцы сыворотки пациентов (50 мкл на ячейку при скорости 1 мкл/мин).
Затем карбоксильные группы активировали путем закачки 10 мкл НЭ в каждую ячейку со скоростью потока 5 мкл/мин и пропускали через поверхность пластины.В присутствии NHS EDC переносит карбоксильные группы на сложный эфир Sulfo-NHS, который реагирует с аминогруппами белков, иммобилизуя белки на поверхности. Далее лиганд иммобилизовали: в каждую клетку закачивали CMV-3A в качестве лиганда или зонда (10 мкл на ячейку со скоростью 1 мкл/мин). В-третьих, блокирование происходило путем закачки блокирующего реагента в каждую ячейку (50 мкл на ячейку при скорости 1 мкл/мин) и пропускания его через каждую область лиганда. Таким образом, была сформирована сенсорная поверхность матрицы с CMV-3A для улавливания антител CMV. В-четвертых, цели были обнаружены.PBST использовали в качестве холостого контроля (50 мкл на ячейку при 1 мкл/мин) и очищенное антитело ЦМВ в качестве положительного контроля (50 мкл на ячейку при 1 мкл/мин) путем закачки их в несколько отдельных клеток. Одновременно в оставшиеся клетки также закачивали образцы сыворотки пациентов (50 мкл на ячейку при скорости 1 мкл/мин). Антитела к ЦМВ в сыворотке были захвачены, когда они взаимодействовали с ЦМВ-3А на сенсорной поверхности. Все клетки промывали PBST (20 мкл на ячейку при 20 мкл/мин) между каждыми двумя последовательными этапами операции.Наконец, пластины микрочипов удаляли из микрожидкостной системы. После ополаскивания деионизированной водой и сушки азотом пластины анализировали с помощью эллипсометрии изображений. Если антитела к ЦМВ в растворе или сыворотке взаимодействовали с ЦМВ-3А на поверхности и образовывали комплекс, слой в этой области становился толще. Экспериментальные результаты были записаны в виде изображений в оттенках серого, а связывание антител ЦМВ приводило к значительному увеличению значения в оттенках серого.
Антитела к ЦМВ в сыворотке были захвачены, когда они взаимодействовали с ЦМВ-3А на сенсорной поверхности. Все клетки промывали PBST (20 мкл на ячейку при 20 мкл/мин) между каждыми двумя последовательными этапами операции.Наконец, пластины микрочипов удаляли из микрожидкостной системы. После ополаскивания деионизированной водой и сушки азотом пластины анализировали с помощью эллипсометрии изображений. Если антитела к ЦМВ в растворе или сыворотке взаимодействовали с ЦМВ-3А на поверхности и образовывали комплекс, слой в этой области становился толще. Экспериментальные результаты были записаны в виде изображений в оттенках серого, а связывание антител ЦМВ приводило к значительному увеличению значения в оттенках серого.
Качественное определение антител к ЦМВ и сыворотке пациента
Для определения специфичности антител против ЦМВ, ЦМВ-3А в качестве лиганда иммобилизовали на двух колонках (рис. 1).Буфер PBST добавляли в качестве пустого контроля к двум областям в первой строке. Одновременно очищенные антитела ЦМВ (0,1 мг/мл) добавляли в качестве положительного контроля в две области во втором ряду. Нормальная сыворотка без антител к ЦМВ была добавлена в качестве отрицательного контроля к двум областям в третьем ряду. Три образца сыворотки пациентов (№ 956, 933 и 978; информацию о образцах см. в Таблице A в файле S2) были проанализированы в следующих рядах соответственно. Увеличение плотности отражения света в каждой области показало, что антитела к ЦМВ в образцах взаимодействовали с ЦМВ-3А, иммобилизованным на чипе.
Одновременно очищенные антитела ЦМВ (0,1 мг/мл) добавляли в качестве положительного контроля в две области во втором ряду. Нормальная сыворотка без антител к ЦМВ была добавлена в качестве отрицательного контроля к двум областям в третьем ряду. Три образца сыворотки пациентов (№ 956, 933 и 978; информацию о образцах см. в Таблице A в файле S2) были проанализированы в следующих рядах соответственно. Увеличение плотности отражения света в каждой области показало, что антитела к ЦМВ в образцах взаимодействовали с ЦМВ-3А, иммобилизованным на чипе.
Рис. 1. Специфичность и качественное определение антител к ЦМВ с помощью BIE.
(A) Изображения различных образцов антител ЦМВ в оттенках серого; и (B) трехмерная карта распределения различных образцов антител CMV в оттенках серого на изображении A. На первом этапе CMV-3A иммобилизовали в качестве лиганда на двух колонках. На втором этапе буфер PBST был добавлен в качестве пустого контроля к двум областям в первой строке. Одновременно в качестве положительного контроля в две области во втором ряду добавляли очищенное антитело к ЦМВ. Нормальная сыворотка без антител к ЦМВ была добавлена в качестве отрицательного контроля к двум областям в третьем ряду. По данным ИФА, № 956 имел высокую концентрацию антител к ЦМВ, а № 933 и 978 – среднюю концентрацию антител к ЦМВ. Для наблюдения за качественным обнаружением антител к ЦМВ в сыворотке были выбраны образцы с более высокими концентрациями.
Нормальная сыворотка без антител к ЦМВ была добавлена в качестве отрицательного контроля к двум областям в третьем ряду. По данным ИФА, № 956 имел высокую концентрацию антител к ЦМВ, а № 933 и 978 – среднюю концентрацию антител к ЦМВ. Для наблюдения за качественным обнаружением антител к ЦМВ в сыворотке были выбраны образцы с более высокими концентрациями.
https://doi.org/10.1371/journal.pone.0136253.g001
Мы дополнительно проанализировали типы антител к ЦМВ, захваченных ЦМВ-3А (рис. 2).На первом этапе IgG иммобилизовали в качестве лиганда на первой и второй колонках. Одновременно ЦМВ-3А обездвижили на третьей, четвертой, пятой и шестой колоннах. На втором этапе в третью и четвертую колонки добавляли образец № 948, а в пятую и шестую колонки добавляли образец № 940. Буфер PBST добавляли в качестве пустого контроля к оставшимся областям. На третьем этапе к третьему и четвертому рядам добавляли анти-IgG и анти-IgM, чтобы идентифицировать и подтвердить, является ли антитело, захваченное лигандом, IgG или IgM. Буфер PBST добавляли в качестве пустого контроля к оставшимся областям.
Буфер PBST добавляли в качестве пустого контроля к оставшимся областям.
Рис. 2. Идентификация антител IgG против ЦМВ с помощью BIE.
(A) Изображения в градациях серого для идентификации антител IgG в сыворотке; и (B) значение шкалы серого и P -значение идентификации антитела IgG. «*» указывает на значительные изменения значений оттенков серого. На первом этапе IgG иммобилизовали в качестве лиганда на первой и второй колонках. CMV-3A был обездвижен на третьей, четвертой, пятой и шестой колоннах.На втором этапе к соответствующим областям изображения добавляли буфер PBST в качестве пустого контроля. В третью и четвертую колонки добавляли образец № 948, а в пятую и шестую колонки добавляли образец № 940. На третьем этапе буфер PBST добавляли в качестве пустого контроля к первым областям в каждом столбце. Анти-IgG и анти-IgM были добавлены в третий и четвертый ряды соответственно.
https://doi.org/10.1371/journal.pone.0136253.g002
Калибровочная кривая и количественное определение образцов клинической сыворотки
Для построения калибровочной кривой образец сыворотки (No. 942, 21,8 МЕ/мл, см. Таблицу A в файле S2), и пять уровней серийных разведений, содержащих 0,011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл антитела ЦМВ, готовили в PBST. CMV-3A иммобилизовали в качестве лиганда на двух колонках (фиг. 3). После блокирования буфер PBST, антитела к ЦМВ и нормальную сыворотку без антител к ЦМВ добавляли в качестве пустого, положительного и отрицательного контроля (соответственно) в первый, второй и третий ряды соответственно. Образцы с концентрацией 0,011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл были добавлены с четвертого по восьмой ряды соответственно.Концентрация отложена по оси X, а изменение значения в оттенках серого по сравнению с пустым контролем отложено по оси Y для построения калибровочной кривой (рис. 3).
942, 21,8 МЕ/мл, см. Таблицу A в файле S2), и пять уровней серийных разведений, содержащих 0,011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл антитела ЦМВ, готовили в PBST. CMV-3A иммобилизовали в качестве лиганда на двух колонках (фиг. 3). После блокирования буфер PBST, антитела к ЦМВ и нормальную сыворотку без антител к ЦМВ добавляли в качестве пустого, положительного и отрицательного контроля (соответственно) в первый, второй и третий ряды соответственно. Образцы с концентрацией 0,011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл были добавлены с четвертого по восьмой ряды соответственно.Концентрация отложена по оси X, а изменение значения в оттенках серого по сравнению с пустым контролем отложено по оси Y для построения калибровочной кривой (рис. 3).
Рис. 3. Калибровочная кривая и чувствительность BIE для обнаружения антител к ЦМВ.
(A) Обнаружены изображения в оттенках серого с различными уровнями концентрации антител к ЦМВ; (B) трехмерная карта распределения в градациях серого различных концентраций обнаруженных антител к ЦМВ; и (C) стандартная кривая CMV-3A в качестве лиганда для обнаружения пяти серийных разведений содержащих антитела CMV (0. 011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл). На первом этапе CMV-3A иммобилизовали в качестве лиганда на двух колонках. На втором этапе буфер PBST был добавлен в качестве пустого контроля к двум областям в первой строке. Одновременно в качестве положительного контроля в две области во втором ряду добавляли очищенное антитело к ЦМВ. Отрицательную сыворотку добавляли в качестве отрицательного контроля к двум областям в третьем ряду. Серийные разведения антител к ЦМВ добавляли в качестве аналитических образцов в следующие ряды. Одна и та же концентрация была измерена в двух дублирующих областях.
011, 0,043, 0,170, 0,681 и 2,725 МЕ/мл). На первом этапе CMV-3A иммобилизовали в качестве лиганда на двух колонках. На втором этапе буфер PBST был добавлен в качестве пустого контроля к двум областям в первой строке. Одновременно в качестве положительного контроля в две области во втором ряду добавляли очищенное антитело к ЦМВ. Отрицательную сыворотку добавляли в качестве отрицательного контроля к двум областям в третьем ряду. Серийные разведения антител к ЦМВ добавляли в качестве аналитических образцов в следующие ряды. Одна и та же концентрация была измерена в двух дублирующих областях.
https://doi.org/10.1371/journal.pone.0136253.g003
После получения калибровочной кривой концентрации антител в образцах неизвестной концентрации можно было определить на кривой в соответствии с их значениями в градациях серого. Измерения каждого образца повторялись в двух областях на одном чипе (рис. 4). Коммерческие наборы антител ELISA CMV использовали в качестве контроля в соответствии с инструкциями производителя.
Рис. 4. Обнаружение антител к ЦМВ в сыворотке пациента с помощью BIE.
На первом этапе CMV-3A иммобилизовали в качестве лиганда на шести колонках. На втором этапе буфер PBST был добавлен в качестве пустого контроля к шести областям в первой строке. Одновременно очищенные антитела ЦМВ добавляли в качестве положительного контроля в две последние области во втором ряду. Образцы сыворотки пациентов добавляли в качестве аналитических образцов на следующие участки соответственно. Один и тот же образец сыворотки был измерен в двух дублирующих областях (№ 940, 959,938 без образца, P15-9 и контроль PBST подчеркнуты).
https://doi.org/10.1371/journal.pone.0136253.g004
Статистический анализ
Для статистического анализа соответствующие значения P были рассчитаны с помощью однофакторного дисперсионного анализа в Microsoft Office Excel в соответствии с количеством областей на изображениях и образцах сыворотки пациентов в таблице A в файле S2 [30]. В экспериментах по качественному и количественному обнаружению значительные изменения в областях обнаружения оттенков серого по сравнению с пустыми контрольными областями и областями обнаружения считались положительными сигналами, если значение P было <0.05. Если P был ≥ 0,05, области обнаружения считались отрицательными сигналами. При сравнении данных ELISA и BIE результаты двух методов считались согласованными, если P составляло ≥ 0,05. Если P было < 0,05, два метода считались несовместимыми. Коэффициент корреляции ( r -значение) BIE и ELISA рассчитывали с помощью анализа коэффициента корреляции в Microsoft Office Excel (таблица B в файле S2).
В экспериментах по качественному и количественному обнаружению значительные изменения в областях обнаружения оттенков серого по сравнению с пустыми контрольными областями и областями обнаружения считались положительными сигналами, если значение P было <0.05. Если P был ≥ 0,05, области обнаружения считались отрицательными сигналами. При сравнении данных ELISA и BIE результаты двух методов считались согласованными, если P составляло ≥ 0,05. Если P было < 0,05, два метода считались несовместимыми. Коэффициент корреляции ( r -значение) BIE и ELISA рассчитывали с помощью анализа коэффициента корреляции в Microsoft Office Excel (таблица B в файле S2).
Результаты
Подтверждение специфичности и качественное определение
По сравнению с пустыми контрольными областями, очищенные ЦМВ-антитела и области обнаружения образцов сыворотки пациентов имели заметно более толстые пленки, при этом среднее значение в оттенках серого демонстрировало значительное увеличение, в то время как в отрицательных контрольных областях этого не наблюдалось (рис. 1).Среднее значение шкалы серого для пустых контролей составило 117,45 ± 0,92, а значение очищенного антитела ЦМВ составило 176,8 ± 3,39. Таким образом, среднее значение шкалы серого очищенного антитела ЦМВ минус среднее значение шкалы серого контрольного бланка составило 59,4 ( P = 0,002). Значение отрицательного контроля составило 125,9 ± 3,18. Среднее значение шкалы серого отрицательного контроля минус среднее значение шкалы серого пустого контроля составило 8,4 ( P = 0,07). Это указывало на наличие специфических взаимодействий между очищенным антителом к ЦМВ и ЦМВ-3А.Следовательно, антитела к ЦМВ в образцах пациентов могут быть захвачены ЦМВ-3А, иммобилизованным на субстрате.
1).Среднее значение шкалы серого для пустых контролей составило 117,45 ± 0,92, а значение очищенного антитела ЦМВ составило 176,8 ± 3,39. Таким образом, среднее значение шкалы серого очищенного антитела ЦМВ минус среднее значение шкалы серого контрольного бланка составило 59,4 ( P = 0,002). Значение отрицательного контроля составило 125,9 ± 3,18. Среднее значение шкалы серого отрицательного контроля минус среднее значение шкалы серого пустого контроля составило 8,4 ( P = 0,07). Это указывало на наличие специфических взаимодействий между очищенным антителом к ЦМВ и ЦМВ-3А.Следовательно, антитела к ЦМВ в образцах пациентов могут быть захвачены ЦМВ-3А, иммобилизованным на субстрате.
Действительно, среднее значение шкалы серого в проанализированных образцах сыворотки значительно увеличилось по сравнению с контролем (рис. 1). Среднее значение в сыворотке составило 253,58 ± 0,49, а среднее значение в оттенках серого для сыворотки за вычетом среднего значения в оттенках серого для пустого контроля составило 136,1 (90 133 P 90 134 = 2,8 × 10 90 163 -5 90 164), что указывает на то, что антитела к ЦМВ были в большом количестве в сыворотке. образцы. Это соответствовало результатам ELISA (таблица A в файле S2).
образцы. Это соответствовало результатам ELISA (таблица A в файле S2).
Идентификация антител IgG против ЦМВ с помощью BIE
Когда в качестве лиганда использовали очищенный человеческий IgG, среднее значение шкалы серого в областях обнаружения анти-IgG значительно увеличивалось, в то время как области обнаружения анти-IgM не увеличивались (два столбца слева на рис. 2). Среднее значение шкалы серого для анти-IgG минус среднее значение шкалы серого для пустого контроля составило 96,2 ( P = 0,003). Среднее значение анти-IgM за вычетом среднего значения шкалы серого пустого контроля равнялось 8.15 ( Р = 0,29). Эти данные указывают на специфические взаимодействия между анти-IgG и человеческим IgG, иммобилизованным на чипе, которые можно использовать в качестве эталонов для определения того, являются ли антитела в образцах IgG.
По сравнению с областями антител ЦМВ, области обнаружения анти-IgG показали значительное увеличение, в то время как области обнаружения анти-IgM не увеличились (рис. 2). Например, значение образца 948 составило 156,2 ± 2,6, а значение анти-IgG — 189,6 ± 4.4, для разницы 33,4 ( P = 0,02). Однако значение анти-IgM составило 154,25 ± 0,25, и разница не была очевидной ( P = 0,53). Это указывало на то, что антитела IgG CMV были захвачены чипом. Для обнаружения образца № 940 значение анти-IgG составило 237,7 ± 11, а прирост составил 77,3 ( P = 0,01). Результат также указывал на то, что содержание IgG в образцах № 948 и 940 было разным.
2). Например, значение образца 948 составило 156,2 ± 2,6, а значение анти-IgG — 189,6 ± 4.4, для разницы 33,4 ( P = 0,02). Однако значение анти-IgM составило 154,25 ± 0,25, и разница не была очевидной ( P = 0,53). Это указывало на то, что антитела IgG CMV были захвачены чипом. Для обнаружения образца № 940 значение анти-IgG составило 237,7 ± 11, а прирост составил 77,3 ( P = 0,01). Результат также указывал на то, что содержание IgG в образцах № 948 и 940 было разным.
Чувствительность BIE и кривая калибровки
Пять градиентов концентрации образца сыворотки (№942, 21,8 МЕ/мл, см. таблицу A в файле S2), измеренные в образцах с серийным разведением, использовали для определения чувствительности анализа BIE (рис. 3). Мы обнаружили, что изменение интенсивности сигнала соответствовало увеличению концентрации антител к ЦМВ. Уровни чувствительности обнаружения антител к ЦМВ достигали 0,01 МЕ/мл. Значения шкалы серого для пустого контроля составляли 124,7 ± 0,5, а значения шкалы серого для разведений до 0,01 МЕ/мл составляли 132,3 ± 0,1, i . e ., ~ 6,1% больше, чем у контроля ( P = 0.03). Повторяя эти тесты более 10 раз, наши результаты показали, что чувствительность анализа достигала 0,01 МЕ/мл или менее. Каждое изменение значения в оттенках серого было связано с соответствующей концентрацией антител к ЦМВ в диапазоне 0,011–2,725 МЕ/мл, а калибровочная кривая показана на рис. 3. Концентрации неизвестных образцов можно было определить в соответствии с соответствующим значением в оттенках серого на калибровочная кривая.
e ., ~ 6,1% больше, чем у контроля ( P = 0.03). Повторяя эти тесты более 10 раз, наши результаты показали, что чувствительность анализа достигала 0,01 МЕ/мл или менее. Каждое изменение значения в оттенках серого было связано с соответствующей концентрацией антител к ЦМВ в диапазоне 0,011–2,725 МЕ/мл, а калибровочная кривая показана на рис. 3. Концентрации неизвестных образцов можно было определить в соответствии с соответствующим значением в оттенках серого на калибровочная кривая.
Количественное определение антител к ЦМВ в клинической сыворотке
41 пациент с ЦМВ (таблица A в файле S2) с количественными результатами ELISA был протестирован с помощью BIE (рис. 4).Для разных образцов сыворотки изменения интенсивности сигнала BIE были разными. Сравнение результатов двух методов показано на рис. 5. Однофакторный анализ и анализ коэффициентов корреляции показали, что результаты ELISA и BIE согласуются между собой (F = 1,38 0,05, r = 0,7) (таблица B в файле S2).
0,05, r = 0,7) (таблица B в файле S2).
Рис. 5. Сравнение BIE с ELISA.
P15-1 и P15-2 использовались в качестве здоровых контролей. Концентрация антител ЦМВ (0.5 МЕ/мл), находящийся в нормальном референтном диапазоне (0,4–0,6 МЕ/мл). Рассчитывали коэффициент корреляции ( r -значение) и P -значение.
https://doi.org/10.1371/journal.pone.0136253.g005
Обсуждение
Высокопроизводительная детекция подходит для массового скрининга ЦМВ у женщин детородного возраста. В сочетании с микрожидкостными технологиями BIE может значительно повысить пропускную способность для обнаружения CMV на одном чипе. Разработанные здесь микрочипы имеют несколько клеток, иммобилизованных с разными лигандами для разных подтипов антител ЦМВ.Эллипсометрия изображений также подходит для высокопроизводительного анализа. Его можно использовать для визуализации изменения сигнала от всех единиц микрочипа с высоким пространственным разрешением. Результаты анализа образцов пациентов с одного микрочипа могут быть одновременно идентифицированы, а данные могут быть получены за несколько секунд с использованием визуализирующего эллипсометра. В настоящее время наш метод может одновременно обеспечивать 48 реакционных зон. Благодаря повышенной производительности и меньшей стоимости, BIE может использоваться в клинических массовых скринингах ЦМВ для здоровых новорожденных в будущем.
Результаты анализа образцов пациентов с одного микрочипа могут быть одновременно идентифицированы, а данные могут быть получены за несколько секунд с использованием визуализирующего эллипсометра. В настоящее время наш метод может одновременно обеспечивать 48 реакционных зон. Благодаря повышенной производительности и меньшей стоимости, BIE может использоваться в клинических массовых скринингах ЦМВ для здоровых новорожденных в будущем.
Обнаружение антител широко используется для клинической диагностики ЦМВ-инфекции. Однако идентификация типов антител может помочь определить течение заболевания, а BIE можно использовать в качестве основного клинического инструмента скрининга пациентов с ЦМВ. IgM продуцируется в больших количествах на ранних стадиях инфекции (достигая пика в первый месяц), после чего следует продукция IgG [7,31]. Уровни IgM снижаются в течение нескольких месяцев после начала инфекции, тогда как уровни IgG сохраняются до конца жизни пациента [32,33].Определение авидности IgG может дать дополнительные сведения о статусе инфекции, а IgG с низкой авидностью изначально присутствует, но со временем увеличивается [34]. Положительный результат на IgM в сочетании с IgG от низкого до умеренного предполагает авидность первичной ЦМВ-инфекции в течение последних 3–4 месяцев [35]. Визуализированное изображение BIE (рис. 2) может отражать типы по разнице в яркости, поэтому эта технология может обеспечить быстрое скрининг. На сегодняшний день наша работа представляет собой просто демонстрацию обнаружения антител типа IgG с помощью BIE.IgM и другие антитела, необходимые для скрининга специфического антигена, могут быть включены в будущем для дальнейшего практического применения.
Положительный результат на IgM в сочетании с IgG от низкого до умеренного предполагает авидность первичной ЦМВ-инфекции в течение последних 3–4 месяцев [35]. Визуализированное изображение BIE (рис. 2) может отражать типы по разнице в яркости, поэтому эта технология может обеспечить быстрое скрининг. На сегодняшний день наша работа представляет собой просто демонстрацию обнаружения антител типа IgG с помощью BIE.IgM и другие антитела, необходимые для скрининга специфического антигена, могут быть включены в будущем для дальнейшего практического применения.
В настоящее время в большинстве методов упоминается относительная чувствительность (%) обнаружения антител к ЦМВ [8,36], но мало информации об абсолютной чувствительности. По сравнению с другими методами абсолютная чувствительность BIE может достигать 0,01 МЕ/мл, и он имеет хорошее разрешение в диапазоне 0,1–1,0 МЕ/мл на калибровочной кривой для количественного определения. Ранее был опубликован референсный диапазон для обнаружения антител к ЦМВ. Например, иммуноанализы Elecsys (Roche Diagnostics) имеют сомнительный диапазон (0,5–1,0 МЕ/мл) CMV IgG [12]. В нашем эксперименте ИФА в качестве контрольного метода имел референтный диапазон 0,4–0,6 МЕ/мл. Таким образом, чувствительность нашего биосенсора BIE ниже референсного диапазона и уже достигла клинических стандартов.
Например, иммуноанализы Elecsys (Roche Diagnostics) имеют сомнительный диапазон (0,5–1,0 МЕ/мл) CMV IgG [12]. В нашем эксперименте ИФА в качестве контрольного метода имел референтный диапазон 0,4–0,6 МЕ/мл. Таким образом, чувствительность нашего биосенсора BIE ниже референсного диапазона и уже достигла клинических стандартов.
Однако у некоторых пациентов (например, 940, 956, 964, 984 и 980) между ИФА и BIE наблюдается существенное несоответствие. Образцы от этих пациентов продемонстрировали более сильный сигнал при использовании ELISA, чем BIE.В ELISA молекулы анти-CMV IgG выявляются путем добавления поликлональных специфических анти-H-IgG антител, меченных пероксидазой хрена (HRP). Напротив, биосенсор BIE напрямую идентифицировал изменение поверхностной концентрации анти-ЦМВ IgG после захвата мишени без вторичной метки. Таким образом, этот метод без меток может избежать некоторого фактора помех. Кроме того, изображения в градациях серого предлагали однородные области, помогая избежать ложных положительных сигналов. Когда коэффициент корреляции ( r -значение) и P -значение были рассчитаны после исключения количества тяжелых мутаций (940, 956, 964 и 984), r -значение = 0.93 и P = 0,8 статистические результаты показали большее соответствие между ELISA и BIE.
Когда коэффициент корреляции ( r -значение) и P -значение были рассчитаны после исключения количества тяжелых мутаций (940, 956, 964 и 984), r -значение = 0.93 и P = 0,8 статистические результаты показали большее соответствие между ELISA и BIE.
В заключение, мы разработали метод биосенсора CMV IgG без меток и мультиплексного скрининга. Высокопроизводительная детекция подходит для массового скрининга на ЦМВ женщин детородного возраста. Кроме того, наши результаты показывают, что чувствительность BIE уже достигла стандартов клинической диагностики для анти-CMV IgG. Таким образом, на основе обнаружения анти-ЦМВ IgG, BIE можно использовать для качественного и количественного обнаружения большего количества типов антител к ЦМВ с использованием простой и быстрой процедуры.
Благодарности
Мы благодарим больницу QiLu Шаньдунского университета за клинические образцы пациентов с CMV.
Авторские взносы
Задумал и разработал эксперименты: WZ GJ. Проведены опыты: ЗОЖ CQ YN. Проанализированы данные: ТФК YGW XZD. Предоставленные реагенты/материалы/инструменты для анализа: HLS WZ. Написал газету: CQ. Собраны данные: ЗОЖ ЗЗ ЧВ.
Проведены опыты: ЗОЖ CQ YN. Проанализированы данные: ТФК YGW XZD. Предоставленные реагенты/материалы/инструменты для анализа: HLS WZ. Написал газету: CQ. Собраны данные: ЗОЖ ЗЗ ЧВ.
Каталожные номера
- 1. Адлер С.П., Нигро Г. Профилактика передачи цитомегаловируса от матери к плоду.Клин Инфекция Дис. 2013; 57: 189–192. пмид: 24257425.
- 2. Канеко М., Самешима Х., Минемацу Т., Кусумото К., Ямаути А., Икеноуэ Т. Авидность материнских IgG, IgM и ультразвуковые отклонения: комбинированный метод выявления врожденной цитомегаловирусной инфекции с последствиями. Дж. Перинатол. 2013; 33: 831–835. пмид: 23867961.
- 3. Ревелло М.Г., Герна Г. Диагностика и лечение цитомегаловирусной инфекции человека у матери, плода и новорожденного. клин. микробиол.ред. 2002 г.; 15: 680–715. пмид:12364375.
- 4.
Лаззаротто Т., Герра Б., Ланари М., Габриэлли Л., Ландини М.П. Новые достижения в диагностике врожденной цитомегаловирусной инфекции.
 Дж. Клин. Вирол. 2008 г.; 41: 192–197. пмид: 18054840.
Дж. Клин. Вирол. 2008 г.; 41: 192–197. пмид: 18054840. - 5. Канеко М., Самешима Х., Минемацу Т., Кусумото К., Ямаути А., Икеноуэ Т. Авидность материнских IgG, IgM и ультразвуковые отклонения: комбинированный метод выявления врожденной цитомегаловирусной инфекции с последствиями. Дж. Перинатол. 2013; 33: 831–835.пмид: 23867961.
- 6. Aabye MG, Eugen-Olsen J, Werlinrud AM, Holm LL, Tuuminen T, Ravn P и др. Простой метод количественного определения IP-10 в высушенных пятнах крови и плазмы. PLoS One. 2012 г.; 7:e39228. пмид: 22761744.
- 7. Ревелло М.Г., Волуп-Феллус С., Гранжо-Керос Л., Ван Хелден Дж., Дикштейн Ю., Липкин И. и соавт. Клиническая оценка новых автоматизированных анализов IgM и IgG цитомегаловируса для платформы анализатора Elecsys. Евро. Дж. Клин. микробиол. Заразить. Дис. 2012 г.; 31: 3331–3339.пмид: 22850741.
- 8.
Хань Ф, Сюй В, Сюнь Ч. Значение выявления ЦМВ-IgM иммуноферментным методом электрохемилюминесценции в диагностике ЦМВ-инфекции у беременных.
 Охрана здоровья матери и ребенка в Китае, 2013 г.; 28: 4738–4739.
Охрана здоровья матери и ребенка в Китае, 2013 г.; 28: 4738–4739. - 9. Огава-Гото К., Танака К., Гибсон В., Морииши Э., Миура Ю., Курата Т. и др. Сеть микротрубочек способствует ядерному нацеливанию капсида цитомегаловируса человека. Дж. Вирол. 2003 г.; 77: 8541–8547. пмид: 12857923.
- 10. Эсса С., Пакса А.С., Аль-Аттия Р., Эль-Шазли А., Рагупати Р., Саид Т.Применение проточной цитометрии для выявления ЦМВ-специфического антигена (Рр65) в лейкоцитах реципиентов почек. клин. Пересадка. 2000 г.; 14: 147–151. пмид:10770420
- 11. Раджасекариа Х., Скотт Г., Робертсон П.В., Роулинсон В.Д. Улучшение диагностики первичной цитомегаловирусной инфекции у беременных с помощью иммуноблотов. Дж. Мед. Вирол. 2013; 85: 315–319. пмид: 23171986.
- 12.
Баалави Ф., Робертсон П., Роулинсон В.Д. Обнаружение IgG-антител к цитомегаловирусу человека с использованием автоматизированного иммунологического анализа с рекомбинантными антигенами дает одинаковые результаты по сравнению с установленными анализами с использованием цельных вирусных антигенов.
 Патология 2010; 42: 578–580. пмид: 20854078.
Патология 2010; 42: 578–580. пмид: 20854078. - 13. Feron D, Charleser C, Gourain V, Garderet L, Coste-Burel M, Le Pape P, et al. Мультиплексный инфекционный белковый микроматричный иммуноанализ подходит для изучения специфичности моноклональных иммуноглобулинов. Анальный. Биохим. 2013; 433: 202–209. пмид: 23103342.
- 14. Лю И, Ю Ф, Хуан Х, Хан Дж. Разработка рекомбинантного антигенного массива для одновременного обнаружения вирусных антител. PLoS One. 2013; 8: e73842.пмид: 24058498.
- 15. Джин Г., Тенгвалл П., Лундстром И., Арвин Х. Концепция биосенсора, основанная на эллипсометрии изображений для визуализации биомолекулярных взаимодействий. Анальный. Биохим. 1995 год; 232: 69–72. пмид:8600834.
- 16. Джин Г., Янссон Р., Арвин Х. Новый взгляд на эллипсометрию визуализации: разработки для визуализации тонких прозрачных слоев на кремниевых подложках. преподобный наук. Инструм. 1996 год; 67: 2930–2936.
- 17.
 Jin G, Meng YH, Liu L, Niu Y, Chen S, Qi C и др.Разработка биосенсора на основе эллипсометрии изображений и биомедицинских приложений. Тонкие твердые пленки 2011; 519: 2750–2757.
Jin G, Meng YH, Liu L, Niu Y, Chen S, Qi C и др.Разработка биосенсора на основе эллипсометрии изображений и биомедицинских приложений. Тонкие твердые пленки 2011; 519: 2750–2757. - 18. Qi C, Gao GF, Jin G. Биосенсоры для здоровья, окружающей среды и биобезопасности. Седьмая глава, INTECH 2011; ISBN: 978-953-307-443-6.
- 19. Qi C, Zhu W, Niu Y, Zhang HG, Zhu GY, Meng YH и др. Обнаружение маркеров гепатита В с помощью биосенсора на основе визуализирующей эллипсометрии. J. Вирусная гепатит. 2009 г.; 16: 822–832. пмид: 19486471.
- 20.Zhang HG, Qi C, Wang ZH, Jin G, Xiu RJ. Оценка нового метода анализа белка CA15-3: оптическая система белковых чипов для клинического применения. клин. хим. 2005 г.; 51: 1038–1040. пмид: 15817821.
- 21.
Qi C, Tian XS, Chen S, Yan JH, Cao Z, Tian KG и др. Обнаружение вируса птичьего гриппа субтипа H5 с помощью биосенсора на основе эллипсометрии изображений. Биосенс. Биоэлектрон.
 2010 г.; 25: 1530–1534. пмид: 19932609.
2010 г.; 25: 1530–1534. пмид: 19932609. - 22. Qi C, Duan JZ, Wang ZH, Chen YY, Zhang PH, Zhan L, et al.Исследование взаимодействия двух нейтрализующих моноклональных антител с вирусом ТОРС с помощью биосенсора на основе эллипсометрии изображений. Биомед. Микроустройства 2006; 8): 247–253. пмид: 16718402.
- 23. Wang W, Qi C, Kang TF, Niu Y, Jin G, Chen Y и др. Анализ взаимодействия между тропомиозиновым аллергеном и антителом с использованием биосенсора на основе эллипсометрии изображений. Анальный. хим. 2013; 85: 4446–4452. пмид: 23517013.
- 24. Qi C, Zhang H, Liu L, Yang RK, Kang TF, Hao WX и др.Анализ взаимодействий между белками SNARE с использованием визуализирующего эллипсометра в сочетании с микрожидкостной матрицей. науч. 2014 г.; 4: 5341–5346. пмид: 24938428.
- 25.
Wang ZH, Jin G. Возможности протеина А для ориентированной иммобилизации иммуноглобулина на поверхности кремния для биосенсора с эллипсометрией изображений.
 Дж. Биохим. Биофиз. Методы 2003; 57: 203–211. пмид: 14512155.
Дж. Биохим. Биофиз. Методы 2003; 57: 203–211. пмид: 14512155. - 26. Wang ZH, Meng YH, Ying PQ, Qi C, Jin G. Белковый микрофлюидный массив без меток для параллельных иммуноанализов.Электрофорез 2006; 27: 4078–4085. пмид: 17054092.
- 27. Стенберг М., Найгрен Х. Использование изоскопического эллипсометра при изучении адсорбированных белков и реакций биоспецифического связывания. Дж. Физ. 1983 год; 44: 83–86.
- 28. Chen Y, Meng Y, Jin G. Оптимизация ненулевой эллипсометрии для границ раздела воздух/твердое тело. заявл. Опц. 2007 г.; 46: 8475–8481. пмид: 18071378.
- 29. Арвин Х., Велинклинсторм С., Янссон Р. Новый взгляд на ненулевую эллипсометрию: основные соображения по измерению поверхностных концентраций на границе раздела твердой и жидкой фаз.J. Коллоидный интерфейс Sci. 1993 год; 156: 377–382.
- 30.
Фридман Д., Писани Р., Пурвес Р. и Адхикари А. Статистика, 2-е издание. Нортон и компания, 1991; Нью-Йорк Нью-Йорк.
 ISBN: 0 393 96045 5
ISBN: 0 393 96045 5 - 31. Ревелло М.Г., Герна Г. Диагностика врожденной цитомегаловирусной инфекции у матери, плода и новорожденного. Мнение эксперта. Мед. Диагн. 2008 г.; 2: 547–563. пмид: 23495743.
- 32. Новак З., Росс С.А., Патро Р.К., Пати С.К., Кумбла Р.А., Брайс С. и др.Разнообразие штаммов цитомегаловируса у серопозитивных женщин. Дж. Клин. микробиол. 2008 г.; 46: 882–886. пмид: 18216215.
- 33. Росс С.А., Арора Н., Новак З., Фаулер К.Б., Бритт В.Дж., Боппана С.Б. Цитомегаловирусные реинфекции у здоровых сероиммунных женщин. Дж. Заразить. Дис. 2010 г.; 201: 386–389. пмид: 20039807.
- 34. Лаззаротто Т., Спеццакатена П., Праделли П., Абате Д.А., Варани С., Ландини М.П. Авидность иммуноглобулина G, направленного против цитомегаловируса человека, при первичных и вторичных инфекциях у иммунокомпетентных и иммунодефицитных субъектов.клин. Диагн. лаборатория Иммунол. 1997 год; 4: 469–473. пмид:9220166.
- 35.
 Гранжо-Керос Л., Майо М.Дж., Лебон П., Фреймут Ф., Юджин Г., Стрикер Р. и др. Значение индекса авидности IgG к цитомегаловирусу (ЦМВ) для диагностики первичной ЦМВ-инфекции у беременных. Дж. Заразить. Дис. 1997 год; 175: 944–946. пмид:55.
Гранжо-Керос Л., Майо М.Дж., Лебон П., Фреймут Ф., Юджин Г., Стрикер Р. и др. Значение индекса авидности IgG к цитомегаловирусу (ЦМВ) для диагностики первичной ЦМВ-инфекции у беременных. Дж. Заразить. Дис. 1997 год; 175: 944–946. пмид:55. - 36. Бреда Г., Алмейда Б., Карстенсен С., Бонфим К.М., Ногейра М.Б., Видал Л.Р. и др. Обнаружение цитомегаловируса человека с помощью ПЦР в реальном времени и теста на антиген pp65 у реципиентов трансплантата гемопоэтических стволовых клеток: проблема в странах с низким и средним уровнем дохода.Патог. Глоб. Здоровье. 2013; 107 312–319. пмид: 24188241.
Цитомегаловирусное антитело — обзор
Для решения вопросов, касающихся лечения поражений глаз, прежде всего цитомегаловирусного ретинита, у пациентов с синдромом приобретенного иммунодефицита (СПИД), Национальный глазной институт спонсировал SOCA, сеть клинических испытаний. Большинство клинических испытаний SOCA проводились в сотрудничестве с Группой клинических испытаний СПИДа. Несколько испытаний также спонсировались промышленностью. Продольное обсервационное исследование (LSOCA) было проведено исследователями SOCA для получения информации об глазных осложнениях в эпоху ВААРТ.
Несколько испытаний также спонсировались промышленностью. Продольное обсервационное исследование (LSOCA) было проведено исследователями SOCA для получения информации об глазных осложнениях в эпоху ВААРТ.
Исследовательская группа по изучению глазных осложнений СПИДа (SOCA) в сотрудничестве с Группой клинических испытаний СПИДа (ACTG). Исследование глазных осложнений СПИДа с фоскарнет-ганцикловирным цитомегаловирусным ретинитом: 1. Обоснование, дизайн и методы. Испытания Control Clin 1992; 13: 22–39.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Смертность у пациентов с синдромом приобретенного иммунодефицита, получавших лечение фоскарнетом или ганцикловиром по поводу цитомегаловирусного ретинита. N Engl J Med 1992; 326: 213–20.
Группа клинических испытаний. Исследование фоскарнет-ганцикловирного цитомегаловирусного ретинита: 4. Визуальные результаты. Офтальмология 1994;101:1250–61.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу.Заболеваемость и токсические эффекты, связанные с терапией ганцикловиром или фоскарнетом, в рандомизированном исследовании цитомегаловирусного ретинита. Arch Intern Med 1995; 155: 65–74.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Противовирусные эффекты терапии фоскарнетом и ганцикловиром на антиген р24 вируса иммунодефицита человека у больных СПИДом и цитомегаловирусным ретинитом. J Infect Dis 1995; 172: 613–21.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу.Комбинированная терапия фоскарнетом и ганцикловиром по сравнению с монотерапией для лечения рецидивирующего цитомегаловирусного ретинита у пациентов со СПИДом: исследование повторного лечения цитомегаловирусом.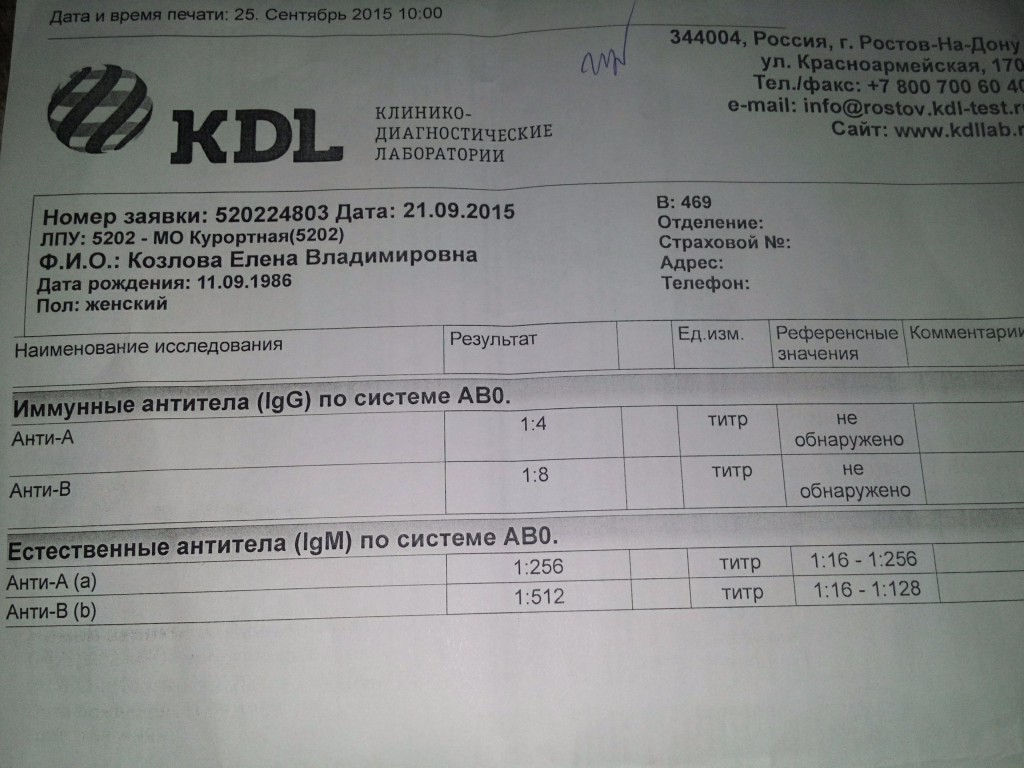 Arch Ophthalmol 1996; 114: 23–33.
Arch Ophthalmol 1996; 114: 23–33.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Клиническая и фотографическая оценка лечения цитомегаловирусного ретинита: отчет об испытании цитомегаловирусного ретинита фоскарнет-ганцикловиром 8. Arch Ophthalmol 1996;114:848–55.
Ву А.В., Колесон Л.С., Холбрук Дж. и др. Измерение зрительных функций и качества жизни у пациентов с цитомегаловирусным ретинитом: разработка опросника. Arch Ophthalmol 1996;114:841–7.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Оценка цитомегаловирусного ретинита: клиническая оценка по сравнению с централизованной оценкой фотографий глазного дна. Arch Ophthalmol 1996; 114:791–805.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Адъювантная терапия MSL-109 цитомегаловирусного ретинита у пациентов с синдромом приобретенного иммунодефицита: исследование моноклонального антитела к цитомегаловирусному ретиниту. Arch Ophthalmol 1997; 115:1528–36. [Исправление: Arch Ophthalmol 1998;116:296.]
Адъювантная терапия MSL-109 цитомегаловирусного ретинита у пациентов с синдромом приобретенного иммунодефицита: исследование моноклонального антитела к цитомегаловирусному ретиниту. Arch Ophthalmol 1997; 115:1528–36. [Исправление: Arch Ophthalmol 1998;116:296.]
Исследовательская группа по изучению глазных осложнений при СПИДе в сотрудничестве с Группой клинических испытаний СПИДа. Парентеральный цидофовир при цитомегаловирусном ретините у пациентов со СПИДом: исследование HPMPC Peripheral Cytomegalovirus Retinitis.Рандомизированное контролируемое исследование. Ann Intern Med 1997; 126: 264–74.
Исследовательская группа по изучению глазных осложнений СПИДа (SOCA) в сотрудничестве с Группой клинических испытаний СПИДа (ACTG). Регматогенная отслойка сетчатки у пациентов с цитомегаловирусным ретинитом: исследование фоскарнет-ганцикловирного цитомегаловирусного ретинита. Ам Дж. Офтальмол 1997; 124:61–70.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу.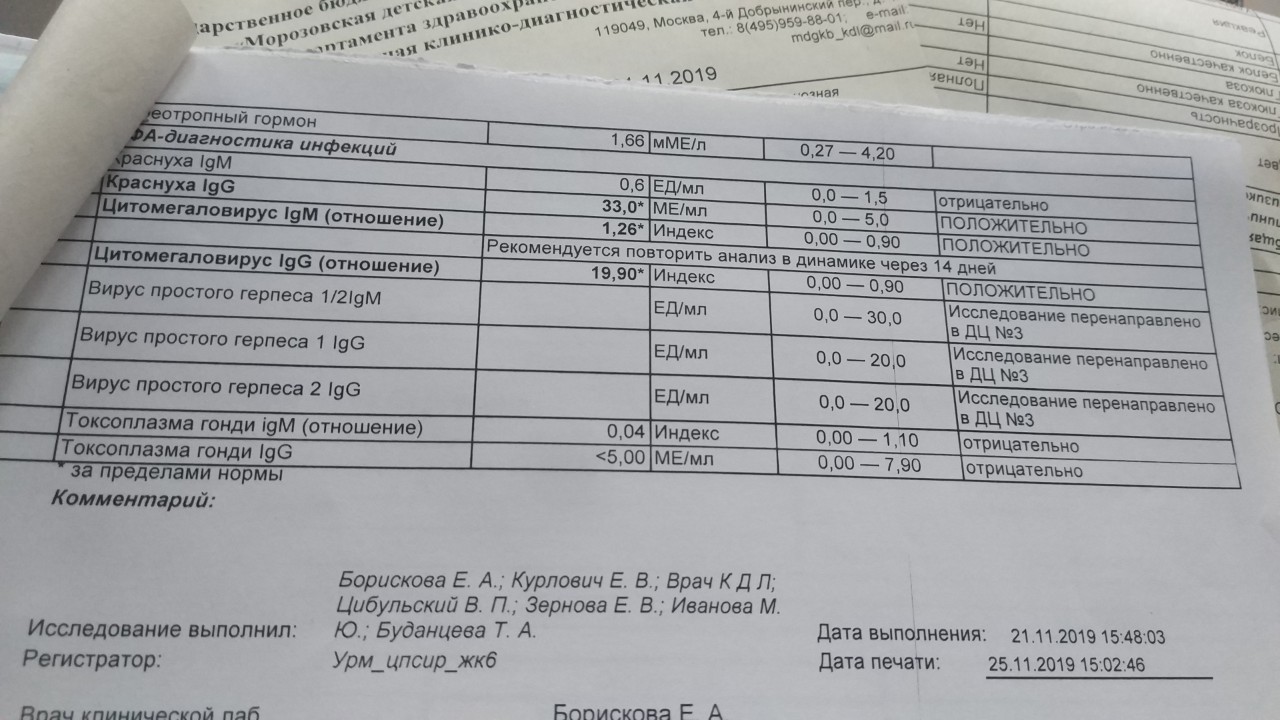 Испытание фоскарнет-ганцикловирного цитомегаловирусного ретинита: 5. Клинические особенности цитомегаловирусного ретинита при постановке диагноза. Ам Дж. Офтальмол 1997; 124:141–57.
Испытание фоскарнет-ганцикловирного цитомегаловирусного ретинита: 5. Клинические особенности цитомегаловирусного ретинита при постановке диагноза. Ам Дж. Офтальмол 1997; 124:141–57.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Результаты посева цитомегаловируса (ЦМВ), лекарственная устойчивость и клинический исход у пациентов со СПИДом с ЦМВ, получавших либо фоскарнет, либо ганцикловир. J Infect Dis 1997;176:50–8.
Холбрук Дж.Т., Дэвис М.Д., Хаббард Л.Д. и др.Факторы риска развития цитомегаловирусного ретинита у больных с синдромом приобретенного иммунодефицита. Arch Ophthalmol 2000; 118:1196–204.
Холбрук Дж.Т., Мейнерт К.Л., Ван Натта М.Л., и др. Фотографические измерения цитомегаловирусного ретинита в качестве заменителей визуальных результатов у пролеченных пациентов. Arch Ophthalmol 2001; 119: 554–63.
Мартин Б.К., Гилпин А.К., Джабс Д.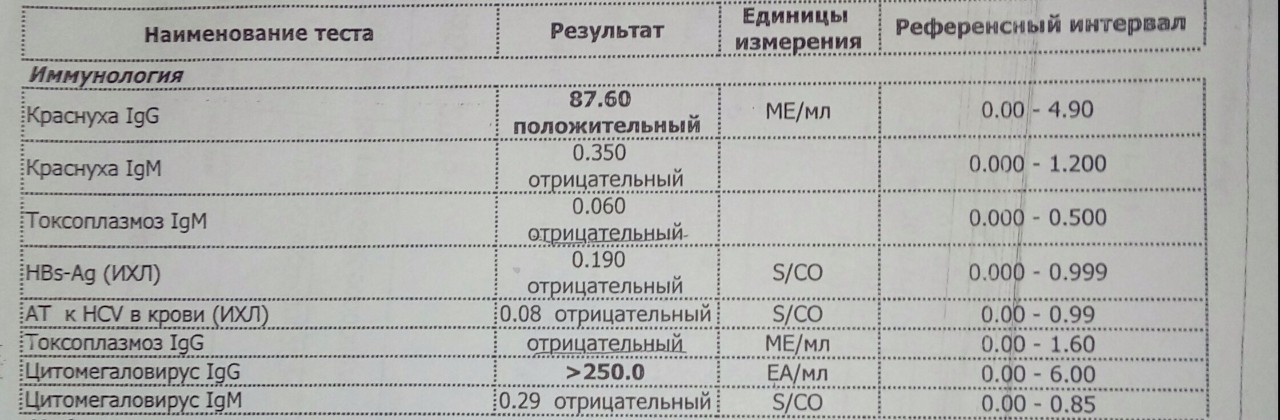 А. и др. за исследования глазных осложнений исследовательской группы по СПИДу. Надежность, достоверность и отзывчивость общих и специфических для заболевания показателей качества жизни в клинических испытаниях цитомегаловирусного ретинита.J Clin Epidemiol 2001; 54: 376–86.
А. и др. за исследования глазных осложнений исследовательской группы по СПИДу. Надежность, достоверность и отзывчивость общих и специфических для заболевания показателей качества жизни в клинических испытаниях цитомегаловирусного ретинита.J Clin Epidemiol 2001; 54: 376–86.
Исследования глазных осложнений Исследовательской группы по СПИДу в сотрудничестве с Группой клинических испытаний по СПИДу. Имплантат ганцикловира плюс пероральный ганцикловир по сравнению с парентеральным цидофовиром для лечения цитомегаловирусного ретинита у пациентов с синдромом приобретенного иммунодефицита: исследование ганцикловира цидофовира цитомегаловирусного ретинита. Am J Ophthalmol 2001;131:457–67.
Jabs DA, Gilpin AMK, Min Y-I, и др. за исследования глазных осложнений исследовательской группы по СПИДу.Вирусная нагрузка ВИЧ и цитомегаловируса и клинические исходы у пациентов со СПИДом и цитомегаловирусным ретинитом: исследование моноклонального антитела к цитомегаловирусному ретиниту. СПИД 2002;16:877–87.
СПИД 2002;16:877–87.
Холбрук Дж.Т., Джабс Д.А., Вайнберг Д.В., и др. для Исследовательской группы по изучению глазных осложнений СПИДа (SOCA). Потеря зрения у пациентов с цитомегаловирусным ретинитом и синдромом приобретенного иммунодефицита до широкого распространения высокоактивной антиретровирусной терапии. Arch Ophthalmol 2003; 121: 99–107.
Данн Дж.П., Ван Натта М., Фостер Г. и др. за исследования глазных осложнений исследовательской группы по СПИДу. Осложнения имплантации ганцикловира у пациентов с цитомегаловирусным ретинитом. Испытание ганцикловира цидофовира цитомегаловирусного ретинита. Сетчатка 2004; 24:41–50.
Джабс Д.А., Ван Натта М., Торн Дж.Е., и др. за исследования глазных осложнений исследовательской группы СПИДа. Течение цитомегаловирусного ретинита в эпоху высокоактивной антиретровирусной терапии.I. Прогрессирование ретинита. Офтальмология 2004;111:2224–31.
Джабс Д.А., Ван Натта М., Торн Дж. Е., и др. за исследования глазных осложнений исследовательской группы СПИДа. Течение цитомегаловирусного ретинита в эпоху высокоактивной антиретровирусной терапии. 2. Вовлечение второго глаза и отслойка сетчатки. Офтальмология 2004;111:2232–9.
Е., и др. за исследования глазных осложнений исследовательской группы СПИДа. Течение цитомегаловирусного ретинита в эпоху высокоактивной антиретровирусной терапии. 2. Вовлечение второго глаза и отслойка сетчатки. Офтальмология 2004;111:2232–9.
Kempen JH, Min Y-I, Freeman WR, и др. за исследования глазных осложнений исследовательской группы СПИДа. Риск иммуновосстановительного увеита у больных СПИДом и цитомегаловирусным ретинитом.Офтальмология 2006;113:684–94.
Thorne JE, Jabs DA, Kempen JH и др. за исследования глазных осложнений исследовательской группы по СПИДу. Частота и факторы риска потери остроты зрения у больных СПИДом и цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Офтальмология 2006;113:1432–40.
Thorne JE, Jabs DA, Kempen JH и др. за исследования глазных осложнений исследовательской группы по СПИДу. Причины снижения остроты зрения у больных СПИДом и цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Офтальмология 2006;113:1441–5.
Офтальмология 2006;113:1441–5.
Thorne JE, Jabs DA, Kempen JH и др. за исследования глазных осложнений исследовательской группы по СПИДу. Частота и факторы риска потери остроты зрения у больных СПИДом и цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Офтальмология 2007;114:787–93.
Джабс Д.А., Ван Натта М.Л., Холбрук Дж.Т. и др. за исследования глазных осложнений исследовательской группы СПИДа. Продольное исследование глазных осложнений СПИДа.1. Окулярные диагнозы при поступлении. Офтальмология 2007;114:780-6.
Джабс Д.А., Ван Натта М.Л., Холбрук Дж.Т. и др. для Исследовательской группы по изучению глазных осложнений СПИДа. Продольное исследование глазных осложнений СПИДа. 2. Результаты обследования глаз при поступлении. Офтальмология 2007;114:787-93.
Гангапутра С., Пак Дж.В., Пэн В. и др. за исследования глазных осложнений исследовательской группы СПИДа. Переход от пленки к цифровой фотографии глазного дна в лонгитюдных исследованиях глазных осложнений СПИДа. Сетчатка 2012; 32:600-605.
Сетчатка 2012; 32:600-605.
Высококоличественное серологическое определение антител к цитомегаловирусу (ЦМВ) | Virology Journal
Dunn W, Chou C, Li H, Hai R, Patterson D, Stolc V, Zhu H, Liu F: Функциональное профилирование генома цитомегаловируса человека. Proceedings of the National Academy of Sciences of the United States of America 2003, 100 (24):14223-14228. 10.1073/pnas.2334032100
PubMed Central КАС Статья пабмед Google Scholar
Ho М: История цитомегаловируса и его заболеваний. Медицинская микробиология и иммунология 2008, 197 (2):65-73. 10.1007/s00430-007-0066-x
Артикул пабмед Google Scholar
Staras SA, Dollard SC, Radford KW, Flanders WD, Pass RF, Cannon MJ: Распространенность цитомегаловирусной инфекции в США, 1988–1994 гг. Clin Infect Dis 2006, 43 (9):1143-1151.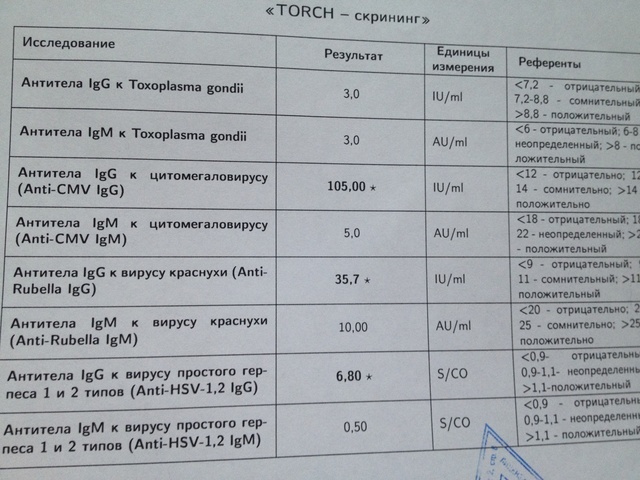 10.1086/508173
10.1086/508173
Артикул пабмед Google Scholar
Steininger C: Клиническая значимость цитомегаловирусной инфекции у больных с нарушениями иммунной системы. Clin Microbiol Infect 2007, 13 (10):953-963. 10.1111/j.1469-0691.2007.01781.x
КАС Статья пабмед Google Scholar
Singh N: Цитомегаловирусная инфекция у реципиентов трансплантатов паренхиматозных органов: новые проблемы и их последствия для профилактических стратегий. J Clin Virol 2006, 35 (4):474-477. 10.1016/j.jcv.2005.10.014
Статья пабмед Google Scholar
Pamphilon DH, Rider JR, Barbara JA, Williamson LM: Профилактика трансфузионно-трансмиссивной цитомегаловирусной инфекции. Трансфузионная медицина (Оксфорд, Англия) 1999, 9 (2):115-123.
КАС Статья Google Scholar
Эпштейн С.Е., Спейр Э., Чжоу Ю.Ф., Гетта Э., Леон М., Финкель Т.: Роль инфекции в рестенозе и атеросклерозе: фокус на цитомегаловирус. Ланцет 1996, 348 (Приложение 1):s13-17. 10.1016/С0140-6736(96)98005-8
КАС Статья пабмед Google Scholar
Beqaj SH, Lerner AM, Fitzgerald JT: Иммуноанализ с ранними антигенами цитомегаловируса из генных продуктов p52 и CM2 (UL44 и UL57) выявляет активную инфекцию у пациентов с синдромом хронической усталости. Журнал клинической патологии 2008, 61 (5):623-626. 10.1136/JCP.2007.050633
CAS Статья пабмед Google Scholar
Berg PJ, van Stijn A, Ten Berge IJ, van Lier RA: Отпечаток пальца, оставленный цитомегаловирусной инфекцией в Т-клеточном компартменте человека. J Clin Virol 2008, 41 (3):213-217. 10.1016/j.jcv.2007.10.016
J Clin Virol 2008, 41 (3):213-217. 10.1016/j.jcv.2007.10.016
Статья пабмед Google Scholar
Almanzar G, Schwaiger S, Jenewein B, Keller M, Herndler-Brandstetter D, Wurzner R, Schonitzer D, Grubeck-Loebenstein B: Длительная цитомегаловирусная инфекция приводит к значительным изменениям в составе CD8+ T-клеточного репертуара, что может лежать в основе дисбаланса профиля продукции цитокинов у лиц пожилого возраста. Журнал вирусологии 2005, 79 (6):3675-3683. 10.1128/ОВИ.79.6.3675-3683.2005
PubMed Central КАС Статья пабмед Google Scholar
Olsson J, Wikby A, Johansson B, Lofgren S, Nilsson BO, Ferguson FG: Возрастные изменения субпопуляций Т-лимфоцитов периферической крови и цитомегаловирусная инфекция у пожилых людей: шведское продольное иммунное исследование OCTO. Механизмы старения и развития 2000, 121 (1–3):187-201.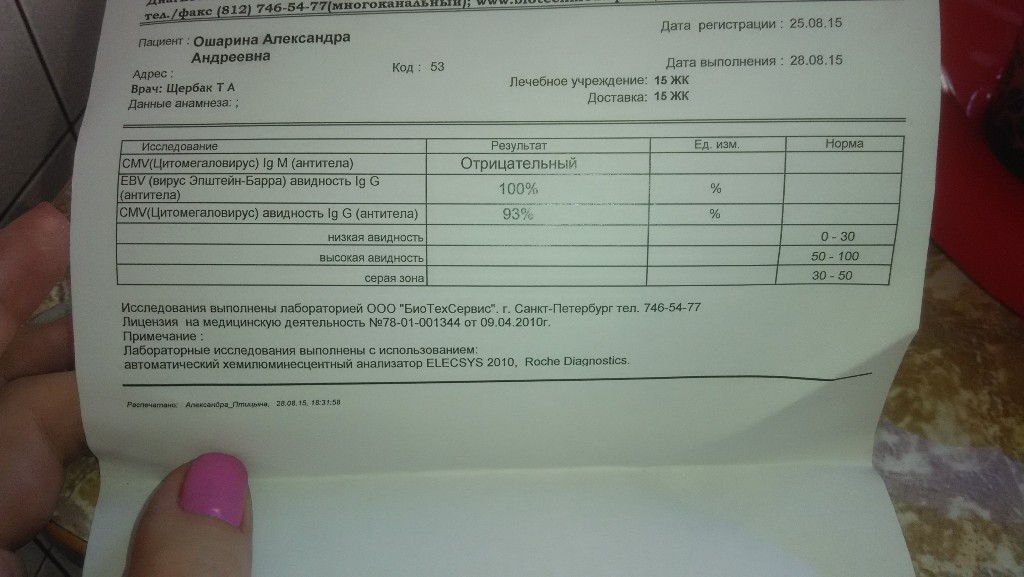
КАС пабмед Google Scholar
Wikby A, Johansson B, Olsson J, Lofgren S, Nilsson BO, Ferguson F: Расширение субпопуляций CD8 T-лимфоцитов периферической крови и связь с цитомегаловирусной серопозитивностью у пожилых людей: шведское иммунное исследование NONA. Экспериментальная геронтология 2002, 37 (2–3):445-453. 10.1016/S0531-5565(01)00212-1
КАС Статья пабмед Google Scholar
Cook CH, Martin LC, Yenchar JK, Lahm MC, McGuinness B, Davies EA, Ferguson RM: Скрытые вирусные инфекции семейства герпеса эндемичны у хирургических больных в критическом состоянии. Реаниматология 2003, 31 (7):1923-1929. 10.1097/01.CCM.0000070222.11325.C4
Артикул пабмед Google Scholar
Cook CH, Yenchar JK, Kraner TO, Davies EA, Ferguson RM: Скрытые вирусы семейства герпеса могут повышать смертность у тяжелобольных хирургических больных. Американский журнал хирургии 1998, 176 (4):357-360. 10.1016/S0002-9610(98)00205-0
Американский журнал хирургии 1998, 176 (4):357-360. 10.1016/S0002-9610(98)00205-0
КАС Статья пабмед Google Scholar
Cook CH, Zhang Y, Sedmak DD, Martin LC, Jewell S, Ferguson RM: Реактивация легочного цитомегаловируса вызывает патологию у иммунокомпетентных мышей. Реаниматология 2006, 34 (3):842-849.
Центральный пабмед пабмед Google Scholar
Heininger A, Jahn G, Engel C, Notheisen T, Unertl K, Hamprecht K: Цитомегаловирусные инфекции человека у пациентов в критическом состоянии без подавления иммунитета. Реаниматология 2001, 29 (3):541-547. 10.1097/00003246-200103000-00012
КАС Статья пабмед Google Scholar
Jaber S, Chanques G, Borry J, Souche B, Verdier R, Perrigault PF, Eledjam JJ: Цитомегаловирусная инфекция у пациентов в критическом состоянии: сопутствующие факторы и последствия. Сундук 2005, 127 (1):233-241. 10.1378/грудь.127.1.233
Сундук 2005, 127 (1):233-241. 10.1378/грудь.127.1.233
Артикул пабмед Google Scholar
Limaye AP, Kirby KA, Rubenfeld GD, Leisenring WM, Bulger EM, Neff MJ, Gibran NS, Huang ML, Santo Hayes TK, Corey L, Boeckh M: Реактивация цитомегаловируса у иммунокомпетентных пациентов в критическом состоянии. Джама 2008, 300 (4):413-422. 10.1001/jama.300.4.413
Центр пабмед КАС Статья пабмед Google Scholar
Drew WL: Лабораторная диагностика цитомегаловирусной инфекции и заболеваний у пациентов с ослабленным иммунитетом. Актуальное мнение по инфекционным болезням 2007, 20 (4):408-411. 10.1097/ККО.0б013е32821ф6010
КАС Статья пабмед Google Scholar
Kropff B, Landini MP, Mach M: ELISA с использованием рекомбинантных белков для обнаружения нейтрализующих антител против цитомегаловируса человека.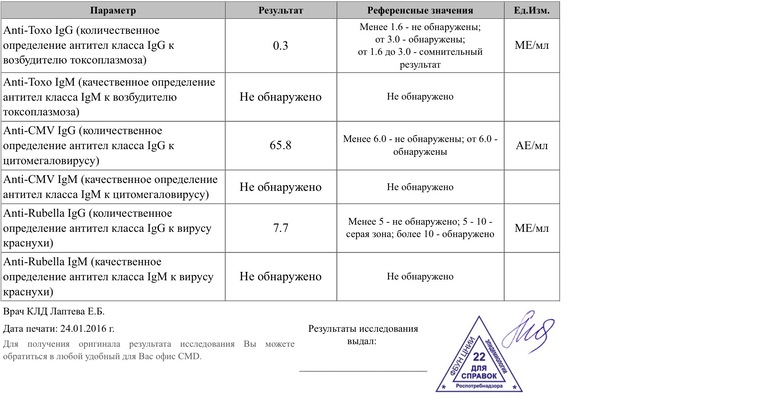 Журнал медицинской вирусологии 1993, 39 (3):187-195. 10.1002/джмв.18903
Журнал медицинской вирусологии 1993, 39 (3):187-195. 10.1002/джмв.18903
КАС Статья пабмед Google Scholar
Landini MP: Новые подходы и перспективы в диагностике цитомегаловируса. Прогресс в медицинской вирусологии Fortschritte der medizinischen Virusforschung 1993, 40: 157-177.
КАС Google Scholar
Plachter B, Wieczorek L, Scholl BC, Ziegelmaier R, Jahn G: Обнаружение антител к цитомегаловирусу с помощью твердофазного иммуноферментного анализа с использованием рекомбинантных полипептидов большого фосфорилированного тегументного белка pp150. Журнал клинической микробиологии 1992, 30 (1):201-206.
Центральный пабмед КАС пабмед Google Scholar
Baccard-Longere M, Freymuth F, Cointe D, Seigneurin JM, Grangeot-Keros L: Многоцентровая оценка быстрого и удобного метода определения авидности цитомегаловирусного иммуноглобулина G. Клинико-диагностическая лаборатория иммунологии 2001, 8 (2):429-431.
Клинико-диагностическая лаборатория иммунологии 2001, 8 (2):429-431.
Центральный пабмед КАС пабмед Google Scholar
Burbelo PD, Ching KH, Mattson TL, Light JS, Bishop LR, Kovacs JA: Быстрая количественная оценка антител и создание профилей ответа всего протеомного антитела с использованием LIPS (системы иммунопреципитации люциферазы). Биохимические и биофизические исследовательские сообщения 2007, 352 (4):889-895.10.1016/j.bbrc.2006.11.140
CAS Статья пабмед Google Scholar
Burbelo PD, Goldman R, Mattson TL: Упрощенный метод иммунопреципитации для количественного измерения ответов антител в образцах клинической сыворотки с использованием слитых белков люциферазы Renilla-антиген, продуцируемых млекопитающими. Биотехнология BMC 2005, 5: 22. 10.1186/1472-6750-5-22
PubMed Central Статья пабмед Google Scholar

Burbelo PD, Groot S, Dalakas MC, Iadarola MJ: Высокое разрешение профилирования аутоантител к декарбоксилазам глутаминовой кислоты GAD65/GAD67 при синдроме скованности. Связь для биохимических и биофизических исследований 2008, 366 (1):1-7. 10.1016/j.bbrc.2007.11.077
PubMed Central КАС Статья пабмед Google Scholar
Burbelo PD, Hirai H, Leahy H, Lernmark A, Ivarsson SA, Iadarola MJ, Notkins AL: Новый люминесцентный анализ аутоантител к белку 2, связанному с инсулиномой, подготовленному клетками млекопитающих. Лечение диабета 2008, 31 (9):1824-1826. 10.2337/dc08-0286
Центральный пабмед Статья пабмед Google Scholar
Burbelo PD, Meoli E, Leahy HP, Graham J, Yao K, Oh U, Janik JE, Mahieux R, Kashanchi F, Iadarola MJ, Jacobson S: Профилирование антител против HTLV выявляет сигнатуру антител для HTLV-I-ассоциированная миелопатия/тропический спастический парапарез (HAM/TSP).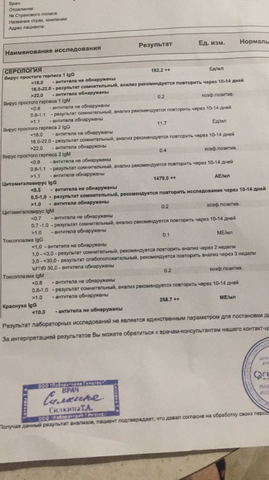 Ретровирусология 2008, 5: 96.10.1186/1742-4690-5-96
Ретровирусология 2008, 5: 96.10.1186/1742-4690-5-96
Центр пабмед Статья пабмед Google Scholar
Бурбело П.Д., Раманатан Р., Клион А.Д., Иадарола М.Дж., Натман Т.Б.: Быстрый, новый, специфичный, высокопроизводительный анализ для диагностики инфекции Loa loa. Журнал клинической микробиологии 2008, 46 (7):2298-2304. 10.1128/JCM.00490-08
PubMed Central КАС Статья пабмед Google Scholar
Ramanathan R, Burbelo PD, Groot S, Iadarola MJ, Neva FA, Nutman TB: Анализ систем иммунопреципитации с использованием люциферазы повышает чувствительность и специфичность диагностики инфекции Strongyloides stercoralis. Журнал инфекционных болезней 2008, 198 (3):444-451. 10.1086/589718
Центральный пабмед Статья пабмед Google Scholar
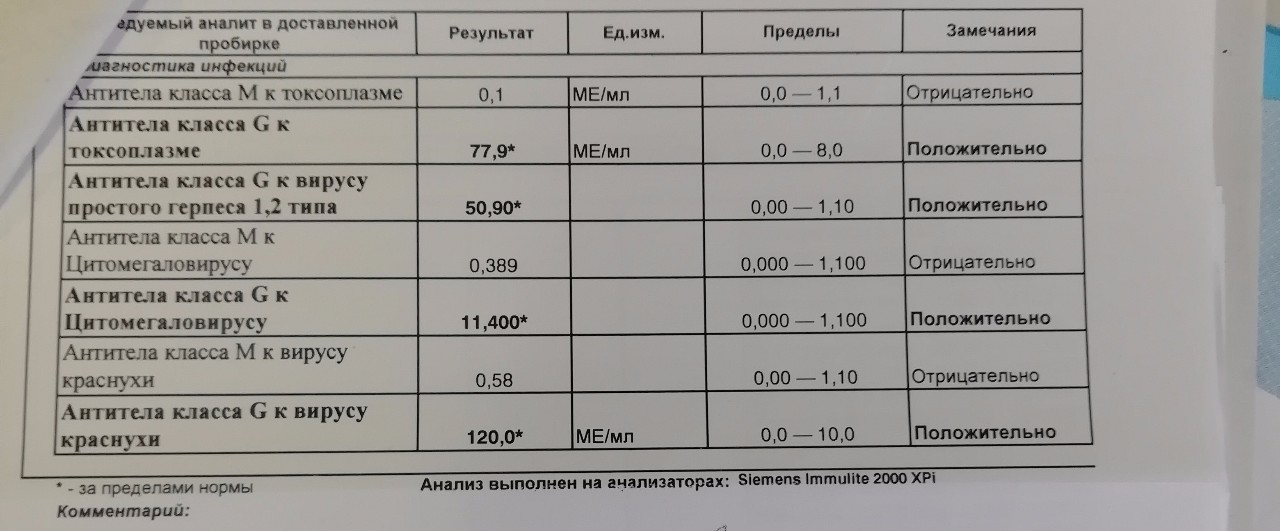
Burbelo PD, Hoshino Y, Leahy H, Krogmann T, Hornung RL, Iadarola MJ, Cohen JI: Серологическая диагностика вируса простого герпеса человека типов 1 и 2 с помощью системы иммунопреципитации люциферазы. Clin Vaccine Immunol 2009, 16 (3):336-71. 10.1128/CVI.00350-08
Артикул Google Scholar
Weber B, Fall EM, Berger A, Doerr HW: Скрининг доноров крови на антитела IgG цитомегаловируса человека (HCMV) с помощью иммуноферментного анализа с использованием рекомбинантных антигенов. J Clin Virol 1999, 14 (3):173-181. 10.1016/С1386-6532(99)00060-8
КАС Статья пабмед Google Scholar
Новак З., Росс С.А., Патро Р.К., Пати С.К., Редди М.К., Персер М., Бритт В.Дж., Боппана С.Б.: Метод твердофазного иммуноферментного анализа для выявления ответов антител, специфичных к штамму цитомегаловируса.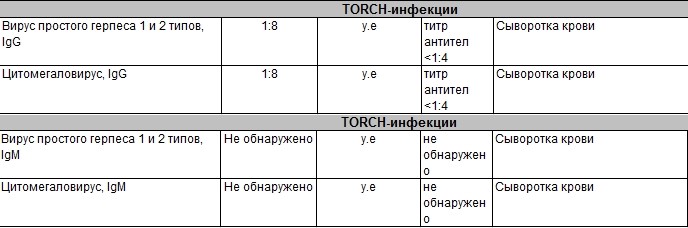 Клин Вакцина Иммунол 2009, 16 (2):288-290. 10.1128/CVI.00281-08
Клин Вакцина Иммунол 2009, 16 (2):288-290. 10.1128/CVI.00281-08
PubMed Central КАС Статья пабмед Google Scholar
Границы | Цитомегаловирусная инфекция может спровоцировать начало или рецидивы болезни Стилла у взрослых
Введение
Болезнь Стилла у взрослых (AOSD) — редкое, но клинически хорошо известное системное воспалительное заболевание.Он обычно характеризуется высокой лихорадкой, исчезающей кожной сыпью, артралгией, болью в горле и нейтрофилией (1–3). Несмотря на то, что этиология AOSD остается неизвестной, есть доказательства того, что она вызывается факторами окружающей среды с генетической предрасположенностью (4). Давно предполагалось, что вирусные инфекции могут способствовать возникновению и рецидиву AOSD, хотя окончательных доказательств представлено не было.
Связь между инфекционным агентом и развитием AOSD давно обсуждается (5), и в исследовании 1988 г.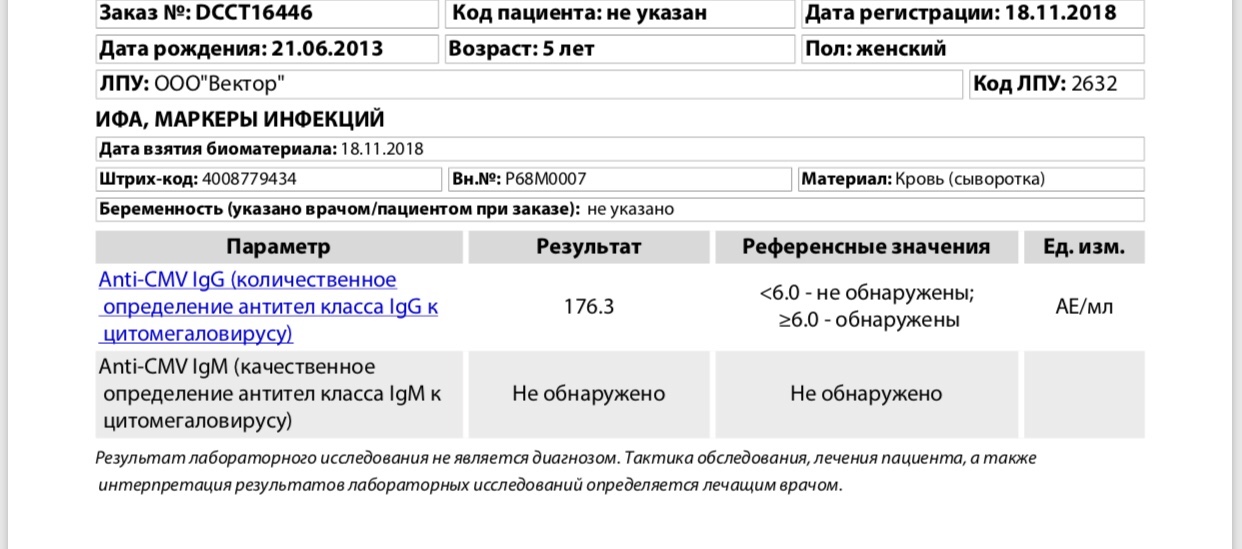 сообщалось, что у трех из пяти пациентов с AOSD были получены признаки вирусных инфекций, включая эховирус 7 и вирус краснухи (6).С тех пор несколько исследователей сообщили о возникновении AOSD после вирусных инфекций, включая вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV), вирус герпеса человека 6, вирус гриппа, вирусы парагриппа или вирус Коксаки (7–9). Кроме того, у пациентов с AOSD часто наблюдается высокая температура, боль в горле и сыпь непосредственно перед началом заболевания или рецидивом. Эти проявления были похожи на вирусные инфекции с сигналом инфекционной опасности для запуска воспалительной реакции (10). Исследования, проведенные в течение последнего десятилетия, подчеркивали важность вирусных инфекций для возникновения AOSD, в то время как имеющиеся данные были основаны на некоторых случаях, а когортное исследование для определения наличия вирусных инфекций при AOSD все еще отсутствует (11).Следовательно, необходимо предоставить больше доказательств для изучения связи между вирусными инфекциями и возникновением AOSD с помощью когортного исследования.
сообщалось, что у трех из пяти пациентов с AOSD были получены признаки вирусных инфекций, включая эховирус 7 и вирус краснухи (6).С тех пор несколько исследователей сообщили о возникновении AOSD после вирусных инфекций, включая вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV), вирус герпеса человека 6, вирус гриппа, вирусы парагриппа или вирус Коксаки (7–9). Кроме того, у пациентов с AOSD часто наблюдается высокая температура, боль в горле и сыпь непосредственно перед началом заболевания или рецидивом. Эти проявления были похожи на вирусные инфекции с сигналом инфекционной опасности для запуска воспалительной реакции (10). Исследования, проведенные в течение последнего десятилетия, подчеркивали важность вирусных инфекций для возникновения AOSD, в то время как имеющиеся данные были основаны на некоторых случаях, а когортное исследование для определения наличия вирусных инфекций при AOSD все еще отсутствует (11).Следовательно, необходимо предоставить больше доказательств для изучения связи между вирусными инфекциями и возникновением AOSD с помощью когортного исследования.
Цитокиновый шторм при AOSD имеет решающее значение для патогенеза AOSD, который активируется клетками врожденного иммунитета. При AOSD обнаруживается избыточная продукция провоспалительных цитокинов, включая TNF-α, интерлейкин (IL)-1β, IL-18 и IL-6 (2). Отправной точкой цитокинового шторма, вероятно, являются специфические сигналы вирусной опасности. Защита хозяина от вирусов частично зависит от рецепторов, которые контролируют присутствие чужеродных нуклеиновых кислот, связанных с вирусной инфекцией (12).Идентифицировано большинство рецепторов нуклеиновых кислот, ответственных за индукцию провоспалительных факторов транскрипции. Семейство RIG-I-подобных рецепторов РНК-сенсоров включает индуцируемый ретиноевой кислотой ген I (RIG-I; также известный как DExD/H-box helicases 58, DDX58) и ген 5, ассоциированный с дифференцировкой меланомы (MDA5; также известный как IFIh2, интерферон). индуцируется геликазным доменом C 1). Датчики ДНК включают AIM2 и циклическую GMP-AMP-синтетазу (cGAS) (13). RIG-I-подобные рецепторы обнаруживают молекулы РНК, отсутствующие у неинфицированного хозяина (14).Рецепторы ДНК предупреждают клетку об аномальном присутствии чужеродных нуклеиновых кислот в цитозоле (15). Сигнальные пути, запускаемые рецепторами РНК и ДНК, могут активировать инфламмасому NOD-подобного рецепторного белка 3 (NLRP3), продуцировать провоспалительные цитокины и хемокины (16). На сегодняшний день сигнальный путь вируса при AOSD не оценивался.
RIG-I-подобные рецепторы обнаруживают молекулы РНК, отсутствующие у неинфицированного хозяина (14).Рецепторы ДНК предупреждают клетку об аномальном присутствии чужеродных нуклеиновых кислот в цитозоле (15). Сигнальные пути, запускаемые рецепторами РНК и ДНК, могут активировать инфламмасому NOD-подобного рецепторного белка 3 (NLRP3), продуцировать провоспалительные цитокины и хемокины (16). На сегодняшний день сигнальный путь вируса при AOSD не оценивался.
В настоящем исследовании мы стремились изучить связь ЦМВ, вируса простого герпеса-1 (ВПГ-1), вируса простого герпеса-2 (ВПГ-2) и ВЭБ с клиническими проявлениями путем измерения противовирусных антител IgG и IgM. в плазме от 100 пациентов с AOSD и 70 соответствующих здоровых контролей.И мы определили связь между появлением ДНК ЦМВ и началом заболевания и рецидивами. Наконец, мы определили паттерн экспрессии ДНК-чувствительных рецепторов у пациентов с AOSD. Наши результаты обеспечили дальнейшее понимание роли вирусной инфекции в патогенезе AOSD.
Материалы и методы
Пациенты с AOSD и здоровые субъекты контроля
Всего в настоящее исследование было включено 100 пациентов с AOSD (69 активных и 31 неактивный пациент с AOSD) и 70 HCs.Все пациенты соответствовали критериям Yamaguchi после исключения пациентов с инфекционными, неопластическими и аутоиммунными заболеваниями (17). Пациентов считали имеющими активный AOSD, если у них была лихорадка и/или артралгия/артрит и/или любое предполагаемое поражение кожи и/или боль в горле. Пациенты с впервые выявленным заболеванием определялись как пациенты с недавно диагностированным AOSD с первым появлением признаков или симптомов и без предшествующего лечения стероидными или синтетическими противоревматическими препаратами, модифицирующими заболевание. Все пациенты с HC были набраны из добровольцев соответствующего возраста и пола без аутоиммунных, ревматических или других заболеваний в анамнезе.Информация о демографических и клинических данных вводилась в базу данных вместе с результатами лабораторных исследований.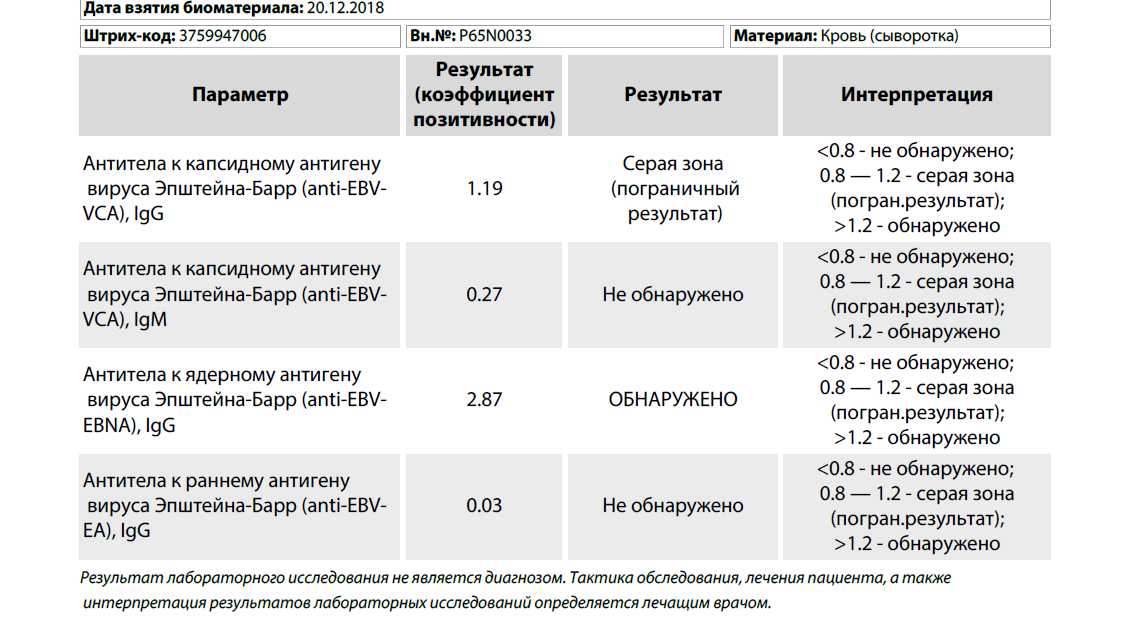 Активность AOSD у каждого пациента оценивалась с использованием модифицированной шкалы Pouchot (18). Экспериментальный план был одобрен Комитетом по этике Шанхайского университета Цзяо Тонг (идентификатор 2016-62), и все участники дали информированное согласие. Все образцы плазмы и сыворотки хранили при температуре -80°C сразу после сбора.
Активность AOSD у каждого пациента оценивалась с использованием модифицированной шкалы Pouchot (18). Экспериментальный план был одобрен Комитетом по этике Шанхайского университета Цзяо Тонг (идентификатор 2016-62), и все участники дали информированное согласие. Все образцы плазмы и сыворотки хранили при температуре -80°C сразу после сбора.
Обнаружение противовирусных антител IgG и IgM в плазме с помощью ИФА
Противовирусные (CMV, HSV1, HSV2, EBV) антитела в плазме анализировали с помощью наборов ELISA (Trinity Biotech, Нью-Йорк, США) в соответствии с инструкциями производителей.96-луночные планшеты инкубировали с плазмой человека (1:81) при 37°C в течение 2 ч и пять раз промывали PBS плюс 0,05% Tween-20. Отрицательный контроль, положительный контроль, стандарты добавляли для подтверждения достоверности эксперимента. В каждую лунку добавляли вторичные моноклональные антитела козы против IgM или IgG человека, конъюгированные с пероксидазой хрена (HRP). После пяти промывок PBS плюс 0,05% Tween 20 добавляли 100 мкл раствора тетраметилбензидинового субстрата (TMB) и образцы инкубировали при комнатной температуре. Реакцию останавливали добавлением 100 мкл 2 N H 2 SO 4 на лунку и измеряли оптическую плотность (OD) при 450 нм. Пороговые значения были равны среднему значению ОП стандартов, умноженному на пограничный фактор.
Реакцию останавливали добавлением 100 мкл 2 N H 2 SO 4 на лунку и измеряли оптическую плотность (OD) при 450 нм. Пороговые значения были равны среднему значению ОП стандартов, умноженному на пограничный фактор.
ПЦР в реальном времени для измерения вирусной нагрузки ЦМВ
ДНК из 50 мкл плазмы амплифицировали с использованием прибора системы ПЦР в реальном времени с набором для количественного определения нуклеиновой кислоты цитомегаловируса человека (DAAN Gene Co., Ltd., Китай) в соответствии с инструкциями производителей.Образцы плазмы объемом 50 мкл смешивали с экстракционным раствором нуклеиновой кислоты для очистки ДНК ЦМВ. Два микролитра стандарта ДНК ЦМВ или образца ДНК, а также 3 мкл ДНК-полимеразы Taq смешивали с 40 мкл реакционного раствора HCMV-PCR для амплификации и количественного определения вирусной ДНК. В каждом анализе ПЦР использовали положительный и отрицательный контроли ЦМВ. Фермент активировали при 93°С в течение 2 мин, затем проводили 40 циклов при 93°С в течение 5 с и при 57°С в течение 45 с. Вирусную нагрузку ЦМВ выражали в копиях/мл.
Вирусную нагрузку ЦМВ выражали в копиях/мл.
Определение ДНК-сенсоров
Обнаружение экспрессии ДНК-сенсоров с помощью количественной ПЦР (кПЦР)
Образцы венозной крови были получены от нелеченных, активных и госпитализированных пациентов с AOSD, у которых были доступные образцы на момент включения ( N = 20), и от здоровых контролей ( N = 21).Вкратце, PBMC выделяли центрифугированием в градиенте плотности на Lymphoprep (Axis-Shield, Данди, Великобритания) в соответствии с инструкциями производителя (19). Собранные клетки использовали для выделения РНК с использованием колонок RNAeasy (Qiagen, Hilden, Germany), а кДНК получали с помощью набора для транскрипции PrimeScript RT Master Mix (TaKaRa, Токио, Япония). Уровни экспрессии мРНК экспрессии ДНК-сенсоров определяли с помощью SYBR green master mix (Takara). Для стандартизации уровней экспрессии мРНК ДНК-сенсоров параллельно для каждого образца определяли уровни мРНК гена домашнего хозяйства глицеральдегид-3-фосфатдегидрогеназы (GAPDH).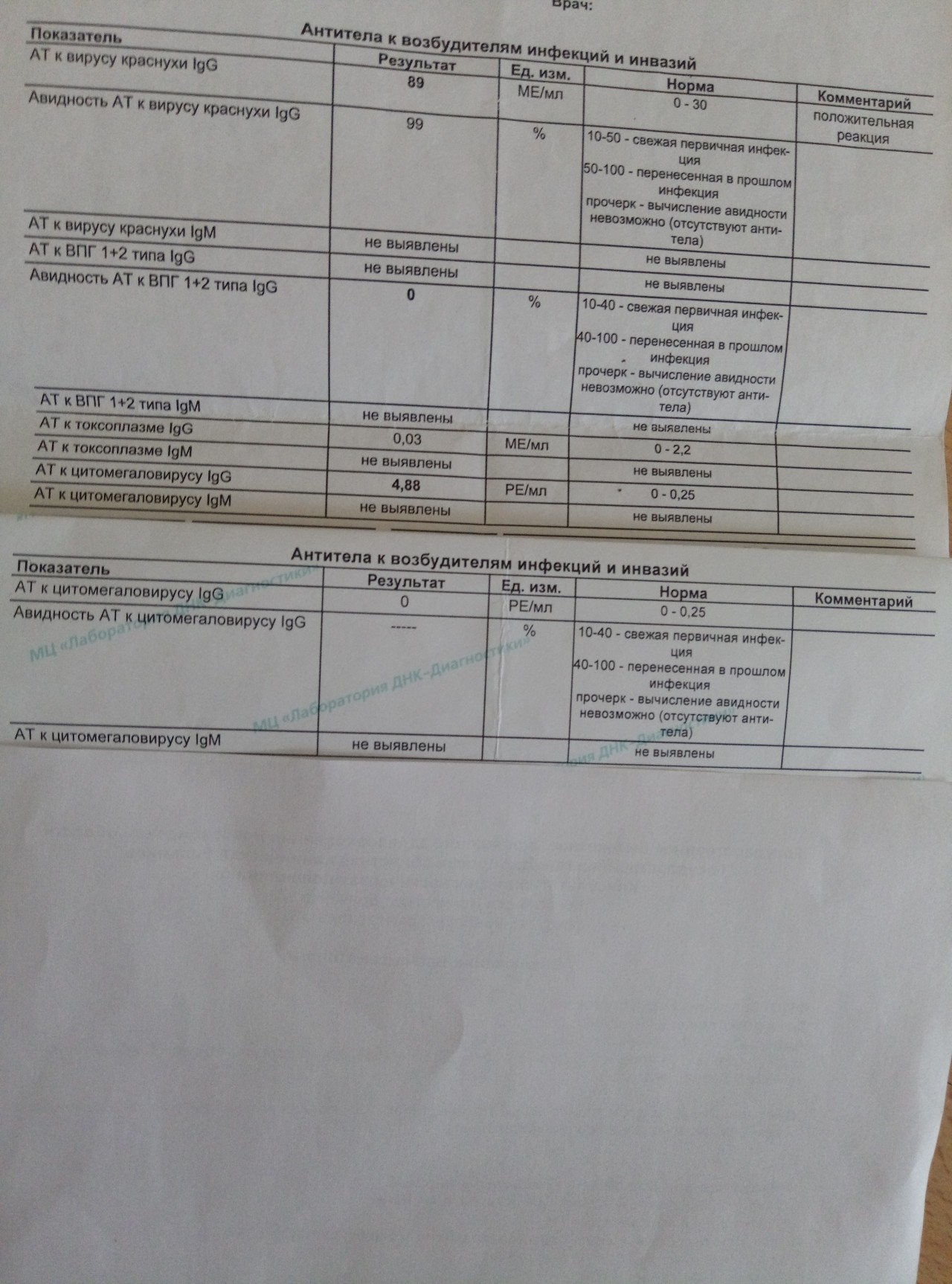 Относительную экспрессию мРНК рассчитывали, как описано ранее.
Относительную экспрессию мРНК рассчитывали, как описано ранее.
Обнаружение экспрессии IFI16 и AIM2 с помощью иммуногистохимического анализа
Биоптаты кожи пациентов с AOSD с типичной кожной сыпью во время пиков лихорадки ( N = 4) и здоровых людей ( N = 4) были проанализированы на экспрессию белка (подробный протокол см. в дополнительных файлах) с помощью иммуногистохимии с использованием следующих антител: кроличьи анти-IFI16 (CST, США) и кроличьи анти-AIM2 (CST, США).Затем реакцию визуализировали под световой микроскопией (BX51 Olympus, Япония).
МСД для определения TNF-α, IL-1β, IL-6 и IL-18
Уровень TNF-α, IL-1β, IL-6 и IL-18 в сыворотке измеряли с помощью электрохемилюминесцентного анализа Meso Scale Discovery (MSD, Rockville, MD, USA) в соответствии с инструкциями производителя.
Статистический анализ
Все данные были подвергнуты статистическому анализу с использованием программного обеспечения SPSS версии 20.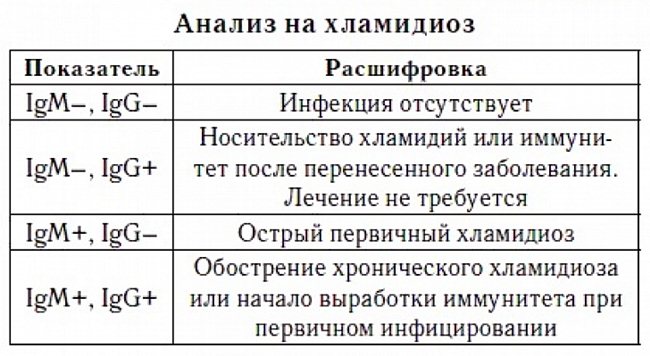 0 (SPSS Inc., Чикаго, Иллинойс, США). Количественные данные выражены как среднее значение ± стандартное отклонение.Данные между двумя группами с гауссовым распределением анализировали с использованием непарного t -критерия, а непараметрические данные оценивали с помощью критерия Манна-Уитни U . Данные среди трех или более групп были проанализированы с использованием однофакторного дисперсионного анализа (ANOVA) или критерия суммы рангов Уилкоксона. Был проведен корреляционный анализ Спирмена, чтобы проверить, коррелируют ли уровни антител против ЦМВ и количество копий ДНК ЦМВ с клиническими переменными. P — значения <0,05 считались статистически значимыми.
0 (SPSS Inc., Чикаго, Иллинойс, США). Количественные данные выражены как среднее значение ± стандартное отклонение.Данные между двумя группами с гауссовым распределением анализировали с использованием непарного t -критерия, а непараметрические данные оценивали с помощью критерия Манна-Уитни U . Данные среди трех или более групп были проанализированы с использованием однофакторного дисперсионного анализа (ANOVA) или критерия суммы рангов Уилкоксона. Был проведен корреляционный анализ Спирмена, чтобы проверить, коррелируют ли уровни антител против ЦМВ и количество копий ДНК ЦМВ с клиническими переменными. P — значения <0,05 считались статистически значимыми.
Результаты
Более высокие уровни антител против цитомегаловируса (CMV) в AOSD
Чтобы определить, есть ли у пациентов с AOSD иммунный ответ на ДНК-вирусы, включая CMV, HSV-1, HSV-2 и EBV, которые были относительно распространенными ДНК-вирусами в клинической практике, мы затем использовали ELISA для тестирования.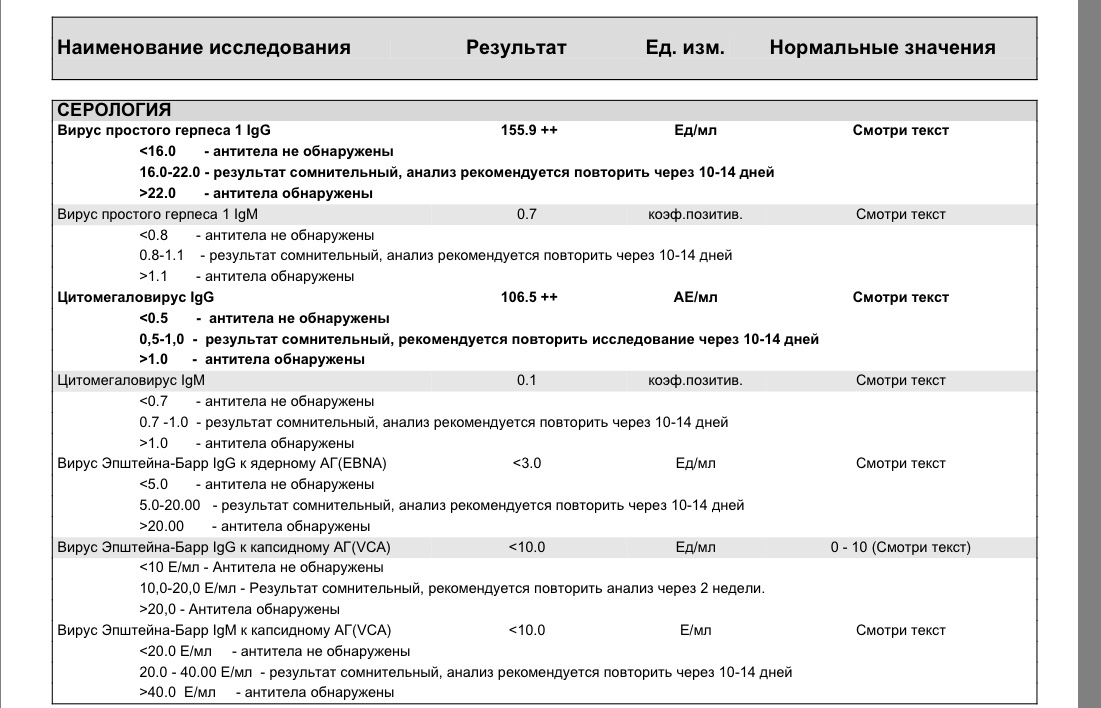 Собирали плазму от 100 пациентов с AOSD (69 активных и 31 неактивный пациент) и 70 здоровых контролей (HCs). Клинические характеристики этих субъектов в каждой группе подробно представлены в таблице 1.
Собирали плазму от 100 пациентов с AOSD (69 активных и 31 неактивный пациент) и 70 здоровых контролей (HCs). Клинические характеристики этих субъектов в каждой группе подробно представлены в таблице 1.
Таблица 1 . Демографические и клинические характеристики лиц с AOSD.
Среди 69 пациентов с активным AOSD общие проявления включали пиковую лихорадку (62, 89,9%), исчезающую сыпь (60, 86,7%), боль в горле (46, 66,7%) и артралгию (55, 79,7%). Гепатомегалия, спленомегалия и лимфаденопатия отмечены у 10 (14,5%), 26 (37,7%) и 26 (37,7%) пациентов по отдельности. Не было никаких существенных различий с точки зрения среднего распределения по возрасту или полу между пациентами с AOSD и HCs ( P = 0.9338 и P = 0,6690).
Как показано на рис. 1А, уровни антител к CMV IgM и IgG были значительно выше у пациентов с AOSD, чем у пациентов с HCs (оба P <0,0001). Положительный уровень анти-CMV антител IgM составил 5% у пациентов с AOSD, 0% у здоровых людей. А положительная частота антител IgG к ЦМВ составила 93% и 90% у пациентов с AOSD и HCs. Более того, уровни антивирусных антител против HSV1, HSV2 и EBV были повышены у пациентов с AOSD по сравнению с HCs, хотя существенной разницы не было (рис. 1B, C).Эти результаты свидетельствуют о том, что у пациентов с AOSD более выражен иммунный ответ на ЦМВ с более высокими уровнями анти-ЦМВ IgG и IgM антител.
А положительная частота антител IgG к ЦМВ составила 93% и 90% у пациентов с AOSD и HCs. Более того, уровни антивирусных антител против HSV1, HSV2 и EBV были повышены у пациентов с AOSD по сравнению с HCs, хотя существенной разницы не было (рис. 1B, C).Эти результаты свидетельствуют о том, что у пациентов с AOSD более выражен иммунный ответ на ЦМВ с более высокими уровнями анти-ЦМВ IgG и IgM антител.
Рисунок 1 . Уровни антивирусных антител у пациентов с AOSD ( N = 100) и HCs ( N = 70). (A) Сравнение уровней антител к ЦМВ IgM и IgG у пациентов с AOSD и HCs. (B) Сравнение уровней антител IgM и IgG против HSV1 и HSV2 у пациентов с AOSD и HCs. (C) Сравнение уровней анти-EBVCA IgM, анти-EBVCA IgG, анти-EBNA IgG и анти-EAD IgG у пациентов с AOSD и HC.Каждый символ представляет отдельного пациента с AOSD и HC. Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t . ЦМВ, цитомегаловирус; ВПГ, вирус простого герпеса; EBVCA, капсидный антиген вируса Эпштейна-Барр; EBNA, ядерный антиген вируса Эпштейна-Барр; EAD, ранний диффузный антиген вируса Эпштейна-Барр.
ЦМВ, цитомегаловирус; ВПГ, вирус простого герпеса; EBVCA, капсидный антиген вируса Эпштейна-Барр; EBNA, ядерный антиген вируса Эпштейна-Барр; EAD, ранний диффузный антиген вируса Эпштейна-Барр.
Более высокие уровни анти-ЦМВ антител при активном AOSD
Кроме того, мы оценили уровни анти-ЦМВ-антител у пациентов с AOSD с различной активностью заболевания. Примечательно, что уровни в плазме анти-ЦМВ антител IgM и IgG были значительно повышены у пациентов с AOSD с активным заболеванием ( N = 69) по сравнению с пациентами с неактивным заболеванием ( N = 31) (рис. 2, P). = 0.0112 и P = 0,0355). Кроме того, уровни анти-ЦМВ IgM и IgG значительно различались, причем более высокие уровни антител были обнаружены у пациентов с активным AOSD по сравнению с HCs (рис. 2, оба P <0,0001). Уровни анти-ЦМВ-антител также были значительно выше у неактивных AOSD по сравнению с HCs (рис. 2, P = 0,0105 и P = 0,0167). В совокупности наши данные показывают, что антитела IgM и IgG против ЦМВ связаны с активностью заболевания AOSD.
Рисунок 2 . Уровни антител к CMV у пациентов с AOSD с различной активностью заболевания и HCs. (A) Уровни антител IgM против CMV в плазме при активном AOSD ( N = 69), неактивном AOSD ( N = 31) и HC ( N = 70). (B) Уровни антител IgG к ЦМВ в плазме при активном AOSD, неактивном AOSD и HCs. Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Антитела к ЦМВ при AOSD были связаны с клиническими проявлениями
Затем мы оценили корреляцию между уровнями анти-ЦМВ-антител и клиническими проявлениями.По сравнению с пациентами с AOSD без высокой пиковой лихорадки уровни анти-ЦМВ IgM и IgG антител были значительно выше у пациентов с AOSD с лихорадкой (рис. 3A, B, P = 0,0022 и P = 0,0411). Кроме того, наши результаты показали, что у пациентов с болью в горле был более высокий уровень антител IgM и IgG к ЦМВ (рис. 3C, D, P = 0,0015 и P = 0,0141).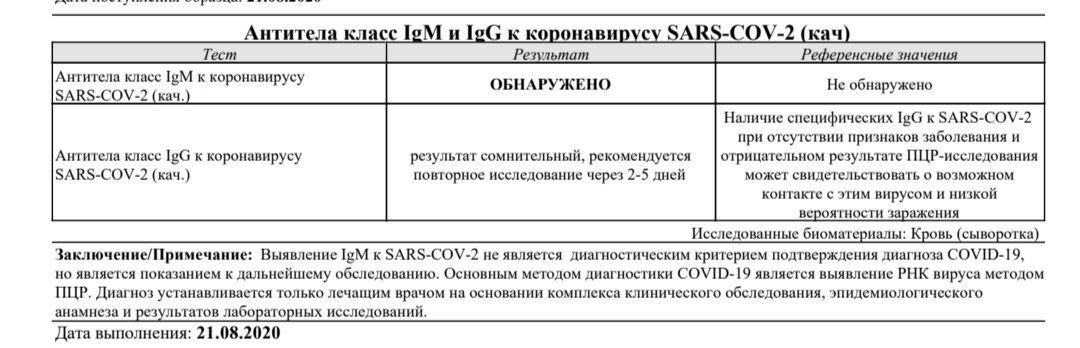 А при наличии боли в горле уровень антител IgM к ЦМВ был значительно повышен у пациентов с AOSD (рис. 3E, P = 0.0283). Уровень анти-ЦМВ IgG, как правило, был выше у пациентов с AOSD с болью в горле (рис. 3F). Кроме того, уровень антител IgM к ЦМВ был значительно выше у пациентов с артралгией, чем у пациентов без артралгии (рис. 3G, P = 0,0231). У пациентов с AOSD с артралгией уровень анти-ЦМВ IgG-антител не демонстрировал существенной разницы по сравнению с пациентами без артралгии (рис. 3H). Более того, разница антител к ЦМВ у пациентов с другими клиническими проявлениями, включая пневмонию, плеврит, перикардит, гепатомегалию, спленомегалию, лимфаденопатию и миалгию, не достигала статистической разницы (дополнительная фигура 1).В совокупности у пациентов с AOSD наблюдается иммунный ответ на ЦМВ, приводящий к возникновению и рецидивам, поскольку критерии Ямагучи включают клинические проявления высокой пиковой лихорадки, кожной сыпи, артралгии и боли в горле.
А при наличии боли в горле уровень антител IgM к ЦМВ был значительно повышен у пациентов с AOSD (рис. 3E, P = 0.0283). Уровень анти-ЦМВ IgG, как правило, был выше у пациентов с AOSD с болью в горле (рис. 3F). Кроме того, уровень антител IgM к ЦМВ был значительно выше у пациентов с артралгией, чем у пациентов без артралгии (рис. 3G, P = 0,0231). У пациентов с AOSD с артралгией уровень анти-ЦМВ IgG-антител не демонстрировал существенной разницы по сравнению с пациентами без артралгии (рис. 3H). Более того, разница антител к ЦМВ у пациентов с другими клиническими проявлениями, включая пневмонию, плеврит, перикардит, гепатомегалию, спленомегалию, лимфаденопатию и миалгию, не достигала статистической разницы (дополнительная фигура 1).В совокупности у пациентов с AOSD наблюдается иммунный ответ на ЦМВ, приводящий к возникновению и рецидивам, поскольку критерии Ямагучи включают клинические проявления высокой пиковой лихорадки, кожной сыпи, артралгии и боли в горле.
Рисунок 3 . Сравнение уровней анти-ЦМВ-антител у больных AOSD с различными клиническими проявлениями. Уровни анти-ЦМВ антител IgM и IgG у пациентов с AOSD с лихорадкой (A, B) или без нее, сыпью (C, D) , болью в горле (E, F) и артралгией (G, З) .Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Сравнение уровней анти-ЦМВ-антител у больных AOSD с различными клиническими проявлениями. Уровни анти-ЦМВ антител IgM и IgG у пациентов с AOSD с лихорадкой (A, B) или без нее, сыпью (C, D) , болью в горле (E, F) и артралгией (G, З) .Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Вирусная нагрузка ЦМВ была выше при реактивном AOSD
Из-за высокого уровня анти-ЦМВ-антител у пациентов с AOSD мы также стремились определить количество копий ДНК CMV у 100 пациентов с AOSD. Чтобы исключить влияние лечения на вирусную нагрузку ЦМВ, 69 активных пациентов с AOSD были стратифицированы на 38 пациентов с впервые выявленным заболеванием и 31 реактивного пациента. По сравнению с неактивными пациентами с AOSD ( N = 31), у пациентов с впервые выявленным заболеванием наблюдалось значительно более высокое число копий ДНК ЦМВ в плазме ( N = 38) (рис. 4А, P = 0.027). Дальнейшее сравнение было проведено между пациентами с AOSD с неактивным и реактивным заболеванием. Примечательно, что по сравнению с пациентами с AOSD с неактивным заболеванием число копий ДНК ЦМВ в плазме крови при реактивном заболевании было значительно выше ( N = 31) (рис. 4А, P = 0,0014), что указывает на наличие ЦМВ-инфекции при AOSD. больных с повышенной активностью заболевания. Затем мы исследовали, связано ли высокое число копий ДНК ЦМВ с повышенным системным баллом. Выяснилось, что количество копий ДНК ЦМВ положительно связано с системной оценкой с низким коэффициентом корреляции (рис. 4В, r 2 = 0.2152, P = 0,0383). Таким образом, ЦМВ-инфекция чаще встречалась у пациентов с AOSD в дебюте и обострении.
4А, P = 0.027). Дальнейшее сравнение было проведено между пациентами с AOSD с неактивным и реактивным заболеванием. Примечательно, что по сравнению с пациентами с AOSD с неактивным заболеванием число копий ДНК ЦМВ в плазме крови при реактивном заболевании было значительно выше ( N = 31) (рис. 4А, P = 0,0014), что указывает на наличие ЦМВ-инфекции при AOSD. больных с повышенной активностью заболевания. Затем мы исследовали, связано ли высокое число копий ДНК ЦМВ с повышенным системным баллом. Выяснилось, что количество копий ДНК ЦМВ положительно связано с системной оценкой с низким коэффициентом корреляции (рис. 4В, r 2 = 0.2152, P = 0,0383). Таким образом, ЦМВ-инфекция чаще встречалась у пациентов с AOSD в дебюте и обострении.
Рисунок 4 . Выявление количества копий ДНК ЦМВ у больных AOSD. (A) Сравнение копий ДНК ЦМВ у пациентов с неактивным ( N = 31), впервые возникшим ( N = 38) и активным AOSD ( N = 31). (B) Корреляция между числом копий ДНК ЦМВ и системной оценкой AOSD. Данные представляют собой среднее ± стандартное отклонение по тесту Стьюдента t в (А) .Корреляции оценивали с помощью непараметрического критерия Спирмена в (B) . p < 0,05 представляет значительную разницу.
(B) Корреляция между числом копий ДНК ЦМВ и системной оценкой AOSD. Данные представляют собой среднее ± стандартное отклонение по тесту Стьюдента t в (А) .Корреляции оценивали с помощью непараметрического критерия Спирмена в (B) . p < 0,05 представляет значительную разницу.
Вирусная нагрузка ЦМВ была связана с клиническими проявлениями
Из-за высокого уровня антител IgM к ЦМВ у пациентов с AOSD с лихорадкой, сыпью, болью в горле и артралгией мы дополнительно проанализировали разницу количества копий ДНК ЦМВ у пациентов с этими клиническими проявлениями и без них. Как показано в таблице 2, более высокое число копий ДНК ЦМВ наблюдалось у пациентов с лихорадкой ( P = 0.0039), сыпь ( P = 0,0462), боль в горле ( P = 0,0006) и артралгия ( P = 0,0156). При этом разница вирусной нагрузки ЦМВ у больных с другими клиническими проявлениями, включая пневмонию, плеврит, перикардит, гепатомегалию, спленомегалию, лимфаденопатию и миалгию, не достигала статистической разницы.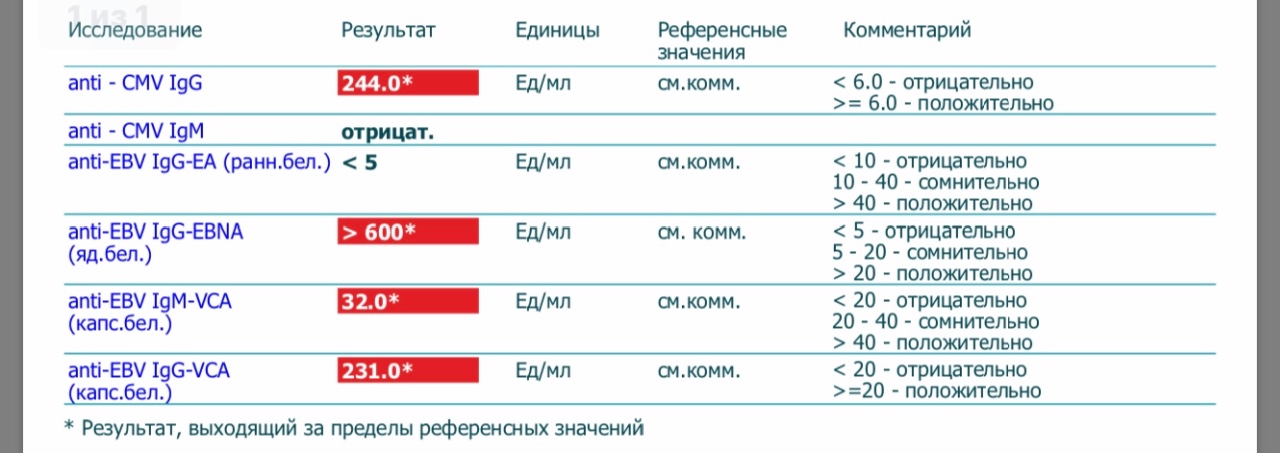 Таким образом, ЦМВ-инфекции могут быть связаны с AOSD, поскольку критерии Yamaguchi включают клинические проявления высокой лихорадки, артралгии, боли в горле и артралгии.
Таким образом, ЦМВ-инфекции могут быть связаны с AOSD, поскольку критерии Yamaguchi включают клинические проявления высокой лихорадки, артралгии, боли в горле и артралгии.
Таблица 2 . Сравнение числа копий ДНК ЦМВ в зависимости от проявлений заболевания у 100 пациентов с болезнью Стилла во взрослом возрасте.
Затем мы измерили коэффициент корреляции уровней ДНК ЦМВ с индексом воспаления, включая лейкоциты, СОЭ и СРБ. Количество копий ДНК ЦМВ было положительно связано с лейкоцитами (рис. 5А, r 2 = 0,3642, P = 0,0005) и СОЭ (рис. 5Б, r 2 = 0,2657, P = 0).0146), а также СРБ (рис. 5С, r 2 = 0,3456, P = 0,0021). Кроме того, была обнаружена значительная связь между числом копий ДНК ЦМВ и уровнями TNF-α (рис. 5D, r 2 = 0,2265, P = 0,0338). Мы обнаружили, что количество копий ДНК ЦМВ не показало значимой корреляции с IL-1β, IL-6 и IL-18 у пациентов с AOSD (данные не представлены).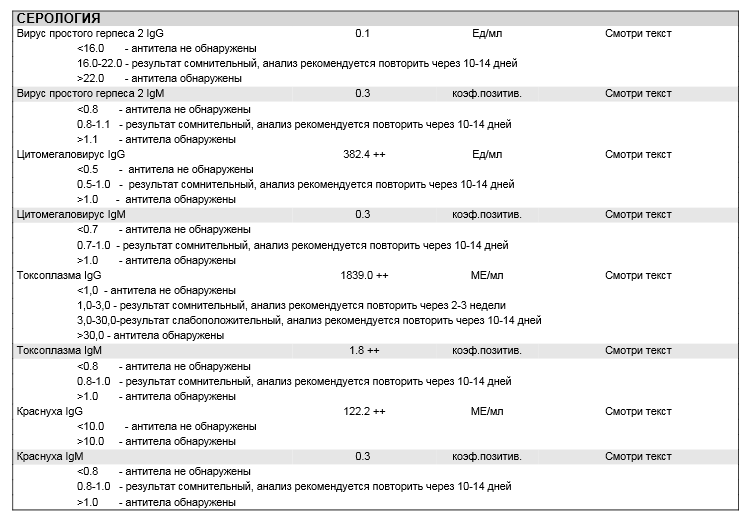 В совокупности результаты показывают, что ДНК ЦМВ может играть роль в воспалительной реакции при AOSD.
В совокупности результаты показывают, что ДНК ЦМВ может играть роль в воспалительной реакции при AOSD.
Рисунок 5 .Корреляция между числом копий ДНК ЦМВ и воспалительным индексом у пациентов с AOSD. Корреляция между числом копий ДНК ЦМВ и лейкоцитами (A) , СОЭ (B) и CRP (C) и уровнями TNF-α (D) . Корреляции оценивали с помощью непараметрического критерия Спирмена. p < 0,05 представляет значительную разницу.
ДНК-чувствительных PRR были усилены в AOSD
Чтобы продемонстрировать патогенетическую роль вирусных инфекций в AOSD, мы сначала обнаружили рецепторы нуклеиновых кислот, которые инициируют путь распознавания вирусов.Мы обнаружили значительную активацию IFI16 (рис. 6A, P <0,05) в PBMC при AOSD по сравнению с HC PBMC. Уровень экспрессии AIM2 имел тенденцию к увеличению у пациентов с AOSD со статистической значимостью (рис. 6A, P <0,001).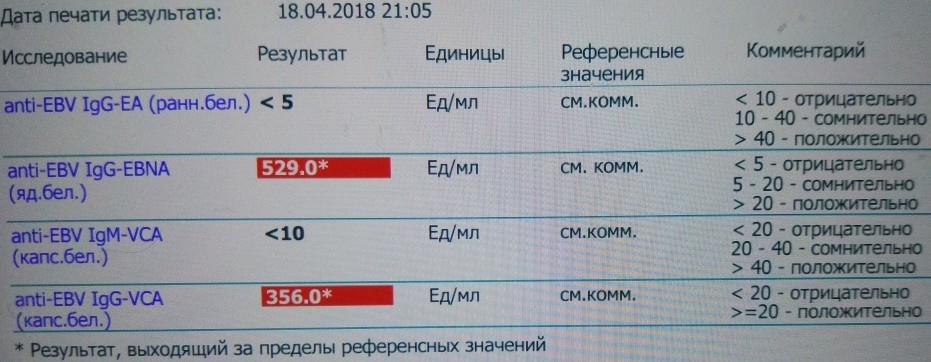 Уровень ДНК-зависимого активатора IFN-регуляторных факторов (DAI) и DDX46 имеет тенденцию к увеличению без существенной разницы (Фигура 6А). Напротив, другие чувствительные к ДНК рецепторы, DDX41 и GAS, были значительно снижены у пациентов с AOSD по сравнению с HCs (рис. 6A, P <0.01 и P < 0,001, рецептивно). Кроме того, полиглутамин-связывающий белок 1 (PQBP1) и мейотическая рекомбинация 11 (MRE11), как правило, были ниже у пациентов с AOSD по сравнению с HCs (рис. 6A). В заключение, наши данные свидетельствуют о том, что ДНК-чувствительные рецепторы IFI16 и AIM2 были выше у пациентов с AOSD.
Уровень ДНК-зависимого активатора IFN-регуляторных факторов (DAI) и DDX46 имеет тенденцию к увеличению без существенной разницы (Фигура 6А). Напротив, другие чувствительные к ДНК рецепторы, DDX41 и GAS, были значительно снижены у пациентов с AOSD по сравнению с HCs (рис. 6A, P <0.01 и P < 0,001, рецептивно). Кроме того, полиглутамин-связывающий белок 1 (PQBP1) и мейотическая рекомбинация 11 (MRE11), как правило, были ниже у пациентов с AOSD по сравнению с HCs (рис. 6A). В заключение, наши данные свидетельствуют о том, что ДНК-чувствительные рецепторы IFI16 и AIM2 были выше у пациентов с AOSD.
Рисунок 6 . Обнаружение сенсоров ДНК у пациентов с AOSD. (A) Сравнение различных ДНК-чувствительных рецепторов у пациентов с AOSD и HCs. (B,C) Ткань поражения кожи пациента с AOSD и HC окрашивали антителами, специфичными к IFI16 (B) и AIM2 (C) .Показаны репрезентативные примеры иммуногистохимических данных (AOSD, N = 4; HCs, N = 4).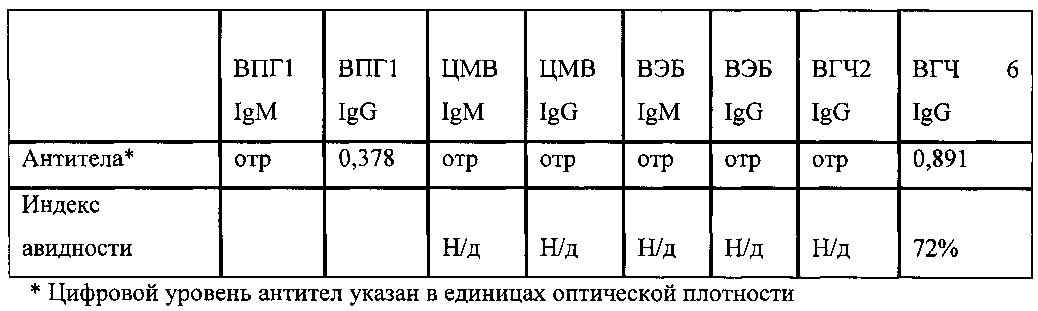 Шрамовая полоса: 50 мкм. Оригинальное увеличение: 200×.
Шрамовая полоса: 50 мкм. Оригинальное увеличение: 200×.
Для дальнейшей оценки экспрессии белков IFI16 и AIM2 у пациентов с AOSD мы оценили экспрессию IFI16 и AIM2 в биоптатах кожи AOSD ( N = 4) и у здоровых контролей ( N = 4). На рисунках 6B, C показано репрезентативное окрашивание кожи с AOSD. Картина окрашивания для IFI16 и AIM2 была наиболее заметной у пациентов с AOSD.Основываясь на этих результатах, мы предполагаем, что ДНК-вирусная инфекция может играть роль у пациентов с AOSD.
Обсуждение
В ряде исследований рассматривалась возможная роль вирусных инфекций в патогенезе AOSD, в то время как на сегодняшний день доказательства и патогенная роль вирусных инфекций в AOSD еще предстоит определить. Потенциальная роль вирусной инфекции в патогенезе аутоиммунных заболеваний уже давно является привлекательной гипотезой, частично основанной на клинических проявлениях, имитирующих острую или хроническую вирусную инфекцию (20).Концепция о том, что факторы окружающей среды, включая инфекции, вызывают заболевание у лиц с определенным генетическим фоном, широко признана (21). Наличие повышенных уровней антивирусных антител в плазме и вирусной ДНК в крови и тканях пациентов с волчанкой и другими системными аутоиммунными заболеваниями, включая первичный синдром Шегрена (СС) (22), ревматоидный артрит (РА) (23) и дерматомиозит (24). ) согласуются с вирусным триггером, указывая на то, что аутоиммунное заболевание может быть вызвано вирусными инфекциями.Мы предположили, что вирусы, которые представляют собой эндогенный источник лигандов для сенсоров нуклеиновых кислот, способствуют микроокружению хозяина, поддерживающему иммунную дисфункцию, аутоиммунитет и воспаление, подобно иммунопатологическим характеристикам некоторых хронических вирусных инфекций (25, 26).
Наличие повышенных уровней антивирусных антител в плазме и вирусной ДНК в крови и тканях пациентов с волчанкой и другими системными аутоиммунными заболеваниями, включая первичный синдром Шегрена (СС) (22), ревматоидный артрит (РА) (23) и дерматомиозит (24). ) согласуются с вирусным триггером, указывая на то, что аутоиммунное заболевание может быть вызвано вирусными инфекциями.Мы предположили, что вирусы, которые представляют собой эндогенный источник лигандов для сенсоров нуклеиновых кислот, способствуют микроокружению хозяина, поддерживающему иммунную дисфункцию, аутоиммунитет и воспаление, подобно иммунопатологическим характеристикам некоторых хронических вирусных инфекций (25, 26).
Чтобы исследовать эту возможность, мы изучили характер экспрессии сенсоров нуклеиновых кислот у пациентов с AOSD. Мы обнаружили, что экспрессия чувствительных к ДНК рецепторов значительно увеличилась в PBMC и биоптатах кожи пациентов с AOSD, что указывает на то, что чужеродные нуклеиновые кислоты могут присутствовать при AOSD. Затем мы использовали анализ ELISA для обнаружения противовирусных антител в образцах плазмы от 100 пациентов с AOSD и 70 здоровых людей из контрольной группы. Мы продемонстрировали, что антитела IgM и IgG к ЦМВ были значительно выше у пациентов с AOSD по сравнению с HCs. Кроме того, у пациентов с лихорадкой, болью в горле, артралгией и сыпью были обнаружены повышенные уровни антител IgM к ЦМВ, которые являются типичными клиническими проявлениями AOSD. После идентификации ДНК ЦМВ в плазме пациентов с AOSD с новым началом и рецидивом заболевания мы также продемонстрировали, что инфекции ЦМВ играют роль в инициации или усилении воспалительных реакций при AOSD.
Затем мы использовали анализ ELISA для обнаружения противовирусных антител в образцах плазмы от 100 пациентов с AOSD и 70 здоровых людей из контрольной группы. Мы продемонстрировали, что антитела IgM и IgG к ЦМВ были значительно выше у пациентов с AOSD по сравнению с HCs. Кроме того, у пациентов с лихорадкой, болью в горле, артралгией и сыпью были обнаружены повышенные уровни антител IgM к ЦМВ, которые являются типичными клиническими проявлениями AOSD. После идентификации ДНК ЦМВ в плазме пациентов с AOSD с новым началом и рецидивом заболевания мы также продемонстрировали, что инфекции ЦМВ играют роль в инициации или усилении воспалительных реакций при AOSD.
Большое внимание уделяется потенциальной патогенетической роли различных бактериальных и вирусных патогенов в AOSD, особенно вирусов, включая CMV, EBV, вирус краснухи и вирус герпеса человека 6 (4). Результаты этих исследований, взятые в совокупности, позволяют предположить вирусный вклад в AOSD, хотя полученные данные дают мало информации о потенциальных механизмах, а устойчивой ассоциации с конкретным экзогенным вирусом как этиологическим агентом AOSD не выявлено.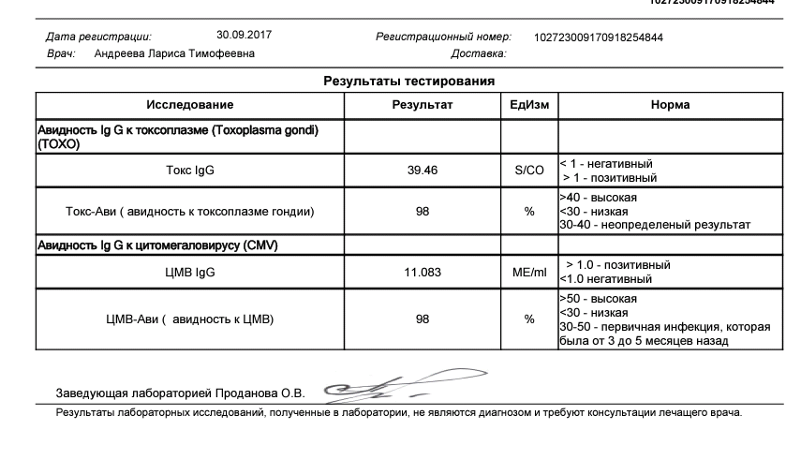 Сообщалось, что ЦМВ человека, вездесущий вирус бета-герпеса, связан с несколькими аутоиммунными заболеваниями (27–29).В то же время недостаточно данных для прямого участия ЦМВ-инфекции в возникновении и рецидиве AOSD. Несколько характеристик ЦМВ вызвали у нас интерес к изучению этого ДНК-вируса как потенциального триггера врожденного иммунного ответа и аутоиммунитета. Первая ДНК ЦМВ положительно коррелировала с количеством лейкоцитов у пациентов с AOSD. Нейтрофилы, первая линия врожденной иммунной защиты от инфекции, являются первичными эффекторными клетками в патогенезе AOSD (30). Недавние данные демонстрируют глубокую реакцию выживания и отсроченный апоптоз нейтрофилов, подвергшихся воздействию ЦМВ, путем секреции про-выживательного секретома (31), что еще раз подтверждает гипотезу о том, что ЦМВ-инфекция может запускать воспалительную реакцию нейтрофилов.Вторичные нейтрофилы, подвергшиеся воздействию ЦМВ, высвобождают факторы, которые усиливают рекрутирование моноцитов, способствуя воспалительной реакции (31).
Сообщалось, что ЦМВ человека, вездесущий вирус бета-герпеса, связан с несколькими аутоиммунными заболеваниями (27–29).В то же время недостаточно данных для прямого участия ЦМВ-инфекции в возникновении и рецидиве AOSD. Несколько характеристик ЦМВ вызвали у нас интерес к изучению этого ДНК-вируса как потенциального триггера врожденного иммунного ответа и аутоиммунитета. Первая ДНК ЦМВ положительно коррелировала с количеством лейкоцитов у пациентов с AOSD. Нейтрофилы, первая линия врожденной иммунной защиты от инфекции, являются первичными эффекторными клетками в патогенезе AOSD (30). Недавние данные демонстрируют глубокую реакцию выживания и отсроченный апоптоз нейтрофилов, подвергшихся воздействию ЦМВ, путем секреции про-выживательного секретома (31), что еще раз подтверждает гипотезу о том, что ЦМВ-инфекция может запускать воспалительную реакцию нейтрофилов.Вторичные нейтрофилы, подвергшиеся воздействию ЦМВ, высвобождают факторы, которые усиливают рекрутирование моноцитов, способствуя воспалительной реакции (31).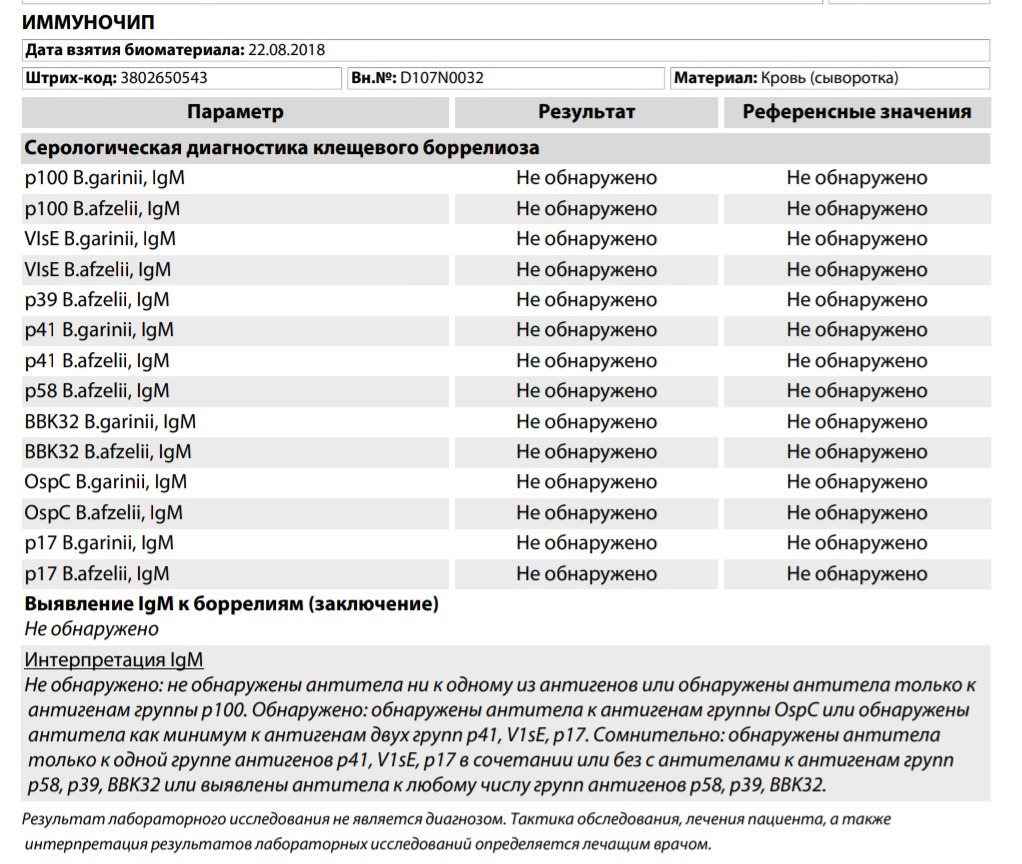 Корреляция между ДНК ЦМВ и белком острой фазы (СОЭ и СРБ) в нашем исследовании предполагает, что ЦМВ-инфекции являются основными причинами цитокинового шторма при AOSD. В-третьих, было установлено, что воспалительные моноциты/макрофаги выходят из костного мозга и попадают в периферическую кровь во время ЦМВ-инфекции зависимым от хемокинового рецептора (CCR)2 мотива СС (32), что еще раз подтверждает исследование механизма ЦМВ в иммунопатология АОСД путем активации нейтрофилов и макрофагов.Тем не менее, четкую связь между серопревалентностью ЦМВ и заболеванием до сих пор было трудно установить, потому что ЦМВ широко распространен, и тогда действительно существует необходимость в дальнейшем последующем изучении пациентов с AOSD, включенных в наше исследование. Кроме того, относительно низкие коэффициенты корреляции между нагрузкой ДНК ЦМВ и воспалительным индексом указывают на то, что другие эндогенные или экзогенные триггерные факторы могут быть вовлечены в патогенез AOSD, что в будущем следует изучить на большой когорте пациентов с AOSD.
Корреляция между ДНК ЦМВ и белком острой фазы (СОЭ и СРБ) в нашем исследовании предполагает, что ЦМВ-инфекции являются основными причинами цитокинового шторма при AOSD. В-третьих, было установлено, что воспалительные моноциты/макрофаги выходят из костного мозга и попадают в периферическую кровь во время ЦМВ-инфекции зависимым от хемокинового рецептора (CCR)2 мотива СС (32), что еще раз подтверждает исследование механизма ЦМВ в иммунопатология АОСД путем активации нейтрофилов и макрофагов.Тем не менее, четкую связь между серопревалентностью ЦМВ и заболеванием до сих пор было трудно установить, потому что ЦМВ широко распространен, и тогда действительно существует необходимость в дальнейшем последующем изучении пациентов с AOSD, включенных в наше исследование. Кроме того, относительно низкие коэффициенты корреляции между нагрузкой ДНК ЦМВ и воспалительным индексом указывают на то, что другие эндогенные или экзогенные триггерные факторы могут быть вовлечены в патогенез AOSD, что в будущем следует изучить на большой когорте пациентов с AOSD. Более того, прямое отношение ЦМВ к индукции AOSD требует дальнейшего изучения in vivo .
Более того, прямое отношение ЦМВ к индукции AOSD требует дальнейшего изучения in vivo .
Поскольку ЦМВ относится к ДНК-вирусам, мы предположили, что он может распознаваться сенсорами цитоплазматической ДНК и усиливать врожденный иммунный ответ. Повышенная экспрессия IFI16 и AIM2 в PBMC и биоптатах кожи пациентов с AOSD позволяет предположить, что ДНК-вирус может представлять собой эндогенный источник лигандов. В исследованиях IFI16 и AIM2 были названы новым семейством врожденных ДНК-сенсоров «AIM2-подобных рецепторов (ALR)» (33).Способность IFI16 и AIM2 индуцировать воспаление (34, 35) также привлекает внимание к потенциальной роли IFI16 и AIM2 в AOSD. Зараженный герпесвирусом, IFI16 взаимодействует с адапторной молекулой ASC и прокаспазой-1 для сборки функциональной инфламмасомы (36). Было продемонстрировано, что AIM2 запускает зависимую от каспазы-1 передачу сигналов и врожденный иммунитет к ДНК-вирусам, особенно мышиному CMV (37). Таким образом, наши результаты предполагают потенциальную роль ЦМВ-инфекций в AOSD за счет активации двух сенсоров ДНК, IFI16 и AIM2.
В заключение следует отметить, что уровни антител IgM и IgG к ЦМВ были выше у пациентов с AOSD, а повышенное количество копий ДНК ЦМВ было обнаружено у пациентов с впервые возникшим и реактивным AOSD. Более того, мы обнаружили активацию цитоплазматических ДНК-чувствительных рецепторов IFI16 и AIM2 в PBMC и коже пациентов с AOSD, что еще раз подтверждает гипотезу о том, что ЦМВ-инфекции существуют при AOSD. Кроме того, у пациентов с лихорадкой, болью в горле, артралгией и сыпью были значительно повышены уровни антител IgM к ЦМВ и число копий ДНК ЦМВ.Также наблюдалась значительная ассоциация уровня ДНК ЦМВ с уровнями лейкоцитов, СОЭ, СРБ и ФНО-α, что свидетельствует о том, что инфекции ЦМВ могут играть роль в воспалительном ответе при AOSD. В совокупности эти данные свидетельствуют о том, что ЦМВ-инфекции могут способствовать возникновению и обострению AOSD.
Заявление об этике
Исследование проводилось в соответствии с Хельсинкской декларацией и принципами надлежащей клинической практики. Биологические образцы были получены в соответствии с протоколом, одобренным Комитетом по этике институциональных исследований больницы Жуйцзинь (ID: 2016-62), Шанхай, Китай.Все субъекты подписывали письменное информированное согласие.
Биологические образцы были получены в соответствии с протоколом, одобренным Комитетом по этике институциональных исследований больницы Жуйцзинь (ID: 2016-62), Шанхай, Китай.Все субъекты подписывали письменное информированное согласие.
Вклад авторов
JJ и HS участвовали в выделении РНК, qRT-PCR и написали рукопись. ML проанализировал результаты биопсии кожи. TL помог отредактировать рукопись. JG и LW собрали клинические образцы и данные. JT и HL подготовили рисунки. XC и JY подготовили рассказы. ЮС и ЮЭС провели статистический анализ. РГ подготовила дополнительные рисунки. CY разработал эксперименты и отредактировал рукопись.QH разработал эксперименты, провел статистический анализ и отредактировал рукопись. Все авторы прочитали и одобрили окончательный вариант рукописи.
Финансирование
Эта работа была поддержана Национальным фондом естественных наук Китая (81671589, 81871272, 81801602, 81602747, 81502016).
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим всех пациентов, принимавших участие в исследовании.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fimmu.2019.00898/full#supplementary-material
.Дополнительный рисунок 1 . Сравнение уровней антител IgM к ЦМВ у пациентов с AOSD с различными клиническими проявлениями. Уровни антител IgM к ЦМВ у пациентов с AOSD с пневмонией (A) , плевритом (B) , перикардитом (C) , гепатомегалией (D) , спленомегалией (E) , лимфаденопатией (F) и миалгия (G) .Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Дополнительный рисунок 2 . Сравнение уровней антител IgG к ЦМВ у пациентов с AOSD с различными клиническими проявлениями.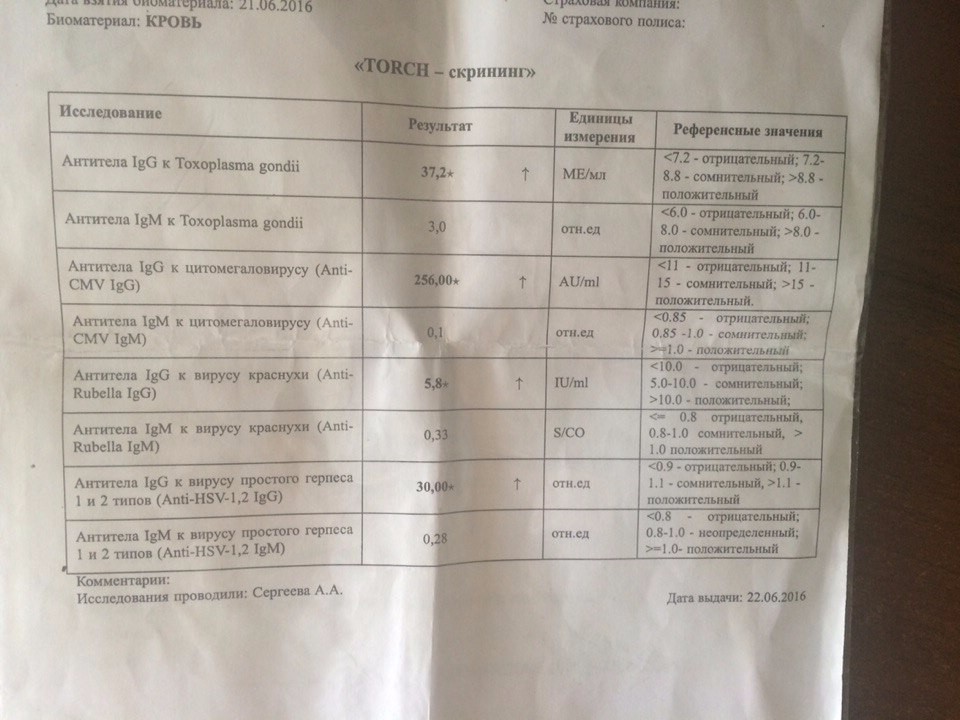 Уровни антител IgG к ЦМВ у пациентов с AOSD с пневмонией (A) , плевритом (B) , перикардитом (C) , гепатомегалией (D) , спленомегалией (E) , лимфаденопатией (F) и миалгия (G) .Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Уровни антител IgG к ЦМВ у пациентов с AOSD с пневмонией (A) , плевритом (B) , перикардитом (C) , гепатомегалией (D) , спленомегалией (E) , лимфаденопатией (F) и миалгия (G) .Данные представляют собой среднее значение ± стандартное отклонение по критерию Стьюдента t .
Сокращения
AOSD, Болезнь Стилла у взрослых; HC, здоровый контроль; СС, синдром Шегрена; РА, ревматоидный артрит; ЦМВ, цитомегаловирус; ВПГ, вирус простого герпеса; ВЭБ, вирус Эпштейна-Барр; IFI16, белок 16, индуцируемый гамма-интерфероном; AIM2 отсутствует при меланоме 2; ELISA, твердофазный иммуноферментный анализ; qPCR, количественная полимеразная цепная реакция; PBMC, мононуклеарные клетки периферической крови; GAPDH, глицеральдегид-3-фосфатдегидрогеназа; СОЭ, скорость оседания эритроцитов; СРБ, С-реактивный белок; TNF-α, фактор некроза опухоли-α; ИЛ, интерлейкин; RIG-I, индуцируемый ретиноевой кислотой ген I; IFIh2, интерферон, индуцированный геликазой С-домен 1; геликазы DDX, DExD/H-box; cGAS, циклическая GMP-AMP-синтетаза; NLRP3, NOD-подобный рецепторный белок 3; DAI, ДНК-зависимый активатор IFN-регуляторных факторов; HRP, пероксидаза хрена; TMB, раствор субстрата тетраметилбензидина; ОП, оптическая плотность; CCR, хемокиновый рецептор с мотивом CC; ALR, AIM2-подобные рецепторы; PQBP1, полиглутамин-связывающий белок 1; MRE11, мейотическая рекомбинация 11.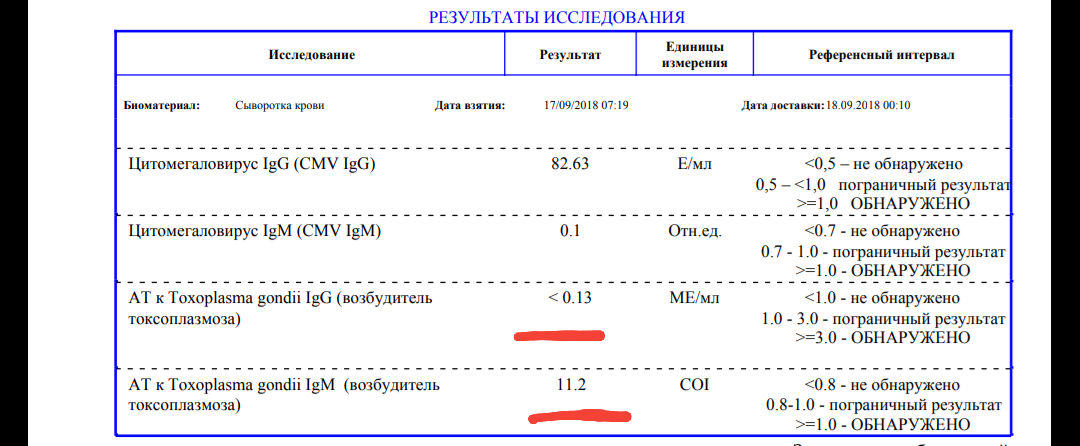
Ссылки
2. Кадават С., Эфтимиу П. Болезнь Стилла с началом во взрослом возрасте, патогенез, клинические проявления и новые варианты лечения. Энн Мед. (2015) 47:6–14. дои: 10.3109/07853890.2014.971052
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
5. Jamilloux Y, Gerfaud-Valentin M, Martinon F, Belot A, Henry T, Seve P. Патогенез болезни Стилла у взрослых: новое понимание ювенильного аналога. Иммунол Рез. (2015) 61:53–62. doi: 10.1007/s12026-014-8561-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
6. Воутерс Дж.М., ван дер Вин Дж., ван де Путте Л.Б., де Ройдж Д.Дж. Болезнь Стилла и вирусные инфекции с началом во взрослом возрасте. Энн Реум Дис. (1988) 47:764–7.
Реферат PubMed | Академия Google
7. Изумикава К., Моринага Ю., Кондо А., Хара К., Изумикава К., Миядзаки Ю. и др. Болезнь Стилла взрослых, связанная с цитомегаловирусной инфекцией.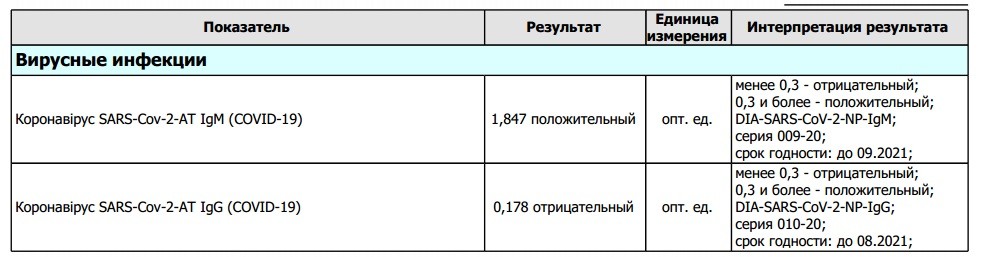 Дж. Заразить Хематер. (2007) 13:114–7. doi: 10.1007/s10156-007-0503-1
Дж. Заразить Хематер. (2007) 13:114–7. doi: 10.1007/s10156-007-0503-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Хуан С.Х., ДеКото В.Е. Болезнь Стилла у взрослых: необычное проявление инфекции краснухи. Can Med Assoc J. (1980) 122:1275–6.
Реферат PubMed | Академия Google
10. Chen DY, Chen YM, Chen HH, Hsieh CW, Gung NR, Hung WT, et al. Неструктурный белок NS1 парвовируса человека B19 активирует передачу сигналов воспаления NLRP3 при болезни Стилла у взрослых. Mol Med Rep. (2018) 17:3364–71. doi: 10.3892/mmr.2017.8275
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11. Говони М., Бортолуцци А., Росси Д., Модена В. Как я лечу пациентов с болезнью Стилла у взрослых в клинической практике. Autoimmun Rev. (2017) 16:1016–23. doi: 10.1016/j.autrev.2017.07.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
16. Brisse E, Wouters CH, Andreas G, Matthys P. Как вирусы способствуют патогенезу гемофагоцитарного лимфогистиоцитоза. Фронт Иммунол. (2017) 8:1102. doi: 10.3389/fimmu.2017.01102
Brisse E, Wouters CH, Andreas G, Matthys P. Как вирусы способствуют патогенезу гемофагоцитарного лимфогистиоцитоза. Фронт Иммунол. (2017) 8:1102. doi: 10.3389/fimmu.2017.01102
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
17. Ямагути М., Охта А., Цунэмацу Т., Касукава Р., Мидзусима Ю., Кашиваги Х. и соавт. Предварительные критерии классификации болезни Стилла у взрослых. Дж Ревматол. (1992) 19:424–30.
Реферат PubMed | Академия Google
18. Рау М., Шиллер М., Криенке С., Хейдер П., Лоренц Х., Бланк Н. Клинические проявления, но не профили цитокинов, отличают болезнь Стилла и сепсис у взрослых. Дж Ревматол. (2010) 37:2369–76. doi: 10.3899/jrheum.100247
Полнотекстовая перекрестная ссылка | Академия Google
19. Гривинк Х.В., Луисман Т., Клуфт С., Морланд М., Мэлоун К.Е. Сравнение трех методов выделения мононуклеарных клеток периферической крови человека: восстановление и жизнеспособность клеток, состав популяции и функциональность клеток. Биоконсерв Биобанк. (2016) 14:410–15. doi: 10.1089/bio.2015.0104
Биоконсерв Биобанк. (2016) 14:410–15. doi: 10.1089/bio.2015.0104
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
20.Panoutsakopoulou V, Sanchirico ME, Huster KM, Jansson M, Granucci F, Shim DJ и др. Анализ взаимосвязи между вирусной инфекцией и аутоиммунным заболеванием. Иммунитет. (2001) 15:137–47. doi: 10.1016/s1074-7613(01)00172-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
21. Munz C, Lunemann JD, Getts MT, Miller SD. Противовирусные иммунные реакции: триггеры или вызваны аутоиммунитетом? Nat Rev Immunol. (2009) 9: 246–58. doi: 10.1038/nri2527
Полнотекстовая перекрестная ссылка | Академия Google
22.Gottenberg JE, Cagnard N, Lucchesi C, Letourneur F, Mistou S, Lazure T, et al. Активация путей IFN и рекрутирование плазмоцитоидных дендритных клеток в органах-мишенях первичного синдрома Шегрена. Proc Natl Acad Sci USA. (2006) 103:2770–5. doi: 10. 1073/pnas.0510837103
1073/pnas.0510837103
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
26. Niespodziana K, Stenberg-Hammar K, Megremis S, Cabauatan CR, Napora-Wijata K, Vacal PC, et al. Диагностика риновирусного хрипа с высоким разрешением на основе чипа PreDicta. Нац.коммун. (2018) 9:2382. doi: 10.1038/s41467-018-04591-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
28. Lunardi C, Bason C, Navone R, Millo E, Damonte G, Corrocher R, et al. Аутоантитела системного склероза иммуноглобулина G связывают поздний белок цитомегаловируса человека UL94 и индуцируют апоптоз в эндотелиальных клетках человека. Nat Med (2000) 6:1183–6. дои: 10.1038/80533
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
29.Пак С.И., Ын Х.М., Макартур Р.Г., Юн Дж.В. Ассоциация цитомегаловирусной инфекции с аутоиммунным диабетом 1 типа. Ланцет. (1988) 2:1–4.
Реферат PubMed | Академия Google
30. Seo JY, Suh CH, Jung JY, Kim AR, Yang JW, Kim HA. Соотношение нейтрофилов и лимфоцитов может быть хорошим диагностическим маркером и предиктором рецидива у пациентов с болезнью Стилла у взрослых: ретроспективный наблюдательный анализ, соответствующий STROBE. Медицина. (2017) 96:e7546.doi: 10.1097/MD.0000000000007546
Seo JY, Suh CH, Jung JY, Kim AR, Yang JW, Kim HA. Соотношение нейтрофилов и лимфоцитов может быть хорошим диагностическим маркером и предиктором рецидива у пациентов с болезнью Стилла у взрослых: ретроспективный наблюдательный анализ, соответствующий STROBE. Медицина. (2017) 96:e7546.doi: 10.1097/MD.0000000000007546
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
31. Pocock JM, Storisteanu DML, Reeves MB, Juss JK, Wills MR, Cowburn AS, et al. Цитомегаловирус человека задерживает апоптоз нейтрофилов и стимулирует высвобождение секретома для выживания. Фронт Иммунол. (2017) 8:1185. doi: 10.3389/fimmu.2017.01185
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
32. Крейн М.Дж., Хокенесс-Антонелли К.Л., Салазар-Мазер Т.П.Регуляция рекрутирования воспалительных моноцитов/макрофагов из костного мозга во время мышиной цитомегаловирусной инфекции: роль интерферонов типа I в локализованной индукции лигандов CCR2. Дж Иммунол. (2009) 183:2810–7. doi: 10.4049/jimmunol.0
Дж Иммунол. (2009) 183:2810–7. doi: 10.4049/jimmunol.0
5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
33. Унтерхольцнер Л., Китинг С.Е., Баран М., Хоран К.А., Дженсен С.Б., Шарма С. и соавт. IFI16 является сенсором врожденного иммунитета для внутриклеточной ДНК. Нат Иммунол. (2010) 11:997–1004. doi: 10.1038/ni.1932
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
34. Фернандес-Алнемри Т., Ю Дж. В., Датта П., Ву Дж., Алнемри Э. С. AIM2 активирует инфламмасомы и гибель клеток в ответ на цитоплазматическую ДНК. Природа. (2009) 458:509–13. doi: 10.1038/nature07710
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
35. Jonsson KL, Laustsen A, Krapp C, Skipper KA, Thavachelvam K, Hotter D, et al.IFI16 необходим для распознавания ДНК в макрофагах человека, способствуя выработке и функционированию цГАМФ. Нац.коммун. (2017) 8:14391. doi: 10. 1038/ncomms14391
1038/ncomms14391
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
36. Керур Н., Веттил М.В., Шарма-Валия Н., Боттеро В., Садагопан С., Отагери П. и соавт. IFI16 действует как сенсор ядерного патогена, индуцируя инфламмасому в ответ на герпесвирусную инфекцию, связанную с саркомой Капоши. Микроб-хозяин клетки. (2011) 9:363–75.doi: 10.1016/j.chom.2011.04.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
37. Swanson KV, Junkins RD, Kurkjian CJ, Holley-Guthrie E, Pendse AA, El Morabiti R, et al. Неканоническая функция цГАМФ в праймировании и активации воспалительных заболеваний. J Exp Med. (2017) 214:3611–26. doi: 10.1084/jem.20171749
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цитомегаловирус (ЦМВ): основы практики, фон, патофизиология
Bennett J, Dolin R, Blaser M. Принципы и практика лечения инфекционных заболеваний Манделла, Дугласа и Беннета . 9-е издание. Эльзевир/Сондерс; 2015.
9-е издание. Эльзевир/Сондерс; 2015.
Ходсон Э.М., Джонс К.А., Вебстер А.С., Стрипполи Г.Ф., Барклай П.Г., Кейбл К. Противовирусные препараты для предотвращения цитомегаловирусной болезни и ранней смерти у реципиентов трансплантатов паренхиматозных органов: систематический обзор рандомизированных контролируемых испытаний. Ланцет . 2005 18-24 июня. 365 (9477): 2105-15. [Медлайн].
Чжан Л.Дж., Ханфф П., Резерфорд С., Черчилль В.Х., Крампакер С.С.Обнаружение ДНК, РНК и антител цитомегаловируса человека в нормальной донорской крови. J Заразить Dis . 1995 г., апрель 171(4):1002-6. [Медлайн].
Collier AC, Meyers JD, Corey L, Murphy VL, Roberts PL, Handsfield HH. Цитомегаловирусная инфекция у гомосексуальных мужчин. Отношение к сексуальным практикам, антителам к вирусу иммунодефицита человека и клеточному иммунитету. Am J Med . 1987 г., 23 марта. 82 (3 спецификации №): 593-601. [Медлайн].
Am J Med . 1987 г., 23 марта. 82 (3 спецификации №): 593-601. [Медлайн].
Гинан М.Е., Томас П.А., Пинский П.Ф., Гудрич Дж.Т., Селик Р.М., Джаффе Х.В.Гетеро- и гомосексуальные пациенты с синдромом приобретенного иммунодефицита. Сравнение эпиднадзора, интервью и лабораторных данных. Энн Интерн Мед . 1984 г., февраль 100(2):213-8. [Медлайн].
Staras SA, Dollard SC, Radford KW, Flanders WD, Pass RF, Cannon MJ. Серораспространенность цитомегаловирусной инфекции в США, 1988-1994 гг. Клин Заражение Дис . 2006 1 ноября. 43(9):1143-51. [Медлайн].
Бейт С.Л., Доллард С.К., Кэннон М.Дж.Серораспространенность цитомегаловируса в Соединенных Штатах: национальные обследования состояния здоровья и питания, 1988–2004 гг. Клин Заражение Дис . 2010 1 июня. 50(11):1439-47. [Медлайн].
Ljungman P, Griffiths P, Paya C. Определения цитомегаловирусной инфекции и заболевания у реципиентов трансплантата. Клин Заражение Дис . 2002 г., 15 апреля. 34(8):1094-7. [Медлайн].
Кунья Б.А. Цитомегаловирусная пневмония: внебольничная пневмония у иммунокомпетентных хозяев. Заразить Dis Clin North Am . 2010 март 24 (1): 147-58. [Медлайн].
Deayton JR, Prof Sabin CA, Johnson MA, Emery VC, Wilson P, Griffiths PD. Значение цитомегаловирусной виремии в риске прогрессирования заболевания и смерти у ВИЧ-инфицированных пациентов, получающих высокоактивную антиретровирусную терапию. Ланцет . 2004 г., 26 июня. 363 (9427): 2116-21. [Медлайн].
Stagno S, Pass RF, Cloud G, Britt WJ, Henderson RE, Walton PD.Первичная цитомегаловирусная инфекция при беременности. Заболеваемость, передача плоду и клинический исход. ЯМА . 1986 г., 10 октября. 256 (14): 1904-8. [Медлайн].
Заболеваемость, передача плоду и клинический исход. ЯМА . 1986 г., 10 октября. 256 (14): 1904-8. [Медлайн].
Stagno S. Цитомегаловирус. Ремингтон Дж. С., Кляйн Дж. О. Инфекционные болезни плода и новорожденного . Филадельфия: В. Б. Сондерс; 2001. 389-424.
Арора Н., Новак З., Фаулер К.Б., Боппана С.Б., Росс С.А. Цитомегаловирусная вирурия и ДНКемия у здоровых серопозитивных женщин. J Заразить Dis . 2010 15 декабря. 202(12):1800-3. [Медлайн]. [Полный текст].
Уолтер Э.А., Гринберг П.Д., Гилберт М.Дж. Восстановление клеточного иммунитета против цитомегаловируса у реципиентов аллогенного костного мозга путем переноса клонов Т-клеток от донора. N Английский J Med . 1995, 19 октября. 333(16):1038-44. [Медлайн].
Комитет Института медицины (США) по изучению приоритетов разработки вакцин, Stratton KR, Durch JS, Lawrence RS, eds. Вакцины для 21 века: инструмент для принятия решений. Издательство национальных академий (США) . 2000.
Мортон CC, Нэнси WE. Проверка слуха новорожденных — бесшумная революция. N Английский J Med . 2006. 354(20):2151-2164. [Полный текст].
Leruez-Ville M, Foulon I, Pass R, Ville Y.Цитомегаловирусная инфекция при беременности: состояние науки. Am J Obstet Gynecol . 2020. 223(3):330-349. [Полный текст].
Дреер А.М., Арора Н., Фаулер К.Б. и др. Спектр заболевания и исход у детей с симптоматической врожденной цитомегаловирусной инфекцией. J Педиатр . 2014. 164(4):855-859. [Полный текст].
J Педиатр . 2014. 164(4):855-859. [Полный текст].
Хиоприс Г., Веронезе П., Кузенца Ф. и др. Врожденная цитомегаловирусная инфекция: обновленная информация о диагностике и лечении. Микроорганизмы . 2020. 8(10):1516. [Полный текст].
Дэвис Н.Л., Кинг К.С., Кортис А.П. Цитомегаловирусная инфекция при беременности. Врожденные дефекты Res . 2017. 109(5):336-346. [Полный текст].
Fonseca Brito L, Brune W, Stahl FR. Цитомегаловирусный (ЦМВ) пневмонит: клеточный тропизм, воспаление и иммунитет. Int J Mol Sci . 2019. 20(16):3865. [Полный текст].
Бонковски Х.Л., Ли Р.В., Клацкин Г.Острый гранулематозный гепатит. Встречается при цитомегаловирусном мононуклеозе. ЯМА . 1975 г., 22 сентября. 233(12):1284-8. [Медлайн].
[Медлайн].
Meiselman MS, Cello JP, Margaretten W. Цитомегаловирусный колит. Отчет о клинических, эндоскопических и патологических данных у двух пациентов с синдромом приобретенного иммунодефицита. Гастроэнтерология . 1985 г., янв. 88 (1 часть 1): 171–175. [Медлайн].
Орликовски Д., Порчер Р., Сивадон-Тарди В. и др.Синдром Гийена-Барре после первичной цитомегаловирусной инфекции: проспективное когортное исследование. Клин Заражение Дис . 2011 апр. 52(7):837-44. [Медлайн].
Джабс Д.А., Ван Натта М.Л., Кемпен Дж.Х., Рид Паван П., Лим Дж.И., Мерфи Р.Л. и другие. Характеристика больных цитомегаловирусным ретинитом в эпоху высокоактивной антиретровирусной терапии. Am J Офтальмол . 2002 янв. 133(1):48-61. [Медлайн].
Каравеллас М.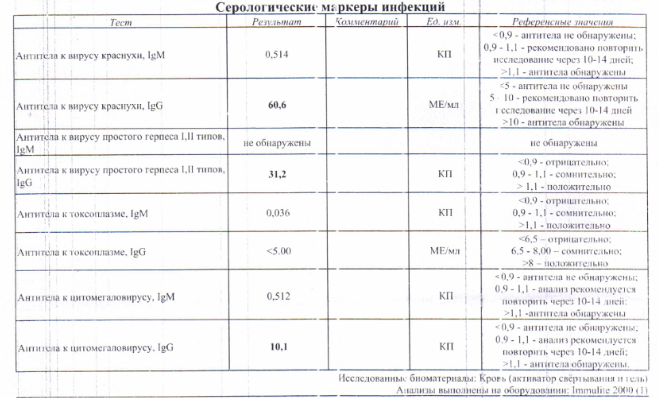 П., Пламмер Д.Дж., Макдональд Д.С., Торриани Ф.Дж., Шуфельт К.Л., Азен С.П.Частота случаев иммуновосстановительного витрита у пациентов с цитомегаловирусным ретинитом после введения успешной высокоактивной антиретровирусной терапии. J Заразить Dis . 1999 март 179(3):697-700. [Медлайн].
П., Пламмер Д.Дж., Макдональд Д.С., Торриани Ф.Дж., Шуфельт К.Л., Азен С.П.Частота случаев иммуновосстановительного витрита у пациентов с цитомегаловирусным ретинитом после введения успешной высокоактивной антиретровирусной терапии. J Заразить Dis . 1999 март 179(3):697-700. [Медлайн].
Воль Д.А., Кендалл М.А., Оуэнс С., Холланд Г., Нокта М., Спектор С.А. Безопасность прекращения поддерживающей терапии цитомегаловирусного (ЦМВ) ретинита и частота увеита с восстановлением иммунитета после мощной антиретровирусной терапии. Клинические испытания ВИЧ .2005 май-июнь. 6(3):136-46. [Медлайн].
Райт М.Э., Сузман Д.Л., Чаки К.Г., Мазур Х., Полис М.А., Робинсон М.Р. Обширная ретинальная неоваскуляризация как поздняя находка у пациентов с иммунодефицитным увеитом, инфицированных вирусом иммунодефицита человека. Клин Заражение Дис . 2003 г., 15 апреля.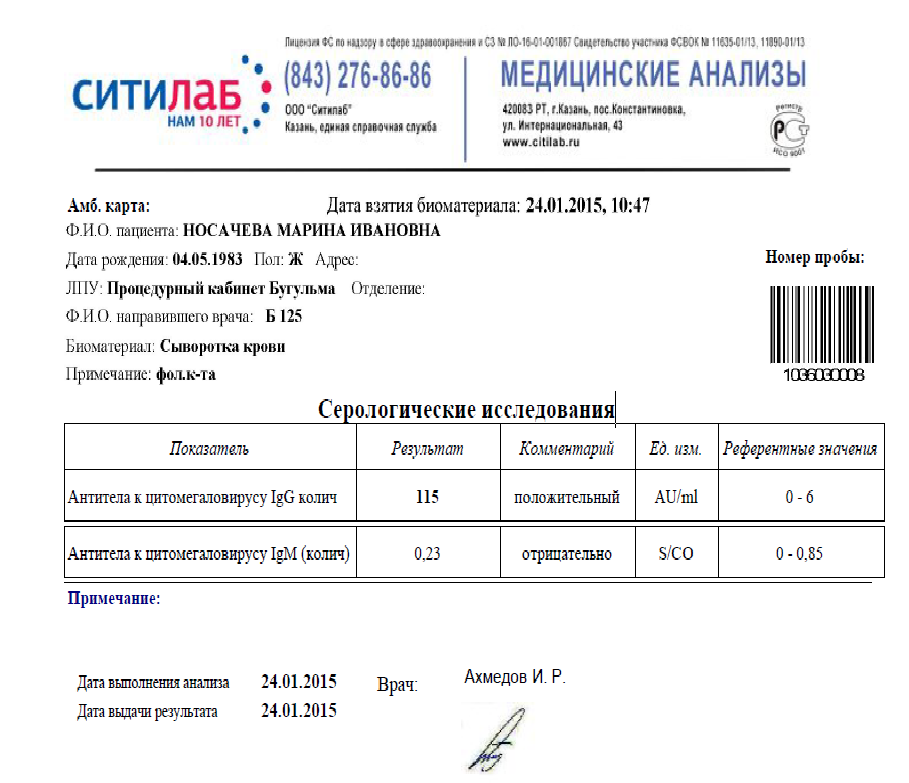 36(8):1063-6. [Медлайн].
36(8):1063-6. [Медлайн].
Ричардсон В.П., Колвин Р.Б., Чизман С.Х. Гломерулопатия, связанная с цитомегаловирусной виремией в почечных аллотрансплантатах. N Английский J Med .1981 9 июля. 305(2):57-63. [Медлайн].
Torok-Storb B, Boeckh M, Hoy C. Связь специфических генотипов цитомегаловируса со смертью от миелосупрессии после трансплантации костного мозга. Кровь . 1997 г., 1 сентября. 90(5):2097-102. [Медлайн].
Мануэль О., Асберг А., Панг Х., Роллаг Х., Эмери В.К., Прейксайтис Дж.К. Влияние генетических полиморфизмов гликопротеина B цитомегаловируса на исходы у реципиентов паренхиматозных органов с цитомегаловирусной болезнью. Клин Заражение Дис . 2009 15 октября. 49(8):1160-6. [Медлайн].
Ивасенко Дж.М., Ховард Дж. , Арбакл С. и др. Цитомегаловирусная инфекция человека часто выявляется у мертворожденных и связана с тромботической васкулопатией плода. J Заразить Dis . 2011 июнь 203(11):1526-33. [Медлайн].
, Арбакл С. и др. Цитомегаловирусная инфекция человека часто выявляется у мертворожденных и связана с тромботической васкулопатией плода. J Заразить Dis . 2011 июнь 203(11):1526-33. [Медлайн].
Клемола Э., Фон Эссен Р., Хенле Г., Хенле В. Инфекционно-мононуклеозоподобное заболевание с отрицательной реакцией агглютинации гетерофилов. Клинические особенности в отношении антител к вирусу Эпштейна-Барр и цитомегаловирусу. J Заразить Dis . 1970 июнь 121(6):608-14. [Медлайн].
Коэн Дж.И., Кори Г.Р. Цитомегаловирусная инфекция у нормального хозяина. Медицина (Балтимор) . 1985 март 64(2):100-14. [Медлайн].
Horwitz CA, Henle W, Henle G. Клиническая и лабораторная оценка мононуклеоза, вызванного цитомегаловирусом, у ранее здоровых людей. Отчет о 82 случаях. Медицина (Балтимор) . 1986 март 65(2):124-34. [Медлайн].
1986 март 65(2):124-34. [Медлайн].
Клемола Э., Стенстрем Р., фон Эссен Р. Пневмония как клиническое проявление цитомегаловирусной инфекции у ранее здоровых взрослых. Scand J Infect Dis . 1972. 4(1):7-10. [Медлайн].
Жабер С., Чанкес Г., Борри Дж., Суш Б., Вердье Р., Перриго П.Ф. Цитомегаловирусная инфекция у больных в критическом состоянии: ассоциированные факторы и последствия. Сундук . 2005 янв. 127(1):233-41. [Медлайн].
фон Мюллер Л., Клемм А., Вайс М. и др.Активная цитомегаловирусная инфекция у больных с септическим шоком. Внезапное заражение Dis . 2006 12 октября (10): 1517-22. [Медлайн]. [Полный текст].
Калил А.С., Флореску Д.Ф. Распространенность и смертность, связанные с цитомегаловирусной инфекцией, у пациентов без иммуносупрессии в отделении интенсивной терапии.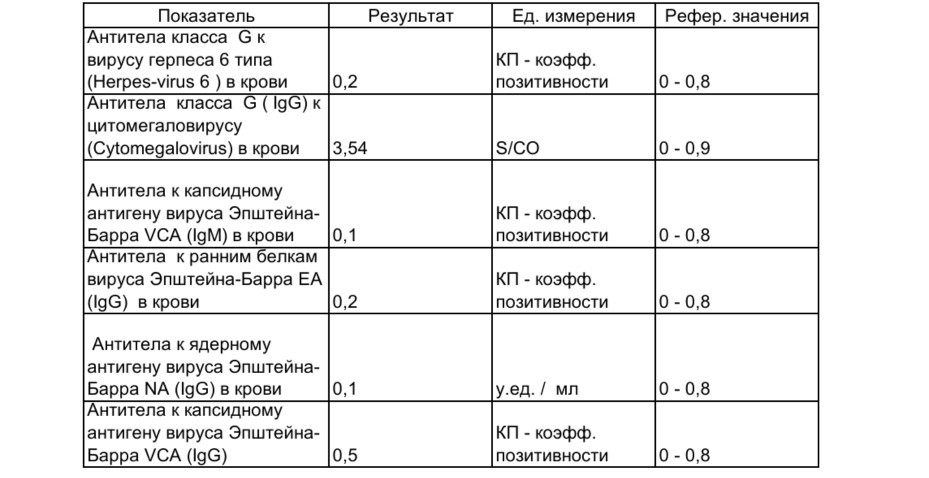 Крит Кеар Мед . 2009 г. 37 августа (8): 2350-8. [Медлайн].
Крит Кеар Мед . 2009 г. 37 августа (8): 2350-8. [Медлайн].
Кук С.Х., Йенчар Дж.К., Кранер Т.О., Дэвис Э.А., Фергюсон Р.М. Скрытые вирусы семейства герпеса могут повышать смертность хирургических пациентов в критическом состоянии. Am J Surg . 1998 окт. 176(4):357-60. [Медлайн].
De Vlieger G, Meersseman W, Lagrou K, et al. Цитомегаловирусный серостатус и исход у пациентов в критическом состоянии без иммунодефицита. Крит Кеар Мед . 2012 янв. 40 (1): 36-42. [Медлайн].
Джерри Тенг CL, Ван ПН, Чен ЮК, Ко БС. Лечение цитомегаловируса после аллогенной трансплантации гемопоэтических стволовых клеток: мини-обзор. J Microbiol Immunol Infect .2021. [Полный текст].
Reed EC, Bowden RA, Dandliker PS. Лечение цитомегаловирусной пневмонии ганцикловиром и внутривенным цитомегаловирусным иммуноглобулином у пациентов с трансплантацией костного мозга. Энн Интерн Мед . 1988, 15 ноября. 109(10):783-8. [Медлайн].
Энн Интерн Мед . 1988, 15 ноября. 109(10):783-8. [Медлайн].
Ид А.Дж., Артурс С.К., Дезиэль П.Дж., Вильгельм М.П., Разонэйбл Р.Р. Клинические предикторы рецидива после лечения первичного желудочно-кишечного цитомегаловирусного заболевания у реципиентов трансплантата паренхиматозных органов. Am J Трансплантация . 2010 10 января (1): 157-61. [Медлайн].
Дитерих Д.Т., Рахмин М. Цитомегаловирусный колит при СПИДе: клинические проявления у 44 пациентов и обзор литературы. J Приобретенный иммунодефицитный синдром . 1991. 4 Приложение 1: S29-35. [Медлайн].
Маккатчан Дж.А. Цитомегаловирусные инфекции нервной системы у больных СПИДом. Клин Заражение Дис . 1995 г. 20 апреля (4): 747-54. [Медлайн].
Шанахан А. , Малани П.Н., Каул Д.Р.Рецидивирующая цитомегаловирусная инфекция у реципиентов паренхиматозных органов. Transpl Infect Dis . 2009 г. 11 (6): 513-8 декабря. [Медлайн].
, Малани П.Н., Каул Д.Р.Рецидивирующая цитомегаловирусная инфекция у реципиентов паренхиматозных органов. Transpl Infect Dis . 2009 г. 11 (6): 513-8 декабря. [Медлайн].
Мартин-Давила П., Фортун Х., Гутьеррес К., Марти-Бельда П., Канделас А., Хонрубиа А. и др. Анализ количественного ПЦР-теста на ЦМВ-инфекцию у реципиентов трансплантата печени: цель найти оптимальное пороговое значение. Дж Клин Вирол . 2005 г. 33 июня (2): 138-44. [Медлайн].
Эйткен С., Барретт-Мьюир В., Миллар С., Темплтон К., Томас Дж., Шеридан Ф.Использование молекулярных анализов в диагностике и мониторинге цитомегаловирусной болезни после трансплантации почки. Дж Клин Микробиол . 1999 г., 37 сентября (9): 2804-7. [Медлайн]. [Полный текст].
Gerna G, Zipeto D, Parea M, Revello MG, Silini E, Percivalle E. Мониторинг инфекций, вызванных цитомегаловирусом человека, и лечение ганцикловиром у реципиентов трансплантата сердца путем определения виремии, антигенемии и ДНКемии. J Заразить Dis . 1991, сен. 164(3):488-98.[Медлайн].
Мониторинг инфекций, вызванных цитомегаловирусом человека, и лечение ганцикловиром у реципиентов трансплантата сердца путем определения виремии, антигенемии и ДНКемии. J Заразить Dis . 1991, сен. 164(3):488-98.[Медлайн].
Танабэ К., Токумото Т., Исикава Н., Кояма И., Такахаси К., Фучиноуэ С. Сравнительное исследование цитомегаловирусной (ЦМВ) антигенемии, полимеразной цепной реакции, серологии и анализа скорлупы в ранней диагностике и мониторинге ЦМВ-инфекции после трансплантация почки. Трансплантация . 1997, 27 декабря. 64(12):1721-5. [Медлайн].
Антицитомегаловирусное (CMV) моноклональное антитело с немедленным ранним антигеном, неконъюгированное, клон 3G9.2 от ХЕМИКОН. www.chemicon.com. Доступно на http://www.bio-medicine.org/biology-products/Anti-Cytomegalovirus—28CMV-29-Immediate-Early-Antigen-Monoclonal-Antibody—Unconjugated—Clone-3G9-2-from-CHEMICON -2132-1/. Доступ: 17 марта 2010 г.
Доступ: 17 марта 2010 г.
Боппана С.Б., Росс С.А., Шимамура М., Палмер А.Л., Ахмед А., Майклс М.Г. и др. Анализ полимеразной цепной реакции слюны для скрининга цитомегаловируса у новорожденных. N Английский J Med . 2011 2 июня. 364(22):2111-8. [Медлайн].[Полный текст].
Сангхави С.К., Абу-Эльмагд К., Кейтли М.С., Сент-Джордж К., Левандовски К., Боэс С.С. Взаимосвязь цитомегаловирусной нагрузки, оцененной с помощью ПЦР в реальном времени, с антигенемией pp65 у реципиентов трансплантата органов. Дж Клин Вирол . 2008 авг. 42 (4): 335-42. [Медлайн].
Джабс Д.А., Мартин Б.К., Форман М.С., Рикс М.О. Нагрузка ДНК цитомегаловируса (ЦМВ) в крови, прогрессирование ЦМВ ретинита и появление резистентного ЦМВ у пациентов с ЦМВ ретинитом. J Заразить Dis . 2005 г., 15 августа. 192(4):640-9.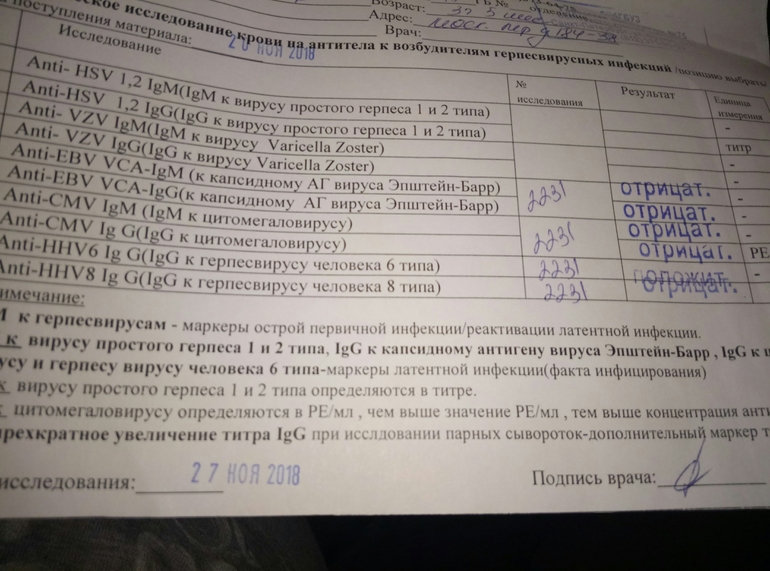 [Медлайн].
[Медлайн].
Молекулярная диагностика Рош. Тест COBAS AMPLICOR CMV MONITOR. Доступно на http://молекулярно.roche.com/assays/Pages/COBASAMPLICORCMVMONITORTest.aspx. Доступ: 10 июля 2012 г.
Молекулярная диагностика Рош. Тест COBAS AmpliPrep/COBAS TaqMan CMV. Доступно на http://молекулярно.roche.com/assays/Pages/COBASAmpliPrepCOBASTaqManCMVTest.aspx. Доступ: 10 июля 2012 г.
Смит Т.Ф., Эспи М.Дж., Мандрекар Дж., Джонс М.Ф., Кокерилл Ф.Р., Патель Р.Количественная полимеразная цепная реакция в режиме реального времени для оценки ДНКемии, вызванной цитомегаловирусом, вирусом Эпштейна-Барр и вирусом BK у реципиентов трансплантатов паренхиматозных органов. Клин Заражение Дис . 2007 15 октября. 45(8):1056-61. [Медлайн].
Размещаемый РР. Лекарственно-устойчивый цитомегаловирус: клинические проявления специфических мутаций.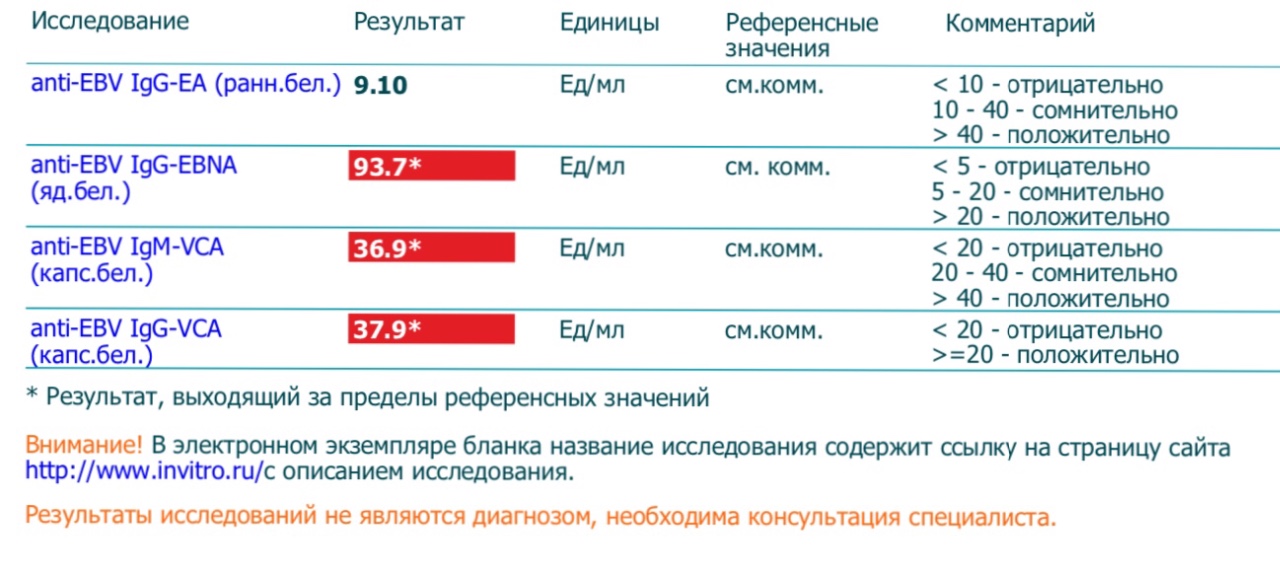 Карр Опин Трансплантация органов . 2018. 23(4):388-394. [Полный текст].
Карр Опин Трансплантация органов . 2018. 23(4):388-394. [Полный текст].
Marty FM, Ljungman P, Chemaly RF, Maertens J, Dadwal SS, Duarte RF, et al.Летермовир для профилактики цитомегаловируса при трансплантации гемопоэтических клеток. N Английский J Med . 2017, 6 декабря. [Medline]. [Полный текст].
Акоста Э., Боулин Т., Брукс Дж. и др. Достижения в разработке терапии цитомегаловирусных инфекций. J Заразить Dis . 2020. 221 (Приложение 1): S32-S44. [Полный текст].
Авторы не указаны. Валганцикловир: новый препарат. ЦМВ-ретинит: более простое пероральное лечение. Предварительный ввод .2003 12 августа (66): 133-5. [Медлайн].
Кальдес А., Жиль-Верне С., Армендарис Ю., Колом Х., Поу Л., Ниубо Х. и др. Последовательное лечение цитомегаловирусной инфекции или заболевания коротким курсом внутривенного введения ганцикловира с последующим пероральным введением валганцикловира: эффективность, безопасность и фармакокинетика. Transpl Infect Dis . 2009, 9 декабря. [Medline].
Transpl Infect Dis . 2009, 9 декабря. [Medline].
Dieterich DT, Chachoua A, Lafleur F. Лечение ганцикловиром желудочно-кишечных инфекций, вызванных цитомегаловирусом, у больных СПИДом. Rev Infect Dis . 1988 июль-август. 10 Приложение 3:S532-7. [Медлайн].
Калил А.С., Миндру К., Флореску Д.Ф. Эффективность валганцикловира 900 мг по сравнению с 450 мг для профилактики цитомегаловируса при трансплантации: мета-анализ прямого и непрямого сравнения лечения. Клин Заражение Дис . 2011 фев. 52(3):313-21. [Медлайн].
Эйвери РК. Валганцикловир в низких дозах для профилактики цитомегаловирусной инфекции при трансплантации органов: меньше на самом деле больше? Клин Заражение Дис . 2011 фев. 52(3):322-4. [Медлайн].
Legendre C, Pascual M. Улучшение результатов для реципиентов трансплантатов солидных органов, подверженных риску заражения цитомегаловирусной инфекцией: заболевание с поздним началом и косвенные последствия. Клин Заражение Дис . 2008 1 марта. 46(5):732-40. [Медлайн].
Улучшение результатов для реципиентов трансплантатов солидных органов, подверженных риску заражения цитомегаловирусной инфекцией: заболевание с поздним началом и косвенные последствия. Клин Заражение Дис . 2008 1 марта. 46(5):732-40. [Медлайн].
Цитомегаловирус. Am J Трансплантация . 4 ноября 2004 г. Приложение 10: 51-8. [Медлайн].
Бодро М., Сабе Н., Льядо Л. и др.Профилактика по сравнению с превентивной терапией цитомегаловирусной болезни у реципиентов трансплантата печени с высоким риском. Трансплантат печени . 2012 Сентябрь 18 (9): 1093-9. [Медлайн].
Паудис Н., Мехметай А., Занацци М., Москарелли Л., Пиперно Р., Ди Мария Л. Превентивная терапия для профилактики цитомегаловирусной болезни у реципиентов почечного трансплантата: наш предварительный опыт. Процесс трансплантации . 2009 май. 41(4):1204-6. [Медлайн].
2009 май. 41(4):1204-6. [Медлайн].
Бекх М., Гули Т.А., Майерсон Д.Цитомегаловирусная антигенемия pp65, раннее лечение ганцикловиром по сравнению с ганцикловиром при приживлении после аллогенной трансплантации костного мозга: рандомизированное двойное слепое исследование. Кровь . 1996 15 ноября. 88 (10): 4063-71. [Медлайн].
Avery RK, Marty FM, Strasfeld L, Lee I, Arrieta A, Chou S. Пероральный марибавир для лечения рефрактерных или резистентных цитомегаловирусных инфекций у реципиентов трансплантатов. Transpl Infect Dis . 2010 г., 12 декабря (6): 489–96.[Медлайн].
Marty FM, Ljungman P, Papanicolaou GA, Winston DJ, Chemaly RF, Strasfeld L. Профилактика марибавиром для предотвращения цитомегаловирусной болезни у реципиентов аллогенных трансплантатов стволовых клеток: фаза 3, двойное слепое, плацебо-контролируемое, рандомизированное исследование . Ланцет Infect Dis . 11 апреля 2011 г. (4): 284–92. [Медлайн].
Ланцет Infect Dis . 11 апреля 2011 г. (4): 284–92. [Медлайн].
Трофе Дж., Поте Л., Уэйд Э., Блумберг Э., Блум Р.Д. Марибавир: новый противовирусный препарат с активностью против цитомегаловируса. Энн Фармакотер . 2008 Октябрь 42 (10): 1447-57. [Медлайн].
Джон Г.Т., Маниваннан Дж., Чанди С., Питер С., Джейкоб К.К. Лечение лефлуномидом цитомегаловирусной болезни у реципиентов почечного аллотрансплантата. Трансплантация . 2004 г., 15 мая. 77(9):1460-1. [Медлайн].
Джон Г.Т., Маниваннан Дж., Чанди С., Питер С., Флеминг Д.Х., Чанди С.Дж. и др. Проспективная оценка терапии лефлуномидом цитомегаловирусной болезни у реципиентов почечного трансплантата. Процесс трансплантации . 2005 г., декабрь 37 (10): 4303-5. [Медлайн].
Battiwalla M, Paplham P, Almyroudis NG, McCarthy A, Abdelhalim A, Elefante A. Неспособность лефлуномида контролировать рецидивирующую цитомегаловирусную инфекцию в условиях почечной недостаточности после аллогенной трансплантации стволовых клеток. Transpl Infect Dis . 2007 9 марта (1): 28-32. [Медлайн].
Valantine HA, Luikart H, Doyle R, Theodore J, Hunt S, Oyer P. Влияние гипериммунного глобулина цитомегаловируса на исход после кардиоторакальной трансплантации: сравнительное исследование комбинированной профилактики ЦМВ-гипериммунным глобулином плюс ганцикловир по сравнению с одним ганцикловиром. Трансплантация . 2001 27 ноября.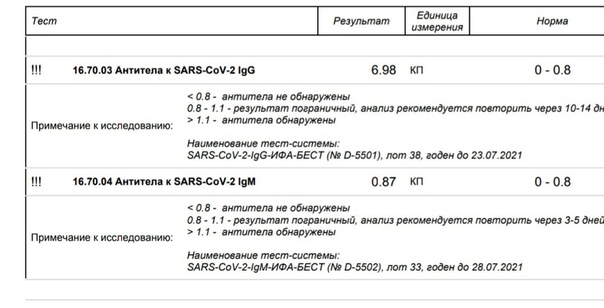 72 (10): 1647-52. [Медлайн].
72 (10): 1647-52. [Медлайн].
Го В., Поллард Р.Б.Цитомегаловирусная вакцина для трансплантации: мы ближе?. J Заразить Dis . 2008 г., 15 июня. 197(12):1631-3. [Медлайн].
Шляйсс МР. Вакцина против цитомегаловируса укрощает тролля трансплантации. Ланцет . 2011 9 апреля. 377(9773):1216-8. [Медлайн].
Pass RF, Zhang C., Evans A., Simpson T., Andrews W., Huang ML, et al. Вакцинопрофилактика материнской цитомегаловирусной инфекции. N Английский J Med . 2009 19 марта.360(12):1191-9. [Медлайн]. [Полный текст].
Прайс НБ, Причард МН. Прогресс в разработке новых методов лечения герпесвирусных инфекций. Карр Опин Вирол . 2011 Декабрь 1 (6): 548-54. [Медлайн].
Wolf DG, Shimoni A, Resnick IB, Stamminger T, Neumann AU, Chou S. Кинетика цитомегаловируса человека после введения артесуната после трансплантации гемопоэтических стволовых клеток. Противовирусный рез . 2011 июнь 90 (3): 183-6. [Медлайн].
Шапира М.Ю., Резник И.Б., Чоу С. и др. Артесунат как мощное противовирусное средство у пациента с поздней лекарственно-устойчивой цитомегаловирусной инфекцией после трансплантации гемопоэтических стволовых клеток. Клин Заражение Дис . 2008 1 мая. 46(9):1455-7. [Медлайн].
Kaul DR, Stoelben S, Cober E, Ojo T, Sandusky E, Lischka P. Первый отчет об успешном лечении полирезистентной цитомегаловирусной болезни новым анти-ЦМВ соединением AIC246. Am J Трансплантация . 2011 май. 11(5):1079-84. [Медлайн].
Первый отчет об успешном лечении полирезистентной цитомегаловирусной болезни новым анти-ЦМВ соединением AIC246. Am J Трансплантация . 2011 май. 11(5):1079-84. [Медлайн].
30809 — Цитомегаловирус (ЦМВ) ИФА на все антитела | Клинический
Клиническая утилитаImmucor Capture-CMV — это качественная твердофазная тест-система для определения адгезии эритроцитов in vitro для обнаружения антител (IgG плюс IgM) к цитомегаловирусу (CMV) в сыворотке или плазме человека.Capture-CMV предназначен для скрининга доноров или пациентов на наличие серологических признаков предшествующей инфекции ЦМВ.
О ЦМВ
Цитомегаловирус (ЦМВ) является распространенным вирусным патогеном человека, принадлежащим к семейству вирусов герпеса. Наличие антител к ЦМВ у человека указывает на предыдущее заражение вирусом. Существует вероятность того, что у таких людей может произойти реактивация вируса.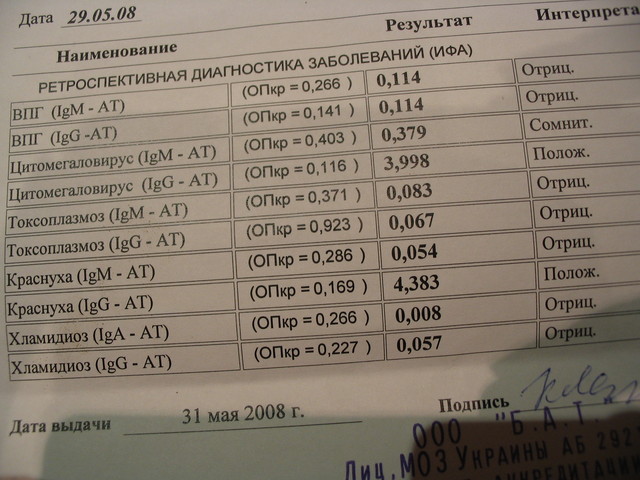 ЦМВ-инфекция обычно протекает бессимптомно и может сохраняться как латентная или хроническая инфекция. 1 Передача вируса может происходить при переливании крови или трансплантации органов от серопозитивных доноров. 2
ЦМВ-инфекция обычно протекает бессимптомно и может сохраняться как латентная или хроническая инфекция. 1 Передача вируса может происходить при переливании крови или трансплантации органов от серопозитивных доноров. 2
Пациенты с ослабленным иммунитетом, такие как недоношенные новорожденные, пациенты с трансплантацией органов и онкологические больные, подвергаются большему риску развития более тяжелых проявлений ЦМВ-инфекции, которая может быть основной прямой или косвенной причиной смертности у таких пациентов. 2 Врожденно инфицированные новорожденные особенно склонны к развитию тяжелой цитомегалической болезни включения (CID). 3 Тяжелая форма CID может быть фатальной или может вызвать постоянные неврологические последствия, такие как умственная отсталость, глухота, микроцефалия и двигательная дисфункция. Синдром типа ЦМВ-мононуклеоза может возникнуть в результате переливания продуктов крови, инфицированных ЦМВ, или трансплантации инфицированных ЦМВ донорских органов серонегативному пациенту с ослабленным иммунитетом.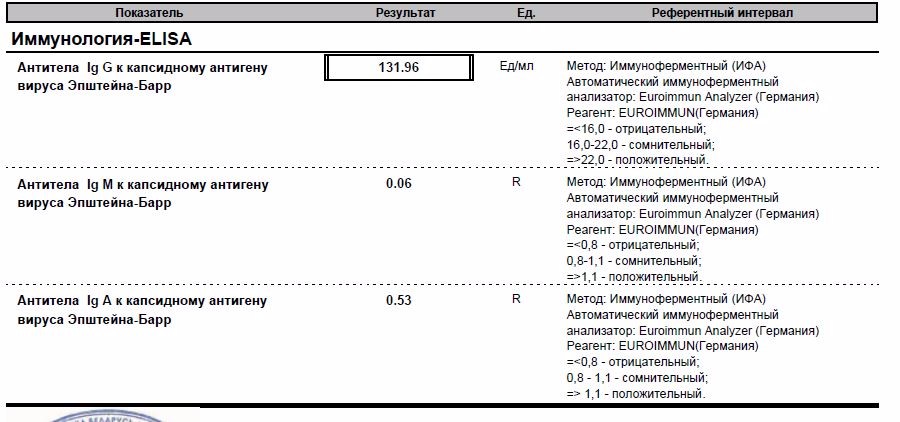 1 Новорожденные с низкой массой тела при рождении также подвергаются высокому риску ЦМВ-мононуклеоза
1 Новорожденные с низкой массой тела при рождении также подвергаются высокому риску ЦМВ-мононуклеоза
при переливании инфицированных ЦМВ продуктов крови.
Одним из методов предотвращения или снижения ЦМВ-инфекции у серонегативных пациентов с ослабленным иммунитетом является выбор ЦМВ-серонегативных доноров крови или доноров органов, которые прошли серологический скрининговый тест на антитела к ЦМВ. Capture-CMV — это твердофазная система обнаружения антител к адгезии эритроцитов, основанная на процедурах Plapp et al. 4 Эта процедура представляет собой модификацию тестов смешанной агглютинации для обнаружения антигенов и антител Coombs et al5 и Hogman6 с использованием эритроцитов, покрытых анти-IgG и IgG, в качестве индикаторной системы.В анализах захвата для обнаружения антител к эритроцитам или тромбоцитам в качестве индикатора используются эритроциты, покрытые анти-IgG. 7 Capture-CMV использует анти-IgG плюс индикаторные эритроциты, покрытые анти-IgM.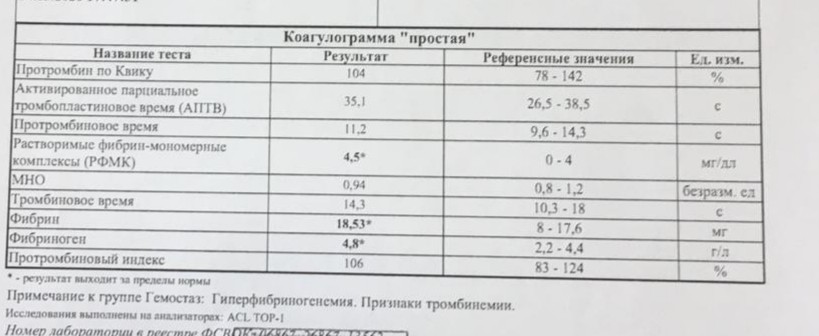
Антиген CMV, используемый в этом тесте, получен из штамма цитомегаловируса AD 169, выращенного в клетках фибробластов крайней плоти человека (HF). Инактивированный вирус наносят на лунки для микротитрования. Лунки высушиваются и поставляются пользователям вместе с необходимыми реагентами и контролями.
Твердофазная система адгезии эритроцитов Immucor Capture-CMV для обнаружения антител IgG и IgM к ЦМВ с использованием процесса ручного тестирования и/или платформы Immucor NEO. Образцы будут протестированы с использованием метода, подходящего для данного типа образца и условий: |Ручной метод Реагенты общего количества антител CMV; Автоматизированный метод |Реагенты общего содержания антител NEO CMV.
Процедура анализа представляет собой двухэтапный тест на адгезию эритроцитов в твердой фазе, проводимый в лунках для микротитрования, покрытых инактивированным вирусом ЦМВ.Образцы сыворотки или плазмы добавляют в лунки, покрытые вирусом.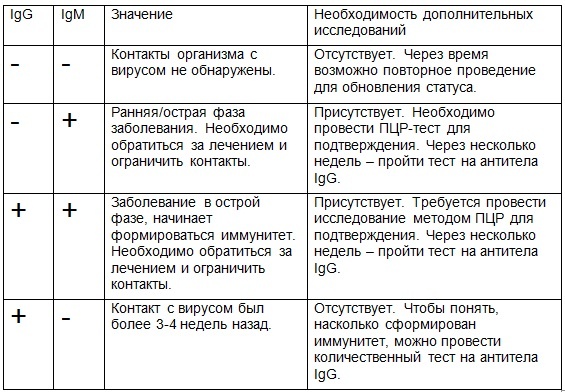 Образцы инкубируют в течение пяти минут, в течение которых антитела, специфичные к белкам ЦМВ, связываются с иммобилизованными вирусными белками. Несвязавшиеся иммуноглобулины вымывают из лунок и заменяют суспензией индикаторных эритроцитов, покрытых анти-IgG плюс анти-IgM. Центрифугирование приводит индикаторные эритроциты в контакт с антителами, связанными с иммобилизованными вирусными белками. В случае положительного теста миграция индикаторных эритроцитов на дно лунки затруднена, так как между индикаторными эритроцитами и антителами, связанными с вирусом, образуются мостики анти-IgG и анти-IgM.Как следствие, индикаторные эритроциты прилипают к поверхности лунки для микротитрования. Напротив, при отсутствии взаимодействия вирусного антигена с антителом (т. е. при отрицательном тесте) индикаторные эритроциты не препятствуют своей миграции и оседают на дно лунки в виде упакованной, четко очерченной клеточной кнопки. Тест проведен компанией VRL Eurofins, 6933 S. Revere Parkway, Centennial, CO 80112.
Образцы инкубируют в течение пяти минут, в течение которых антитела, специфичные к белкам ЦМВ, связываются с иммобилизованными вирусными белками. Несвязавшиеся иммуноглобулины вымывают из лунок и заменяют суспензией индикаторных эритроцитов, покрытых анти-IgG плюс анти-IgM. Центрифугирование приводит индикаторные эритроциты в контакт с антителами, связанными с иммобилизованными вирусными белками. В случае положительного теста миграция индикаторных эритроцитов на дно лунки затруднена, так как между индикаторными эритроцитами и антителами, связанными с вирусом, образуются мостики анти-IgG и анти-IgM.Как следствие, индикаторные эритроциты прилипают к поверхности лунки для микротитрования. Напротив, при отсутствии взаимодействия вирусного антигена с антителом (т. е. при отрицательном тесте) индикаторные эритроциты не препятствуют своей миграции и оседают на дно лунки в виде упакованной, четко очерченной клеточной кнопки. Тест проведен компанией VRL Eurofins, 6933 S. Revere Parkway, Centennial, CO 80112.

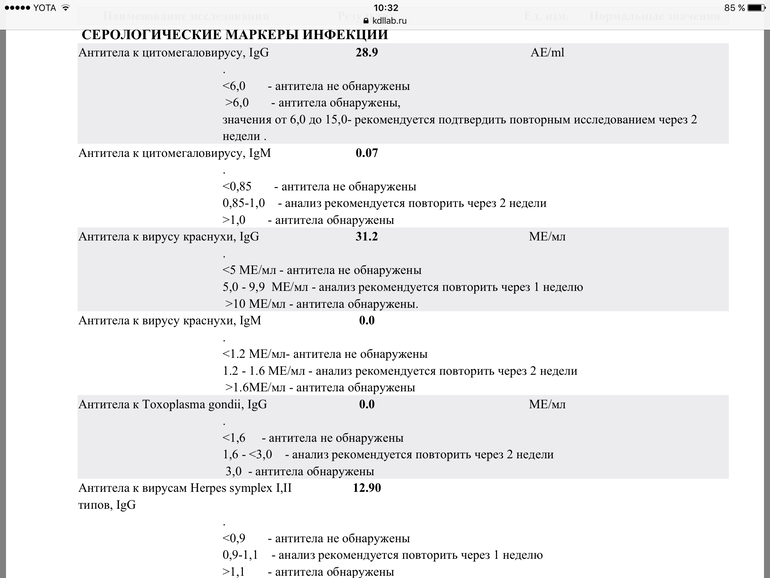

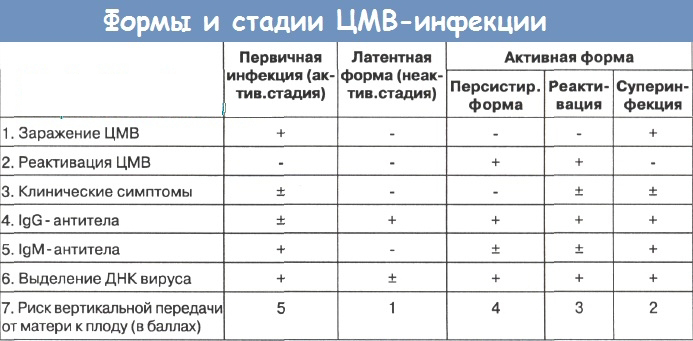
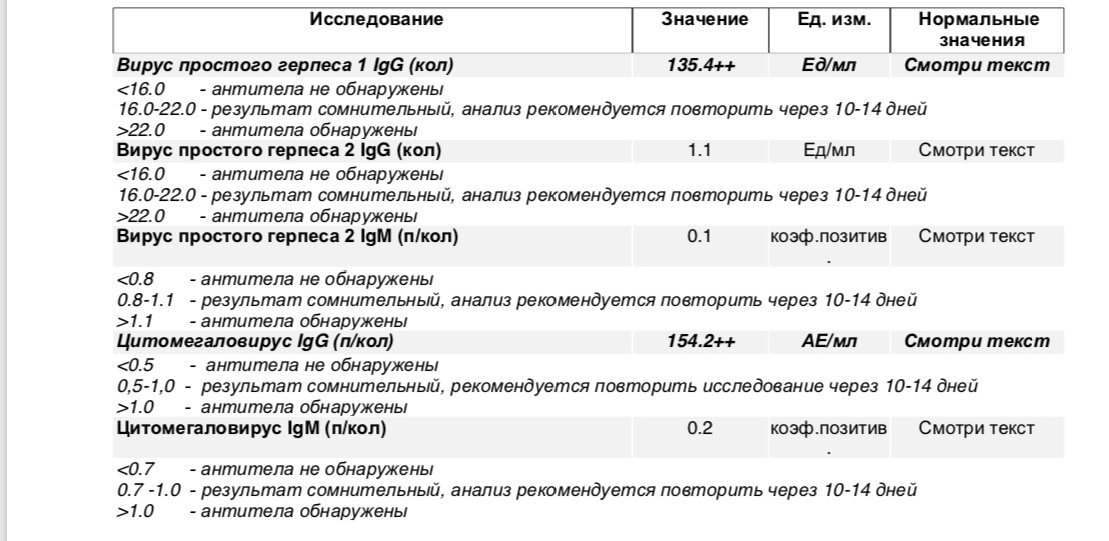
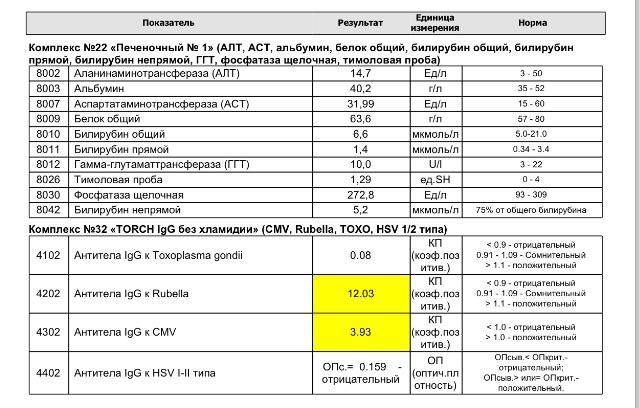 Обнаружение специфического антитела иммуноглобулина M к вирусу краснухи с использованием меченого ферментом антигена.Дж. Клин Микробиол. 1985 июнь; 21 (6): 963–968. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Обнаружение специфического антитела иммуноглобулина M к вирусу краснухи с использованием меченого ферментом антигена.Дж. Клин Микробиол. 1985 июнь; 21 (6): 963–968. [Бесплатная статья PMC] [PubMed] [Google Scholar] J заразить дис. 1979 г., октябрь; 140 (4): 596–600. [PubMed] [Google Scholar]
J заразить дис. 1979 г., октябрь; 140 (4): 596–600. [PubMed] [Google Scholar] Джей Клин Патол. 1978 г., май; 31 (5): 483–487. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Джей Клин Патол. 1978 г., май; 31 (5): 483–487. [Бесплатная статья PMC] [PubMed] [Google Scholar] J заразить дис. 1980 г., август; 142 (2): 250–255. [PubMed] [Google Scholar]
J заразить дис. 1980 г., август; 142 (2): 250–255. [PubMed] [Google Scholar] Прямой иммуноферментный анализ, в котором используется антиген, меченный пероксидазой, для определения антител иммуноглобулина М к цитомегаловирусу. Дж. Клин Микробиол. 1981 март; 13 (3): 416–422. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Прямой иммуноферментный анализ, в котором используется антиген, меченный пероксидазой, для определения антител иммуноглобулина М к цитомегаловирусу. Дж. Клин Микробиол. 1981 март; 13 (3): 416–422. [Бесплатная статья PMC] [PubMed] [Google Scholar]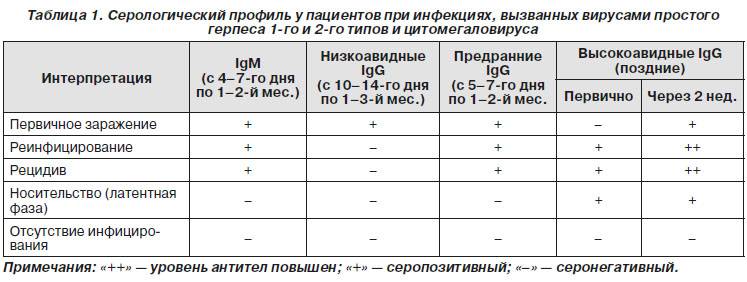 Дж. Клин. Вирол. 2008 г.; 41: 192–197. пмид: 18054840.
Дж. Клин. Вирол. 2008 г.; 41: 192–197. пмид: 18054840. Охрана здоровья матери и ребенка в Китае, 2013 г.; 28: 4738–4739.
Охрана здоровья матери и ребенка в Китае, 2013 г.; 28: 4738–4739. Патология 2010; 42: 578–580. пмид: 20854078.
Патология 2010; 42: 578–580. пмид: 20854078. Jin G, Meng YH, Liu L, Niu Y, Chen S, Qi C и др.Разработка биосенсора на основе эллипсометрии изображений и биомедицинских приложений. Тонкие твердые пленки 2011; 519: 2750–2757.
Jin G, Meng YH, Liu L, Niu Y, Chen S, Qi C и др.Разработка биосенсора на основе эллипсометрии изображений и биомедицинских приложений. Тонкие твердые пленки 2011; 519: 2750–2757. 2010 г.; 25: 1530–1534. пмид: 19932609.
2010 г.; 25: 1530–1534. пмид: 19932609. Дж. Биохим. Биофиз. Методы 2003; 57: 203–211. пмид: 14512155.
Дж. Биохим. Биофиз. Методы 2003; 57: 203–211. пмид: 14512155. ISBN: 0 393 96045 5
ISBN: 0 393 96045 5 Гранжо-Керос Л., Майо М.Дж., Лебон П., Фреймут Ф., Юджин Г., Стрикер Р. и др. Значение индекса авидности IgG к цитомегаловирусу (ЦМВ) для диагностики первичной ЦМВ-инфекции у беременных. Дж. Заразить. Дис. 1997 год; 175: 944–946. пмид:55.
Гранжо-Керос Л., Майо М.Дж., Лебон П., Фреймут Ф., Юджин Г., Стрикер Р. и др. Значение индекса авидности IgG к цитомегаловирусу (ЦМВ) для диагностики первичной ЦМВ-инфекции у беременных. Дж. Заразить. Дис. 1997 год; 175: 944–946. пмид:55.