Влияние хронического внутриутробного дистресса на состояние здоровья детей первого года жизни » Акушерство и Гинекология
Цель исследования. Изучение состояния здоровья детей у женщин с привычным невынашиванием беременности в анамнезе в течение первого года жизни в зависимости от степени тяжести перенесенной внутриутробной гипоксии по данным антенатальной кардиотокографии (КТГ).
Материал и методы. Обследовано 110 детей первого года жизни, рожденных у матерей, родоразрешенных вследствие ухудшения состояния плода путем кесарева сечения в сроки беременности 37–40 нед. Выделены 3 подгруппы детей в зависимости от показателя состояния плода (ПСП) по данным антенатальной КТГ. Контрольную группу составили 11 детей, рожденных от матерей с привычным невынашиванием беременности в анамнезе путем кесарева сечения и без единого эпизода нарушения состояния во внутриутробном периоде (с нормальными показателями ПСП от 0 до 1 по данным антенатальной КТГ). Оценивались параметры физического развития, соматический, неврологический статус, нейроповеденческие реакции, психомоторное развитие.
Результаты исследования. Нарушения постнатальной адаптации у детей 1-й подгруппы (ПСП 1,1–2,0) были минимальными. Дети 3-й подгруппы (ПСП больше 3) перенесли острую гипоксию, и безотлагательное их родоразрешение способствовало быстрой компенсации и в дальнейшем благополучной адаптации. Наиболее явные отклонения отмечались у детей 2-й подгруппы ( ПСП 2,1–3,0) в виде различных проявлений нарушения постнатальной адаптации, причем состояние детей, родоразрешенных в пределах 5 дней, было компенсировано, в отличие от детей той же группы, перенесших более длительную (свыше 5 дней) хроническую гипоксию и родоразрешенных соответственно в более поздние сроки (в 85,4% случаев отмечалась затрудненная адаптация после рождения, в 90,3% — вегетовисцеральная дисфункция и другие отклонения в развитии).
Заключение. При ПСП менее 2,0 рекомендована выжидательная тактика с мониторированием состояния плода и фетоплацентарной системы, родоразрешение — только при ухудшении ПСП; при ПСП более 3,0 – срочное родоразрешение. Нецелесообразно пролонгирование беременности при ПСП в пределах от 2,1 до 3,0 более 5 дней.
Нецелесообразно пролонгирование беременности при ПСП в пределах от 2,1 до 3,0 более 5 дней.
Важнейшим фактором, определяющим качество жизни детей, перенесших внутриутробную гипоксию плода, является определение оптимального срока родоразрешения на основе объективных клинико-лабораторных данных состояния плода и фетоплацентарной системы. Именно длительность страдания плода является прогностическим маркером психосоматического развития в течение жизни.
В настоящее время наиболее оптимальный интегральный показатель состояния плода (ПСП) позволяет получить антенатальная кардиотокография (КТГ), результаты которой являются определяющими в выборе дальнейшей тактики ведения беременности. Вместе с тем ложноположительные и ложноотрицательные результаты этого исследования свидетельствуют о необходимости, с одной стороны, объективизации состояния плода с помощью новых диагностических тестов, а с другой – изучения катамнеза детей первых лет жизни для решения вопроса об оптимальных сроках пролонгирования беременности в зависимости от данных антенатальной КТГ [3,4].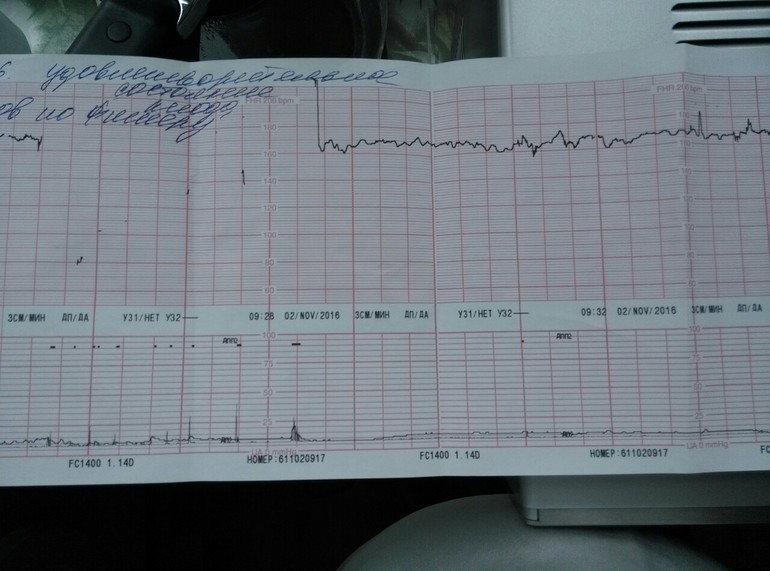
Цель исследования – изучение состояния здоровья детей у женщин с привычным невынашиванием беременности в анамнезе в течение первого года жизни в зависимости от степени тяжести перенесенной внутриутробной гипоксии по данным антенатальной КТГ.
Материал и методы исследования
Обследовано 110 детей первого года жизни, рожденных от матерей, родоразрешенных вслед ствие
ухудшения состояния плода по данным антенатальной КТГ путем кесарева сечения в доношенные сроки беременности (37–40 нед). Анализ состояния здоровья детей в течение первого года жизни
проведен в зависимости от степени выраженности перенесенного хронического дистресса по данным
антенатальной КТГ (ПСП). Контрольную группу составили 11 детей, рожденных от матерей с привычным невынашиванием беременности в анамнезе путем кесарева сечения, без единого эпизода
нарушения состояния во внутриутробном периоде (с нормальными показателями ПСП от 0 до 1 по данным антенатальной КТГ).
С целью выявления значимости перенесенных нарушений в течение первого года жизни дети были осмотрены трехкратно в динамике (в 3, 6 мес и 1 год).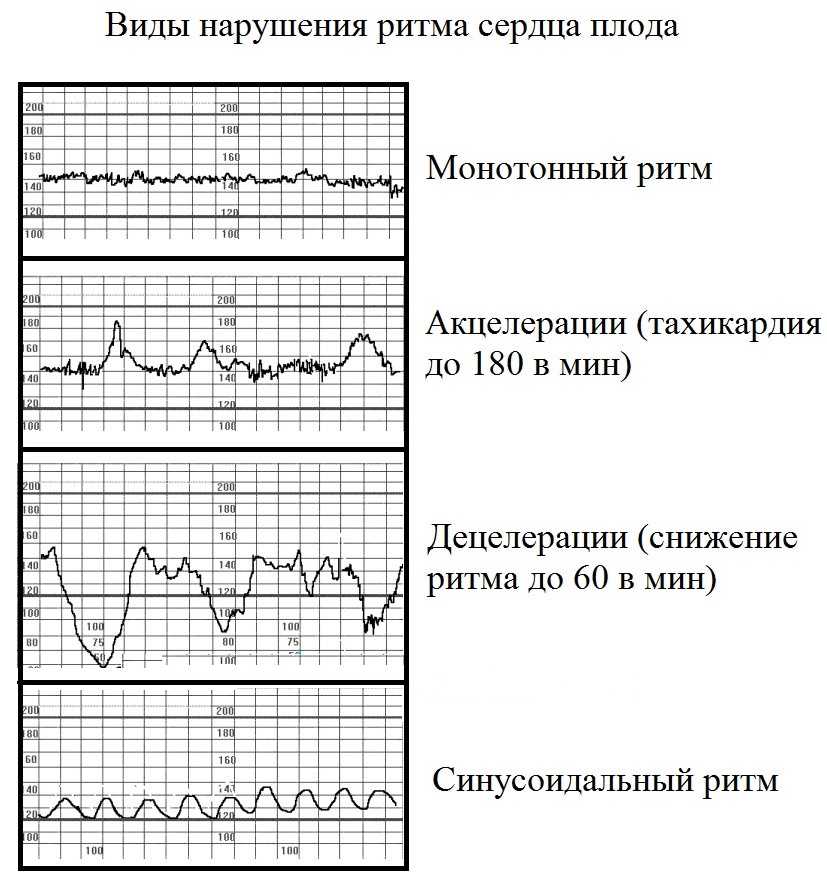 При каждом осмотре оценивались параметры физического развития, соматический, неврологический статус, нейроповеденческие реакции, прирост умений и навыков ребенка ‒ оценка психомоторного развития.
При каждом осмотре оценивались параметры физического развития, соматический, неврологический статус, нейроповеденческие реакции, прирост умений и навыков ребенка ‒ оценка психомоторного развития.
Оценка параметров физического статуса проводилась с учетом центильных кривых, разработанных на основании методических рекомендаций Минздравсоцразвития Российской Федерации по физическому развитию детей раннего возраста [1,2].
Оценка психомоторного развития проводилась по шкале КАТ/КЛАМС (The Clinical Adaptive Test/Clinical Linguistic and Auditory Milestone Scale). По данной методике раздельно оценивали развитие макромоторики, формирование навыков решения наглядных (КАТ) и речевых задач (КЛАМС). Тестирование проводилось с учетом возраста развития, отражающего уровень функциональной зрелости ребенка. Из инструментальных методов использовались нейросонография, определение состояния слухового (по данным отоакустической эмиссии) и зрительного анализаторов.
Результаты исследования и обсуждение
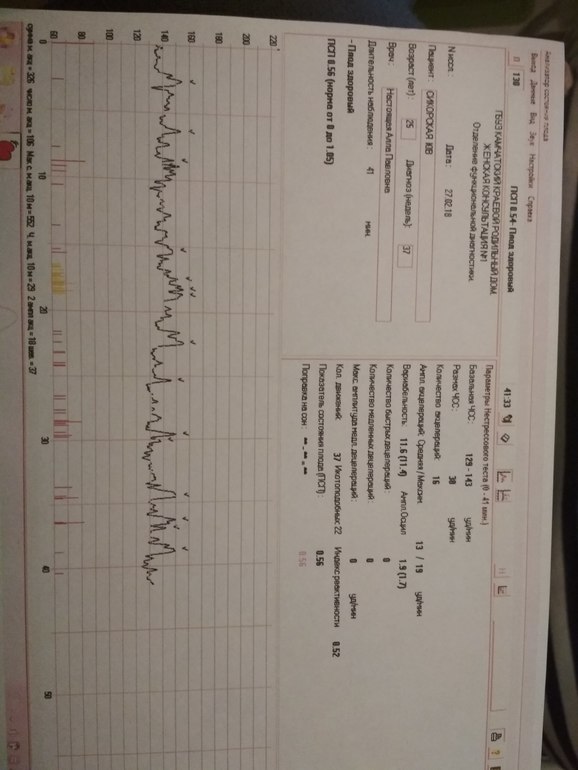
В соответствии с данными антенатальной КТГ (ПСП) обследуемые были распределены на 3 подгруппы: 1-ю подгруппу составили 37 детей, имевших ПСП 1,1–2,0 (среднее значение 1,67±0,24), 2-ю – 41 ребенок с ПСП 2,1–3,0 (среднее значение 2,37±0,29), 3-ю – 32 ребенка с ПСП свыше 3,0 (среднее значение 3,53±0,35).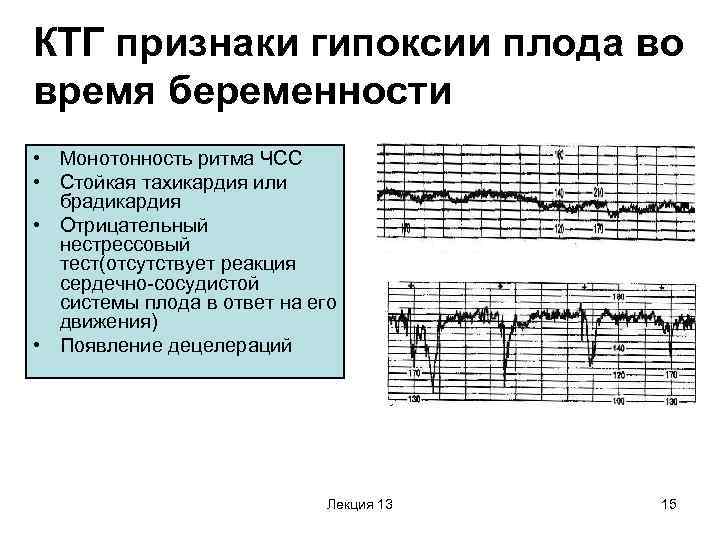
Длительность антенатального страдания в 1-й подгруппе колебалась от 7 до 43 дней и составила в среднем 7,48±2,6 дня, во 2-й – от 5 до 32 дней (16,2±1,5 дня) и в 3-й– от 1 до 2 дней (1,7±0,7 дня).
Общая характеристика детей при рождении по группам представлена в табл. 1.
Таблица 1. Характеристика массо-ростовых параметров новорожденных, оценки состояния при рождении по шкале Апгар в зависимости от показателей ПСП.
Как видно из табл.1, достоверных различий по массоростовым показателям в подгруппах и отличия от контрольной группы детей не установлено.
Оценка состояния по шкале Апгар в 1-й подгруппе составила 7,5±0,6 балла на 1-й минуте и 8,5±0,5 балла на 5-й минуте. во 2-й подгруппе – 6,7±1,6 и 7,2±1,2 балла, в 3-й — 7±1,1 и 8,2±0,7 балла соответственно. При отсутствии достоверных различий прослеживается тенденция к более низким цифрам оценки по шкале Апгар и на 1-й и 5-й минуте у детей 2-й подгруппы (ПСП 2,37 ± 0,29).
При исследовании показателей кислотноосновного состояния капиллярной крови у новорожденных до 1 вдоха (истинный показатель перенесенной внутриутробной гипоксии) установлено (табл.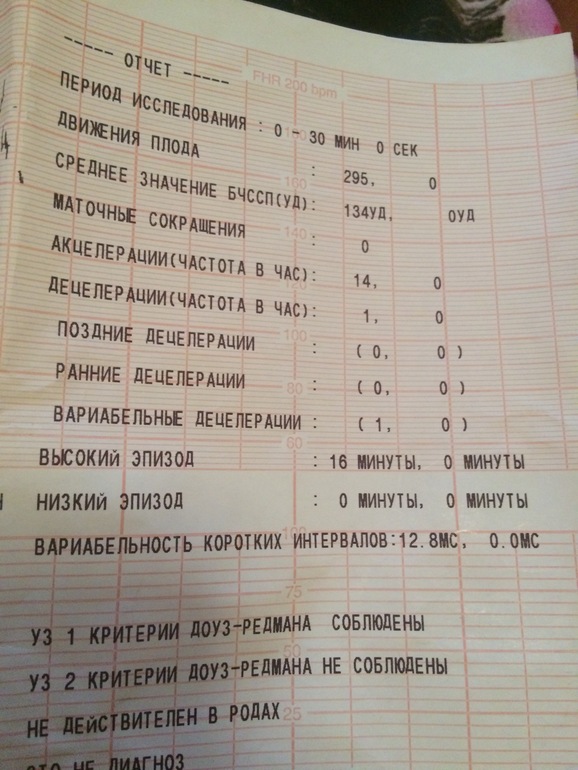 2), что во всех случаях имела место гипоксемия (рО ) с достоверно более низкими параметрами во 2-й подгруппе (44,94±2,7 в 1-й подгруппе, 38±6,81 во 2-й, 31±1,15 в 3-й подгруппе, р <0,05). Ацидоз различного генеза (метаболический, смешанный) имел место почти во всех случаях: pН 7,289±0,02 в 1-й подгруппе, 7,20±0,03 во 2-й, 7,245±0,01 в 3-й подгруппе новорожденных; при этом также прослеживалась тенденция к более низким показателям во 2-й подгруппе.
2), что во всех случаях имела место гипоксемия (рО ) с достоверно более низкими параметрами во 2-й подгруппе (44,94±2,7 в 1-й подгруппе, 38±6,81 во 2-й, 31±1,15 в 3-й подгруппе, р <0,05). Ацидоз различного генеза (метаболический, смешанный) имел место почти во всех случаях: pН 7,289±0,02 в 1-й подгруппе, 7,20±0,03 во 2-й, 7,245±0,01 в 3-й подгруппе новорожденных; при этом также прослеживалась тенденция к более низким показателям во 2-й подгруппе.
Таблица 2. Характеристика кислотно-основного состояния капиллярной крови у детей в зависимости от ПСП по данным антенатальной КТГ.
В целом в основной группе к 12 мес все дети были полностью компенсированы и здоровы. Ни в одном
случае не был установлен грубый неврологический дефект. Уже к возрасту 6 мес дети имели средние
показатели развития, удовлетворительный соматический и неврологический статус. Наибольшие
отличия и особенности были установлены при оценке состояния детей в первые 3 мес жизни, когда происходит основной процесс адаптации к внеутробному существованию, начинается самостоятельное функционирование всех органов и систем. Учитывалась частота транзиторных симптомов, которые могли бы указать на перенесенную гипоксию: длительный и частый немотивированный крик-плач, нарушение сна (невротический сон), частые срыгивания, выраженные кишечные колики, нерегулярный стул, снижение аппетита, возбудимость ребенка ‒ частый тремор, спонтанный симптом Моро, клонусоиды стоп, которые носили характер вегетовисцеральной дисфункции, и повышение нервно-рефлекторной возбудимости пограничного характера (табл. 3)
Учитывалась частота транзиторных симптомов, которые могли бы указать на перенесенную гипоксию: длительный и частый немотивированный крик-плач, нарушение сна (невротический сон), частые срыгивания, выраженные кишечные колики, нерегулярный стул, снижение аппетита, возбудимость ребенка ‒ частый тремор, спонтанный симптом Моро, клонусоиды стоп, которые носили характер вегетовисцеральной дисфункции, и повышение нервно-рефлекторной возбудимости пограничного характера (табл. 3)
Таблица 3. Показатели состояния здоровья и нейроповеденческих реакций у детей в зависимости от показателей ПСП.
Как видно из табл. 3, а также из приведенных выше данных, наиболее выраженные нарушения адаптации отмечались у детей 2-й подгруппы. Полученные результаты являются важными не только для акушеров ‒ для выработки тактики родоразрешения, но и для педиатров-неонатологов — для более правильной оценки состояния детей и изменения тактики их ведения, особенно медикаментозных вмешательств.
Возможно, что нарушения фетоплацентарных взаимоотношений прежде всего приводят к регуляторным расстройствам, которые проявляются в дисфункции желудочно-кишечного тракта, фаз
сна и бодрствования и, возможно, в дискомфорте и даже боли, что ребенок выражает в виде крика.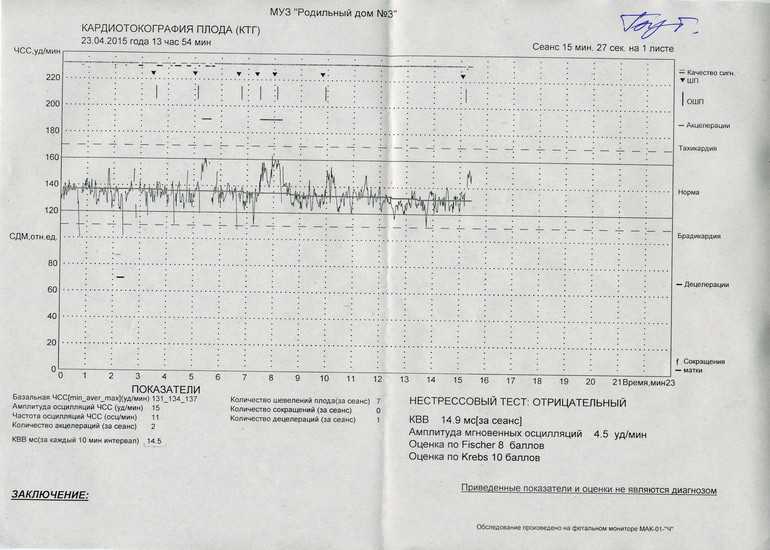
Таким образом, в нашем исследовании установлено, что наиболее сложную постнатальную адаптацию проходили дети, у которых наблюдались длительные пограничные параметры ПСП по данным кардиотокограммы. Трудность трактовки этих показателей предопределяет желание акушера пролонгировать беременность медикаментозным способом. Именно этим объясняется факт достоверно
более длительного периода от момента получения первых результатов до родоразрешения (в среднем
более 2 нед). В то же время показатели физического развития новорожденных младенцев указывают на то, что именно в этой группе страдание детей было более выраженным и прибавка массы тела у них происходила медленнее, чем у детей двух остальных подгрупп. Можно предположить, что дети 2-й подгруппы с пограничными параметрами ПСП, переносящие более длительную, хотя и не критическую (по абсолютным значени-ям рН) внутриутробную гипоксию, имеют столь значительное напряжение всех компенсаторных возможностей, что в дальнейшем это выражается в более затрудненной адаптации к внешним условиям. Дети 3-й подгруппы по данным состояния плода и выраженности гипоксемии по параметрам кислотно-основного состояния перенесли острую гипоксию, и безотлагательное их родоразрешение способствовало быстрой компенсации и в дальнейшем благополучной адаптации. Нарушение постнатальной адаптации у детей 1-й группы было минимальным.
Дети 3-й подгруппы по данным состояния плода и выраженности гипоксемии по параметрам кислотно-основного состояния перенесли острую гипоксию, и безотлагательное их родоразрешение способствовало быстрой компенсации и в дальнейшем благополучной адаптации. Нарушение постнатальной адаптации у детей 1-й группы было минимальным.
В результате детального анализа состояния детей 2-й подгруппы с ПСП от 2,1 до 3,0, родоразрешенных в пределах 5 дней, установлено, что дети были компенсированы и не вызывали опасений у педиатров, в отличие от детей той же группы, перенесших более длительную (свыше 5 дней) хроническую гипоксию и родоразрешенных соответственно в более поздние сроки. У детей 2-й подгруппы, перенесших длительную (16,2±1,5 дня) внутриутробную гипоксию (ПСП 2,1–3,0), в 85,4% случаев отмечалась затрудненная адаптация после рождения, в 90,3% ‒ вегетовисцеральная дисфункция и другие отклонения в развитии в течение ≥12 мес жизни, требующие усиленного мониторинга и врачебного контроля.
Тактика при параметрах ПСП менее 2,0 и более 3,0 является достаточно понятной – в первом случае выжидательная тактика с мониторированием состояния плода и фетоплацентарной системы в целом и родоразрешение только при ухудшении ПСП, во втором – срочное родоразрешение.
Таким образом, проведенные исследования свидетельствуют о необходимости внедрения новых, объективных маркеров состояния плода во избежание ненадлежащих врачебных (в том числе оперативных) манипуляций. Особенности развития детей первого года жизни, перенесших внутриутробную гипоксию (дистресс) различной степени тяжести в сроки беременности 37 нед и более, свидетельствуют о нецелесообразности пролонгирования беременности при ПСП в пределах от 2,1 до 3,0 и сокращении продолжительности консервативных мероприятий до 5 дней.
1. Доскин В.А., Келлер Х., Мураенко Н.М. Морфофункциональные константы детского организма.
М.: Медицина, 1997.
2. Кешишян Е.С. Психомоторное развитие детей на первом году жизни: Пособие для врачей. – М.:
Московский НИИ педиатрии и детской хирургии МЗ РФ, 2000.
3. ACOG compendium of selected publications: Antepartum Fetal surveillance. – 2009. — P.634.
4. Grivell RM, Wong L, Bhatia V. Regimens of fetal surveillance for impaired fetal growth (Review) // The Cochrane Library.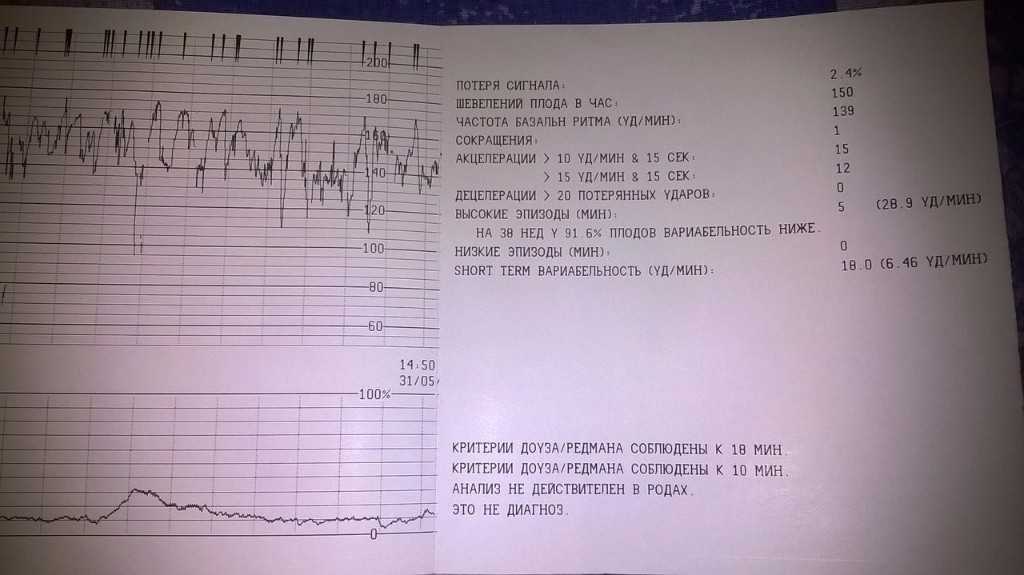 — 2009. — Issue 1. – P. 20—29.
— 2009. — Issue 1. – P. 20—29.
Ходжаева Зульфия Сагдуллаевна, д-р мед. наук, вед. науч. сотр. отд-ния невынашивания беременности ФГУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздравсоцразвития России
Адрес: 117997, Москва, ул. Академика Опарина, д. 4
Телефон: (8-495) 438-14-77
E-mail: [email protected]
Особенности адаптации плода к кардиотокографическому исследованию как критерий оценки его состояния » Библиотека врача
1) ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России, Москва, Россия;
2) АНО ВО «Открытый университет экономики, управления и права», Москва, Россия;
3) ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России, кафедра акушерства, гинекологии, перинатологии и репродуктологии ИПО врачей, Москва, Россия
Цель. Определение адаптационного профиля плода во время регистрации антенатальной кардиотокографии (КТГ) с последующим анализом неонатальных исходов.
Определение адаптационного профиля плода во время регистрации антенатальной кардиотокографии (КТГ) с последующим анализом неонатальных исходов.
Материалы и методы. В ретроспективное исследование вошло 1927 наблюдений в сроке от 33 до 40 недель беременности. Последовательные величины интервалов R–R регистрировали с помощью компьютеризированного кардиомонитора УНИКОС. Оценку вариабельности сердечного ритма (ВСР) проводили в течение первых 30 измерений. На основе кластерного анализа наблюдения разделены на две группы, соответствующие адаптационным профилям плода: 1 (habituation) – 1702 (88,3%) и 2 (dishabituation) – 225 (11,7%). Рассмотрена связь между адаптационными профилями и данными о наличии осложнений в раннем неонатальном периоде.

Заключение. Оценка ВСР плода в период его адаптации к процедуре КТГ имеет важное значение для оценки его состояния и прогнозирования осложненного течения неонатального периода.
Применение антенатальной кардиотокографии (КТГ) для оценки состояния плода в перинатальном периоде существенно расширило возможности для диагностики внутриутробных нарушений. Неинвазивный мониторинг сердечной деятельности плода позволяет выделить группу риска по развитию осложнений и тем самым снизить показатели перинатальной заболеваемости и смертности [1]. При этом остается актуальным вопрос интерпретации патологической КТГ, в частности, гипердиагностики дистресса плода [2].
Сердцебиение плода начинает регистрироваться на 5–6-й неделе беременности.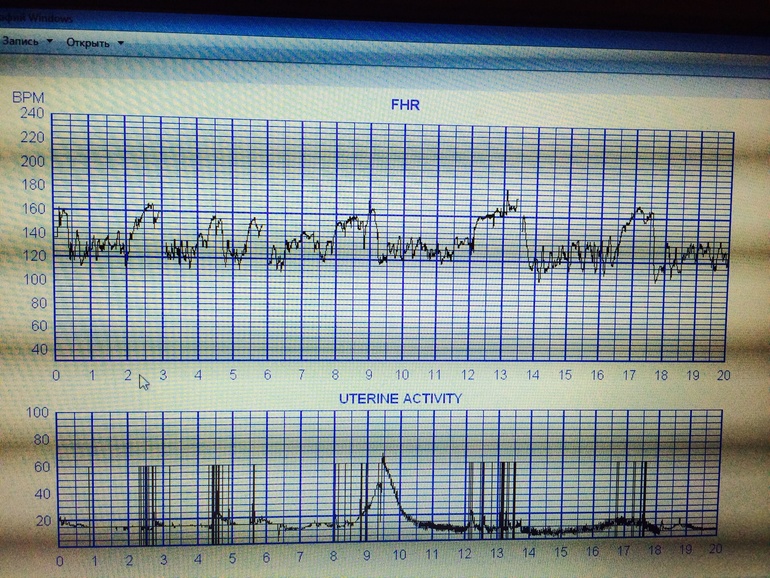 К этому периоду в миокарде появляется достаточное количество клеток-пейсмейкеров, которые самостоятельно генерируют импульсы для мышечных сокращений. К 18-й неделе гестации в миокард начинают проникать парасимпатические волокна блуждающего нерва, с 27-й недели – симпатические. Окончательно проводящая нервная система сердца формируется к 32–33 неделям беременности [3, 4]. Исследование сердечно- сосудистой системы плода не только отражает его внутриутробную оксигенацию, но и дает важную информацию о состоянии вегетативной регуляции сердечно-сосудистой системы и организма в целом.
К этому периоду в миокарде появляется достаточное количество клеток-пейсмейкеров, которые самостоятельно генерируют импульсы для мышечных сокращений. К 18-й неделе гестации в миокард начинают проникать парасимпатические волокна блуждающего нерва, с 27-й недели – симпатические. Окончательно проводящая нервная система сердца формируется к 32–33 неделям беременности [3, 4]. Исследование сердечно- сосудистой системы плода не только отражает его внутриутробную оксигенацию, но и дает важную информацию о состоянии вегетативной регуляции сердечно-сосудистой системы и организма в целом.
Вариабельность сердечного ритма (ВСР) – это изменения интервалов между сердечными сокращениями нормального синусового ритма сердца. Последовательный ряд кардиоинтервалов (R–R) имеет сложную структуру, что отражает регуляторное влияние на синусный узел сердца вегетативной нервной системы и различных гуморальных факторов [5]. В результате воздействия на плод внешнего раздражителя изменяется частота сердечных сокращений, которая в течение определенного времени стабилизируется – habituation (привыкание).
В связи с этим целью данного исследования было определение адаптационного профиля плода во время регистрации антенатальной КТГ с последующим анализом неонатальных исходов.
Материалы и методы
Исследование проведено на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России, являющегося клинической базой кафедры акушерства, гинекологии, перинатологии и репродуктологии и кафедры неонатологии ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России. Ретроспективное исследование было выполнено с использованием 1927 антенатально зарегистрированных КТГ с помощью прибора УНИКОС в 2018–2019 гг. 1195 (62%) пациенток родоразрешены в Центре, из них у 42 (3,5%) новорожденных зафиксированы нарушения в неонатальном периоде. Критерии включения в исследование: одноплодная беременность в сроке 33–40 недель, отсутствие клинических или лабораторных признаков дистресса плода, показатель состояния плода (ПСП) ≤1,05.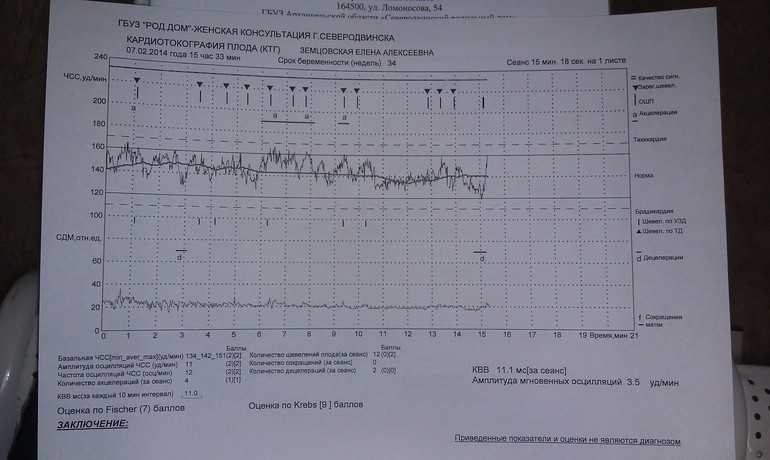 Критерии невключения в исследование: нарушение состояния плода, ПСП>1,05. Исходные данные представляли собой последовательные измерения величины интервалов R–R от 2500 до 6600 R–R (16–60 минут). В процессе регистрации КТГ беременную размещали на кушетке, датчики закрепляли в точках наилучшего поступления сигнала. Контролировали наличие сигнала, после чего начинали запись, которая продолжалась от 10 минут…
Критерии невключения в исследование: нарушение состояния плода, ПСП>1,05. Исходные данные представляли собой последовательные измерения величины интервалов R–R от 2500 до 6600 R–R (16–60 минут). В процессе регистрации КТГ беременную размещали на кушетке, датчики закрепляли в точках наилучшего поступления сигнала. Контролировали наличие сигнала, после чего начинали запись, которая продолжалась от 10 минут…
Психосоциальный стресс при беременности и преждевременных родах: ассоциации и механизмы
1. Abeysena C, Jayawardana P, de Seneviratne RA. Влияние психосоциального стресса и физической активности на преждевременные роды: когортное исследование. J Obstet Gynaecol Res. 2010;36:260–7. [PubMed] [Google Scholar]
2. Альтшулер Л.Л., Хендрик В., Коэн Л.С. Актуальная информация о расстройствах настроения и тревожных расстройствах во время беременности и в послеродовой период. Prim Care Companion J Clin Psychiatry. 2000; 2: 217–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Ancel PY, Saurel-Cubizolles MJ, Di Renzo GC, Papiernik E, Breart G. Очень и умеренно преждевременные роды: различаются ли факторы риска? Br J Obstet Gynaecol. 1999; 106:1162–70. [PubMed] [Google Scholar]
Ancel PY, Saurel-Cubizolles MJ, Di Renzo GC, Papiernik E, Breart G. Очень и умеренно преждевременные роды: различаются ли факторы риска? Br J Obstet Gynaecol. 1999; 106:1162–70. [PubMed] [Google Scholar]
4. Остин М.П., Лидер Л. Материнский стресс и акушерские и младенческие исходы: эпидемиологические данные и нейроэндокринные механизмы. Aust NZ J Obstet Gynaecol. 2000;40:331–37. [PubMed] [Google Scholar]
5. Bailey MT, Lubach GR, Coe CL. Пренатальный стресс изменяет бактериальную колонизацию кишечника у детенышей обезьян. J Pediatr Gastroenterol Nutr. 2004; 38: 414–21. [PubMed] [Академия Google]
6. Берман Р.Э., Батлер А.С., ред. Преждевременные роды: причины, последствия и профилактика. Вашингтон, округ Колумбия: Национальная академия наук; 2007. [Google Scholar]
7. Бхагванани С.Г., Сигрейвс К., Диркер Л.Дж., Лакс М. Взаимосвязь между пренатальной тревогой и перинатальным исходом у нерожавших женщин: проспективное исследование. J Natl Med Assoc. 1997; 89: 93–98. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Бланк В., Хирш Э., Чаллис Дж. Р., Ромеро Р., Лай С. Дж. Передача сигналов цитокинов, воспаление, врожденный иммунитет и преждевременные роды — отчет о семинаре. Плацента. 2008;29:S102–4. [PubMed] [Google Scholar]
9. Боровикова Л.В., Иванова С., Чжан М., Ян Х., Бочкина Г.И., Уоткинс Л.Р., и соавт. Стимуляция блуждающего нерва ослабляет системный воспалительный ответ на эндотоксин. Природа. 2000; 405:458–62. [PubMed] [Google Scholar]
10. Брайс Р.Л., Стэнли Ф.Дж., Гарнер Дж.Б. Рандомизированное контролируемое исследование антенатальной социальной поддержки для предотвращения преждевременных родов. Br J Obstet Gynaecol. 1991; 98: 1001–8. [PubMed] [Google Scholar]
11. Challis JRG. Механизм родов и преждевременные роды. Акушерство Gynecol Surv. 2000;55:650–60. [PubMed] [Академия Google]
12. Challis JR, Lockwood CJ, Myatt L, Norman JE, Strauss JF, 3rd, Petraglia F. Воспаление и беременность. Репрод науч. 2009;16:206–15. [PubMed] [Google Scholar]
2009;16:206–15. [PubMed] [Google Scholar]
13. Challis JRG, Matthews SG, Gibb W, Lye SJ. Эндокринная и паракринная регуляция родов у доношенных и недоношенных. Endocr Rev. 2000; 21:514–50. [PubMed] [Google Scholar]
14. Challis JR, Sloboda D, Matthews SG, Holloway A, Alfaidy N, Patel FA, et al. Плацентарно-гипоталамо-гипофизарно-надпочечниковая (ГГН) ось плода, роды и послеродовое здоровье. Мол Селл Эндокринол. 2001; 185:135–44. [PubMed] [Академия Google]
15. Кристианс И., Сарагоса Д.Б., Гилберт Л., Робертсон С.А., Митчелл Б.Ф., Олсон Д.М. Воспалительные процессы при преждевременных и срочных родах. J Reprod Immunol. 2008;79:50–7. [PubMed] [Google Scholar]
16. Кристиан Л.М. Психонейроиммунология во время беременности: иммунные пути, связывающие стресс со здоровьем матери, неблагоприятными исходами родов и развитием плода. Neurosci Biobehav Rev. 2012; 36:350–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Collins NL, Dunkel-Schetter C, Lobel M, Scrimshaw SC.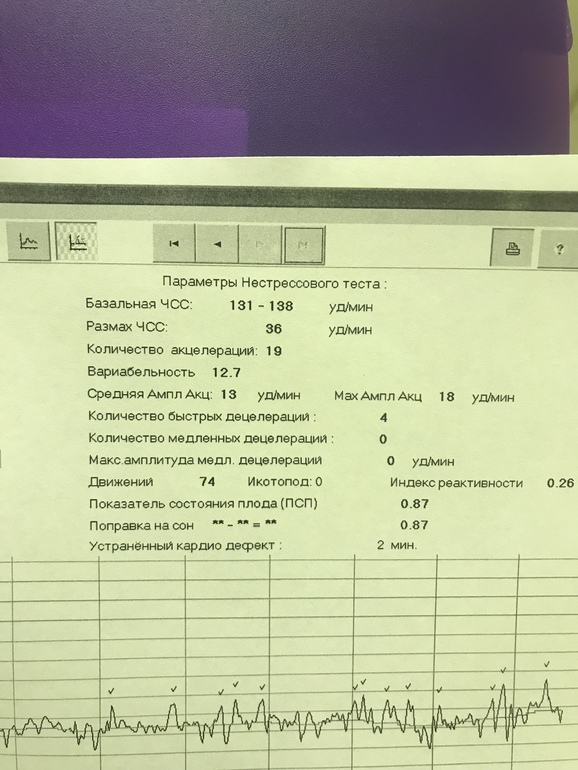 Социальная поддержка во время беременности: психосоциальные корреляты исходов родов и послеродовой депрессии. J Pers Soc Psychol. 1993;65:1243–58. [PubMed] [Google Scholar]
Социальная поддержка во время беременности: психосоциальные корреляты исходов родов и послеродовой депрессии. J Pers Soc Psychol. 1993;65:1243–58. [PubMed] [Google Scholar]
18. Dancause KN, Laplante DP, Oremus C, Fraser S, Brunet A, King S. Пренатальный материнский стресс, связанный со стихийным бедствием, влияет на исход родов: Project Ice Storm. Ранний Хам Дев. 2011; 87: 813–20. [PubMed] [Google Scholar]
19. de Boo HA, Harding JE. Гипотеза развития болезней взрослых (Баркера). Aust NZ J Obstet Gynaecol. 2006; 46:4–14. [PubMed] [Google Scholar]
20. de Jonge WJ, van der Zanden EP, The FO, Bijlsma MF, van Westerloo DJ, Bennink RJ, et al. Стимуляция блуждающего нерва ослабляет активацию макрофагов за счет активации сигнального пути Jak2-STAT3. Нат Иммунол. 2005; 6: 844–51. [PubMed] [Академия Google]
21. DiGiulio DB, Romero R, Amogan HP, Kusanovic JP, Bik EM, Gotsch F, et al. Распространенность, разнообразие и изобилие микробов в амниотической жидкости во время преждевременных родов: молекулярное и культуральное исследование.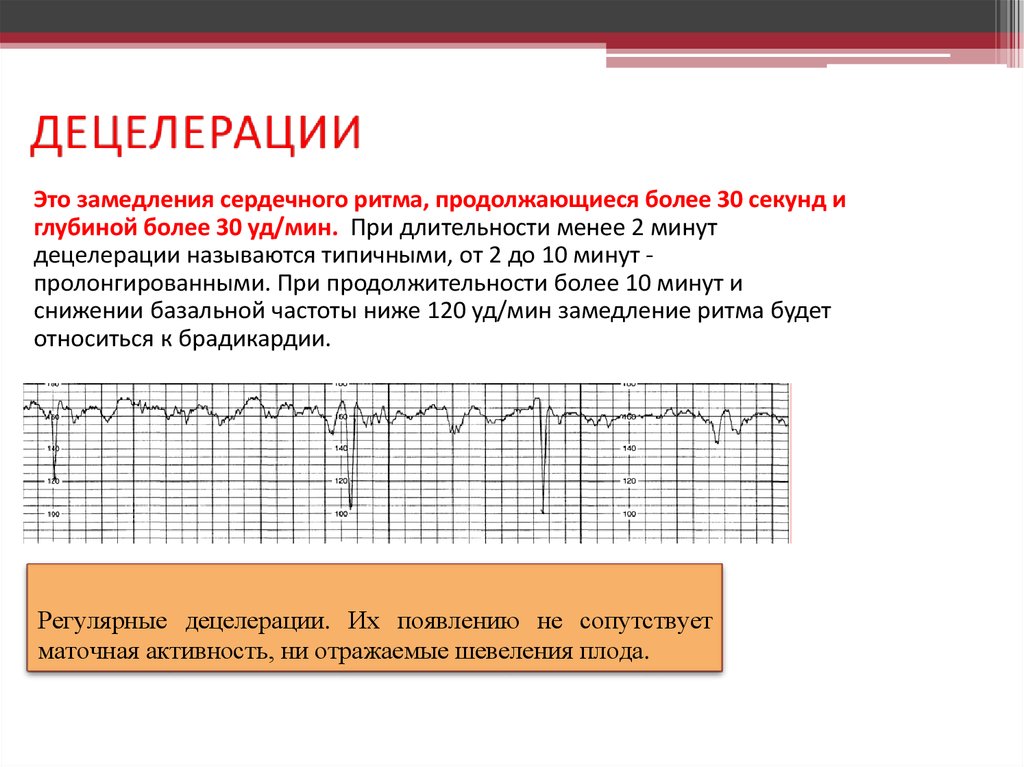 ПЛОС Один. 2008;3:e3056. [Бесплатная статья PMC] [PubMed] [Google Scholar]
ПЛОС Один. 2008;3:e3056. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Доул Н., Савиц Д.А., Герц-Пиччиотто И., Сига-Риз А.М., МакМахон М.Дж., Бьюкенс П. Материнский стресс и преждевременные роды. Am J Эпидемиол. 2003; 157:14–24. [PubMed] [Google Scholar]
23. Dominguez TP, Schetter CD, Mancuso R, Rini CM, Hobel C. Стресс во время беременности афроамериканцев: проверка роли различных концепций стресса в прогнозировании исходов родов. Энн Бехав Мед. 2005;29: 12–21. [PubMed] [Google Scholar]
24. Дункель-Шеттер С. Материнский стресс и преждевременные роды. Пренатальная неонатальная мед. 1998; 3:39–42. [Google Scholar]
25. Дункель Шеттер С. Стрессовые процессы при беременности и преждевременных родах. Curr Dir Psychol Sci. 2009;18:205–9. [Google Scholar]
26. Дункель Шеттер С. Психологическая наука о беременности: стрессовые процессы, биопсихосоциальные модели и возникающие проблемы исследований. Анну Рев Психол. 2011;62:531–58. [PubMed] [Академия Google]
27. Эванс Л.М., Майерс М.М., Монк С. Уровень кортизола у беременных повышен при тревоге и депрессии, но только при сопутствующих заболеваниях. Arch Womens Ment Health. 2008; 11: 239–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Эванс Л.М., Майерс М.М., Монк С. Уровень кортизола у беременных повышен при тревоге и депрессии, но только при сопутствующих заболеваниях. Arch Womens Ment Health. 2008; 11: 239–48. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Field T, Diego M, Hernandez-Reif M, Figueiredo B, Deeds O, Ascencio A, et al. Коморбидная депрессия и тревога влияют на беременность и неонатальный исход. Младенец Поведение Дев. 2010; 33:23–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Fuchs E, Flugge G. Модуляция сайтов связывания кортикотропин-рилизинг-гормона при хроническом психосоциальном стрессе. Психонейроэндокринология. 1995;20:33–51. [PubMed] [Google Scholar]
30. Fumagalli F, Bedogni F, Slotkin TA, Racagni G, Riva MA. Пренатальный стресс вызывает регионально избирательные изменения в базальной экспрессии гена FGF-2 во взрослом возрасте и изменяет реакцию взрослых на острый или хронический стресс. Нейробиол Дис. 2005; 20: 731–7. [PubMed] [Google Scholar]
31. Ghia JE, Blennerhassett P, Collins SM. Нарушение парасимпатической функции повышает восприимчивость к воспалительным заболеваниям кишечника в мышиной модели депрессии. Джей Клин Инвест. 2008;118:2209–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Ghia JE, Blennerhassett P, Collins SM. Нарушение парасимпатической функции повышает восприимчивость к воспалительным заболеваниям кишечника в мышиной модели депрессии. Джей Клин Инвест. 2008;118:2209–18. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Ghosh JK, Wilhelm MH, Dunkel-Schetter C, Lombardi CA, Ritz BR. Поддержка отца и преждевременные роды, а также смягчение последствий хронического стресса: исследование матерей округа Лос-Анджелес. Arch Womens Ment Health. 2010;13:327– 38. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Giurgescu C. Связан ли уровень кортизола у матери с преждевременными родами? J Obstet Gynecol Neonatal Nurs. 2009; 38: 377–90. [PubMed] [Академия Google]
34. Glynn LM, Schetter CD, Wadhwa PD, Sandman CA. Беременность влияет на оценку негативных жизненных событий. Дж. Психосом Рез. 2004; 56: 47–52. [PubMed] [Google Scholar]
35. Glynn LM, Wadhwa PD, Dunkel-Schetter C, Chicz-Demet A, Sandman CA. Когда возникает стресс, имеет значение: влияние времени землетрясения на реакцию на стресс во время беременности. Am J Obstet Gynecol. 2001; 184: 637–42. [PubMed] [Google Scholar]
Am J Obstet Gynecol. 2001; 184: 637–42. [PubMed] [Google Scholar]
36. Гольденберг Р.Л. Ведение преждевременных родов. Акушерство Гинекол. 2002; 100:1020–37. [PubMed] [Академия Google]
37. Гольденберг Р.Л., Калхейн Дж.Ф., Ямс Дж.Д., Ромеро Р. Эпидемиология и причины преждевременных родов. Ланцет. 2008; 371: 75–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Gotsch F, Romero R, Kusanovic JP, Mazaki-Tovi S, Pineles BL, Erez O, et al. Синдром воспалительной реакции плода. Клин Обстет Гинекол. 2007; 50: 652–83. [PubMed] [Google Scholar]
39. Green NS, Damus K, Simpson JL, Iams J, Reece EA, Hobel CJ, et al. Программа исследований преждевременных родов: рекомендации March of Dimes. Am J Obstet Gynecol. 2005;193: 626–35. [PubMed] [Google Scholar]
40. Гендельман С., Коса Дж. Л., Перл М., Грэм С., Харрази М. Изучение взаимосвязи высвобождения кортикотропина во втором триместре, хронического стресса и преждевременных родов. J Matern Fetal Neonatal Med. 2008; 21: 788–95. [PubMed] [Google Scholar]
2008; 21: 788–95. [PubMed] [Google Scholar]
41. Harville EW, Savitz DA, Dole N, Herring AH, Thorp JM. Опросники стресса и биомаркеры стресса во время беременности. J Womens Health (Larchmt) 2009; 18:1425–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Hedegaard M, Henriksen TB, Secher NJ, Hatch MC, Sabroe S. Влияют ли стрессовые жизненные события на продолжительность беременности и риск преждевременных родов? Эпидемиология. 1996; 7: 339–45. [PubMed] [Google Scholar]
43. Хаймс К.П., Симхан Х.Н. Концентрация кортикотропин-рилизинг-гормона и кортизола в плазме и воспринимаемый стресс у беременных с преждевременными и срочными родами. Ам Дж. Перинатол. 2011; 28:443–8. [PubMed] [Google Scholar]
44. Hobel C, Culhane J. Роль психосоциального и пищевого стресса в плохом исходе беременности. Дж Нутр. 2003;133:1709С–17С. [PubMed] [Google Scholar]
45. Hobel CJ, Dunkel-Schetter C, Roesch SC, Castro LC, Arora CP. Кортикотропин-рилизинг-гормон материнской плазмы связан со стрессом на 20-й неделе беременности при беременности, закончившейся преждевременными родами.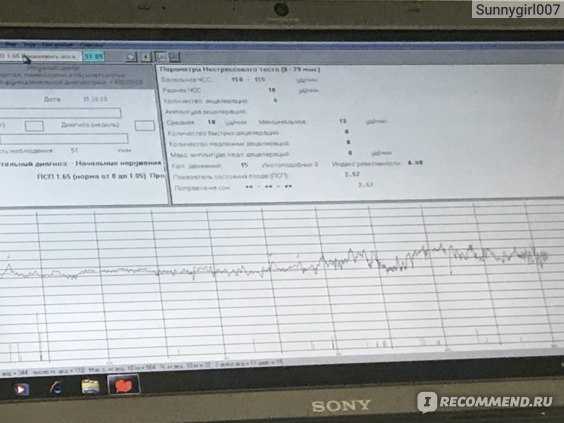 Am J Obstet Gynecol. 1999; 180:S257–63. [PubMed] [Google Scholar]
Am J Obstet Gynecol. 1999; 180:S257–63. [PubMed] [Google Scholar]
46. Hobel CJ, Goldstein A, Barrett ES. Психосоциальный стресс и исход беременности. Клин Обстет Гинекол. 2008; 51: 333–48. [PubMed] [Google Scholar]
47. Khashan AS, McNamee R, Abel KM, Mortensen PB, Kenny LC, Pedersen MG, et al. Частота преждевременных родов после антенатального воздействия тяжелых жизненных событий на мать: популяционное когортное исследование. Хум Репрод. 2009 г.;24:429–37. [PubMed] [Google Scholar]
48. Коребритс С., Рамирес М.М., Уотсон Л., Бринкман Э., Бокинг А.Д., Чаллис Дж.Р. Материнский кортикотропин-рилизинг-гормон повышается при надвигающихся преждевременных родах. J Clin Endocrinol Metab. 1998; 83: 1585–91. [PubMed] [Google Scholar]
49. Krabbendam L, Smits L, de Bie R, Bastiaanssen J, Stelma F, van Os J. Влияние материнского стресса на исход беременности у хорошо образованного населения европеоидной расы. Педиатр Перинат Эпидемиол. 2005;19:421–5. [PubMed] [Академия Google]
50. Крамер М.С. Меняющийся перинатальный ландшафт: есть ли у нас какие-то успехи? академик педиатр. 2011; 11: 247–9. [PubMed] [Google Scholar]
Крамер М.С. Меняющийся перинатальный ландшафт: есть ли у нас какие-то успехи? академик педиатр. 2011; 11: 247–9. [PubMed] [Google Scholar]
51. Kramer MS, Lydon J, Seguin L, Goulet L, Kahn SR, McNamara H, et al. Пути стресса к спонтанным преждевременным родам: роль стрессоров, психологического дистресса и гормонов стресса. Am J Эпидемиол. 2009; 169:1319–26. [PubMed] [Google Scholar]
52. Kramer MS, Lydon J, Seguin L, Goulet L, Kahn SR, McNamara H, et al. Не связанные со стрессом факторы, связанные с концентрацией кортикотропин-рилизинг-гормона (CRH) у матери. Педиатр Перинат Эпидемиол. 2010;24:390–7. [PubMed] [Google Scholar]
53. Крамер М.С., Сегин Л., Лайдон Дж., Гуле Л. Социально-экономические различия в исходах беременности: почему бедные живут так плохо? Педиатр Перинат Эпидемиол. 2000; 14:194–210. [PubMed] [Google Scholar]
54. Lataster J, Collip D, Ceccarini J, Haas D, Booij L, van Os J, et al. Психосоциальный стресс связан с высвобождением дофамина in vivo в вентромедиальной префронтальной коре человека: исследование позитронно-эмиссионной томографии с использованием [(1)(8)F]фаллиприда. Нейроизображение. 2011; 58:1081–9. [PubMed] [Google Scholar]
Нейроизображение. 2011; 58:1081–9. [PubMed] [Google Scholar]
55. Леви Р., Лундберг У., Хэнсон У., Франкенхойзер М. Беспокойство во время беременности после аварии на Чернобыльской АЭС в связи с акушерским исходом. J Psychosom Obstet Gynecol. 1989;10:221– 30. [Google Scholar]
56. Liston C, McEwen BS, Casey BJ. Психосоциальный стресс обратимо нарушает префронтальную обработку информации и контроль внимания. Proc Natl Acad Sci USA. 2009; 106: 912–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Лобель М., Дункель Шеттер К. Концептуализация стресса для изучения воздействия на здоровье: компоненты окружающей среды, восприятия и эмоций. Беспокойство рез. 1990;3:213–30. [Google Scholar]
58. Лобель М., Каннелла Д.Л., Грэм Дж.Е., ДеВинсент С., Шнайдер Дж., Мейер Б.А. Стресс, связанный с беременностью, пренатальное поведение в отношении здоровья и исходы родов. Психология здоровья. 2008; 27: 604–15. [PubMed] [Google Scholar]
59. Лобель М., Дункель-Шеттер С. , Скримшоу С.К. Пренатальный материнский стресс и преждевременные роды: проспективное исследование социально-экономически неблагополучных женщин. Психология здоровья. 1992; 11:32–40. [PubMed] [Google Scholar]
, Скримшоу С.К. Пренатальный материнский стресс и преждевременные роды: проспективное исследование социально-экономически неблагополучных женщин. Психология здоровья. 1992; 11:32–40. [PubMed] [Google Scholar]
60. Lu MC, Chen B. Расовые и этнические различия в преждевременных родах: роль стрессовых жизненных событий. Am J Obstet Gynecol. 2004;191: 691–9. [PubMed] [Google Scholar]
61. Lupien SJ, Parent S, Evans AC, Tremblay RE, Zelazo PD, Corbo V, et al. Увеличение миндалевидного тела, но отсутствие изменений в объеме гиппокампа у 10-летних детей, подвергшихся материнской депрессивной симптоматике с рождения. Proc Natl Acad Sci USA. 2011; 108:14324–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Mancuso RA, Schetter CD, Rini CM, Roesch SC, Hobel CJ. Материнская пренатальная тревожность и кортикотропин-рилизинг-гормон связаны со сроками родов. Психозом Мед. 2004; 66: 762–9.. [PubMed] [Google Scholar]
63. Martini J, Knappe S, Beesdo-Baum K, Lieb R, Wittchen HU.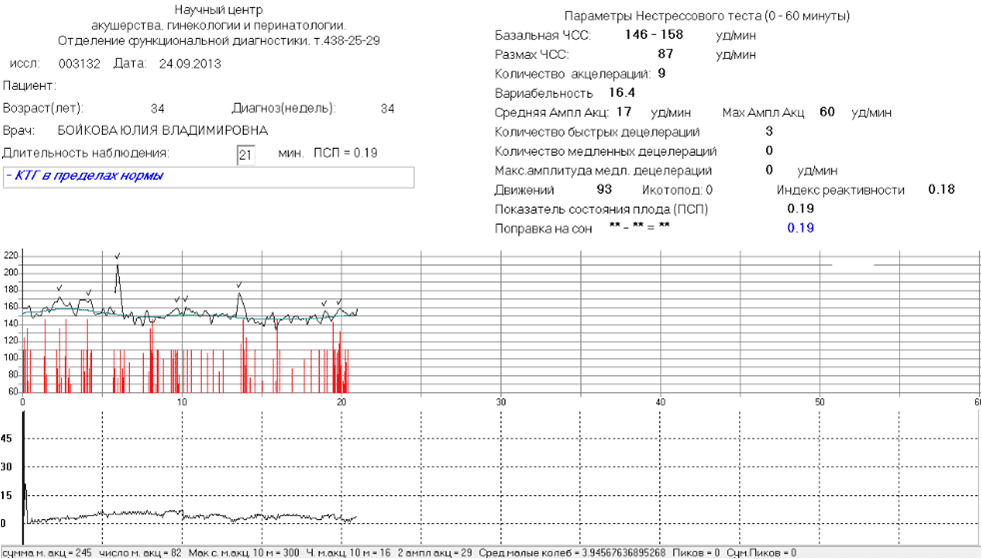 Тревожные расстройства до рождения и самоощущение дистресса во время беременности: связь с материнской депрессией и акушерскими, неонатальными и ранними детскими исходами. Ранний Хам Дев. 2010;86:305–10. [PubMed] [Google Scholar]
Тревожные расстройства до рождения и самоощущение дистресса во время беременности: связь с материнской депрессией и акушерскими, неонатальными и ранними детскими исходами. Ранний Хам Дев. 2010;86:305–10. [PubMed] [Google Scholar]
64. Martius JA, Steck T, Oehler MK, Wulf KH. Факторы риска, связанные с преждевременными (<37+0 недель) и ранними преждевременными родами (<32+0 недель): одномерный и многомерный анализ 106 345 одноплодных родов из 1994 общегосударственных перинатальных обследования Баварии. Eur J Obstet Gynecol Reprod Biol. 1998; 80: 183–9. [PubMed] [Google Scholar]
65. Маклин М., Биситс А., Дэвис Дж., Вудс Р., Лоури П., Смит Р. Плацентарные часы, контролирующие продолжительность беременности человека. Нат Мед. 1995; 1: 460–3. [PubMed] [Google Scholar]
66. Misra DP, O’Campo P, Strobino D. Тестирование социально-медицинской модели преждевременных родов. Педиатр Перинат Эпидемиол. 2001; 15:110–22. [PubMed] [Google Scholar]
67. Molfese VJ, Bricker MC, Manion LG, Beadnell B, Yaple K, Moires KA. Тревога, депрессия и стресс во время беременности – многомерная модель интранатальных рисков и исходов беременности. J Psychosom Obstet Gynecol. 1987;7:77–92. [Google Scholar]
Тревога, депрессия и стресс во время беременности – многомерная модель интранатальных рисков и исходов беременности. J Psychosom Obstet Gynecol. 1987;7:77–92. [Google Scholar]
68. Мур М.Л. Преждевременные роды и роды: чему мы научились за последние два десятилетия? J Obstet Gynecol Neonatal Nurs. 2003; 32: 638–49. [PubMed] [Google Scholar]
69. Moutquin JM. Социально-экономические и психосоциальные факторы в ведении и профилактике преждевременных родов. Br J Obstet Gynaecol. 2003; 110:56–60. [PubMed] [Google Scholar]
70. Olds DL, Henderson CR, Jr, Tatelbaum R, Chamberlin R. Улучшение оказания дородовой помощи и исходов беременности: рандомизированное исследование посещения медсестрой на дому. Педиатрия. 1986;77:16–28. [PubMed] [Google Scholar]
71. Orr ST, Reiter JP, Blazer DG, James SA. Пренатальная тревога матери, связанная с беременностью, и спонтанные преждевременные роды в Балтиморе, штат Мэриленд. Психозом Мед. 2007; 69: 566–70. [PubMed] [Google Scholar]
72. Orr ST. Социальная поддержка и исход беременности: обзор литературы. Клин Обстет Гинекол. 2004;47:842–55. обсуждение 81–2. [PubMed] [Google Scholar]
Orr ST. Социальная поддержка и исход беременности: обзор литературы. Клин Обстет Гинекол. 2004;47:842–55. обсуждение 81–2. [PubMed] [Google Scholar]
73. Страница NM. Эндокринология преэклампсии. Clin Endocrinol (Oxf) 2002;57:413–23. [PubMed] [Академия Google]
74. Pearce BD, Grove J, Bonney EA, Bliwise N, Dudley DJ, Schendel DE, et al. Взаимосвязь цитокинов, гормонов гипоталамо-гипофизарно-надпочечниковой оси и психосоциальных переменных в прогнозировании преждевременных родов. Гинеколь Обстет Инвест. 2010;70:40–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Petraglia F, Hatch MC, Lapinski R, Stomati M, Reis FM, Cobellis L, et al. Отсутствие влияния психосоциального стресса на материнский уровень кортикотропин-рилизинг-фактора и катехоламинов на сроке беременности 28 недель. J Soc Gynecol Invest. 2001; 8:83–88. [PubMed] [Академия Google]
76. Канадское агентство общественного здравоохранения (PHAC) Канадский отчет о перинатальном здоровье. 2008. Оттава: PHAC; 2008. [Google Scholar]
Оттава: PHAC; 2008. [Google Scholar]
77. Раухфусс М., Майер Б. Биопсихосоциальные предикторы преждевременных родов. J Перинат Мед. 2011;39:515–21. [PubMed] [Google Scholar]
78. Rini CK, Dunkel-Schetter C, Wadhwa PD, Sandman CA. Психологическая адаптация и исходы родов: роль личных ресурсов, стресса и социокультурного контекста во время беременности. Психология здоровья. 1999;18:333–45. [PubMed] [Академия Google]
79. Roesch SC, Schetter CD, Woo G, Hobel CJ. Моделирование видов и сроков стресса при беременности. Совладание со стрессом при тревоге. 2004; 17:87–102. [Google Scholar]
80. Rogers MM, Peoples-Sheps MD,suchindran C. Влияние программы социальной поддержки на использование дородового ухода подростками и исходы беременности. Дж Адолеск Здоровье. 1996; 19: 132–40. [PubMed] [Google Scholar]
81. Roy-Matton N, Moutquin JM, Brown C, Carrier N, Bell L. Влияние воспринимаемого материнского стресса и других психосоциальных факторов риска на осложнения беременности.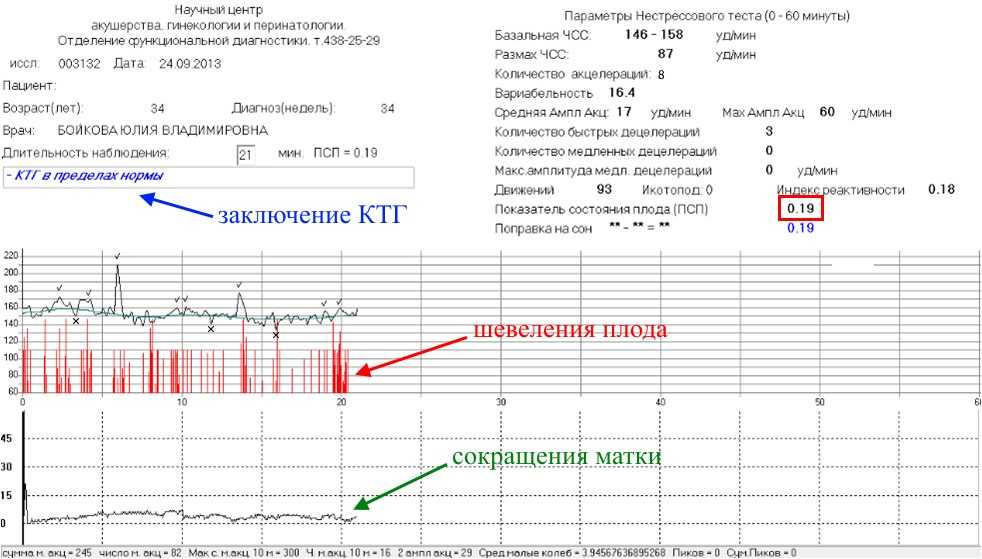 J Obstet Gynaecol Can. 2011;33:344–52. [PubMed] [Академия Google]
J Obstet Gynaecol Can. 2011;33:344–52. [PubMed] [Академия Google]
82. Руис Р.Дж., Фуллертон Дж., Браун С.Е., Дадли Д.Дж. Прогнозирование риска преждевременных родов: роль стресса, клинических факторов риска и кортикотропин-рилизинг-гормона. Биол Рез Нурс. 2002; 4: 54–64. [PubMed] [Google Scholar]
83. Ruiz RJ, Fullerton J, Brown CE, Schoolfield J. Отношения кортизола, воспринимаемого стресса, мочеполовых инфекций и фибронектина плода к гестационному возрасту при рождении. Биол Рез Нурс. 2001; 3:39–48. [PubMed] [Google Scholar]
84. Саркар П., Бергман К., Фиск Н.М., Гловер В. Материнская тревога при амниоцентезе и кортизол плазмы. Пренатальная диагностика 2006; 26: 505–9.. [PubMed] [Google Scholar]
85. Снеговских В., Парк Дж. С., Норвиц Э. Р. Эндокринология родов. Эндокринол Метаб Клин Норт Ам. 2006; 35: 173–91. VIII. [PubMed] [Google Scholar]
86. St-Laurent J, De Wals P, Moutquin JM, Niyonsenga T, Noiseux M, Czernis L. Биопсихосоциальные детерминанты продолжительности беременности и роста плода.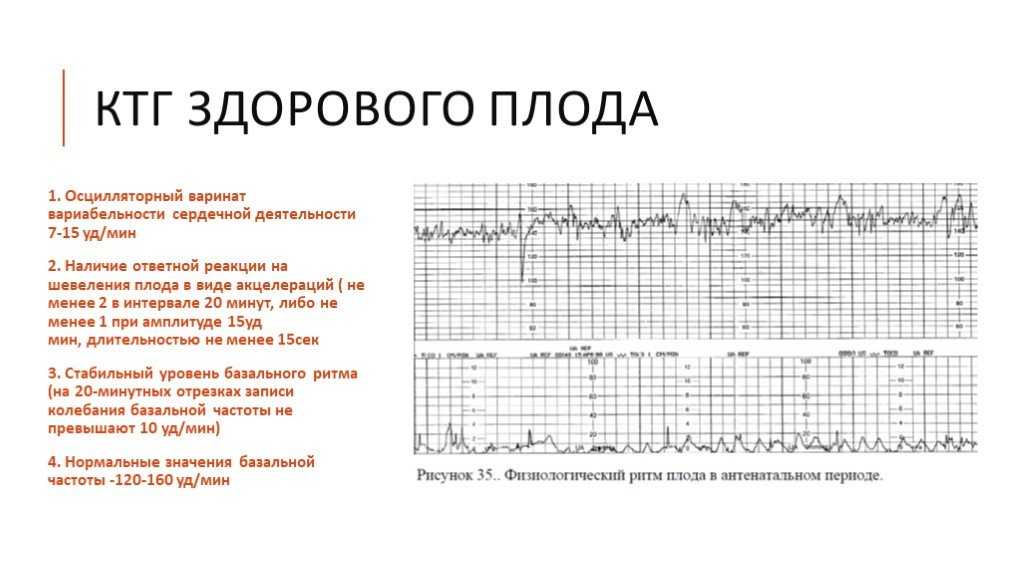 Педиатр Перинат Эпидемиол. 2008; 22: 240–8. [PubMed] [Google Scholar]
Педиатр Перинат Эпидемиол. 2008; 22: 240–8. [PubMed] [Google Scholar]
87. Тегетхофф М., Грин Н., Олсен Дж., Мейер А.Х., Майнльшмидт Г. Психосоциальные невзгоды матери во время беременности связаны с продолжительностью беременности и размером потомства при рождении: данные популяционной когорты изучать. Психозом Мед. 2010;72:419–26. [PubMed] [Google Scholar]
88. Трейси К.Дж. Рефлекторная регуляция иммунитета. Нат Рев Иммунол. 2009; 9: 418–28. [Бесплатная статья PMC] [PubMed] [Google Scholar]
89. van Westerloo DJ, Giebelen IA, Florquin S, Bruno MJ, Larosa GJ, Ulloa L, et al. Блуждающий нерв и никотиновые рецепторы модулируют тяжесть экспериментального панкреатита у мышей. Гастроэнтерология. 2006; 130:1822–30. [PubMed] [Google Scholar]
90. Виллар Дж., Фарнот У., Баррос Ф., Виктора С., Лангер А., Белизан Дж.М. Рандомизированное исследование психосоциальной поддержки во время беременности с высоким риском. Латиноамериканская сеть перинатальных и репродуктивных исследований.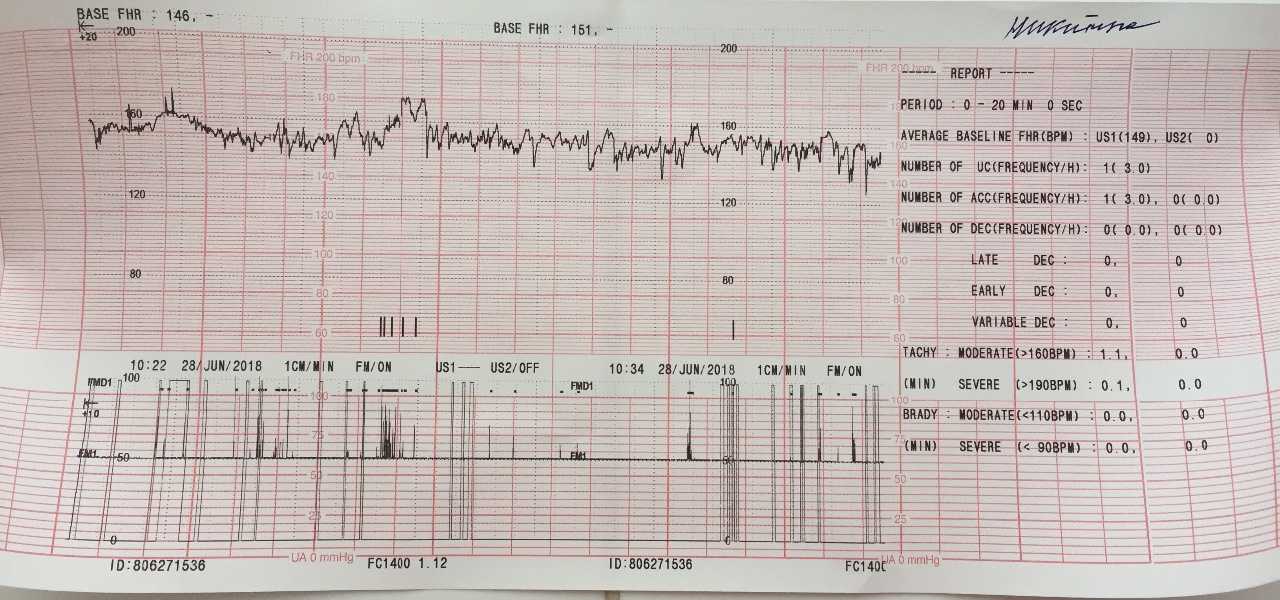 N Engl J Med. 1992;327:1266–71. [PubMed] [Google Scholar]
N Engl J Med. 1992;327:1266–71. [PubMed] [Google Scholar]
91. Wadhwa PD, Dunkel-Schetter C, Chicz-DeMet A, Porto M, Sandman CA. Пренатальные психосоциальные факторы и нейроэндокринная ось при беременности человека. Психозом Мед. 1996; 58: 432–46. [PubMed] [Google Scholar]
92. Wadhwa PD, Entringer S, Buss C, Lu MC. Вклад материнского стресса в преждевременные роды: вопросы и соображения. Клин Перинатол. 2011; 38: 351–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
93. Wadhwa PD, Sandman CA, Porto M, Dunkel-Schetter C, Garite TJ. Связь между пренатальным стрессом и массой тела при рождении и гестационным возрастом при рождении: проспективное исследование. Am J Obstet Gynecol. 1993;169:858–65. [PubMed] [Google Scholar]
94. Ван М.Л., Дорер Д.Дж., Флеминг М.П., Кэтлин Э.А. Клинические исходы у доношенных детей. Педиатрия. 2004; 114: 372–6. [PubMed] [Google Scholar]
95. Wei SQ, Fraser W, Luo ZC. Воспалительные цитокины и спонтанные преждевременные роды у бессимптомных женщин: систематический обзор.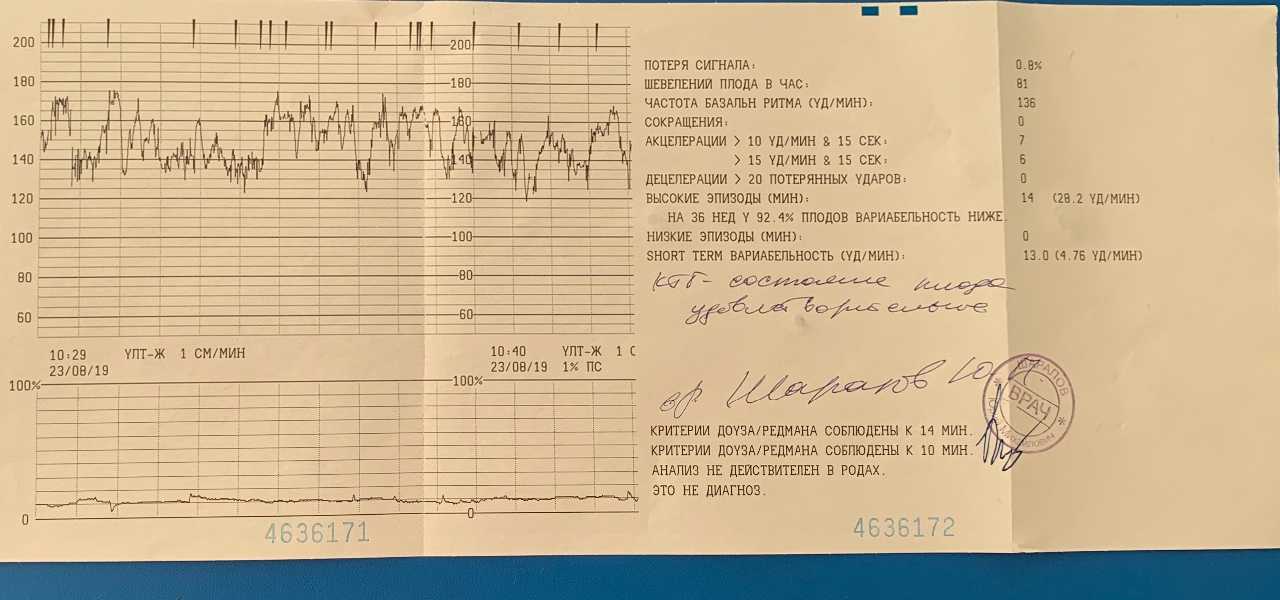 Акушерство Гинекол. 2010; 116: 393–401. [PubMed] [Google Scholar]
Акушерство Гинекол. 2010; 116: 393–401. [PubMed] [Google Scholar]
96. Уайт Б.А., Кридон Д.Дж., Нельсон К.Е., Уилсон Б.А. Вагинальный микробиом в норме и при патологии. Тенденции Эндокринол Метаб. 2011;22:389–93. [Бесплатная статья PMC] [PubMed] [Google Scholar]
97. Zhu P, Tao F, Hao J, Sun Y, Jiang X. Стресс, связанный с пренатальными жизненными событиями: последствия для преждевременных родов и массы тела при рождении. Am J Obstet Gynecol. 2010;203:34, д1–8. [PubMed][Google Scholar]
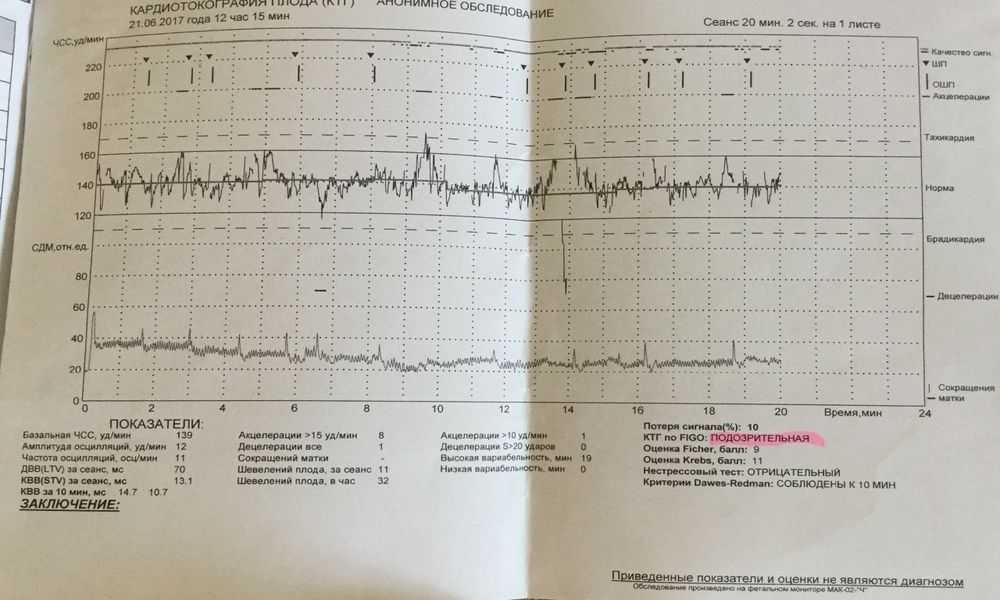
На каком сроке делают КТГ плода при беременности?
· Вам потребуется прочитать: 5 мин
Если УЗИ при беременности является обязательным исследованием на весь период, остальные обследования считаются дополнительными. Но они показывают ряд важных параметров. В какие сроки делают КТГ, как делают КТГ и что показывает этот вид исследования?
Обычно КТГ вводят после 28 недель, чаще всего в 30-32 недели. Это связано с тем, что к этому времени формируется взаимодействие сердца и нервной системы, а именно работа сердца и отражает КТГ.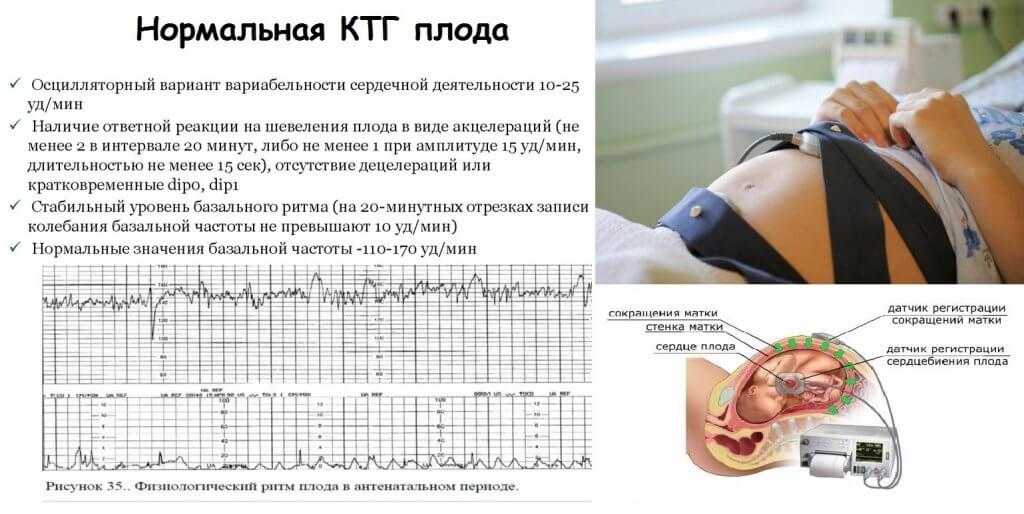 Как работает КТГ?
Как работает КТГ?
КТГ или кардиотокограмма (кардиотокография) отражает количество сердечных сокращений и позволяет отслеживать любые отклонения от нормы. Исследование проводится по принципу ультразвуковой диагностики, то есть используется ультразвуковая волна. КТГ позволяет оценить состояние плода на основе подсчета количества сердечных сокращений. Также аппарат отражает сокращение матки.
instagram viewer
Кому делают КТГ и на какой срок?
Поскольку кардиотокография является высокоинформативным, доступным и безвредным методом обследования, ее назначают всем беременным, но с разной частотой и разным сроком. В зависимости от течения беременности график устанавливает врач.
График КТГ:
- При нормально протекающей беременности — каждые 10 дней после 28 недель;
- При персистенции — каждые 4-5 дней до самых родов;
- При многоводии — каждые семь дней;
- При патологии (плацентарная недостаточность, многоводие, многоплодная беременность, пороки развития плода) назначают не реже 1 раза в неделю;
- При внезапном прекращении шевелений плода (когда женщина перестает чувствовать шевеления в течение 8-12 часов) — срочно.

Процедуру назначают также в предполагаемый день родов и в начале родов. Плюс подготовка к родам проводится под контролем. С момента начала схваток и до начала потуги всех рожениц подключают к устройству, регистрирующему величину ЧСС. Это важно для наблюдения за состоянием ребенка. В норме количество ударов в минуту от 110 до 160, если их больше 160, а затем количество снижается, это сигнал для акушеров о том, что что-то идет не так, возможен риск гипоксии. КТГ-норма у женщин также позволяет принять решение в пользу естественных родов.
В какое время проводится исследование? Проведение исследования методом КТГ актуально только после 28-й недели беременности. В этот период формируются связи между нервной системой и сердцем, то есть деятельность ребенка влияет на изменение числа сердечных сокращений, они различаются периодом покоя и активности.
См. также: Проявления и диагностика рака почки
Как делают КТГ и в какой день?
Процедура абсолютно безвредна для мамы и малыша.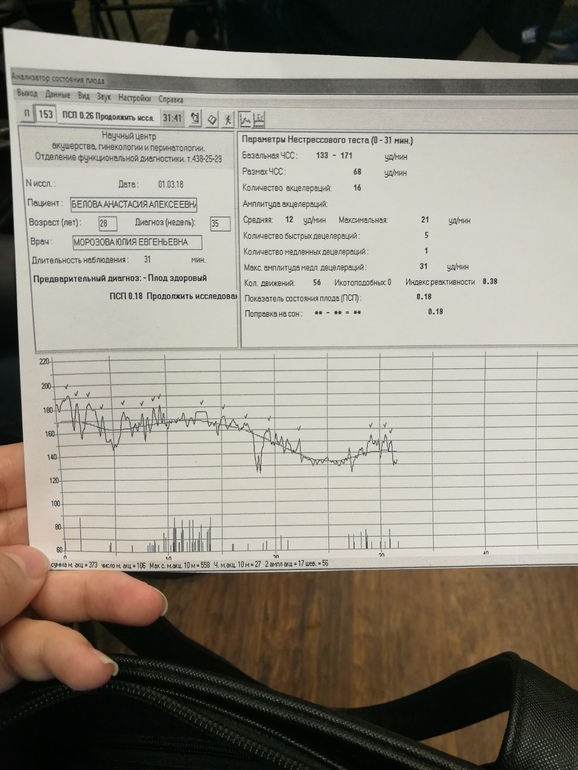 К желудку женщины прикреплен датчик, который улавливает сердцебиение. Предварительно врач слушает там, где его слышно наиболее отчетливо. Женщину укладывают на левый бок или просят занять положение полусидя.
К желудку женщины прикреплен датчик, который улавливает сердцебиение. Предварительно врач слушает там, где его слышно наиболее отчетливо. Женщину укладывают на левый бок или просят занять положение полусидя.
Для КТГ важно зафиксировать нормальную активность ребенка — то есть выбрать период после еды (через 2-3 часа после еды), исключить физическую активность матери перед процедурой, постараться попасть в период бодрствования малыша.
Это, кстати, одна из самых больших «проблем» на обследовании — спящий ребенок. В этом случае рекомендуется есть сладкое.
Если прибор фиксирует активность ребенка, предыдущие результаты КТГ были в норме, беременность протекает без осложнений — исследование прекращают через 20-30 минут. Если прибор не может определить активность, беременность протекает с особенностями, процедура может длиться от 40 минут до полутора часов. Чтобы точно сказать, как проходит КТГ, сколько времени и может ли быть процедура, рассказывает врач.
Показания меняются от недели к неделе.
В результате на устройстве отображается график, на котором отмечены пики активности и ЧСС.
Ознакомиться с результатами может специалист, проводящий исследование, но заключение по нему должен давать только врач, учитывая общую картину течения беременности.
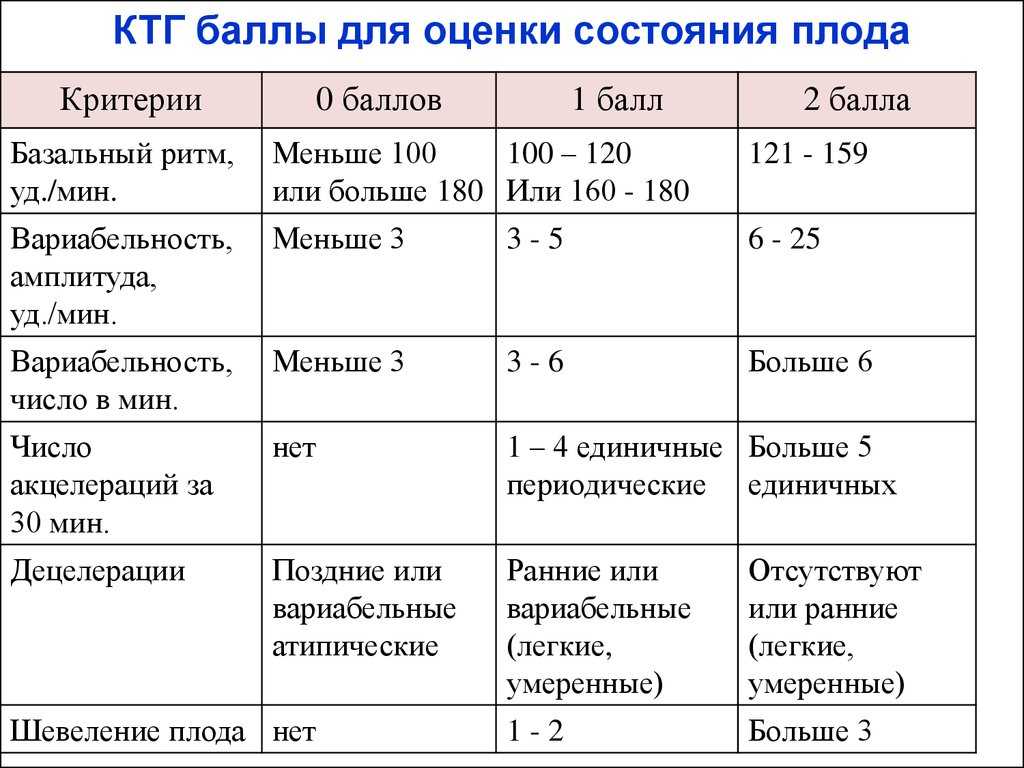
Токограмма дает следующие оценки на основе информации о сердцебиении (не путать с оценкой PSP):
- 8-10 баллов – все в порядке;
- 5-7 баллов — необходима консультация врача;
- 1-4 балла — высокие риски гипоксии плода.
При получении сомнительных или неудовлетворительных результатов назначают допплерографию и УЗИ. Допплерэхокардиография помогает изучить кровоток, сосуды и сердце ребенка, а также плацентарный кровоток и работу маточных сосудов матери. УЗИ помогает оценить состояние плода, работу всех его систем.
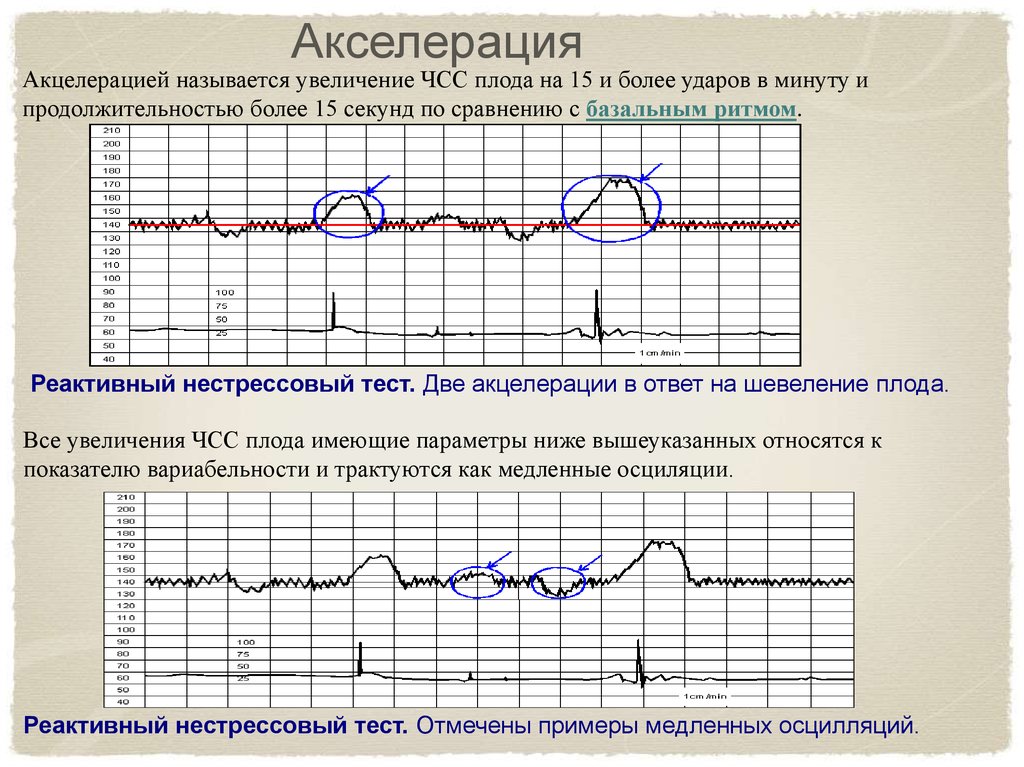
Показатели, которые оценивают при кардиотокографии:
- Базальный ритм — в норме от 110 до 160 уд/мин;
- Вариабельность сокращений или диапазона ЧСС (отражается в виде зубцов на графике), с частотой 10-25 в минуту.
 Превышение значений указывает на риски и возможные проблемы;
Превышение значений указывает на риски и возможные проблемы; - Учащение или учащение пульса (в виде крупных зубцов, пиков на диаграмме) — в норме не менее 2 за 10 мин, максимально 10 за 40 мин;
- Замедление или снижение — не более 5 за весь сеанс КТГ;
- Через 36 недель — нет поздних децелераций.
См. также: Нормальные показатели УЗИ органов брюшной полости, исследования почек, желез, печени и других органов
Почему важно подключать к аппарату рожениц, зачем и как делают КТГ в начале родов
Так как КТГ фиксирует сокращение матки, выявляет схватки.
На что влияет, в какое время делать исследование? Сразу уточним – регистрируемые после 36-й недели на кардиограмме схватки, если они не сопровождаются учащенным сердцебиением ребенка, считаются нормальными. Это подготовка матки.
При нормальном течении родовой деятельности ресурсов организма мамы и малыша хватает на преодоление трудностей, нормальное прохождение через родовые пути.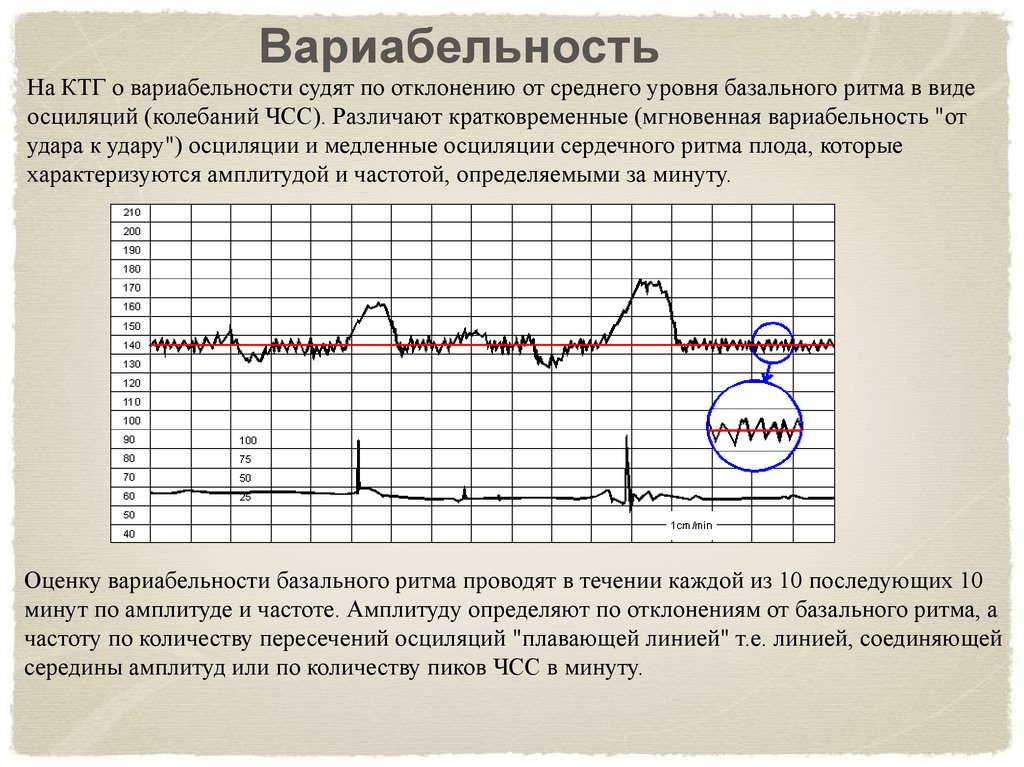
Таким образом, показания кардиограммы во время родов могут служить для акушеров сигналом к своевременному принятию необходимых мер.
Тахикардия плода до 200 ударов в минуту в ответ на схватку считается нормой. Но частота сердечных сокращений более 180 ударов в минуту непрерывно в течение 10 минут и более может быть признаком гипоксии. При частоте сердечных сокращений более 220 ударов в минуту возникают риски сердечной недостаточности. Все эти цифры вне нормы, а также монотонный график КТГ служат для врачей сигналами к изменению тактики родов.
Таким образом, на сегодняшний день результаты, полученные при проведении кардиотокограммы, позволяют снизить риски гибели плода в родах, свести к минимуму возможность развития острой гипоксии, тяжелой асфиксии, более точно оценить состояние ребенка.

 Превышение значений указывает на риски и возможные проблемы;
Превышение значений указывает на риски и возможные проблемы;