Комплексная терапия неосложненных инфекций мочевых путей, вызванных условно–патогенной микрофлорой, с применением ципрофлоксацина и иммуномодуляторов | Султанова Е.А., Григорян В.А., Шпоть Е.В.
Введение Инфекции мочевых путей (ИМП) – одни из наиболее распространенных инфекционных заболеваний, которые широко встречаются в амбулаторной и во внутрибольничной практике.
Инфекции мочевых путей (ИМП) – одни из наиболее распространенных инфекционных заболеваний, которые широко встречаются в амбулаторной и во внутрибольничной практике.
ИМП обычно подразделяют по локализации на инфекции верхних (острый и хронический пиелонефрит) и нижних (уретрит, цистит) отделов мочевых путей. Кроме того, выделяют бессимптомную бактериурию, когда у больных обнаруживают лейкоциты и бактерии в моче, однако клинические проявления заболевания отсутствуют.
По характеру течения ИМП разделяют на неосложненные и осложненные. Неосложненные инфекции развиваются у людей, не страдающих серьезными сопутствующими заболеваниями, в отсутствие структурных изменений почек и других отделов мочевыводящего тракта. Осложненные инфекции нередко возникают в стационаре на фоне катетеризации мочевых путей. Их диагностируют также при появлении симптомов инфекции у больных, страдающих заболеваниями мочевыводящих путей (мочекаменная болезнь, поликистоз почек, доброкачественная гиперплазия простаты и т.д.), а также другими заболеваниями, которые способствуют развитию и более тяжелому течению инфекционных осложнений (сахарный диабет, нейтропения, иммунодепрессивная терапия) [6,7, 10,11,34].
Осложненные инфекции нередко возникают в стационаре на фоне катетеризации мочевых путей. Их диагностируют также при появлении симптомов инфекции у больных, страдающих заболеваниями мочевыводящих путей (мочекаменная болезнь, поликистоз почек, доброкачественная гиперплазия простаты и т.д.), а также другими заболеваниями, которые способствуют развитию и более тяжелому течению инфекционных осложнений (сахарный диабет, нейтропения, иммунодепрессивная терапия) [6,7, 10,11,34].
Выделяют также внебольничные (возникают в амбулаторных условиях) и больничные, или нозокомиальные (развиваются после 48 ч пребывания пациента в стационаре) ИМП. Последние практически всегда являются осложненными [6,7,11,33,34].
К уропатогенным микроорганизмам, вызывающим более 90% ИМП, относятся бактерии семейства Enterobacteriaceae, а также P.
 aeruginosa, Enterococcus faecalis, Staphylococcus saprophyticus. В то же время такие микроорганизмы, как S. aureus, S. epidermidis, Gardnerella vaginalis, Streptococcus spp., дифтероиды, лактобациллы, анаэробы, практически не вызывают эти инфекции, хотя также колонизируют прямую кишку, влагалище и кожу [9,15,18] (табл. 1 и 2).
aeruginosa, Enterococcus faecalis, Staphylococcus saprophyticus. В то же время такие микроорганизмы, как S. aureus, S. epidermidis, Gardnerella vaginalis, Streptococcus spp., дифтероиды, лактобациллы, анаэробы, практически не вызывают эти инфекции, хотя также колонизируют прямую кишку, влагалище и кожу [9,15,18] (табл. 1 и 2). Антибактериальная терапия
Основным методом лечения острых и хронических ИМП, вызванных условно–патогенной микрофлорой, в настоящее время является антибактериальная терапия.
В терапии инфекционно–воспалительных урологических заболеваний ведущее место занимают антибиотики группы фторхинолонов (ФХ). Широкое применение в клинической практике в течение десятилетий доказало эффективность препаратов этой группы, что заставляет исследователей постоянно пытаться синтезировать новые химические модификации молекулы налидиксовой кислоты, которая является ядром любого хинолона.

ФХ широко применяются в качестве эмпирической терапии ИМП любой локализации. Наиболее частный аргумент против широкого использования ФХ – рост резистентных штаммов микроорганизмов к ним. С точки зрения клинической практики важно, что резистентность у большинства микроорганизмов к ФХ развивается достаточно медленно.
Риск токсичности препаратов ограничивает применение ФХ у детей, беременных и кормящих женщин и пожилых пациентов с наличием тяжелых сопутствующих заболеваний.

Ципрофлоксацин – один из ранних синтезированных ФХ, однако он по–прежнему является препаратом выбора для лечения ИМП, вызванных синегнойной палочкой, или инфекций, вызванных возбудителями семейства Enterobacteriaceae, до сих пор сохраняя свой мощный потенциал и малое число побочных эффектов, по сравнению с другими ФХ и антибиотиками других групп.
 ч. клеточной стенки и мембран) и быструю гибель бактериальной клетки.
ч. клеточной стенки и мембран) и быструю гибель бактериальной клетки.Препарат действует бактерицидно на грамотрицательные организмы в период покоя и деления (т.к. влияет не только на ДНК–гиразу, но и вызывает лизис клеточной стенки), на грамположительные микроорганизмы – только в период деления. Низкая токсичность для клеток макроорганизма объясняется отсутствием в них ДНК–гиразы. На фоне приема ципрофлоксацина не происходит параллельной выработки устойчивости к другим актибиотикам, не принадлежащим к группе ингибиторов гиразы, что делает его высокоэффективным по отношению к бактериям, которые устойчивы, например, к аминогликозидам, пенициллинам, цефалоспоринам, тетрациклинам и многим другим антибиотикам.
К препарату резистентны: Bacteroides fragilis, Pseudomonas cepacia, Pseudomonas maltophilia, Ureaplasma urealyticum, Clostridium difficile, Nocardia asteroides.

Резистентность развивается крайне медленно, поскольку, с одной стороны, после действия ципрофлоксацина практически не остается персистирующих микроорганизмов, а с другой – у бактериальных клеток нет ферментов, инактивирующих его.
При пероральном приеме быстро и достаточно полно всасывается из ЖКТ (преимущественно в 12–перстной и тощей кишке). Прием пищи замедляет всасывание, но не изменяет МПК и биодоступность.
Хорошо распределяется в тканях организма (исключая ткань, богатую жирами, например нервную ткань). Метаболизируется в печени (15–30%) с образованием малоактивных метаболитов (диэтилципрофлоксацин, сульфоципрофлоксацин, оксоципрофлоксацин, формилципрофлоксацин). Выводится в основном почками путем канальцевой фильтрации и канальцевой секреции в неизмененном виде (при приеме внутрь – 40–50%, при в/в введении – 50–70%) и в виде метаболитов (при приеме внутрь – 15%, при в/в введении – 10%), остальная часть – через ЖКТ.

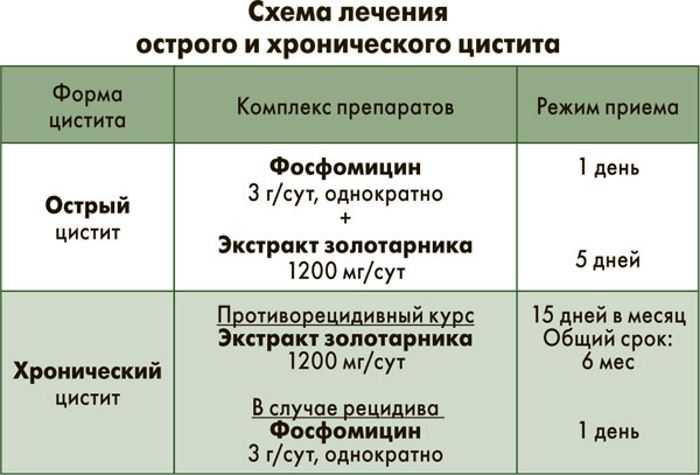
Для лечения неосложненных инфекций нижних мочевых путей ципрофлоксацин (Ифиципро®ОД) назначают в течение 3 дней, так как клинические исследования показали, что терапия одной дозой ФХ менее эффективна, чем лечение короткими курсами:
ципрофлоксацин внутрь по 250 мг 2 р/сут.
 или Ифиципро®ОД внутрь по 500 мг 1 р/сут. в течение 3 сут.
или Ифиципро®ОД внутрь по 500 мг 1 р/сут. в течение 3 сут.При лечении острого необструктивного пиелонефрита ципрофлоксацин сначала вводят в/в, в последующем переходя на пероральный способ применения, что позволяет сократить время пребывания больного в стационаре:
– ципрофлоксацин в/в по 200 мг 2 р/сут. в течение 3–7 сут., затем внутрь по 250 мг 2 р/сут. или Ифиципро®ОД внутрь по 500 мг–1000 мг 1 р/сут. в течение 11–14 сут.;
С профилактической целью при рецидивирующих неосложненных ИМП ципрофлоксацин назначают длительно в низких дозах:
ципрофлоксацин внутрь 125 мг 1 р/сут. в течение длительного времени.
Тем не менее следует отметить, что длительный прием антимикробных средств приводит к селекции резистентных штаммов микроорганизмов, развитию аллергических реакций и, более того, после прекращения такого поддерживающего лечения примерно у 60% женщин в течение 3–4–х месяцев отмечается рецидив инфекции.
Учитывая этот фактор, а также то, что одной из ключевых причин хронизации ИМП в настоящее время считается нарушение иммунитета, при рецидивирующих ИМП целесообразно добавление к антибактериальной терапии иммуномодулирующих препаратов.

Обоснование применения иммуномодуляторов
при хронических ИМП
Слизистые оболочки являются естественной первой линией противомикробной защиты. Доказано, что у больных с рецидивирующими инфекциями нижних МП имеются изменения местного иммунного ответа в виде нарушения отдельных функций нейтрофилов (хемотаксис, фагоцитоз, бактерицидная функция) [19,20,23,24, 28], снижения активности ИЛ–2 [21] и уровня ИЛ–8 в моче, способствующего миграции нейтрофилов в просвет мочевого пузыря [22, 23], а также секреторного IgA [27,37], который блокирует прикрепление бактерий к эпителиальным клеткам.
Под воздействием токсических факторов инфекционных агентов происходят не только деструктивные изменения: подавляется фагоцитарная активность лейкоцитов, фагоцитоз протекает по типу незавершенной реакции, в которой преимущественно принимают участие полиморфноядерные лейкоциты. Это приводит к развитию торпидных форм заболевания. Хронизация деструктивного процесса наблюдается также в случае функциональной неполноценности мононуклеарных фагоцитов, которые проникают в очаг повреждения вслед за полиморфноядерными лейкоцитами.
 Отмечено, что при хроническом воспалительном процессе фагоцитарно–бактери¬цидная активность лейкоцитов в очаге воспаления резко снижается [19,20,23,24,28].
Отмечено, что при хроническом воспалительном процессе фагоцитарно–бактери¬цидная активность лейкоцитов в очаге воспаления резко снижается [19,20,23,24,28].В крови уменьшается количество NK–клеток (CD16) [20,28,38], снижается абсолютное количество лимфоци¬тов и уменьшается общая популяция Т–лимфоцитов (CD3) и Т–хелперов (CD4). Одновременно увеличивается количество Т–супрессоров (CD8). Ввиду наличия дисбаланса между основными субпопуляциями лимфоцитов, Т–хелперами (CD4) и Т–супрессорами (CD8), иммунорегуляторный индекс Т–хелперы/Т–супрессоры имеет очень низкое значение [25,26,36,39].
Наблюда¬ется снижение уровня всех фракций иммуноглобулинов (IgA, IgM и IgG) и некоторых цитокинов (ИЛ–2) [30,32].
Однако возможна и обратная картина: хронические ИМП часто сопровождаются поликлональной активацией лимфоцитов – наблюдается значительная гипергаммаглобулинемия, увеличивается число предшественников В–клеток и зрелых плазматических клеток в периферической крови, активированные В–лимфоциты спонтанно синтезируют иммуноглобулины различных классов.
 На ключевую роль иммунопатологических механизмов указывает избыток циркулирующих иммунных комплексов (ЦИК), противотканевых IgA, IgG и IgM в периферической крови. Расстройство системы «активация – супрессия» на фоне персистирующей инфекции ведет к нарушению иммунобиологического надзора. В результате появляются иммунокомпетентные клетки, выступающие против аллоантигенов. Создаются условия для развития аутоиммунных реакций [2,35] и подавления иммунитета [26]. Образование иммунных комплексов (то есть фиксация иммуноглобулинов класса G и M и комплемента на стенках мелких сосудов и гладкомышечных клетках), а также снижение активности Т–хелперов и повышении активности Т–супрессоров, обладающих цитотоксическим эффектом, приводит к развитию вторичного иммунодефицита. Кроме того, у всех микроорганизмов имеются антигены, родственные тканям гениталий, что также ведет к развитию аутоиммунных процессов [29–31].
На ключевую роль иммунопатологических механизмов указывает избыток циркулирующих иммунных комплексов (ЦИК), противотканевых IgA, IgG и IgM в периферической крови. Расстройство системы «активация – супрессия» на фоне персистирующей инфекции ведет к нарушению иммунобиологического надзора. В результате появляются иммунокомпетентные клетки, выступающие против аллоантигенов. Создаются условия для развития аутоиммунных реакций [2,35] и подавления иммунитета [26]. Образование иммунных комплексов (то есть фиксация иммуноглобулинов класса G и M и комплемента на стенках мелких сосудов и гладкомышечных клетках), а также снижение активности Т–хелперов и повышении активности Т–супрессоров, обладающих цитотоксическим эффектом, приводит к развитию вторичного иммунодефицита. Кроме того, у всех микроорганизмов имеются антигены, родственные тканям гениталий, что также ведет к развитию аутоиммунных процессов [29–31].Благодаря исследованиям последних лет было доказано, что каждая из инфекций органов мочеполовой системы может имитировать симптомы ВИЧ–инфекции, подавляя Т– и В–клеточные звенья регуляции иммунитета, истощая буферную емкость среды и вызывая нарушения микробиоценоза, которые обусловлены постоянным поступлением в кровь продуктов воспаления, тканевого и клеточного детрита, снижением защитных свойств слизистых оболочек и секрета желез.
 Все это, в конечном счете, приводит к развитию аутоиммунного воспаления [1,29–31,35].
Все это, в конечном счете, приводит к развитию аутоиммунного воспаления [1,29–31,35]. Хронические заболевания, сопровождающиеся длительной персистенцией микроорганизмов, приводят к возникновению иммунодефицита из–за их прямого токсического действия на костный мозг, вилочковую железу, а также Т– и В–лимфоциты [1,4].
В Урологической клинике ММА мы предпочитаем включать в терапию рецидивирующих ИМП иммуномодуляторы широкого спектра действия, характеризующиеся низкой частотой развития побочных эффектов (таких как, полиоксидоний, гепон и глутоксим) [13].
Полиоксидоний назначают в/м или п/к 6 мг 1 р/сут. в течение 5 сут., затем по 6 мг через день, всего 10 инъекций; или ректально по 1 суппозиторию (6 мг) 1 р/сут. в течение 3 сут., затем по 1 суппозиторию через день, всего 10 суппозиториев.
Гепон можно применять одновременно местно и системно: под язык 0,002 г 1 р/сут. в течение 3 сут. + внутрипузырно 0,002 г 1 р/сут. в течение 3–12 сут.
Глутоксим назначают в/м 10–20 мг 1 р/сут.
 в течение 10 сут.
в течение 10 сут.Нами было доказано, что включение иммуномодуляторов в комплексную терапию позволяет повысить клиническую эффективность лечения на 20–36,5% [13].
Аналогичные результаты были получены и при лабораторных исследованиях. По данным микробиологического исследования мочи применение иммуномодуляторов в комплексной терапии повышало ее эффективность на 18,4%, по данным микроскопического исследования мочи – на 26,3%. Кроме того, иммунная терапия снижала частоту повторного появления пиурии на 31,5 – 42%, а также вероятность повторного выявления возбудителя – на 31,5% [13].
Заключение
Проблема лечения ИМП продолжает оставаться актуальной и в настоящее время. Следует отметить, что лишь комплексный подход к терапии данных заболеваний позволяет получить действительно хорошие результаты.
Литература
1. Бакулев А.Л., Рубин В.И., Суворов А.П., Слесаренко Н.А. Болезнь Рейтера. Изд. Саратовского мед. университета. 1999:44–56.
2. Голигорский С.Д. Циститы. Кишинев, 1958.
3. Гольдин Г.И. Циститы. М., «Медгиз», 1960.
4. Дидковский Н.А., Малашенкова И.К. Принципы иммунокорригирующей терапии вторичных иммунодефицитов, ассоциированных с хронической вирусно–бактериальной инфекцией//Русский медицинский журнал, 2002, 10, 21:973–974.
5. Добрица В.П., Ботерашвили Н.М., Добрица Е.В. Современные иммуномодуляторы для клинического применения. Ст.–Петербург, 2001.
6. Лопаткин Н.А., Деревянко И.И. Неосложненные и осложненные инфекции мочеполовых путей. Принципы антибактериальной терапии//Русский медицинский журнал, 1997, 5, 24:1579–1588.
7. Лопаткин Н.А., Деревянко И.И. Программа антибактериальной терапии острого цистита и пиелонефрита у взрослых//Consilium–medicum, 1999, 2:182–183.
8. Лоран О.Б., Зайцев А.В., Липский В.С. Диагностика и лечение интерстициального цистита у женщин. Саратов, 2001.
9. Моисеев С.В. Практические рекомендации по антибактериальной терапии и профилактике инфекций мочевыводящих путей с позиций доказательной медицины//Инфекции и антимикробная терапия, 2003, 5, 3.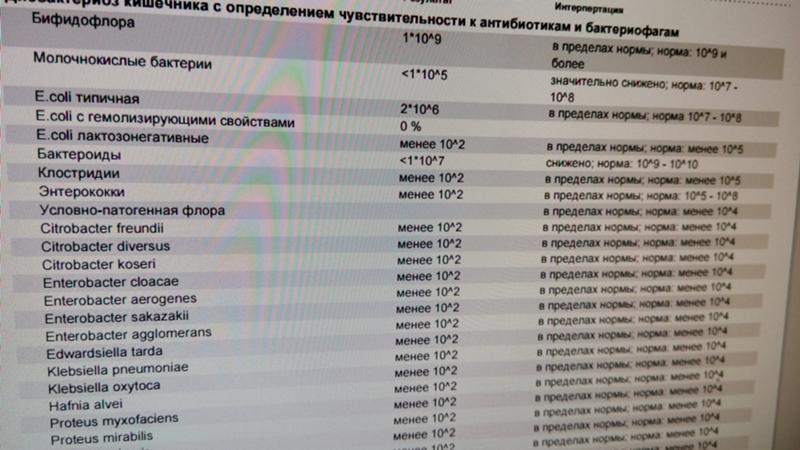
10. Перепанова Т.С. Комплексное лечение и профилактика госпитальной инфекции мочевых путей. Дис. докт. мед. наук. М., 1996.
11. Перепанова Т.С., Кудрявцев Ю.В., Хазан П.Л. Неосложненная инфекция мочевых путей//Consilium–medicum, 2003, 5, 1.
12. Страчунский Л.С., Рафальский В.В. Клиническое значение антибактериальной терапии острых циститов// Клиническая Антимикробная Химиотерапия, 1999, 1, 3:84–91.
13. Султанова Е.А. Диагностика и коррекция иммунных нарушений при хронических неосложненных инфекциях нижних мочевых путей, вызванных условно–патогенной микрофлорой. Дис. Канд. Мед. наук. М., 2006.
14. Султанова Е.А., Григорян В.А., Атауллаханов Р.И., Шпоть Е.В., Алленов С.Н. Современный подход к лечению хронических воспалительных заболеваний органов мочеполовой системы//Материалы юбил. науч.–практич. конф., посв. 100–летию к–ки им. А.В. Вишневского. Казань, 2000:223–224.
15. Яковлев С.В. Современные подходы к антибактериальной терапии инфекций мочевыводящих путей//Consilium–medicum, 2001, 3, 7:300–306.
16. Яковлев С.В., Дворецкий Л.И., Суворова М.П. Бактериальные инфекции в амбулаторной практике: выбор оптимального антибактериального препарата//Consilium–medicum, 2002, 4, 1:10–21.
17. Яковлев С.В., Деревянко И.И. Инфекция мочевыводящих путей. Учебно–методическое пособие для врачей. М., Медиа Медика, 2001.
18. Яковлев С.В., Деревянко И.И. Какие антибиотики действительно нужны для лечения урогенитальных инфекций?// Consilium–medicum, 2004, 6, 1:40–45.
19. Agace W.W., Hedges S.R., Ceska M., Svanborg C. Interleukin–8 and the neutrophil response to mucosal gram–negative infection//J. Clin. Invest., 1993, 92(2):780–5.
20. Condron C., Toomey D., Casey R.G., Shaffii M., Creagh T., Bouchier–Hayes D. Neutrophil bactericidal function is defective in patients with recurrent urinary tract infections//Urol. Res., 2003, 31(5):329–34.
21. Fleischmann J.D., Wentworth D.B., Thomas K.M., Imbembo A.L. Urinary interleukin–2 inhibition in patients with cystitis//Immunol. Invest., 1989, 18(6):825–31.
Invest., 1989, 18(6):825–31.
22. Frendeus B., Godaly G., Hang L., Karpman D., Lundstedt A.C., Svanborg C. Interleukin 8 receptor deficiency confers susceptibility to acute experimental pyelonephritis and may have a human counterpart//J. Exp. Med., 2000, 18;192(6):881–90.
23. Godaly G., Bergsten G., Hang L., et al. Neutrophil recruitment, chemokine receptors, and resistance to mucosal infection//J. Leukoc. Biol., 2001, 69(6):899–906.
24. Haraoka M., Hang L., Frendeus B., Godaly G., Burdick M., Strieter R., Svanborg C. Neutrophil recruitment and resistance to urinary tract infection//J. Infect. Dis., 1999, 180(4):1220–9.
25. Hoepelman A.I., van Buren M., van den Broek J., Borleffs J.C. Bacteriuria in men infected with HIV–1 is related to their immune status (CD4+ cell count)//AIDS, 1992, 6(2):179–84.
26. Hopkins W.J., James L.J., Balish E., Uehling D.T. Congenital immunodeficiencies in mice increase susceptibility to urinary tract infection//J. Urol., 1993, 149(4):922–5.
Urol., 1993, 149(4):922–5.
27. James–Ellison M.Y., Roberts R., Verrier–Jones K., Williams J.D., Topley N. Mucosal immunity in the urinary tract: changes in sIgA, FSC and total IgA with age and in urinary tract infection//Clin. Nephrol., 1997, 48(2):69–78.
28. Khan A.J., Kumar K., Evans H.E. Role of neutrophil chemotaxis in the pathogenesis of urinary tract infection//J. Urol., 1987, 137(2):342–4.
29. Leonardo E., Dogliotti C., Navone R. Autoimmune aspects of a case of chronic interstitial cystitis//Minerva Med., 1986, 77(27):1323–6.
30. Mattila J. et al. Immunoglobulin deposits in the bladder epithelium and vessels in interstitial cystitis: Possible relationship to circulating anti–intermediate filament autoantibodies//Clin. Immunol. Immunopathol., 1984, 2:81–89.
31. Mattila J. Vascular immunopathology in interstitial cystitis//Clin. Immunol. Immunopathol., 1982, 23:648–652.
32. Mattila J., Harmoinen A., Hallstrom O. Serum immunoglobulin and complement alterations in interstitial cystitis//Eur. Urol., 1983, 9(6):350–2.
Urol., 1983, 9(6):350–2.
33. Naber K.G. et al. EAU Guidelines for the management of urinary and male genital tract infections//Clinical Microbiology and Antimicrobial Chemotherapy, 2002, 4, 4.
34. Naber K.G. et al. Guidelines on urinary and male genital tract infections. EAU, 2000.
35. Ochs R.L. et al. Autoantibodies in interstitial cystitis//J. Urol., 1994, 151:587–592.
36. Su H., Caldwell H.D. CD4+ T–cells play a significans role in adoptive immunity to Chlamydia trachomatis infection of the mouse genital tract//Infect. Immunol., 1995, 63, 9:3302–3308.
37. Suman E., Gopalkrishna Bhat K,, Hegde B.M. Bacterial adherence and immune response in recurrent urinary tract infection//Int. J. Gynaecol. Obstet., 2001, 75(3):263–8.
38. Tambic A., Kes P., Milutinovic S., Rabatic S., Silobrcic V. Phagocytic function in patients with recurrent urinary tract infections//Acta Med. Croatica., 1992, 46(1):21–5.
39. Toba K., Sudoh N., Ouchi Y. , Lien J., Fukuchi Y., Orimo H., Harada N., Washida K., Hoshino T., Ohata N. The importance of the host nutritional and immune status on the prognosis of urinary tract infection in the elderly//Nippon Ronen Igakkai Zasshi., 1993, 30(6):487–96.
, Lien J., Fukuchi Y., Orimo H., Harada N., Washida K., Hoshino T., Ohata N. The importance of the host nutritional and immune status on the prognosis of urinary tract infection in the elderly//Nippon Ronen Igakkai Zasshi., 1993, 30(6):487–96.
Авторизация
Размер:
AAA
Цвет: C C C
Изображения Вкл. Выкл.
Обычная версия сайта
Сведения об образовательной организации Контакты Старая версия сайта Версия для слабовидящих Версия для слабовидящих
Южно-Уральский государственный медицинский университет
- Университет
- События
- Новости
- ЮУГМУ сегодня
- Историческая справка
- Руководство
- Выборы ректора
- Лицензия, аккредитация и сертификаты
- Организационная структура
- Противодействие коррупции
- Первичная профсоюзная организация ЮУГМУ Профсоюза работников здравоохранения РФ
- Абитуриенту
- Новости для абитуриентов
- Центр довузовской подготовки
- Поступающим на специалитет
- Поступающим в ординатуру
- Поступающим в аспирантуру
- Поступающим в медицинский колледж
- Документы на право ведения образовательной деятельности
- Положения о приемной, экзаменационной и апелляционной комиссиях
- Информация об общежитиях
- Часто задаваемые вопросы
- Результаты приема студентов
- Информация для инвалидов
- Обучающемуся
- Факультеты
- Кафедры
- Медицинский колледж
- Ординатура
- Аспирантура
- Научная библиотека
- Образовательный портал
- Расписания
- Совет обучающихся ЮУГМУ
- Этический кодекс студентов медицинских вузов
- Совет студентов Минздрава России
- О допуске студентов к работе в медицинских организациях
- Иностранным обучающимся
- Медицинское обслуживание
- Информация об общежитиях
- Стипендиальное обеспечение
- Порядок перехода обучающихся с платного на бесплатное обучение
- Часто задаваемые вопросы
- Анкетирование
- Студенческие отряды
- Противодействие терроризму и экстремизму
- Специалисту
- Институт дополнительного профессионального образования
- Аккредитация специалистов
- Пациенту
- Клиника ФГБОУ ВО ЮУГМУ Минздрава России
- Профилактика новой коронавирусной инфекции, гриппа, ОРВИ, вакцинация
- Здоровый образ жизни
- Нет наркотикам!
- Научная работа
- Управление по научной и инновационной работе
- Экспериментально-биологическая клиника (виварий)
- Отдел международных связей
- НИИ иммунологии
- Центральная научно-исследовательская лаборатория
- НОЦ «Проблемы фундаментальной медицины»
- НОЦ «Клиническая фармакология»
- Конференции и другие мероприятия
- Диссертационные советы
- Журнал «Непрерывное медицинское образование и наука»
- Студенческое научное общество
- Совет молодых ученых и специалистов
Внекишечная инфекция, вызванная Hafnia alvei
Сохранить цитату в файл
Формат: Резюме (текст)PubMedPMIDAbstract (текст)CSV
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Не удалось загрузить вашу коллекцию из-за ошибки
Повторите попытку
Добавить в мою библиографию
- Моя библиография
Не удалось загрузить делегатов из-за ошибки
Повторите попытку
Ваш сохраненный поиск
Название сохраненного поиска:
Условия поиска:
Тестовые условия поиска
Эл. адрес:
(изменить)
адрес:
(изменить)
Который день? Первое воскресеньеПервый понедельникПервый вторникПервая средаПервый четвергПервая пятницаПервая субботаПервый деньПервый рабочий день
Который день? ВоскресеньеПонедельникВторникСредаЧетвергПятницаСуббота
Формат отчета: РезюмеРезюме (текст)АбстрактАбстракт (текст)PubMed
Отправить максимум: 1 шт. 5 шт. 10 шт. 20 шт. 50 шт. 100 шт. 200 шт.
Отправить, даже если нет новых результатов
Необязательный текст в электронном письме:
Создайте файл для внешнего программного обеспечения для управления цитированием
Полнотекстовые ссылки
Спрингер
Полнотекстовые ссылки
. 2000 сен; 19 (9): 708-10.
2000 сен; 19 (9): 708-10.
doi: 10.1007/s100960000356.
А Рамос 1 , D Дамасо
принадлежность
- 1 Отделение внутренней медицины III и клинической микробиологии, Университетская клиника Пуэрта-де-Йерро, Автономный университет Мадрида, Испания. antonioramosmartí[email protected]
- PMID: 11057506
- DOI: 10.1007/с100960000356
А Рамос и соавт. Eur J Clin Microbiol Infect Dis. 2000 Сентябрь
. 2000 сен; 19 (9): 708-10.
2000 сен; 19 (9): 708-10.
дои: 10.1007/s100960000356.
Авторы
Рамос 1 , Д Дамасо
принадлежность
- 1 Отделение внутренней медицины III и клинической микробиологии, Университетская клиника Пуэрта-де-Йерро, Автономный университет Мадрида, Испания. antonioramosmartí[email protected]
- PMID: 11057506
- DOI: 10.1007/с100960000356
Абстрактный
Целью данного исследования было установление клинических особенностей внекишечных инфекций, вызванных Hafnia alvei. За 5-летний период (1994-1998 гг.) были собраны данные о стационарных больных (n = 8) с внутрибольничными (n = 5) или внебольничными (n = 3) инфекциями, вызванными Hafnia alvei. Средний возраст больных составил 47 ± 21 год. У трех пациентов были внутрибольничные инфекции мочевыводящих путей. Hafnia alvei также вызывала внебольничный холангит, холецистит, аппендицит, абсцесс поясничной мышцы и протезный эндокардит. Hafnia alvei была чувствительна к амоксициллину/клавулановой кислоте и в двух случаях к цефалоспоринам первого поколения. Чувствительность к аминогликозидам, имипенему, котримоксазолу, ципрофлоксацину, пиперациллину и цефотаксиму была очень хорошей (8/8). Четырем пациентам потребовалось инвазивное лечение.
За 5-летний период (1994-1998 гг.) были собраны данные о стационарных больных (n = 8) с внутрибольничными (n = 5) или внебольничными (n = 3) инфекциями, вызванными Hafnia alvei. Средний возраст больных составил 47 ± 21 год. У трех пациентов были внутрибольничные инфекции мочевыводящих путей. Hafnia alvei также вызывала внебольничный холангит, холецистит, аппендицит, абсцесс поясничной мышцы и протезный эндокардит. Hafnia alvei была чувствительна к амоксициллину/клавулановой кислоте и в двух случаях к цефалоспоринам первого поколения. Чувствительность к аминогликозидам, имипенему, котримоксазолу, ципрофлоксацину, пиперациллину и цефотаксиму была очень хорошей (8/8). Четырем пациентам потребовалось инвазивное лечение.
Похожие статьи
Клиническая характеристика внутрибольничных и внебольничных внекишечных инфекций, вызванных Hafnia alvei.
Родригес-Гуардадо А.
 , Бога Х.А., Диего И.Д., Ордас Х., Альварес М.Е., Перес Ф.
Родригес-Гуардадо А. и др.
Scand J Infect Dis. 2005;37(11-12):870-2. дои: 10.1080/00365540500333699.
Scand J Infect Dis. 2005.
PMID: 16308222
, Бога Х.А., Диего И.Д., Ордас Х., Альварес М.Е., Перес Ф.
Родригес-Гуардадо А. и др.
Scand J Infect Dis. 2005;37(11-12):870-2. дои: 10.1080/00365540500333699.
Scand J Infect Dis. 2005.
PMID: 16308222Выделение резистентной к колистину Hafnia alvei.
Савини В., Катавителло С., Талия М., Бальбинот А., Феббо Ф., Помпилио А., Ди Бонавентура Г., Пикколомини Р., Д’Антонио Д. Савини В. и др. J Med Microbiol. 2009, февраль; 58 (часть 2): 278–280. doi: 10.1099/jmm.0.001321-0. J Med Microbiol. 2009. PMID: 19141752 Аннотация недоступна.
Естественные модели чувствительности к противомикробным препаратам и биохимическая идентификация штаммов Escherichia albertii и Hafnia alvei.
Сток И., Рахман М.
 , Шервуд К.Дж., Видеманн Б.
Сток I и др.
Диагностика Microbiol Infect Dis. 2005 март; 51(3):151-63. doi: 10.1016/j.diagmicrobio.2004.10.008.
Диагностика Microbiol Infect Dis. 2005.
PMID: 15766600
, Шервуд К.Дж., Видеманн Б.
Сток I и др.
Диагностика Microbiol Infect Dis. 2005 март; 51(3):151-63. doi: 10.1016/j.diagmicrobio.2004.10.008.
Диагностика Microbiol Infect Dis. 2005.
PMID: 15766600Клиническое значение внекишечных изолятов Hafnia alvei от 61 пациента и обзор литературы.
Гюнхард Х., Пеннекамп А. Гюнхард Х. и др. Клин Инфекция Дис. 1996 июнь; 22 (6): 1040-5. doi: 10.1093/клиниды/22.6.1040. Клин Инфекция Дис. 1996. PMID: 8783707 Обзор.
Пиелонефрит Hafnia alvei у реципиента почечного трансплантата: отчет о клиническом случае и обзор недостаточно распознанного нозокомиального возбудителя.
Cardile AP, Forbes D, Cirigliano V, Stout B, Das NP, Hsue G. Cardile AP и соавт.
 Transpl Infect Dis. 2011 авг; 13 (4): 407-10. дои: 10.1111/j.1399-3062.2011.00600.х. Epub 2011 7 февраля.
Transpl Infect Dis. 2011.
PMID: 21299775
Обзор.
Transpl Infect Dis. 2011 авг; 13 (4): 407-10. дои: 10.1111/j.1399-3062.2011.00600.х. Epub 2011 7 февраля.
Transpl Infect Dis. 2011.
PMID: 21299775
Обзор.
Посмотреть все похожие статьи
Цитируется
Резистентность к цефалоспоринам третьего поколения у внутренне устойчивых к колистину энтеробактерий, выделенных из розничного мяса.
Одои ДЖО, Такаянаги С., Йоссапол М., Сугияма М., Асаи Т. Одои Джо и др. Антибиотики (Базель). 2021 24 ноября; 10 (12): 1437. дои: 10.3390/антибиотики10121437. Антибиотики (Базель). 2021. PMID: 34943649 Бесплатная статья ЧВК.
Катетер-ассоциированный Hafnia alvei, индуцированный уросепсисом.
Ярлагадда К., Шриманкер И.
 , Ноокала В.К.
Ярлагадда К. и др.
Куреус. 26 декабря 2019 г.; 11(12):e6471. doi: 10.7759/cureus.6471.
Куреус. 2019.
PMID: 32025398
Бесплатная статья ЧВК.
, Ноокала В.К.
Ярлагадда К. и др.
Куреус. 26 декабря 2019 г.; 11(12):e6471. doi: 10.7759/cureus.6471.
Куреус. 2019.
PMID: 32025398
Бесплатная статья ЧВК.Hafnia alvei Urosepsis у пациента после трансплантации почки.
Станик М., Мейсбургер Э., Хартманн Г., Лхотта К. Станик М. и др. Кейс Rep Трансплантация. 2015;2015:863131. дои: 10.1155/2015/863131. Epub 2015 15 апр. Кейс Rep Трансплантация. 2015. PMID: 25960912 Бесплатная статья ЧВК.
Краткий химический синтез тетрасахаридного повторяющегося звена О-антигена Hafnia alvei 10457.
Кумар Р., Маулик П.Р., Мисра А.К. Кумар Р. и соавт. Glycoconj J. 25 августа 2008 г. (6): 511-9. doi: 10.1007/s10719-007-9087-3. Epub 2007 12 декабря. Гликокондж Дж.
 2008.
PMID: 18074224
2008.
PMID: 18074224Популяционный лабораторный надзор за изолятами Hafnia alvei в большом канадском регионе здравоохранения.
Laupland KB, Church DL, Ross T, Pitout JD. Лаупланд К.Б. и др. Энн Клин Микробиол Антимикроб. 2006 18 мая; 5:12. дои: 10.1186/1476-0711-5-12. Энн Клин Микробиол Антимикроб. 2006. PMID: 16707023 Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
термины MeSH
вещества
Полнотекстовые ссылки
Спрингер
Укажите
Формат: ААД АПА МДА НЛМ
Добавить в коллекции
- Создать новую коллекцию
- Добавить в существующую коллекцию
Назовите свою коллекцию:
Имя должно содержать менее 100 символов
Выберите коллекцию:
Невозможно загрузить вашу коллекцию из-за ошибки
Повторите попытку
Send To
Hafnia alvei Urosepsis in a Kidney Transplant Patient
On this page
AbstractIntroductionCase ReportDiscussionReferencesCopyrightRelated Articles
Hafnia alvei , a gram-negative facultative anaerobic, rod-shaped bacterium, is a rare cause of infection в людях. Мы сообщаем о пациенте с пересадкой почки, у которого развился H. alvei пиелонефрит и уросепсис. Источник инфекции остается загадочным, но, скорее всего, это кишечный тракт. Соответствующая антибактериальная терапия цефепимом с последующим пероральным приемом ципрофлоксацина привела к быстрому исчезновению симптомов и полному выздоровлению. H. alvei может вызывать тяжелую инфекцию у пациентов после трансплантации без предрасполагающих факторов, таких как госпитализация, инвазивные процедуры или лечение антибиотиками.
Мы сообщаем о пациенте с пересадкой почки, у которого развился H. alvei пиелонефрит и уросепсис. Источник инфекции остается загадочным, но, скорее всего, это кишечный тракт. Соответствующая антибактериальная терапия цефепимом с последующим пероральным приемом ципрофлоксацина привела к быстрому исчезновению симптомов и полному выздоровлению. H. alvei может вызывать тяжелую инфекцию у пациентов после трансплантации без предрасполагающих факторов, таких как госпитализация, инвазивные процедуры или лечение антибиотиками.
1. Введение
Hafnia alvei — факультативная анаэробная грамотрицательная бактерия, принадлежащая к семейству Enterobacteriaceae. Хотя этот род был впервые описан в 1954 году, очень мало известно о его роли в инфекционных заболеваниях человека. H. alvei может быть выделен из почвы, воды и многих видов животных, особенно млекопитающих, где он колонизирует преимущественно желудочно-кишечный тракт [1]. У человека H. alvei , по-видимому, является членом нормального кишечного микробиома как непатогенный обитатель, хотя в некоторых исследованиях делается вывод, что эти бактерии вызывают значительный клинический гастроэнтерит [1, 2], особенно у детей [3], но также и у взрослых пациентов, страдающих от хронического заболевания или после предшествующей антибактериальной терапии [4]. Представляется, что H. alvei является микроорганизмом с ограниченной патогенностью для человека, который может вызывать клинически значимые инфекции только у лиц с ослабленным иммунитетом, например, при злокачественных опухолях или после трансплантации органов [5, 6]. Здесь мы описываем реципиента почечного трансплантата, который страдал от H. alvei уросепсис.
Представляется, что H. alvei является микроорганизмом с ограниченной патогенностью для человека, который может вызывать клинически значимые инфекции только у лиц с ослабленным иммунитетом, например, при злокачественных опухолях или после трансплантации органов [5, 6]. Здесь мы описываем реципиента почечного трансплантата, который страдал от H. alvei уросепсис.
2. История болезни
У 56-летней женщины развилась терминальная стадия почечной недостаточности вследствие IgA-нефропатии. В августе 2012 года ей сделали упреждающую трансплантацию почки, получив аллотрансплантат почки от мужа. Ее течение после трансплантации было стабильным с уровнем креатинина в сыворотке 0,90 мг/дл (рСКФ 75 мл/мин), а медикаментозная терапия состояла из такролимуса (уровень в крови от 5 до 7 нг/мл), азатиоприна, симвастатина и пантопразола.
За два дня до поступления в ноябре 2014 г. у нее появились головная боль, озноб, тошнота, многократная рвота и диарея. При поступлении у нее была температура 38°С. Анализы крови показали умеренный лейкоцитоз 10,5 Г/л (нейтрофилы 84%), СРБ 20 мг/дл, а уровень креатинина в сыворотке увеличился до 1,30 мг/дл. УЗИ трансплантата ничем не примечательно. Осадок мочи содержал множественные лейкоциты и бактерии. Был поставлен диагноз трансплантационного пиелонефрита, и цефепим 2 г два раза в день. было начато. Культуры, взятые из образцов мочи и крови, взятых при поступлении, выросли на H. alvei , идентифицированный времяпролетной масс-спектрометрией с лазерной десорбцией и ионизацией с матрицей (MALDI TOF) (MALDI Biotyper©Microflex LT, Bruker Daltonics, Бремен, Германия). Коинфекции с другими бактериями не выявлено. Результаты определения чувствительности к противомикробным препаратам с использованием системы VITEK 2 (bioMerieux) представлены в таблице 1.
Анализы крови показали умеренный лейкоцитоз 10,5 Г/л (нейтрофилы 84%), СРБ 20 мг/дл, а уровень креатинина в сыворотке увеличился до 1,30 мг/дл. УЗИ трансплантата ничем не примечательно. Осадок мочи содержал множественные лейкоциты и бактерии. Был поставлен диагноз трансплантационного пиелонефрита, и цефепим 2 г два раза в день. было начато. Культуры, взятые из образцов мочи и крови, взятых при поступлении, выросли на H. alvei , идентифицированный времяпролетной масс-спектрометрией с лазерной десорбцией и ионизацией с матрицей (MALDI TOF) (MALDI Biotyper©Microflex LT, Bruker Daltonics, Бремен, Германия). Коинфекции с другими бактериями не выявлено. Результаты определения чувствительности к противомикробным препаратам с использованием системы VITEK 2 (bioMerieux) представлены в таблице 1.
На фоне антибактериальной терапии у пациента исчезли симптомы и лихорадка, а креатинин сыворотки снизился до 0,90 мг/дл в течение двух дней. Через пять дней антибиотикотерапия была переведена на ципрофлоксацин 500 мг два раза в день. и пациента выписали. Через неделю при амбулаторном контроле у нее было отличное клиническое состояние, нормализовались лабораторные показатели, антибиотикотерапия могла быть прекращена.
и пациента выписали. Через неделю при амбулаторном контроле у нее было отличное клиническое состояние, нормализовались лабораторные показатели, антибиотикотерапия могла быть прекращена.
3. Обсуждение
Хотя относительно мало известно о роли H. alvei в клинических инфекциях человека, некоторые общие моменты все же возникают. Прежде всего, H. alvei редко обнаруживается в образцах человека, в основном из дыхательных путей и желудочно-кишечного тракта, мочи, крови, ран и абсцессов [9, 10]. Однако в большинстве этих случаев бактерия, по-видимому, не связана с клинической инфекцией. Например, вопрос о том, может ли H. alvei вызывать острый гастроэнтерит, до сих пор остается предметом дискуссий [1, 2]. Гюнтхард и Пеннекамп нашли H. alvei в 80 образцах, но считали его патогенетическим только у трех пациентов (два с септицемией и один с перитонитом). Во-вторых, у большинства пациентов, по-видимому, имеются сопутствующие заболевания, которые предрасполагают их к инфекции. Например, в серии, изученной Günthard и Pennekamp, 93% пациентов имели основное заболевание, преимущественно злокачественное. В-третьих, в большинстве случаев заражение H. alvei носит внутрибольничный характер. Родригес-Гуардадо в коллективе из 36 больных с внекишечной инфекцией вследствие H. alvei за одиннадцатилетний период обнаружили, что 25 из них были внутрибольничными и 11 внебольничными [10]. В дополнение к основным сопутствующим заболеваниям у 76% пациентов были другие предрасполагающие факторы риска, такие как хирургическое вмешательство, установка внутривенного катетера или антибактериальная терапия [9–11]. И, наконец, в большинстве образцов наблюдалась коинфекция другими, более патогенными бактериями, такими как Staphylococcus aureus [10].
Например, в серии, изученной Günthard и Pennekamp, 93% пациентов имели основное заболевание, преимущественно злокачественное. В-третьих, в большинстве случаев заражение H. alvei носит внутрибольничный характер. Родригес-Гуардадо в коллективе из 36 больных с внекишечной инфекцией вследствие H. alvei за одиннадцатилетний период обнаружили, что 25 из них были внутрибольничными и 11 внебольничными [10]. В дополнение к основным сопутствующим заболеваниям у 76% пациентов были другие предрасполагающие факторы риска, такие как хирургическое вмешательство, установка внутривенного катетера или антибактериальная терапия [9–11]. И, наконец, в большинстве образцов наблюдалась коинфекция другими, более патогенными бактериями, такими как Staphylococcus aureus [10].
В нашем учреждении за последние десять лет было обнаружено 40 изолятов H. alvei . Большинство положительных образцов было получено из выделений из дыхательных путей у интубированных пациентов или при инфекциях после операций на органах брюшной полости. Было обнаружено только три положительных результата посева крови, и у двух из этих пациентов имелось злокачественное новообразование.
Было обнаружено только три положительных результата посева крови, и у двух из этих пациентов имелось злокачественное новообразование.
Несколько случаев инфекции H. alvei были описаны у реципиентов стволовых клеток и, в частности, у реципиентов трансплантированных паренхиматозных органов. Колонизация кишечника и возможная инфекция H. alvei были зарегистрированы у 9-летней девочки после трансплантации гемопоэтических стволовых клеток по поводу анемии Фанкони. У двух пациентов, 61-летней женщины и 2-летнего мальчика, после трансплантации печени развился абсцесс печени. У первого пациента была коинфекция Enterococcus faecalis 9.0253 и Candida albicans и второй с Enterococcus faecalis . Иммуносупрессивное и противомикробное лечение указано в таблице 2. Günthard и Pennekamp сообщили о положительном образце у пациента с трансплантацией легкого, но без дополнительных подробностей.
Клинически значимая инфекция H. alvei также зарегистрирована у двух реципиентов почечного трансплантата.
Первым пациентом была 69-летняя женщина, у которой через девять лет после трансплантации почки развился сепсис и пневмония. Базальная иммуносупрессия состояла из циклоспорина, азатиоприна и стероидов. Пациент также страдал от инфекции гепатита С. У нее развились гипотензия, олигурия и коагулопатия, и она выздоровела после гемодинамической поддержки и антибактериальной терапии имипенемом и кларитромицином.
Второй случай — 45-летняя женщина, страдающая терминальной почечной недостаточностью вследствие диабетической нефропатии. Ее течение после трансплантации осложнялось острым гуморальным отторжением и хроническим отторжением. H. alvei пиелонефрит, развившийся после имплантации мочеточникового стента по поводу гидроуретеронефроза. Пациент выздоровел после лечения цефтриаксоном, цефиксимом и удаления стента.
Наш случай аналогичен этим двум отчетам. Нам также не удалось установить источник инфекции. Некоторые продукты, особенно мясо и рыба, могут содержать H. alvei в больших количествах [12]. Поскольку H. alvei является частью нормальной микробиоты кишечника, мы считаем, что желудочно-кишечный тракт, как это обычно бывает при инфекциях мочевыводящих путей, был наиболее вероятным источником инфекции. Ни у одного из этих пациентов с трансплантацией почки не было коинфекции другими более агрессивными бактериями. У двух других пациентов, однако, были дополнительные сопутствующие заболевания, а именно диабет у одного и инфекция гепатита С у другого пациента. У одного пациента инфекция H. alvei развилась после инвазивной процедуры. Два других пациента получали тройную иммуносупрессивную терапию, включающую преднизолон, тогда как у нашего пациента была только двойная терапия без стероидов. Все три пациента в конечном итоге выздоровели после соответствующей антибактериальной терапии.
alvei в больших количествах [12]. Поскольку H. alvei является частью нормальной микробиоты кишечника, мы считаем, что желудочно-кишечный тракт, как это обычно бывает при инфекциях мочевыводящих путей, был наиболее вероятным источником инфекции. Ни у одного из этих пациентов с трансплантацией почки не было коинфекции другими более агрессивными бактериями. У двух других пациентов, однако, были дополнительные сопутствующие заболевания, а именно диабет у одного и инфекция гепатита С у другого пациента. У одного пациента инфекция H. alvei развилась после инвазивной процедуры. Два других пациента получали тройную иммуносупрессивную терапию, включающую преднизолон, тогда как у нашего пациента была только двойная терапия без стероидов. Все три пациента в конечном итоге выздоровели после соответствующей антибактериальной терапии.
В заключение, H. alvei может вызывать тяжелые инфекции, такие как уросепсис, пиелонефрит и пневмония у реципиентов почечного аллотрансплантата. Для лечения инфекции необходима антимикробная терапия карбапенемами, хинолонами или цефалоспоринами четвертого поколения.
Для лечения инфекции необходима антимикробная терапия карбапенемами, хинолонами или цефалоспоринами четвертого поколения.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Ссылки
Дж. М. Янда и С. Л. Эбботт, «Род Hafnia : от супа до орехов», Clinical Microbiology Reviews , vol. 19, нет. 1, стр. 12–28, 2006 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Риделл, А. Сиитонен, Л. Паулин, Л. Маттила, Х. Коркеала и М. Дж. Альберт, «Hafnia alvei в образцах стула пациентов с диареей и контрольной группы здоровых людей», Журнал клинической микробиологии , том. 32, нет. 9, стр. 2335–2337, 1994.
Посмотреть по адресу:
Google Scholar
М. Дж. Альберт, К. Алам, М. Ислам и др.
 , «Hafnia alvei, вероятная причина диареи у людей», Infection and Immunity , vol. 59, нет. 4, pp. 1507–1513, 1991.
, «Hafnia alvei, вероятная причина диареи у людей», Infection and Immunity , vol. 59, нет. 4, pp. 1507–1513, 1991.Посмотреть по адресу:
Google Scholar
К. Пульчини, С. Рот, Э. Бернар, Ф. Ванденбос, Ж.-Л. Bernard и P. Dellamonica, «Бактеремия Hafnia alvei с абсцессом печени и мышц: клинический случай», Presse Medicale , vol. 32, нет. 22, стр. 1026–1027, 2003.
Посмотреть по адресу:
Google Scholar
V. Savini, E. Di Bartolomeo, C. Catavitello et al., «Колонизация Hafnia alvei, связанная с болезнью трансплантата, и вероятная инфекция», Journal of Medical Microbiology , об. 57, нет. 9, стр. 1167–1169, 2008 г.
Посмотреть по адресу:
Сайт издателя | Google Scholar
J. W. Barry, E.
 A. Dominguez, D. J. Boken и L. C. Preheim, «Инфекция Hafnia alvei после трансплантации печени», Клинические инфекционные болезни , том. 24, нет. 6, стр. 1263–1264, 1997.
A. Dominguez, D. J. Boken и L. C. Preheim, «Инфекция Hafnia alvei после трансплантации печени», Клинические инфекционные болезни , том. 24, нет. 6, стр. 1263–1264, 1997.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. P. Cardile, D. Forbes, V. Cirigliano, B. Stout, N. P. Das и G. Hsue, « Hafnia alvei пиелонефрит у реципиента почечного трансплантата: отчет о клиническом случае и обзор недостаточно распознанного нозокомиальный патоген», Transplant Infectious Disease , vol. 13, нет. 4, стр. 407–410, 2011.
Посмотреть по адресу:
Сайт издателя | Google Scholar
М. Х. Бенито, Р. С. Эрнандес, М. Дж. Ф.-Р. Луис и С. Эрнандо, «Сепсис, вызванный hafnia alvei у пациента с трансплантацией почки», Nefrologia , vol. 28, нет. 4, pp. 470–471, 2008.
Просмотр по адресу:
Google Scholar
H.
 Günthard and A. Pennekamp, «Клиническое значение внекишечных изолятов Hafnia alvei от 61 пациента и обзор литературы», Клинические инфекционные заболевания , том. 22, нет. 6, стр. 1040–1045, 1996.
Günthard and A. Pennekamp, «Клиническое значение внекишечных изолятов Hafnia alvei от 61 пациента и обзор литературы», Клинические инфекционные заболевания , том. 22, нет. 6, стр. 1040–1045, 1996.Посмотреть по адресу:
Сайт издателя | Google Scholar
A. Rodríguez-Guardado, JA Boga, I. De Diego, J. Ordás, ME Álvarez и F. Pérez, «Клинические характеристики внутрибольничных и внебольничных внекишечных инфекций, вызванных Hafnia alvei», Скандинавский журнал инфекционных заболеваний , том. 37, нет. 11–12, стр. 870–872, 2005 г.
Посмотреть по адресу:
Сайт издателя | Академия Google
A. Ramos и D. Damaso, «Внекишечная инфекция, вызванная Hafnia alvei », European Journal of Clinical Microbiology and Infectious Diseases , vol. 19, нет. 9, стр. 708–710, 2000.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж.


 , Бога Х.А., Диего И.Д., Ордас Х., Альварес М.Е., Перес Ф.
Родригес-Гуардадо А. и др.
Scand J Infect Dis. 2005;37(11-12):870-2. дои: 10.1080/00365540500333699.
Scand J Infect Dis. 2005.
PMID: 16308222
, Бога Х.А., Диего И.Д., Ордас Х., Альварес М.Е., Перес Ф.
Родригес-Гуардадо А. и др.
Scand J Infect Dis. 2005;37(11-12):870-2. дои: 10.1080/00365540500333699.
Scand J Infect Dis. 2005.
PMID: 16308222 , Шервуд К.Дж., Видеманн Б.
Сток I и др.
Диагностика Microbiol Infect Dis. 2005 март; 51(3):151-63. doi: 10.1016/j.diagmicrobio.2004.10.008.
Диагностика Microbiol Infect Dis. 2005.
PMID: 15766600
, Шервуд К.Дж., Видеманн Б.
Сток I и др.
Диагностика Microbiol Infect Dis. 2005 март; 51(3):151-63. doi: 10.1016/j.diagmicrobio.2004.10.008.
Диагностика Microbiol Infect Dis. 2005.
PMID: 15766600 Transpl Infect Dis. 2011 авг; 13 (4): 407-10. дои: 10.1111/j.1399-3062.2011.00600.х. Epub 2011 7 февраля.
Transpl Infect Dis. 2011.
PMID: 21299775
Обзор.
Transpl Infect Dis. 2011 авг; 13 (4): 407-10. дои: 10.1111/j.1399-3062.2011.00600.х. Epub 2011 7 февраля.
Transpl Infect Dis. 2011.
PMID: 21299775
Обзор. , Ноокала В.К.
Ярлагадда К. и др.
Куреус. 26 декабря 2019 г.; 11(12):e6471. doi: 10.7759/cureus.6471.
Куреус. 2019.
PMID: 32025398
Бесплатная статья ЧВК.
, Ноокала В.К.
Ярлагадда К. и др.
Куреус. 26 декабря 2019 г.; 11(12):e6471. doi: 10.7759/cureus.6471.
Куреус. 2019.
PMID: 32025398
Бесплатная статья ЧВК. 2008.
PMID: 18074224
2008.
PMID: 18074224 , «Hafnia alvei, вероятная причина диареи у людей», Infection and Immunity , vol. 59, нет. 4, pp. 1507–1513, 1991.
, «Hafnia alvei, вероятная причина диареи у людей», Infection and Immunity , vol. 59, нет. 4, pp. 1507–1513, 1991. A. Dominguez, D. J. Boken и L. C. Preheim, «Инфекция Hafnia alvei после трансплантации печени», Клинические инфекционные болезни , том. 24, нет. 6, стр. 1263–1264, 1997.
A. Dominguez, D. J. Boken и L. C. Preheim, «Инфекция Hafnia alvei после трансплантации печени», Клинические инфекционные болезни , том. 24, нет. 6, стр. 1263–1264, 1997. Günthard and A. Pennekamp, «Клиническое значение внекишечных изолятов Hafnia alvei от 61 пациента и обзор литературы», Клинические инфекционные заболевания , том. 22, нет. 6, стр. 1040–1045, 1996.
Günthard and A. Pennekamp, «Клиническое значение внекишечных изолятов Hafnia alvei от 61 пациента и обзор литературы», Клинические инфекционные заболевания , том. 22, нет. 6, стр. 1040–1045, 1996.