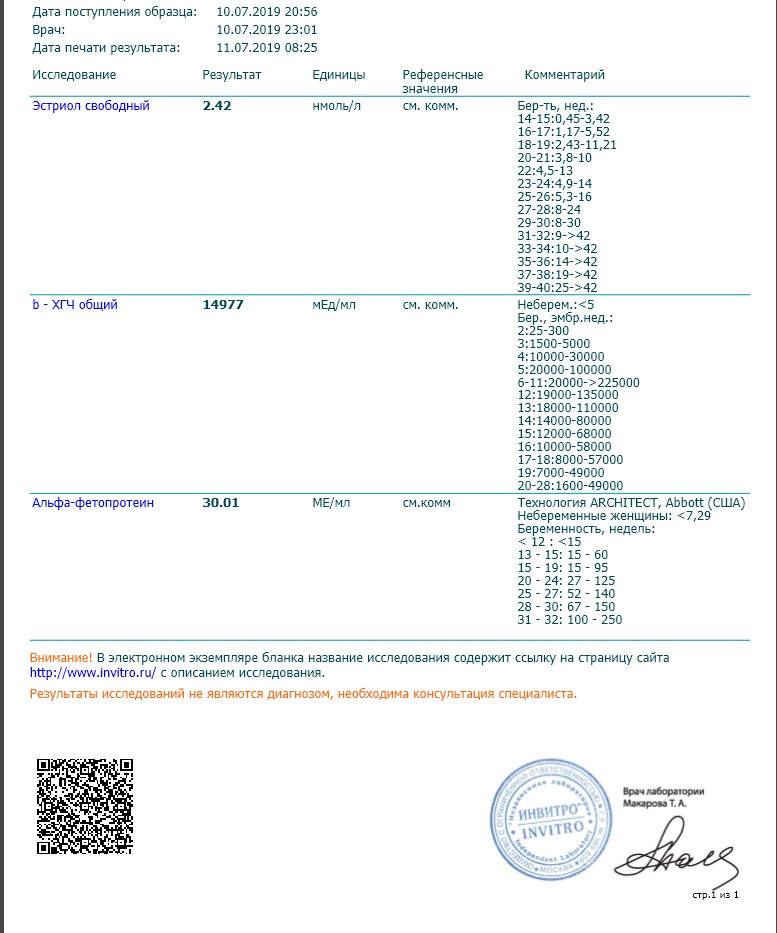
Сдать анализ крови на ХГЧ (хорионический гонадотропин)
Метод определенияХемилюминесцентный иммуноанализ.
Исследуемый материал Сыворотка крови
Специфический гормон беременности.
Гликопротеин — димер с молекулярным весом около 46кДа, синтезирующийся в синтицио-трофобласте плаценты. ХГЧ состоит из двух субъединиц: альфа и бета. Альфа-субъединица идентична с альфа-субъединицами гормонов гипофиза ТТГ, ФСГ и ЛГ. Бета-субъединица (β-ХГЧ), использующаяся для иммунометрического определения гормона — уникальна.Уровень бета-ХГЧ крови уже на 6 — 8 день после зачатия позволяет диагностировать беременность (концентрация β-ХГЧ в моче достигает диагностического уровня на 1 — 2 дня позже, чем в сыворотке крови).
В первом триместре беременности ХГЧ обеспечивает синтез прогестерона и эстрогенов, необходимых для поддержания беременности, жёлтым телом яичника.
Синтез ХГЧ осуществляется клетками трофобласта после имплантации эмбриона и продолжается в течение всей беременности. При нормальном течении беременности, в период между 2 — 5 неделями беременности содержание β-ХГЧ удваивается каждые 1,5 суток. Пик концентрации ХГЧ приходится на 10 — 11 неделю беременности, затем его концентрация начинает медленно снижаться. При многоплодной беременности содержание ХГЧ увеличивается пропорционально числу плодов.

Помимо беременности, ХГЧ используется в лабораторной диагностике в качестве онкомаркёра опухолей трофобластной ткани и герминативных клеток яичников и семенников, секретирующих хорионический гонадотропин.
Что такое ХГЧ?
ХГЧ (хорионический гонадотропин человека) – особый гормон беременности, являющийся важным показателем развития беременности и её отклонений. Хорионический гонадотропин вырабатывают клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки. На основании анализа крови на хорионический гонадотропин врач определяет присутствие в организме хориальной ткани, а значит, и наступление беременности у женщины.
Определение уровня хорионического гонадотропина в крови является наиболее достоверным методом определения беременности на ранних сроках.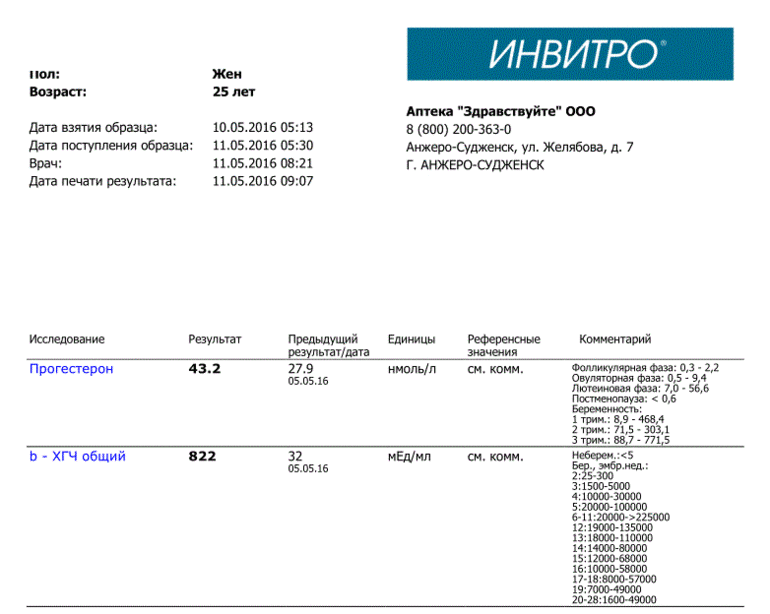 Хорионический гонадотропин появляется в организме женщины c 5- 6 дня с момента оплодотворения. Распространенный экспресс-тест на беременность, которым может воспользоваться каждая женщина в домашних условиях, также основан на определении хорионического гонадотропина в моче, но необходимый уровень данного гормона в моче для диагностирования беременности достигается на несколько дней позже.
Хорионический гонадотропин появляется в организме женщины c 5- 6 дня с момента оплодотворения. Распространенный экспресс-тест на беременность, которым может воспользоваться каждая женщина в домашних условиях, также основан на определении хорионического гонадотропина в моче, но необходимый уровень данного гормона в моче для диагностирования беременности достигается на несколько дней позже.
При отсутствии какой-либо патологии, в первые недели беременности уровень гормона удваивается каждые 2 дня, а максимальная концентрация его достигается к 10-11 неделям беременности. После 11 недели уровень гормона постепенно идет к снижению.
Повышение уровня хорионического гонадотропина при беременности может происходить при:
-
многоплодии;
-
токсикозе, гестозе;
-
сахарном диабете матери;
-
-
неправильно установленном сроке беременности;
-
приеме синтетических гестагенов и т.
 д..
д..
Повышенные значения можно также увидеть в течение недели при сдаче анализа после проведенной процедуры прерывания беременности. Высокий уровень гормона после миниаборта указывает на прогрессирующую беременность.
Низкий уровень хорионического гонадотропина при беременности может означать неправильную постановку срока беременности или быть признаком серьезных нарушений, таких как:
-
внематочная беременность;
-
неразвивающаяся беременность;
-
задержка в развитии плода;
-
угроза самопроизвольного аборта;
-
хроническая плацентарная недостаточность;
-
гибель плода (во II-III триместре беременности).

Определение уровня хорионического гонадотропинавходит в тройной тест-исследование, по результатам которого можно судить о наличии некоторых аномалий развития плода, но точный диагноз поставить нельзя. Исследование лишь позволяет выявить женщин, составляющих группу риска. В этом случае женщинам необходимо будет произвести серьезное дополнительное обследование.
Какова роль гормона ХГЧ в организме человека?
Помимо установления факта наступления беременности, по количественному определению уровня данного гормона можно судить о характере течения беременности, о наличии многоплодной беременности.
Самой важной задачей хорионического гонадотропина является поддержание самой беременности. Под его контролем происходит синтез основных гормонов беременности: эстрогенов и прогестерона. В первом триместре, до полного формирования плаценты (до 16 недель), хорионический гонадотропин поддерживает нормальную функциональную активность желтого тела, а именно, выработку прогестерона.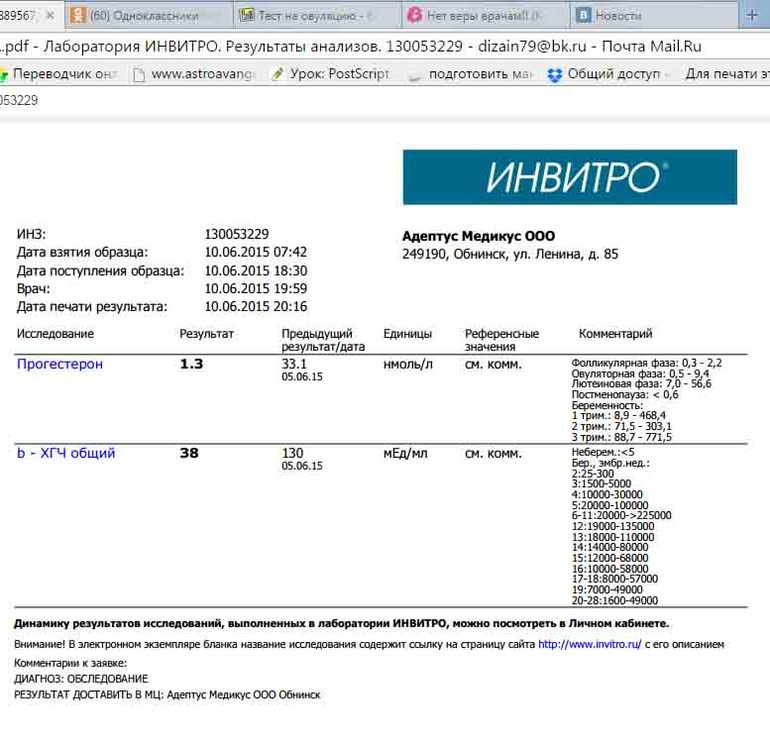
Другая важная функция хорионического гонадотропина заключается в стимуляции овуляции и поддержании жизнеспособности желтого тела.
Когда врач назначает анализ на ХГЧ?
Помимо диагностики ранних сроков беременности, хорионический гонадотропин определяют:
у женщин —
-
для выявления аменореи;
-
исключения возможности внематочной беременности;
-
для оценки полноты искусственного аборта;
-
для динамического наблюдения за беременностью;
-
при угрозе выкидыша и подозрениях на неразвивающуюся беременность;
-
для диагностики опухолей – хорионэпителиомы, пузырного заноса;
-
для пренатальной диагностики пороков развития плода;
у мужчин —
Как правильно сдать анализ крови на гормон ХГЧ?
Независимая лаборатория ИНВИТРО предлагает пройти лабораторное исследование на определение уровня хорионического гонадотропина.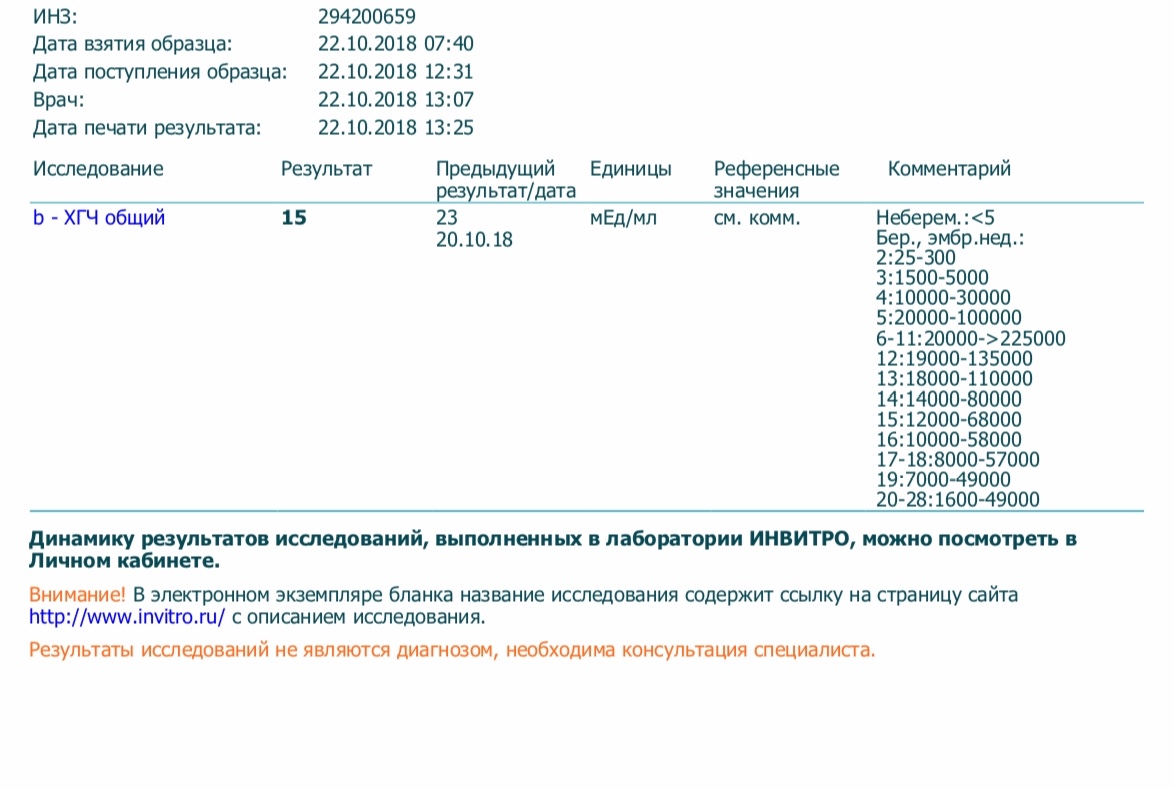
Анализ сдается путем взятия крови из вены, желательно — утром и натощак. Лабораторный тест рекомендуется проводить не ранее 4-5 дней задержки менструации, а также можно повторить через 2-3 дня для уточнения результатов. Для выявления патологии плода у беременных, анализ рекомендуется сдавать с 14 по 18 неделю беременности.
В комплексной диагностике пороков развития плода рекомендуется также сдать анализы на определение следующих маркеров: АФП (альфа-фетопротеин), Е3 (свободный эстриол), а также сделать УЗИ.
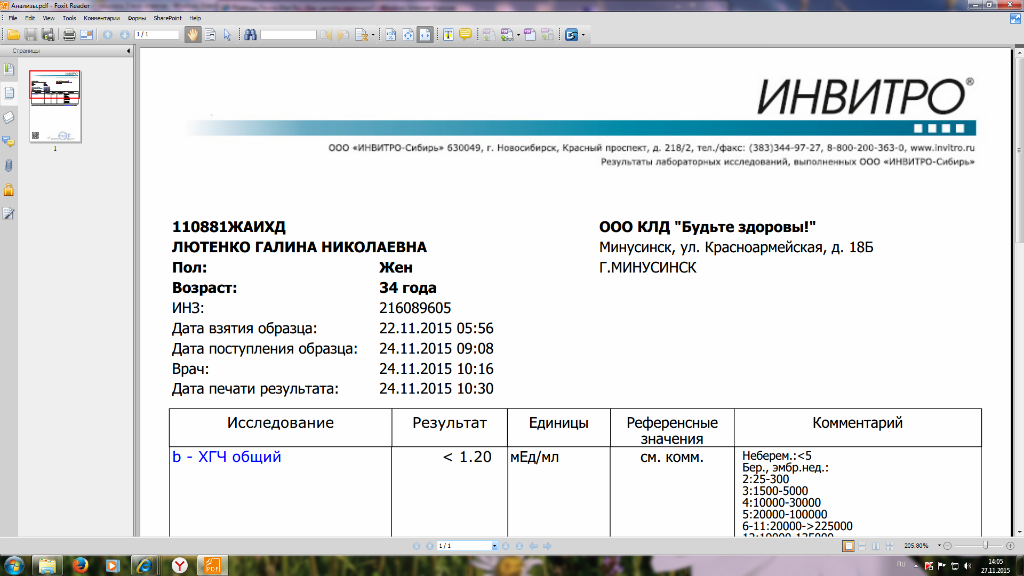
Пределы определения: 1,2 мЕд/мл-1125000мЕд/млСдать анализ крови на ХГЧ (хорионический гонадотропин)
Метод определенияИсследуемый материал Сыворотка крови
Специфический гормон беременности.
Гликопротеин — димер с молекулярным весом около 46кДа, синтезирующийся в синтицио-трофобласте плаценты. ХГЧ состоит из двух субъединиц: альфа и бета. Альфа-субъединица идентична с альфа-субъединицами гормонов гипофиза ТТГ, ФСГ и ЛГ. Бета-субъединица (β-ХГЧ), использующаяся для иммунометрического определения гормона — уникальна.
Уровень бета-ХГЧ крови уже на 6 — 8 день после зачатия позволяет диагностировать беременность (концентрация β-ХГЧ в моче достигает диагностического уровня на 1 — 2 дня позже, чем в сыворотке крови).В первом триместре беременности ХГЧ обеспечивает синтез прогестерона и эстрогенов, необходимых для поддержания беременности, жёлтым телом яичника. ХГЧ действует на жёлтое тело подобно лютеинизирующему гормону, то есть поддерживает его существование. Это происходит до тех пор, пока комплекс «плод-плацента» не приобретет способность самостоятельно формировать необходимый гормональный фон. У плода мужского пола ХГЧ стимулирует клетки Лейдига, синтезирующие тестостерон, необходимый для формирования половых органов по мужскому типу.

Синтез ХГЧ осуществляется клетками трофобласта после имплантации эмбриона и продолжается в течение всей беременности. При нормальном течении беременности, в период между 2 — 5 неделями беременности содержание β-ХГЧ удваивается каждые 1,5 суток. Пик концентрации ХГЧ приходится на 10 — 11 неделю беременности, затем его концентрация начинает медленно снижаться. При многоплодной беременности содержание ХГЧ увеличивается пропорционально числу плодов.
Пониженные концентрации ХГЧ могут говорить об эктопической беременности или угрожающем аборте. Определение содержания ХГЧ в комплексе с другими тестами (альфа-фетопротеином и свободным эстриолом на 15 — 20 неделях беременности, так называемый «тройной тест») используется в пренатальной диагностике для выявления риска отклонений развития плода.
Помимо беременности, ХГЧ используется в лабораторной диагностике в качестве онкомаркёра опухолей трофобластной ткани и герминативных клеток яичников и семенников, секретирующих хорионический гонадотропин.
 Ранняя диагностика беременности: определение уровня ХГЧ
Ранняя диагностика беременности: определение уровня ХГЧЧто такое ХГЧ?
ХГЧ (хорионический гонадотропин человека) – особый гормон беременности, являющийся важным показателем развития беременности и её отклонений. Хорионический гонадотропин вырабатывают клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки. На основании анализа крови на хорионический гонадотропин врач определяет присутствие в организме хориальной ткани, а значит, и наступление беременности у женщины.
Когда можно проводить исследование на определение уровня ХГЧ?
Определение уровня хорионического гонадотропина в крови является наиболее достоверным методом определения беременности на ранних сроках. Хорионический гонадотропин появляется в организме женщины c 5- 6 дня с момента оплодотворения. Распространенный экспресс-тест на беременность, которым может воспользоваться каждая женщина в домашних условиях, также основан на определении хорионического гонадотропина в моче, но необходимый уровень данного гормона в моче для диагностирования беременности достигается на несколько дней позже.
При отсутствии какой-либо патологии, в первые недели беременности уровень гормона удваивается каждые 2 дня, а максимальная концентрация его достигается к 10-11 неделям беременности. После 11 недели уровень гормона постепенно идет к снижению.
Повышение уровня хорионического гонадотропина при беременности может происходить при:
-
многоплодии;
-
токсикозе, гестозе;
-
сахарном диабете матери;
-
патологиях плода, синдроме Дауна, множественных пороках развития;
-
неправильно установленном сроке беременности;
-
приеме синтетических гестагенов и т. д..
Повышенные значения можно также увидеть в течение недели при сдаче анализа после проведенной процедуры прерывания беременности.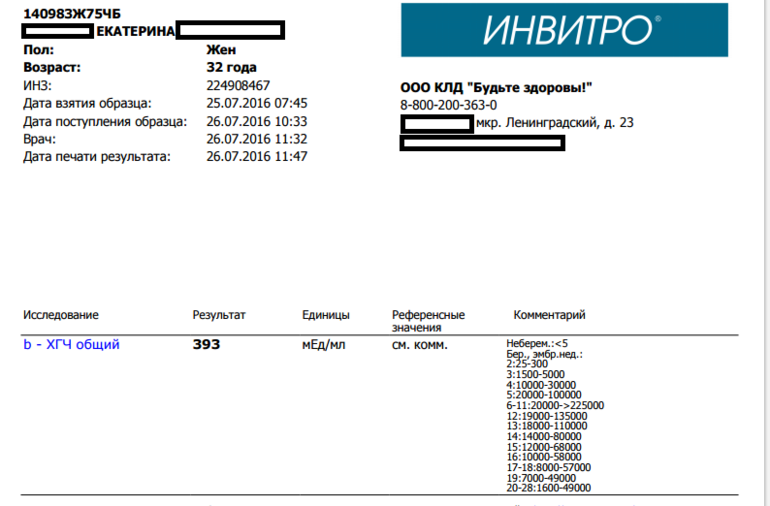 Высокий уровень гормона после миниаборта указывает на прогрессирующую беременность.
Высокий уровень гормона после миниаборта указывает на прогрессирующую беременность.
Низкий уровень хорионического гонадотропина при беременности может означать неправильную постановку срока беременности или быть признаком серьезных нарушений, таких как:
-
внематочная беременность;
-
неразвивающаяся беременность;
-
задержка в развитии плода;
-
угроза самопроизвольного аборта;
-
хроническая плацентарная недостаточность;
-
гибель плода (во II-III триместре беременности).
Определение уровня хорионического гонадотропинавходит в тройной тест-исследование, по результатам которого можно судить о наличии некоторых аномалий развития плода, но точный диагноз поставить нельзя. Исследование лишь позволяет выявить женщин, составляющих группу риска. В этом случае женщинам необходимо будет произвести серьезное дополнительное обследование.
Исследование лишь позволяет выявить женщин, составляющих группу риска. В этом случае женщинам необходимо будет произвести серьезное дополнительное обследование.
Какова роль гормона ХГЧ в организме человека?
Помимо установления факта наступления беременности, по количественному определению уровня данного гормона можно судить о характере течения беременности, о наличии многоплодной беременности.
Самой важной задачей хорионического гонадотропина является поддержание самой беременности. Под его контролем происходит синтез основных гормонов беременности: эстрогенов и прогестерона. В первом триместре, до полного формирования плаценты (до 16 недель), хорионический гонадотропин поддерживает нормальную функциональную активность желтого тела, а именно, выработку прогестерона.
Другая важная функция хорионического гонадотропина заключается в стимуляции овуляции и поддержании жизнеспособности желтого тела.
Когда врач назначает анализ на ХГЧ?
Помимо диагностики ранних сроков беременности, хорионический гонадотропин определяют:
у женщин —
-
для выявления аменореи;
-
исключения возможности внематочной беременности;
-
для оценки полноты искусственного аборта;
-
для динамического наблюдения за беременностью;
-
при угрозе выкидыша и подозрениях на неразвивающуюся беременность;
-
для диагностики опухолей – хорионэпителиомы, пузырного заноса;
-
для пренатальной диагностики пороков развития плода;
у мужчин —
Как правильно сдать анализ крови на гормон ХГЧ?
Независимая лаборатория ИНВИТРО предлагает пройти лабораторное исследование на определение уровня хорионического гонадотропина.
Анализ сдается путем взятия крови из вены, желательно — утром и натощак. Лабораторный тест рекомендуется проводить не ранее 4-5 дней задержки менструации, а также можно повторить через 2-3 дня для уточнения результатов. Для выявления патологии плода у беременных, анализ рекомендуется сдавать с 14 по 18 неделю беременности.
В комплексной диагностике пороков развития плода рекомендуется также сдать анализы на определение следующих маркеров: АФП (альфа-фетопротеин), Е3 (свободный эстриол), а также сделать УЗИ.
Тест на ХГЧ / «www.womanstreet.ru»
ноябрь 2011 годаАвтор – Нона Овсепян, врач-консультант Независимой лаборатории ИНВИТРО
Тест на ХГЧ – одно из важнейших лабораторных исследований, обязательных во время беременности. Что же это за анализ и зачем он проводится?
Чтобы подтвердить зачатие. Тест на ХГЧ способен точно установить, что беременность наступила, уже на 5-6 день после зачатия. Это намного раньше и, главное, намного надежнее, чем обычные экспресс-тесты. Дело в том, что ХГЧ (хорионический гонадотропин человека) – это особый гормон беременности, который вырабатывается клетками хориона (оболочки зародыша) сразу после его прикрепления к стенке матки. Активный синтез этого гормона необходим для сохранения плода. Обычный экспресс-тест на беременность также основывается на определении содержания ХГЧ, но в моче. Однако на ранних сроках уровень гормона в моче зачастую недостаточен для того, чтобы экспресс-тест дал положительный результат. Гораздо быстрее и точнее можно установить факт беременности по уровню ХГЧ в крови.
Это намного раньше и, главное, намного надежнее, чем обычные экспресс-тесты. Дело в том, что ХГЧ (хорионический гонадотропин человека) – это особый гормон беременности, который вырабатывается клетками хориона (оболочки зародыша) сразу после его прикрепления к стенке матки. Активный синтез этого гормона необходим для сохранения плода. Обычный экспресс-тест на беременность также основывается на определении содержания ХГЧ, но в моче. Однако на ранних сроках уровень гормона в моче зачастую недостаточен для того, чтобы экспресс-тест дал положительный результат. Гораздо быстрее и точнее можно установить факт беременности по уровню ХГЧ в крови.
Чтобы определить точный срок беременности. Очень часто будущая мама не может назвать точную дату зачатия или же называет ее, но неправильно. Вместе с тем информация о точном сроке необходима для тщательного контроля за внутриутробным развитием плода. Каждому сроку соответствуют определенные нормативные показатели роста и развития, отклонения от которых могут свидетельствовать о возникновении различных осложнений. Кроме того, знание срока беременности помогает наиболее точно установить предполагаемую дату родов. Это необходимо, если женщине нужна дородовая госпитализация, для предоставления отпуска и по многим другим причинам.
Кроме того, знание срока беременности помогает наиболее точно установить предполагаемую дату родов. Это необходимо, если женщине нужна дородовая госпитализация, для предоставления отпуска и по многим другим причинам.
Чтобы контролировать развитие плода. Тест на ХГЧ — важный показатель развития плода, а также наличия или отсутствия отклонений. По уровню ХГЧ можно судить о характере течения беременности, локализации плода, наличии многоплодной беременности. В норме концентрация ХГЧ в организме беременной женщины постоянно растет, достигая максимума к 10-11 неделям. После 11 недель беременности уровень ХГЧ постепенно снижается, его концентрация постепенно уменьшается в 2-3 раза, после чего уровень гормона остается неизменным вплоть до конца беременности.
Низкий уровень ХГЧ при беременности может означать или неправильно установленный срок, или стать признаком серьезных нарушений (неразвивающаяся, внематочная беременность, хроническая плацентарная недостаточность, задержка развития плода).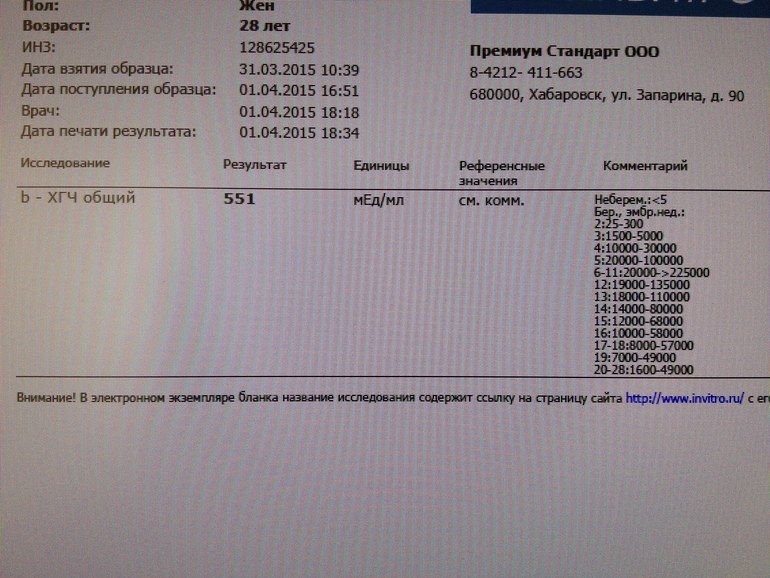
Повышение уровня ХГЧ может служить признаком многоплодной беременности, гестоза, сахарного диабета, гестационного диабета. Но главная проблема, возможная при повышении уровня ХГЧ, — развитие множественных пороков плода. Поэтому в течение беременности проводятся как минимум два обязательных скрининговых исследования на уровень ХГЧ – в первом (11-12 недель) и втором (16-20 недель) триместрах беременности. Это необходимо для оценки риска хромосомных аномалий плода (синдром Дауна, синдром Эдвардса, дефекты нервной трубки). Если результаты сомнительны или же выявлен повышенный риск хромосомных патологий, беременной рекомендуется пройти дальнейшее обследование для уточнения диагноза.
Важно. Анализ крови для теста на ХГЧ рекомендуется сдавать натощак. Желательно, чтобы между последним приемом пищи и взятием крови был интервал не менее 8 часов. В это время можно пить только воду.
Анализ крови на онкомаркеры: когда и кому следует проходить эту диагностическую процедуру?
Доступность медицинского обслуживания и информации дают положительные результаты: все больше запорожцев задумываются о регулярном контроле за состоянием своего здоровья. В связи с высоким уровнем онкозаболеваний, которые часто выявляются уже на поздних стадиях, людей нередко охватывает тревога: к какому специалисту обращаться, чтобы пройти диагностику вовремя? Не зря психологи все чаще говорят о такой патологии как канцерофобия – боязнь онкологических заболеваний. На этом этапе многие узнают о возможности сдать кровь на онкомаркеры. Что это за вид лабораторной диагностики и в каких случаях применяется, мы бы и хотели рассказать.
В связи с высоким уровнем онкозаболеваний, которые часто выявляются уже на поздних стадиях, людей нередко охватывает тревога: к какому специалисту обращаться, чтобы пройти диагностику вовремя? Не зря психологи все чаще говорят о такой патологии как канцерофобия – боязнь онкологических заболеваний. На этом этапе многие узнают о возможности сдать кровь на онкомаркеры. Что это за вид лабораторной диагностики и в каких случаях применяется, мы бы и хотели рассказать.
Начнем с того, что онкомаркеры – это белковые вещества, которые продуцируются и выбрасываются в кровь раковыми клетками. То есть, это своеобразные «метки», позволяющие выявить наличие злокачественных новообразований в организме.
Существует более 20 онкомаркеров, о которых в Европе было известно еще в 80-ых. Принято считать, что открыты они были еще в 1845 году.
Присутствие их в крови – норма, если показатель не переступает допустимое пороговое значение.
Самый известный из онкомаркеров – ПСА (общий и свободный) или простатический специфический антиген, позволяющий на ранней стадии выявить злокачественное заболевание предстательной железы. Именно поэтому ежегодно сдавать кровь на ПСА урологи и андрологи рекомендуют всем мужчинам после 40. Пугаться результатов до консультации со специалистом не стоит, ведь повышение уровня этого маркера в крови может быть так же связано с острым воспалительным процессом, аденомой или даже физиотерапевтическими процедурами, например, массажем простаты.
Именно поэтому ежегодно сдавать кровь на ПСА урологи и андрологи рекомендуют всем мужчинам после 40. Пугаться результатов до консультации со специалистом не стоит, ведь повышение уровня этого маркера в крови может быть так же связано с острым воспалительным процессом, аденомой или даже физиотерапевтическими процедурами, например, массажем простаты.
Повышение ХГЧ (хорионического гонадотропина человека), альфа-фетопротеина и маркера Сa 125 может сигнализировать о раке яичка или яичника. Однако, как и в случае с ПСА, причиной повышения этих онкомаркеров может служить наличие доброкачественной опухоли.
Также в сыворотки крови можно выявить «метки» рака поджелудочной железы, желудка, печени.
Данную лабораторную диагностику применяют и в процессе терапии, чтобы определить ее эффективность и не пропустить рецидив. Пациентам, которым удаляли опухоль, рекомендуют проходить онкоскрининг каждые 3-4 месяца. Таким образом, анализ используют не только с диагностической, но и с мониторинговой целью. Назначают анализ на онкомаркеры и во время химиотерапии. В этом случае резкий скачок уровня онкомаркеров указывает на распад опухоли.
Назначают анализ на онкомаркеры и во время химиотерапии. В этом случае резкий скачок уровня онкомаркеров указывает на распад опухоли.
В первую очередь, анализ на онкомаркеры показан людям с наследственной предрасположенностью к онкозаболеваниям и тем, кто по той или иной причине, находится в группе риска – является курильщиком с многолетним стажем, страдает от алкогольной зависимости, работает на вредном производстве.
Кровь на онкомаркеры сдают из вены натощак. При сдаче анализа на ПСА накануне не следует проходить трансуретральную биопсию, ректальное пальцевое исследование или колоноскопию. За два часа до процедуры не рекомендуется курить. Женщинам лучше не сдавать анализ во время менструации, так как показатель может быть повышен.
В любом случае, перед тем, как сдавать этот анализ, оптимальным решением будет получить консультацию специалиста, который подтвердит или опровергнет необходимость данного вида диагностики, а также назначит другие, уточняющие диагноз, обследования. А главное, получив результаты анализов на руки, не спешите самостоятельно расшифровывать их результаты, находя показатели нормы в интернете, доверьте это профессионалу: такой подход поможет сохранить Ваши нервы.
А главное, получив результаты анализов на руки, не спешите самостоятельно расшифровывать их результаты, находя показатели нормы в интернете, доверьте это профессионалу: такой подход поможет сохранить Ваши нервы.
норма, расшифровка, инвитро, у детей, 32 показателя
Основу протеинового белка составляют аминокислоты — органические соединения в организме человека. Для выявления проблем с функционированием печени и почек, необходимо провести анализ крови на аминокислоты, так как нарушенный аминокислотный обмен приводит к заболеваниям этих органов. Степень усвоения белка в крови и метаболический дисбаланс устанавливается путем проведения анализа 20 аминокислот.
Признаки нарушения
Следующее сочетание симптомов у детей и взрослых, являются признаками нарушения аминокислотного обмена:
Некоторые аминокислоты синтезируются в организме, а некоторые поставляются с потреблением пищи.
Типы
Аланин.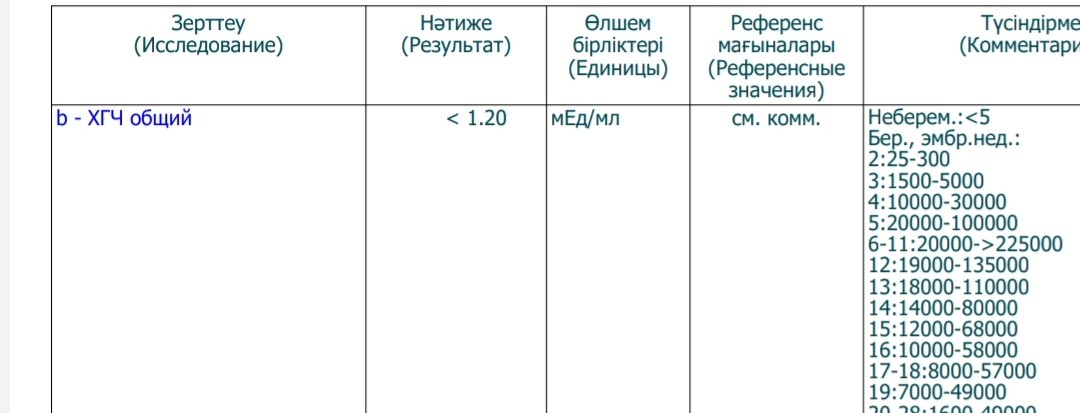 С помощью аминокислоты аланина центральная нервная система и головной мозг получают энергию. Аланин участвует в метаболизме органических кислот и сахаров, а также вырабатывает антитела в крови, что способствует укреплению иммунитета. Кроме того, из данного типа аминокислот может вырабатываться глюкоза, то есть регуляция уровня сахара в крови проходит с участием аланина.
С помощью аминокислоты аланина центральная нервная система и головной мозг получают энергию. Аланин участвует в метаболизме органических кислот и сахаров, а также вырабатывает антитела в крови, что способствует укреплению иммунитета. Кроме того, из данного типа аминокислот может вырабатываться глюкоза, то есть регуляция уровня сахара в крови проходит с участием аланина.
Аргинин. Это заменимая аминокислота, с помощью которой из организма человека выводится конечный азот.
Аспаргиновая кислота. Содержится в белковом составе. При увеличении ее концентрации в моче, возникает дикарбоксильная аминоацидурия.
Глутаминовая кислота. Глутаминовая аминокислота выполняет в организме множество функций, среди которых участие в обмене белками и углеводами, стимулирование окислительных процессов, повышение устойчивости организма к гипоксии (кислородное голодание), нормализация обмена веществ.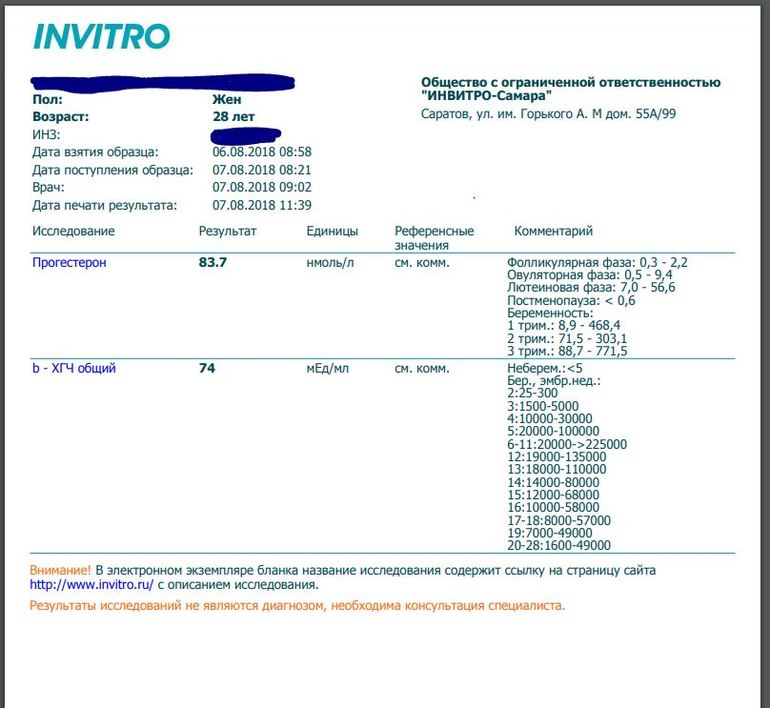 Она способствует выведению токсинов и аммиака из организма.
Она способствует выведению токсинов и аммиака из организма.
Глицин. В ЦНС протекают процессы возбуждения и торможения. За нормальное функционирование этих процессов отвечает глицин. Он способствует улучшению умственной работоспособности, а также помогает человеку справиться со стрессом.
Треонин. Треонин способствует стимуляции иммунной системы, улучшает энергообсеспечение. К его функциям относится обезвреживание аммиака.
Метионин. Дезинтоксикация ксенобиотиков протекает с помощью метионина. Гормоны, витамины, белки и ферменты в крови активируются благодаря метионину.
Тирозин. Синтез тирозина может протекать в организме. Он является незаменимой аминокислотой. Повышенное содержание тирозина в крови говорит о возможном сепсисе.
Валин. Синтез роста тканей тела невозможен без валина. Он способствует стимуляции координации, улучшает умственную деятельность и активность. Поврежденные ткани восстанавливаются благодаря валину, также с его участием протекает метаболизм в мышцах.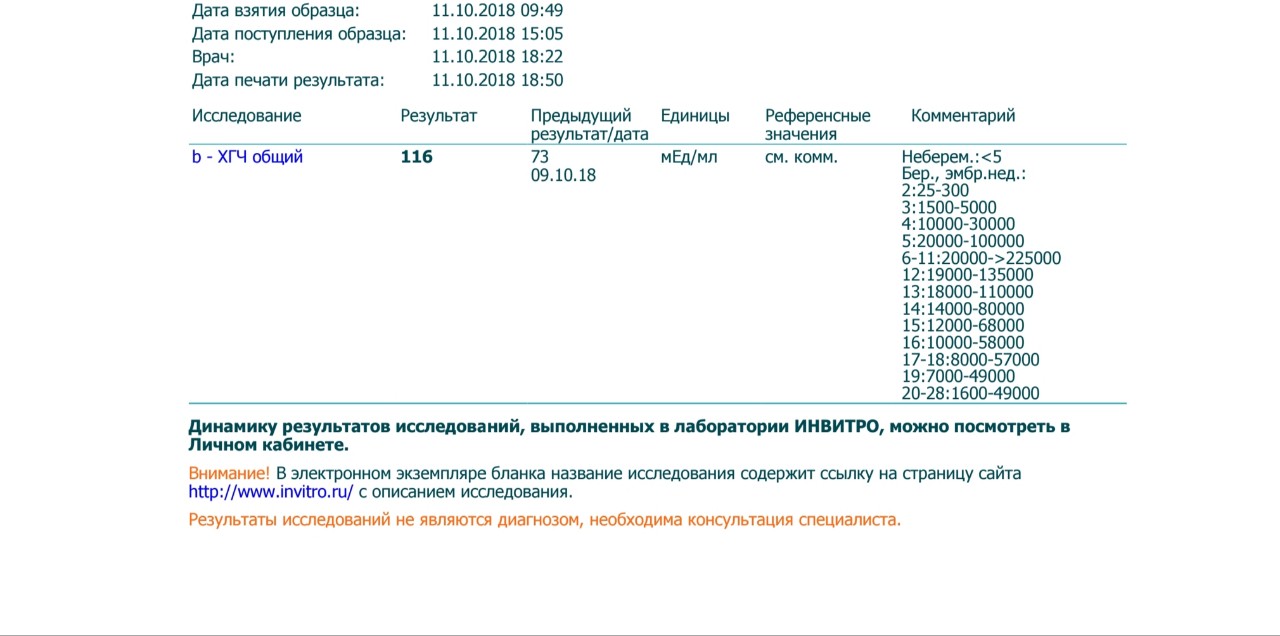
Фенилаланин. Аминокислота фенилаланина способствует улучшению памяти и способности к обучению. Фенилаланин способен уменьшить боль и подавить аппетит. Он также оказывает влияние на настроение.
Лейцин и изолейцин. Лейцин и изолейцин это аминоксилоты, действуя вместе, служат источниками энергии. Еще одной их функцией является защита мышечных тканей. На психическую устойчивость и физическую выносливость влияет изолицейн. Без него невозможна выработка гемоглобина в крови. Он также осуществляет регуляцию уровня сахара в крови и занимает важное место при проблемах с психикой и физических нагрузках. Лейцин отвечает за восстановление кожи, мышц, костей, так как вырабатывает гормон роста.
Диагностика
Далее приведен список болезней и соответствующие характеристики из расшифровки анализа крови на аминокислоты:
Таблица нормы аминокислот- Болезнь Кушинга – повышенное содержание аланинина;
- Подагра – повышенное содержание аланинина, повышенный уровень глутаминовой кислоты, пониженное содержание глицина;
- Сахарный диабет – пониженное содержание глицина;
- Белковая непереносимость – повышенное содержание аланинина;
- Кеотическая гипогликемия – недостаток аланина;
- Хроническая почечная недостаточность – недостаток аланина, аргинина, глутаминовой кислоты, тирозина, повышенное содержание глицина;
- Гиперинсулинемия 2 типа – высокий уровень аргинина;
- Ревматоидный артрит – недостаток аргинина, тирозина, повышенный уровень глутаминовой кислоты;
- Дикарбоксильная аминоацидурия – повышенная концентрация аспаргиновой кислоты в моче;
- Рак поджелудочной – повышенный уровень глутаминовой кислоты;
- Гипераммониемия 1 типа – повышенное содержание глицина;
- Гипогликемия при сахарном диабете – повышенное содержание глицина;
- Тяжелые ожоги – повышенное содержание глицина;
- Голодание – повышенное содержание глицина, валина.

- Нарушение толерантности к белку – повышенный уровень треонина;
- Болезни печени – повышенный уровень треонина, метионина;
- Дефицит пируват-карбоксилазы – повышенный уровень треонина;
- Интоксикация аммонием – повышенный уровень треонина;
- Гомоцистинурия – повышенный уровень треонина;
- Карциноидный синдром – повышенный уровень треонина;
- Гомоцистинурия – пониженный уровень треонина;
- Нарушение белкового питания – пониженный уровень треонина, повышенный уровень валина;
- Сепсис крови – повышенный уровень тирозина, фенилаланина;
- Микседема – пониженный уровень тирозина;
- Гипотиреоидизм — пониженный уровень тирозина;
- Поликистоз почек — пониженный уровень тирозина;
- Гипотермия – пониженный уровень тирозина;
- Фенилкетонурия – пониженный уровень тирозина, повышенное содержание фенилаланина;
- Карциноидный синдром – пониженный уровень тирозина, повышенный уровень валина;
- Печеночная энцефалопатия – недостаток валина (также свидетельствует о нарушении координации, повышенной чувствительности кожи к раздражителям), повышенное содержание фенилаланина;
- Преходящая тирозинемия новорожденных – повышенное содержание фенилаланина;
- Вирусный гепатит — повышенное содержание фенилаланина;
- Гиперфенилаланинемия — повышенное содержание фенилаланина.

Отклонения от нормы анализа крови на аминокислоты являются поводом для беспокойства.
По мнению врачей, следующим группам людей необходимо делать анализ крови на аминокислоты (32 показателя):
- младенцы;
- вегетарианцы и люди, придерживающиеся диет;
- спортсмены и люди, испытывающие повышенную физическую нагрузку.
Процедура сдачи анализа
Анализ крови на аминокислоты можно сдать во многих клиниках. Перед сдачей аминокислотного анализа нельзя принимать пищу в течение 4 часов. Забор крови у грудничка проводится из пятки. Возможно образование гематомы. Срок выполнения анализа составляет около 16 дней.
Анализ крови на аминокислоты для детей имеет большое значение, так как помогает своевременно выявить проблемы со здоровьем и приступить к лечению.
Анализ крови на аминокислоты и ацилкарнитины проводится с целью выявления наследственных болезней. Чем раньше обнаружится патология, тем больше вероятность предотвращения тяжелых заболеваний.
измерений ХГЧ после ЭКО | Блог InVia Fertility
Тест на беременность в цикле ЭКО обычно назначается примерно через две недели после переноса эмбриона. Это включает анализ крови для определения гормона беременности — ХГЧ (хорионический гонадотропин человека). В случае положительного результата (более 5 мМЕ / мл) тест повторяют через два дня, и он должен соответственно повыситься. Первоначальные исследования показали, что при естественном зачатии увеличение количества беременностей за 2 дня должно составлять не менее 66%. Считалось, что медленный рост связан с аномальной внутриутробной беременностью или трубной беременностью.Более поздние исследования показали, что рост может быть медленным, до 53% за 2 дня, и беременность все еще может протекать нормально.
А как насчет беременности при ЭКО? Применяются ли те же правила или мы должны использовать разные критерии для этих беременностей? Доктор Беата Э. Сибер (из Медицинского университета Инсбрука, Инсбрук, Австрия) обсудила именно этот вопрос в недавней статье в журнале «Фертильность и бесплодие». Ниже приведены некоторые из важных моментов, представленных в документе.
Сибер (из Медицинского университета Инсбрука, Инсбрук, Австрия) обсудила именно этот вопрос в недавней статье в журнале «Фертильность и бесплодие». Ниже приведены некоторые из важных моментов, представленных в документе.
- Уровни ХГЧ, определенные через 13-15 дней после оплодотворения, выше у беременных от эмбрионов на стадии дробления на 3-й день, чем уровни, достигнутые при переносе бластоцист на 5-й день.Тем не менее, процент увеличения серийного измерения ХГЧ не различается между этими группами.
- Один уровень ХГЧ не может использоваться для различения выкидыша и внематочной беременности.
- Сочетание уровней ХГЧ на 15 и 22 день после переноса эмбриона может предсказать исход беременности. Когда уровень ХГЧ на 15-й день составлял ≥150 мМЕ / мл и соотношение ХГЧ на 22-й день / ХГЧ на 15-й день было ≥15 со специфичностью 94% и чувствительностью 47% для нормальной беременности. И наоборот, когда ХГЧ на 15-й день был ниже 150 мМЕ / мл и соотношение ХГЧ на 22-й день / ХГЧ на 15-й день было ниже 15, вероятность ненормальной беременности составляла 84%.

- Не существует единого уровня ХГЧ, определяющего нормальную беременность. Тем не менее, значение составляет повышения уровня ХГЧ. Чем выше процент повышения уровня ХГЧ, полученного через 2 дня после исходного значения, тем лучше показатель живого родоразрешения.
- По сравнению со спонтанными беременностями, среднее время удвоения уровня ХГЧ при беременностях с ЭКО, по-видимому, одинаково (около 1,5 дней).
- У пациентов с синдромом гиперстимуляции яичников (СГЯ) следует осторожно интерпретировать уровни ХГЧ.У этих пациентов часто есть жидкость, которая перемещается из кровеносных сосудов в брюшную полость, вызывая концентрацию крови. Когда вводятся жидкости внутривенно, уровни в крови могут понижаться, что приводит к колебаниям в уровнях ХГЧ. Часто можно увидеть ровный или ненормальный рост уровня ХГЧ у этих пациентов только для того, чтобы показать нормальный рост, когда СГЯ стабилизируется.
- А как насчет беременности двойней и тройней? Они чаще встречаются при ЭКО и поэтому заслуживают особого обсуждения.
 Начальный уровень ХГЧ выше при многоплодной беременности, чем при одиночной.Но скорость роста одинакова для обеих групп.
Начальный уровень ХГЧ выше при многоплодной беременности, чем при одиночной.Но скорость роста одинакова для обеих групп.
часто используются в сочетании с ультразвуком для подтверждения диагноза нормальной или аномальной беременности. На очень ранних сроках беременности уровень ХГЧ является основным диагностическим инструментом. На более поздних сроках беременности ультразвуковое исследование и клиническое обследование часто используются в сочетании с определением уровня ХГЧ.
Чтобы обратиться к специалисту по фертильности, который является сертифицированным врачом с отличными показателями успешности, запишитесь на прием в одну из четырех клиник репродуктивного здоровья InVia в Чикаго.
Значение уровней бета-хорионического гонадотропина человека после переноса на 12-й день для прогнозирования исходов беременности циклов интрацитоплазматической инъекции сперматозоидов
Balkan Med J. 2017 Сентябрь; 34 (5): 450–457.
Инджи Кахьяоглу
1 Отделение акушерства и гинекологии, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
Берфу Демир
1 Отделение акушерства и гинекологии, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
Сезин Эртюрк Аксакал
1 Отделение акушерства и гинекологии, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
Искендер Капланоглу
2 Центр вспомогательной репродукции, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
Лейла Молламахмутоглу
1 Отделение акушерства и гинекологии, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
1 Отделение акушерства и гинекологии, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
2 Центр вспомогательной репродукции, Университет медицинских наук, Ankara Etlik Zübeyde Hanım Женский медицинский учебный и исследовательский госпиталь, Анкара, Турция
* Адрес для корреспонденции: Отделение акушерства и гинекологии, Университет медицинских наук, Анкара Этлик Зубейде Ханым Женская медицинская клиника, Анкара, Турция GSM: +90 505 884 33 21 Эл. Почта: moc.liamg @ ulgoayhakicnidm
Почта: moc.liamg @ ulgoayhakicnidmПоступило в редакцию 12 декабря 2016 г .; Принято 8 апреля 2017 г.
© Copyright 2017, Медицинский факультет Университета ТракьяBalkan Medical Journal
Эта статья цитируется другими статьями в PMC.Abstract
Предпосылки:
Несколько маркеров были изучены ранее, чтобы предсказать исход беременности при вспомогательных репродуктивных технологиях; однако было обнаружено, что бета-хорионический гонадотропин человека в сыворотке крови является наиболее прогностическим маркером.
Цели:
Оценить значение сывороточных уровней бета-хорионического гонадотропина человека при различении биохимических и клинических беременностей через 12 дней после переноса эмбриона, при этом определение факторов, предсказывающих продолжающуюся беременность, было установлено в качестве вторичной цели.
Дизайн исследования:
Ретроспективное поперечное исследование.
Методы:
Всего было ретроспективно проанализировано 445 беременных циклов в 2359 циклах переноса эмбрионов. По исходу беременности пациенты были разделены на две группы: биохимическую и клиническую.
По исходу беременности пациенты были разделены на две группы: биохимическую и клиническую.
Результаты:
Пороговое значение уровней бета-хорионического гонадотропина человека на 12-й день при прогнозировании клинической беременности составило 86,8 МЕ / мл с чувствительностью 65,1% и 74.Специфичность 7% [ДИ: 0,76 (0,71-0,81). Анализ кривой рабочих характеристик приемника выявил различные пороговые значения для дней переноса эмбриона (57 мМЕ / мл для переноса эмбриона на 3 день, ДИ: 0,59–0,79 и 87 мМЕ / мл для переноса эмбриона на 5 день, ДИ: 0,74–0,86). Подгрупповой анализ клинических беременностей выявил значительную разницу между продолжающейся беременностью и ранней потерей плода в отношении продолжительности бесплодия (81,3 ± 54,4 против 100,2 ± 62,2 месяца), эстрадиола в сыворотке крови в день ХГЧ (2667,4 ± 1276,4 против 2094.6 ± 1260,5 пг / мл), количество перенесенных эмбрионов (1,9 ± 0,8 против 1,5 ± 0,7) и распространенность сниженного овариального резерва в качестве показателя (2,3% против 12,2%).
Заключение:
Уровни бета-хорионического гонадотропина человека на 12-й день после переноса эмбриона являются важным параметром для прогнозирования клинической беременности; однако другие параметры стимуляции указываются при прогнозировании продолжающейся беременности.
Ключевые слова: Бета хорионический гонадотропин человека, интрацитоплазматическая инъекция спермы, клиническая беременность, текущая беременность
Бесплодие считается одним из самых серьезных источников стресса в жизни пациента (1) и рассматривается как психологическая травма. большинство пар (2).Самый высокий уровень стресса, который испытывает пациентка, демонстрируется на этапе теста на беременность (3). Более того, временной интервал после теста и подтверждения жизнеспособной внутриутробной беременности с помощью ультразвукового исследования 46% пациенток считают чрезвычайно или очень стрессовым (4). Учитывая повышенный риск потери беременности на ранних сроках при вспомогательной репродуктивной помощи по сравнению со спонтанной беременностью (5), этот временной интервал можно считать эмоционально сложным периодом для пар.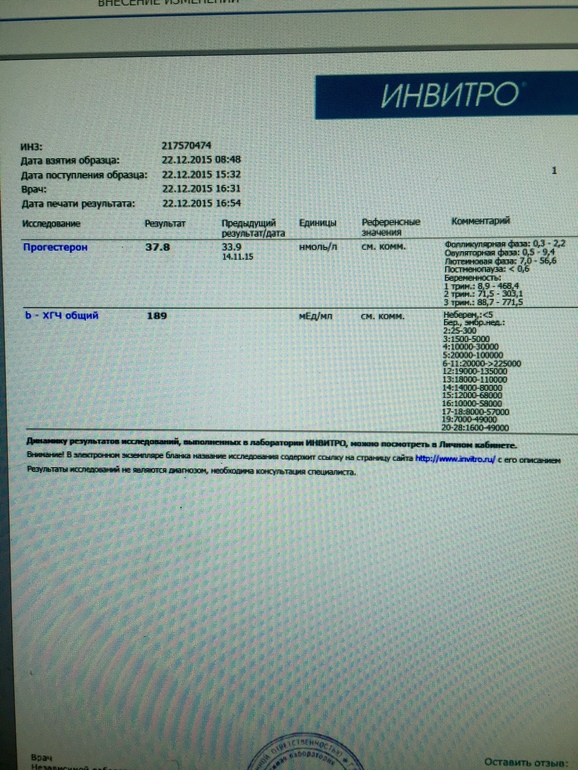 Следовательно, раннее прогнозирование исхода беременности имеет большое значение для пациенток, чтобы подготовить их к неблагоприятному исходу беременности, а также для врача, чтобы консультировать и вести пациентку соответствующим образом.
Следовательно, раннее прогнозирование исхода беременности имеет большое значение для пациенток, чтобы подготовить их к неблагоприятному исходу беременности, а также для врача, чтобы консультировать и вести пациентку соответствующим образом.
Несколько маркеров были изучены ранее для прогнозирования исхода беременности при беременности с экстракорпоральным оплодотворением (ЭКО), такие как сывороточный эстрадиол, прогестерон (6), CA-125 (7) или ингибин (8). Тем не менее, бета-хорионический гонадотропин человека (β-ХГЧ) оказался наиболее прогностическим маркером (9,10,11,12,13).Показана прямая корреляция между уровнем β-ХГЧ после имплантации и исходом беременности (9,10,12,13,14). Низкий уровень β-ХГЧ в сыворотке крови на ранних сроках беременности предсказывает неблагоприятный исход беременности (9,15,16,17,18,19,20,21,22).
Основная цель этого исследования состояла в том, чтобы оценить значение сывороточных уровней β-ХГЧ при различении биохимических и клинических беременностей через 12 дней после переноса эмбриона (ЭТ) и определить факторы, позволяющие определить, была ли продолжающаяся беременность вторичной целью. Эти результаты были предназначены для улучшения консультирования пациентов путем предоставления надежной прогностической информации и уменьшения беспокойства пациента.
Эти результаты были предназначены для улучшения консультирования пациентов путем предоставления надежной прогностической информации и уменьшения беспокойства пациента.
МАТЕРИАЛЫ И МЕТОДЫ
Была проведена ретроспективная проверка компьютерной базы данных о 2359 циклах ЭКО, проведенных с марта 2007 г. по май 2014 г. в клинике ЭКО третичного учебно-исследовательского госпиталя. В исследование были включены циклы ЭТ с доступными данными об уровнях сывороточного β-ХГЧ через 12 дней после ЭТ. Критерии исключения были определены следующим образом: циклы замороженных-размороженных эмбрионов, циклы с отменой ЭТ из-за неудачного оплодотворения, неудачного дробления и циклов, потерянных для последующего наблюдения.Уменьшение резерва яичников определялось возрастом матери в возрасте 40 лет или старше, предыдущим плохим ответом яичников с тремя или менее ооцитами, полученными при традиционной стимуляции, количеством антральных фолликулов (AFC) ниже 7 фолликулов или AMH ниже 1,1 нг / мл. Бесплодие по мужскому фактору определялось на основании анализа спермы; азооспермия, тяжелая олигозооспермия (<5x106 / мл) и ретроградная эякуляция рассматривались как показания для вспомогательных репродуктивных технологий (ВРТ). В начале исследования было получено одобрение наблюдательного совета учреждения (Университет медицинских наук, Анкара, Этлик Зубейде Ханым, Женский медицинский учебный и исследовательский госпиталь, номер 27.02.2014 / 171). Информированное согласие было получено у всех пациентов. Уровни β-ХГЧ в сыворотке крови через 12 дней после ЭТ, демографические характеристики [возраст, индекс массы тела, базальная сыворотка фолликулостимулирующего гормона (ФСГ), общая АФК, продолжительность бесплодия, причина бесплодия], параметры контролируемой стимуляции яичников и данные эмбриологии сравнивались между биохимическая и клиническая беременность. Также были проанализированы факторы, влияющие на текущую беременность и раннюю потерю плода.
Бесплодие по мужскому фактору определялось на основании анализа спермы; азооспермия, тяжелая олигозооспермия (<5x106 / мл) и ретроградная эякуляция рассматривались как показания для вспомогательных репродуктивных технологий (ВРТ). В начале исследования было получено одобрение наблюдательного совета учреждения (Университет медицинских наук, Анкара, Этлик Зубейде Ханым, Женский медицинский учебный и исследовательский госпиталь, номер 27.02.2014 / 171). Информированное согласие было получено у всех пациентов. Уровни β-ХГЧ в сыворотке крови через 12 дней после ЭТ, демографические характеристики [возраст, индекс массы тела, базальная сыворотка фолликулостимулирующего гормона (ФСГ), общая АФК, продолжительность бесплодия, причина бесплодия], параметры контролируемой стимуляции яичников и данные эмбриологии сравнивались между биохимическая и клиническая беременность. Также были проанализированы факторы, влияющие на текущую беременность и раннюю потерю плода.
Протоколы агонистов лютеинового длинного гонадотропин-рилизинг-гормона, обострения микродоз или антагонистов использовались для контролируемой стимуляции яичников. Использовали либо чистый рекомбинантный ФСГ, либо менопаузальный гонадотропин человека, и для каждого пациента использовали индивидуальные дозы гонадотропина. Серийное трансвагинальное ультразвуковое исследование и уровни эстрадиола в сыворотке использовались для контроля циклов. Когда по крайней мере три фолликула имели средний диаметр 17 мм, вводили 250 мкг рекомбинантного ХГЧ (Ovitrelle, Serono, Стамбул, Турция) и через 35,5-36 часов после инъекции ХГЧ с помощью трансвагинальной аспирации под контролем УЗИ проводили процедуры сбора ооцитов.Всем пациентам была проведена процедура интрацитоплазматической инъекции сперматозоидов (ИКСИ). ЭТ проводилась на второй, третий или пятый день после ИКСИ. Количество перенесенных эмбрионов определялось в зависимости от возраста пациента, количества предыдущих попыток и качества эмбриона. Для поддержки лютеиновой фазы применялся вагинальный прогестерон (8% гель Crinone, Serono, Великобритания) два раза в день. С октября 2013 года внутримышечный прогестерон 100 мг в день (Progestan 50 мг в ампулах, Кочак, Стамбул) сочетался с вагинальным прогестероном до определения сывороточного β-ХГЧ.
Использовали либо чистый рекомбинантный ФСГ, либо менопаузальный гонадотропин человека, и для каждого пациента использовали индивидуальные дозы гонадотропина. Серийное трансвагинальное ультразвуковое исследование и уровни эстрадиола в сыворотке использовались для контроля циклов. Когда по крайней мере три фолликула имели средний диаметр 17 мм, вводили 250 мкг рекомбинантного ХГЧ (Ovitrelle, Serono, Стамбул, Турция) и через 35,5-36 часов после инъекции ХГЧ с помощью трансвагинальной аспирации под контролем УЗИ проводили процедуры сбора ооцитов.Всем пациентам была проведена процедура интрацитоплазматической инъекции сперматозоидов (ИКСИ). ЭТ проводилась на второй, третий или пятый день после ИКСИ. Количество перенесенных эмбрионов определялось в зависимости от возраста пациента, количества предыдущих попыток и качества эмбриона. Для поддержки лютеиновой фазы применялся вагинальный прогестерон (8% гель Crinone, Serono, Великобритания) два раза в день. С октября 2013 года внутримышечный прогестерон 100 мг в день (Progestan 50 мг в ампулах, Кочак, Стамбул) сочетался с вагинальным прогестероном до определения сывороточного β-ХГЧ. Поддержка лютеиновой фазы проводилась до 12 недель гестационного возраста.
Поддержка лютеиновой фазы проводилась до 12 недель гестационного возраста.
Кровь брали через 12 дней после ЕТ для определения количественных концентраций β-ХГЧ в сыворотке. Беременность определялась, если концентрация ХГЧ в сыворотке была выше 10 МЕ / л. Если тест на β-ХГЧ на 12 день был положительным, через 48 часов брали второй образец сыворотки на концентрацию β-ХГЧ, чтобы отличить жизнеспособную внутриутробную беременность от возможной внематочной беременности. Затем через 4 недели после ЭТ было проведено УЗИ, чтобы проверить количество гестационных мешков и сердечную активность.Анализ сыворотки был выполнен с помощью анализаторов, в которых использовался общий β-ХГЧ Beckman Coulter Access, калиброванный в соответствии с Третьим международным стандартом Всемирной организации здравоохранения 75/537. Биохимическая беременность определялась как беременность, выявленная с помощью измерения ХГЧ без какого-либо гестационного мешка, видимого на УЗИ, а клиническая беременность диагностировалась путем определения частоты сердечных сокращений плода.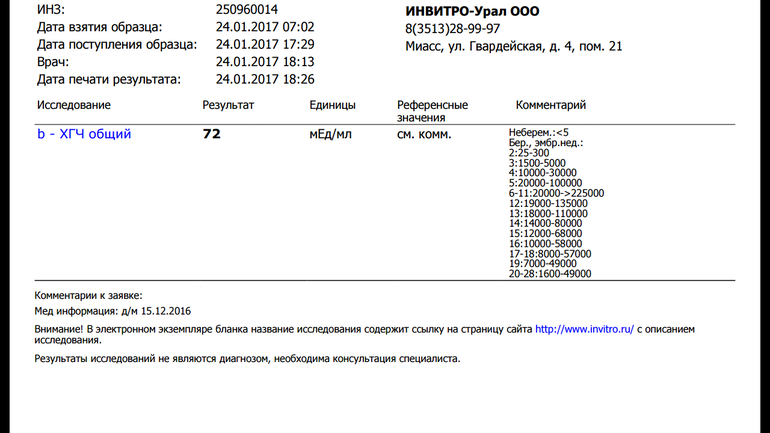 Текущая беременность определялась как беременность, которая продолжалась более 12 недель.
Текущая беременность определялась как беременность, которая продолжалась более 12 недель.
Статистический анализ
Программное обеспечение IBM SPSS Statistics (21.0, SPSS Inc., Чикаго, Иллинойс, США). Распределение переменных проверялось тестом Шапиро-Уилкса. T-критерий Стьюдента использовался для переменных с нормальным распределением, тогда как U-критерий Манна-Уитни использовался для данных с асимметричным распределением. Для сравнения пропорций использовался критерий хи-квадрат. Непрерывные переменные были представлены как среднее ± стандартное отклонение. Кривая рабочих характеристик приемника (ROC) использовалась для сравнения чувствительности и специфичности при каждом значении β-ХГЧ для прогнозирования клинической и продолжающейся беременности.Для каждой оценки рассчитывались чувствительность, специфичность, площадь под кривой ROC и 95% доверительный интервал. Логистическая регрессия использовалась для прогнозирования вероятности продолжения беременности после ЭТ. Связь исходного уровня β-ХГЧ, возраста, общей АЧХ, максимального уровня E2 и толщины эндометрия при ЭТ с исходом беременности оценивалась с помощью моделей логистической регрессии. Расчет мощности производился с использованием MedCalc 11.1.1.0 (статистическое программное обеспечение MedCalc®, Бельгия). В предыдущем исследовании Urbancsek et al. (14) сообщили, что разница в уровне β-ХГЧ в 66 МЕ была значимой на 11-й день.Используя этот показатель, предполагая предел эквивалентности 20% при значимости 0,05, наше исследование будет иметь достаточную мощность (не менее 80%) с 88 пациентами. Статистическая значимость была определена как p <0,05.
Связь исходного уровня β-ХГЧ, возраста, общей АЧХ, максимального уровня E2 и толщины эндометрия при ЭТ с исходом беременности оценивалась с помощью моделей логистической регрессии. Расчет мощности производился с использованием MedCalc 11.1.1.0 (статистическое программное обеспечение MedCalc®, Бельгия). В предыдущем исследовании Urbancsek et al. (14) сообщили, что разница в уровне β-ХГЧ в 66 МЕ была значимой на 11-й день.Используя этот показатель, предполагая предел эквивалентности 20% при значимости 0,05, наше исследование будет иметь достаточную мощность (не менее 80%) с 88 пациентами. Статистическая значимость была определена как p <0,05.
РЕЗУЛЬТАТЫ
Критериям включения соответствовали 445 беременностей. Из 445 беременностей 87 (19,6%) были биохимическими, а 358 (80,4%) — клиническими. Из 358 клинических беременностей 86,3% (309 из 358) наступили после 12 недель беременности (текущих), в то время как остальные 13 беременностей.7% (49 из 358) привели к ранней потере плода ().
День 12 Уровни ХГЧ значительно различались между биохимическими и клиническими беременностями (p <0,001). Не было обнаружено значительных различий между биохимическими и клиническими беременностями в отношении демографических характеристик (p> 0,05). Что касается параметров стимуляции, E2 в день ХГЧ, количество извлеченных ооцитов, количество зрелых ооцитов и E2 в день ET были значительно выше при клинической беременности по сравнению с биохимической беременностью (p <0.05). День и количество перенесенных эмбрионов были сопоставимы между двумя группами ().
Таблица 1
Демографические и контролируемые параметры стимуляции яичников при биохимической и клинической беременности
Анализ кривой ROC выявил пороговое значение β-ХГЧ 86,8 МЕ / мл с чувствительностью 65,1% и специфичностью 74,7% для прогнозирования клинической беременности [ AUC (ДИ): 0,76 (0,71-0,81)] (). Когда уровни β-ХГЧ в сыворотке крови через 12 дней после переноса оценивались в соответствии с днем переноса, значения, которые были наиболее надежными для прогнозирования клинической беременности, составили 57 мМЕ / мл для циклов переноса 3 дней (чувствительность 71. 2%, специфичность 64,7%, ДИ: 0,59–0,79) () и 87 мМЕ / мл для переноса на 5 день (чувствительность 71,2%, специфичность 75,5%, ДИ: 0,74–0,86) ().
2%, специфичность 64,7%, ДИ: 0,59–0,79) () и 87 мМЕ / мл для переноса на 5 день (чувствительность 71,2%, специфичность 75,5%, ДИ: 0,74–0,86) ().
Анализ кривой приемник-оператор для показателей сывороточного бета-хорионического гонадотропина через 12 дней после переноса эмбрионов для прогнозирования клинической беременности.
Анализ кривой приемника-оператора для эффективности сывороточного бета-хорионического гонадотропина через 12 дней после переноса эмбрионов при прогнозировании клинических беременностей для переноса на 3 день.
Анализ кривой приемника-оператора для эффективности сывороточного бета-хорионического гонадотропина через 12 дней после переноса эмбрионов при прогнозировании клинических беременностей на 5-й день.
При сравнении демографических характеристик и характеристик стимуляции яичников у пациенток в подгруппах клинических беременностей (продолжающаяся беременность и ранняя потеря плода) не было обнаружено значительных различий в отношении уровней β-ХГЧ в сыворотке на 12-й день ЭТ (p> 0,05 ) (). Не было обнаружено значительных различий между двумя группами в отношении возраста, исходного уровня ФСГ или общего AFC (p> 0,05). Продолжительность бесплодия была значительно короче в группе с продолжающейся беременностью по сравнению с группой с ранней потерей плода (p = 0,046). Что касается показаний к лечению АРТ, уровень снижения резерва яичников был значительно выше в группе ранней потери плода (12,2%), чем в группе продолжающейся беременности (2,3%) (p = 0,002). Что касается параметров стимуляции, E2 в день ХГЧ и количество перенесенных эмбрионов были значительно выше в группе продолжающейся беременности, чем в группе ранней потери плода (p = 0.02 и p = 0,001 соответственно).
Не было обнаружено значительных различий между двумя группами в отношении возраста, исходного уровня ФСГ или общего AFC (p> 0,05). Продолжительность бесплодия была значительно короче в группе с продолжающейся беременностью по сравнению с группой с ранней потерей плода (p = 0,046). Что касается показаний к лечению АРТ, уровень снижения резерва яичников был значительно выше в группе ранней потери плода (12,2%), чем в группе продолжающейся беременности (2,3%) (p = 0,002). Что касается параметров стимуляции, E2 в день ХГЧ и количество перенесенных эмбрионов были значительно выше в группе продолжающейся беременности, чем в группе ранней потери плода (p = 0.02 и p = 0,001 соответственно).
Таблица 2
Демографические характеристики и результаты контролируемых параметров стимуляции яичников в группах продолжающейся беременности и ранней потери плода
По результатам логистического регрессионного анализа уровни β-ХГЧ и E2 в день ХГЧ оказались равными значимые переменные коррелировали с продолжающейся беременностью [OR: 1.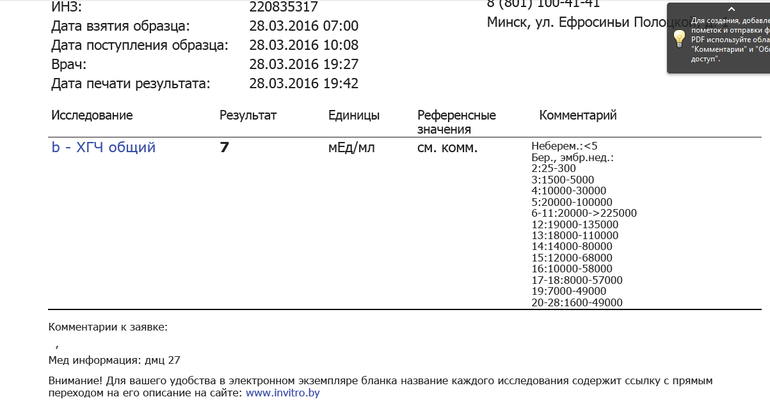 0042 (95% CI: 1.0025; 1.0058) и OR: 1.00035 (95% CI: 1.00016; 1.00053) соответственно, (p <0,001)]. Повышение уровня β-ХГЧ на 1 единицу связано с увеличением шансов на успех в 0 раз.042, а E2 связано с увеличением на 0,0035 ().
0042 (95% CI: 1.0025; 1.0058) и OR: 1.00035 (95% CI: 1.00016; 1.00053) соответственно, (p <0,001)]. Повышение уровня β-ХГЧ на 1 единицу связано с увеличением шансов на успех в 0 раз.042, а E2 связано с увеличением на 0,0035 ().
Таблица 3
Резюме логистического регрессионного анализа переменных, предсказывающих текущую беременность
ОБСУЖДЕНИЕ
Результаты настоящего исследования продемонстрировали, что уровни β-ХГЧ в сыворотке на 12-й день ЭТ имеют прогностическую ценность в различении биохимических и биохимических показателей. клиническая беременность. Было обнаружено, что это значение не является предиктором успешного продолжения беременности после 12 недель беременности.Было продемонстрировано, что на 12-й день уровни β-ХГЧ варьировались в зависимости от стадии эмбрионального развития на момент переноса. На основании анализа кривой ROC были обнаружены более высокие пороговые уровни β-ХГЧ для клинических беременностей при переносе на 5-й день по сравнению с переносом на 3-й день.
Уровни β-ХГЧ в сыворотке отражают массу и функцию трофобласта, которые играют решающую роль на ранних сроках беременности, поскольку они поддерживают желтое тело и играют роль в регуляции эндометрия, формировании синцития плаценты и имплантации (22).Было высказано предположение, что абсолютное значение β-ХГЧ может отражать качество имплантации (23) и может использоваться в качестве маркера успеха имплантации (24). Хотя различные сывороточные маркеры были исследованы как предикторы исхода беременности после вспомогательной репродукции, было показано, что сывороточный β-ХГЧ является надежным и самым ранним индикатором исходов беременности в циклах ЭКО (25, 26). В литературе сообщалось о различных пороговых значениях от 50 до 76 МЕ / л в течение 11-14 дней после ЭТ для прогнозирования жизнеспособных и нежизнеспособных беременностей с различной чувствительностью и специфичностью (19, 20, 21, 27). .Подобно этим результатам, наши результаты также показали немного более высокое пороговое значение β-ХГЧ на 12-й день — 86,8 МЕ / мл, что лучше всего позволяет различать биохимическую и клиническую беременность с чувствительностью 65,1% и специфичностью 74,7%. С другой стороны, в литературе есть противоречивые результаты относительно пороговых значений в отношении дня переноса эмбрионов. Kumbak et al. (10) оценили уровни β-ХГЧ в сыворотке через 12 дней после переноса эмбрионов на 3 и 5 день и показали, что значения, которые были наиболее надежными для прогнозирования продолжающейся беременности, составили 98 мМЕ / мл для 3-го цикла переноса и 257 мМЕ / мл. за 5-й день переезды.Они пришли к выводу, что в фиксированное время после переноса бластоциста может продуцировать большее количество β-ХГЧ, чем эмбрионы на стадии расщепления, в зависимости от большего количества жизнеспособных клеток трофэктодермы, которые у них есть в этот момент времени. Два исследования соответствуют этому результату, сообщая о более высоких значениях β-ХГЧ для эмбрионов 5-го дня, чем для эмбрионов 3-го дня (26, 28). Kathiresen et al. (26) сообщили о пороговых значениях 78 МЕ / л и 160 МЕ / л для эмбрионов на 3 и 5 день, соответственно, через 15 дней после переноса для прогнозирования продолжающихся беременностей.
С другой стороны, в литературе есть противоречивые результаты относительно пороговых значений в отношении дня переноса эмбрионов. Kumbak et al. (10) оценили уровни β-ХГЧ в сыворотке через 12 дней после переноса эмбрионов на 3 и 5 день и показали, что значения, которые были наиболее надежными для прогнозирования продолжающейся беременности, составили 98 мМЕ / мл для 3-го цикла переноса и 257 мМЕ / мл. за 5-й день переезды.Они пришли к выводу, что в фиксированное время после переноса бластоциста может продуцировать большее количество β-ХГЧ, чем эмбрионы на стадии расщепления, в зависимости от большего количества жизнеспособных клеток трофэктодермы, которые у них есть в этот момент времени. Два исследования соответствуют этому результату, сообщая о более высоких значениях β-ХГЧ для эмбрионов 5-го дня, чем для эмбрионов 3-го дня (26, 28). Kathiresen et al. (26) сообщили о пороговых значениях 78 МЕ / л и 160 МЕ / л для эмбрионов на 3 и 5 день, соответственно, через 15 дней после переноса для прогнозирования продолжающихся беременностей. В этом отчете было указано, что разница между начальными уровнями β-ХГЧ может быть результатом разных стадий развития перенесенных эмбрионов, которые могут иметь разный потенциал развития и в конечном итоге могут повлиять на частоту имплантации. Papageorgiou et al. (28) продемонстрировали несколько более низкие пороговые уровни, 32 МЕ / л и 173 МЕ / л, для эмбрионов на 3 и 5 день соответственно, когда кровь брали через 16 дней после оплодотворения, подтверждая гипотезу о том, что бластоцисты производят более высокие уровни β -hCG в связи с их более продвинутой стадией развития.Напротив, Zhang et al. (29) продемонстрировали более низкий исходный уровень β-ХГЧ в сыворотке после переноса на 5 день по сравнению с переносом на 3 день (75 ± 54 против 62 ± 41), предполагая, что развитие и имплантация эмбриона могут быть нарушены дополнительными двумя днями культивирования. В соответствии с предыдущими исследованиями, результаты нашего исследования также продемонстрировали более высокие пороговые значения β-ХГЧ на 12-й день для эмбрионов 5-го дня, чем для эмбрионов 3-го дня, для прогнозирования клинической беременности (86,9 МЕ / мл против 57,6 МЕ / мл.
В этом отчете было указано, что разница между начальными уровнями β-ХГЧ может быть результатом разных стадий развития перенесенных эмбрионов, которые могут иметь разный потенциал развития и в конечном итоге могут повлиять на частоту имплантации. Papageorgiou et al. (28) продемонстрировали несколько более низкие пороговые уровни, 32 МЕ / л и 173 МЕ / л, для эмбрионов на 3 и 5 день соответственно, когда кровь брали через 16 дней после оплодотворения, подтверждая гипотезу о том, что бластоцисты производят более высокие уровни β -hCG в связи с их более продвинутой стадией развития.Напротив, Zhang et al. (29) продемонстрировали более низкий исходный уровень β-ХГЧ в сыворотке после переноса на 5 день по сравнению с переносом на 3 день (75 ± 54 против 62 ± 41), предполагая, что развитие и имплантация эмбриона могут быть нарушены дополнительными двумя днями культивирования. В соответствии с предыдущими исследованиями, результаты нашего исследования также продемонстрировали более высокие пороговые значения β-ХГЧ на 12-й день для эмбрионов 5-го дня, чем для эмбрионов 3-го дня, для прогнозирования клинической беременности (86,9 МЕ / мл против 57,6 МЕ / мл. , соответственно).
, соответственно).
Плохие ответчики яичников показали плохой исход беременности, даже если первоначальные результаты по β-ХГЧ были положительными.Данные SART продемонстрировали более низкую частоту наступления беременности у женщин с пониженным овариальным резервом среди других показаний к ЭКО, независимо от возраста. Частота наступления беременности у женщин с пониженным овариальным резервом составляет 34,1% в возрасте до 35 лет, однако частота наступления беременности составляет 50,5% и 49,2% при мужском бесплодии и овуляторной дисфункции соответственно (30). Результаты настоящего исследования также согласуются с этими данными, выявив процент клинической беременности 82,2%, 81% и 68,4% у пациенток с признаками необъяснимого бесплодия, мужского бесплодия и сниженного резерва яичников.Значительно более высокие уровни E2 в день ХГЧ как при клинической, так и при продолжающейся беременности также подтверждают более высокую вероятность беременности у пациенток с хорошим ответом на стимуляцию яичников. Хотя большее количество перенесенных эмбрионов увеличивает вероятность продолжения беременности, можно предположить, что возможности имплантации более качественных эмбрионов от хороших респондентов также могут внести свой вклад в эти результаты. Кроме того, было отмечено, что потеря беременности у пациенток с пониженным овариальным резервом была значительно выше для всех возрастных групп по сравнению с пациентами с нормальным овариальным резервом.Подавляющее большинство потерь было зарегистрировано на ранних сроках беременности, то есть до выявления клинической беременности. С другой стороны, поскольку ооциты плохо ответивших людей являются последними ооцитами пула яичников и подвержены повышенному риску хромосомных аномалий, предполагается, что они имеют низкое качество. Анеуплоидия плода, вызванная этими ооцитами, может привести к раннему самопроизвольному выкидышу. Показатели клинической и продолжающейся беременности среди всех беременных с мужским бесплодием составили 80.9% и 68,1%, тогда как в нашем исследовании у женщин с необъяснимым бесплодием было 82% и 74%.
Хотя большее количество перенесенных эмбрионов увеличивает вероятность продолжения беременности, можно предположить, что возможности имплантации более качественных эмбрионов от хороших респондентов также могут внести свой вклад в эти результаты. Кроме того, было отмечено, что потеря беременности у пациенток с пониженным овариальным резервом была значительно выше для всех возрастных групп по сравнению с пациентами с нормальным овариальным резервом.Подавляющее большинство потерь было зарегистрировано на ранних сроках беременности, то есть до выявления клинической беременности. С другой стороны, поскольку ооциты плохо ответивших людей являются последними ооцитами пула яичников и подвержены повышенному риску хромосомных аномалий, предполагается, что они имеют низкое качество. Анеуплоидия плода, вызванная этими ооцитами, может привести к раннему самопроизвольному выкидышу. Показатели клинической и продолжающейся беременности среди всех беременных с мужским бесплодием составили 80.9% и 68,1%, тогда как в нашем исследовании у женщин с необъяснимым бесплодием было 82% и 74%. Однако наблюдалось резкое снижение у женщин со сниженным овариальным резервом с 68,4% до 36,8%, что подтверждает увеличение скорости потери в первом триместре в этой группе пациенток.
Однако наблюдалось резкое снижение у женщин со сниженным овариальным резервом с 68,4% до 36,8%, что подтверждает увеличение скорости потери в первом триместре в этой группе пациенток.
Основным ограничением этого исследования был его ретроспективный характер, хотя в исследование было включено большое количество случаев.
В заключение, уровни β-ХГЧ через 12 дней после ЭТ имеют значение для прогнозирования клинической беременности, но не для продолжающейся беременности.Пороговые значения варьируются в зависимости от дня ЭТ, при этом более высокие значения наблюдаются при переносе бластоцисты. Однако вероятность прогрессирования беременности после 12 недель беременности ниже у пациентов с плохим ответом, чем при любых других показаниях к АРТ после выявления клинической беременности.
Благодарности
Мы хотели бы поблагодарить профессора д-ра Сердара Дилбаза за создание отделения ЭКО и администрирование до осени 2011 года.
Сноски
Раскрытие финансовой информации: Авторы не заявили о раскрытии финансовой информации.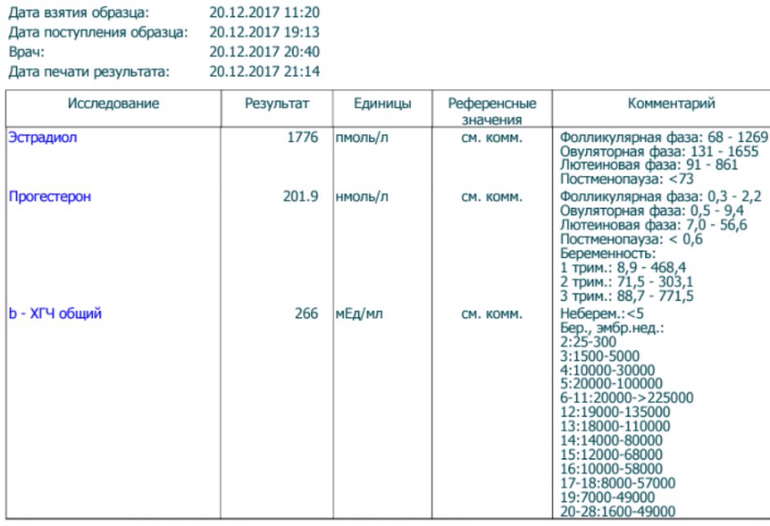
Конфликт интересов: Авторы не заявляли о конфликте интересов.
Список литературы
1. Домар А.Д., Зуттермайстер П.К., Фридман Р. Психологическое влияние бесплодия: сравнение с пациентами с другими заболеваниями. J Psychosom Obstet Gynaecol. 1993; 14 (Прил.): 45–52. [PubMed] [Google Scholar] 2. Freeman EW, Boxer AS, Rickels K, Tureck R, Mastroianni L., Jr. Психологическая оценка и поддержка программы экстракорпорального оплодотворения и переноса эмбрионов.Fertil Steril. 1985. 43: 48–53. [PubMed] [Google Scholar] 3. Йонг П., Мартин С., Тонг Дж. Сравнение психологического функционирования женщин на разных этапах лечения экстракорпоральным оплодотворением с использованием контрольного списка прилагательного среднего аффекта. J Assist Reprod Genet. 2000. 17: 553–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4. Хаммарберг К., Астбери Дж., Бейкер Х. Женский опыт ЭКО: последующее исследование. Hum Reprod. 2001; 16: 374–83. [PubMed] [Google Scholar] 5. Бен-Рафаэль З., Фатех М., Фликингер Г.Л., Турек Р., Бласко Л., Мастроянни Л., Jr Частота абортов при беременности после экстракорпорального оплодотворения и переноса эмбрионов. Obstet Gynecol. 1988. 71: 297–300. [PubMed] [Google Scholar] 6. Ямасита Т., Окамото С., Томас А., Маклахлан В., Хили Д.Л. Прогнозирование исхода беременности после экстракорпорального оплодотворения и переноса эмбриона с использованием эстрадиола, прогестерона и бета-субъединицы хорионического гонадотропина человека. Fertil Steril. 1989; 51: 304–9. [PubMed] [Google Scholar] 7. Hauzman EE, Lagarde AR, Nagy K, Fancsovits P, Murber A, Jánoki G, et al. Прогностическая ценность измерений СА-125 в сыворотке на 1-й день стимуляции и в день забора ооцитов для прогнозирования исхода лечения ЭКО.J Assist Reprod Genet. 2005; 22: 265–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Хаузман Э., Федорчак П., Клинга К., Папп З., Рабе Т., Стровицки Т. и др. Использование сывороточного ингибина А и измерения хорионического гонадотропина человека для прогнозирования исходов беременностей при экстракорпоральном оплодотворении.
Бен-Рафаэль З., Фатех М., Фликингер Г.Л., Турек Р., Бласко Л., Мастроянни Л., Jr Частота абортов при беременности после экстракорпорального оплодотворения и переноса эмбрионов. Obstet Gynecol. 1988. 71: 297–300. [PubMed] [Google Scholar] 6. Ямасита Т., Окамото С., Томас А., Маклахлан В., Хили Д.Л. Прогнозирование исхода беременности после экстракорпорального оплодотворения и переноса эмбриона с использованием эстрадиола, прогестерона и бета-субъединицы хорионического гонадотропина человека. Fertil Steril. 1989; 51: 304–9. [PubMed] [Google Scholar] 7. Hauzman EE, Lagarde AR, Nagy K, Fancsovits P, Murber A, Jánoki G, et al. Прогностическая ценность измерений СА-125 в сыворотке на 1-й день стимуляции и в день забора ооцитов для прогнозирования исхода лечения ЭКО.J Assist Reprod Genet. 2005; 22: 265–8. [Бесплатная статья PMC] [PubMed] [Google Scholar] 8. Хаузман Э., Федорчак П., Клинга К., Папп З., Рабе Т., Стровицки Т. и др. Использование сывороточного ингибина А и измерения хорионического гонадотропина человека для прогнозирования исходов беременностей при экстракорпоральном оплодотворении. Fertil Steril. 2004. 81: 66–72. [PubMed] [Google Scholar] 9. Qasim SM, Callan C, Choe JK. Прогностическая ценность исходного уровня бета-хорионического гонадотропина человека в сыворотке крови для исхода беременности после экстракорпорального оплодотворения.J Assist Reprod Genet. 1996; 13: 705–8. [PubMed] [Google Scholar] 10. Kumbak B, Oral E, Karlikaya G, Lacin S, Kahraman S. Измерения сывороточного эстрадиола и бета-ХГЧ после переноса эмбрионов на 3 или 5 день при интерпретации исхода беременности. Репродукция Биомед онлайн. 2006; 13: 459–64. [PubMed] [Google Scholar] 11. Порат С., Савчев С., Бдола Ю., Гурвиц А., Хаимов-Кохман Р. Ранний сывороточный бета-хорионический гонадотропин человека при беременности после экстракорпорального оплодотворения: влияние переменных лечения и прогнозирование долгосрочного исхода беременности.Fertil Steril. 2007; 88: 82–9. [PubMed] [Google Scholar] 12. McCoy TW, Nakajima ST, Bohler HC., Jr Возраст и один 14-дневный бета-ХГЧ могут предсказать продолжение беременности после ЭКО.
Fertil Steril. 2004. 81: 66–72. [PubMed] [Google Scholar] 9. Qasim SM, Callan C, Choe JK. Прогностическая ценность исходного уровня бета-хорионического гонадотропина человека в сыворотке крови для исхода беременности после экстракорпорального оплодотворения.J Assist Reprod Genet. 1996; 13: 705–8. [PubMed] [Google Scholar] 10. Kumbak B, Oral E, Karlikaya G, Lacin S, Kahraman S. Измерения сывороточного эстрадиола и бета-ХГЧ после переноса эмбрионов на 3 или 5 день при интерпретации исхода беременности. Репродукция Биомед онлайн. 2006; 13: 459–64. [PubMed] [Google Scholar] 11. Порат С., Савчев С., Бдола Ю., Гурвиц А., Хаимов-Кохман Р. Ранний сывороточный бета-хорионический гонадотропин человека при беременности после экстракорпорального оплодотворения: влияние переменных лечения и прогнозирование долгосрочного исхода беременности.Fertil Steril. 2007; 88: 82–9. [PubMed] [Google Scholar] 12. McCoy TW, Nakajima ST, Bohler HC., Jr Возраст и один 14-дневный бета-ХГЧ могут предсказать продолжение беременности после ЭКО.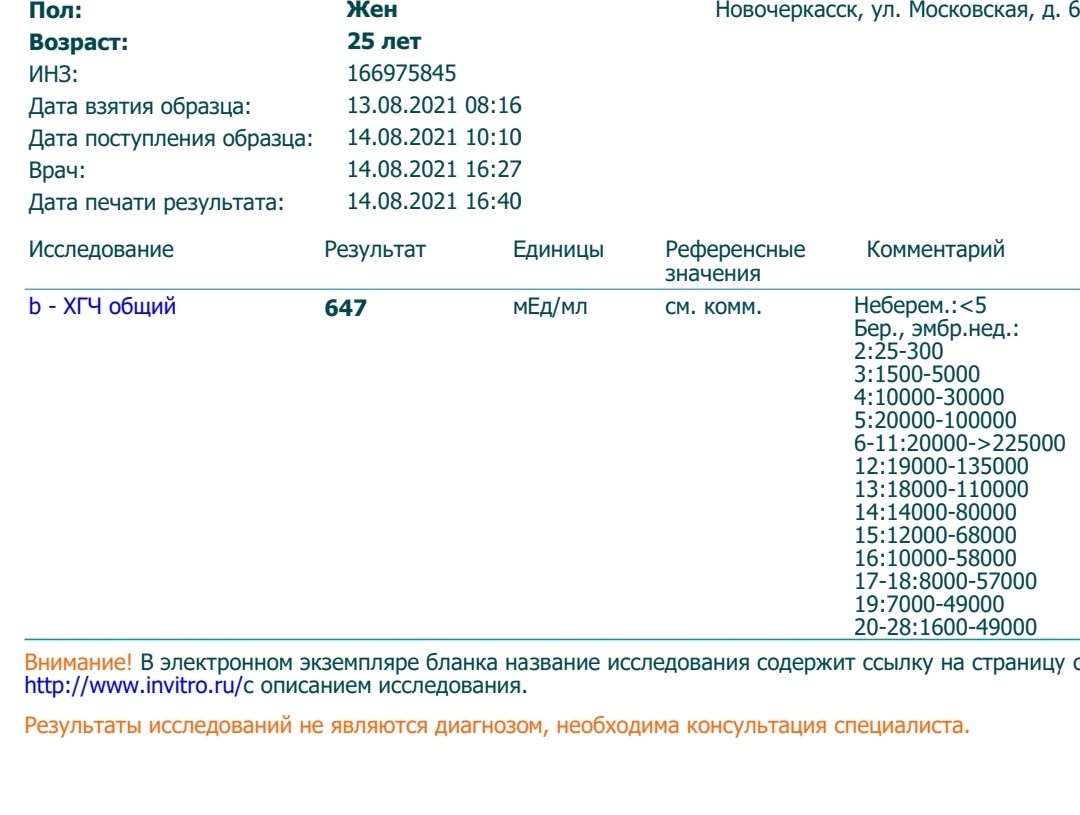 Репродукция Биомед онлайн. 2009; 19: 114–20. [PubMed] [Google Scholar] 13. Poikkeus P, Hiilesmaa V, Tiitinen A. Сывороточный ХГЧ через 12 дней после переноса эмбриона для прогнозирования исхода беременности. Hum Reprod. 2002; 17: 1901–1905. [PubMed] [Google Scholar] 14. Урбанчек Дж., Хаузман Э., Федорчак П., Халмос А., Девеньи Н., Папп З. Измерения хорионического гонадотропина человека в сыворотке крови могут предсказать исход беременности и многоплодие после экстракорпорального оплодотворения.Fertil Steril. 2002; 78: 540–2. [PubMed] [Google Scholar] 15. Confino E, Demir RH, Friberg J, Gleicher N. Прогностическая ценность уровней бета-субъединиц ХГЧ при беременности, достигаемая с помощью экстракорпорального оплодотворения и переноса эмбрионов: международное совместное исследование. Fertil Steril. 1986; 45: 526–31. [PubMed] [Google Scholar] 16. Daily CA, Laurent SL, Nunley WC., Jr. Прогностическое значение сывороточного прогестерона и количественного бета-хорионического гонадотропина человека на ранних сроках беременности.
Репродукция Биомед онлайн. 2009; 19: 114–20. [PubMed] [Google Scholar] 13. Poikkeus P, Hiilesmaa V, Tiitinen A. Сывороточный ХГЧ через 12 дней после переноса эмбриона для прогнозирования исхода беременности. Hum Reprod. 2002; 17: 1901–1905. [PubMed] [Google Scholar] 14. Урбанчек Дж., Хаузман Э., Федорчак П., Халмос А., Девеньи Н., Папп З. Измерения хорионического гонадотропина человека в сыворотке крови могут предсказать исход беременности и многоплодие после экстракорпорального оплодотворения.Fertil Steril. 2002; 78: 540–2. [PubMed] [Google Scholar] 15. Confino E, Demir RH, Friberg J, Gleicher N. Прогностическая ценность уровней бета-субъединиц ХГЧ при беременности, достигаемая с помощью экстракорпорального оплодотворения и переноса эмбрионов: международное совместное исследование. Fertil Steril. 1986; 45: 526–31. [PubMed] [Google Scholar] 16. Daily CA, Laurent SL, Nunley WC., Jr. Прогностическое значение сывороточного прогестерона и количественного бета-хорионического гонадотропина человека на ранних сроках беременности. Am J Obstet Gynecol. 1994; 171: 380–3.[PubMed] [Google Scholar] 17. Зегерс-Хохшильд Ф., Альтиери Э., Фабрес С., Фернандес Э., Маккенна А., Ориуэла П. Прогностическое значение хорионического гонадотропина человека в исходе ранней беременности после экстракорпорального оплодотворения и спонтанного зачатия. Hum Reprod. 1994; 9: 1550–5. [PubMed] [Google Scholar] 18. Хоман Г., Браун С., Моран Дж., Хоман С., Керин Дж. Хорионический гонадотропин человека как прогностический фактор при беременности с использованием вспомогательных репродуктивных технологий. Fertil Steril. 2000. 73: 270–4. [PubMed] [Google Scholar] 19.Суганта С.Е., Вебстер С., Сундар Е., Лентон Е.А. Прогностическая ценность хорионического гонадотропина человека в плазме после лечения вспомогательным оплодотворением. Hum Reprod. 2000; 15: 469–73. [PubMed] [Google Scholar] 20. Poikkeus P, Hiilesmaa V, Tiitinen A. Сывороточный ХГЧ через 12 дней после переноса эмбриона для прогнозирования исхода беременности. Hum Reprod. 2002; 17: 1901–1905.
Am J Obstet Gynecol. 1994; 171: 380–3.[PubMed] [Google Scholar] 17. Зегерс-Хохшильд Ф., Альтиери Э., Фабрес С., Фернандес Э., Маккенна А., Ориуэла П. Прогностическое значение хорионического гонадотропина человека в исходе ранней беременности после экстракорпорального оплодотворения и спонтанного зачатия. Hum Reprod. 1994; 9: 1550–5. [PubMed] [Google Scholar] 18. Хоман Г., Браун С., Моран Дж., Хоман С., Керин Дж. Хорионический гонадотропин человека как прогностический фактор при беременности с использованием вспомогательных репродуктивных технологий. Fertil Steril. 2000. 73: 270–4. [PubMed] [Google Scholar] 19.Суганта С.Е., Вебстер С., Сундар Е., Лентон Е.А. Прогностическая ценность хорионического гонадотропина человека в плазме после лечения вспомогательным оплодотворением. Hum Reprod. 2000; 15: 469–73. [PubMed] [Google Scholar] 20. Poikkeus P, Hiilesmaa V, Tiitinen A. Сывороточный ХГЧ через 12 дней после переноса эмбриона для прогнозирования исхода беременности. Hum Reprod. 2002; 17: 1901–1905. [PubMed] [Google Scholar] 21. Урбанчек Дж., Хаузман Э., Федорчак П., Халмос А., Девеньи Н., Папп З. Измерения хорионического гонадотропина человека в сыворотке крови могут предсказать исход беременности и многоплодие после экстракорпорального оплодотворения.Fertil Steril. 2002; 78: 540–2. [PubMed] [Google Scholar] 22. Ticconi C, Zicari A, Belmonte A, Realacci M, Rao ChV, Piccione E. Стимулирующие беременность действия ХГЧ в миометрии человека и мембранах плода. Плацента. 2007. 28 (Приложение A): 137–43. [PubMed] [Google Scholar] 23. Кармона Ф., Балаш Дж., Креус М., Фабрегес Ф., Казамитхана Р., Сивико С. и др. Ранние гормональные маркеры исхода беременности после экстракорпорального оплодотворения и переноса эмбрионов. J Assist Reprod Genet. 2003. 20: 521–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24.Глатштейн И.З., Хорнштейн М.Д., Кахана М.Дж., Джексон К.В., Фридман А.Дж. Прогностическая ценность дискриминационных уровней хорионического гонадотропина человека в диагностике исхода имплантации в циклах экстракорпорального оплодотворения.
[PubMed] [Google Scholar] 21. Урбанчек Дж., Хаузман Э., Федорчак П., Халмос А., Девеньи Н., Папп З. Измерения хорионического гонадотропина человека в сыворотке крови могут предсказать исход беременности и многоплодие после экстракорпорального оплодотворения.Fertil Steril. 2002; 78: 540–2. [PubMed] [Google Scholar] 22. Ticconi C, Zicari A, Belmonte A, Realacci M, Rao ChV, Piccione E. Стимулирующие беременность действия ХГЧ в миометрии человека и мембранах плода. Плацента. 2007. 28 (Приложение A): 137–43. [PubMed] [Google Scholar] 23. Кармона Ф., Балаш Дж., Креус М., Фабрегес Ф., Казамитхана Р., Сивико С. и др. Ранние гормональные маркеры исхода беременности после экстракорпорального оплодотворения и переноса эмбрионов. J Assist Reprod Genet. 2003. 20: 521–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24.Глатштейн И.З., Хорнштейн М.Д., Кахана М.Дж., Джексон К.В., Фридман А.Дж. Прогностическая ценность дискриминационных уровней хорионического гонадотропина человека в диагностике исхода имплантации в циклах экстракорпорального оплодотворения. Fertil Steril. 1995; 63: 350–6. [PubMed] [Google Scholar] 25. Ямасита Т., Окамото С., Томас А., Маклахлан В., Хили Д.Л. Прогнозирование исхода беременности после экстракорпорального оплодотворения и переноса эмбриона с использованием эстрадиола, прогестерона и бета-субъединицы хорионического гонадотропина человека. Fertil Steril.1989; 51: 304–9. [PubMed] [Google Scholar] 26. Катиресан А.С., Круз-Алмейда Ю., Баррионуево М.Дж., Максон В.С., Хоффман Д.И., Вайцман В.Н. и др. Прогностическая ценность бета-хорионического гонадотропина человека зависит от дня переноса эмбриона во время оплодотворения in vitro. Fertil Steril. 2011; 96: 1362–6. [PubMed] [Google Scholar] 27. Bjercke S, Tanbo T, Dale PO, Mørkrid L, Abyholm T. Концентрация хорионического гонадотропина человека на ранних сроках беременности после экстракорпорального оплодотворения. Hum Reprod. 1999; 14: 1642–6. [PubMed] [Google Scholar] 28.Папагеоргиу Т.К., Леондирес М.П., Миллер Б.Т., Чанг А.С., Армстронг А.Б., Скотт Л.А. и др. Уровни хорионического гонадотропина человека после переноса бластоцисты в высокой степени позволяют прогнозировать исход беременности.
Fertil Steril. 1995; 63: 350–6. [PubMed] [Google Scholar] 25. Ямасита Т., Окамото С., Томас А., Маклахлан В., Хили Д.Л. Прогнозирование исхода беременности после экстракорпорального оплодотворения и переноса эмбриона с использованием эстрадиола, прогестерона и бета-субъединицы хорионического гонадотропина человека. Fertil Steril.1989; 51: 304–9. [PubMed] [Google Scholar] 26. Катиресан А.С., Круз-Алмейда Ю., Баррионуево М.Дж., Максон В.С., Хоффман Д.И., Вайцман В.Н. и др. Прогностическая ценность бета-хорионического гонадотропина человека зависит от дня переноса эмбриона во время оплодотворения in vitro. Fertil Steril. 2011; 96: 1362–6. [PubMed] [Google Scholar] 27. Bjercke S, Tanbo T, Dale PO, Mørkrid L, Abyholm T. Концентрация хорионического гонадотропина человека на ранних сроках беременности после экстракорпорального оплодотворения. Hum Reprod. 1999; 14: 1642–6. [PubMed] [Google Scholar] 28.Папагеоргиу Т.К., Леондирес М.П., Миллер Б.Т., Чанг А.С., Армстронг А.Б., Скотт Л.А. и др. Уровни хорионического гонадотропина человека после переноса бластоцисты в высокой степени позволяют прогнозировать исход беременности.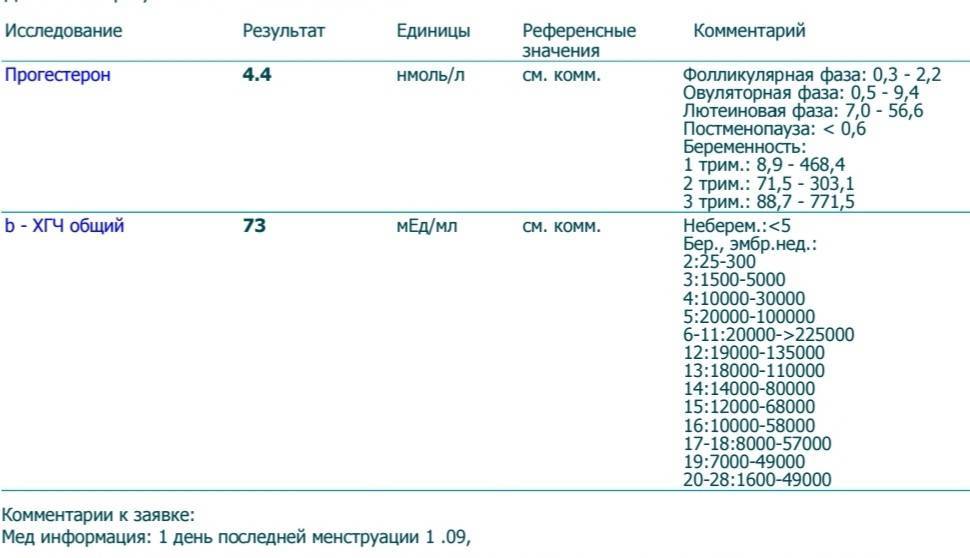 Fertil Steril. 2001; 76: 981–7. [PubMed] [Google Scholar] 29. Чжан Х, Барнс Р., Конфино Е., Милад М., Пушек Е., Казер Р. Задержка переноса эмбриона до 5-го дня приводит к снижению исходных уровней бета-хорионического гонадотропина человека в сыворотке крови. Fertil Steril. 2003. 80: 1359–63. [PubMed] [Google Scholar] 30. нет автора. Центры по контролю и профилактике заболеваний, Американское общество репродуктивной медицины, Общество вспомогательных репродуктивных технологий.Национальный итоговый отчет по вспомогательным репродуктивным технологиям за 2010 год. Министерство здравоохранения и социальных служб США. 2012 [цитировано 10 августа 2014 г.] [Google Scholar]
Fertil Steril. 2001; 76: 981–7. [PubMed] [Google Scholar] 29. Чжан Х, Барнс Р., Конфино Е., Милад М., Пушек Е., Казер Р. Задержка переноса эмбриона до 5-го дня приводит к снижению исходных уровней бета-хорионического гонадотропина человека в сыворотке крови. Fertil Steril. 2003. 80: 1359–63. [PubMed] [Google Scholar] 30. нет автора. Центры по контролю и профилактике заболеваний, Американское общество репродуктивной медицины, Общество вспомогательных репродуктивных технологий.Национальный итоговый отчет по вспомогательным репродуктивным технологиям за 2010 год. Министерство здравоохранения и социальных служб США. 2012 [цитировано 10 августа 2014 г.] [Google Scholar]Две недели ожидания — Интерпретация результатов бета-тестирования ХГЧ
Пожалуй, самая нервная часть процесса ЭКО — это легендарный номер «Двухнедельное ожидание». Для новичков в ЭКО это период между переносом эмбриона и временем, когда женщина получает результаты своего первого теста на беременность. Тип теста на беременность, который проводится после ЭКО, — это анализ крови на беременность, который намного более чувствителен, чем анализ мочи, отпускаемый без рецепта, хотя оба типа тестов измеряют концентрацию гормона, называемого хорионическим гонадотропином человека или ХГЧ.Анализ крови обычно называют бета-тестом ХГЧ или просто «бета-тестом». Пациентам с ЭКО проводится два или более теста на бета-ХГЧ, обычно с интервалом в два дня. Причина, по которой выполняется несколько бета-тестов, заключается в том, что мы смотрим на скорость изменения (в идеале — увеличения) уровня ХГЧ.
Тип теста на беременность, который проводится после ЭКО, — это анализ крови на беременность, который намного более чувствителен, чем анализ мочи, отпускаемый без рецепта, хотя оба типа тестов измеряют концентрацию гормона, называемого хорионическим гонадотропином человека или ХГЧ.Анализ крови обычно называют бета-тестом ХГЧ или просто «бета-тестом». Пациентам с ЭКО проводится два или более теста на бета-ХГЧ, обычно с интервалом в два дня. Причина, по которой выполняется несколько бета-тестов, заключается в том, что мы смотрим на скорость изменения (в идеале — увеличения) уровня ХГЧ.
После длительного времени, затрат, усилий, боли, беспокойства и эмоций, потраченных на подготовку и прохождение цикла ЭКО, все надежды, похоже, зависят от того номера, который медсестра-координатор сообщает пациенту — обычно по телефону.Это момент, когда пациентка узнает, «сработал» ли ее цикл ЭКО (по крайней мере, таково восприятие). С технической точки зрения это «бета» число представляет количество единиц ХГЧ на мл в крови. Поскольку он измеряет концентрацию ХГЧ в крови, это не просто «положительный» или «отрицательный» тест, но во многих случаях это вопрос степени. Хотя нулевой уровень является довольно надежным индикатором того, что беременность не развивается, не существует окончательного порогового значения, которое надежно указывает на жизнеспособную беременность.
Поскольку он измеряет концентрацию ХГЧ в крови, это не просто «положительный» или «отрицательный» тест, но во многих случаях это вопрос степени. Хотя нулевой уровень является довольно надежным индикатором того, что беременность не развивается, не существует окончательного порогового значения, которое надежно указывает на жизнеспособную беременность.
Когда в этот благословенный / страшный день наконец зазвонит телефон, пациенты могут испытывать большее беспокойство и беспокойство, если номер не соответствует тому, что они считают «хорошим» на основании того, что им сказал другой пациент, друг, родственник или незнакомец. Итак … какое число бета-версий в ЭКО является «хорошим»? Это хороший вопрос. И короткий ответ не очень обнадеживает. Как и во многих других аспектах ЭКО, ответ — «это зависит от обстоятельств».
Существует диапазон, в который попадают многие (не все) жизнеспособные беременности ЭКО.Дело в том, что я видел бета-числа всего до 4, которые приводили к здоровому ребенку, и я видел первые бета-числа, превышающие 100, которые закончились химической беременностью. Важно понимать, что гораздо более надежным и прогностическим показателем жизнеспособной беременности является скорость, с которой увеличивается число бета-ХГЧ. Нам нравится, когда число бета-версий примерно удваивается каждые 48 часов (хотя на удвоение может потребоваться до 72 часов). Например, если первое бета-число ХГЧ равно 24, второе бета-число должно быть в районе 40-60.Даже при высоком первом бета-числе отсутствие удвоения за 48-72 часа является возможным признаком того, что беременность начинает прерываться. Точно так же даже крайне низкое значение первой беты не вызывает паники или пессимизма, если оно увеличивается с приемлемой скоростью.
Важно понимать, что гораздо более надежным и прогностическим показателем жизнеспособной беременности является скорость, с которой увеличивается число бета-ХГЧ. Нам нравится, когда число бета-версий примерно удваивается каждые 48 часов (хотя на удвоение может потребоваться до 72 часов). Например, если первое бета-число ХГЧ равно 24, второе бета-число должно быть в районе 40-60.Даже при высоком первом бета-числе отсутствие удвоения за 48-72 часа является возможным признаком того, что беременность начинает прерываться. Точно так же даже крайне низкое значение первой беты не вызывает паники или пессимизма, если оно увеличивается с приемлемой скоростью.
С учетом вышесказанного, существует ряд обстоятельств, при которых бета-числа не соответствуют этому шаблону даже при жизнеспособной беременности. Например, двойня или другая многоплодная беременность может показывать высокое начальное бета-число, поскольку два плода начинают формироваться и расти.Если один плод задерживается, это может привести к более медленному увеличению бета-числа, что повергает будущую мать в панику. В таком случае мы можем сделать третий и даже четвертый бета-ХГЧ, чтобы позволить числам стабилизироваться и возобновить более предсказуемую картину. Во многих случаях многоплодных беременностей, которые хорошо прогрессируют, бета-число может увеличиваться более быстрыми темпами, иногда увеличиваясь в четыре раза за 2 дня.
В таком случае мы можем сделать третий и даже четвертый бета-ХГЧ, чтобы позволить числам стабилизироваться и возобновить более предсказуемую картину. Во многих случаях многоплодных беременностей, которые хорошо прогрессируют, бета-число может увеличиваться более быстрыми темпами, иногда увеличиваясь в четыре раза за 2 дня.
С такой большой неопределенностью и изменчивостью в числах бета, как мы можем определить, является ли число «хорошим»? Ответ заключается в том, что бета-число, которое удваивается за соответствующий период времени, с гораздо большей вероятностью будет жизнеспособной беременностью, чем беременность, которая не является таковой, даже если есть обстоятельства, когда она выходит за рамки этих параметров.
Рискуя остаться на этих цифрах, вот несколько приблизительных рекомендаций по бета-тестированию. Я публикую их в основном для того, чтобы показать, насколько изменчивыми могут быть числа даже при жизнеспособной беременности:
• 2 недели после переноса: 5 — 50 мМЕ / мл
• 3 недели после переноса: 5 — 426 мМЕ / мл
• 4 недели после переноса : 18 — 7340 мМЕ / мл
• 5 недель после переноса: 1080 — 56 500 мМЕ / мл
• 6-7 недель после переноса: 7, 650 — 229 000 мМЕ / мл
(Источник: Американская ассоциация беременных)
Примерно через 6-7 недель после перевода можно сделать ультразвуковое подтверждение беременности, и чудесный и волшебный звук сердцебиения можно будет услышать при жизнеспособной беременности . .. что представляет собой следующий этап беспокойства для будущих пар.
.. что представляет собой следующий этап беспокойства для будущих пар.
Подводя итог, можно сказать, что существует широкий диапазон «нормальных» результатов теста на бета-ХГЧ на беременность. Ключевой фактор, на который мы обращаем внимание, — это время удвоения числа бета. Прежде всего, знайте, что мы приветствуем и поощряем ваши звонки с любыми вопросами или проблемами, которые могут у вас возникнуть на этом или любом другом этапе вашего лечения.
Уровни свободного β-ХГЧ и альфа-фетопротеина при ЭКО, ИКСИ и беременностях с переносом замороженных эмбрионов при скрининге сыворотки матери на синдром Дауна в середине триместра | Репродукция человека
Также оценивалось влияние количества перенесенных эмбрионов и количества используемых гонадотропинов на уровни маркеров. Методы. Исследуемая популяция состояла из 58 беременностей ЭКО, 32 ИКСИ и 26 беременностей с переносом замороженных эмбрионов (FET). Уровни β-ХГЧ и АФП сравнивали с контрольной группой из 6548 одноплодных спонтанных беременностей. РЕЗУЛЬТАТЫ: частота ложноположительных результатов (FPR) при скрининге синдрома Дауна составила 19% в целом по беременностям с использованием вспомогательных репродуктивных технологий, что является самым высоким показателем (30.8%) в группе полевых транзисторов. Свободные β-ХГЧ, кратные медианным (МоМ) значениям, были статистически значимо повышены только в группе FET (1,33 МоМ; P = 0,012). Положительная корреляция между количеством перенесенных эмбрионов и уровнями маркеров наблюдалась в группе ЭКО. Не было обнаружено корреляции между количеством использованных препаратов гонадотропина и уровнями маркеров. ВЫВОДЫ. Настоящие данные подтверждают, что общий FPR при скрининге сыворотки на синдром Дауна при беременности с искусственным оплодотворением является высоким, что приводит к ненужным инвазивным процедурам. , 1996). В недавнем исследовании сообщалось, что при беременностях, инициированных ИКСИ, уровни АФП во втором триместре в сыворотке крови были значительно ниже, чем в контрольной группе или при беременностях с ЭКО (Lam et al ., 1999).
, 1996). В недавнем исследовании сообщалось, что при беременностях, инициированных ИКСИ, уровни АФП во втором триместре в сыворотке крови были значительно ниже, чем в контрольной группе или при беременностях с ЭКО (Lam et al ., 1999).Причина изменения уровня маркеров при беременности с использованием вспомогательной репродукции остается неизвестной. Тот факт, что средний возраст женщин, беременных с помощью вспомогательной репродуктивной системы, выше, чем при спонтанной беременности, не может сам по себе объяснить более высокий FPR (Heinonen et al ., 1996; Wald et al ., 1999). Недавно было высказано предположение, что высокий FPR при ЭКО и беременностях с донорством ооцитов может отражать факторы, связанные с самой беременностью, а не с процедурой вспомогательной репродукции (Maymon and Shulman, 2001).
Целью этого исследования было оценить влияние количества перенесенных эмбрионов и количества препаратов гонадотропина для стимуляции яичников при ЭКО и ИКСИ на уровни β-ХГЧ и АФП в сыворотке крови матери во втором триместре скрининга синдрома Дауна. Мы предположили, что режимы стимуляции овуляции могут влиять как на плодную яйцеклетку, так и на созревание эндометрия, и тем самым на имплантацию эмбриона на стенку матки. Чтобы проверить эту гипотезу, мы изучили уровни маркеров при беременностях с переносом замороженных эмбрионов (FET), когда стимуляция яичников не использовалась, но влияла на яйцеклетку до оплодотворения.
Мы предположили, что режимы стимуляции овуляции могут влиять как на плодную яйцеклетку, так и на созревание эндометрия, и тем самым на имплантацию эмбриона на стенку матки. Чтобы проверить эту гипотезу, мы изучили уровни маркеров при беременностях с переносом замороженных эмбрионов (FET), когда стимуляция яичников не использовалась, но влияла на яйцеклетку до оплодотворения.
Скрининг синдрома Дауна проводился путем анализа уровней β-ХГЧ и АФП в сыворотке крови матери между 14 и 18 неделями беременности, а соотношение рисков синдрома Дауна рассчитывалось по формуле Вальда (Wald et al ., 1994). Данные были собраны из разных регистров: регистра рождений, больничных регистров, регистра пороков развития, регистра легальных абортов и лабораторных регистров в Финляндии в период с 1994 по 1999 год. Контрольную группу составили 6548 одноплодных беременностей с известным нормальным исходом и без врожденных аномалий. Информация о количестве перенесенных эмбрионов и лекарствах, используемых для стимуляции яичников, была собрана из документов пациентов. Данные о количестве перенесенных эмбрионов отсутствовали при четырех беременностях ЭКО и одной беременности ИКСИ.
Информация о количестве перенесенных эмбрионов и лекарствах, используемых для стимуляции яичников, была собрана из документов пациентов. Данные о количестве перенесенных эмбрионов отсутствовали при четырех беременностях ЭКО и одной беременности ИКСИ.
Сывороточный АФП и β-ХГЧ анализировали с помощью иммунофлюориметрического анализа с временным разрешением (hAFP / свободный ХГЧ бета-двойной набор; Wallac, Турку, Финляндия).
Различия в уровнях двух анализов между разными исследуемыми группами и контрольной группой оценивали с помощью тестов Краскела – Уоллиса и Вилкоксона. Анализ ковариации (ANCOVA) для логарифмически преобразованных кратных значений медианы (MoM) был использован для корректировки возрастных различий между группами. Коэффициент корреляции Спирмена использовался для оценки того, повлияло ли количество перенесенных эмбрионов или количество используемых лекарств на уровни β-ХГЧ или АФП в сыворотке.Во всех расчетах использовался SAS 6.12 для Windows.
Субъекты в группах вспомогательной репродукции были старше контрольной группы ( P = 0,0001).FPR среди контрольной группы составляла 5%, тогда как среди беременностей с искусственным оплодотворением ( n = 116) она составляла 19% в целом, составляя 17,2% в группе ЭКО, 12,5% в группе ICSI и 30,8% в группе FET. . После исключения четырех случаев замены эстрогена FPR в группе FET составлял 22.7%. При общем сравнении статистически значимая разница в уровнях MoM свободного β-ХГЧ наблюдалась между тремя исследуемыми группами и контрольной группой ( P = 0,018). Никаких различий в уровнях МоМ β-ХГЧ между тремя исследуемыми группами с помощью теста Краскалла – Уоллиса не наблюдалось. Разница в возрасте между участниками исследования и контрольной группой не объясняла разницу в значениях β-ХГЧ MoM, которые оставались статистически значимыми после корректировки по возрасту ( P = 0,0017).
Апостериорные сравнения уровней MoM свободного β-ХГЧ в сыворотке крови были выполнены между исследуемыми группами и контрольной группой: статистически значимая разница в уровнях β-ХГЧ наблюдалась только между группой FET и контролем ( P = 0.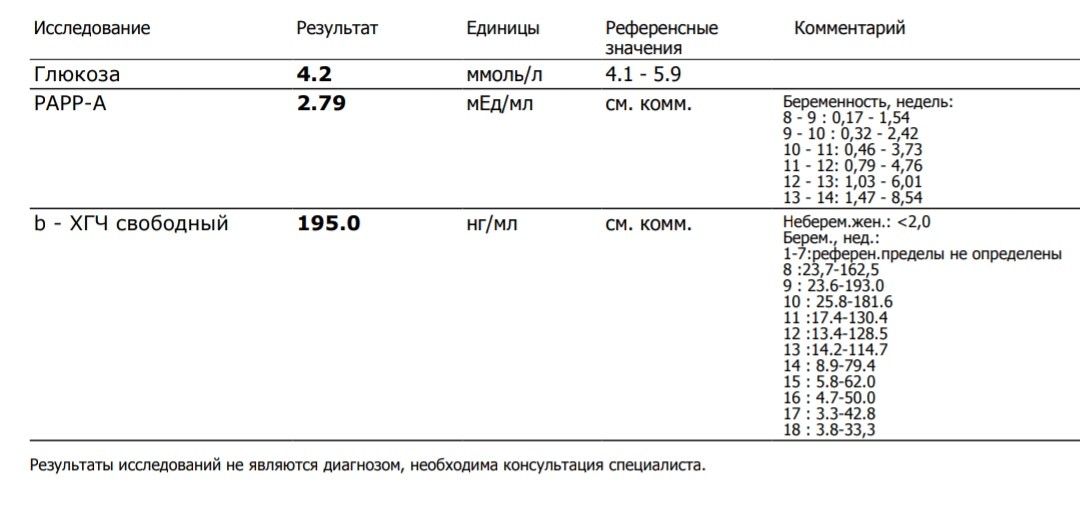 012) (Таблица II). После исключения четырех случаев приема эстрогена в группе FET уровень β-ХГЧ оставался самым высоким среди исследуемых групп, но разница не достигла статистической значимости. Не было различий в уровнях AFP между любой из исследуемых групп и контрольной группой (Таблица II).
012) (Таблица II). После исключения четырех случаев приема эстрогена в группе FET уровень β-ХГЧ оставался самым высоким среди исследуемых групп, но разница не достигла статистической значимости. Не было различий в уровнях AFP между любой из исследуемых групп и контрольной группой (Таблица II).
В таблице III приведены уровни маркеров в зависимости от количества перенесенных эмбрионов. Слабая положительная корреляция между количеством перенесенных эмбрионов и уровнями маркеров наблюдалась только в группе ЭКО (таблица III).Количество используемых гонадотропинов не различалось между группами ЭКО (диапазон 450–4800 МЕ) и ИКСИ (диапазон 950–3750 МЕ) (Таблица I). Не было обнаружено корреляции между уровнями маркеров и количеством используемых гонадотропинов.
Частота выявления синдрома Дауна при скрининге сыворотки составляет 60–66% при 5% FPR (Wald et al ., 1988), тогда как ультразвуковой скрининг выявляет 77–81% пораженных беременностей (Pandya et al ., 1995. ; Economides et al ., 1998). В нашем материале беременностей с искусственным оплодотворением FPR составила 19%, что является самым высоким показателем в группе FET (30,8%). По нашим данным, более высокий уровень FPR при скрининге синдрома Дауна при беременности с искусственным оплодотворением был обусловлен повышенным уровнем свободного β-ХГЧ.В представленном материале уровни β-ХГЧ были повышены как при беременностях с ЭКО, так и при ИКСИ, но повышение было более очевидным в группе ЭКО. Уровни АФП остались почти на том же уровне, что и в контроле. Наши результаты согласуются с более ранними исследованиями беременностей при ЭКО (Heinonen et al ., 1996; Ribbert et al ., 1996; Frishman et al ., 1997; Wald et al ., 1999), но В отличие от результатов Lam и соавторов, которые сообщили о несколько более низком ХГЧ и значительном снижении уровней АФП при беременностях по ИКСИ по сравнению с контрольной группой (Lam et al . , 1999). В настоящее время нет хорошего объяснения различий в уровнях маркеров среди беременностей по ИКСИ между настоящим исследованием и исследованием Lam et al . Клинические характеристики исследуемых популяций сопоставимы (средний возраст матери, гестационный возраст при выборке), но количество случаев в обоих исследованиях было относительно небольшим (Lam et al ., 1999: n = 23; наше исследование n = 32). Поскольку первое исследование проводилось на азиатских женщинах, а наше — на европейцах, этнические различия могут быть одним из объяснений различий в уровнях маркеров.Однако при скрининге синдрома Дауна среди азиатских популяций ранее сообщалось о более высоких уровнях ХГЧ, чем среди белых, черных африканцев или жителей Северной Африки (Muller et al ., 1994), что еще больше затрудняет интерпретацию этих данных.
, 1999). В настоящее время нет хорошего объяснения различий в уровнях маркеров среди беременностей по ИКСИ между настоящим исследованием и исследованием Lam et al . Клинические характеристики исследуемых популяций сопоставимы (средний возраст матери, гестационный возраст при выборке), но количество случаев в обоих исследованиях было относительно небольшим (Lam et al ., 1999: n = 23; наше исследование n = 32). Поскольку первое исследование проводилось на азиатских женщинах, а наше — на европейцах, этнические различия могут быть одним из объяснений различий в уровнях маркеров.Однако при скрининге синдрома Дауна среди азиатских популяций ранее сообщалось о более высоких уровнях ХГЧ, чем среди белых, черных африканцев или жителей Северной Африки (Muller et al ., 1994), что еще больше затрудняет интерпретацию этих данных. Насколько нам известно, влияние количества перенесенных эмбрионов на уровни маркеров ранее не оценивалось, хотя ранняя имплантация нескольких эмбрионов может влиять на уровни маркеров и, таким образом, вызывать ложноположительные результаты при скрининге на синдром Дауна при помощи вспомогательных средств. репродуктивная беременность.Мы обнаружили слабую положительную корреляцию между количеством перенесенных эмбрионов и уровнями сывороточных маркеров только в группе ЭКО. Однако статистическая мощность этого анализа снижается из-за того, что перенос как одного, так и четырех эмбрионов редко выполнялся в Финляндии в течение 1994–1999 годов, что делает размеры соответствующих подгрупп небольшими. По нашим данным, количество перенесенных эмбрионов может влиять на уровни маркеров и должно быть пересмотрено с более крупными данными.Хотя раннее ультразвуковое исследование было выполнено примерно на 7 неделе беременности, чтобы исключить многоплодную беременность, ранняя имплантация нескольких эмбрионов может повлиять на уровень ХГЧ даже во время скрининга во втором триместре.
репродуктивная беременность.Мы обнаружили слабую положительную корреляцию между количеством перенесенных эмбрионов и уровнями сывороточных маркеров только в группе ЭКО. Однако статистическая мощность этого анализа снижается из-за того, что перенос как одного, так и четырех эмбрионов редко выполнялся в Финляндии в течение 1994–1999 годов, что делает размеры соответствующих подгрупп небольшими. По нашим данным, количество перенесенных эмбрионов может влиять на уровни маркеров и должно быть пересмотрено с более крупными данными.Хотя раннее ультразвуковое исследование было выполнено примерно на 7 неделе беременности, чтобы исключить многоплодную беременность, ранняя имплантация нескольких эмбрионов может повлиять на уровень ХГЧ даже во время скрининга во втором триместре.
Одна из наших основных гипотез заключалась в том, что доза гонадотропина, используемая для стимуляции яичников, может вызывать изменения в уровнях маркеров при беременности с искусственным оплодотворением. Однако нам не удалось найти никакой связи между уровнями маркеров материнской сыворотки и количеством лекарств для стимуляции яичников. К сожалению, нам не удалось оценить влияние фактического ответа яичников во время стимуляции на уровни маркеров. Можно предположить, что при скрининге сыворотки матери в середине триместра беременности повышенный уровень β-ХГЧ может происходить в результате чрезмерной реакции яичников, при которой развиваются множественные фолликулы и желтые тела. Однако группа FET, которая, как мы предполагали, была наиболее близкой к контролю по уровням маркеров, продемонстрировала самые высокие уровни MoM HCG в сыворотке и самый высокий FPR (30,8%). Вместо стимуляции овуляции механизм повышения уровня ХГЧ в сыворотке в группе ФЭТ может быть связан с неудачей плацентации, которая может привести к изменениям функции трофобласта и, следовательно, к выработке ХГЧ.Среди нашей исследуемой популяции частота имплантации была немного ниже в группе FET (49%), чем в группах IVF (54%) или ICSI (51%). Это соответствует более высокому проценту наступления беременности после переноса свежих, чем криоконсервированных эмбрионов.
К сожалению, нам не удалось оценить влияние фактического ответа яичников во время стимуляции на уровни маркеров. Можно предположить, что при скрининге сыворотки матери в середине триместра беременности повышенный уровень β-ХГЧ может происходить в результате чрезмерной реакции яичников, при которой развиваются множественные фолликулы и желтые тела. Однако группа FET, которая, как мы предполагали, была наиболее близкой к контролю по уровням маркеров, продемонстрировала самые высокие уровни MoM HCG в сыворотке и самый высокий FPR (30,8%). Вместо стимуляции овуляции механизм повышения уровня ХГЧ в сыворотке в группе ФЭТ может быть связан с неудачей плацентации, которая может привести к изменениям функции трофобласта и, следовательно, к выработке ХГЧ.Среди нашей исследуемой популяции частота имплантации была немного ниже в группе FET (49%), чем в группах IVF (54%) или ICSI (51%). Это соответствует более высокому проценту наступления беременности после переноса свежих, чем криоконсервированных эмбрионов. Интересно, что после исключения субъектов, принимающих эстроген, уровень β-ХГЧ немного снизился. Было высказано предположение, что причиной суб / бесплодия могут быть некоторые неустановленные эндокринные / метаболические ошибки. Эти факторы могут повлиять на результаты скрининга сыворотки при беременностях с искусственным оплодотворением, а также могут быть причиной осложнений при этих беременностях (McElrath and Wise, 1997; Maymon and Shulman, 2001).
Интересно, что после исключения субъектов, принимающих эстроген, уровень β-ХГЧ немного снизился. Было высказано предположение, что причиной суб / бесплодия могут быть некоторые неустановленные эндокринные / метаболические ошибки. Эти факторы могут повлиять на результаты скрининга сыворотки при беременностях с искусственным оплодотворением, а также могут быть причиной осложнений при этих беременностях (McElrath and Wise, 1997; Maymon and Shulman, 2001).
Было высказано предположение, что высокие уровни ХГЧ при вспомогательной репродуктивной беременности могут быть вызваны более высокими уровнями прогестерона при этих беременностях, чем при спонтанных беременностях (Wald et al ., 1999). Эти исследователи предположили, что причиной высоких уровней прогестерона могло быть развитие множественных фолликулов при беременностях с ЭКО и ИКСИ и последующее образование множественных желтых тел, что, в свою очередь, могло увеличить выработку ХГЧ из плаценты. Результаты, полученные с группой FET в настоящем исследовании, и недавние данные о беременностях после донорства ооцитов (Maymon and Shulman, 2001) сбивают с толку эту теорию, потому что при беременностях с FET и донорством ооцитов не существует избыточных фолликулов или желтых тел. .В случаях FET при заместительной терапии эстрогеном не участвует желтое тело, но заместительная терапия прогестероном используется до 8 недели беременности, как и во всех протоколах IVF / ICSI / FET настоящего исследования. Поскольку период полувыведения природного прогестерона составляет всего 4 часа, мы предположили, что замещение прогестерона не может повлиять на уровни маркеров в середине триместра (14–18 неделя беременности) при беременности с искусственным оплодотворением. Также недавно было показано, что при беременностях с ЭКО сывороточные уровни прогестерона, но не ХГЧ, значительно выше, чем при нормальной беременности, вплоть до 8 недель после зачатия (Costea et al ., 2000).
.В случаях FET при заместительной терапии эстрогеном не участвует желтое тело, но заместительная терапия прогестероном используется до 8 недели беременности, как и во всех протоколах IVF / ICSI / FET настоящего исследования. Поскольку период полувыведения природного прогестерона составляет всего 4 часа, мы предположили, что замещение прогестерона не может повлиять на уровни маркеров в середине триместра (14–18 неделя беременности) при беременности с искусственным оплодотворением. Также недавно было показано, что при беременностях с ЭКО сывороточные уровни прогестерона, но не ХГЧ, значительно выше, чем при нормальной беременности, вплоть до 8 недель после зачатия (Costea et al ., 2000).
Согласно настоящему исследованию, FPR при скрининге синдрома Дауна при вспомогательной репродуктивной беременности выше, чем при спонтанной беременности. Это приводит к увеличению потребности в инвазивных процедурах, например амниоцентез, при котором риск прерывания беременности составляет 0,5–1%.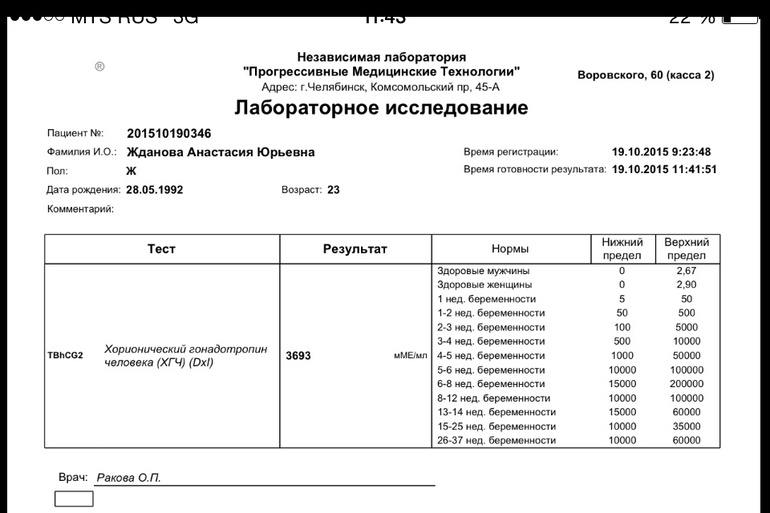 Даже этот небольшой риск может оказаться слишком большим при таких ценных беременностях, когда бесплодие может длиться много лет.
Даже этот небольшой риск может оказаться слишком большим при таких ценных беременностях, когда бесплодие может длиться много лет.
Демографические данные по группам ЭКО, ИКСИ, переноса замороженных эмбрионов (FET) и контрольной группе
| . | ЭКО ( n = 58) . | ICSI ( n = 32) . | полевой транзистор ( n = 26) . | Элементы управления ( n = 6548) . | п. . | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Значения являются средними (стандартное отклонение). P -значения указывают на значительные различия между группами. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NS = не имеет значения. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Возраст (лет) | 33.9 (4,1) | 32,1 (4,2) | 32,4 (3,7) | 29,7 (4,7) | 0,0001 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Гестационный возраст (дни) | 110,6 (4,7) | 109,1 (3,8) | 110,7 4,3) | 109,8 (4,1) | NS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Количество гонадотропинов (МЕ) | 2150,4 (802,6) | 1994,7 (586,9) | — | — |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 д..
д..

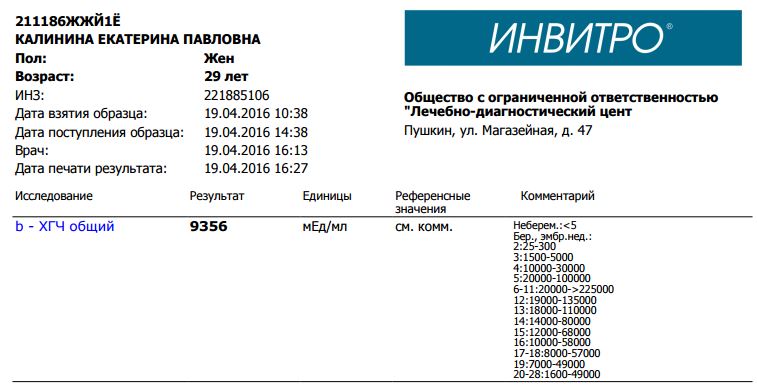
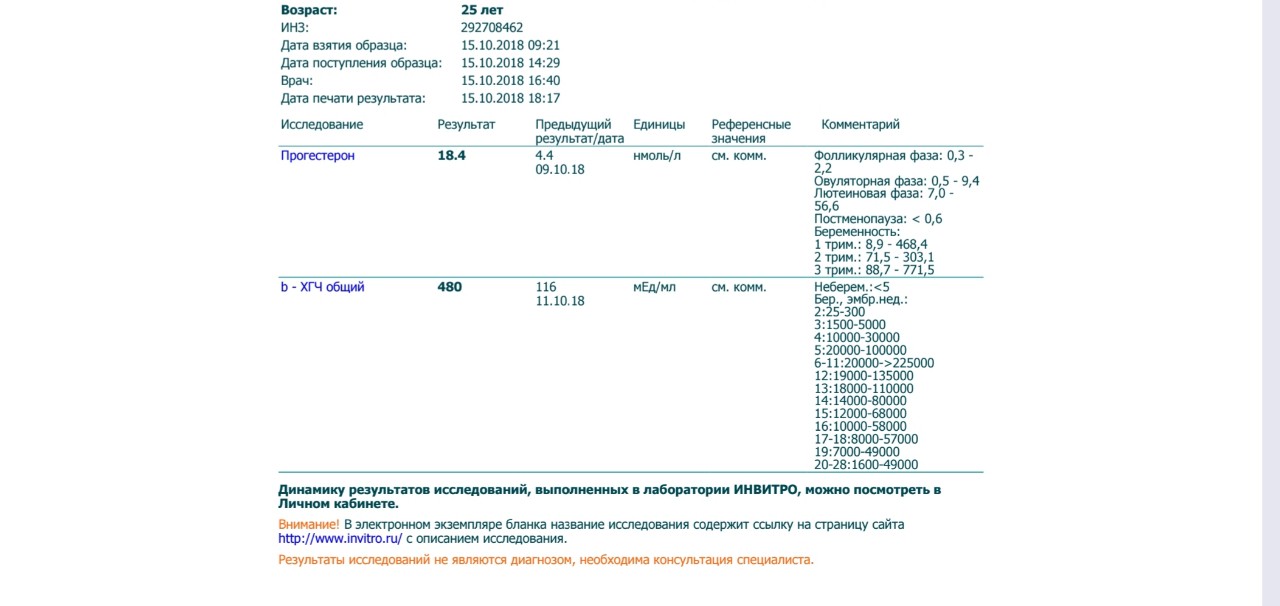

 Начальный уровень ХГЧ выше при многоплодной беременности, чем при одиночной.Но скорость роста одинакова для обеих групп.
Начальный уровень ХГЧ выше при многоплодной беременности, чем при одиночной.Но скорость роста одинакова для обеих групп.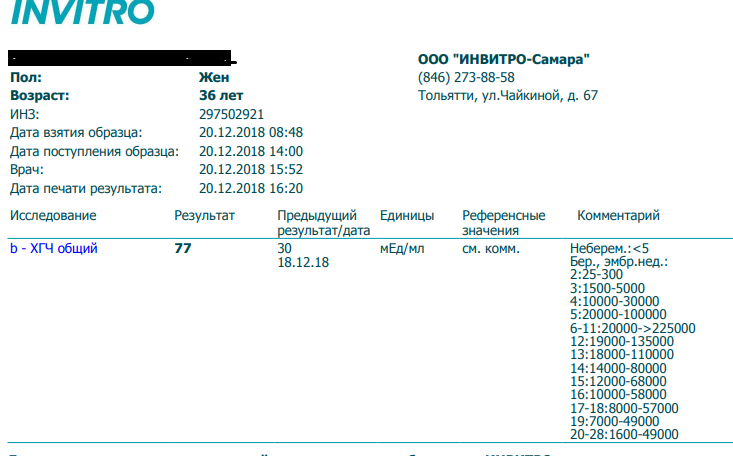



 07
07 00
00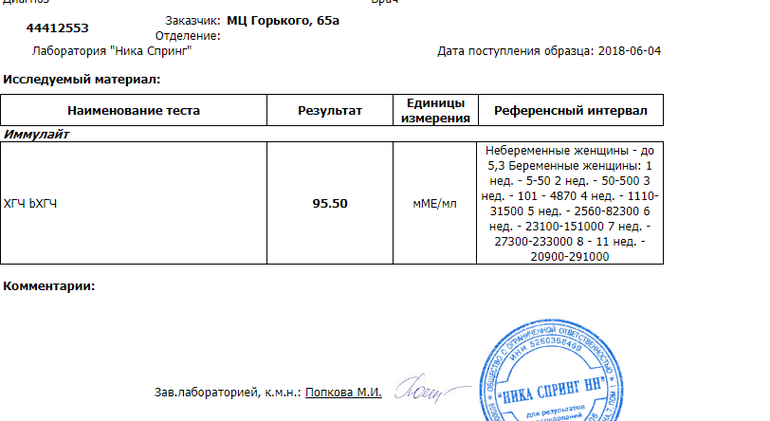 19
19
 91
91
 64
64 99
99
 15
15
 и др. . (
и др. . (
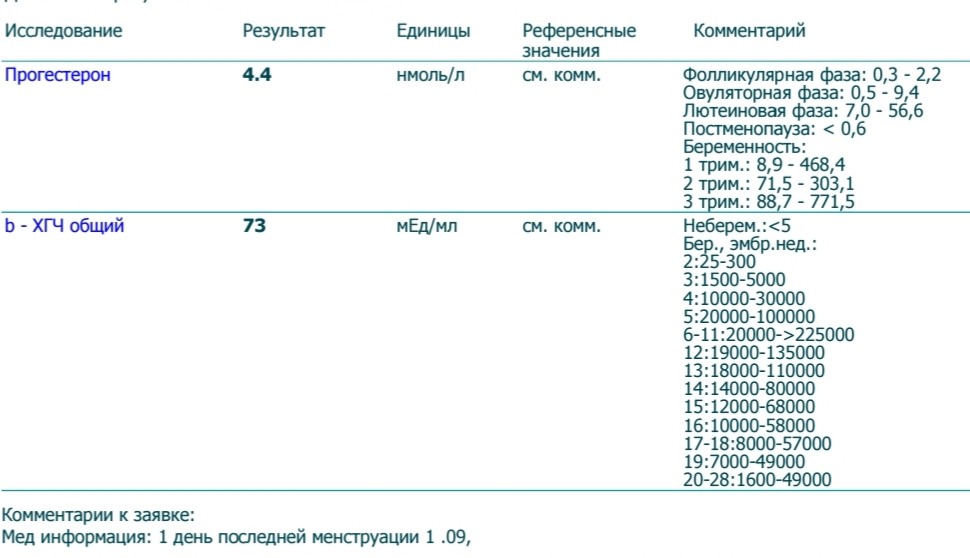 Это используется для расчета беременности на более позднем этапе, то есть день аспирации считается за полные две недели беременности, а дата за две недели до аспирации — как день последней менструации (с которой обычно рассчитывается беременность).
Это используется для расчета беременности на более позднем этапе, то есть день аспирации считается за полные две недели беременности, а дата за две недели до аспирации — как день последней менструации (с которой обычно рассчитывается беременность). Тесты на беременность в моче имеют чувствительность 25-50 МЕ ХГЧ и показывают положительные результаты в то время, когда ожидается менструация. В некоторых случаях биохимическая беременность не развивается, и клиническая беременность не удается. Это чаще встречается у женщин старше 40 лет.
Тесты на беременность в моче имеют чувствительность 25-50 МЕ ХГЧ и показывают положительные результаты в то время, когда ожидается менструация. В некоторых случаях биохимическая беременность не развивается, и клиническая беременность не удается. Это чаще встречается у женщин старше 40 лет.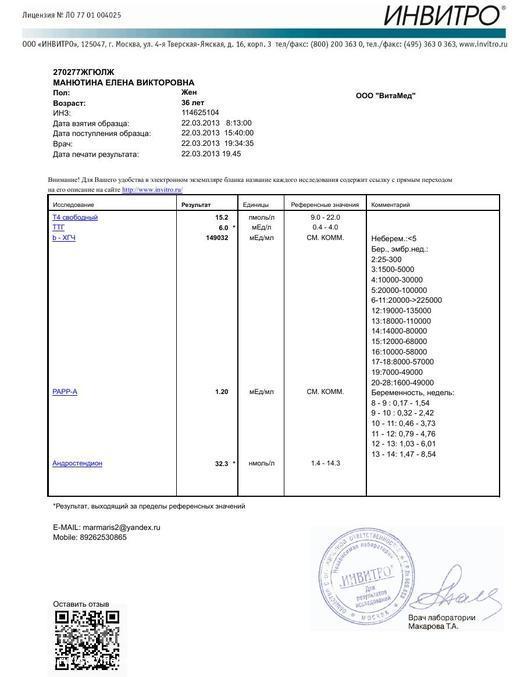 Риск гетеротопной беременности (один эмбрион развивается в матке, а другой — в маточной трубе) составляет около 1%.
Риск гетеротопной беременности (один эмбрион развивается в матке, а другой — в маточной трубе) составляет около 1%. Слишком много хорошего? Экспериментальные данные свидетельствуют о том, что длительное воздействие ХГЧ пагубно влияет на восприимчивость эндометрия. Hum Reprod.2013; 28: 1610–9.
Слишком много хорошего? Экспериментальные данные свидетельствуют о том, что длительное воздействие ХГЧ пагубно влияет на восприимчивость эндометрия. Hum Reprod.2013; 28: 1610–9. , Зибзенрубл Э., Вильдт Л. Новое понимание паракринологии эндометрия человека и коммуникации эмбриона с матерью с помощью внутриматочного микродиализа. Обновление Hum Reprod. 1998. 4: 532–8.
, Зибзенрубл Э., Вильдт Л. Новое понимание паракринологии эндометрия человека и коммуникации эмбриона с матерью с помощью внутриматочного микродиализа. Обновление Hum Reprod. 1998. 4: 532–8.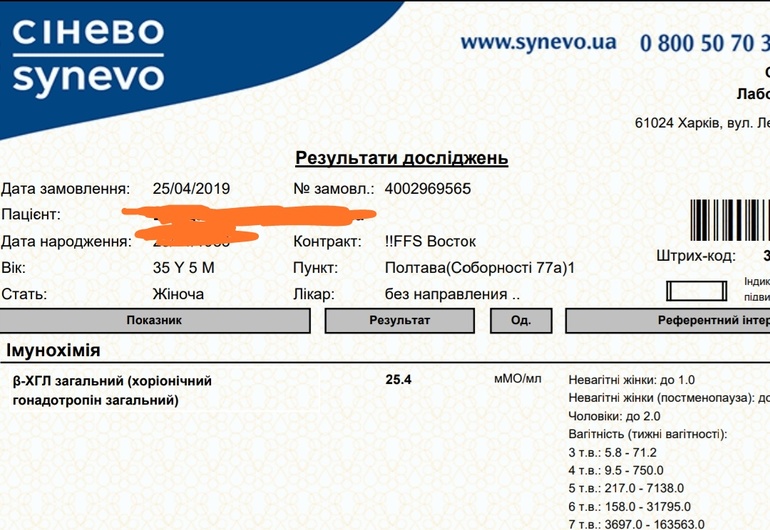 Fertil Steril. 2008; 90: 1390–5.
Fertil Steril. 2008; 90: 1390–5.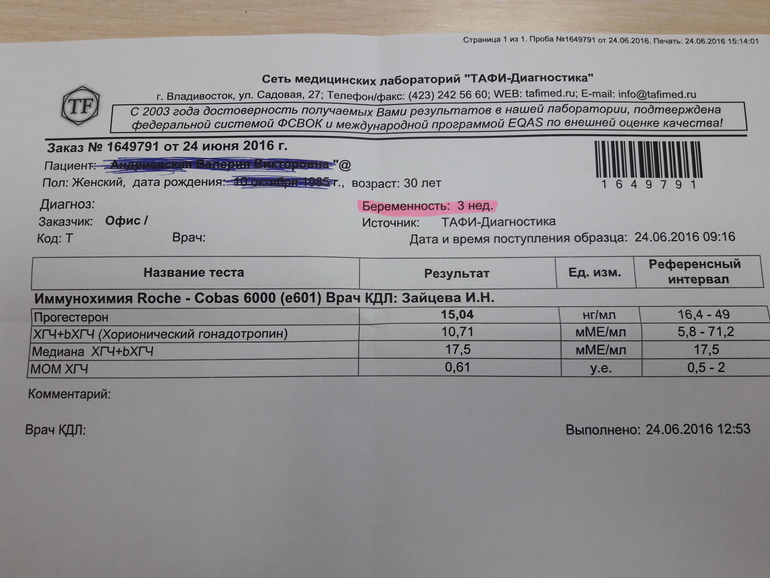 J Clin Endocrinol Metab. 2005; 90: 2904–10.
J Clin Endocrinol Metab. 2005; 90: 2904–10.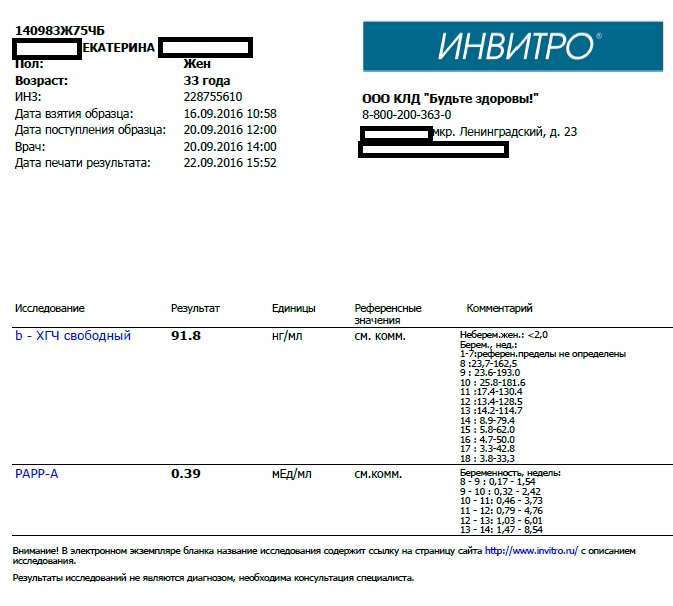
 Репрод Биол Эндокринол. 2014; 12: 9.
Репрод Биол Эндокринол. 2014; 12: 9. Лютеинизирующий гормон влияет на восприимчивость матки независимо от функции яичников. Воспроизвести BioMed Online. 2003; 7: 59–64.
Лютеинизирующий гормон влияет на восприимчивость матки независимо от функции яичников. Воспроизвести BioMed Online. 2003; 7: 59–64. Fertil Steril. 2009. 92: 1520–4.
Fertil Steril. 2009. 92: 1520–4. Fertil Steril. 2014; 102: 1591–5.e2.
Fertil Steril. 2014; 102: 1591–5.e2. Воспроизвести BioMed Online. 2017; 34: 240–7.
Воспроизвести BioMed Online. 2017; 34: 240–7.

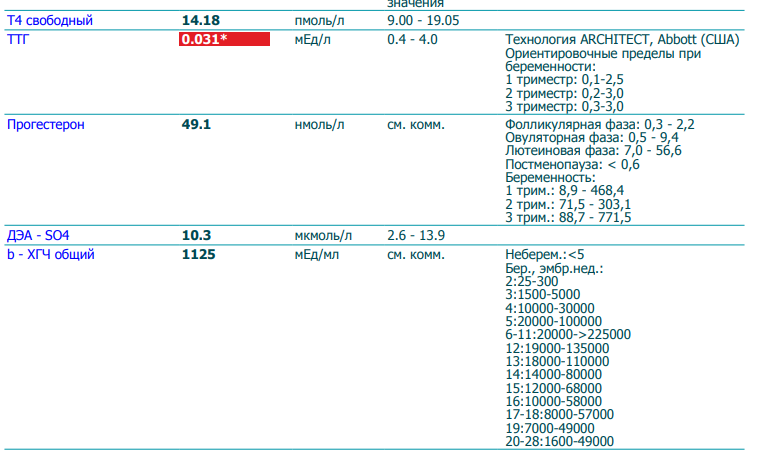 Это ожидание, которое обычно длится от 9 до 14 дней, в зависимости от того, когда был осуществлен перенос эмбриона, является временем надежды, но также и стрессом, который может вызвать у пациентов сильное беспокойство.
Это ожидание, которое обычно длится от 9 до 14 дней, в зависимости от того, когда был осуществлен перенос эмбриона, является временем надежды, но также и стрессом, который может вызвать у пациентов сильное беспокойство. ХГЧ — очень важный и необходимый гормон для силы и прогресса беременности.
ХГЧ — очень важный и необходимый гормон для силы и прогресса беременности.
