Молекула — хлорид — натрий
Cтраница 1
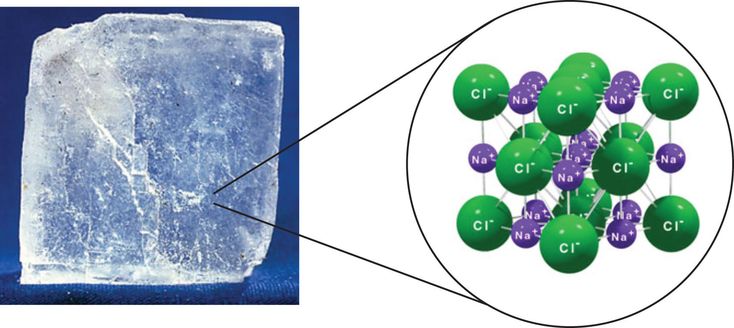
Молекулы хлорида натрия NaCI существуют только в парообразном состоянии. [1]
Молекулы хлорида натрия NaCl существуют только в парообразном состоянии. В твердом ( кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. [2]
Молекулы хлорида натрия NaCi существуют только в парообразном состоянии. В твердом ( кристаллическом) состоянии ионные соединения состоят из закономерно расположенных положительных и отрицательных ионов. [3]
В молекуле хлорида натрия электронная пара локализована на атоме хлора. [4]
Рассмотрим образование молекул хлорида натрия. Во внешнем слое у иона натрия 8 электронов, и он приобретает устойчивую восьмиэлектронную конфигурацию ближайшего инертного газа неона. Атом хлора, получив электрон, становится отрицательным ионом ( анионом) и приобретает устойчивую конфигурацию инертного газа аргона.
Как известно, молекула хлорида натрия состоит из двух, а молекула хлорида бария — из трех атомов, и Аррениус пришел к мысли, что при растворении в растворителях, подобных воде, определенная часть молекул распадается на отдельные атомы. Более того, поскольку эти распавшиеся молекулы проводят электрический ток ( в то время как молекулы, подобные молекуле сахара, не распадаются и не проводят электрический ток), Аррениус предположил, что молекулы распадаются ( или диссоциируют) не на обычные атомы, а на атомы, несущие электрический заряд. [6]
Очевидно, что молекулы хлорида натрия при их растворении в воде делятся на какие-то части. Зная, что молекула не может подвергаться механическому делению на две маленькие молекулы того же хлорида натрия, мы должны искать какое-то иное объяснение ненормально большому давлению. [7]
Прибор для прохождения электрического тока через растворы. [8]
[8] |
Следовательно, при растворении 1000 молекул хлорида натрия в растворе появляется 1 000 свободно движущихся ионов натрия и 1 000 свободно движущихся ионов хлора. Таким образом, общее число частиц в 1 мл раствора составляет 2000; отсюда следует, что раствор хлорида натрия должен обнаруживать двойное осмотическое давление, двойное понижение температуры замерзания и двойное повышение температуры кипения. [9]
Где локализована электронная пара в молекуле хлорида натрия. [10]
| Прибор для прохождения электрического тока через растворы. [11] |
И с атомом газообразного хлора, когда образуется молекула хлорида натрия NaCl. Атом натрия теряет свой валентный электрон и переходит в состояние иона с одним положительным зарядом; этот электрон захватывается атомом хлора, и последний переходит в состояние иона хлора с одним отрицательным зарядом.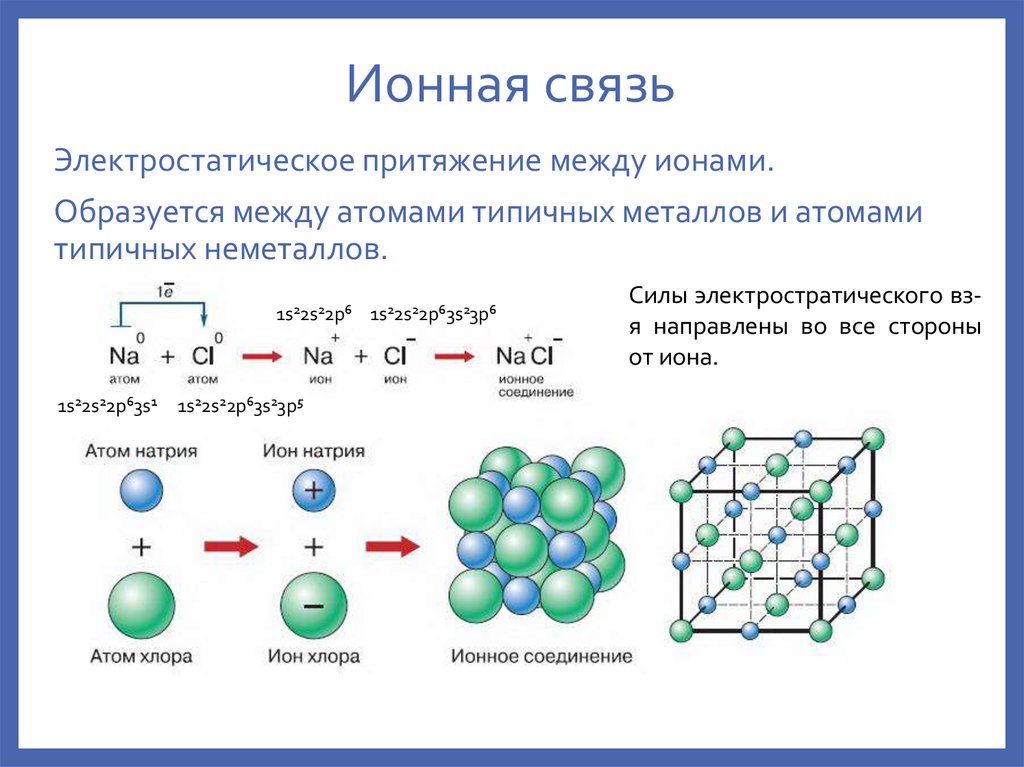
Таким образом, можно сказать, что в молекуле хлорида натрия электронная пара принадлежит атому хлора. [13]
Два атома натрия, соединяясь с молекулой хлора, образуют 2 молекулы хлорида натрия. [14]
Два атома натрия, соединяясь с молекулой хлора, образуют две молекулы хлорида натрия. [15]
Страницы: 1 2 3
Гепарин-натрий Браун 5000 МЕ/мл
Гепарин-натрий Браун является лекарственным препаратом, отпускаемым по рецепту. Информация на данной странице предназначена исключительно для специалистов здравоохранения — для медицинских и фармацевтических работников. Полная информация по применению препарата Гепарин-натрий Браун содержится в инструкции по медицинскому применению.
ГЕПАРИН-НАТРИЙ БРАУН
Раствор для внутривенного и подкожного введения
Регистрационный номер: П N012984/01 от 28. 10.2011
10.2011
Торговое название: Гепарин-натрий Браун
Лекарственная форма: раствор для внутривенного и подкожного введения
МНН или Группировочное наименование: Гепарин натрия
Состав
5 мл раствора содержат:
| Действующее вещество | |
|---|---|
| Гепарин натрия | 25 000 МЕ |
| Вспомогательные вещества | |
| Спирт бензиловый | 50 мг |
| Натрия хлорид | 15 мг |
| Натрия гидроксид 0,1 М или кислота хлористоводородная 0,1 М | 0–0,5 мкл |
| Вода для инъекций | до 5 мл |
Характеристики
Описание: бесцветный или светло-желтый раствор
Фармакотерапевтическая группа: антикоагулянтное средство прямого действия
Код АТХ: B01AB01
Фармакологические свойства
Гепарин — сульфатированный мукополисахарид, состоящий из остатков глюкозамин-N-серной кислоты и сульфатированных остатков глюкуроновой кислоты, связанных друг с другом гликозидной связью. Вследствие того, что молекула гепарина обладает выраженным отрицательным зарядом, она образует комплексы с определенными белками, изменяя их биологическую активность. В частности, путем образования комплекса с гепарином активность антитромбина III (AT III) повышается примерно в 700 раз.
Вследствие того, что молекула гепарина обладает выраженным отрицательным зарядом, она образует комплексы с определенными белками, изменяя их биологическую активность. В частности, путем образования комплекса с гепарином активность антитромбина III (AT III) повышается примерно в 700 раз.
Активированный антитромбин ингибирует различные протеазы, действующие на серин, включая факторы свертывания XIIa XIа, Ха, VIIa и IIa. Фактор VIIa обладает умеренной чувствительностью, а фактор IIa (тромбин), напротив, характеризуется высокой чувствительностью к действию комплекса АТ III-гепарин. Даже низкие дозы гепарина ускоряют инактивацию факторов IIa (тромбин) и Ха. Это объясняет эффективность низких доз гепарина при профилактике тромбозов. Антикоагулянтное действие гепарина зависит от концентрации антитромбина и фибриногена. Гепарин в высоких дозах инактивирует образующийся в избытке тромбин и, таким образом, предотвращает образование фибрина из фибриногена. Гепарин также оказывает влияние на функцию тромбоцитов. Некоторые вещества, содержащиеся в тромбоцитах (например, тромбоцитарный фактор 4), нейтрализуют гепарин.
Некоторые вещества, содержащиеся в тромбоцитах (например, тромбоцитарный фактор 4), нейтрализуют гепарин.
Показания к применению
- Профилактика тромбозов и тромбоэмболий.
- Лечение острых венозных и артериальных тромбозов и тромбоэмболий в качестве антикоагулянтного средства (включая раннее лечение инфаркта миокарда и нестабильной стенокардии).
- Предупреждение свертывания крови в процессе экстракорпорального кровообращения (при использовании аппарата искусственного кровообращения и гемодиализа).
Способ применения и дозы
Полная информация по применению препарата Гепарин-натрий Браун содержится в инструкции по медицинскому применению.
Подкожное или внутривенное введение.
Доза гепарина определяется индивидуально для каждого пациента и зависит от фактических значений показателей системы свертывания крови, характера и течения заболевания, реакции на проводимую терапию, характера и выраженности неблагоприятных побочных реакций, а также от возраста и массы тела пациента.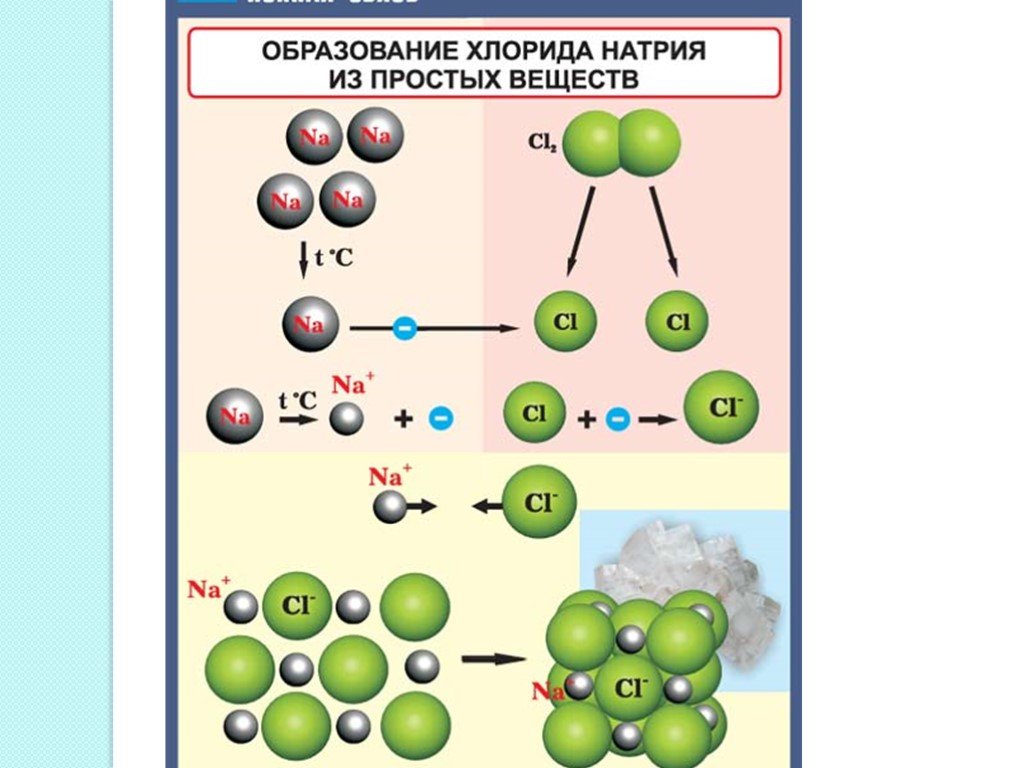 Необходимо учитывать индивидуальную чувствительность к гепарину, а также изменение толерантности к лечению гепарином.
Необходимо учитывать индивидуальную чувствительность к гепарину, а также изменение толерантности к лечению гепарином.
Подкожная инъекция
После дезинфекции кожи дозу гепарина вводят строго подкожно в неплотно захваченную складку кожи на животе или разгибательной поверхности бедра, вертикально к продольной оси тела, используя тонкую иглу. Перед инъекцией необходимо удалить капли раствора с наружной части иглы, поскольку гепарин, введенный в пункционный канал, может вызвать поверхностную гематому или, в редких случаях, местную аллергическую реакцию.
Чтобы избежать нарушения дренажа лимфы у пациентов, перенесших резекцию лимфатических узлов в абдоминальной или урогенитальной области, подкожную инъекцию гепарина необходимо выполнять в верхнюю часть плеча.
Внутривенная инфузия
Для внутривенной инфузии Гепарин-натрий Браун может быть разведен в следующих растворах для инфузий:
- раствор натрия хлорида 0,9 %;
- раствор глюкозы 5 %, 10 %;
- раствор натрия хлорида 0,45 % и глюкозы 2,5 %;
- раствор Рингера.

Классический случай ионной связи: молекула хлорида натрия образуется в результате ионизации атомов натрия и хлора и притяжения образующихся ионов. Атом натрия имеет один 3s-электрон вне замкнутой оболочки, и для удаления этого электрона требуется всего 5,14 электрон-вольт энергии. Хлору не хватает одного электрона, чтобы заполнить оболочку, и он высвобождает 3,62 эВ, когда приобретает этот электрон (его сродство к электрону составляет 3,62 эВ).
Это означает, что требуется всего 1,52 эВ энергии, чтобы отдать один из электронов натрия хлору, когда они находятся далеко друг от друга. Когда образующиеся ионы сближаются, их электрическая потенциальная энергия становится все более и более отрицательной, достигая -1,52 эВ примерно при 0,9Разделение 4 нм. Это означает, что если бы нейтральные атомы натрия и хлора оказались ближе 0,94 нм, то энергетически выгодно было бы передать электрон от Na к Cl и образовать ионную связь. Кривая потенциальной энергии показывает, что существует минимум на расстоянии 0,236 нм, а затем крутой подъем потенциала, который представляет силу отталкивания. Эта сила отталкивания представляет собой нечто большее, чем просто электростатическое отталкивание между электронными облаками двух атомов. Он имеет квантово-механический характер, основанный на принципе исключения Паули, и его часто называют просто «отталкиванием принципа исключения». Когда ионы находятся далеко друг от друга, волновые функции их остовных электронов существенно не перекрываются, и они могут иметь одинаковые квантовые числа. По мере того, как они приближаются, увеличивающееся перекрытие волновых функций приводит к тому, что некоторые из них вынуждены переходить в более высокие энергетические состояния. Никакие два электрона не могут занимать одно и то же состояние, поэтому, когда для составной двухъядерной системы формируется новый набор энергетических состояний, более низкие энергетические состояния заполняются, а некоторые электроны выталкиваются в более высокие состояния. Приведенная выше диаграмма потенциалов предназначена для газообразного NaCl, и окружающая среда отличается в нормальном твердом состоянии, когда хлорид натрия (обычная поваренная соль) образует кубические кристаллы. Расстояние между ионами составляет 0,28 нм, что несколько больше, чем в газообразном состоянии. Главной частью изучения молекулярной структуры является описание химических связей, которые образуются между атомами. Классическими исследованиями являются крайности ионной связи в хлориде натрия и ковалентной связи в молекуле водорода.
| Индекс Артикул | |||
| Вернуться |
Ионные структуры — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3627
- Джим Кларк
- Школа Труро в Корнуолле
На этой странице объясняется взаимосвязь между расположением ионов в типичном ионном твердом веществе, таком как хлорид натрия, и его физическими свойствами — точкой плавления, точкой кипения, хрупкостью, растворимостью и электрическими характеристиками. Это также объясняет, почему хлорид цезия имеет структуру, отличную от хлорида натрия, хотя и натрий, и цезий находятся в группе 1 Периодической таблицы.
Это также объясняет, почему хлорид цезия имеет структуру, отличную от хлорида натрия, хотя и натрий, и цезий находятся в группе 1 Периодической таблицы.
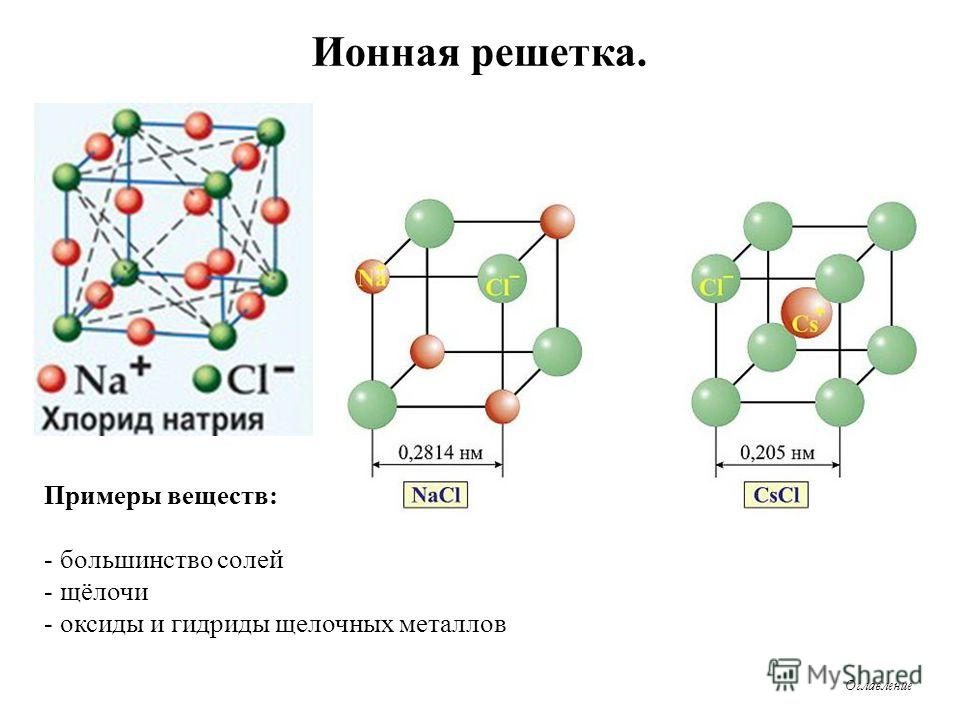
Структура типичного ионного твердого вещества — хлорида натрия
Хлорид натрия считается типичным ионным соединением. Подобные соединения состоят из гигантской (бесконечно повторяющейся) решетки ионов. Итак, хлорид натрия (и любое другое ионное соединение) описывается как имеющий гигантскую ионную структуру.
Вам должно быть ясно, что гигант в данном контексте не означает просто очень большой. Это означает, что вы не можете точно сказать, сколько существует ионов. Там могут быть миллиарды ионов натрия и ионов хлора, упакованных вместе, или триллионы, или что-то еще — это просто зависит от размера кристалла. Это отличается, скажем, от молекулы воды, которая всегда содержит ровно 2 атома водорода и один атом кислорода — никогда больше и никогда меньше. Небольшой репрезентативный кусочек решетки хлорида натрия выглядит так:
Если вы внимательно посмотрите на схему, то увидите, что ионы натрия и ионы хлора чередуются друг с другом в каждом из трех измерений.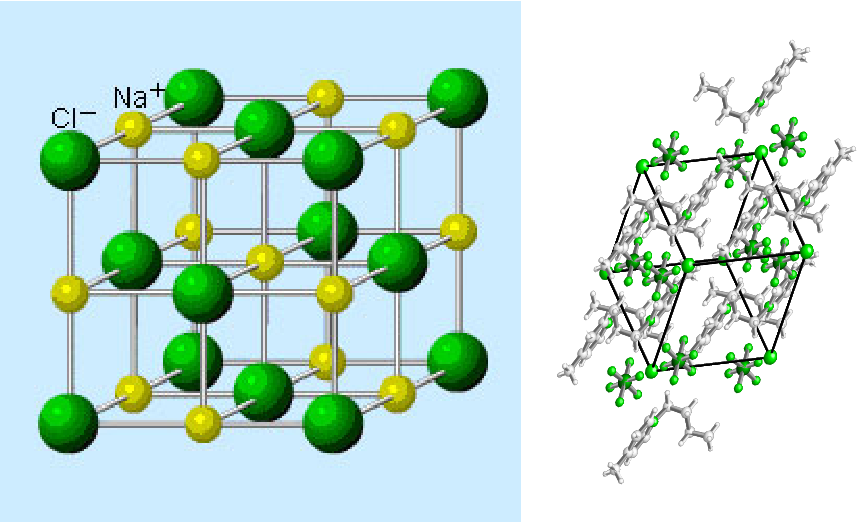 Эту диаграмму достаточно легко нарисовать с помощью компьютера, но крайне сложно убедительно нарисовать вручную. Обычно мы рисуем «взорванную» версию, которая выглядит так:
Эту диаграмму достаточно легко нарисовать с помощью компьютера, но крайне сложно убедительно нарисовать вручную. Обычно мы рисуем «взорванную» версию, которая выглядит так:
Только те ионы, которые соединены линиями, на самом деле соприкасаются друг с другом. Ион натрия в центре соприкасается с 6 ионами хлора. Случайно мы могли бы с тем же успехом расположить диаграмму вокруг иона хлорида, который, конечно же, был бы затронут 6 ионами натрия. Хлорид натрия описывается как координированный 6: 6. Эта диаграмма представляет собой лишь крошечную часть всего кристалла хлорида натрия; картина повторяется таким образом для бесчисленных ионов.
Как нарисовать эту структуру
Нарисуйте идеальный квадрат:
Теперь нарисуйте такой же квадрат за этим и немного сместите его. Возможно, вам придется немного потренироваться, чтобы правильно расположить два квадрата. Если вы ошибетесь, все ионы перепутаются друг с другом на вашей окончательной диаграмме.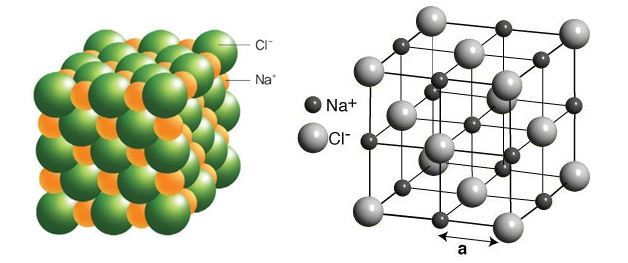
Превратите это в идеальный куб, соединив квадраты вместе:
Теперь самое сложное! Разделите этот большой куб на 8 маленьких кубов, соединив среднюю точку каждого ребра с средней точкой ребра напротив него. Чтобы завершить процесс, вам также нужно будет соединить среднюю точку каждой грани (легко найти, когда вы соедините края) с средней точкой противоположной грани.
Теперь все, что вам нужно сделать, это ввести ионы. Используйте разные цвета или разные размеры для двух разных ионов и не забудьте ключ. Неважно, окажетесь ли вы в центре куба ионом натрия или ионом хлорида — важно лишь то, что они чередуются во всех трех измерениях.
Вы должны быть в состоянии нарисовать совершенно адекватный набросок этого от руки менее чем за две минуты — менее одной минуты, если вы не слишком суетливы!
Почему хлорид натрия координируется в соотношении 6:6?
Чем сильнее притяжение между положительными и отрицательными ионами, тем больше энергии высвобождается. Чем больше энергии высвобождается, тем более энергетически стабильной становится структура. Это означает, что для достижения максимальной стабильности вам необходимо максимальное количество аттракционов. Так почему же каждый ион окружает себя 6 ионами противоположного заряда? Это максимальное количество ионов хлора, которое вы можете разместить вокруг центрального иона натрия, прежде чем ионы хлора начнут касаться друг друга. Если они начнут соприкасаться, вы создадите отталкивание в кристалле, что сделает его менее устойчивым.
Чем больше энергии высвобождается, тем более энергетически стабильной становится структура. Это означает, что для достижения максимальной стабильности вам необходимо максимальное количество аттракционов. Так почему же каждый ион окружает себя 6 ионами противоположного заряда? Это максимальное количество ионов хлора, которое вы можете разместить вокруг центрального иона натрия, прежде чем ионы хлора начнут касаться друг друга. Если они начнут соприкасаться, вы создадите отталкивание в кристалле, что сделает его менее устойчивым.
Различная структура хлорида цезия
Сначала мы рассмотрим расположение ионов, а затем поговорим о том, почему структуры хлорида натрия и хлорида цезия различны. Представьте себе слой ионов хлора, как показано ниже. Отдельные ионы хлора не соприкасаются друг с другом. Это действительно важно — если бы они соприкасались, было бы отталкивание.
Теперь поместим поверх них аналогично устроенный слой ионов цезия.
Обратите внимание, что ионы цезия также не соприкасаются друг с другом, а каждый ион цезия опирается на четыре иона хлорида из нижнего слоя.
Теперь давайте нанесем еще один слой ионов хлора, точно такой же, как первый слой. Опять же, ионы хлорида в этом слое НЕ касаются ионов в нижнем слое, иначе вы введете отталкивание. Поскольку мы смотрим прямо на структуру, вы, конечно, больше не можете видеть нижний слой ионов хлора.
Если теперь представить себе ион цезия, зажатый между двумя слоями ионов хлора, то он касается четырех ионов хлора в нижнем слое и еще четырех в верхнем. К каждому иону цезия прикасаются восемь ионов хлора. Мы говорим, что она 8-координатна. Если бы мы добавили еще один слой ионов цезия, вы могли бы точно так же понять, что каждый ион хлорида касается восьми ионов цезия. Ионы хлора также имеют 8-координацию. Таким образом, в целом хлорид цезия имеет координацию 8:8.
На последней диаграмме в этой последовательности вид структуры слегка наклонен, чтобы вы могли видеть, как формируются слои. Эти диаграммы довольно сложно нарисовать, чтобы не было похоже, что ионы с одинаковым зарядом касаются друг друга. Это не так!
Это не так!
Схемы ионных кристаллов обычно упрощаются, чтобы показать основную единицу повторяющегося узора. Для хлорида цезия вы можете, например, нарисовать простую диаграмму, показывающую расположение ионов хлорида вокруг каждого иона цезия:0006
Поменяв местами цвета (зеленый ион хлорида в центре и оранжевый ионы цезия вокруг него), вы получите точно эквивалентную диаграмму расположения ионов цезия вокруг каждого иона хлорида.
Почему структуры хлорида цезия и хлорида натрия различаются?
Когда между двумя ионами с противоположными зарядами возникает притяжение, высвобождается энергия. Чем больше энергии может быть высвобождено, тем более стабильной становится система. Это означает, что чем больше контакт между отрицательными и положительными ионами, тем стабильнее должен стать кристалл.
Если вы можете окружить положительный ион, такой как цезий, восемью хлорид-ионами, а не шестью (и наоборот для хлорид-ионов), то вы должны получить более стабильный кристалл. Так почему же хлорид натрия не делает того же? Посмотрите еще раз на последнюю диаграмму:
Так почему же хлорид натрия не делает того же? Посмотрите еще раз на последнюю диаграмму:
Теперь представьте, что произойдет, если вы замените ион цезия на меньший ион натрия. Ионы натрия, конечно, меньше ионов цезия, потому что вокруг них меньше слоев электронов.
Вы все еще должны поддерживать контакт ионов хлорида с натрием. Эффект от этого будет заключаться в том, что вся конструкция сожмется, в результате чего ионы хлорида соприкоснутся друг с другом, а это вызовет отталкивание.
Любое увеличение притяжения из-за восьми хлоридов вокруг натрия, а не шести, более чем компенсируется новым отталкиванием между самими ионами хлорида. Когда хлорид натрия координируется в соотношении 6:6, такого отталкивания нет, и это лучший способ его самоорганизации.
В какую структуру кристаллизуется простое соединение 1:1, такое как NaCl или CsCl, зависит от соотношения радиусов положительных и отрицательных ионов. Если радиус положительного иона больше 73% радиуса отрицательного иона, то возможна координация 8:8.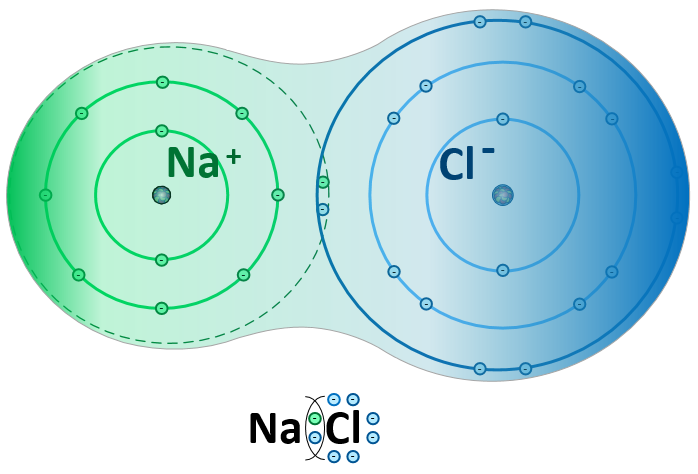 Если меньше (до 41%), то вы получите координацию 6:6.
Если меньше (до 41%), то вы получите координацию 6:6.
В CsCl ион цезия составляет около 93% от размера иона хлорида, поэтому легко попадает в диапазон, в котором возможна координация 8:8. Но с NaCl ион натрия составляет всего около 52% от размера иона хлорида. Это ставит его в диапазон, где вы получаете координацию 6: 6.
Физические свойства хлорида натрия
Хлорид натрия считается типичным для ионных соединений и выбран, а не, скажем, хлорид цезия, потому что он встречается в каждой программе на этом уровне.
Хлорид натрия имеет высокую температуру плавления и кипения
Между положительными и отрицательными ионами существует сильное электростатическое притяжение, и для его преодоления требуется много тепловой энергии. Все ионные вещества имеют высокие температуры плавления и кипения. Различия между ионными веществами будут зависеть от таких вещей, как:
- Число зарядов ионов : Оксид магния имеет точно такое же строение, как и хлорид натрия, но гораздо более высокую температуру плавления и кипения.
 Ионы 2+ и 2- притягиваются друг к другу сильнее, чем 1+ притягивает 1-.
Ионы 2+ и 2- притягиваются друг к другу сильнее, чем 1+ притягивает 1-. - Размеры ионов : Если ионы меньше, они сближаются, поэтому электростатическое притяжение больше. Иодид рубидия, например, плавится и кипит при несколько более низких температурах, чем хлорид натрия, потому что ионы рубидия и йодида больше, чем ионы натрия и хлорида. Притяжение между более крупными ионами меньше, поэтому для их разделения требуется меньше тепловой энергии.
Кристаллы хлорида натрия хрупкие
Хрупкость опять же характерна для ионных веществ. Представьте, что произойдет с кристаллом, если приложить к нему напряжение, которое слегка сместит ионные слои.
Ионы с одинаковым зарядом сближаются, и кристалл рассыпается на куски!
Хлорид натрия растворим в воде
Многие ионные твердые вещества растворимы в воде, хотя и не все. Это зависит от того, достаточно ли велико притяжение между молекулами воды и ионами, чтобы преодолеть притяжение между самими ионами. Положительные ионы притягиваются к неподеленным парам молекул воды, и могут образовываться координационные (дательные ковалентные) связи. Молекулы воды образуют водородные связи с отрицательными ионами.
Положительные ионы притягиваются к неподеленным парам молекул воды, и могут образовываться координационные (дательные ковалентные) связи. Молекулы воды образуют водородные связи с отрицательными ионами.
Хлорид натрия нерастворим в органических растворителях
Это также характерно для ионных твердых веществ. Притяжение между молекулами растворителя и ионами недостаточно велико, чтобы преодолеть притяжение, скрепляющее кристалл.
Электрические свойства хлорида натрия
Твердый хлорид натрия не проводит электричество, так как в нем нет электронов, которые могли бы свободно двигаться. Когда он плавится, хлорид натрия подвергается электролизу, который включает проводимость электричества из-за движения и разряда ионов. В процессе образуются натрий и хлор. Это химическое изменение, а не физический процесс. 9- \rightarrow Na\]
Движение электронов с катода на ионы натрия оставляет места на катоде. Источник питания (батарея или что-то еще) перемещает электроны по проводу во внешней цепи, чтобы заполнить эти пространства.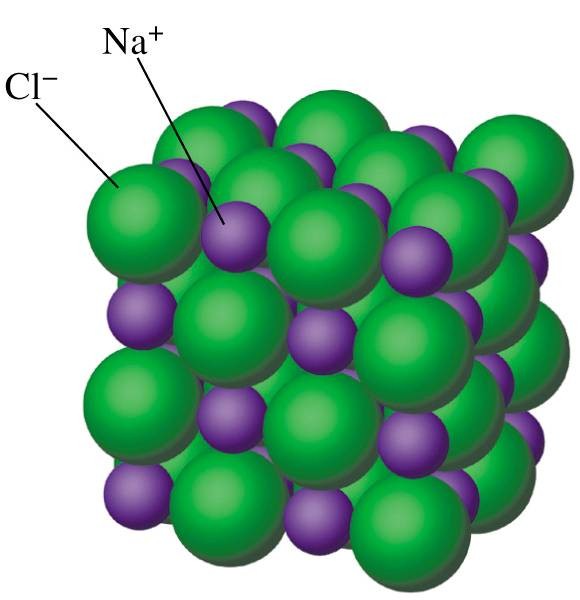 Этот поток электронов можно рассматривать как электрический ток (внешняя цепь — это вся остальная часть цепи, за исключением расплавленного хлорида натрия).
Этот поток электронов можно рассматривать как электрический ток (внешняя цепь — это вся остальная часть цепи, за исключением расплавленного хлорида натрия).
Между тем, ионы хлорида притягиваются к положительному электроду (аноду). Когда они туда попадают, каждый ион хлора теряет электрон на аноде, образуя атом. Затем они объединяются, образуя молекулы хлора. Образуется газообразный хлор. В целом изменение есть. . . 9-\]
Новые электроны, осевшие на аноде, откачиваются источником питания по внешней цепи и в конечном итоге оказываются на катоде, где они передаются ионам натрия. Расплавленный хлорид натрия проводит электричество из-за движения ионов в расплаве и разряда ионов на электродах. И то, и другое должно произойти, если вы хотите, чтобы электроны текли во внешней цепи. В твердом хлориде натрия, конечно, такого движения ионов быть не может, и это исключает любую возможность протекания тока в цепи.
Авторы
Эта страница под названием Ionic Structures используется в соответствии с лицензией CC BY-NC 4.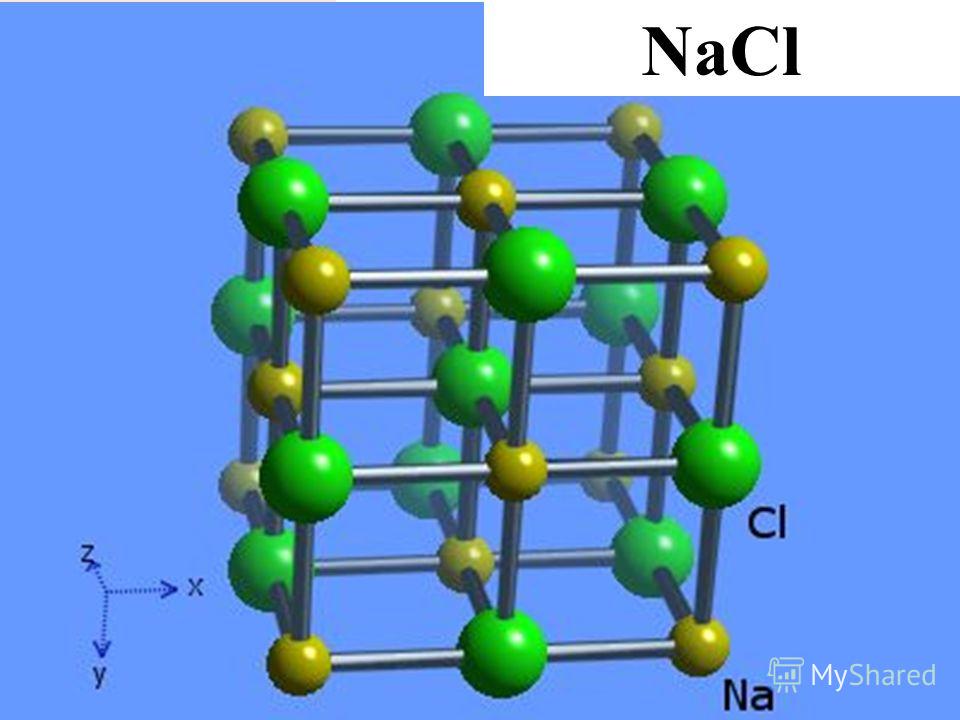 0, ее автором, ремиксом и/или куратором является Джим Кларк.
0, ее автором, ремиксом и/или куратором является Джим Кларк.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Автор
- Джим Кларк
- Лицензия
- CC BY-NC
- Версия лицензии
- 4,0
- Показать страницу TOC
- нет на странице
- Метки



 Современная физика, гл. 5
Современная физика, гл. 5 Ионы 2+ и 2- притягиваются друг к другу сильнее, чем 1+ притягивает 1-.
Ионы 2+ и 2- притягиваются друг к другу сильнее, чем 1+ притягивает 1-.