Дисбактериоз с определением чувствительности к антибиотикам и бактериофагам
Количественный метод бактериологического исследования микрофлоры кишечника на специальных обогащенных питательных средах с целью выявления дисбиотических состояний у взрослых. Исследование на определение чувствительности к антибиотикам ставится диско-диффузионным методом с учетом рекомендаций по антибиотикорезистентности. Исследование на определение чувствительности к бактериофагам может быть выполнено в случае, если к обнаруженному возбудителю существует бактериофаг.
В каких случаях обычно назначают посев на дисбактериоз?
Посев на дисбактериоз проводится с целью выявления нарушений баланса микрофлоры кишечника, основывается на определении количественного состава основных бактерий, населяющих кишечник. Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Дисбактериоз (нарушение баланса нормальной флоры кишечника) у взрослых и у детей может быть связано с нарушением работы печени, желчевыводящих путей, желудка, поджелудочной железы.
Признаки дисбактериоза могут сопровождать следующие состояния:
- паразитарные инвазии, в том числе лямблиоз;
- хронические инфекции, например, носительство стафилококка;
- аллергии;
- гиповитаминоз;
- сахарный диабет;
- после приема антибиотиков.
Дисбактериоз кишечника может проявляться запором, диареей, метеоризмом, болями и другими расстройствами.
Что именно определяется в процессе анализа?
Исследование позволят выявить и определить количество как нормальной микрофлоры, так и условно- патогенных микроорганизмов. Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Что означают результаты теста?
Анализ позволит выявить изменения биоценоза кишечника и определить степень их выраженности. При выявлении патогенных бактерий или условно-патогенных микроорганизмов в значимом количестве проводится тестирование их на чувствительность к действию антибиотиков и бактериофагов.
При выявлении патогенных бактерий или условно-патогенных микроорганизмов в значимом количестве проводится тестирование их на чувствительность к действию антибиотиков и бактериофагов.
Обычный срок выполнения теста:
до 7-8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Исследование нельзя проводить на фоне приема антибактериальных препаратов. После окончания лечения должно пройти не менее 2-ух недель.
Сдать анализ кала на дисбактериоз кишечника
Метод определения Бактериологический, бактериоскопический
Исследуемый материал Кал
Доступен выезд на дом
Синонимы: Дисбиоз кишечника; Анализ кала на дисбактериоз.
Intestinal dysbiosis; Intestinal disbios; Intestinal dysbacteriosis.
Краткое описание исследования «Дисбактериоз кишечника»
В медицинских офисах Москвы и Московской области приём биоматериала для выполнения теста № 456 производится 7 дней в неделю с ограничениями по времени взятия. Интересующую информацию уточняйте у администраторов медицинских офисов.
Дисбактериоз (в англоязычной литературе используют термин Intestinal bacterial overgrowth, реже – disbios) острое или хроническое нарушение нормальной микрофлоры кишечника.
В содержимом тощей кишки здоровых людей может находиться до 105 бактерий в 1 мл кишечного содержимого. Основными являются молочнокислые палочки, стафилококки и стрептококки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 108, в первую очередь за счёт энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. В толстой кишке преобладают анаэробы (бактероиды, клостридии, лактобациллы).
Соотношение количества различных микроорганизмов достаточно постоянно. Но вследствии ослабления иммунитета, нерациональной терапии антибиотиками, лучевой и химиотерапии, врождённых дефектов ферментов баланс нарушается. Могут исчезнуть некоторые представители нормальной микрофлоры (бифидобактерии, молочнокислые и кишечные палочки) и появиться грибки рода кандида, стафилококки, протей, синегнойная палочка. Возникает клинический синдром, для которого характерны понос, стеаторея, снижение веса и анемия. При резком ослаблении защитных сил, иммунитета может развиться генерализованная форма эндогенной инфекции вплоть до сепсиса.
С какой целью проводят исследование на дисбактериоз кишечника
Исследование микрофлоры кишечника применяют для определения характера нарушения биоценоза кишечника.
Выявляемые микроорганизмы и возбудители в исследовании «Дисбактериоз кишечника»
Выделяемые микроорганизмы и возбудители:
- полезные бактерии кишечника – лактобактерии, бифидобактерии, кишечные палочки с типичными свойствами, а также со сниженными ферментативными и гемолитическими признаками;
- условно-патогенные бактерии – энтеробактерии, неферментирующие бактерии, стафилококки, энтерококки, анаэробные бактерии (клостридии, без идентификации до вида), грибы;
- патогенные – сальмонеллы, шигеллы.
🧬 Анализ на «дисбактериоз»: пожалуйста, хватит
Прилетели как-то на Землю инопланетяне. Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины.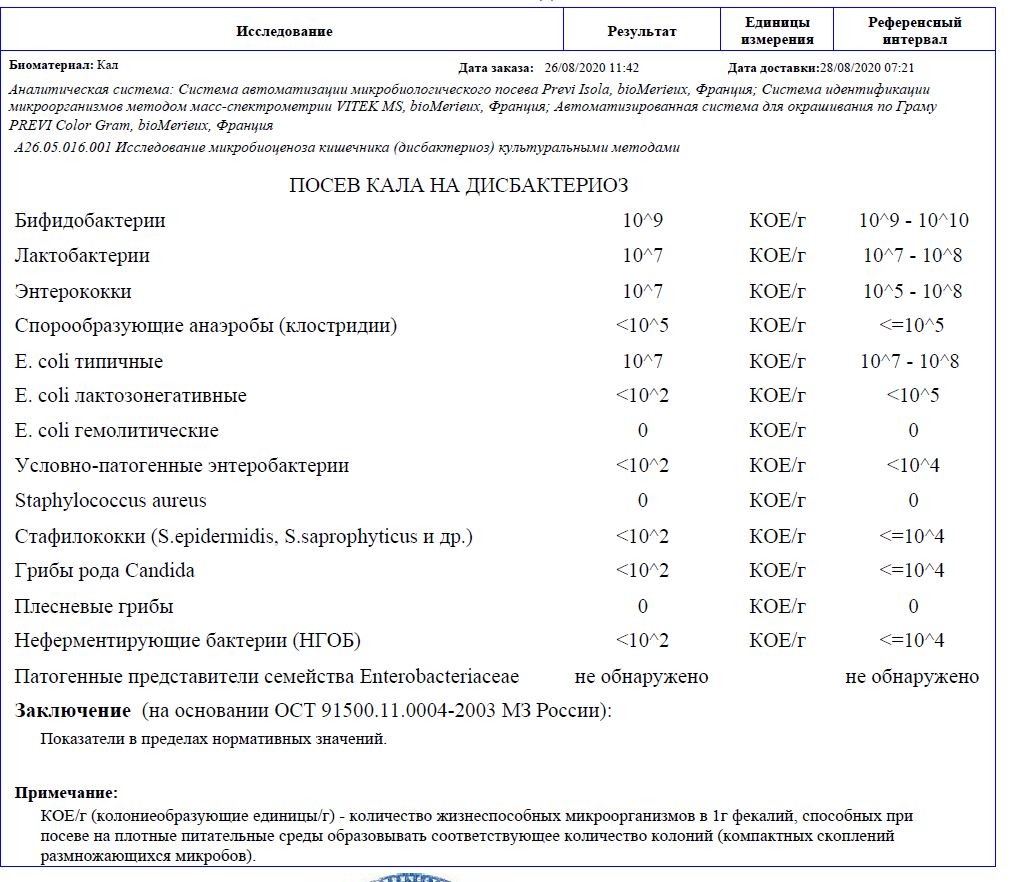
Вот как-то так и проводится «анализ на дисбактериоз». Поговорим об этом диагнозе с гастроэнтерологом GMS Clinic Головенко Алексеем.
Что не так с этим исследованием? Его же так часто назначают врачи!
- Давайте оговоримся: его назначают врачи только в странах бывшего СССР. За пределами этих государств простой посев стула для выявления дисбаланса микрофлоры не выполняется. Вы не найдете указаний на необходимость этого исследования ни в руководстве WGO по синдрому раздраженного кишечника, ни в рекомендациях ACG (Американской коллегии гастроэнтерологов) по острой диарее, ни в стандарте AAFP (Американской ассоциации семейных врачей) по наблюдению новорожденных с коликами. Ну и, естественно, никакого диагноза «дисбактериоз» нет ни в Международной классификации болезней, ни в хотя бы одном (!) нерусскоязычном учебнике.

- Бактерии, обнаруживаемые в стуле (который формируется в толстой кишке) — это совсем не те же бактерии, что обитают в ротовой полости или тонкой кишке. Кроме того, бактерии в стуле (то есть в просвете кишки) — это совсем не бактерии, обитающие в слизи, защищающей кишечную стенку. Вообще, через наш пищеварительный тракт «пролетает» безумное количество чужеродных бактерий, грибов и вирусов. К счастью, большая их часть не могут подобраться к кишечной стенке: обитающая там пристеночная микрофлора конкурирует с «пришельцами». Мы называем это явление колонизационной резистентностью, и именно ему мы обязаны тем, что первая же проглоченная со стаканом московской воды условно-патогенная бактерия не вызывает у нас понос.

- Состав и соотношение кишечных бактерий у каждого человека свои. Изучив (не посевом кала, конечно, а сложнейшими генетическими методами) состав бактерий в стуле, можно, например, угадать принадлежит ли образец жителю Нью-Йорка или побережья Амазонки. Ну, или в каком регионе отдельной страны (например, Дании). проживает человек, отправивший на анализ свои фекалии. В общем, истинный состав кишечной микрофлоры — наши «отпечатки пальцев», и предполагать некую общую норму, а уж тем более судить о «нормальности» флоры всего по 20 видам из 1000 — смешно.
- То, будут ли размножаться бактерии на питательной среде, зависит не только от того, какие бактерии в стуле живут, но и от того, как стул собрали (с унитаза, со стерильной бумаги), как хранили (в холодильнике, у батареи, у окна), как быстро доставили в лабораторию. Много ли людей, которым рекомендовали анализ на дисбактериоз читали вот эту инструкцию, согласно которой кал нужно собрать в стерильную посуду, поместить в холодильник и нести в лабораторию не в руках, а в термосе с кубиком льда? Впрочем, даже при совершении этих действий результат анализа на дисбактериоз интерпретировать нормальный врач не может.

В питательной среде появились колонии бактерий. К счастью для нас, действительно опасная Сальмонелла растет в питательной среде. Большая часть кишечных бактерий, увы, нет.
Так что, нет такого понятия — «дисбактериоз»?
Конечно, есть. Например, псевдомембранозный колит — тяжелое воспаление толстой кишки после антибиотика — самый настоящий дисбактериоз: погибли конкуренты, и поэтому размножается Clostridium difficile. Только для того, чтобы это лечить, совершенно не нужно констатировать очевидное — состав бактерий в кишке изменился. Достаточно подтвердить инфекцию (выявить токсины C.difficile) и назначить лечение.
Кишечная микрофлора, вне сомнения, влияет на все процессы в нашем организме. Пересадив стул от мыши с ожирением мышке с нормальным весом, у последней мы вызываем ожирение. Состав кишечных бактерий принципиально разный у людей с тревожностью и депрессией. Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Ну, а добавление пробиотика Bacteroides fragilis мышам, у которых искусственно вызвали аутизм, улучшает их социальные навыки. Прочитайте популярную книгу «Смотри, что у тебя внутри» известного микробиолога Роба Найта: наши знания о микрофлоре колоссальны, но применять их на практике (то есть для лечения болезней) мы пока только начинаем.
Состав бактерий можно и нужно изучать. Этому посвящено амбициозное международное исследование Human Microbiome Project с бюджетом $115 млн. Естественно, никакие «посевы стула» при этом не используются. Для анализа микробных «джунглей» кишечника используются методы метагеномики. Они позволяют описать, сколько уникальных последовательностей ДНК присутствует у конкретного человека, какие группы бактерий преобладают, а какие отсутствуют. К слову, когда такие технологии (например, секвенирование 16S-рРНК появились, выяснилось, что 75% видов, обнаруживаемых при генетическом анализе того же кала, вообще не известны науке.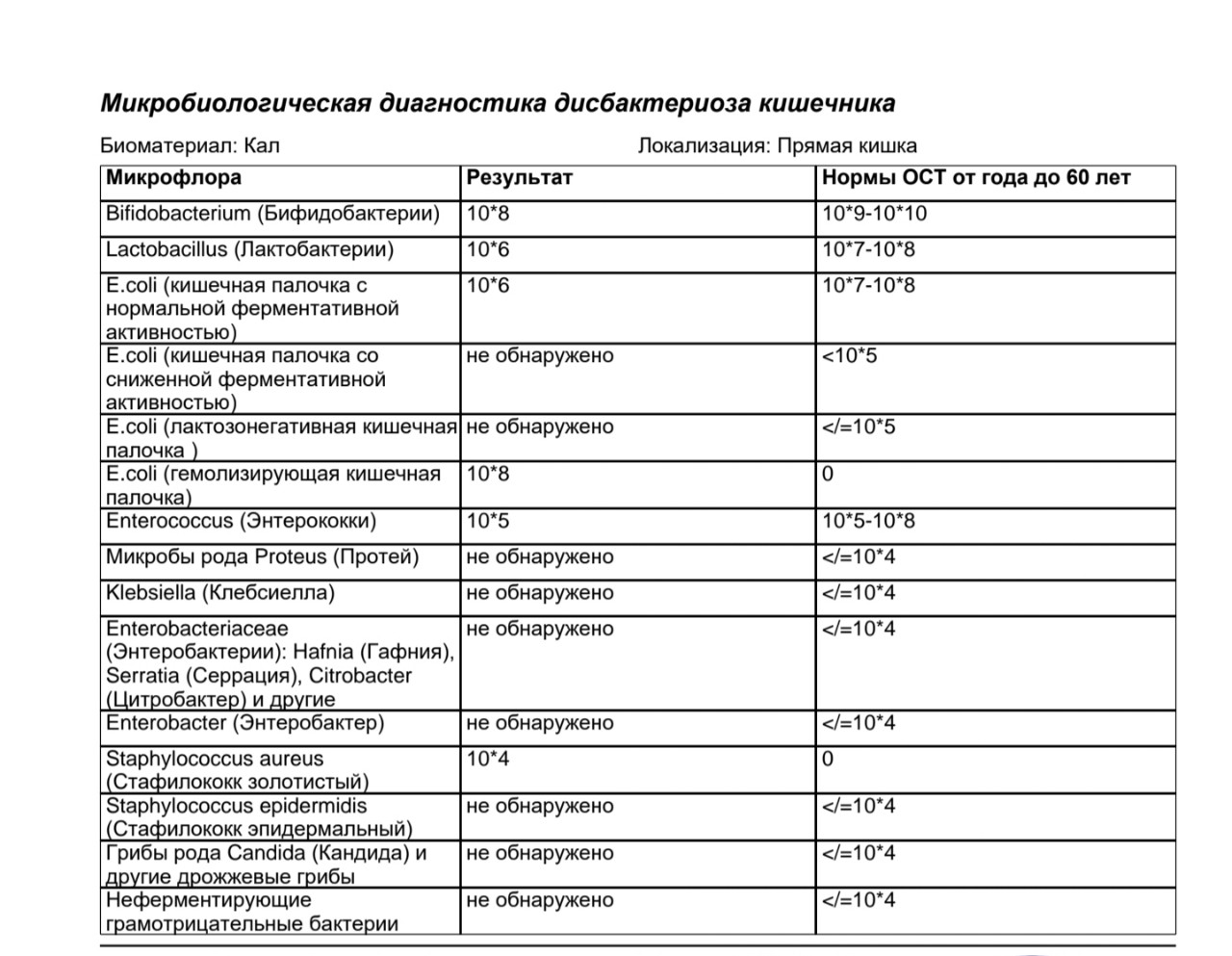
Стоп. То есть делать посев стула вообще нет смысла?
Я этого не говорил. Мы обязательно выполняем посев стула, если хотим выявить рост по-настоящему вредных бактерий. Например, у человека с кровавой диареей мы пытаемся найти Сальмонеллу или Шигеллу, Кампилобактерию или особую разновидность кишечной палочки. Здесь посев кала жизненно необходим, ведь так мы сможем назначить лечение антибиотиком — убить конкретного возбудителя.
Грамотный врач выполняет диагностический тест только тогда, когда его результат может изменить лечение. Если и при «дефиците» лактобактерий, и при «избытке» кишечной палочки будет назначено одно и то же лекарство или диета, анализ является пустой тратой денег.
Полноценное исследование собственной микрофлоры уже можно сделать на коммерческой основе в США и Европе. Стоит «удовольствие» около 100 евро, и в результате генетического анализа микрофлоры вы получите заключение (например, вот такое) о преобладающих в вашем пищеварительном тракте бактериях. Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
пока у нас НЕТ способа, избирательно менять состав кишечных бактерий.
Предположим, мы однозначно установили, что у человека имеется дефицит какой-то конкретной микроорганизмы (например, лактобактерий). Мы можем:
- Дать пробиотик (то есть конкретную живую бактерию) и надеяться, что она останется жить в кишечнике.
- Дать пребиотик (то есть «корм» для бактерии) и надеяться, что это усилит рост именно нужной нам бактерии.
- Дать антибиотик (яд для бактерии) и надеяться, что погибнет именно чрезмерно размножившаяся бактерия.
- Пересадить человеку чужую микрофлору — сделать трансплантацию фекальной микробиоты (ввести разбавленный стул здорового человека больному человеку).
Очевидно, избирательным действием можно считать только назначение пробиотика. Максимальная доза лучшего коммерческого пробиотика — это 10 млрд. жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
жизнеспособных бактерий в дозе препарата. В кишечнике обитает около 100 триллионов бактерий. То есть, на каждую бактерию «из аптеки» приходится 10 тысяч бактерий, уже «проживающих» в кишке. Маловероятно, что это ничтожное количество бактерий сможет преодолеть колонизационную резистентность и «заселить» кишку. Кроме того, механизм действия пробиотиков (когда они работают) может вообще быть связан с не с самими бактериями: у трансгенных мышей, предрасположенных в воспалению кишечника это самое воспаление удалось остановить, применяя не «живой» пробиотик, а вообще ДНК и некоторые белки, выделенные из «убитого» температурой препарата.
Ну, а главное: одно дело — теория и лабораторные исследования, другое дело — клинические испытания (то есть изучение эффекта препаратов у людей). Разберем три типовых для России ситуации, когда человеку предлагают сдать «анализ кала на дисбактериоз»:
Колики у новорожденного
Мама жалуется, что ребенок много плачет. К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
Чаще бывает не так. Выполняется анализ кала на дисбактериоз, там, естественно (норма-то взята с «потолка»), обнаруживаются «отклонения». Назначается пробиотик. И часто ведь помогает: еще бы, ведь частота колик неумолимо снижается с возрастом ребенка. При этом уверенности в том, что пробиотики вообще эффективны при коликах, у нас нет. Многочисленные мета-анализы, посвященные лечению и профилактике этого состояния, не смогли однозначно подтвердить эффективность пробиотиков. Возможно, какое-то полезное действие оказывает пробиотик Lactobacillus reuteri. Вот только для того, чтобы назначить этот препарат, анализ кала на «дисбактериоз» нам совершенно не нужен.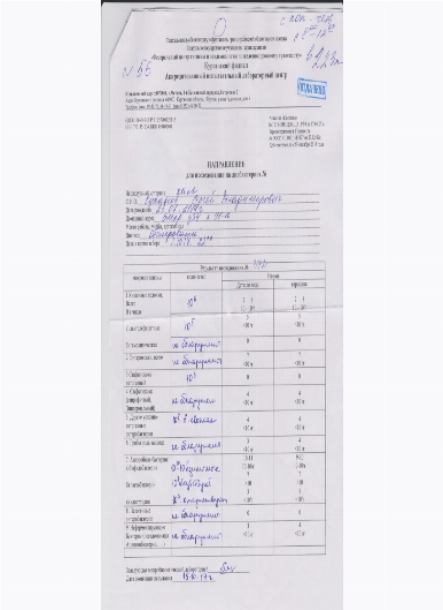
Атопический дерматит у ребенка
Все уверены, что проблемы с кожей — от «живота». Будь это так, наверное, атопический дерматит прекрасно лечился бы пробиотиками. Но этот подход не слишком эффективен. Последний мета-анализ свидетельствует: применение пробиотиков (главным образом, Lactobacillus rhamnosus GG) несколько уменьшает выраженность экземы, но эффект этот весьма символический, а дополнительная терапия пробиотиком не позволяет сократить частоту применения местных стероидов, которые (вместе с увлажнением кожи) остаются основой лечения атопического дерматита. И вновь: назначить этот пробиотик мы можем вне зависимости от «результатов» «анализа на дисбактериоз».
Вздутие и спазмы в животе у взрослого
Вздутие живота чаще всего является проявлением избыточного бактериального роста в тонкой кишке (СИБРа), при котором помогает не пробиотик, а антибиотик, например, рифаксимин. Это состояние диагностируется при помощи специального дыхательного теста. Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Так нужно хоть в какой-то ситуации сдавать «кал на дисбактериоз»?
Нет. Никогда. Ни при каких обстоятельствах. Мы не лечим вздутие живота, изучая линии на ладони. Мы не лечим сыпь, глядя в хрустальный шар. Мы не делаем бессмысленный анализ на дисбактериоз, чтобы назначить лечение.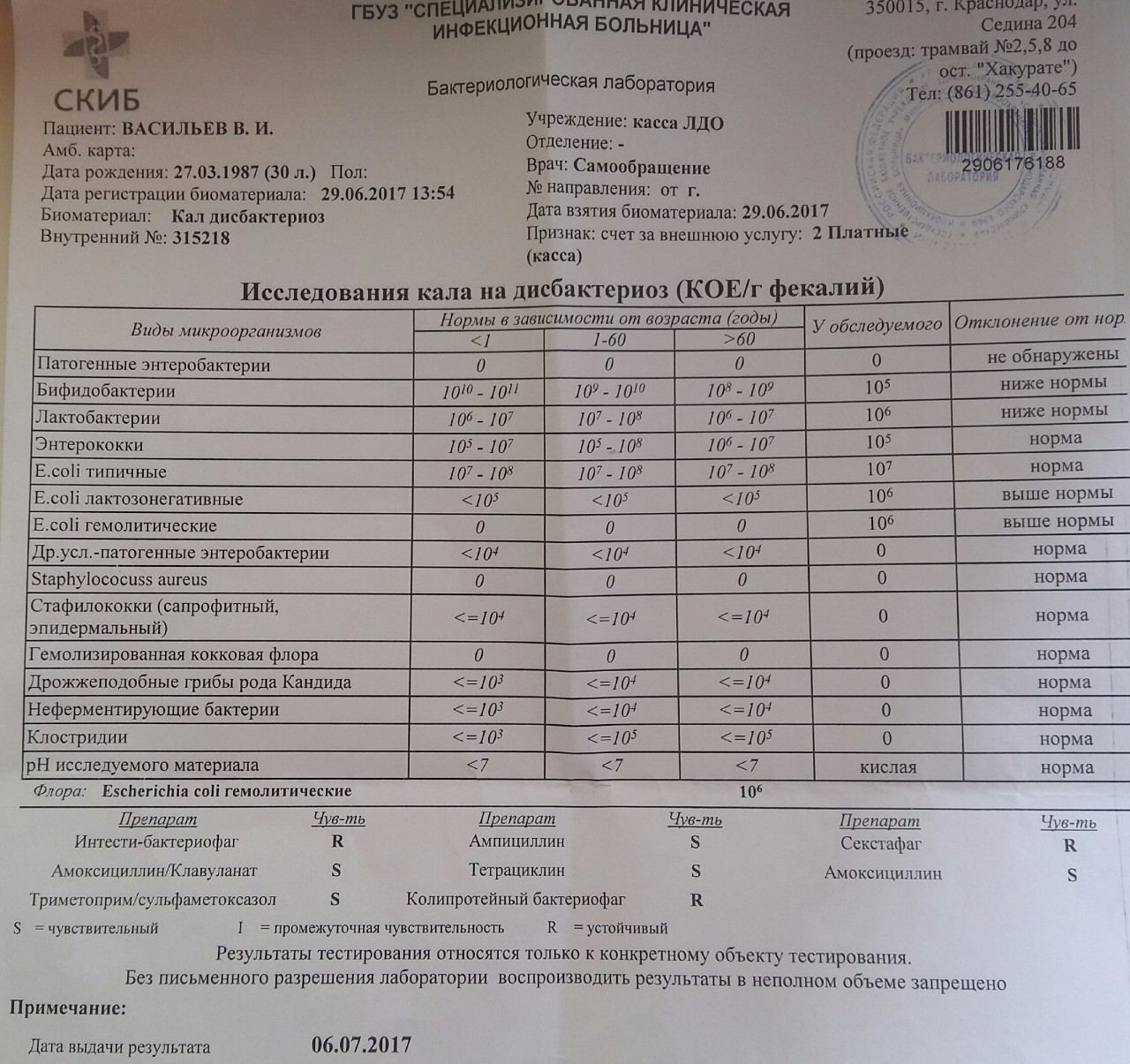
Мы ждем, когда доказательная медицина предложит нам эффективные препараты и практические способы понять, что не так с нашими бактериями.
Жду вместе с вами!
Источник: deti.mail.ru
О дисбактериозе рассказывает педиатр «ЕвроМед клиники»
Дисбактериоз — история о плохих и хороших бактериях
Дисбактериоз — одна из наиболее часто обсуждаемых проблем со здоровьем, особенно, среди детей. Педиатр «ЕвроМед клиники»Елена Сергеевна Кочеткова рассказывает нашим читателям, что известно о дисбактериозе в свете современных знаний.
Дисбактериоз – микроэкологические нарушения в желудочно-кишечном тракте. Это клиническая совокупность нарушений в макроорганизме (то есть в человеке), вызванные изменением количественных соотношений, состава и свойств микрофлоры. Дисбактериоз определяется, по сути, по результату анализа — посева кала на известные и возможные для исследования микроорганизмы толстого кишечника.В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить. Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация.
Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
Что же делает микрофлора в нашем теле?
- противостоит болезнетворным бактериям и сдерживает рост условно-патогенных бактерий
- участвует в синтезе и всасывании многих витаминов
- разрушает и выводит токсины
- вырабатывает вещества, участвующие в обмене холестерина, жирных кислот, липопротеидов, оксалатов, стероидных гормонов
- участвует в формировании как местного, так и системного иммунитета. По сути, кишечник и находящиеся в нем бактерии являются самым большим иммунным органом человека
- участвует в переваривании многих пищевых ингредиентов
- питает, поддерживает работу клеток кишечной стенки
Это далеко не все, только основные направления работы нашей микрофлоры. Не зря 20% поступающих пищевых ингредиентов и 10% вырабатываемой организмом энергии идет на поддержание нашей микрофлоры.
Симптомы
Как проявляется дисбиоз хорошо известно всем:
- диспептический синдром: поносы, запоры, метеоризм, повышенное газообразование, отрыжка, боли в животе
- аллергические реакции: кожные высыпания, бронхиальная астма, насморк, непереносимость некоторых пищевых продуктов
- частые простудные заболевания, как правило, протекающие длительно и волнообразно
- синдром мальабсорбции — нарушение всасывания, как следствие: гиповитаминоз, анемия, неврологические расстройства, задержка роста и развития
- хроническая интоксикация, как следствие: недомогание, плохой аппетит, головные боли, субфебрильная температура
Хотя, как упоминалось выше, кишечная микробиота индивидуальна и в целом постоянна, она не существует как нечто неизменное, представляя собой динамически меняющуюся смесь микробов, индивидуальных для каждого человека. К факторам, влияющим на становление кишечной микробиоты, у младенцев относят:
- наличие у мамы любых инфекций: хронических урогенитальных и других, даже вне обострения, острых (ОРЗ и др.
 ), прием лекарств, нерациональное питание
), прием лекарств, нерациональное питание - роды путем кесарева сечения
- позднее (не в родовом зале) прикладывание к груди. Млечные ходы молочной железы заселены лакто- и бифидобактериями, даже если новорожденный высосет 3–5 мл молозива он получит первой «хорошую» семейную микрофлору, а не больничную, вероятнее всего, вредную
- гипоксия нервной системы любой степени тяжести
- долгое нахождение в родильном доме
- раздельное нахождение мамы и младенца в роддоме
- искусственное вскармливание
- применение антибиотиков и некоторых других лекарств
- раннее введение прикормов и прекращение грудного вскармливания
- нерациональное питание
Какие анализы можно сдать для выявления дисбиоза:
- Кал на дисбиоз. До 3 месяцев идет активное заселение кишечника, микрофлора меняется каждый день, анализ будет готов через 7–10 дней, значит, говорит о прошлом состоянии, не о сегодняшнем.
 Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий. - Копрограмма – показывает нарушения характера пищеварения: своевременно ли и в достаточном ли количестве выделяется желчь и секрет поджелудочной железы.
- Газо-жидкостная хроматография и молекулярно-генетическое исследование фекалий показывают истинное состояние микрофлоры, ее полный количественный и качественный состав (в том числе тонко-кишечный и тот, который невозможно вырастить вне человека), энтеротип человека. Проводится в нескольких НИИ в мире, в широком применении будет только в ближайшие 5–10 лет.
Можем ли мы как то повлиять на количество и качество микробиоты? Даже учитывая, что мы, на сегодняшний день, не знаем большинства «наших» бактерий, но все же можем многое сделать, особенно, для младенца. У всех детей первого полугодия 98-99 % микрофлоры — это бифидо- и лактобактерии, значит, надо обеспечить их достаточное количество и качество их жизнедеятельности. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактазной недостаточности в кишечнике неблагоприятная среда, а бифидо- и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Кстати тут сразу встает вопрос: когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная организация здравоохранения), но решение принимается в каждом случае индивидуально!
У всех детей первого полугодия 98-99 % микрофлоры — это бифидо- и лактобактерии, значит, надо обеспечить их достаточное количество и качество их жизнедеятельности. Задача эта очень сложная. Почему? Эти бактерии очень нежные, могут жить и хорошо работать в определенных условиях. Например, при наличии лактазной недостаточности в кишечнике неблагоприятная среда, а бифидо- и лактобактерии не могут ни жить, ни работать в такой среде. С введением прикормов изменяется характер пищи, требуются другие бактерии, происходит заселение кишечника новыми видами. Кстати тут сразу встает вопрос: когда вводить прикорм, какой? Есть определенные рекомендации, даже национальная программа вскармливания по рекомендациям ВОЗ (Всемирная организация здравоохранения), но решение принимается в каждом случае индивидуально!
Получается, мы живем в океане микробов, и только так мы можем жить. Если мы хотим жить долго и здорово, мы должны заботиться о них. Лечение — это одно, а постоянное поддержание здоровья — это другое.Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
Бакпосев кала на дисбактериоз + антибиотикограмма
Общая характеристика
Изменения количественных или качественных характеристик нормальной микрофлоры создают условия для развития условнопатогенных бактерий (УПБ) — представителей родов клебсиел, энтеробактеров, протея, стафилококков, ацинетобактеров, псевдомонад и грибов рода Candidа. Нарушение нормальной микрофлоры кишечника характеризуется исчезновением или снижением числа облигатных ее представителей и увеличением популяционного уровня УПБ, отсутствующих или встречающихся в ничтожных количествах в норме. В итоге такие дисбиозные микробные ассоциации не в состоянии выполнять защитные и физиологические функции в кишечнике, которые они осуществляют в условиях нормобиоценоза.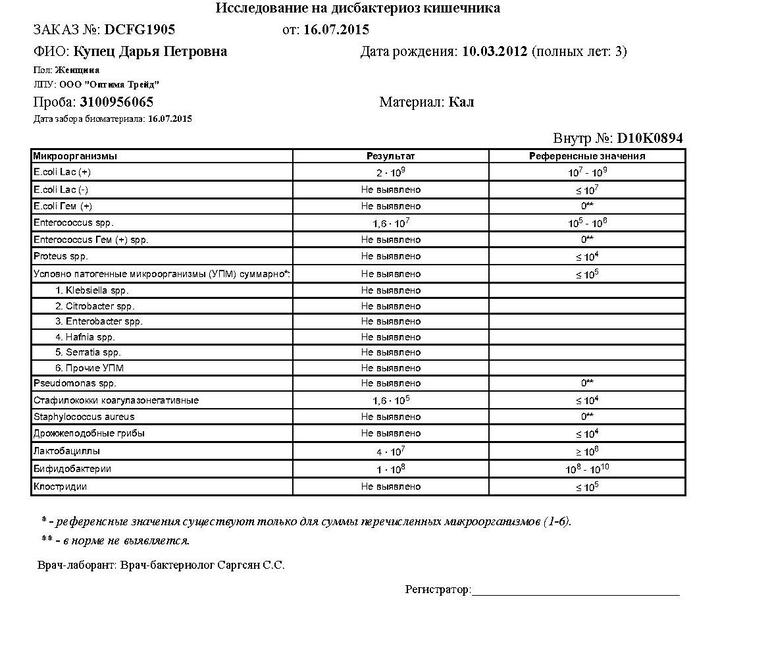
Показания для назначения
Обследование на дисбактериоз лиц в группе риска по развитию дисбиоза кишечника:
•новорождённые, у которых нарушению нормофлоры кишечника способствуют следующие факторы: бактериальный вагиноз и мастит у матери, низкая оценка по шкале Апгар и проведение реанимационных мероприятий, позднее прикладывание к груди, длительное пребывание в роддоме, физиологическая незрелость моторной функции кишечника, наличие малых гнойных инфекций, непереносимость грудного молока, синдром мальабсорбции, первичный иммунодефицит;
•дети грудного и раннего возраста в случаях неблагоприятного течения периода новорожденности (в анамнезе), раннего искусственного вскармливания, диспептических нарушений, частых ОРВИ, рахита, анемии, гипотрофии, изменений в психоневрологическом статусе ребёнка, аллергического дерматита;
•дети дошкольного и школьного возраста, находящиеся в замкнутых коллективах, с частыми ОРВИ, аллергическими реакциями;
•взрослые: профессиональные вредности; стрессы; несбалансированное питание; кишечные инфекции; лечение антибактериальными препаратами; длительная гормонотерапия, лечение нестероидными противовоспалительными препаратами; проведение химио- и лучевой терапии у онкологических больных; иммунодефицитные состояния.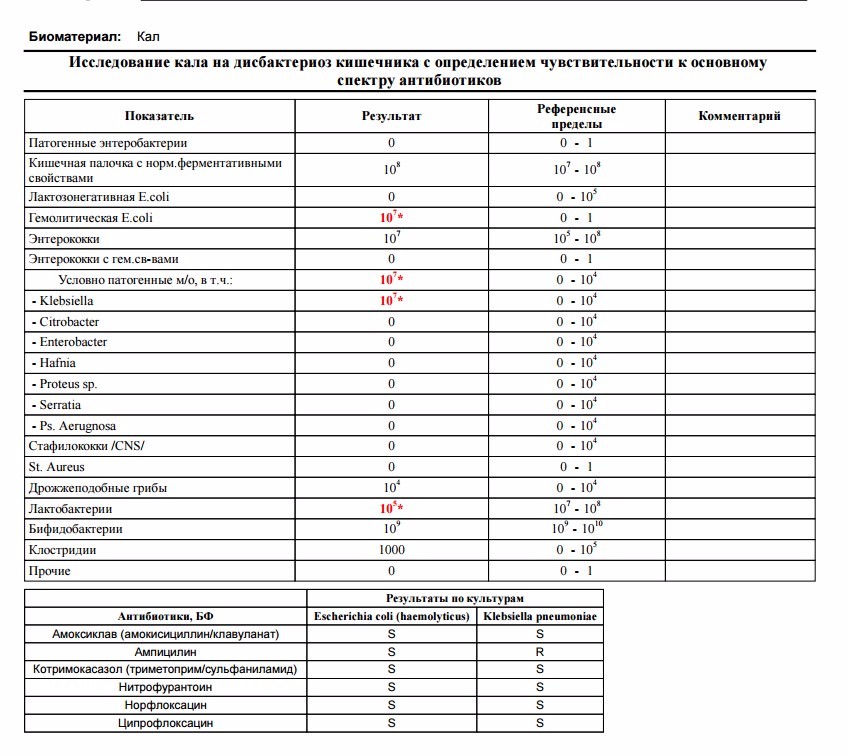
•люди пожилого возраста: возрастные изменения свойств микрофлоры (уменьшение канцеролитических свойств кишечной палочки, увеличение числа штаммов, синтезирующих холестерин, увеличение количества гемолитической флоры).
Маркер
Комплексная оценка бактериологического состава исследуемого биоматериала с определением чуствительности УПМ к антибиотикам (определение характера нарушения нормального биоценоза кишечника).
Клиническая значимость
Определение состава микрофлоры толстого кишечника и пути коррекции в случае нарушения нормального биоценоза
Состав показателей:
Бактериологический посев + а/биотикограмма кала на дисбактериоз
Метод:
Микробиологический
Диапазон измерений:
0-0
Единица измерения:
Колониеобразующих единиц на грамм
Выполнение возможно на биоматериалах:
Биологический материал
Условия доставки
Контейнер
Объем
кал
Условия доставки:
4 час. при температуре от 2 до 8 градусов Цельсия
при температуре от 2 до 8 градусов Цельсия
Контейнер:
Стерильный контейнер с крышкой
Объем:
50 Миллилитров
Правила подготовки пациента
Стандартные условия подготовки (если иное не определено врачом): За 2 недели Прекратить прием препаратов антибактериальной, антимикотической терапии. Примечания: Стерильный контейнер, 5 гр (1/2 ч.л.), доставка в течении 2-х ч. на ОД №1.
Примечания: Стерильный контейнер, 5 гр (1/2 ч.л.), доставка в течении 2-х ч. на ОД №1.
Вы можете добавить данное исследование в корзину на этой странице
Интерференция:
- Приём антимикробных и пробиотических препаратов значительно оказывает влияние на достоверность результата.
 Рекомендуется производить обследование через 14 – 21 день после отмены указанных препаратов.
Рекомендуется производить обследование через 14 – 21 день после отмены указанных препаратов.
Интерпретация:
- I степень — незначительные изменения в аэробной части микробиоценоза, посторонняя микрофлора отсутствует;
II степень — на фоне сниженного количества лакто- и бифидофлоры проявляется качественные и количественные изменения эшерихий;
III степень — резкое снижение или отсутствие бифидофлоры, лактобацилл, преобладают гемолитические микроорганизмы и дрожжеподобные грибы;
IV степень — глубокие изменения микробиоценоза, увеличение количества условно-патогенной микрофлоры и их ассоциаций, появление протея.
Дисбиоз (дисбактериоз) кишечника | ФБУН «Ростовский научно-исследовательский институт микробиологии и паразитологии» Роспотребнадзора
Высококвалифицированные сотрудники нашего института осуществляют:
1. Бактериологический посев на дисбактериоз кишечника + чувствительность к бактериофагам, противогрибковым препаратам и антибиотикам до и после лечения. Данные исследования проводят с целью выявления наличия бактерий, вызывающих такие заболевания, как дизентерия, сальмонеллез, брюшной тиф, а также нарушение микробного состава.
Бактериологический посев на дисбактериоз кишечника + чувствительность к бактериофагам, противогрибковым препаратам и антибиотикам до и после лечения. Данные исследования проводят с целью выявления наличия бактерий, вызывающих такие заболевания, как дизентерия, сальмонеллез, брюшной тиф, а также нарушение микробного состава.
2. Копрологические исследования (копрограмма). Этот вид исследования кала позволяет диагностировать нарушение функций желудка, поджелудочной железы, печени, ускоренного прохождения пищи через желудок и кишечник, нарушение всасывания в тонкой кишке; воспалительный процесс в желудочно-кишечном тракте, язвенный, аллергический и спастический колит.
3. Наличие кишечных ферментов (энтерокиназы, липазы, амилазы и др.). Показатель количества и эффективности работы пищеварительных ферментов в тонком кишечнике.
4. Кишечные вирусы (ротавирусы, норовирусы, энтеровирусы, астровирусы) – могут вызывать острые инфекционные заболевания с разной степенью выраженности (бессимптомно, в легкой форме – с однократной рвотой и поносом, а также в тяжелой форме с выраженной интоксикацией). Особенно кишечные инфекции опасны у детей до 1-го года. Подтверждение присутствия вирусов в кале необходимо для выбора правильной тактики лечения больного.
Особенно кишечные инфекции опасны у детей до 1-го года. Подтверждение присутствия вирусов в кале необходимо для выбора правильной тактики лечения больного.
При исследовании кишечника в институте применяются новые, высокотехнологические методы, основанные на выявлении местных иммунологических и метаболических процессов, протекающих в кишечнике, что позволяет улучшить диагностику, лечение и профилактику заболеваний кишечника.
Клинические анализы выполняются как «классическим» бактериологическим методом, так и с применением бактериологических анализаторов Vitek-2, масс-спектрометра Bruker, ПЦР в режиме real-time и др.
Важно отметить, что обратившийся в наш институт за медицинским обследованием человек получает максимально возможную информацию из одной пробы материала, что значительно облегчает обследование пациентов и дает максимально полную информацию для лечащего врача.
|
Клиника высоких технологий WMT на Постовой
ул. Постовая, д. 33 |
ул. Постовая, д. 33 | ||||
|
|||||
|
Сити-Клиник на Бабушкина
ул. Бабушкина, д. 37 |
ул. Бабушкина, д. 37 | ||||
|
|||||
|
Евромед на Калинина
ул. Калинина, д. 201 |
ул. Калинина, д. 201 | ||||
|
|||||
|
Life на Восточно-Кругликовской
ул. Восточно-Кругликовская, д. 30 |
ул. Восточно-Кругликовская, д. 30 | ||||
|
|||||
|
Клиника Евроонко на Северной
ул. Северная, д. 315 |
ул. Северная, д. 315 | ||||
|
|||||
|
Евромед на КИМ
ул. КИМ, д. 143 |
ул. КИМ, д. 143 | ||||
|
|||||
|
Евромед на Памяти Чернобыльцев
ул. Памяти Чернобыльцев, д. 1 |
ул. Памяти Чернобыльцев, д. 1 | ||||
|
|||||
|
Евромед на Федора Лузана
ул. Федора Лузана, д. 19 |
ул. Федора Лузана, д. 19 | ||||
|
|||||
|
МЦ Молодо на Красных Партизан
ул. Красных Партизан, д. 359 |
ул. Красных Партизан, д. 359 | ||||
|
|||||
|
Клиника Городская на Российской
ул. Российская, д. 267/3, корп. 1 |
ул. Российская, д. 267/3, корп. 1 | ||||
|
|||||
|
Мать и Дитя на Старокубанской
ул. Старокубанская, д. 137, корп. 2 |
ул. Старокубанская, д. 137, корп. 2 | ||||
|
|||||
|
ЭкспрессМедСервис на Ставропольской
ул. Ставропольская, д. 96/1 |
ул. Ставропольская, д. 96/1 | ||||
|
|||||
|
Евромед на Кутузова
ул. Кутузова, д. 50 |
ул. Кутузова, д. 50 | ||||
|
|||||
|
Клиника Солнечная на Красных Партизан
ул. Красных Партизан, д. 128 |
ул. Красных Партизан, д. 128 | ||||
|
|||||
|
Клиника №1 на Сормовской
ул. Сормовская, д. 204, лит. А |
ул. Сормовская, д. 204, лит. А | ||||
|
|||||
|
ЕвроЛаб на Дальней
ул. Дальняя, д. 39/1 |
ул. Дальняя, д. 39/1 | ||||
|
|||||
|
ЕвроЛаб на Зиповской
ул. |
ул. Зиповская, д. 68 | ||||
|
|||||
|
ЕвроЛаб на Минской
ул. Минская, д. |
ул. Минская, д. 118/2 | ||||
|
|||||
|
ЕвроЛаб на Селезнёва
ул. Селезнёва, д. |
ул. Селезнёва, д. 203 | ||||
|
|||||
|
Ваш Доктор на Селезнева
ул. Селезнева, д. |
ул. Селезнева, д. 86/1 | ||||
|
|||||
|
Клиника Солнечная на Ставропольской
ул. |
ул. Ставропольская, д. 210, лит. Д | ||||
|
|||||
|
G8 Center на Совхозной
ул. |
ул. Совхозная, д. 1, лит. 7 | ||||
|
|||||
|
Клиника Первомайская на Евдокии Бершанской
ул. |
ул. Евдокии Бершанской, д. 402/Б | ||||
|
|||||
|
ЧУЗ Клиническая больница РЖД-Медицина на Московской
ул. |
ул. Московская, д. 96 | ||||
|
|||||
|
Краевая клиническая больница №2
ул. |
ул. Красных партизан, д. 6, корп. 2 | ||||
|
|||||
|
ГБУЗ КБСМП на 40 лет Победы
ул. |
ул. 40 лет Победы, д. 14 | ||||
|
|||||
|
Специализированная инфекционная больница на Седина
ул. |
ул. Седина, д. 204 | ||||
|
|||||
|
Краевая больница №1 имени С.В. Очаповского
ул. |
ул. 1 Мая, д. 167 | ||||
|
|||||
Микробный дисбиоз тонкой кишки лежит в основе симптомов, связанных с функциональными желудочно-кишечными расстройствами
Этическое одобрение исследований на людях
Все исследования на людях были одобрены IRB клиники Майо [тестовые образцы (16-006388 и 15-003235), здоровые контроли (14-002382 и 15–003603)], и мы соблюдали все соответствующие этические нормы. Исследование диетического вмешательства было зарегистрировано на сайте ClinicalTrials.gov (NCT03266536). Все участники диетического исследования дали информированное согласие, в то время как аспираты тонкой кишки были получены в лаборатории клинической микробиологии в соответствии с отказом от согласия IRB для протокола 15-003235.Биологические материалы, полученные от пациентов, не могут быть переданы на основании протокола, утвержденного институциональным IRB.
Исследование диетического вмешательства было зарегистрировано на сайте ClinicalTrials.gov (NCT03266536). Все участники диетического исследования дали информированное согласие, в то время как аспираты тонкой кишки были получены в лаборатории клинической микробиологии в соответствии с отказом от согласия IRB для протокола 15-003235.Биологические материалы, полученные от пациентов, не могут быть переданы на основании протокола, утвержденного институциональным IRB.
Сбор аспиратов тонкой кишки
Последовательные образцы аспиратов тонкой кишки от пациентов с симптомами после диагностической ЭГДС были получены непосредственно в микробиологической лаборатории с мая 2016 г. по декабрь 2016 г. Образцы аспиратов из двенадцатиперстной кишки были собраны во время ЭГДС после прямого прохождения в двенадцатиперстную кишку с минимальным надуванием в желудке с помощью стандартного однопросветного аспирационного катетера, проведенного через аспирационное отверстие эндоскопа.Были включены образцы, связанные с пациентами, которые ранее дали согласие на просмотр электронной медицинской карты. Всего за этот промежуток времени было получено 143 аспирата от пациентов с симптомами. После исключения образцов из-за отсутствия согласия или низкой глубины чтения при секвенировании (< 1000) было включено в общей сложности 126 пациентов с симптомами. Аспираты двенадцатиперстной кишки, полученные от 38 здоровых добровольцев, участвовавших в других исследованиях, и собранные аналогичным образом, также были получены и обработаны аналогичным образом.Клинические метаданные были получены путем ретроспективного просмотра электронной медицинской карты, включая демографическую информацию, ИМТ, клинические показания для тестирования на SIBO, количественные результаты аэробных и анаэробных аспирационных культур, курс антибиотиков для лечения SIBO, клинический ответ на антибиотики, потребность в повторных антибиотиках, недавние лекарства. включая антибиотики и использование ИПП, операции на желудочно-кишечном тракте, сопутствующие заболевания и т. д.
Всего за этот промежуток времени было получено 143 аспирата от пациентов с симптомами. После исключения образцов из-за отсутствия согласия или низкой глубины чтения при секвенировании (< 1000) было включено в общей сложности 126 пациентов с симптомами. Аспираты двенадцатиперстной кишки, полученные от 38 здоровых добровольцев, участвовавших в других исследованиях, и собранные аналогичным образом, также были получены и обработаны аналогичным образом.Клинические метаданные были получены путем ретроспективного просмотра электронной медицинской карты, включая демографическую информацию, ИМТ, клинические показания для тестирования на SIBO, количественные результаты аэробных и анаэробных аспирационных культур, курс антибиотиков для лечения SIBO, клинический ответ на антибиотики, потребность в повторных антибиотиках, недавние лекарства. включая антибиотики и использование ИПП, операции на желудочно-кишечном тракте, сопутствующие заболевания и т. д.
Критерии диагностики SIBO на основе количественных посевов
Аспираты тонкой кишки (10 мкл) посева штрихами на RBAP (кровяной агар), REMB (грамотрицательная селекционная среда) , RBAPA (предварительно восстановленный кровяной агар) и инкубировали в аэробных условиях при 35 °C, 5% CO 2 , RIMA (селективная среда для дрожжей) и инкубировали при комнатной температуре и на RCDC (анаэробный кровяной агар), RLKC (озеренная кровь, канамицин, ванкомицин — Prevotella selection), RPEA (феноло-спиртовой агар — грамположительный селективный) и инкубировали в анаэробных условиях либо в клинической лаборатории, либо в исследовательской лаборатории. лаборатория.Общее количество бактерий (анаэробных и аэробных) было меньше или больше 10 5 КОЕ/мл, а диагноз SIBO был основан на культуре аспирата двенадцатиперстной кишки, демонстрирующей ≥ 10 5 КОЕ/мл роста бактерий (аэробных, анаэробных , или оба) более 48 часов 15,16,17 .
лаборатория.Общее количество бактерий (анаэробных и аэробных) было меньше или больше 10 5 КОЕ/мл, а диагноз SIBO был основан на культуре аспирата двенадцатиперстной кишки, демонстрирующей ≥ 10 5 КОЕ/мл роста бактерий (аэробных, анаэробных , или оба) более 48 часов 15,16,17 .
Сравнение культур и секвенирования 16S рРНК
Бактериальную ДНК экстрагировали из аспиратов и биоптатов двенадцатиперстной кишки с использованием фенол-хлороформа и из кала с помощью набора для экстракции фекальной ДНК MoBio с последующей амплификацией 16 S рРНК с использованием совместимых с библиотекой Nextera праймеров, фланкирующих V4 гипервариабельная область ([прямой выступ] + 515 F: [TCGTCGGCAGCGTCAGATGTGTATAAGAGACAG]GTGCCAGCMGCCGCGGTAA; и [обратный выступ] + 806 R: [GTCTCGTGGGCTCGGAGATGTGTATAAGAGACAG]GGACTACHVGGGTWTCTAAT) и подготовлена для секвенирования с использованием двойного in-in.Все образцы были секвенированы вместе в режиме 2 × 300 парных концов на приборе Illumina MiSeq с использованием реагентов v3 Центра геномики Университета Миннесоты.
Необработанные последовательности с парными концами были отфильтрованы по качеству, обрезаны адаптером и сшиты с использованием конвейера контроля качества SHI7 35 с порогом обрезки > 32 и средним показателем качества > 35. с помощью ускоренного механизма выравнивания с оптимальным зазором BURST 36,37 в режиме CAPITALIST по базам данных 16 S бактерий и архей проекта NCBI RefSeq Targeted Loci Project (https://www.ncbi.nlm.nih.gov/refseq/targetedloci/) с 97-процентной идентичностью. После фильтрации образцов с низкой глубиной считывания мы приступили к анализу 126 пациентов с симптомами и 38 здоровых людей из контрольной группы. Анализ разнообразия был выполнен с использованием QIIME v1.9.1 38 , а анализ других данных, статистические тесты и визуализация были выполнены в R. Чтобы сравнить разнообразие различных типов образцов желудочно-кишечного тракта в исследовании диетического вмешательства, последовательности были разрежены до средней глубины. сайта с наименьшим количеством чтений, CLR (центрированное логарифмическое отношение) — преобразовано после мультипликативной замены и проанализировано с помощью пользовательских сценариев R и пакета «vegan » .
сайта с наименьшим количеством чтений, CLR (центрированное логарифмическое отношение) — преобразовано после мультипликативной замены и проанализировано с помощью пользовательских сценариев R и пакета «vegan » .
Дифференциальный анализ численности между здоровыми и симптомными субъектами был выполнен на основе нормализованных данных численности 39 в каждом таксономическом ранге с использованием теста перестановок (1000 перестановок) с t-статистикой в качестве статистики теста. Перед тестированием к нормализованным данным о численности применяли преобразование квадратного корня. Таксоны с распространенностью < 10% или максимальной долей < 0,2% исключались из тестирования. Контроль FDR (процедура Бенджамини-Хохберга) выполнялся для каждого таксономического ранга, чтобы скорректировать множественное тестирование.SI был сгенерирован с использованием классификации случайных лесов на основе нормализованных данных уровня OTU (пакет «randomForest» в R). Шкала индекса была определена как неверная вероятность классификации пациентов с симптомами на основе сгенерированной модели.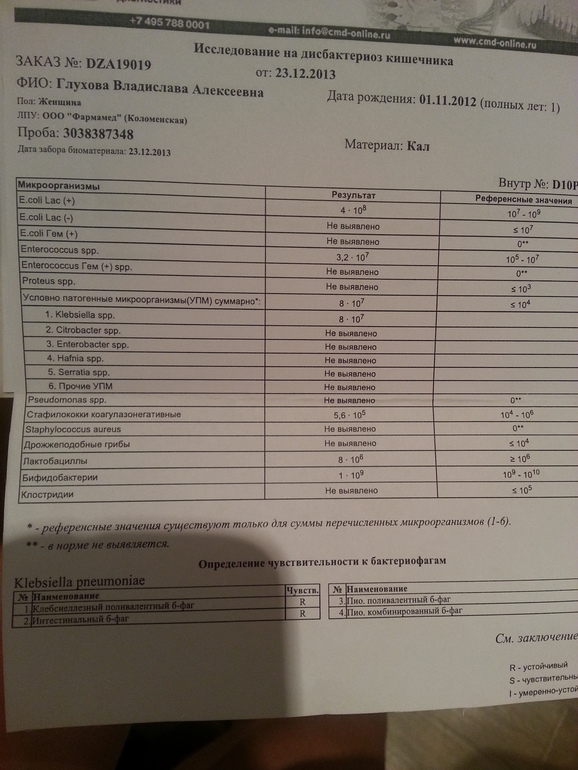 Этот метод предотвращает переобучение, удерживая выборку для классификации и прогнозируя на основе оставшихся n -1 наборов данных. Функция выбора Boruta 40 (пакет «Boruta» в R) использовалась для определения OTU, которые вносят значительный вклад в классификацию.Связи с семью демографическими или клиническими переменными были проверены с использованием моделей линейной регрессии и скорректированы для множественного тестирования с использованием контроля FDR.
Этот метод предотвращает переобучение, удерживая выборку для классификации и прогнозируя на основе оставшихся n -1 наборов данных. Функция выбора Boruta 40 (пакет «Boruta» в R) использовалась для определения OTU, которые вносят значительный вклад в классификацию.Связи с семью демографическими или клиническими переменными были проверены с использованием моделей линейной регрессии и скорректированы для множественного тестирования с использованием контроля FDR.
Мы сгенерировали DI, используя метод CLOUD 24 . Вкратце, матрица расстояний Эйтчисона для здоровых образцов использовалась в качестве эталонного облака, и расстояние от каждого здорового образца до здорового облака рассчитывалось для каждого образца в наборе данных. Этот расчет расстояния был затем повторен для каждого образца пациента с симптомами относительно здорового облака; расстояния, превышающие два стандартных отклонения (SD) от среднего значения здорового расстояния, считаются «дисбиотическими»; те, которые находятся в пределах 2 SD от среднего значения здорового расстояния, считаются «здоровыми». Затем эта оценка дисбиоза CLOUD была подтверждена с использованием ортогонального подхода, основанного на показателях SI: мы подгоняем показатели SI здоровых людей к распределению по логит-шкале (значения SI здорового контроля приблизительно нормальны по логит-шкале; p = 0,41, нормальность Шапиро-Уилка контрольная работа). Мы снова применили правило 2 SD, классифицировав образцы, превышающие 2 SD, от среднего значения здорового распределения как «дисбиотические», а образцы в пределах 2 SD — как «похожие на здоровое». Чтобы сгенерировать DI здесь, мы затем повторно классифицировали выборки по случайному лесу, используя новые групповые классификации, и использовали OOB-вероятность «дисбиотической» классификации в качестве показателя индекса.Эти два независимых метода находятся в близком согласии, что оценивается по высокой степени корреляции между показателями дисбиоза CLOUD образцов и их оценкой индекса, основанного на вероятности ( r = 0,7, p = 2 × 10 −16 , Корреляции Пирсона).
Затем эта оценка дисбиоза CLOUD была подтверждена с использованием ортогонального подхода, основанного на показателях SI: мы подгоняем показатели SI здоровых людей к распределению по логит-шкале (значения SI здорового контроля приблизительно нормальны по логит-шкале; p = 0,41, нормальность Шапиро-Уилка контрольная работа). Мы снова применили правило 2 SD, классифицировав образцы, превышающие 2 SD, от среднего значения здорового распределения как «дисбиотические», а образцы в пределах 2 SD — как «похожие на здоровое». Чтобы сгенерировать DI здесь, мы затем повторно классифицировали выборки по случайному лесу, используя новые групповые классификации, и использовали OOB-вероятность «дисбиотической» классификации в качестве показателя индекса.Эти два независимых метода находятся в близком согласии, что оценивается по высокой степени корреляции между показателями дисбиоза CLOUD образцов и их оценкой индекса, основанного на вероятности ( r = 0,7, p = 2 × 10 −16 , Корреляции Пирсона).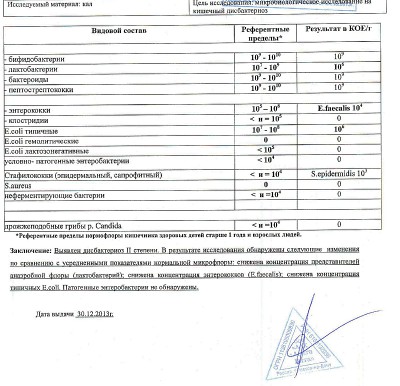 Оценка расстояния CLOUD использовалась во всех последующих анализах. Для сравнения мы также сгруппировали данные с помощью спектральной кластеризации, реализованной в пакете R «kernlab» v0.9.27, с использованием двух центров кластеризации и настроек по умолчанию 41 .
Оценка расстояния CLOUD использовалась во всех последующих анализах. Для сравнения мы также сгруппировали данные с помощью спектральной кластеризации, реализованной в пакете R «kernlab» v0.9.27, с использованием двух центров кластеризации и настроек по умолчанию 41 .
Предполагаемые функции по составу микробиоты
Для прогнозирования микробных функций предварительно обработанные считывания ДНК были сопоставлены с базой данных GreenGenes 16 S рРНК версии 13_8 с использованием BURST при 97% идентичности. Полученные таблицы OTU использовались для создания прогнозируемых аннотаций KEGG с использованием PICRUSt v1.1.3 42 . Линейный дискриминантный анализ (LDA) размер эффекта (LEfSe; Galaxy Version 1.0) 43 был затем использован для выявления предполагаемых функций, которые значительно различались (показатель LDA > 2.0) между группами.
Исследование диетических вмешательств на здоровых добровольцах
Это было пилотное проспективное одноцентровое диетическое интервенционное исследование на здоровых добровольцах, исходно потреблявших диету с высоким содержанием клетчатки. Исследование было зарегистрировано на сайте Clinicaltrials.gov под номером NCT03266536. Подходящими субъектами были здоровые взрослые ( ≥ 18 лет) с исходным потреблением клетчатки ≥ 11 г/1000 калорий/день; < 10% дневных калорий из добавленного сахара; ≥ 5 порций фруктов и овощей в день; и ≤ 13% дневных калорий из насыщенных жиров на основе заполненного опросника частоты приема пищи.Пациентов исключали из исследования, если они не соответствовали вышеуказанным диетическим требованиям, имели известный диагноз воспалительного заболевания кишечника, микроскопического колита, глютеновой болезни или других воспалительных состояний, наличие абдоминальных симптомов на основании исходного опросника, прием пероральных антибиотиков или пробиотиков в течение последние 4 недели, беременность или планы забеременеть в течение периода исследования, или любое другое заболевание (я), состояние (я) или привычка (я), которые могут помешать завершению исследования. Инструкции по питанию и выбор продуктов питания обсуждались во время индексного визита лицензированного диетолога до вмешательства.
Исследование было зарегистрировано на сайте Clinicaltrials.gov под номером NCT03266536. Подходящими субъектами были здоровые взрослые ( ≥ 18 лет) с исходным потреблением клетчатки ≥ 11 г/1000 калорий/день; < 10% дневных калорий из добавленного сахара; ≥ 5 порций фруктов и овощей в день; и ≤ 13% дневных калорий из насыщенных жиров на основе заполненного опросника частоты приема пищи.Пациентов исключали из исследования, если они не соответствовали вышеуказанным диетическим требованиям, имели известный диагноз воспалительного заболевания кишечника, микроскопического колита, глютеновой болезни или других воспалительных состояний, наличие абдоминальных симптомов на основании исходного опросника, прием пероральных антибиотиков или пробиотиков в течение последние 4 недели, беременность или планы забеременеть в течение периода исследования, или любое другое заболевание (я), состояние (я) или привычка (я), которые могут помешать завершению исследования. Инструкции по питанию и выбор продуктов питания обсуждались во время индексного визита лицензированного диетолога до вмешательства.
Все субъекты были обследованы лично или по телефону и заполнили анкету по частоте приема пищи, чтобы убедиться, что они соответствуют критериям включения и исключения. При первом и последующем посещении им была проведена ФГДС с седацией в сознании. Дуоденальные аспираты получали с помощью стандартного аспирационного катетера, проведенного через аспирационный порт с минимальным надуванием в желудке; аликвоту отправляли в клиническую лабораторию для тестирования на SIBO, а оставшуюся часть хранили для анализа микробиома при - 80 °C.Было получено восемь биоптатов двенадцатиперстной кишки для исследований в камере Уссинга, анализа микробиома и секвенирования РНК хозяина. При первоначальном и последующем посещении участники заполнили вопросник по симптомам и демографическим данным и предоставили образец стула. Симптомы, оцениваемые по опросникам, включали: частоту стула, напряжение, неполную эвакуацию, твердый/комковатый стул, боль в животе, связанную с дефекацией, диарею/жидкий водянистый стул, вздутие живота, трудности с глотанием, тошноту/рвоту, изжогу, утомляемость и аппетит. Ответы записывались в бинарном порядке (да/нет). Во время вмешательства все участники придерживались 7-дневной стандартизированной диеты с типичным для США распределением калорий по макронутриентам: 50% углеводов, 35% жиров и 15% белков. В рационе было мало клетчатки ( < 10 г/1000 калорий/день) и много простого сахара ( ≥ 50% суточной нормы углеводов).
Ответы записывались в бинарном порядке (да/нет). Во время вмешательства все участники придерживались 7-дневной стандартизированной диеты с типичным для США распределением калорий по макронутриентам: 50% углеводов, 35% жиров и 15% белков. В рационе было мало клетчатки ( < 10 г/1000 калорий/день) и много простого сахара ( ≥ 50% суточной нормы углеводов).
Статистический анализ мощности
Мы выполнили апостериорный расчет мощности для сравнения микробиома между здоровыми и симптомными субъектами, сосредоточив внимание на мощности дифференциального анализа численности, где у нас была гораздо более низкая статистическая мощность по сравнению с анализами альфа- и бета-разнообразия. , из-за многократной коррекции тестирования.Мы использовали онлайн-калькулятор мощности микробиома для проведения анализа мощности (http://fedematt.shinyapps.io/shinyMB/), который был основан на моделировании Монте-Карло и тесте Уилкоксона-Манна-Уитни 44 . Мы использовали коэффициент ложного обнаружения 5%, чтобы скорректировать множественное тестирование.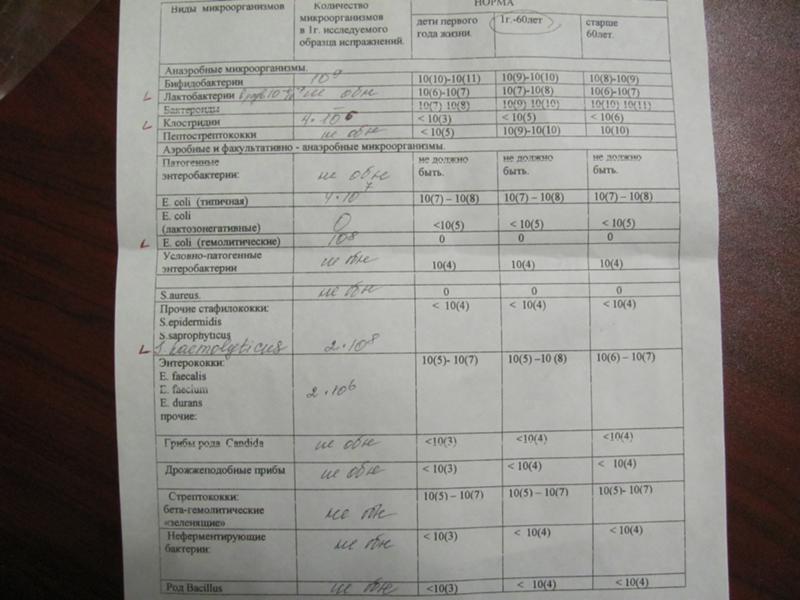 Предполагая, что мы тестируем 65 родов с обилием 10 умеренно обильных родов (ранг обилия 6–15), уменьшающимся на 50% у пациентов с симптомами (по сравнению с 26 дифференциальными родами со средним снижением на 59% в наблюдаемых данных), мы имели средняя мощность 75% для обнаружения этих 10 дифференциальных родов и мощность 100% для обнаружения по крайней мере одного значимого рода при текущем размере выборки.Таким образом, исследование имело достаточные возможности для выявления умеренной разницы в таксонах при сравнении здоровых и симптоматических субъектов.
Предполагая, что мы тестируем 65 родов с обилием 10 умеренно обильных родов (ранг обилия 6–15), уменьшающимся на 50% у пациентов с симптомами (по сравнению с 26 дифференциальными родами со средним снижением на 59% в наблюдаемых данных), мы имели средняя мощность 75% для обнаружения этих 10 дифференциальных родов и мощность 100% для обнаружения по крайней мере одного значимого рода при текущем размере выборки.Таким образом, исследование имело достаточные возможности для выявления умеренной разницы в таксонах при сравнении здоровых и симптоматических субъектов.
Функция эпителиального барьера ex vivo
Исследования в камере Ussing проводились для измерения барьерной функции слизистой оболочки двенадцатиперстной кишки и секреторных реакций, как описано ранее 45 . Вкратце, биопсии двенадцатиперстной кишки помещали в 4-мл камеры Ussing (Physiologic Instruments, Сан-Диего, Калифорния), обнажая площадь 0,031 см 2 в течение 45 минут после сбора.Камеры заполняли по Кребсу 10 мм маннитом (слизистая сторона) и по Кребсу 10 мм глюкозой (подслизистая сторона).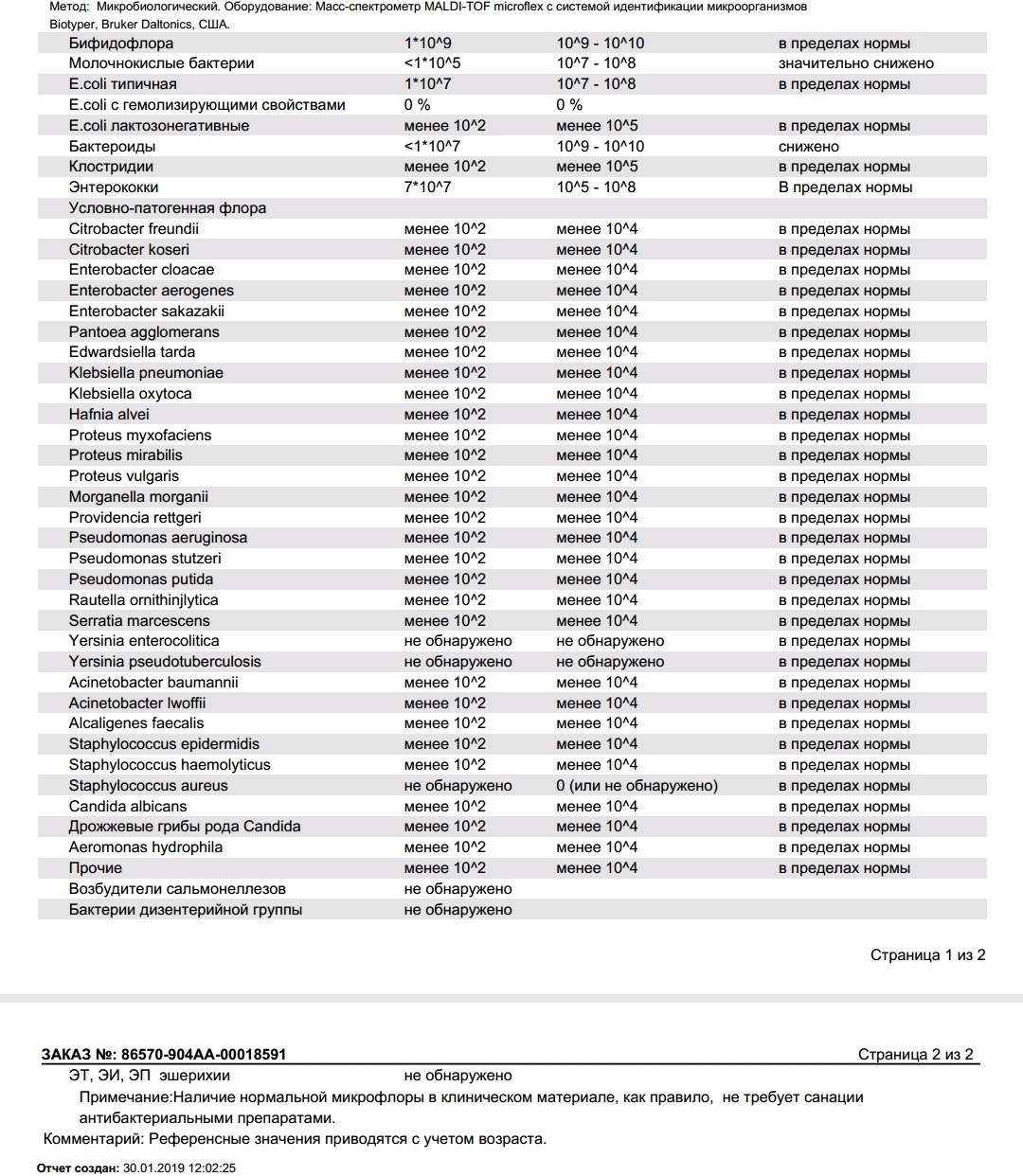 Исходное трансэпителиальное сопротивление и ток короткого замыкания каждой ткани измеряли с использованием пары электродов Ag/AgCl с агарово-солевыми мостиками и пары платиновых электродов, подающих ток, для поддержания условий фиксации напряжения. Парацеллюлярный поток через биоптаты измеряли с использованием 4 кДа FITC-декстрана, вводимого на стороне слизистой оболочки (камерная концентрация 1 мг/мл). Отбор образцов производился со стороны подслизистого слоя каждые 30 минут в течение 3 часов, а кумулятивная флуоресценция измерялась с помощью многорежимного считывателя микропланшетов Synergy Multi-Mode (BioTek, VT) и преобразовывалась в концентрацию с использованием стандартных кривых.Кумулятивный поток в конце 3 ч был рассчитан для ФИТЦ-декстран. Корреляции Спирмена (непараметрические) использовались для проверки связи между разнообразием микробиома и потоком FITC-декстран.
Исходное трансэпителиальное сопротивление и ток короткого замыкания каждой ткани измеряли с использованием пары электродов Ag/AgCl с агарово-солевыми мостиками и пары платиновых электродов, подающих ток, для поддержания условий фиксации напряжения. Парацеллюлярный поток через биоптаты измеряли с использованием 4 кДа FITC-декстрана, вводимого на стороне слизистой оболочки (камерная концентрация 1 мг/мл). Отбор образцов производился со стороны подслизистого слоя каждые 30 минут в течение 3 часов, а кумулятивная флуоресценция измерялась с помощью многорежимного считывателя микропланшетов Synergy Multi-Mode (BioTek, VT) и преобразовывалась в концентрацию с использованием стандартных кривых.Кумулятивный поток в конце 3 ч был рассчитан для ФИТЦ-декстран. Корреляции Спирмена (непараметрические) использовались для проверки связи между разнообразием микробиома и потоком FITC-декстран.
Последовательность РНК
Образцы биопсии оттаивали на льду, гомогенизировали и центрифугировали при 13 000 об/мин, а супернатант переносили в новую пробирку. РНК готовили с использованием мини-набора RNeasy (QIAGEN, Hilden, Germany) и секвенировали на Illumina HiSeq 2500. Анализ данных проводили с использованием конвейера Mayo Analysis Pipeline для секвенирования РНК (MAP-RSeq) с выравниванием по сборке генома человека (GRCh48.78) 46 . Вкратце, конвейер MAP-RSeq предварительно формирует оценку качества считываний последовательностей из файла FASTQ, выравнивает оставшиеся оставшиеся считывания с TopHat 47 , а подсчет генов агрегируется с помощью библиотеки Python HTSeq 48 . Средняя общая глубина чтения составила 57 052 595 (стандартное отклонение 8,5 × 10 6 ) и в среднем 87,0% (стандартное отклонение 2,0%) от общего числа прочтений, сопоставленных с генными моделями. Условная нормализация квантилей была выполнена для учета смещения длины гена и содержания GC 49 .
РНК готовили с использованием мини-набора RNeasy (QIAGEN, Hilden, Germany) и секвенировали на Illumina HiSeq 2500. Анализ данных проводили с использованием конвейера Mayo Analysis Pipeline для секвенирования РНК (MAP-RSeq) с выравниванием по сборке генома человека (GRCh48.78) 46 . Вкратце, конвейер MAP-RSeq предварительно формирует оценку качества считываний последовательностей из файла FASTQ, выравнивает оставшиеся оставшиеся считывания с TopHat 47 , а подсчет генов агрегируется с помощью библиотеки Python HTSeq 48 . Средняя общая глубина чтения составила 57 052 595 (стандартное отклонение 8,5 × 10 6 ) и в среднем 87,0% (стандартное отклонение 2,0%) от общего числа прочтений, сопоставленных с генными моделями. Условная нормализация квантилей была выполнена для учета смещения длины гена и содержания GC 49 .
Образцы аспирата центрифугировали при 4°C при 12 000 × g в течение 5 мин.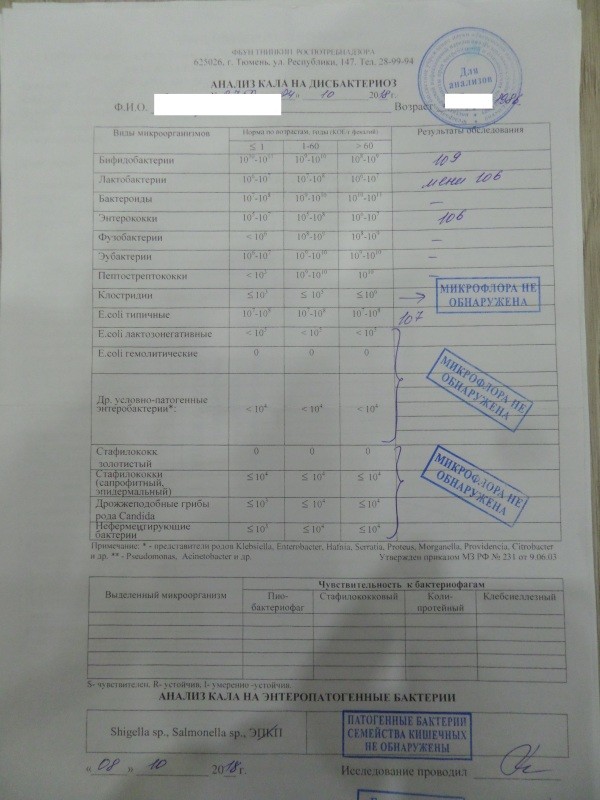 162 мкл супернатанта смешивали с 18 мкл буфера ЯМР (1,5 м KH 2 PO 4 , 1 г/л TSP и 0,13 г/л NaN 3 , Sigma-Aldrich) и переносили в 3 мм ЯМР трубка. Образцы фекалий предварительно взвешивали (~ 100 мг), рандомизировали и помещали в пробирку с завинчивающейся крышкой, содержащую 50 мг 1.Циркониевые шарики диаметром 0 мм, к которым было добавлено 400 мкл ACN:H 2 O (1:3). Пробирку помещали в бисерную мешалку Biospec на 30 с. Затем гомогенизированный образец центрифугировали в течение 20 минут при 16 000× г . Супернатант осторожно переносили в пробирки со спин-фильтром и центрифугировали в течение 30 мин при 16 000 × г . 80 мкл отфильтрованной фекальной воды аликвотировали в 96-луночный планшет, а 10 мкл использовали для контроля качества. Отфильтрованную фекальную воду в 96-луночном планшете сушили в токе азота перед восстановлением с помощью 540 мкл D 2 O (Sigma-Aldrich) и 60 мкл буфера ЯМР.Восстановленную смесь фекальной воды и буфера переносили в экспериментальные пробирки для ЯМР диаметром 5 мм.
162 мкл супернатанта смешивали с 18 мкл буфера ЯМР (1,5 м KH 2 PO 4 , 1 г/л TSP и 0,13 г/л NaN 3 , Sigma-Aldrich) и переносили в 3 мм ЯМР трубка. Образцы фекалий предварительно взвешивали (~ 100 мг), рандомизировали и помещали в пробирку с завинчивающейся крышкой, содержащую 50 мг 1.Циркониевые шарики диаметром 0 мм, к которым было добавлено 400 мкл ACN:H 2 O (1:3). Пробирку помещали в бисерную мешалку Biospec на 30 с. Затем гомогенизированный образец центрифугировали в течение 20 минут при 16 000× г . Супернатант осторожно переносили в пробирки со спин-фильтром и центрифугировали в течение 30 мин при 16 000 × г . 80 мкл отфильтрованной фекальной воды аликвотировали в 96-луночный планшет, а 10 мкл использовали для контроля качества. Отфильтрованную фекальную воду в 96-луночном планшете сушили в токе азота перед восстановлением с помощью 540 мкл D 2 O (Sigma-Aldrich) и 60 мкл буфера ЯМР.Восстановленную смесь фекальной воды и буфера переносили в экспериментальные пробирки для ЯМР диаметром 5 мм.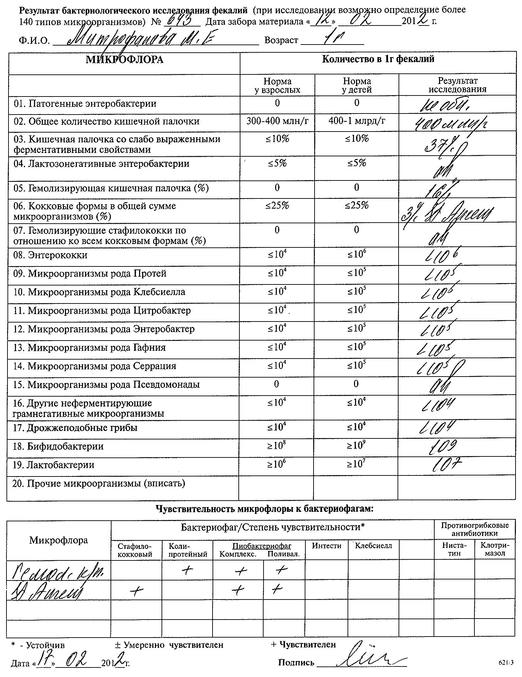
Метаболические профили измеряли на спектрометре Bruker 600 МГц (Bruker Biospin, Rheinstetten, Germany) при постоянной температуре 300 K для образцов мочи, аспирата и кала и 310 K для образцов плазмы. Стандартный одномерный эксперимент NOSY был проведен для каждого образца мочи, аспирата и фекальной воды, а эксперимент CPMG — для образцов плазмы.В общей сложности было получено 64 сканирования для каждого образца в 64 K точек данных для мочи, аспиратов и плазмы; Было собрано 128 сканирований на образец в 64 K точек данных для фекальной воды.
1 Предварительная обработка данных Н-ЯМР Данные спектров были импортированы в MATLAB (версия 8.3.0.532 R2014a, Mathworks Inc, Натик, Массачусетс, США). Для следующих исполнений использовалась серия сценариев собственной разработки. Фазирование, коррекция базовой линии и спектральная калибровка по TSP (0 частей на миллион). Спектры выравнивались вручную. Чтобы учесть разницу в концентрации образцов, к образцам применялась нормализация вероятностного отношения. Собственные сценарии использовались для построения моделей PCA и OPLS-DA и интеграции интересующих пиков. Корреляции признаков и тенденции были проанализированы в R.
Спектры выравнивались вручную. Чтобы учесть разницу в концентрации образцов, к образцам применялась нормализация вероятностного отношения. Собственные сценарии использовались для построения моделей PCA и OPLS-DA и интеграции интересующих пиков. Корреляции признаков и тенденции были проанализированы в R.
Сводка отчетов
Дополнительная информация о дизайне исследования доступна в Краткой сводке отчетов об исследованиях Nature, связанной с этой статьей.
Границы | Текущие методы отбора проб для микробиоты кишечника: призыв к более точным устройствам
Введение
Люди обладают сложной кишечной микробиотой, состав которой варьируется в зависимости от различных отделов желудочно-кишечного тракта (ЖКТ) (Zoetendal et al., 2012). Сообщалось, что количество некультивируемых видов в микробиоте кишечника достигло 1952 (Almeida et al., 2019). Считается, что физиологические изменения в различных областях тонкой и толстой кишки, включая химические и пищевые градиенты и изолированную иммунную активность хозяина, влияют на состав бактериальных сообществ (Donaldson et al. , 2016). Микробиота кишечника играет важную роль во внутренней среде человека. Он развивается вместе с хозяином и выполняет важные физиологические функции для хозяина, такие как предотвращение заражения различными патогенами; содействие созреванию иммунной системы; участие в регуляции иммунного ответа, пищевого поглощения и метаболизма; и продвижение противораковых функций (Foster et al., 2017; Ким и др., 2017; Макферсон и др., 2017; Ли и др., 2019). Колонизация микробиоты новорожденных начинается с внутриутробного развития (Dunn et al., 2017). Как способ родов, так и прекращение грудного вскармливания считаются важными для сборки кишечной микробиоты, подобной взрослой. Микробный состав резко меняется на 1-м году жизни (La Rosa et al., 2014; Bäckhed et al., 2015).
, 2016). Микробиота кишечника играет важную роль во внутренней среде человека. Он развивается вместе с хозяином и выполняет важные физиологические функции для хозяина, такие как предотвращение заражения различными патогенами; содействие созреванию иммунной системы; участие в регуляции иммунного ответа, пищевого поглощения и метаболизма; и продвижение противораковых функций (Foster et al., 2017; Ким и др., 2017; Макферсон и др., 2017; Ли и др., 2019). Колонизация микробиоты новорожденных начинается с внутриутробного развития (Dunn et al., 2017). Как способ родов, так и прекращение грудного вскармливания считаются важными для сборки кишечной микробиоты, подобной взрослой. Микробный состав резко меняется на 1-м году жизни (La Rosa et al., 2014; Bäckhed et al., 2015).
Микробиота кишечника постепенно меняется со временем, и были обнаружены различия между молодыми и пожилыми людьми (O’Toole and Jeffery, 2015).Микробиота кишечника различается у разных людей из-за многих факторов, таких как гены и диета. Исследования показали, что диеты с высоким содержанием углеводов и клетчатки могут увеличить количество и разнообразие кишечных микроорганизмов, особенно у людей с ограниченным микробным разнообразием (Tap et al., 2015; Sheflin et al., 2017). Низкоуглеводные диеты могут значительно снизить количество бактерий, продуцирующих масляную кислоту (таких как Roseburia и Bifidobacterium ), тем самым снижая выработку масляной кислоты и снижая защитный эффект на кишечник (Duncan et al., 2007; Рассел и др., 2011). Незрелая кишечная микробиота считается одной из причин недоедания, а олигосахариды грудного молока могут улучшать недоедание, регулируя микробиом (Blanton et al., 2016; Charbonneau et al., 2016). Кроме того, возникновение многих заболеваний, таких как инфекция Clostridium difficile , воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), также связано с изменением микробиоты кишечника. Длительный прием большого количества антибиотиков широкого спектра действия может привести к дисбактериозу, например С.
Исследования показали, что диеты с высоким содержанием углеводов и клетчатки могут увеличить количество и разнообразие кишечных микроорганизмов, особенно у людей с ограниченным микробным разнообразием (Tap et al., 2015; Sheflin et al., 2017). Низкоуглеводные диеты могут значительно снизить количество бактерий, продуцирующих масляную кислоту (таких как Roseburia и Bifidobacterium ), тем самым снижая выработку масляной кислоты и снижая защитный эффект на кишечник (Duncan et al., 2007; Рассел и др., 2011). Незрелая кишечная микробиота считается одной из причин недоедания, а олигосахариды грудного молока могут улучшать недоедание, регулируя микробиом (Blanton et al., 2016; Charbonneau et al., 2016). Кроме того, возникновение многих заболеваний, таких как инфекция Clostridium difficile , воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), также связано с изменением микробиоты кишечника. Длительный прием большого количества антибиотиков широкого спектра действия может привести к дисбактериозу, например С.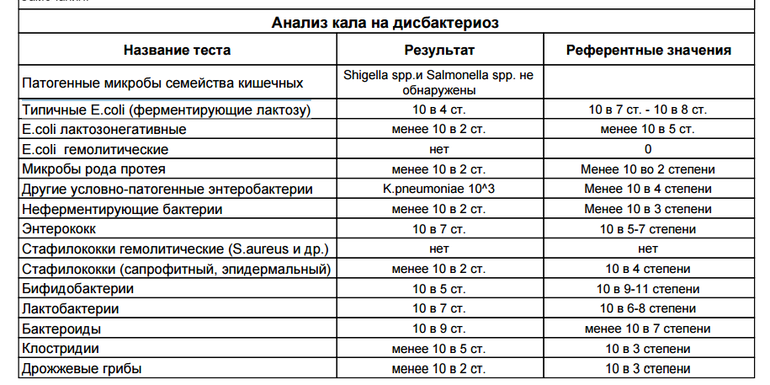 difficile (Stanley and Burns, 2010). По сравнению с контрольной группой исследования кишечной микрофлоры у пациентов с ВЗК постоянно показывают изменения в составе микрофлоры и снижение общего биоразнообразия, например, увеличение количества факультативных анаэробов и снижение количества облигатных анаэробов (Shim, 2013; Lloyd-Price et al. , 2019). Считается, что возникновение СРК связано с микробным влиянием на связь между кишечником и мозгом (Eisenstein, 2016).
difficile (Stanley and Burns, 2010). По сравнению с контрольной группой исследования кишечной микрофлоры у пациентов с ВЗК постоянно показывают изменения в составе микрофлоры и снижение общего биоразнообразия, например, увеличение количества факультативных анаэробов и снижение количества облигатных анаэробов (Shim, 2013; Lloyd-Price et al. , 2019). Считается, что возникновение СРК связано с микробным влиянием на связь между кишечником и мозгом (Eisenstein, 2016).
Поскольку существует множество связей между кишечной микробиотой и здоровьем человека, особенно важно проанализировать взаимосвязь между изменениями в кишечной микробиоте и возникновением, прогрессированием и прогнозом заболевания.В прошлом анализ кишечного микробиома зависел от выделения и посева, но сложность культивирования анаэробных бактерий, которых много в кишечнике, серьезно влияла на точность анализа. В последние годы развитие секвенирования нового поколения (NGS), которое может точно анализировать микробные компоненты без культивирования, привлекло внимание в исследованиях кишечного микробиома. Однако крайне важно собрать соответствующие образцы кишечной микробиоты для NGS.Существующие методы отбора проб для получения образцов кала, биопсии слизистой оболочки и аспирации кишечника, все из которых могут иметь некоторые дефекты, не могут точно отражать состав кишечного микробиома (таблица 1). В этом обзоре мы суммируем современные методы сбора кишечной микробиоты и их возможные недостатки, чтобы изучить трудности, которые необходимо преодолеть в технологиях сбора кишечной микробиоты.
Однако крайне важно собрать соответствующие образцы кишечной микробиоты для NGS.Существующие методы отбора проб для получения образцов кала, биопсии слизистой оболочки и аспирации кишечника, все из которых могут иметь некоторые дефекты, не могут точно отражать состав кишечного микробиома (таблица 1). В этом обзоре мы суммируем современные методы сбора кишечной микробиоты и их возможные недостатки, чтобы изучить трудности, которые необходимо преодолеть в технологиях сбора кишечной микробиоты.
Таблица 1 . Сравнение различных методов отбора проб для анализа микробиоты кишечника.
Обзор
Образцы фекалий
Из прагматических соображений образцы фекалий часто используются в качестве косвенных показателей микробиоты кишечника. Образцы фекалий собираются естественным путем, неинвазивны и могут браться повторно, поэтому они являются источником образцов для большинства исследований кишечной микробиоты. Однако становится все более очевидным, что могут существовать значительные различия в микробном составе слизистой оболочки и фекалий (Zoetendal et al. , 2002; Carroll et al., 2010).Фекалии считались заменителями содержимого просвета ЖКТ, но их компоненты неточно отражают прямое взаимодействие со слизистой оболочкой. В недавних исследованиях было продемонстрировано, что микробиота, связанная с фекалиями и слизистой оболочкой, представляет собой две разные микробные ниши (Rangel et al., 2015; Ringel et al., 2015; Tap et al., 2017). Образцы фекалий не могут быть индикаторами состава и метагеномной функции связанной со слизистой оболочкой микробиоты, распределенной по нескольким участкам кишечника (Zmora et al., 2018).Следовательно, существует погрешность в оценке кишечной микробиоты с фекалиями. Более того, фекальная микробиота неравномерно распределена в фекалиях и имеет собственную биоструктуру (Swidsinski et al., 2008). Ву и др. сообщили, что 35% малочисленных таксонов, на долю которых приходится 0,2–0,4% всего микробиома в одной повторности, не были обнаружены во втором образце фекалий (Wu et al., 2010). Индивидуальная изменчивость обнаруженных бактерий была значительно снижена в большинстве исследований, в которых гомогенизировались образцы фекалий или мазки и игнорировалась их структура (Hsieh et al.
, 2002; Carroll et al., 2010).Фекалии считались заменителями содержимого просвета ЖКТ, но их компоненты неточно отражают прямое взаимодействие со слизистой оболочкой. В недавних исследованиях было продемонстрировано, что микробиота, связанная с фекалиями и слизистой оболочкой, представляет собой две разные микробные ниши (Rangel et al., 2015; Ringel et al., 2015; Tap et al., 2017). Образцы фекалий не могут быть индикаторами состава и метагеномной функции связанной со слизистой оболочкой микробиоты, распределенной по нескольким участкам кишечника (Zmora et al., 2018).Следовательно, существует погрешность в оценке кишечной микробиоты с фекалиями. Более того, фекальная микробиота неравномерно распределена в фекалиях и имеет собственную биоструктуру (Swidsinski et al., 2008). Ву и др. сообщили, что 35% малочисленных таксонов, на долю которых приходится 0,2–0,4% всего микробиома в одной повторности, не были обнаружены во втором образце фекалий (Wu et al., 2010). Индивидуальная изменчивость обнаруженных бактерий была значительно снижена в большинстве исследований, в которых гомогенизировались образцы фекалий или мазки и игнорировалась их структура (Hsieh et al.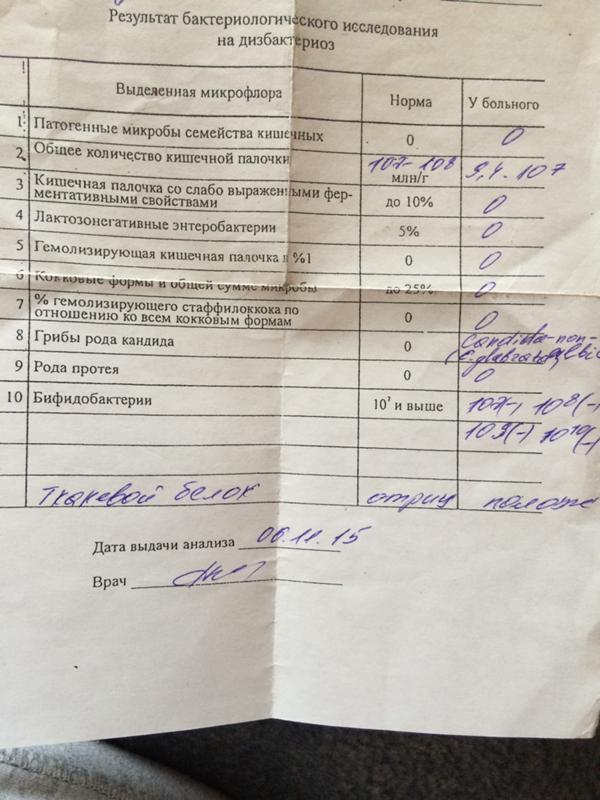 , 2016). В случае фекальной подвыборки результаты микробных таксонов, обнаруженных с помощью количественной ПЦР, сильно различались (Gorzelak et al., 2015).
, 2016). В случае фекальной подвыборки результаты микробных таксонов, обнаруженных с помощью количественной ПЦР, сильно различались (Gorzelak et al., 2015).
Кроме того, при определенных условиях свежие образцы стула не могут быть проанализированы немедленно и должны храниться некоторое время. Фекальные материалы, мгновенно замороженные при температуре -80 ° C, которые могут поддерживать микробную целостность без консервантов, широко считаются золотым стандартом для определения профиля микробиоты кишечника. Этот подход сохраняет микробные компоненты, аналогичные компонентам свежих образцов, и воздерживается от потенциального воздействия консервантов (Fouhy et al., 2015). Для крупномасштабных популяционных исследований важны соответствующие методы для соблюдения пациентом режима лечения и сбора оптимальных образцов. Иногда идеальные условия для немедленного хранения образцов при температуре -80°C не могут быть соблюдены. Таким образом, необходимо рассмотреть допустимые методы сбора, чтобы свести к минимуму систематическую погрешность, которая может быть введена на этапах предварительной обработки (Flores et al.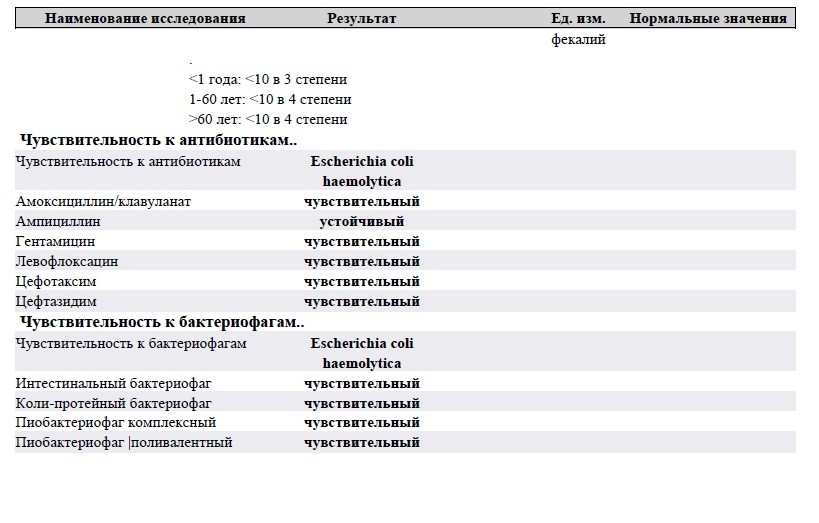 , 2015). Джоселин М. и др. сообщили, что хранение и транспортировка образцов при 4°C может свести к минимуму изменения микробного состава, если невозможно хранение при сверхнизких температурах (Choo et al., 2015).
, 2015). Джоселин М. и др. сообщили, что хранение и транспортировка образцов при 4°C может свести к минимуму изменения микробного состава, если невозможно хранение при сверхнизких температурах (Choo et al., 2015).
Существуют и другие методы хранения с консервантами или без них, которые используются для достижения состава микробиома, аналогичного составам свежих образцов. В качестве неаддитивных методов образцы фекалий, хранившиеся при комнатной температуре в течение 24 часов, -20°C в течение 1 недели и в пробирках Эппендорфа при комнатной температуре в течение 3 дней, не оказали существенного влияния на профили фекального микробиома (Carroll et al., 2012; Tedjo et al. др., 2015). Кроме того, было доказано, что карты анализа кала на скрытую кровь, карты FTA (Whatman) и набор OMNIgene Gut (DNA Genotek) также эффективны для образцов, хранившихся в течение нескольких дней при комнатной температуре (Dominianni et al., 2014; Сонг и др., 2016; Фогтманн и др., 2017). Для использования консервантов для стабильного хранения образцов фекалий заслуживают рекомендации 95% этанол и РНКлатер (Flores et al. , 2015; Song et al., 2016; Vogtmann et al., 2017; Wang et al., 2018). Условия хранения могут существенно изменить характеристики микробного сообщества. При отсутствии сверхнизкотемпературных условий хранение и транспортировка указанными выше способами позволяют свести к минимуму изменения микробного состава. Выбор методов сбора и хранения должен основываться на цели, объеме и условиях исследования.
, 2015; Song et al., 2016; Vogtmann et al., 2017; Wang et al., 2018). Условия хранения могут существенно изменить характеристики микробного сообщества. При отсутствии сверхнизкотемпературных условий хранение и транспортировка указанными выше способами позволяют свести к минимуму изменения микробного состава. Выбор методов сбора и хранения должен основываться на цели, объеме и условиях исследования.
Вкратце, недостатки использования образцов фекалий в качестве заменителей микробиоты кишечника можно резюмировать в следующих аспектах. Во-первых, нельзя исключить возможность неполного разделения фекальных бактерий и кишечной флоры. Физиологические вариации, содержащие химические и питательные градиенты, а также разделение иммунной активности хозяина, различаются по длине тонкой и толстой кишки, и все они, как известно, влияют на микробный состав. Семейства Lactobacillaceae и Enterobacteriaceae преобладают в тонкой кишке, тогда как в толстой кишке доминируют семейства Prevotellaceae, Bacteroidaceae, Rikenellaceae, Ruminococcaceae и Lachnospiraceae (Donaldson et al.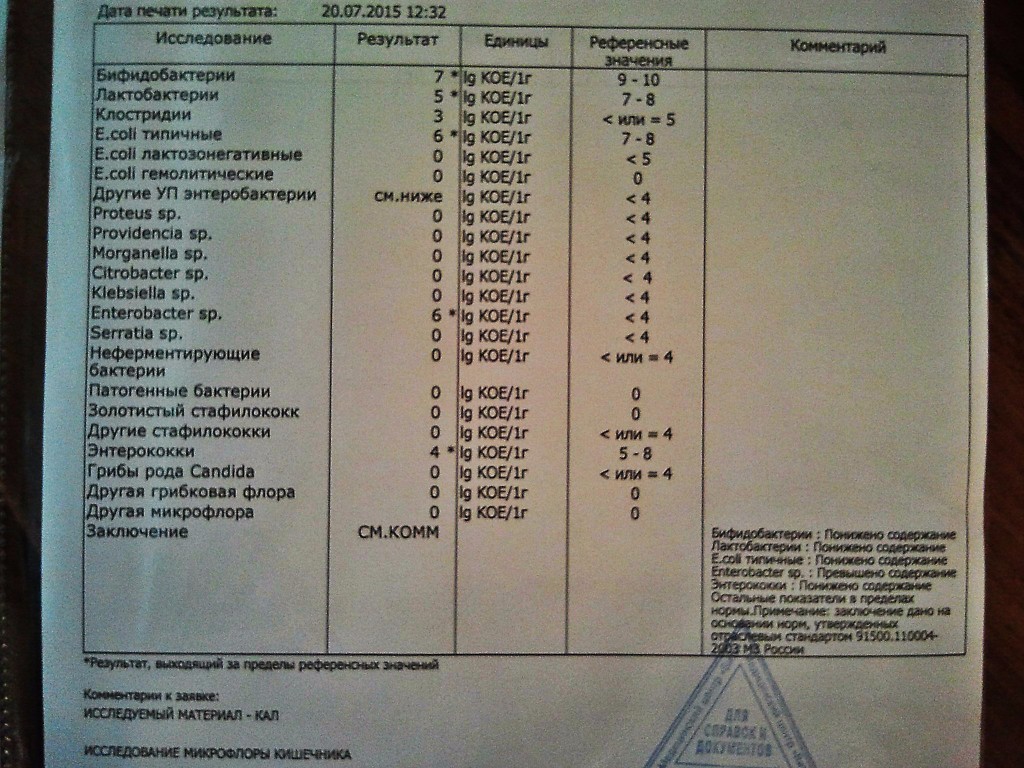 , 2016). Поэтому изучение кишечной флоры с фекальными бактериями не является исчерпывающим. Во-вторых, гомогенизация перед сбором образцов фекалий нарушает биоструктуру фекалий, и без гомогенизации репрезентативность образцов может быть недостаточной. Свидсински и др. использовали пластиковую соломинку для питья, чтобы пробить стул, чтобы получить фекальные цилиндры, которые успешно сохранили биоструктуру фекальной микробиоты и продемонстрировали, что фекальная микробиота высоко структурирована (Swidsinski et al., 2008). Однако в другом исследовании сообщается, что гомогенизация может значительно уменьшить индивидуальные различия в обнаружении каждого компонента фекальной микробиоты (Hsieh et al., 2016). Это приводит к спорам о том, какой метод следует принять. Наконец, в большинстве случаев нереально сразу проанализировать свежие образцы. Затем необходимо учитывать влияние метода хранения, который может вызвать деградацию микробной ДНК, чрезмерный рост и гибель некоторых видов, на компоненты образца фекалий.
, 2016). Поэтому изучение кишечной флоры с фекальными бактериями не является исчерпывающим. Во-вторых, гомогенизация перед сбором образцов фекалий нарушает биоструктуру фекалий, и без гомогенизации репрезентативность образцов может быть недостаточной. Свидсински и др. использовали пластиковую соломинку для питья, чтобы пробить стул, чтобы получить фекальные цилиндры, которые успешно сохранили биоструктуру фекальной микробиоты и продемонстрировали, что фекальная микробиота высоко структурирована (Swidsinski et al., 2008). Однако в другом исследовании сообщается, что гомогенизация может значительно уменьшить индивидуальные различия в обнаружении каждого компонента фекальной микробиоты (Hsieh et al., 2016). Это приводит к спорам о том, какой метод следует принять. Наконец, в большинстве случаев нереально сразу проанализировать свежие образцы. Затем необходимо учитывать влияние метода хранения, который может вызвать деградацию микробной ДНК, чрезмерный рост и гибель некоторых видов, на компоненты образца фекалий.
Образцы эндоскопии
По сравнению с использованием образцов фекалий для анализа состава микробиоты ЖКТ было проведено несколько исследований по сбору образцов тканей и содержимого просвета для оценки микробиоты в различных микробных нишах во время эндоскопических процедур.Более полную информацию о микробиоме кишечника можно получить с помощью инструментов (таких как биопсийные щипцы и просветные щетки) посредством эндоскопии. Существует несколько общих дефектов методов выборки. Во-первых, эндоскопия является инвазивной и небезопасной для пациентов. Во-вторых, многие исследования показали, что влияние подготовки кишечника на микрофлору кишечника неизбежно. Затем, когда инструменты для отбора проб проходят через эндоскопический канал, они могут быть загрязнены содержимым, находящимся в канале. Наконец, из-за сложной структуры эндоскопия ограничивается доступом к дистальным отделам тонкой кишки.В настоящее время существует несколько методов получения образцов кишечной микробиоты с помощью эндоскопии.
Биопсия
Нижний отдел желудочно-кишечного тракта млекопитающих содержит разнообразные микробные среды обитания вдоль тонкой, слепой и толстой кишки. Эндоскопическая биопсия позволяет исследовать состав микробиоты слизистой оболочки в различных анатомических участках желудочно-кишечного тракта. Считается, что микробиота слизистых оболочек важна для хозяина, поскольку они находятся в контакте с лимфоидной тканью, связанной с кишечником (Heinsen et al., 2015).
Для подготовки кишечника обычно требуется некоторое количество слабительных, таких как полиэтиленгликоль (ПЭГ) или сульфат, чтобы очистить желудочно-кишечный тракт от большей части пищеварительного тракта. Адекватная подготовка кишечника требует, чтобы фекалии представляли собой прозрачную жидкость без твердых частиц внутри. Однако у мышей с осмотической диареей, вызванной водным раствором ПЭГ, эпителий кишечника, слизистая оболочка и кишечная среда хозяина были разрушены за короткий период времени, а микробиота кишечника все еще значительно изменялась в течение длительного периода времени.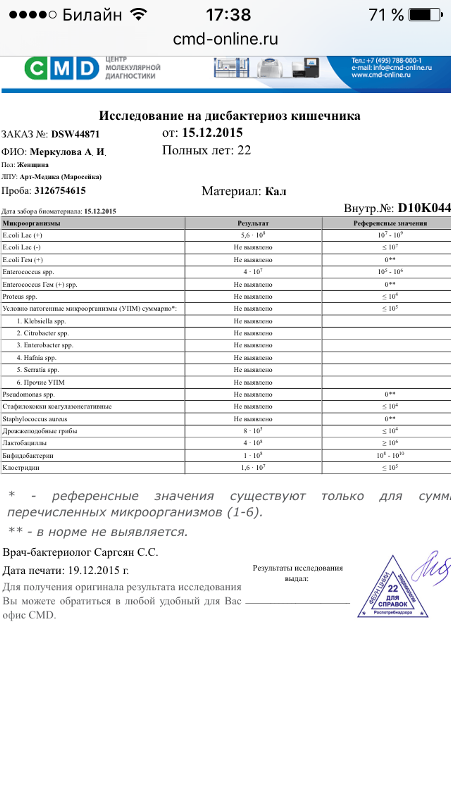 Изменения в кишечной микробиоте в основном заключались в том, что альфа-разнообразие значительно уменьшилось, и оно все еще было значительно ниже исходного уровня через 2 недели после диареи, и его было трудно полностью восстановить. Более того, некоторые бактерии с высокой численностью исчезли (например, семейство S24-7) и были заменены другими таксонами с низкой численностью (Tropini et al., 2018). Предыдущее исследование показало, что подготовка кишечника с помощью ПЭГ может привести к значительным морфологическим изменениям в толстой кишке, включая потерю эпителиальных клеток и поверхностной слизи (Bucher et al., 2006). Шобар и др. сообщили, что на разнообразие и состав микробиомов просвета и слизистых оболочек влияет подготовка кишечника (Shobar et al., 2016). Также установлено, что лаваж перед колоноскопией вызывает 31-кратное снижение общей микробной нагрузки и потерю предметной специфичности микробиоты у 22% участников (Jalanka et al., 2015).
Изменения в кишечной микробиоте в основном заключались в том, что альфа-разнообразие значительно уменьшилось, и оно все еще было значительно ниже исходного уровня через 2 недели после диареи, и его было трудно полностью восстановить. Более того, некоторые бактерии с высокой численностью исчезли (например, семейство S24-7) и были заменены другими таксонами с низкой численностью (Tropini et al., 2018). Предыдущее исследование показало, что подготовка кишечника с помощью ПЭГ может привести к значительным морфологическим изменениям в толстой кишке, включая потерю эпителиальных клеток и поверхностной слизи (Bucher et al., 2006). Шобар и др. сообщили, что на разнообразие и состав микробиомов просвета и слизистых оболочек влияет подготовка кишечника (Shobar et al., 2016). Также установлено, что лаваж перед колоноскопией вызывает 31-кратное снижение общей микробной нагрузки и потерю предметной специфичности микробиоты у 22% участников (Jalanka et al., 2015).
В дополнение к эффектам, вызываемым подготовкой кишечника, биопсия слизистой оболочки, выполняемая во время стандартных эндоскопических процедур, может быть контаминирована просветной жидкостью ЖКТ в эндоскопическом канале.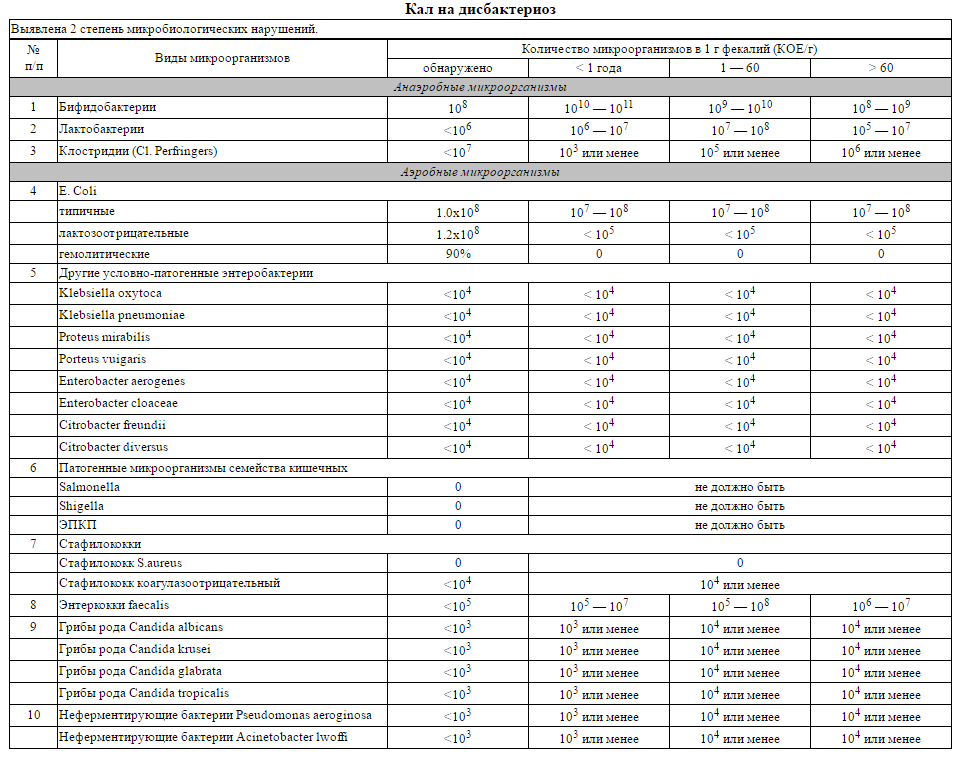 Для сведения к минимуму контаминации во время отбора проб микробиоты, ассоциированной со слизистой оболочкой, было разработано устройство для асептической биопсии Брисбена (BABD), которое состоит из стерильных щипцов, покрытых оболочкой и закрытых заглушками на концах. Биоптаты, полученные с помощью стандартных щипцов, имеют большее разнообразие микробиоты, связанной со слизистой оболочкой, чем образцы, собранные с помощью BABD (Shanahan et al., 2016). Даже в этом случае загрязнение может произойти до отбора проб. Когда эндоскопическая трубка входит в место отбора проб изо рта или ануса, бактерии, находящиеся в местах, не предназначенных для взятия проб, неизбежно попадают в место взятия проб.Кроме того, эндоскоп не может охватить все сегменты всего кишечника, например дистальный отдел тонкой кишки, поэтому количество биоптатов ограничено. Современные мультиомные технологии требуют различных исходных материалов, включая ДНК, РНК и белки, и биопсия может не дать достаточного количества материала, чтобы справиться с требованиями этих технологий.
Для сведения к минимуму контаминации во время отбора проб микробиоты, ассоциированной со слизистой оболочкой, было разработано устройство для асептической биопсии Брисбена (BABD), которое состоит из стерильных щипцов, покрытых оболочкой и закрытых заглушками на концах. Биоптаты, полученные с помощью стандартных щипцов, имеют большее разнообразие микробиоты, связанной со слизистой оболочкой, чем образцы, собранные с помощью BABD (Shanahan et al., 2016). Даже в этом случае загрязнение может произойти до отбора проб. Когда эндоскопическая трубка входит в место отбора проб изо рта или ануса, бактерии, находящиеся в местах, не предназначенных для взятия проб, неизбежно попадают в место взятия проб.Кроме того, эндоскоп не может охватить все сегменты всего кишечника, например дистальный отдел тонкой кишки, поэтому количество биоптатов ограничено. Современные мультиомные технологии требуют различных исходных материалов, включая ДНК, РНК и белки, и биопсия может не дать достаточного количества материала, чтобы справиться с требованиями этих технологий. По этой причине Watt и соавт. продемонстрировали, что лаваж толстой кишки предлагает тип образца, аналогичный типу биопсии, и генерирует значительно более высокий уровень ДНК, чем у биопсии, со средним выходом ДНК 48.5 и 1,95 мкг для кишечного лаважа и биопсии соответственно (Watt et al., 2016).
По этой причине Watt и соавт. продемонстрировали, что лаваж толстой кишки предлагает тип образца, аналогичный типу биопсии, и генерирует значительно более высокий уровень ДНК, чем у биопсии, со средним выходом ДНК 48.5 и 1,95 мкг для кишечного лаважа и биопсии соответственно (Watt et al., 2016).
Биопсия слизистой оболочки покрывает лишь небольшую площадь поверхности и может привести к отклонению пробы и недоступности редких таксонов, если микробная популяция распределяется неравномерно. Биопсия слизистой часто содержит большое количество загрязненной ДНК хозяина, что усложняет метагеномный и другие молекулярные анализы (Huse et al., 2014).
Из-за влияния подготовки кишечника и контаминации во время процедуры, инвазии, ограниченности мест взятия проб, риска кровотечения и инфицирования и непригодности для здоровых людей биопсия, хотя и считается золотым стандартом для сбора микробиоты слизистой оболочки , не подходит для будущего анализа микробиоты кишечника.
Luminal Brush
В 1979 г.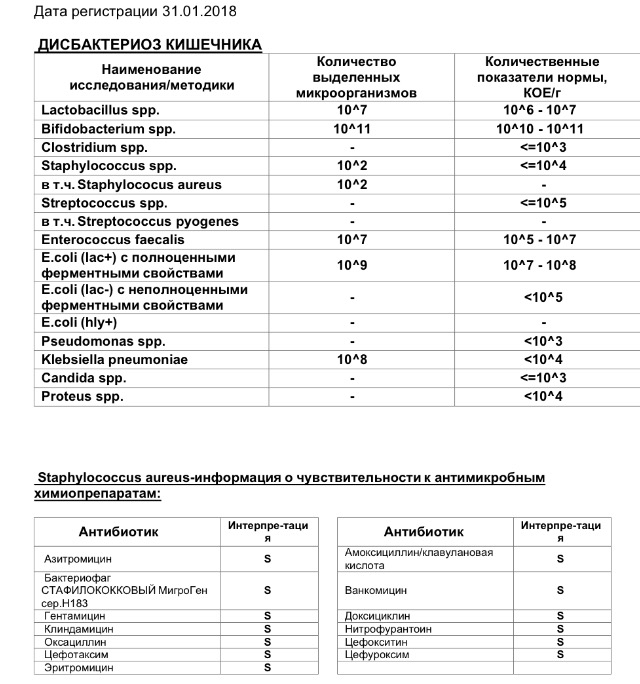 Wimberley et al. впервые применили метод защищенной щетки для образцов (PSB) для сбора инфекционных образцов из нижних дыхательных путей с помощью оптоволоконного бронхоскопа (Wimberley et al., 1979). Эти образцы щетки не легко контаминируются нормальной флорой верхних дыхательных путей, что имеет большее значение для диагностики инфекций нижних дыхательных путей. В последние годы Лавель и соавт. продвигали и валидировали методы повторной оценки пространственной изменчивости микробной популяции толстой кишки путем сочетания биопсии слизистой оболочки с методом PSB, который используется для отбора проб микробиоты, связанной с просветом (Lavelle et al., 2013). PSB представляет собой стерильную одноразовую щетку-оболочку с дистальной заглушкой наверху, которая герметизируется в оболочке при введении и извлечении через колоноскопический канал. В отличие от биопсии, чистка слизистой оболочки щеткой может снизить риски, связанные с биопсией слизистой оболочки (кровотечение и инфекция), и обеспечить более репрезентативный образец поверхности слизистой оболочки, а при взятии образцов щеткой было получено относительно большое соотношение ДНК бактерий и ДНК хозяина (Huse et al.
Wimberley et al. впервые применили метод защищенной щетки для образцов (PSB) для сбора инфекционных образцов из нижних дыхательных путей с помощью оптоволоконного бронхоскопа (Wimberley et al., 1979). Эти образцы щетки не легко контаминируются нормальной флорой верхних дыхательных путей, что имеет большее значение для диагностики инфекций нижних дыхательных путей. В последние годы Лавель и соавт. продвигали и валидировали методы повторной оценки пространственной изменчивости микробной популяции толстой кишки путем сочетания биопсии слизистой оболочки с методом PSB, который используется для отбора проб микробиоты, связанной с просветом (Lavelle et al., 2013). PSB представляет собой стерильную одноразовую щетку-оболочку с дистальной заглушкой наверху, которая герметизируется в оболочке при введении и извлечении через колоноскопический канал. В отличие от биопсии, чистка слизистой оболочки щеткой может снизить риски, связанные с биопсией слизистой оболочки (кровотечение и инфекция), и обеспечить более репрезентативный образец поверхности слизистой оболочки, а при взятии образцов щеткой было получено относительно большое соотношение ДНК бактерий и ДНК хозяина (Huse et al. , 2014). Хотя сообщалось, что альфа-разнообразие образцов, собранных с помощью BABD и метода PSB, сходно на уровне типа, метод PSB дает образцы с более высокой долей бактериальной гДНК (Shanahan et al., 2016). Однако другое исследование показало, что существуют пространственные различия между микробиотой просвета и слизистой оболочки (Lavelle et al., 2015). Поскольку отбор проб с использованием технологии PSB зависит от эндоскопии, этот метод имеет те же недостатки, что и биопсия, такие как влияние подготовки кишечника, неизбежная контаминация и инвазия.
, 2014). Хотя сообщалось, что альфа-разнообразие образцов, собранных с помощью BABD и метода PSB, сходно на уровне типа, метод PSB дает образцы с более высокой долей бактериальной гДНК (Shanahan et al., 2016). Однако другое исследование показало, что существуют пространственные различия между микробиотой просвета и слизистой оболочки (Lavelle et al., 2015). Поскольку отбор проб с использованием технологии PSB зависит от эндоскопии, этот метод имеет те же недостатки, что и биопсия, такие как влияние подготовки кишечника, неизбежная контаминация и инвазия.
Микродиссекция с лазерным захватом
Микродиссекция с лазерным захватом (LCM) была разработана для преодоления недостатков методов микродиссекции тканей. LCM избирательно прикрепляет интересующие материалы к тонкой прозрачной пленке над срезом ткани с помощью импульса инфракрасного лазера (Emmert-Buck et al., 1996). Затем тонкую пленку с полученной тканью снимают со среза и обрабатывают непосредственно ДНК, РНК или ферментным буфером. Таким образом, эта способность избирательно переносить небольшие фокальные области ткани или кластеров клеток на пленку может быть использована для получения слоев слизистого геля на поверхности образцов кишечной биопсии. Прежде чем можно будет проанализировать образцы LCM, замороженные образцы биопсии необходимо разрезать на 10-микронные срезы, а затем поместить на предметные стекла с мембранами, не содержащими нуклеаз и нуклеиновых кислот, и высушить на воздухе в течение ночи.Чтобы с высокой точностью зафиксировать межстворчатые микробы толстой кишки мыши, Nava et al. использовали LCM, чтобы обнаружить, что микробы в межскладчатой области значительно отличаются от микробов в центральном люминальном компартменте (Nava et al., 2011). Хотя максимальный размер области между складками составляет ~ 100 мкм, высокое разрешение LCM ~ 5 мкм позволяет легко и точно проводить отбор проб. Различия между просветным и слизистым интервалами были очевидны при использовании LCM для захвата образцов слоя слизистого геля из быстрозамороженных образцов биопсии (Lavelle et al.
Таким образом, эта способность избирательно переносить небольшие фокальные области ткани или кластеров клеток на пленку может быть использована для получения слоев слизистого геля на поверхности образцов кишечной биопсии. Прежде чем можно будет проанализировать образцы LCM, замороженные образцы биопсии необходимо разрезать на 10-микронные срезы, а затем поместить на предметные стекла с мембранами, не содержащими нуклеаз и нуклеиновых кислот, и высушить на воздухе в течение ночи.Чтобы с высокой точностью зафиксировать межстворчатые микробы толстой кишки мыши, Nava et al. использовали LCM, чтобы обнаружить, что микробы в межскладчатой области значительно отличаются от микробов в центральном люминальном компартменте (Nava et al., 2011). Хотя максимальный размер области между складками составляет ~ 100 мкм, высокое разрешение LCM ~ 5 мкм позволяет легко и точно проводить отбор проб. Различия между просветным и слизистым интервалами были очевидны при использовании LCM для захвата образцов слоя слизистого геля из быстрозамороженных образцов биопсии (Lavelle et al. , 2015). Выявляемая бактериальная нагрузка у пациентов с ЯК, измеренная с помощью целевой LCM и количественной ПЦР, была ниже, чем в контрольной группе (Rowan et al., 2010). Таким образом, LCM обеспечивает простой, точный и эффективный метод получения бактерий в области слизистой оболочки для анализа взаимодействия микробиоты, связанной со слизистой оболочкой. LCM может подходить для прецизионной медицины, но утомительная процедура ограничивает ее использование в крупномасштабных исследованиях. То, что ограничивает точность LCM, может заключаться в том, что источником образца является биопсия, которая имеет свои недостатки, в основном деградацию нуклеиновых кислот, например.g., РНК и недостаточное количество образца.
, 2015). Выявляемая бактериальная нагрузка у пациентов с ЯК, измеренная с помощью целевой LCM и количественной ПЦР, была ниже, чем в контрольной группе (Rowan et al., 2010). Таким образом, LCM обеспечивает простой, точный и эффективный метод получения бактерий в области слизистой оболочки для анализа взаимодействия микробиоты, связанной со слизистой оболочкой. LCM может подходить для прецизионной медицины, но утомительная процедура ограничивает ее использование в крупномасштабных исследованиях. То, что ограничивает точность LCM, может заключаться в том, что источником образца является биопсия, которая имеет свои недостатки, в основном деградацию нуклеиновых кислот, например.g., РНК и недостаточное количество образца.
Образцы аспирированной кишечной жидкости
Для аспирации незагрязненной кишечной жидкости Шайнер изобрел капсулу из нержавеющей стали с колпачком на дистальном конце и полым соединением на проксимальном конце (Шайнер, 1963). Проксимальный конец капсулы через трубку соединен с источником отрицательного давления. При достижении места отбора проб всасывание отрицательного давления приводит к открытию канала отбора проб капсулы, и окружающая жидкость попадает в камеру капсулы.После аспирации капсулу снова закрывают, а собранные пробы изолируют от внешней жидкости. Преимущество этого устройства заключается в предотвращении загрязнения собранных образцов содержимым желудочно-кишечного тракта в местах, где не берутся образцы. Из-за сложной структуры этот метод не получил широкого распространения. После этого прогресс в получении желудочно-кишечной жидкости заключался в разработке специально изготовленной двухпросветной трубки с несколькими аспирационными портами в разных местах и наполненным ртутью мешком на ее дистальном конце (Kalser et al., 1966). Субъекты проглатывали трубку, а затем аспираты отсасывались стерильным шприцем, когда порты располагались в правильном положении (75 см дистальнее связки Трейтца для тощекишечных аспиратов и 75 см проксимальнее илеоцекального клапана для подвздошных аспиратов).
При достижении места отбора проб всасывание отрицательного давления приводит к открытию канала отбора проб капсулы, и окружающая жидкость попадает в камеру капсулы.После аспирации капсулу снова закрывают, а собранные пробы изолируют от внешней жидкости. Преимущество этого устройства заключается в предотвращении загрязнения собранных образцов содержимым желудочно-кишечного тракта в местах, где не берутся образцы. Из-за сложной структуры этот метод не получил широкого распространения. После этого прогресс в получении желудочно-кишечной жидкости заключался в разработке специально изготовленной двухпросветной трубки с несколькими аспирационными портами в разных местах и наполненным ртутью мешком на ее дистальном конце (Kalser et al., 1966). Субъекты проглатывали трубку, а затем аспираты отсасывались стерильным шприцем, когда порты располагались в правильном положении (75 см дистальнее связки Трейтца для тощекишечных аспиратов и 75 см проксимальнее илеоцекального клапана для подвздошных аспиратов).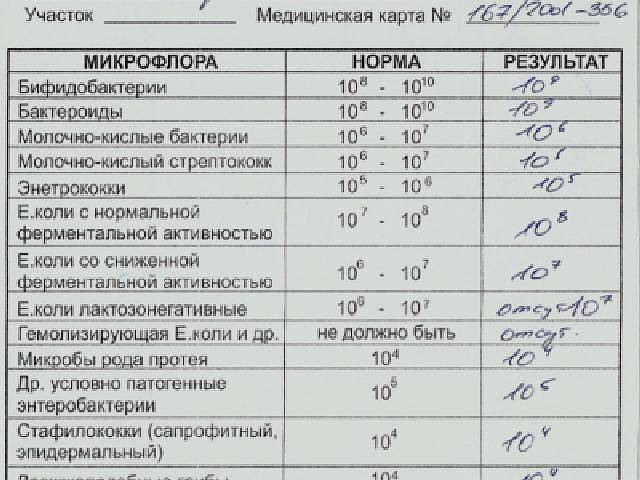 Белов и др. аспирация кишечной жидкости через назоеюнальные зонды, обычно вставленные для энтерального питания (Belov et al., 1999). Однако вязкая кишечная жидкость и закупорка трубок сделали процедуру сбора сложной и трудоемкой.
Белов и др. аспирация кишечной жидкости через назоеюнальные зонды, обычно вставленные для энтерального питания (Belov et al., 1999). Однако вязкая кишечная жидкость и закупорка трубок сделали процедуру сбора сложной и трудоемкой.
В настоящее время для получения кишечной жидкости чаще всего используется эндоскопическая аспирация. Аспирация и посев тонкокишечной жидкости обычно считаются золотым стандартом диагностики избыточного бактериального роста тонкого кишечника, который определяется как ≥ 10 5 колониеобразующих единиц на миллилитр (КОЕ/мл) при посеве аспирированной жидкости. жидкости (Khoshini et al., 2008; Grace et al., 2013; Erdogan et al., 2015). Недавнее исследование, основанное на культуре дуоденального аспирата, показало, что СИБР связан с чрезмерным ростом анаэробов и что микробный состав тонкой кишки у пациентов с симптомами значительно изменился, что не согласуется с результатами аспирационной культуры (Saffouri et al., 2019).
Эндоскопический рабочий канал легко загрязняется содержимым полости рта и желудочно-кишечного тракта. Для покрытия дистального конца катетера использовали резину, чтобы предотвратить инфильтрацию кишечной жидкости (Uno et al., 1998). Вдохновленные предыдущими исследованиями, Quintanilha et al. использовали мембрану из микропленки для защиты дистального кончика во избежание внутреннего загрязнения (Quintanilha et al., 2007). Поскольку эндоскопическая биопсия агрессивна для здоровых людей, альтернативным вариантом стало отсасывание кишечной жидкости.Тем не менее отсасывание кишечной жидкости иногда требует много времени, что увеличивает время эндоскопии, а иногда и безуспешно из-за скудного количества кишечной жидкости (Riordan et al., 1995). Хотя в предыдущих исследованиях были предприняты большие усилия для минимизации сопутствующей контаминации во время аспирации кишечной жидкости, врожденные дефекты при эндоскопическом отборе проб неизбежны, как упоминалось выше. Кроме того, неопределенность мест отбора проб также создает проблемы для получения надежных проб.
Для покрытия дистального конца катетера использовали резину, чтобы предотвратить инфильтрацию кишечной жидкости (Uno et al., 1998). Вдохновленные предыдущими исследованиями, Quintanilha et al. использовали мембрану из микропленки для защиты дистального кончика во избежание внутреннего загрязнения (Quintanilha et al., 2007). Поскольку эндоскопическая биопсия агрессивна для здоровых людей, альтернативным вариантом стало отсасывание кишечной жидкости.Тем не менее отсасывание кишечной жидкости иногда требует много времени, что увеличивает время эндоскопии, а иногда и безуспешно из-за скудного количества кишечной жидкости (Riordan et al., 1995). Хотя в предыдущих исследованиях были предприняты большие усилия для минимизации сопутствующей контаминации во время аспирации кишечной жидкости, врожденные дефекты при эндоскопическом отборе проб неизбежны, как упоминалось выше. Кроме того, неопределенность мест отбора проб также создает проблемы для получения надежных проб.
Образцы из хирургии
Когда трудно достичь дистального отдела подвздошной кишки при эндоскопии, хирургическое вмешательство дает нам возможность взять образец дистального отдела подвздошной кишки. Методы получения кишечной флоры при операции включают прямую аспирацию иглой или биопсию образцов слизистой оболочки (Bentley et al., 1972; Corrodi et al., 1978; Thadepalli et al., 1979; Lavelle et al., 2015). Поскольку хирургические образцы не подвержены загрязнению, теоретически образцы, полученные этим методом, лучше всего представляют микробиоту кишечника. Однако реальность такова, что перед операцией необходимо провести несколько подготовительных мероприятий. Эти препараты могут включать голодание, механическое очищение кишечника и введение антибиотиков, которые могут нарушить микробиоту (Antonopoulos et al., 2009; Убеда и Памер, 2012 г.; Феррер и др., 2014; Зарринпар и др., 2014; Джаланка и др., 2015). В этом контексте Thadepalli et al. для исследования микробиоты тонкой кишки у пациентов с травмой живота, нуждающихся в экстренной лапаротомии, был взят дуоденальный, тощекишечный и подвздошный жидкости путем пункционной аспирации. Ни одному из пациентов не проводилась рутинная предоперационная подготовка; следовательно, эти образцы, полученные без вмешательства предоперационной подготовки, находились в идеальном состоянии.
Методы получения кишечной флоры при операции включают прямую аспирацию иглой или биопсию образцов слизистой оболочки (Bentley et al., 1972; Corrodi et al., 1978; Thadepalli et al., 1979; Lavelle et al., 2015). Поскольку хирургические образцы не подвержены загрязнению, теоретически образцы, полученные этим методом, лучше всего представляют микробиоту кишечника. Однако реальность такова, что перед операцией необходимо провести несколько подготовительных мероприятий. Эти препараты могут включать голодание, механическое очищение кишечника и введение антибиотиков, которые могут нарушить микробиоту (Antonopoulos et al., 2009; Убеда и Памер, 2012 г.; Феррер и др., 2014; Зарринпар и др., 2014; Джаланка и др., 2015). В этом контексте Thadepalli et al. для исследования микробиоты тонкой кишки у пациентов с травмой живота, нуждающихся в экстренной лапаротомии, был взят дуоденальный, тощекишечный и подвздошный жидкости путем пункционной аспирации. Ни одному из пациентов не проводилась рутинная предоперационная подготовка; следовательно, эти образцы, полученные без вмешательства предоперационной подготовки, находились в идеальном состоянии. Кроме того, забор образцов во время операции также может обойти проблему недоступности тонкого кишечника с помощью систем моделей in vivo (Booijink et al., 2007). Пациентов, перенесших илеостому, можно использовать в качестве модели in vivo и получать илеостомический илеостомический сток для получения микробиоты кишечника (Go et al., 1988; Ala Aldeen and Barer, 1989). Зотендаль и др. продемонстрировали, что общие микробные компоненты в образцах, выделяемых илеостомистами (лицами без толстой кишки), также могут быть обнаружены в тонкой кишке здоровых людей с помощью анализа филогенетических микрочипов (Zoetendal et al., 2012). По сравнению с микробиотой толстой кишки микробиота в выделениях из подвздошной кишки относительно нестабильна и менее сложна и состоит из различных доминирующих филотипов (Booijink et al., 2010). Кроме того, модели in vivo также можно использовать для изучения влияния диеты на кишечную флору. Йонссон и др. исследовали влияние потребления большого количества клетчатки на сегментированные нитчатые бактерии, собирая образцы илеостомы человека (Jonsson, 2013).
Кроме того, забор образцов во время операции также может обойти проблему недоступности тонкого кишечника с помощью систем моделей in vivo (Booijink et al., 2007). Пациентов, перенесших илеостому, можно использовать в качестве модели in vivo и получать илеостомический илеостомический сток для получения микробиоты кишечника (Go et al., 1988; Ala Aldeen and Barer, 1989). Зотендаль и др. продемонстрировали, что общие микробные компоненты в образцах, выделяемых илеостомистами (лицами без толстой кишки), также могут быть обнаружены в тонкой кишке здоровых людей с помощью анализа филогенетических микрочипов (Zoetendal et al., 2012). По сравнению с микробиотой толстой кишки микробиота в выделениях из подвздошной кишки относительно нестабильна и менее сложна и состоит из различных доминирующих филотипов (Booijink et al., 2010). Кроме того, модели in vivo также можно использовать для изучения влияния диеты на кишечную флору. Йонссон и др. исследовали влияние потребления большого количества клетчатки на сегментированные нитчатые бактерии, собирая образцы илеостомы человека (Jonsson, 2013). В дополнение к вышеуказанным методам Haysahi et al. получили образцы кишечного содержимого при аутопсии и продемонстрировали градиентное распределение числа OTU от проксимального к дистальному концу кишечника (Hayashi et al., 2005). Хотя модель in vivo обеспечивает удобство отбора проб в любое время, сама операция приводит к значительным изменениям в составе микробиоты кишечника, которые сохраняются в течение длительного времени (Guyton and Alverdy, 2017). Илеостомия изменяет анатомическую структуру кишечника, что может оказать необратимое влияние на состав кишечной микробиоты. Поэтому неясно, подходят ли результаты исследований на основе илеостомы для людей с нормальным анатомическим строением.Поскольку хирургическое вмешательство является инвазивным, получение образца от здорового контроля кажется невозможным. Для операции и вскрытия хирургическое применение явно ограничено. Хирургия не способствует всестороннему анализу связи между бактериальной флорой и заболеваниями в различных популяциях.
В дополнение к вышеуказанным методам Haysahi et al. получили образцы кишечного содержимого при аутопсии и продемонстрировали градиентное распределение числа OTU от проксимального к дистальному концу кишечника (Hayashi et al., 2005). Хотя модель in vivo обеспечивает удобство отбора проб в любое время, сама операция приводит к значительным изменениям в составе микробиоты кишечника, которые сохраняются в течение длительного времени (Guyton and Alverdy, 2017). Илеостомия изменяет анатомическую структуру кишечника, что может оказать необратимое влияние на состав кишечной микробиоты. Поэтому неясно, подходят ли результаты исследований на основе илеостомы для людей с нормальным анатомическим строением.Поскольку хирургическое вмешательство является инвазивным, получение образца от здорового контроля кажется невозможным. Для операции и вскрытия хирургическое применение явно ограничено. Хирургия не способствует всестороннему анализу связи между бактериальной флорой и заболеваниями в различных популяциях.
Устройства для отбора проб
Недостатки вышеуказанных методов кажутся непреодолимыми, и исследователи прилагают усилия для разработки новых устройств для отбора проб. На сегодняшний день для наблюдения за кишечником и доставки лекарств используется множество проглатываемых устройств.Из-за неинвазивных характеристик проглатываемых устройств их все чаще рассматривают для сбора кишечного содержимого. Основываясь на технологии микроэлектромеханических систем (MEMS), Cui et al. изобрели проглатываемую капсулу, которая может доставлять лекарства и собирать кишечную жидкость (Cui et al., 2008). Особенности расположения в желудочно-кишечном тракте, беспроводная связь и большой размер образца позволяют капсуле автоматически собирать кишечную жидкость. Однако ограничением этого устройства является то, что собранный образец легко загрязняется жидкостью, находящейся ниже по потоку.В последние годы NIZO разработала интеллектуальную капсулу для отбора проб микробиома из тонкого кишечника, объединив систему IntelliCap ® и гаситель.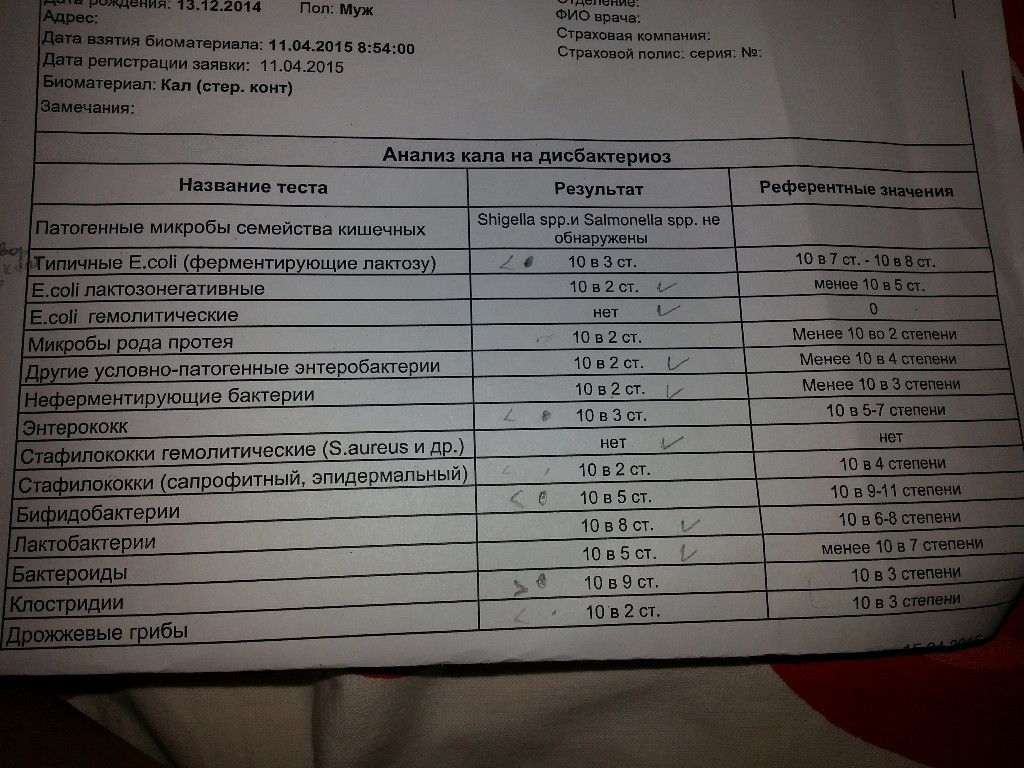 Система IntelliCap ® представляет собой проглатываемую капсулу, которая содержит датчики pH и температуры, блоки связи, микрокомпьютеры, моторы и батареи. Гаситель представляет собой контейнер, помещенный в капсулу для качественного и количественного сохранения микробиоты. Капсулы можно позиционировать, измеряя значительные изменения pH в желудочно-кишечном тракте (Koziolek et al., 2015). Когда проглоченная капсула достигает назначенного отдела тонкой кишки, можно начинать аспирацию кишечной жидкости. Аспирированную кишечную жидкость можно собрать после того, как капсула будет выведена из организма. Недавно Rezaei Nejad et al. также сообщили о напечатанной на 3D-принтере таблетке для аспирации жидкости тонкого кишечника (Rezaei Nejad et al., 2019). Эта таблетка содержит полупроницаемую мембрану для разделения спиральных каналов и солевой камеры. Более высокое осмотическое давление со стороны соляной камеры заставляет жидкость в спиральных каналах течь в камеру через полупроницаемую мембрану.
Система IntelliCap ® представляет собой проглатываемую капсулу, которая содержит датчики pH и температуры, блоки связи, микрокомпьютеры, моторы и батареи. Гаситель представляет собой контейнер, помещенный в капсулу для качественного и количественного сохранения микробиоты. Капсулы можно позиционировать, измеряя значительные изменения pH в желудочно-кишечном тракте (Koziolek et al., 2015). Когда проглоченная капсула достигает назначенного отдела тонкой кишки, можно начинать аспирацию кишечной жидкости. Аспирированную кишечную жидкость можно собрать после того, как капсула будет выведена из организма. Недавно Rezaei Nejad et al. также сообщили о напечатанной на 3D-принтере таблетке для аспирации жидкости тонкого кишечника (Rezaei Nejad et al., 2019). Эта таблетка содержит полупроницаемую мембрану для разделения спиральных каналов и солевой камеры. Более высокое осмотическое давление со стороны соляной камеры заставляет жидкость в спиральных каналах течь в камеру через полупроницаемую мембрану. Затем кишечную жидкость можно аспирировать из входных отверстий, соединенных со спиральными каналами. Внешняя кишечнорастворимая оболочка капсулы обеспечивает начало сбора в тонкой кишке. По сравнению с капсулой NIZO стоимость этой безбатарейной таблетки, безусловно, будет намного ниже. Однако проблема сохранности образцов после сбора, по-видимому, не решена, что может привести к контаминации образцов кишечной жидкостью из неотобранных участков.
Затем кишечную жидкость можно аспирировать из входных отверстий, соединенных со спиральными каналами. Внешняя кишечнорастворимая оболочка капсулы обеспечивает начало сбора в тонкой кишке. По сравнению с капсулой NIZO стоимость этой безбатарейной таблетки, безусловно, будет намного ниже. Однако проблема сохранности образцов после сбора, по-видимому, не решена, что может привести к контаминации образцов кишечной жидкостью из неотобранных участков.
Наша настоящая работа посвящена сбору образцов кишечной жидкости малоинвазивными методами.Мы также исследовали недорогое и удобное капсульное устройство для аспирации микробиома кишечника (IMBA), предназначенное для автономного сбора образцов кишечной жидкости. Без использования дорогостоящих технологий микроэлектромеханической системы IMBA использует технологию контролируемого высвобождения, оснащенную новым механизмом отбора проб для достижения точного и регионарного отбора проб в кишечнике. Более того, форма капсул улучшает комплаентность пациента, а условия отбора проб, приближенные к физиологическому состоянию (отсутствие необходимости подготовки кишечника), обеспечивают более высокую точность. Ключ этой технологии заключается в том, как точно определить местонахождение и собрать кишечную жидкость.
Ключ этой технологии заключается в том, как точно определить местонахождение и собрать кишечную жидкость.
Инструменты для биологии
В дополнение к составу и разнообразию кишечной микробиоты их пространственная организация также отражает отношения между хозяином и микробиотой. Чтобы получить полную структуру кишечника и его содержимого, Johansson et al. усовершенствовали гистологические препараты, которые успешно сохраняли кишечную слизь и локализовали бактерии с помощью флуоресценции in situ гибридизации (FISH) (Johansson and Hansson, 2012).Используя технологию FISH, местоположение интересующих бактерий, помеченных флуоресцентным ДНК-зондом, можно наблюдать под флуоресцентным микроскопом. Однако из-за трудностей отбора проб, этических проблем и огромных индивидуальных различий в микробном составе исследования и манипуляции с микробными сообществами кишечника человека in situ ограничены. В качестве альтернативы широко используется трансплантация кишечной микробиоты человека стерильным мышам (Goodman et al.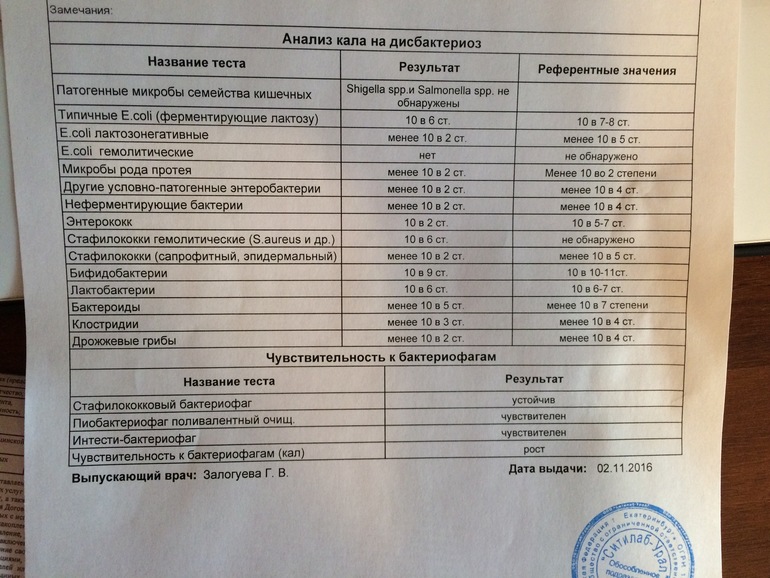 , 2011; McNulty et al., 2013). Чтобы изучить пространственную организацию микробиоты кишечника человека, Earle et al. разработали новый подход, который визуализирует бактерии у гнотобиотических мышей, колонизированных микробиотой человека, с помощью FISH (Earle et al., 2015). Они инокулировали флуоресцентный зонд, соответствующий интересующим бактериям, в фиксированные поперечные срезы кишечника мыши. Однако одно поле зрения на срезе не может представлять весь кишечник. Чтобы решить эту проблему, было разработано программное обеспечение Bacspace, позволяющее сшивать перекрывающиеся изображения нескольких полей зрения в непрерывное изображение, которое представляет весь кишечник, отличать эпителиальные клетки хозяина от бактерий и измерять расстояние между бактериальными клетками и между бактериальными клетками и эпителием.Используя Bacspace, они выявили гомологичную кластеризацию внутри Bacteroidales или Firmicutes , где кластеры Bacteroidales исключают Firmicutes , и наоборот.
, 2011; McNulty et al., 2013). Чтобы изучить пространственную организацию микробиоты кишечника человека, Earle et al. разработали новый подход, который визуализирует бактерии у гнотобиотических мышей, колонизированных микробиотой человека, с помощью FISH (Earle et al., 2015). Они инокулировали флуоресцентный зонд, соответствующий интересующим бактериям, в фиксированные поперечные срезы кишечника мыши. Однако одно поле зрения на срезе не может представлять весь кишечник. Чтобы решить эту проблему, было разработано программное обеспечение Bacspace, позволяющее сшивать перекрывающиеся изображения нескольких полей зрения в непрерывное изображение, которое представляет весь кишечник, отличать эпителиальные клетки хозяина от бактерий и измерять расстояние между бактериальными клетками и между бактериальными клетками и эпителием.Используя Bacspace, они выявили гомологичную кластеризацию внутри Bacteroidales или Firmicutes , где кластеры Bacteroidales исключают Firmicutes , и наоборот. Более того, применение FISH в сочетании с методами спектрального анализа изображений выявило пространственную организацию гнотобиотических мышей, колонизированных 15-членной микробиотой кишечника человека (Welch et al., 2017). В толстой кишке есть две плотно колонизированные области: одна прилегает к слизистой оболочке, а другая граничит с частицами пищи в просвете.Небольшие различия в составе микробиоты в этих двух областях позволяют предположить, что просвет и слизистую оболочку не следует определять как стратифицированные компартменты. Из-за различий в плотности микробов между тонкой и толстой кишкой на порядки число микробов в поперечном сечении тонкой кишки в 10—1 млн раз меньше, чем в толстой кишке. То есть, по сравнению с 1000 бактерий на поле зрения в толстой кишке, в тонкой кишке почти нет бактерий.Из-за более высокой микробной плотности гистологический метод больше подходит для толстой кишки. Неправильная подготовка образца также может привести к потере кишечного содержимого в срезах.
Более того, применение FISH в сочетании с методами спектрального анализа изображений выявило пространственную организацию гнотобиотических мышей, колонизированных 15-членной микробиотой кишечника человека (Welch et al., 2017). В толстой кишке есть две плотно колонизированные области: одна прилегает к слизистой оболочке, а другая граничит с частицами пищи в просвете.Небольшие различия в составе микробиоты в этих двух областях позволяют предположить, что просвет и слизистую оболочку не следует определять как стратифицированные компартменты. Из-за различий в плотности микробов между тонкой и толстой кишкой на порядки число микробов в поперечном сечении тонкой кишки в 10—1 млн раз меньше, чем в толстой кишке. То есть, по сравнению с 1000 бактерий на поле зрения в толстой кишке, в тонкой кишке почти нет бактерий.Из-за более высокой микробной плотности гистологический метод больше подходит для толстой кишки. Неправильная подготовка образца также может привести к потере кишечного содержимого в срезах. По сравнению с другими методами метод встраивания Technovit h8100 может успешно сохранять трехмерную структуру кишечника и совместим с FISH и другими методами мечения для визуализации микробных клеток в кишечнике мышей вместе со слизью и фекальными гранулами (Hasegawa et al. ., 2017). Эти методы визуализации могут одновременно обнаруживать некоторые культивируемые микробы с помощью флуоресцентных зондов, которые требуют предварительной разработки, но они не могут работать со сложными и разнообразными микробиомами. Для беспристрастного анализа сложной микробной биогеографии кишечника с высоким таксономическим разрешением Ravi et al. разработали выборку метагеномного участка путем секвенирования, которое может анализировать пространственное расположение различных микробов без предварительной спецификации (Sheth et al., 2019). Они обнаружили, что сильная связь между Bacteroides во всех полостях кишечника и локальными областями филогенеза и агрегации бактерий была связана с диетическими нарушениями.
По сравнению с другими методами метод встраивания Technovit h8100 может успешно сохранять трехмерную структуру кишечника и совместим с FISH и другими методами мечения для визуализации микробных клеток в кишечнике мышей вместе со слизью и фекальными гранулами (Hasegawa et al. ., 2017). Эти методы визуализации могут одновременно обнаруживать некоторые культивируемые микробы с помощью флуоресцентных зондов, которые требуют предварительной разработки, но они не могут работать со сложными и разнообразными микробиомами. Для беспристрастного анализа сложной микробной биогеографии кишечника с высоким таксономическим разрешением Ravi et al. разработали выборку метагеномного участка путем секвенирования, которое может анализировать пространственное расположение различных микробов без предварительной спецификации (Sheth et al., 2019). Они обнаружили, что сильная связь между Bacteroides во всех полостях кишечника и локальными областями филогенеза и агрегации бактерий была связана с диетическими нарушениями.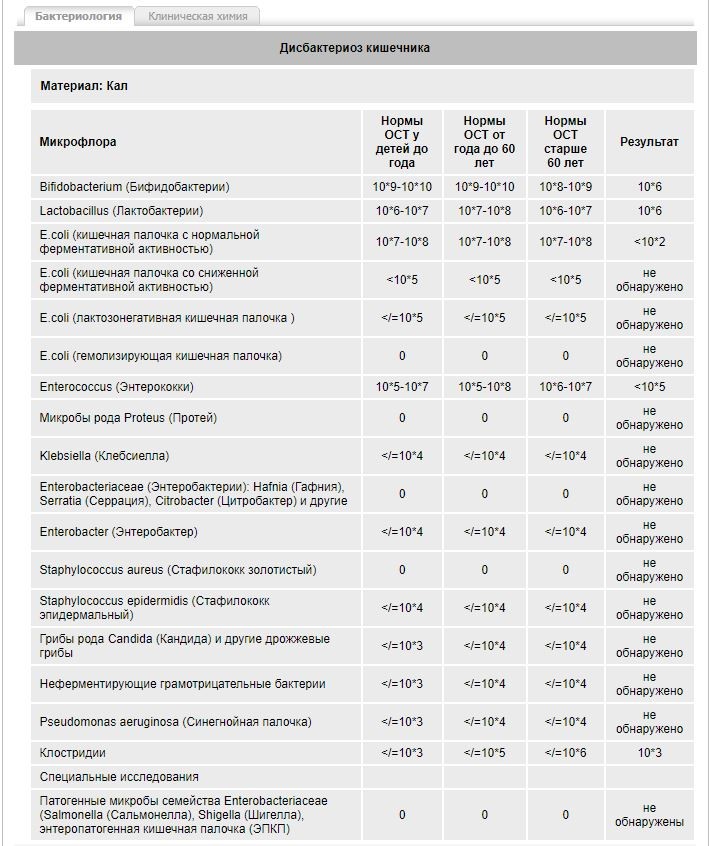 Хотя определение микробиоты кишечника человека у стерильных мышей дает нам решение проблемы отбора образцов в кишечнике человека, нельзя игнорировать влияние различий в генетическом фоне на состав микробиоты (Wos-Oxley et al. ., 2012). В то же время на формирование кишечной микрофлоры человека у безмикробных мышей также повлияет операция бактериальной трансплантации. Есть несколько моментов, на которые следует обратить внимание при пероральном зондировании.Из-за присутствия анаэробных бактерий в флоре человека их необходимо быстро вводить в пищеварительный тракт. Больший объем введения будет способствовать распространению и колонизации кишечного микробного сообщества мышей и защищать микробиоту от кишечных ферментов и изменений pH, а некоторые диеты для грызунов могут также способствовать или подавлять рост некоторых бактерий (Rodriguez-Palacios et al., 2019) По сравнению с контрольной группой, стерильные мыши имеют значительно более длительное время прохождения через кишечник, а также более низкие уровни SCFAs, которые продуцируются в результате ферментации неперевариваемых углеводов комменсальными бактериями и могут способствовать дефекации (Vincent et al.
Хотя определение микробиоты кишечника человека у стерильных мышей дает нам решение проблемы отбора образцов в кишечнике человека, нельзя игнорировать влияние различий в генетическом фоне на состав микробиоты (Wos-Oxley et al. ., 2012). В то же время на формирование кишечной микрофлоры человека у безмикробных мышей также повлияет операция бактериальной трансплантации. Есть несколько моментов, на которые следует обратить внимание при пероральном зондировании.Из-за присутствия анаэробных бактерий в флоре человека их необходимо быстро вводить в пищеварительный тракт. Больший объем введения будет способствовать распространению и колонизации кишечного микробного сообщества мышей и защищать микробиоту от кишечных ферментов и изменений pH, а некоторые диеты для грызунов могут также способствовать или подавлять рост некоторых бактерий (Rodriguez-Palacios et al., 2019) По сравнению с контрольной группой, стерильные мыши имеют значительно более длительное время прохождения через кишечник, а также более низкие уровни SCFAs, которые продуцируются в результате ферментации неперевариваемых углеводов комменсальными бактериями и могут способствовать дефекации (Vincent et al.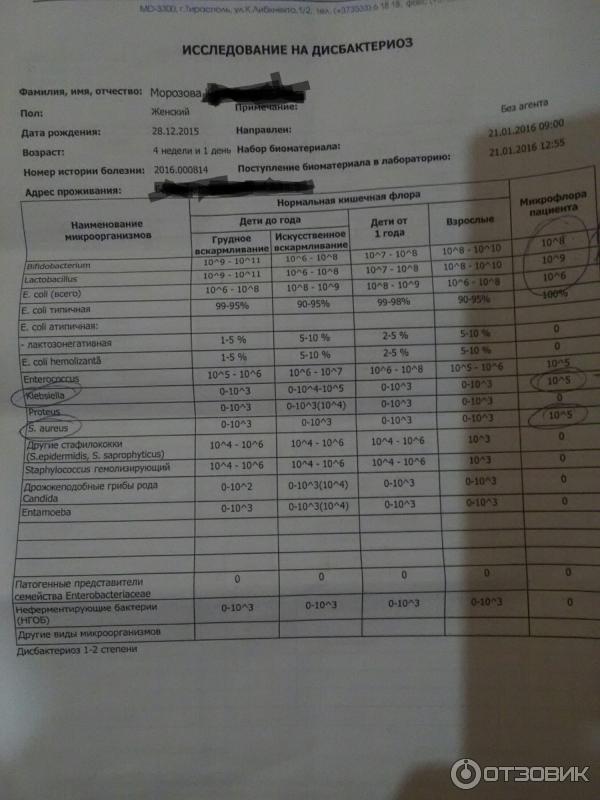 , 2018). Колонизация различных штаммов у стерильных мышей может повлиять на перистальтику кишечника, влияя на уровень SCFAs, что приводит к различному количеству фекальных гранул в толстой кишке. Следовательно, взаимосвязь между бактериями и фекальными шариками в отделе толстой кишки может быть несколько иной.
, 2018). Колонизация различных штаммов у стерильных мышей может повлиять на перистальтику кишечника, влияя на уровень SCFAs, что приводит к различному количеству фекальных гранул в толстой кишке. Следовательно, взаимосвязь между бактериями и фекальными шариками в отделе толстой кишки может быть несколько иной.
Перспектива
Несмотря на значительные усилия исследователей по получению точных образцов, недостатки существующих методов отбора проб неизбежно останутся непреодолимыми. Будет трудно получить точные результаты из неточных образцов.Фекалии стали источником образцов для большинства исследований бактериальной флоры из-за их удобства и неинвазивного характера, но даже содержание микробиоты в нижних отделах пищеварительного тракта, наиболее близком к фекалиям, значительно отличается от такового в фекалиях (Zmora et al. , 2018). Большинство остальных методов взятия проб являются инвазивными и не подходят для здоровых людей. Вопросы, которые необходимо решить в будущих методах отбора проб, должны включать снижение инвазивности, отсутствие перекрестного загрязнения при отборе проб в фиксированных точках и минимизацию нарушения нормальной физиологии кишечника.
Точность образцов оказывает заметное влияние на ценность исследований микробиоты кишечника; поэтому для обеспечения надежности исследований необходимы более точные методы выборки. Конструкция будущих оптимальных устройств для сбора кишечной микробиоты должна соответствовать следующим требованиям. Во-первых, устройства могут эффективно собирать кишечное содержимое в фиксированной точке и предотвращать перекрестное загрязнение образцов. Во-вторых, размеры устройств должны быть небольшими, чтобы обеспечить беспрепятственный проход через привратник и илеоцекальный клапан.Тогда прибор прост по конструкции и удобен в эксплуатации, а процесс отбора проб вызывает меньше психологического напряжения и дискомфорта. Материал, используемый в производственном оборудовании, должен быть нетоксичным, безвредным, нетератогенным и неканцерогенным. Кроме того, стоимость устройств также является ключевым фактором для крупных когортных исследований. Наконец, учитывая, что подготовка кишечника оказывает большее влияние на состав кишечной микробиоты, новые технологии лучше всего устраняют эту процедуру. Ввиду недостатков существующих методов отбора проб разработка более точных методов отбора проб имеет решающее значение для будущих исследований микробиоты кишечника.Для удовлетворения этих требований разработка проглатываемых устройств представляется наиболее реальным методом. В будущем небольшие автономные проглатываемые устройства для взятия проб позволят исследователям и клиницистам изучать кишечную флору со специфичностью, локализацией и чувствительностью. С другой стороны, пространственная структура кишечной флоры также является важным компонентом изучения взаимодействия между флорой и хозяином. По этическим причинам кажется нецелесообразным собирать образцы, содержащие информацию о позиционных отношениях между микробами и кишечником.В качестве альтернативы, создание микробиоты кишечника человека у мышей-гнотобиотиков также дает нам решение трудностей отбора проб. Хотя флуоресцентная визуализация не может изучать сложные микробиомы, применение беспристрастной пространственной макрогеномики у мышей-гнотобиотиков значительно улучшит наше понимание пространственной организации кишечной микробиоты.
Ввиду недостатков существующих методов отбора проб разработка более точных методов отбора проб имеет решающее значение для будущих исследований микробиоты кишечника.Для удовлетворения этих требований разработка проглатываемых устройств представляется наиболее реальным методом. В будущем небольшие автономные проглатываемые устройства для взятия проб позволят исследователям и клиницистам изучать кишечную флору со специфичностью, локализацией и чувствительностью. С другой стороны, пространственная структура кишечной флоры также является важным компонентом изучения взаимодействия между флорой и хозяином. По этическим причинам кажется нецелесообразным собирать образцы, содержащие информацию о позиционных отношениях между микробами и кишечником.В качестве альтернативы, создание микробиоты кишечника человека у мышей-гнотобиотиков также дает нам решение трудностей отбора проб. Хотя флуоресцентная визуализация не может изучать сложные микробиомы, применение беспристрастной пространственной макрогеномики у мышей-гнотобиотиков значительно улучшит наше понимание пространственной организации кишечной микробиоты.
Вклад авторов
QT, GJ, GW, BW и HC разработали исследование. QT, GJ, GW, TL и XL собрали и проанализировали соответствующую информацию.QT, GJ, GW и HC написали статью. Все авторы принимали участие в окончательном утверждении статьи.
Финансирование
Это исследование было поддержано грантами (81570478, 81741075) Национального фонда естественных наук Китая и грантом (17JCYBJC24900) Фонда естественных наук Тяньцзиня, а также грантом (2019M651049) Китайского фонда постдокторских наук.
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Каталожные номера
Алмейда, А., Митчелл, А.Л., Боланд, М., Форстер, С.К., Глор, Г.Б., Тарковска, А., и соавт. (2019). Новый геномный план микробиоты кишечника человека. Природа 568, 499–504. doi: 10.1038/s41586-019-0965-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Антонопулос, Д. А., Хьюз, С. М., Моррисон, Х. Г., Шмидт, Т. М., Согин, М. Л., и Янг, В. Б. (2009). Воспроизводимая динамика сообщества желудочно-кишечной микробиоты после воздействия антибиотиков. Заразить. Иммун. 77, 2367–2375. doi: 10.1128/IAI.01520-08
А., Хьюз, С. М., Моррисон, Х. Г., Шмидт, Т. М., Согин, М. Л., и Янг, В. Б. (2009). Воспроизводимая динамика сообщества желудочно-кишечной микробиоты после воздействия антибиотиков. Заразить. Иммун. 77, 2367–2375. doi: 10.1128/IAI.01520-08
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бэкхед, Ф., Розвалл, Дж., Пэн, Ю., Фэн, К., Цзя, Х., Ковачева-Датчари, П., и др. (2015). Динамика и стабилизация микробиома кишечника человека на первом году жизни. Микроб-хозяин клетки 17, 690–703. doi: 10.1016/j.chom.2015.04.004
Полнотекстовая перекрестная ссылка | Академия Google
Белов Л., Мехер-Хомджи В., Путасвами, В., и Миллер, Р. (1999). Вестерн-блот-анализ желчи или кишечной жидкости пациентов с септическим шоком или синдромом системной воспалительной реакции с использованием антител к ФНО-альфа, ИЛ-1 альфа и ИЛ-1 бета. Иммунол. Клеточная биол. 77, 34–40. doi: 10.1046/j.1440-1711.1999.00796.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bentley, D. W., Nichols, R.L., Condon, R.E., and Gorbach, S.L. (1972). Микрофлора подвздошной и интраабдоминальной ободочной кишки человека: результаты прямой пункционной аспирации во время операции и оценка методики. Дж. Лаб. клин. Мед. 79, 421–429.
W., Nichols, R.L., Condon, R.E., and Gorbach, S.L. (1972). Микрофлора подвздошной и интраабдоминальной ободочной кишки человека: результаты прямой пункционной аспирации во время операции и оценка методики. Дж. Лаб. клин. Мед. 79, 421–429.
Реферат PubMed | Академия Google
Блантон, Л.В., Шарбонно, М.Р., Салих, Т., Барратт, М.Дж., Венкатеш, С., Илкавея, О., и др. (2016). Кишечные бактерии, которые предотвращают нарушения роста, передаваемые микробиотой от недоедающих детей. Наука 80:351. doi: 10.1126/science.aad3311
Полнотекстовая перекрестная ссылка | Академия Google
Booijink, C.C.G.M., El-Aidy, S., Rajilić-Stojanović, M., Heilig, H.G.H.J., Troost, F.J., Smidt, H., et al. (2010). В микробиоте подвздошной кишки человека обнаружены высокие временные и межиндивидуальные вариации. Окружающая среда. микробиол. 12, 3213–3227. doi: 10.1111/j.1462-2920.2010.02294.x
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Booijink, C. C.G.M., Zoetendal, E.G., Kleerebezem, M., and de Vos, WM (2007). Микробные сообщества в тонком кишечнике человека: сочетание разнообразия с метагеномикой. Будущая микробиология. 2, 285–295. дои: 10.2217/17460913.2.3.285
C.G.M., Zoetendal, E.G., Kleerebezem, M., and de Vos, WM (2007). Микробные сообщества в тонком кишечнике человека: сочетание разнообразия с метагеномикой. Будущая микробиология. 2, 285–295. дои: 10.2217/17460913.2.3.285
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Bucher, P., Gervaz, P., Egger, J.F., Soravia, C., and Morel, P. (2006). Морфологические изменения, связанные с механической подготовкой кишечника перед плановой колоректальной хирургией: рандомизированное исследование. Дис. Двоеточие. Прямая кишка. 49, 109–112. doi: 10.1007/s10350-005-0215-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кэрролл, И.М., Чанг, Ю.-Х., Парк, Дж., Сартор, Р.Б., и Рингель, Ю. (2010). Люминальная и ассоциированная со слизистой оболочками кишечная микробиота у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Патог кишечника. 2:19. дои: 10.1186/1757-4749-2-19
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Кэрролл, И.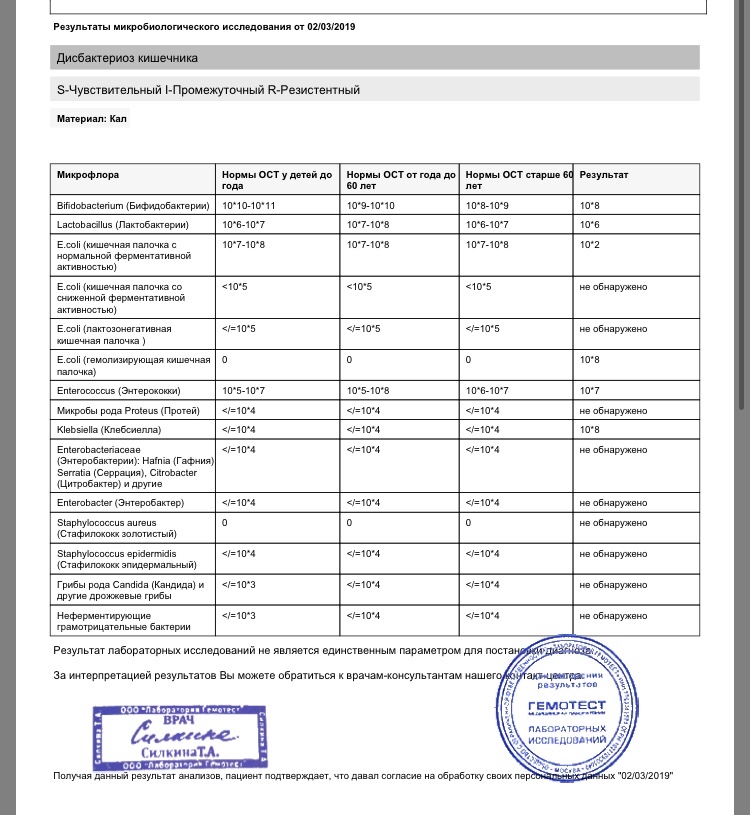 М., Рингель-Кулка, Т., Сиддл, Дж. П., Клаенхаммер, Т. Р., и Рингель, Ю. (2012). Характеристика фекальной микробиоты с использованием высокопроизводительного секвенирования выявляет стабильное микробное сообщество во время хранения. PLoS ONE 7:e46953. doi: 10.1371/journal.pone.0046953
М., Рингель-Кулка, Т., Сиддл, Дж. П., Клаенхаммер, Т. Р., и Рингель, Ю. (2012). Характеристика фекальной микробиоты с использованием высокопроизводительного секвенирования выявляет стабильное микробное сообщество во время хранения. PLoS ONE 7:e46953. doi: 10.1371/journal.pone.0046953
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Charbonneau, M.R., O’Donnell, D., Blanton, L.V., Totten, S.M., Davis, J.C.C., Barratt, M.J., et al. (2016). Сиалилированные олигосахариды молока способствуют зависимому от микробиоты росту в моделях недостаточного питания младенцев. Сотовый 164, 859–871. doi: 10.1016/j.cell.2016.01.024
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Корроди, П., Wideman, P.A., Sutter, V.L., Drenick, E.J., Passaro, E., and Finegold, S.M. (1978). Бактериальная флора тонкой кишки до и после операции шунтирования при морбидном ожирении. Дж. Заразить. Дис. 137, 1–6. doi: 10. 1093/infdis/137.1.1
1093/infdis/137.1.1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Цуй, Дж., Чжэн, X., Хоу, В., Чжуан, Ю., Пи, X., и Ян, Дж. (2008). Исследование дистанционно управляемой желудочно-кишечной системы доставки лекарств и отбора проб. Телемед.Дж. Э. Здоровье. 14, 715–719. doi: 10.1089/tmj.2007.0118
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Дункан, С. Х., Беленгер, А., Холтроп, Г., Джонстон, А. М., Флинт, Х. Дж., и Лобли, Г. Е. (2007). Уменьшение потребления углеводов людьми с ожирением приводит к снижению концентрации бутирата и бактерий, продуцирующих бутират, в фекалиях. Заяв. Окружающая среда. микробиол. 73, 1073–1078. doi: 10.1128/AEM.02340-06
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Данн, А.Б., Джордан С., Бейкер Б.Дж. и Карлсон Н.С. (2017). Материнский младенческий микробиом: соображения о родах. МКС. Являюсь. Дж. Матерн. Детская медсестра.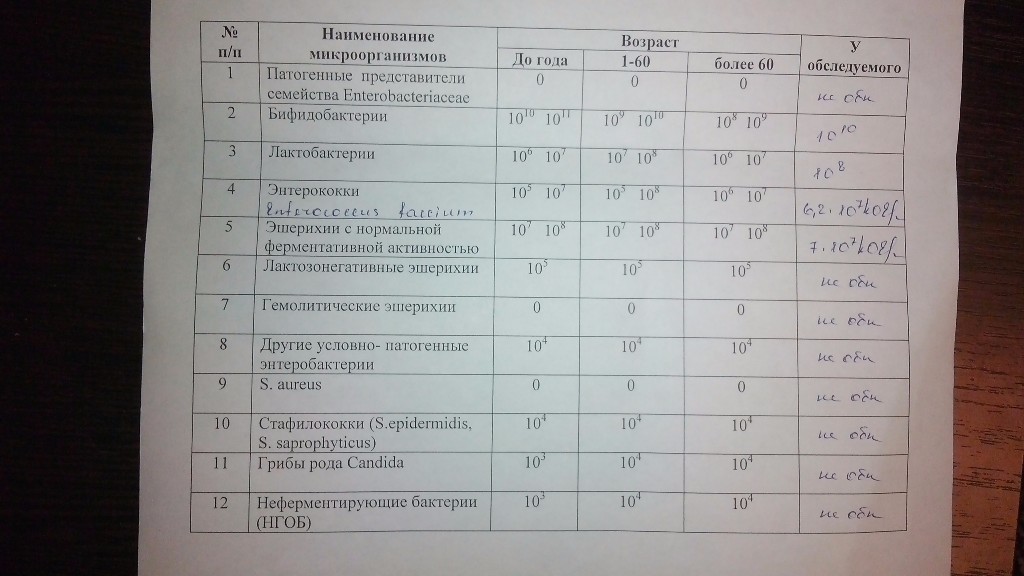 42, 318–325. doi: 10.1097/NMC.0000000000000373
42, 318–325. doi: 10.1097/NMC.0000000000000373
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Earle, K.A., Billings, G., Sigal, M., Lichtman, J.S., Hansson, G.C., Elias, J.E., et al. (2015). Количественная визуализация пространственной организации кишечной микробиоты. Микроб-хозяин клетки 18, 478–488.doi: 10.1016/j.chom.2015.09.002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эммерт-Бак М.Р., Боннер Р.Ф., Смит П.Д., Чуаки Р.Ф., Чжуан З., Гольдштейн С.Р. и соавт. (1996). Лазерный захват микродиссекции. Наука 274, 998–1001. doi: 10.1126/наука.274.5289.998
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Эрдоган, А., Рао, С.С.К., Галли, Д., Джейкобс, К., Ли, Ю.Ю., и Бэджер, К. (2015).Избыточный бактериальный рост в тонкой кишке: дуоденальная аспирация и дыхательный тест с глюкозой. Нейрогастроэнтерол. Мотиль. 27, 481–489. doi: 10. 1111/nmo.12516
1111/nmo.12516
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Феррер, М., Мартинс душ Сантуш, В.А.П., Отт, С.Дж., и Мойя, А. (2014). Нарушение микробиоты кишечника при антибактериальной терапии: мультиомный подход. Микробы кишечника 5, 64–70. doi: 10.4161/gmic.27128
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Флорес, Р., Shi, J., Yu, G., Ma, B., Ravel, J., Goedert, J.J., et al. (2015). Среда для сбора и влияние замедленного замораживания на микробный состав стула человека. Микробиом 3:33. doi: 10.1186/s40168-015-0092-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фостер, К.Р., Шлютер, Дж., Койт, К.З., и Ракофф-Наум, С. (2017). Эволюция микробиома хозяина как экосистемы на поводке. Природа 548, 43–51. doi: 10.1038/nature23292
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фуи, Ф., Deane, J. , Rea, M.C., O’Sullivan, O., Ross, R.P., O’Callaghan, G., et al. (2015). Влияние замораживания на фекальную микробиоту, определенное с помощью секвенирования MiSeq и культуральных исследований. PLoS ONE 10:e0119355. doi: 10.1371/journal.pone.0119355
, Rea, M.C., O’Sullivan, O., Ross, R.P., O’Callaghan, G., et al. (2015). Влияние замораживания на фекальную микробиоту, определенное с помощью секвенирования MiSeq и культуральных исследований. PLoS ONE 10:e0119355. doi: 10.1371/journal.pone.0119355
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Go, P.M., van Dieijen-Visser, M.P., Davies, B.I., Lens, J., and Brombacher, P.J. (1988). Микробная флора и метаболизм желчных кислот у больных с подвздошным резервуаром. Скан. Дж. Гастроэнтерол. 23, 229–36.
Реферат PubMed | Академия Google
Гудман, А.Л., Каллстрем, Г., Фейт, Дж.Дж., Рейес, А., Мур, А., Дантас, Г., и другие. (2011). Обширные коллекции личных культур микробиоты кишечника человека, охарактеризованные и обработанные на гнотобиотических мышах. Проц. Натл. акад. науч. США 108, 6252–6257. doi: 10.1073/pnas.1102938108
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Горжелак, М. А., Гилл С.К., Тасним Н., Ахмади-Ванд З., Джей М. и Гибсон Д.Л. (2015). Методы улучшения данных микробиома кишечника человека за счет снижения изменчивости за счет обработки образцов и хранения стула. PLoS ONE 10:e0134802. doi: 10.1371/journal.pone.0134802
А., Гилл С.К., Тасним Н., Ахмади-Ванд З., Джей М. и Гибсон Д.Л. (2015). Методы улучшения данных микробиома кишечника человека за счет снижения изменчивости за счет обработки образцов и хранения стула. PLoS ONE 10:e0134802. doi: 10.1371/journal.pone.0134802
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Грейс Э., Шоу К., Уилан К. и Андреев Х. Дж. Н. (2013). Обзорная статья: избыточный бактериальный рост в тонкой кишке – распространенность, клинические признаки, текущие и разрабатываемые диагностические тесты и лечение. Алимент. Фармакол. тер. 38, 674–688. doi: 10.1111/кв.12456
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хасегава, Ю., Марк Уэлч, Дж. Л., Россетти, Б. Дж., и Борис, Г. Г. (2017). Сохранение трехмерной пространственной структуры микробиома кишечника. PLoS ONE 12:e188257. doi: 10.1371/journal.pone.0188257
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хаяши Х. , Такахаши Р., Ниши Т., Сакамото, М., и Бенно, Ю. (2005). Молекулярный анализ микробиоты тощей, подвздошной, слепой и прямой кишки человека с использованием библиотек генов 16S рРНК и полиморфизма длины концевых рестрикционных фрагментов. J. Med. микробиол. 54, 1093–1101. doi: 10.1099/jmm.0.45935-0
, Такахаши Р., Ниши Т., Сакамото, М., и Бенно, Ю. (2005). Молекулярный анализ микробиоты тощей, подвздошной, слепой и прямой кишки человека с использованием библиотек генов 16S рРНК и полиморфизма длины концевых рестрикционных фрагментов. J. Med. микробиол. 54, 1093–1101. doi: 10.1099/jmm.0.45935-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Heinsen, F.-A., Knecht, H., Neulinger, S.C., Schmitz, R.A., Knecht, C., Kühbacher, T., et al. (2015). Динамические изменения кишечной микробиоты просвета и слизистой оболочки во время и после антибактериальной терапии паромомицином. Микробы кишечника 6, 243–254. дои: 10.1080/194
.2015.1062959Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Hsieh, Y.-H., Peterson, C.M., Raggio, A., Keenan, M.J., Martin, R.J., Ravussin, E., et al. (2016). Влияние различных методов обработки фекалий на оценку бактериального разнообразия в кишечнике человека. Фронт.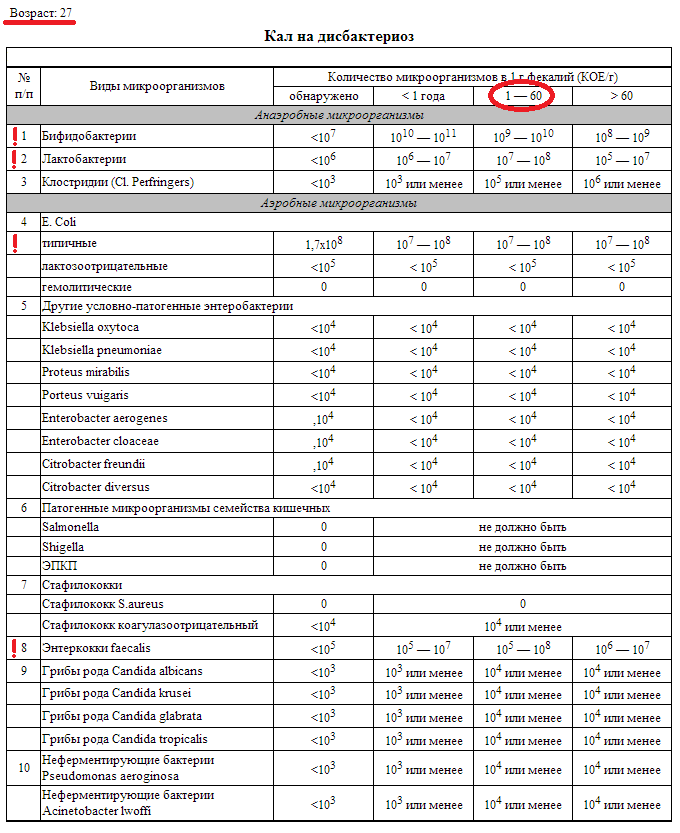 микробиол. 7:1643. doi: 10.3389/fmicb.2016.01643
микробиол. 7:1643. doi: 10.3389/fmicb.2016.01643
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хьюз, С.М., Янг В.Б., Моррисон Х.Г., Антонопулос Д.А., Квон Дж., Далал С. и соавт. (2014). Сравнение методов взятия проб щеткой и биопсии из подвздошного мешка для оценки микробиоты, связанной со слизистой оболочкой человека. Микробиом 2:5. дои: 10.1186/2049-2618-2-5
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Яланка Дж., Салонен А., Салоярви Дж., Ритари Дж., Иммонен О., Марчиани Л. и др. (2015). Влияние очищения кишечника на микробиоту кишечника. Гут 64, 1562–1568. doi: 10.1136/gutjnl-2014-307240
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Йоханссон, М.Е.В., и Ханссон, Г.К. (2012). Сохранение слизи в гистологических срезах, иммуноокрашивание муцинов в фиксированной ткани и локализация бактерий с помощью FISH. Методы Мол. биол. 842, 229–235. дои: 10.1007/978-1-61779-513-8_13
дои: 10.1007/978-1-61779-513-8_13
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Калсер, М.H., Cohen, R., Arteaga, I., Yawn, E., Mayoral, L., Hoffert, W., et al. (1966). Нормальная вирусная и бактериальная флора тонкого и толстого кишечника человека. Н. англ. Дж. Мед. 274, 558–63. дои: 10.1056/NEJM196603102741006
Полнотекстовая перекрестная ссылка | Академия Google
Хошини, Р., Дай, С.К., Лескано, С., и Пиментел, М. (2008). Систематический обзор диагностических тестов на избыточный бактериальный рост в тонкой кишке. Цифр. Дис. науч. 53, 1443–1454. doi: 10.1007/s10620-007-0065-1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ким, С., Ковингтон, А., и Памер, Э. Г. (2017). Кишечная микробиота: антибиотики, колонизационная резистентность и кишечные патогены. Иммунол. Ред. 279, 90–105. doi: 10.1111/imr.12563
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Козиолек М. , Гримм М., Беккер Д., Иорданов В., Зоу Х., Симидзу Дж. и соавт. (2015). Исследование профилей pH и температуры в желудочно-кишечном тракте голодающих людей с использованием системы intellicap ® . Дж.фарм. науч. 104, 2855–2863. doi: 10.1002/jps.24274
, Гримм М., Беккер Д., Иорданов В., Зоу Х., Симидзу Дж. и соавт. (2015). Исследование профилей pH и температуры в желудочно-кишечном тракте голодающих людей с использованием системы intellicap ® . Дж.фарм. науч. 104, 2855–2863. doi: 10.1002/jps.24274
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
La Rosa, P.S., Warner, B.B., Zhou, Y., Weinstock, G.M., Sodergren, E., Hall-Moore, C.M., et al. (2014). Паттерн прогрессирования бактериальных популяций в кишечнике недоношенных детей. Проц. Натл. акад. науч. США 111, 12522–12527. doi: 10.1073/pnas.1409497111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лавель, А., Lennon, G., Docherty, N., Balfe, A., Mulcahy, H.E., Doherty, G., et al. (2013). Зависящие от глубины различия в структуре сообщества микробиоты толстой кишки человека в норме. PLoS ONE 8:e78835. doi: 10.1371/journal.pone.0078835
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лавель А.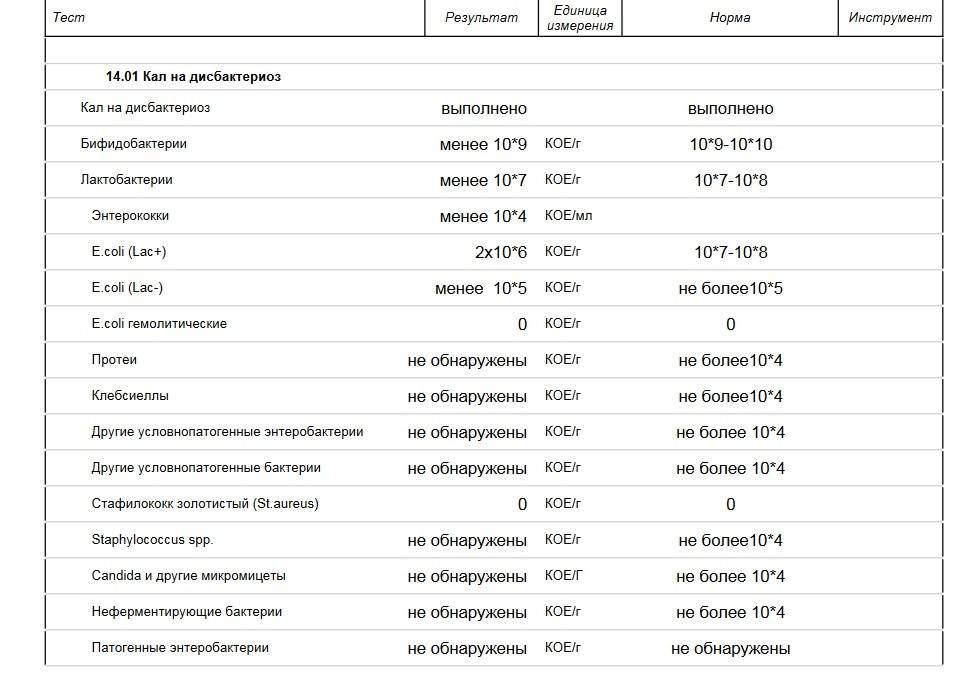 , Леннон Г., О’Салливан О., Дохерти Н., Балф А., Магуайр А. и др. (2015). Пространственная изменчивость микробиоты толстой кишки у пациентов с язвенным колитом и у добровольцев контрольной группы. Гут 64, 1553–1561. doi: 10.1136/gutjnl-2014-307873
, Леннон Г., О’Салливан О., Дохерти Н., Балф А., Магуайр А. и др. (2015). Пространственная изменчивость микробиоты толстой кишки у пациентов с язвенным колитом и у добровольцев контрольной группы. Гут 64, 1553–1561. doi: 10.1136/gutjnl-2014-307873
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Li, Y., Tinoco, R., Elmén, L., Segota, I., Xian, Y., Fujita, Y., et al. (2019). Зависимый от микробиоты кишечника противоопухолевый иммунитет ограничивает рост меланомы у мышей Rnf5-/-. Нац. коммун. 10:1492. doi: 10.1038/s41467-019-09525-y
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ллойд-Прайс, Дж., Арзе, К., Анантакришнан, А.Н., Ширмер М., Авила-Пачеко Дж., Пун Т.В. и соавт. (2019). Мультиомика кишечной микробной экосистемы при воспалительных заболеваниях кишечника. Природа 569, 655–662. doi: 10.1038/s41586-019-1237-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Макферсон, А. Дж., де Агуэро, М. Г., и Ганал-Вонарбург, С. К. (2017). Как питание и материнская микробиота формируют иммунную систему новорожденного. Нац. Преподобный Иммунол. 17, 508–517. doi: 10.1038/nri.2017.58
Дж., де Агуэро, М. Г., и Ганал-Вонарбург, С. К. (2017). Как питание и материнская микробиота формируют иммунную систему новорожденного. Нац. Преподобный Иммунол. 17, 508–517. doi: 10.1038/nri.2017.58
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
McNulty, N.P., Wu, M., Erickson, A.R., Pan, C., Erickson, B.K., Martens, E.C., et al. (2013). Влияние диеты на использование ресурсов модельной микробиотой кишечника человека, содержащей Bacteroides Cellulosilyticus Wh3, симбионт с обширным гликобиомом. PLoS Биол. 11:e1637. doi: 10.1371/journal.pbio.1001637
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Нава, Г.М., Фридрихсен, Х. Дж., и Стаппенбек, Т. С. (2011). Пространственная организация кишечной микробиоты в восходящей ободочной кишке мыши. ISME J. 5, 627–638. doi: 10.1038/ismej.2010.161
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Quintanilha, A. G., Zilberstein, B., Santos, M.A.A., Pajecki, D., Hourneaux Moura, E.G., Alves, P.R.A., et al. (2007). Новый метод отбора проб для исследования микробиоты кишечника. Мир Дж. Гастроэнтерол. 13, 3990–3995.дои: 10.3748/wjg.v13.i29.3990
G., Zilberstein, B., Santos, M.A.A., Pajecki, D., Hourneaux Moura, E.G., Alves, P.R.A., et al. (2007). Новый метод отбора проб для исследования микробиоты кишечника. Мир Дж. Гастроэнтерол. 13, 3990–3995.дои: 10.3748/wjg.v13.i29.3990
Полнотекстовая перекрестная ссылка | Академия Google
Рангель И., Сундин Дж., Фуэнтес С., Репсильбер Д., де Вос В. М. и Браммер Р. Дж. (2015). Взаимосвязь между фекально-ассоциированной и слизисто-ассоциированной микробиотой у пациентов с синдромом раздраженного кишечника и здоровых людей. Алимент. Фармакол. тер. 42, 1211–1221. doi: 10.1111/кв.13399
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Резаи Нежад, Х., Oliveira, B.C.M., Sadeqi, A., Dehkharghani, A., Kondova, I., Langermans, J.A.M., et al. (2019). Осмотическая таблетка для приема внутрь для отбора проб кишечного микробиома in vivo . Доп. Интел. Сист. 1:1
3. doi: 10.1002/aisy.2013Полнотекстовая перекрестная ссылка | Академия Google
Рингель Ю. , Махаршак Н., Рингель-Кулка Т., Вольбер Э. А., Сартор Р. Б. и Кэрролл И. М. (2015). Высокопроизводительное секвенирование выявляет различные микробные популяции в нишах слизистой оболочки и просвета у здоровых людей. Микробы кишечника 6, 173–181. дои: 10.1080/194
, Махаршак Н., Рингель-Кулка Т., Вольбер Э. А., Сартор Р. Б. и Кэрролл И. М. (2015). Высокопроизводительное секвенирование выявляет различные микробные популяции в нишах слизистой оболочки и просвета у здоровых людей. Микробы кишечника 6, 173–181. дои: 10.1080/194
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Риордан С.М., Макивер С.Дж., Данкомб В.М. и Болин Т.Д. (1995). Бактериологический анализ биоптатов слизистой оболочки для выявления избыточного бактериального роста в тонкой кишке. Скан. Дж. Гастроэнтерол. 30, 681–685. дои: 10.3109/0036552950
13
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Родригес-Паласиос, А., Хоретоненко М.В. и Илич С. (2019). Институциональные протоколы для перорального введения (желудочный зонд) химических веществ и микроскопических микробных сообществ мышам: аналитический консенсус. Экспл. биол. Мед. 244, 459–470. дои: 10.1177/1535370219838203
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Роуэн, Ф.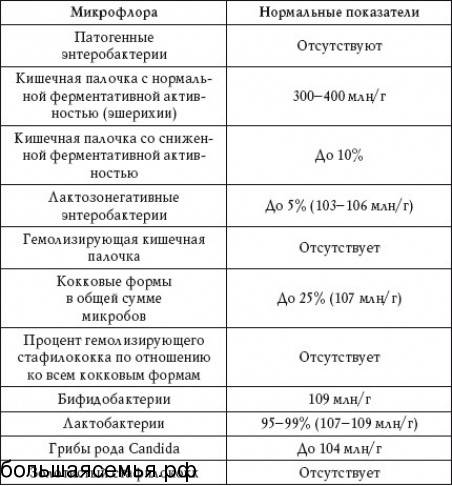 , Дочерти, Н. Г., Мерфи, М., Мерфи, Т. Б., Коффи, Дж. К., и О’Коннелл, П. Р. (2010). Бактериальная колонизация геля слизистой оболочки толстой кишки и активность заболевания при язвенном колите. Энн. Surg. 252, 869–874. doi: 10.1097/SLA.0b013e3181fdc54c
, Дочерти, Н. Г., Мерфи, М., Мерфи, Т. Б., Коффи, Дж. К., и О’Коннелл, П. Р. (2010). Бактериальная колонизация геля слизистой оболочки толстой кишки и активность заболевания при язвенном колите. Энн. Surg. 252, 869–874. doi: 10.1097/SLA.0b013e3181fdc54c
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Russell, W.R., Gratz, S.W., Duncan, S.H., Holtrop, G., Ince, J., Scobbie, L., et al. (2011). Диеты с высоким содержанием белка и низким содержанием углеводов способствуют формированию профилей метаболитов, которые, вероятно, вредны для здоровья толстой кишки. утра. Дж. Клин. Нутр. 93, 1062–1072. doi: 10.3945/ajcn.110.002188
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сафури, Г.Б., Шилдс-Катлер Р.Р., Чен Дж., Ян Ю., Лекатц Х.Р., Хейл В.Л. и соавт. (2019). В основе симптомов, связанных с функциональными расстройствами желудочно-кишечного тракта, лежит микробный дисбактериоз тонкой кишки. Нац. коммун. 10:2012. doi: 10.1038/s41467-019-09964-7
коммун. 10:2012. doi: 10.1038/s41467-019-09964-7
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шанахан, Э. Р., Чжун, Л., Талли, Н. Дж., Моррисон, М., и Холтманн, Г. (2016). Характеристика микробиоты, связанной со слизистой оболочкой желудочно-кишечного тракта: новый метод предотвращения перекрестного загрязнения во время эндоскопических процедур. Алимент. Фармакол. тер. 43, 1186–1196. doi: 10.1111/кв.13622
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шефлин А.М., Борресен Э.С., Кирквуд Дж.С., Бут С.М., Уитни А.К., Лу С. и соавт. (2017). Пищевые добавки с рисовыми отрубями или фасолью изменяют метаболизм кишечных бактерий у выживших после колоректального рака. Мол. Нутр. Еда Рез. 61:905. doi: 10.1002/мнфр.201500905
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шет, Р.У., Ли, М., Цзян, В., Симс, П.А., Леонг, К.В., и Ван, Х.Х. (2019). Пространственная метагеномная характеристика микробной биогеографии в кишечнике. Нац. Биотехнолог. 37, 877–883. doi: 10.1038/s41587-019-0183-2
Нац. Биотехнолог. 37, 877–883. doi: 10.1038/s41587-019-0183-2
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шобар, Р. М., Велини, С., Кешаварзян, А., Суонсон, Г., ДеМео, М. Т., Мелсон, Дж. Э., и соавт. (2016). Влияние подготовки кишечника на показатели, связанные с микробиотой, различается в зависимости от состояния здоровья и воспалительных заболеваний кишечника, а также для компартментов микробиоты слизистой оболочки и просвета. клин. Перевод Гастроэнтерол. 7:e143. doi: 10.1038/ctg.2015.54
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Song, S.J., Amir, A., Metcalf, J.L., Amato, K.R., Xu, Z.Z., Humphrey, G., et al. (2016). Методы консервации отличаются стабильностью фекального микробиома. mSystems 1, 1–12. doi: 10.1128/mSystems.00021-16
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Свидсински А., Лёнинг-Баукке В., Верстрален Х. , Осовска С. и Дёрффель Ю. (2008). Биоструктура фекальной микробиоты у здоровых лиц и больных хронической идиопатической диареей. Гастроэнтерология 135, 568–579. doi: 10.1053/j.gastro.2008.04.017
, Осовска С. и Дёрффель Ю. (2008). Биоструктура фекальной микробиоты у здоровых лиц и больных хронической идиопатической диареей. Гастроэнтерология 135, 568–579. doi: 10.1053/j.gastro.2008.04.017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Tap, J., Derrien, M., Törnblom, H., Brazeilles, R., Cools-Portier, S., Dor,é, J., et al. (2017). Выявление сигнатуры кишечной микробиоты, связанной с тяжестью синдрома раздраженного кишечника. Гастроэнтерология 152, 111–123.e8. doi: 10.1053/j.gastro.2016.09.049
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Tap, J., Furet, J.-P., Bensaada, M., Philippe, C., Roth, H., Rabot, S., et al. (2015). Богатство кишечной микробиоты способствует ее стабильности при повышенном потреблении пищевых волокон у здоровых взрослых. Окружающая среда. микробиол. 17, 4954–4964. дои: 10.1111/1462-2920.13006
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Теджо, Д. I., Jonkers, D.M.A.E., Savelkoul, P.H., Masclee, A.A., van Best, N., Pierik, M.J., et al. (2015). Влияние отбора проб и хранения на состав фекальной микробиоты у здоровых и больных людей. PLoS ONE 10:e0126685. doi: 10.1371/journal.pone.0126685
I., Jonkers, D.M.A.E., Savelkoul, P.H., Masclee, A.A., van Best, N., Pierik, M.J., et al. (2015). Влияние отбора проб и хранения на состав фекальной микробиоты у здоровых и больных людей. PLoS ONE 10:e0126685. doi: 10.1371/journal.pone.0126685
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тадепалли, Х., Лу, М.А., Бах, В.Т., Мацуи, Т.К., и Мандал, А.К. (1979). Микрофлора тонкого кишечника человека. утра. Дж.Surg. 138, 845–850. дои: 10.1016/0002-9610(79)
-хРеферат PubMed | Полный текст перекрестной ссылки | Академия Google
Tropini, C., Moss, E.L., Merrill, B.D., Ng, K.M., Higginbottom, S.K., Casavant, E.P., et al. (2018). Временное осмотическое возмущение вызывает долговременное изменение микробиоты кишечника. Сотовый 173, 1742–1754.e17. doi: 10.1016/j.cell.2018.05.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Уно Ю., Мунаката А.и Отомо, Ю. (1998). Прощание с бактериемией, вызванной эндоскопической инъекцией – эффективность нового инъекционного катетера с закрытым кончиком. Гастроинтест. Эндоск. 47, 523–525.
Прощание с бактериемией, вызванной эндоскопической инъекцией – эффективность нового инъекционного катетера с закрытым кончиком. Гастроинтест. Эндоск. 47, 523–525.
Реферат PubMed | Академия Google
Винсент, А. Д., Ван, X. Y., Парсонс, С. П., Хан, В. И., и Хейзинга, Дж. Д. (2018). Аномальная абсорбционная двигательная активность толстой кишки у стерильных мышей корректируется бутиратом, эффект, возможно, опосредован серотонином слизистой оболочки. утра. Дж. Физиол. 315, G896–G907.doi: 10.1152/jpgi.00237.2017
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Vogtmann, E., Chen, J., Kibriya, M.G., Chen, Y., Islam, T., Eunes, M., et al. (2017). Сравнение методов сбора фекалий для изучения микробиоты в Бангладеш. Заяв. Окружающая среда. микробиол. 83:17. doi: 10.1128/AEM.00361-17
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Ван З., Зольник С. П., Цю Ю., Усик М. , Ван Т., Стриклер Х.Д. и др. (2018). Сравнение методов сбора фекалий для исследований микробиома и метаболомики. Фронт. Клетка. Заразить. микробиол. 8:301. doi: 10.3389/fcimb.2018.00301
, Ван Т., Стриклер Х.Д. и др. (2018). Сравнение методов сбора фекалий для исследований микробиома и метаболомики. Фронт. Клетка. Заразить. микробиол. 8:301. doi: 10.3389/fcimb.2018.00301
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Watt, E., Gemmell, M.R., Berry, S., Glaire, M., Farquharson, F., Louis, P., et al. (2016). Расширение анализа микробиома слизистой оболочки толстой кишки — оценка лаважа толстой кишки в качестве показателя эндоскопической биопсии толстой кишки. Микробиом 4:61.doi: 10.1186/s40168-016-0207-9
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Уэлч, Дж. Л. М., Хасэгава, Ю., Макналти, Н. П., Гордон, Дж. И., и Борис, Г. Г. (2017). Пространственная организация модельной микробиоты кишечника человека из 15 человек, созданная у гнотобиотических мышей. Проц. Натл. акад. науч. США 114, E9105–E9114. doi: 10.1073/pnas.1711596114
Полнотекстовая перекрестная ссылка | Академия Google
Уимберли, Н.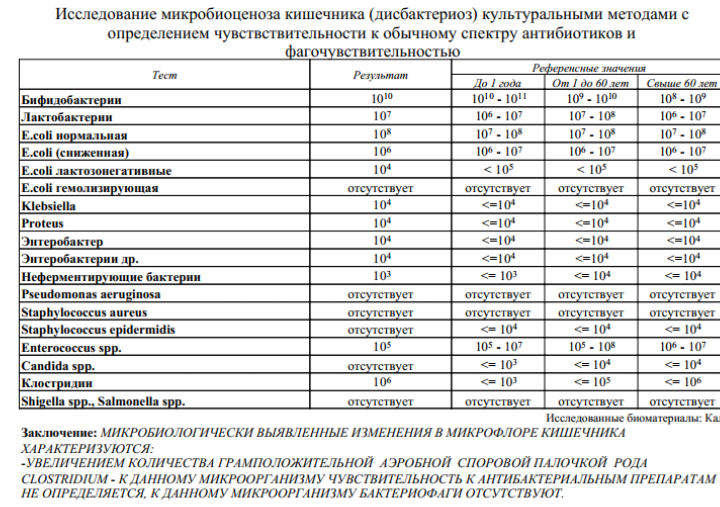 , Фалинг, Л.Дж., и Бартлетт, Дж.Г. (1979). Метод фиброоптической бронхоскопии для получения незагрязненных выделений из нижних дыхательных путей для бактериального посева. утра. Преподобный Респир. Дис. 119, 337–343. doi: 10.1164/arrd.1979.119.3.337
, Фалинг, Л.Дж., и Бартлетт, Дж.Г. (1979). Метод фиброоптической бронхоскопии для получения незагрязненных выделений из нижних дыхательных путей для бактериального посева. утра. Преподобный Респир. Дис. 119, 337–343. doi: 10.1164/arrd.1979.119.3.337
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Вос-Оксли, М.Л., Блайх, А., Оксли, А.П.А., Каль, С., Янус, Л.М., Смочек, А., и соавт. (2012). Сравнительная оценка создания микробного сообщества кишечника человека на моделях грызунов. Микробы кишечника 3, 1–16.doi: 10.4161/gmic.19934
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Wu, G.D., Lewis, J.D., Hoffmann, C., Chen, Y.-Y., Knight, R., Bittinger, K., et al. (2010). Методы отбора проб и пиросеквенирования для характеристики бактериальных сообществ в кишечнике человека с использованием меток последовательности 16S. ВМС микробиол. 10:206. дои: 10.1186/1471-2180-10-206
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зарринпар, А. , Чайкс, А., Юсеф, С.и Панда, С. (2014). Диета и характер питания влияют на суточную динамику кишечного микробиома. Сотовый метаб. 20, 1006–1017. doi: 10.1016/j.cmet.2014.11.008
, Чайкс, А., Юсеф, С.и Панда, С. (2014). Диета и характер питания влияют на суточную динамику кишечного микробиома. Сотовый метаб. 20, 1006–1017. doi: 10.1016/j.cmet.2014.11.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Змора, Н., Зильберман-Шапира, Г., Суэц, Дж., Мор, У., Дори-Бачаш, М., Башиардес, С., и соавт. (2018). Индивидуальная устойчивость колонизации слизистой оболочки кишечника к эмпирическим пробиотикам связана с уникальными особенностями хозяина и микробиома. Сотовый 174, 1388–1405.е21. doi: 10.1016/j.cell.2018.08.041
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Zoetendal, E.G., Raes, J., van den Bogert, B., Arumugam, M., Booijink, C.C.G.M., Troost, F.J., et al. (2012). Микробиота тонкого кишечника человека обусловлена быстрым поглощением и преобразованием простых углеводов. ISME J. 6, 1415–1426. doi: 10.1038/ismej.2011.212
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Зутендаль, Э. Г., фон Райт А., Вилппонен-Салмела Т., Бен-Амор К., Аккерманс А.Д.Л. и де Вос В.М. (2002). Ассоциированные со слизистой оболочкой бактерии в желудочно-кишечном тракте человека равномерно распределены по толстой кишке и отличаются от сообщества, выделенного из фекалий. Заяв. Окружающая среда. микробиол. 68, 3401–3407. doi: 10.1128/aem.68.7.3401-3407.2002
Г., фон Райт А., Вилппонен-Салмела Т., Бен-Амор К., Аккерманс А.Д.Л. и де Вос В.М. (2002). Ассоциированные со слизистой оболочкой бактерии в желудочно-кишечном тракте человека равномерно распределены по толстой кишке и отличаются от сообщества, выделенного из фекалий. Заяв. Окружающая среда. микробиол. 68, 3401–3407. doi: 10.1128/aem.68.7.3401-3407.2002
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Оценка влияния четырех сред на культуру микробиоты кишечника человека in vitro | AMB Express
Bang SJ, Kim G, Mi YL, Song EJ, Jung DH, Kum JS, Nam YD, Park CS, Seo DH (2018) Влияние ферментации пектина in vitro на фекальный микробиом человека.Амб Экспресс 8(1):98. https://doi.org/10.1186/s13568-018-0629-9
КАС Статья пабмед ПабМед Центральный Google Scholar
Барберан А., Бейтс С.Т., Касамайор Э.О., Фиерер Н. (2012) Использование сетевого анализа для изучения закономерностей сосуществования в почвенных микробных сообществах.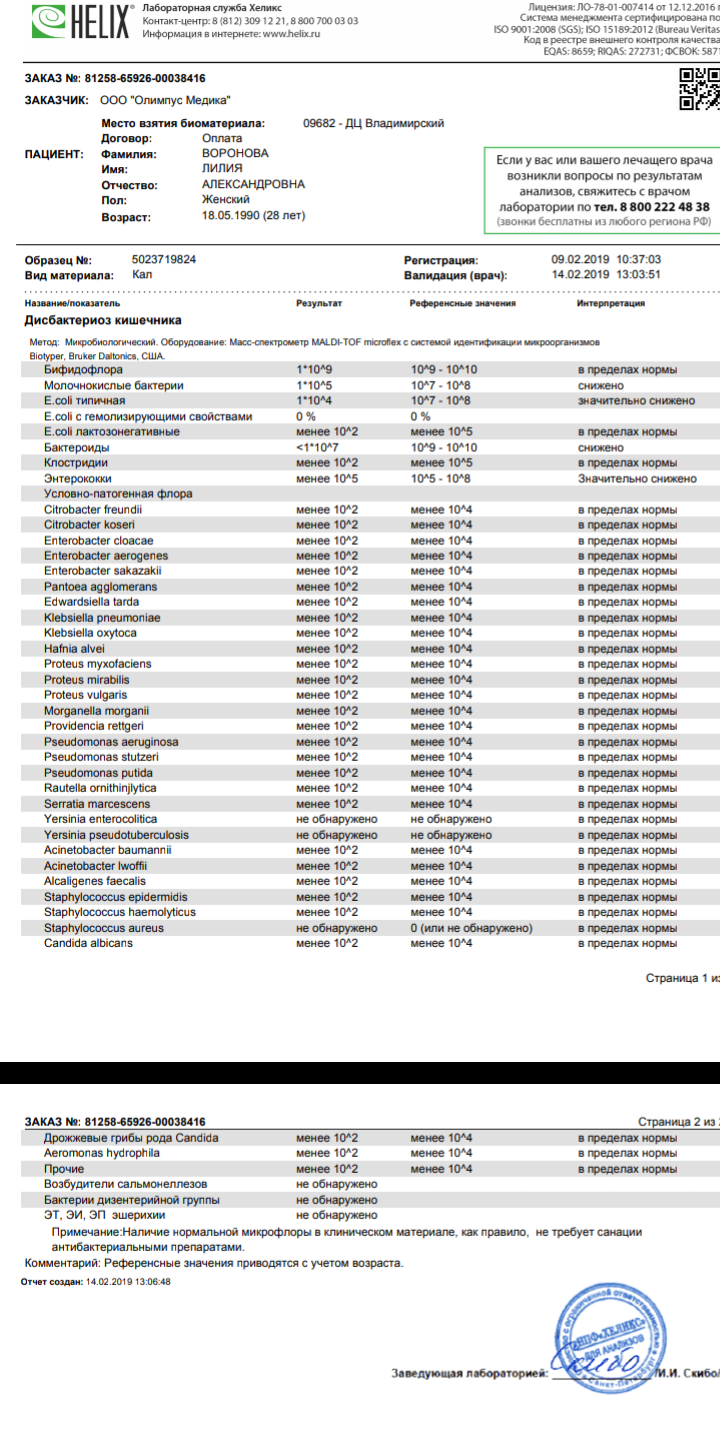 ISME J 6 (2): 343–351. https://doi.org/10.1038/ismej.2011.119
ISME J 6 (2): 343–351. https://doi.org/10.1038/ismej.2011.119
КАС Статья пабмед Google Scholar
Brisse S, Grimont F, Grimont PAD (2006) Род Klebsiella .В: Дворкин М., Фальков С., Розенберг Э., Шлейфер К. Х., Штакебрандт Э. (ред.) Прокариоты, том 6. Proteobacteria : подкласс гамма. Спрингер, Нью-Йорк, стр. 159–196
Глава Google Scholar
Каллахан Б.Дж., Макмерди П.Дж., Розен М.Дж., Хан А.В., Джонсон А.Дж.А., Холмс С.П. (2016) DADA2: вывод образца с высоким разрешением на основе данных ампликона Illumina. Nat Methods 13 (7): 581–583. https://doi.org/10.1038/nmeth.3869
КАС Статья пабмед ПабМед Центральный Google Scholar
Карлсон Дж. Л., Эриксон Дж. М., Хесс Дж. М., Гулд Т. Дж., Славин Дж. Л. (2017) Пребиотические пищевые волокна и здоровье кишечника: сравнение ферментации бета-глюкана, инулина и ксилоолигосахаридов in vitro.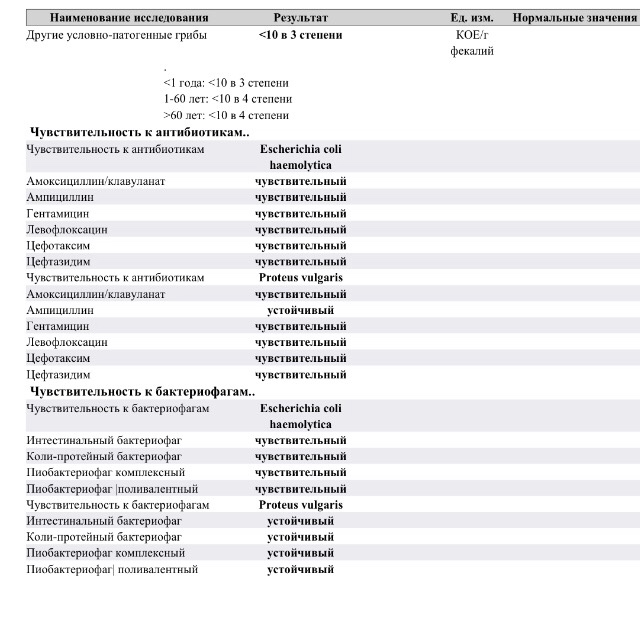 Питательные вещества. https://doi.org/10.3390/nu61
Питательные вещества. https://doi.org/10.3390/nu61
Артикул пабмед ПабМед Центральный Google Scholar
Экбург П.Б., Бик Э.М., Бернштейн К.Н., Пурдом Э., Детлефсен Л., Сарджент М., Гилл С.Р., Нельсон К.Е., Релман Д.А. (2005)Разнообразие микробной флоры кишечника человека. Наука 308 (5728): 1635. https://doi.org/10.1126/science.1110591
Артикул пабмед ПабМед Центральный Google Scholar
Фауст К., Сатирапонгсасути Дж. Ф., Изард Дж., Сегата Н., Геверс Д., Раес Дж., Хаттенхауэр С. (2012) Отношения совместного появления микробов в микробиоме человека.PLoS Comput Biol 8(7):e1002606. https://doi.org/10.1371/journal.pcbi.1002606
КАС Статья пабмед ПабМед Центральный Google Scholar
Fusco A, Savio V, Cammarota M, Alfano A, Schiraldi C, Donnarumma G (2017) Бета-дефенсин-2 и бета-дефенсин-3 уменьшают повреждение кишечника, вызванное Salmonella typhimurium, модулируя экспрессию цитокинов и усиливая пробиотическая активность Enterococcus faecium .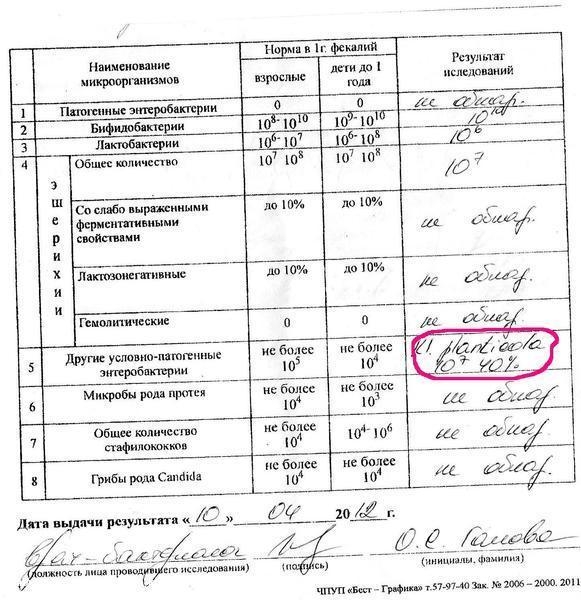 J Immunol Res 2017: 6976935. https://doi.org/10.1155/2017/6976935
J Immunol Res 2017: 6976935. https://doi.org/10.1155/2017/6976935
КАС Статья пабмед ПабМед Центральный Google Scholar
Goodman AL, Kallstrom G, Faith JJ, Reyes A, Moore A, Dantas G, Gordon JI (2011)Обширные коллекции личных культур микробиоты кишечника человека, охарактеризованные и обработанные у гнотобиотических мышей. Proc Natl Acad Sci USA 108(15):6252–6257. https://doi.org/10.1073/pnas.1102938108
Артикул пабмед Google Scholar
Гупта А., Ханна С. (2017)Трансплантация фекальной микробиоты. Джама 318 (1): 102. https://doi.org/10.1001/jama.2017.6466
Артикул пабмед Google Scholar
Jin W, Han K, Dong S, Yang Y, Mao Z, Su M, Zeng M (2018) Модификации кишечной микробиоты и метаболитов ферментации в задней кишке крыс после употребления галактоолигосахаридов, гликированных рыбьим пептидом.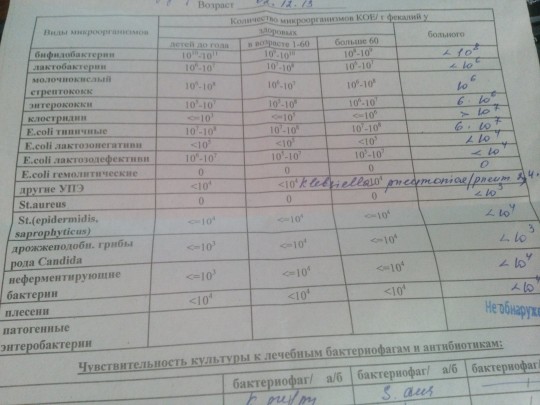 Функция питания https://doi.org/10.1039/C7FO02002C
Функция питания https://doi.org/10.1039/C7FO02002C
Артикул пабмед Google Scholar
Kassinen A, Krogius-Kurikka L, Makivuokko H, Rinttila T, Paulin L, Corander J, Malinen E, Apajalahti J, Palva A (2007) Фекальная микробиота пациентов с синдромом раздраженного кишечника значительно отличается от микробиоты здоровых людей. . Гастроэнтерология 133 (1): 24–33. https://doi.org/10.1053/j.gastro.2007.04.005
КАС Статья пабмед Google Scholar
Ковачева-Дачари П., Нильссон А., Акрами Р., Ли Ю.С., Де Ваддер Ф., Арора Т., Халлен А., Мартенс Э., Бьорк И., Бэкхед Ф. (2015) Улучшение метаболизма глюкозы, вызванное употреблением пищевых волокон, связано с увеличение численности Prevotella .Cell Metab 22 (6): 971–982. https://doi.org/10.1016/j.cmet.2015.10.001
КАС Статья пабмед Google Scholar
Lagier JC, Dubourg G, Million M, Cadoret F, Bilen M, Fenollar F, Levasseur A, Rolain JM, Fournier PE, Raoult D (2018) Культивирование микробиоты человека и культуромика. Nat Rev Microbiol. https://doi.org/10.1038/s41579-018-0041-0
Nat Rev Microbiol. https://doi.org/10.1038/s41579-018-0041-0
Артикул пабмед Google Scholar
Lau JT, Whelan FJ, Herath I, Lee CH, Collins SM, Bercik P, Surette MG (2016) Захват разнообразия микробиоты кишечника человека с помощью молекулярного профилирования, обогащенного культурой.Геном Мед 8(1):72. https://doi.org/10.1186/s13073-016-0327-7
КАС Статья пабмед ПабМед Центральный Google Scholar
Macfarlane GT, Allison C, Gibson SA, Cummings JH (1988) Вклад микрофлоры в протеолиз в толстой кишке человека. J Appl Microbiol 64(1):37–46. https://doi.org/10.1111/j.1365-2672.1988.tb02427.x
КАС Статья Google Scholar
Makki K, Deehan EC, Walter J, Backhed F (2018) Влияние пищевых волокон на микробиоту кишечника на здоровье и болезни хозяина. Клеточный микроб-хозяин 23(6):705–715. https://doi.org/10.1016/j.chom.2018.05.012
Клеточный микроб-хозяин 23(6):705–715. https://doi.org/10.1016/j.chom.2018.05.012
КАС Статья пабмед Google Scholar
Mcdonald JAK, Schroeter K, Fuentes S, Heikamp-Dejong I, Khursigara CM, Vos WMD, Allen-Vercoe E (2013) Оценка воспроизводимости, стабильности и состава микробного сообщества в модели хемостата дистального отдела кишечника человека. J Microbiol Methods 95(2):167–174. https://doi.org/10.1016/j.mimet.2013.08.008
КАС Статья пабмед Google Scholar
Nakano V, Ignacio A, Fernandes MR, Fugukaiti MH, Avila-Campos MJ (2013) Intestinal Bacteroides и Parabacteroides видов, продуцирующих антагонистические вещества. Curr Trends Immunol 1:1–4
Google Scholar
Pham VT, Mohajeri MH (2018) Применение моделей кишечника человека in vitro для скрининга и разработки пре- и пробиотиков.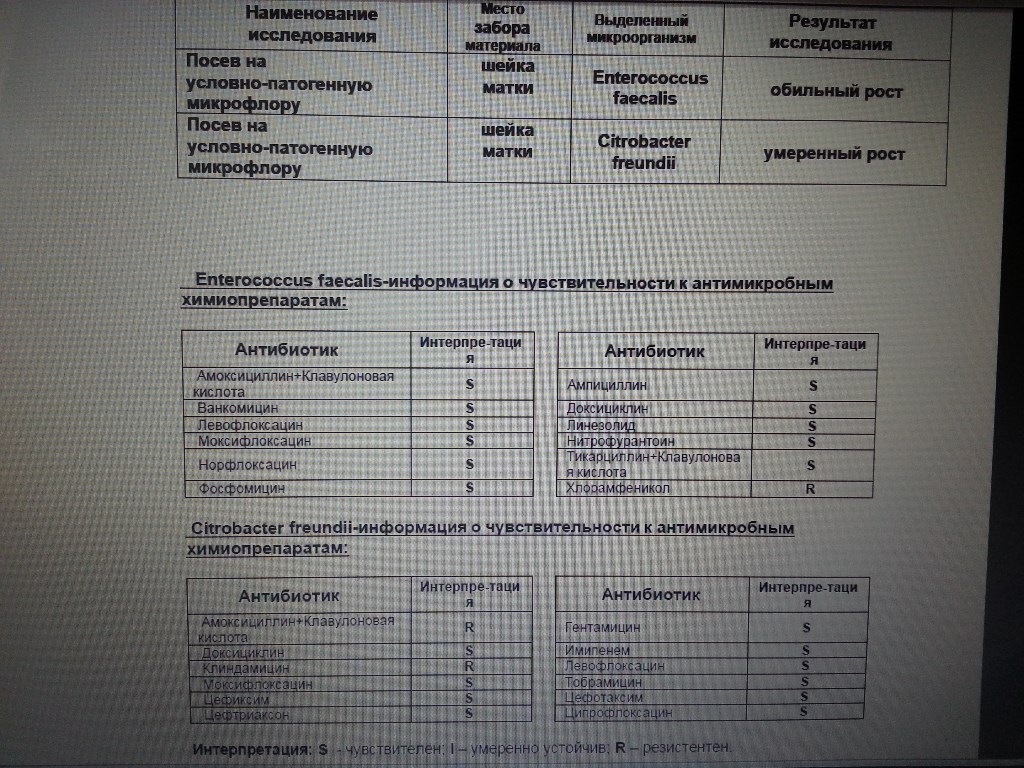 Бенеф Микроб. https://doi.org/10.3920/BM2017.0164
Бенеф Микроб. https://doi.org/10.3920/BM2017.0164
Артикул Google Scholar
Quast C, Pruesse E, Yilmaz P, Gerken J, Schweer T, Yarza P, Peplies J, Glockner FO (2013) Проект базы данных генов рибосомной РНК SILVA: улучшенная обработка данных и веб-инструменты. Nucleic Acids Res 41 (выпуск базы данных): D590–D596. https://doi.org/10.1093/nar/gks1219
КАС Статья пабмед ПабМед Центральный Google Scholar
Риз А.Т., Данн Р.Р. (2018) Факторы биоразнообразия микробиома: обзор общих правил, фекалий и невежества.Мбио. https://doi.org/10.1128/mbio.01294-18
Артикул пабмед ПабМед Центральный Google Scholar
Ren YD, Ye ZS, Yang LZ, Jin LX, Wei WJ, Deng YY, Chen XX, Xiao CX, Yu XF, Xu HZ (2017) Трансплантация фекальной микробиоты вызывает клиренс е-антигена вируса гепатита В (HBeAg) у пациентов с положительным HBeAg после длительной противовирусной терапии. Гепатология 65 (5): 1765. https://doi.org/10.1002/hep.29008
Гепатология 65 (5): 1765. https://doi.org/10.1002/hep.29008
Артикул пабмед Google Scholar
Routy B, Gopalakrishnan V, Daillere R, Zitvogel L, Wargo JA, Kroemer G (2018)Микробиота кишечника влияет на противораковый иммунный надзор и общее состояние здоровья. Nat Rev Clin Oncol 15 (6): 382–396. https://doi.org/10.1038/s41571-018-0006-2
КАС Статья пабмед Google Scholar
Schneeberger M, Everard A, Gomez-Valades AG, Matamoros S, Ramirez S, Delzenne NM, Gomis R, Claret M, Cani PD (2015) Akkermansia muciniphila обратно коррелирует с началом воспаления, изменением жировой ткани обмен веществ и метаболические нарушения при ожирении у мышей.Научный отчет 5:16643. https://doi.org/10.1038/srep16643
КАС Статья пабмед ПабМед Центральный Google Scholar
Секиров И. , Рассел С.Л., Антунес Л.С., Финлей Б.Б. (2010)Кишечная микробиота в норме и при болезнях. Physiol Rev 90 (3): 859–904. https://doi.org/10.1152/physrev.00045.2009
, Рассел С.Л., Антунес Л.С., Финлей Б.Б. (2010)Кишечная микробиота в норме и при болезнях. Physiol Rev 90 (3): 859–904. https://doi.org/10.1152/physrev.00045.2009
КАС Статья пабмед ПабМед Центральный Google Scholar
Seo M, Heo J, Yoon J, Kim SY, Kang YM, Yu J, Cho S, Kim H (2017) Аттенуация Methanobrevibacter с помощью пробиотиков снижает метеоризм у взрослых людей: нерандомизированное клиническое исследование с парным дизайном эффективности.PLoS ONE 12(9):e0184547. https://doi.org/10.1371/journal.pone.0184547
КАС Статья пабмед ПабМед Центральный Google Scholar
Soto M, Herzog C, Pacheco JA, Fujisaka S, Bullock K, Clish CB, Kahn CR (2018)Микробиота кишечника модулирует нейроповедение посредством изменений чувствительности мозга к инсулину и метаболизма. Мол Психиатрия. https://doi. org/10.1038/s41380-018-0086-5
org/10.1038/s41380-018-0086-5
Артикул пабмед ПабМед Центральный Google Scholar
Staley C, Kaiser T, Vaughn BP, Graiziger CT, Hamilton MJ, Rehman Tu, Song K, Khoruts A, Sadowsky MJ (2018) Прогнозирование рецидива инфекции Clostridium difficile после трансплантации инкапсулированной фекальной микробиоты.Микробиом 6(1):166. https://doi.org/10.1186/s40168-018-0549-6
Артикул пабмед ПабМед Центральный Google Scholar
Surawicz CM, Brandt LJ, Binion DG, Anantakrishnan AN, Curry SR, Gilligan PH, Mcfarland LV, Mark M, Zuckerbraun BS (2013) Руководство по диагностике, лечению и профилактике инфекций Clostridium difficile . Am J Gastroenterol 108 (4): 478–494. https://doi.org/10.1038/ажг.2013.4
КАС Статья пабмед Google Scholar
Томсон П. , Медина Д.А., Ортузар В., Готтеланд М., Гарридо Д. (2018) Противовоспалительное действие микробных консорциумов при использовании пищевых полисахаридов. Food Res Int 109: 14–23. https://doi.org/10.1016/j.foodres.2018.04.008
, Медина Д.А., Ортузар В., Готтеланд М., Гарридо Д. (2018) Противовоспалительное действие микробных консорциумов при использовании пищевых полисахаридов. Food Res Int 109: 14–23. https://doi.org/10.1016/j.foodres.2018.04.008
КАС Статья пабмед Google Scholar
Трамонтано М., Андреев С., Прутяну М., Клюнманн М., Кун М., Галардини М., Йоухтен П., Железняк А., Зеллер Г., Борк П. (2018) Пищевые предпочтения кишечных бактерий человека раскрывают их метаболические особенности.Природная микробиология. https://doi.org/10.1038/nature07540
Артикул пабмед Google Scholar
Tremaroli V, Bäckhed F (2012) Функциональные взаимодействия между микробиотой кишечника и метаболизмом хозяина. Природа 71 (7415): 242–249. https://doi.org/10.1038/nature11552
КАС Статья Google Scholar
Wang X, Wang X, Jiang H, Cai C, Li G, Hao J, Yu G (2018)Морские полисахариды ослабляют метаболический синдром за счет продуктов ферментации и изменения микробиоты кишечника: обзор. Карбогидр Полим 195:601–612. https://doi.org/10.1016/j.carbpol.2018.05.003
Карбогидр Полим 195:601–612. https://doi.org/10.1016/j.carbpol.2018.05.003
КАС Статья пабмед Google Scholar
Williams CF, Walton GE, Jiang L, Plummer S, Garaiova I, Gibson GR (2015) Сравнительный анализ моделей кишечного тракта. Ann Rev Food Sci Technol 6 (1): 329–350. https://doi.org/10.1146/annurev-food-022814-015429
КАС Статья Google Scholar
Yan D, Zhang T, Su J, Zhao LL, Wang H, Fang XM, Zhang YQ, Liu HY, Yu LY (2018) Структурные изменения в бактериальном сообществе, связанные с взвешенными в воздухе твердыми частицами в Пекине, Китай, во время туманные и безоблачные дни.Appl Environ Microbiol. https://doi.org/10.1128/aem.00004-18
Артикул пабмед ПабМед Центральный Google Scholar
Zadehtahmasebi M, Duca FA, Rasmussen BA, Bauer PV, Côté CD, Filippi BM, Lam TKT (2016)Активация короткоцепочечных и длинноцепочечных жирных кислот в подвздошной кишке снижает выработку глюкозы in vivo .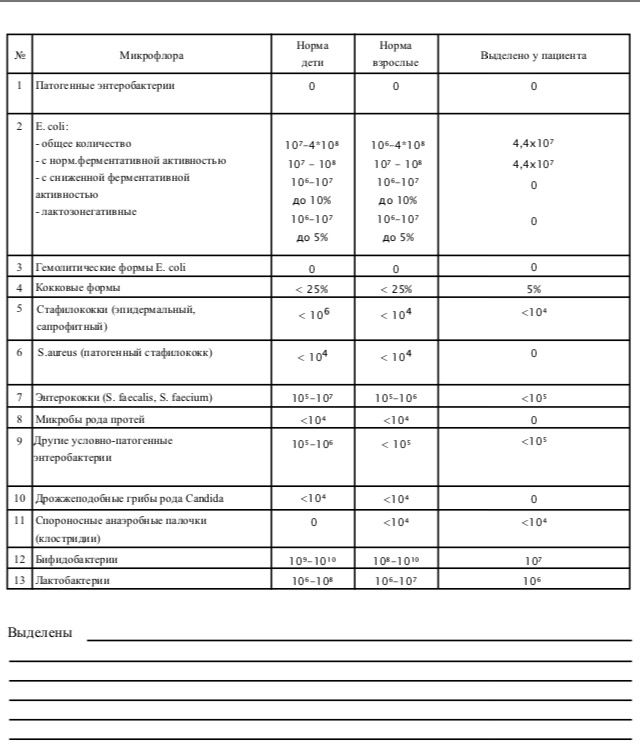 J Biol Chem 291(16):8816–8882. https://doi.org/10.1074/jbc.M116.718460
J Biol Chem 291(16):8816–8882. https://doi.org/10.1074/jbc.M116.718460
КАС Статья Google Scholar
Zhou W, Yan Y, Mi J, Zhang H, Lu L, Luo Q, Li X, Zeng X, Cao Y (2018) Моделирование переваривания и ферментации in vitro микробиотой кишечника человека полисахаридов из собранной пчелами пыльцы Китайская волчья ягода. J Agric Food Chem. https://doi.org/10.1021/acs.jafc.7b05546
Артикул пабмед Google Scholar
Дисбактериоз кишечника, барьерная дисфункция и бактериальная транслокация Объяснение системного воспаления, связанного с ХБП
Резюме
ХБП связана с системным воспалением, но основная причина неизвестна.Здесь мы исследовали участие кишечной микробиоты. Мы сообщаем, что у мышей с дефицитом коллагена типа 4 α 3 с прогрессирующей ХБП, связанной с синдромом Альпорта, наблюдается системное воспаление, включая повышенный уровень пентраксина-2 в плазме и активированных антиген-презентирующих клеток, CD4 и CD8 Т-клеток и Th27- или IFNγ. – продукция Т-клеток в селезенке, а также подавление регуляторных Т-клеток. Связанное с ХБП системное воспаление у этих мышей связано с кишечным дисбактериозом протеобактериального цветения, транслокацией живых бактерий через кишечный барьер в печень и повышенным уровнем бактериального эндотоксина в сыворотке.Уремия не влияла на высвобождение секреторного IgA в просвет подвздошной кишки или субпопуляции лейкоцитов слизистой оболочки. Чтобы проверить причинно-следственную связь между дисбактериозом и системным воспалением при ХБП, мы ликвидировали факультативную анаэробную микробиоту антибиотиками. Эта эрадикация предотвратила бактериальную транслокацию, значительно снизила уровень эндотоксина в сыворотке и полностью восстановила все маркеры системного воспаления до уровня неуремического контроля. Таким образом, мы делаем вывод, что уремия связана с дисбактериозом кишечника, дисфункцией кишечного барьера и бактериальной транслокацией, которые запускают состояние персистирующего системного воспаления при ХБП.
– продукция Т-клеток в селезенке, а также подавление регуляторных Т-клеток. Связанное с ХБП системное воспаление у этих мышей связано с кишечным дисбактериозом протеобактериального цветения, транслокацией живых бактерий через кишечный барьер в печень и повышенным уровнем бактериального эндотоксина в сыворотке.Уремия не влияла на высвобождение секреторного IgA в просвет подвздошной кишки или субпопуляции лейкоцитов слизистой оболочки. Чтобы проверить причинно-следственную связь между дисбактериозом и системным воспалением при ХБП, мы ликвидировали факультативную анаэробную микробиоту антибиотиками. Эта эрадикация предотвратила бактериальную транслокацию, значительно снизила уровень эндотоксина в сыворотке и полностью восстановила все маркеры системного воспаления до уровня неуремического контроля. Таким образом, мы делаем вывод, что уремия связана с дисбактериозом кишечника, дисфункцией кишечного барьера и бактериальной транслокацией, которые запускают состояние персистирующего системного воспаления при ХБП.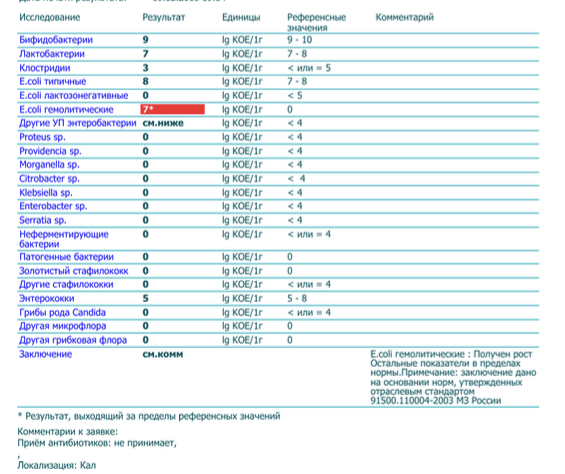 Уремический дисбактериоз и дисфункция кишечного барьера могут быть новыми терапевтическими мишенями для вмешательства, направленного на подавление системного воспаления, связанного с ХБП, и его последствий.
Уремический дисбактериоз и дисфункция кишечного барьера могут быть новыми терапевтическими мишенями для вмешательства, направленного на подавление системного воспаления, связанного с ХБП, и его последствий.
ХБП связана с персистирующим системным воспалением, вызывающим эндотелиальную дисфункцию, атерогенез и сердечно-сосудистые заболевания, 1 , но основная причина системного воспаления, связанного с ХБП, до сих пор неясна. Считалось, что причиной этого явления являются связанные с диализом инфекции катетеров, загрязненная вода или небиосовместимые трубки и диализные фильтры.Однако уровни циркулирующего бактериального эндотоксина в сыворотке увеличиваются от стадии 2 к стадии 5, 2 , что предполагает наличие эндогенного источника бактериального эндотоксина. Здесь мы сосредоточимся на микробиоте организма как на потенциальном причинном триггере системного воспаления, связанного с ХБП.
Микробиота представляет собой в 10 раз больше бактериальных клеток, чем клеток человека, находящихся на внешней и внутренней поверхностях тела. 3 Симбионты ограничивают рост патобионтов и дисбиоз. 4 Кишечные симбионты производят необходимые питательные вещества, такие как витамин К и компоненты, которые регулируют многочисленные метаболические процессы в организме. 5 Исследования на стерильных мышах показали, что микробиота формирует и обучает иммунную систему в раннем возрасте. 6 Однако эпителиальные барьеры должны удерживать микробиоту вне организма, чтобы избежать бактериальной транслокации, системного воспаления и смертельных инфекций. 7,8 Хорошо описано, что дисбактериоз, дисфункция кишечного барьера и бактериальная транслокация вызывают и увековечивают воспаление при воспалительных заболеваниях кишечника, 9 портальной гипертензии, 7 или сердечной недостаточности. 10 Таким образом, мы предположили, что метаболические изменения во время уремии аналогичным образом способствуют кишечному дисбактериозу и бактериальной транслокации как триггеру стойкого состояния системного воспаления, связанного с ХБП.
3 Симбионты ограничивают рост патобионтов и дисбиоз. 4 Кишечные симбионты производят необходимые питательные вещества, такие как витамин К и компоненты, которые регулируют многочисленные метаболические процессы в организме. 5 Исследования на стерильных мышах показали, что микробиота формирует и обучает иммунную систему в раннем возрасте. 6 Однако эпителиальные барьеры должны удерживать микробиоту вне организма, чтобы избежать бактериальной транслокации, системного воспаления и смертельных инфекций. 7,8 Хорошо описано, что дисбактериоз, дисфункция кишечного барьера и бактериальная транслокация вызывают и увековечивают воспаление при воспалительных заболеваниях кишечника, 9 портальной гипертензии, 7 или сердечной недостаточности. 10 Таким образом, мы предположили, что метаболические изменения во время уремии аналогичным образом способствуют кишечному дисбактериозу и бактериальной транслокации как триггеру стойкого состояния системного воспаления, связанного с ХБП.
Мы выбрали мышей с дефицитом коллагена 4 типа α 3 ( Col4a3 ) для реализации нашей гипотезы, поскольку у этих мышей спонтанно развивается прогрессирующий гломерулосклероз и ХБП (нефропатия Альпорта) без каких-либо хирургических, токсических или диетических вмешательств, которые могли бы повлиять на микробиота за пределами метаболических изменений уремии (рис. 1, А и Б). 11 Уремия у 9-недельных мышей Col4a3- с дефицитом ассоциировалась с уровнями в сыворотке пентраксина-2/амилоидного Р-компонента сыворотки, который является функциональным мышиным гомологом человеческого С-реактивного белка, который служит маркером системной воспаление у мышей (рис. 1C). Кроме того, мы проанализировали фенотипирование спленоцитов на 9-й неделе, поскольку селезенка удаляет передающиеся с кровью антигены и инициирует врожденный и адаптивный иммунный ответ против патогенов. Проточная цитометрия показала, что уремия у мышей с дефицитом Col4a3- была связана с увеличением количества активированных CD4 и CD8 Т-лимфоцитов (маркер активации CD69) и IL-17- или IFN γ , продуцирующих Т-клетки CD4 (рис.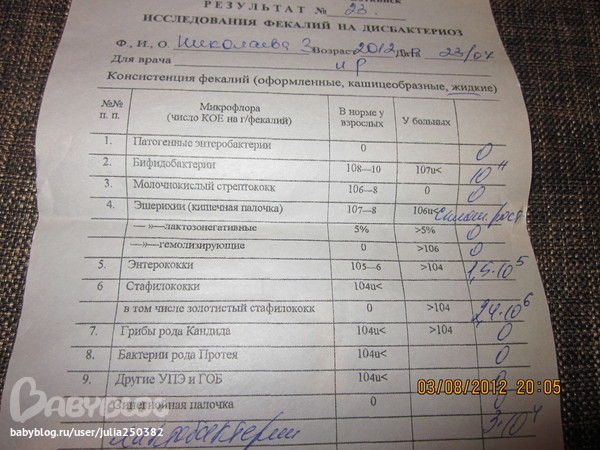 1D).Напротив, количество регуляторных Т-клеток Foxp3+ было снижено по сравнению с контрольными мышами без уремии (рис. 1D). Кроме того, популяция активированных (CD86+) CD11c+ антигенпрезентирующих клеток была увеличена (рис. 1D), что указывает на общее состояние системной иммунной активации у мышей с дефицитом Col4a3 уремии.
1D).Напротив, количество регуляторных Т-клеток Foxp3+ было снижено по сравнению с контрольными мышами без уремии (рис. 1D). Кроме того, популяция активированных (CD86+) CD11c+ антигенпрезентирующих клеток была увеличена (рис. 1D), что указывает на общее состояние системной иммунной активации у мышей с дефицитом Col4a3 уремии.
Системное воспаление у уремических мышей с дефицитом Col4a3. (A) Гломерулярная и тубулоинтерстициальная патология у 9-недельных мышей с дефицитом Col4a3 иллюстрируется периодическим окрашиванием кислотой-Шиффом.Репрезентативные изображения показаны с исходным увеличением в 400 раз. (B) ХЗП иллюстрируется прогрессирующим снижением СКФ, измеренным чрескожным клиренсом синистрина FITC у мышей в сознании. (C) Уровни пентраксина-2 (PTX2)/амилоида P в сыворотке (SAP) в сыворотке соответствуют человеческому PTX1/C-реактивному белку и указывают на системное воспаление в возрасте 9 недель. (D) Проточный цитометрический анализ лимфоцитов и миелоидных клеток в селезенке 9-недельных неуремических мышей дикого типа и уремических Col4a3 -дефицитных мышей показывает значительное увеличение количества активированных Т-клеток и CD11c+ миелоидных мононуклеарных фагоцитов. Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; ** P <0,01 по сравнению с диким типом; *** P <0,001 по сравнению с диким типом.
Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; ** P <0,01 по сравнению с диким типом; *** P <0,001 по сравнению с диким типом.
Предполагая, что системное воспаление при уремии связано с изменениями кишечной микробиоты, мы сначала количественно и качественно охарактеризовали кишечную микробиоту у мышей с дефицитом Col4a3 и мышей дикого типа. Хотя мы обнаружили среднее количество факультативных анаэробных бактерий 10 5 –10 6 КОЕ/г фекалий у мышей дикого типа в возрасте 3–9 недель, прогрессирующая ХБП у мышей с дефицитом Col4a3 была связана с увеличением факультативного количество анаэробных бактерий в пять-десять раз по сравнению с мышами дикого типа того же возраста (рис. 2А).Ампликонное секвенирование бактериальных генов 16S рРНК было проведено для характеристики состава фекальной микробиоты у 3- и 9-недельных уремических и неуремических мышей. α -Разнообразие, мера сложности микробиоты, было незначительно, но незначительно увеличено у 9-недельных мышей, что соответствует увеличению видового разнообразия с возрастом. Точно так же не было обнаружено существенной разницы между мышами дикого типа и мышами с дефицитом Col4a3 (дополнительные рисунки 1 и 2). β -Разнообразие, показатель сходства между различными микробными популяциями, определяли путем анализа невзвешенных и взвешенных матриц расстояний UniFrac.Невзвешенные расстояния UniFrac сравнивают микробные сообщества в филогенетическом контексте на основе наличия или отсутствия таксонов (принадлежность к сообществу), тогда как взвешенный UniFrac также включает информацию об относительной численности (структура сообщества). Значительные различия были определены только с помощью невзвешенного UniFrac между мышами дикого типа и мышами с дефицитом Col4a3 в возрасте 9 недель и между мышами дикого типа в возрасте 9 недель и мышами с дефицитом Col4a3 в возрасте 3 недель (дополнительная фигура 3).
α -Разнообразие, мера сложности микробиоты, было незначительно, но незначительно увеличено у 9-недельных мышей, что соответствует увеличению видового разнообразия с возрастом. Точно так же не было обнаружено существенной разницы между мышами дикого типа и мышами с дефицитом Col4a3 (дополнительные рисунки 1 и 2). β -Разнообразие, показатель сходства между различными микробными популяциями, определяли путем анализа невзвешенных и взвешенных матриц расстояний UniFrac.Невзвешенные расстояния UniFrac сравнивают микробные сообщества в филогенетическом контексте на основе наличия или отсутствия таксонов (принадлежность к сообществу), тогда как взвешенный UniFrac также включает информацию об относительной численности (структура сообщества). Значительные различия были определены только с помощью невзвешенного UniFrac между мышами дикого типа и мышами с дефицитом Col4a3 в возрасте 9 недель и между мышами дикого типа в возрасте 9 недель и мышами с дефицитом Col4a3 в возрасте 3 недель (дополнительная фигура 3).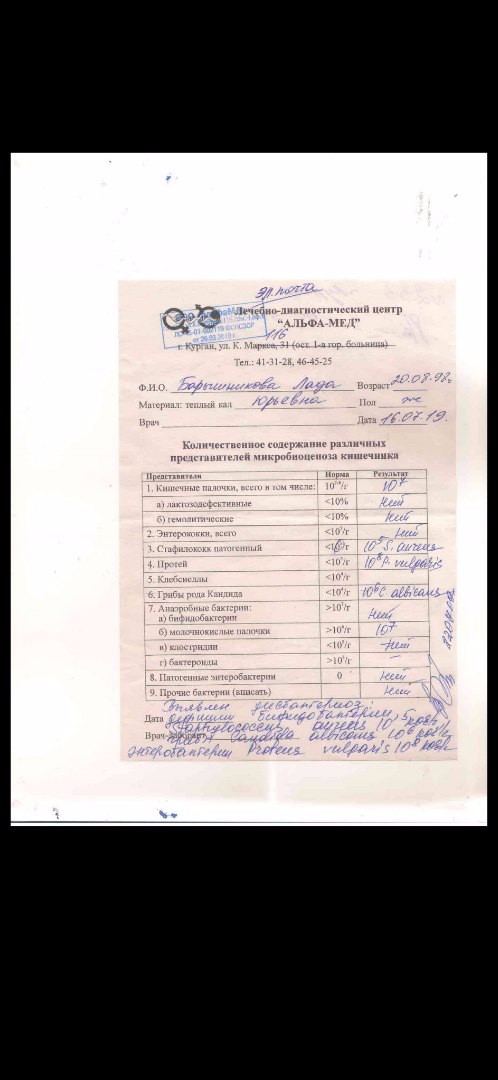 В частности, в возрасте 9 недель относительная численность Alcaligenaceae β -Proteobacteria (среднее ± стандартная ошибка среднего) составляла от 0,09% ± 0,03% до 0,94% ± 0,42% ( P >0,50), относительная численность Verrucomicrobiaceae (средняя ±SEM) составляла от 0,04%±0,01% до 7,90%±6,95% ( P >0,50), относительная численность Bacteroidetes-Bacteroidaceae (среднее ±SEM) составляла от 1,45%±0,72% до 10,65%±3,72% (P <0,50), а относительная численность Bacteroidetes-Porphyromonadaceae (среднее значение ± стандартная ошибка среднего) составила 0,92% ± 0.От 25 % до 3,05 % ± 1,05 % ( P >0,50) у уремических мышей с дефицитом Col4a3, тогда как уровень Bacteroidetes-Bacteroirales был снижен у уремических мышей (с 48,05 % ± 7,97 % до 24,57 % ± 10,46 %; P <0,001). (Рисунок 2Б). Дисбактериоз, связанный с уремией, не был связан с какими-либо изменениями подтипов иммунных клеток стенки тонкой кишки или высвобождением секреторного (s) IgA (таблица 1).
В частности, в возрасте 9 недель относительная численность Alcaligenaceae β -Proteobacteria (среднее ± стандартная ошибка среднего) составляла от 0,09% ± 0,03% до 0,94% ± 0,42% ( P >0,50), относительная численность Verrucomicrobiaceae (средняя ±SEM) составляла от 0,04%±0,01% до 7,90%±6,95% ( P >0,50), относительная численность Bacteroidetes-Bacteroidaceae (среднее ±SEM) составляла от 1,45%±0,72% до 10,65%±3,72% (P <0,50), а относительная численность Bacteroidetes-Porphyromonadaceae (среднее значение ± стандартная ошибка среднего) составила 0,92% ± 0.От 25 % до 3,05 % ± 1,05 % ( P >0,50) у уремических мышей с дефицитом Col4a3, тогда как уровень Bacteroidetes-Bacteroirales был снижен у уремических мышей (с 48,05 % ± 7,97 % до 24,57 % ± 10,46 %; P <0,001). (Рисунок 2Б). Дисбактериоз, связанный с уремией, не был связан с какими-либо изменениями подтипов иммунных клеток стенки тонкой кишки или высвобождением секреторного (s) IgA (таблица 1). Следовательно, мы делаем вывод, что прогрессирующая ХБП и сопровождающая ее уремия у мышей с дефицитом Col4a3 связаны с протеобактериальным цветением и дисбиозом.
Следовательно, мы делаем вывод, что прогрессирующая ХБП и сопровождающая ее уремия у мышей с дефицитом Col4a3 связаны с протеобактериальным цветением и дисбиозом.
Уремия влияет на разнообразие микробиоты и барьерную функцию кишечника. (A) Количественный дисбиоз, измеряемый количеством КОЕ на грамм фекалий, наблюдается у мышей с дефицитом Col4a3 по сравнению с животными дикого типа. С увеличением возраста у мышей с дефицитом Col4a3 развивался еще более выраженный количественный дисбактериоз. (B) Относительное количество различных таксонов бактерий, обнаруженных в образцах фекалий. Изменения в составе микробиоты кишечника, которые могут быть связаны со старением, обнаруживаются у мышей в возрасте 3 и 9 недель в обеих линиях.Сравнение Col4a3 -дефицитных мышей и мышей дикого типа в возрасте 9 недель демонстрирует различия в порядках Bacteroidales, Burholderiales (семейство Alcaligenaceae), Enterobacteriales и Verrucomicrobiales. Подробная информация, включая статистику, приведена в дополнительной таблице 1. (C) Бактериальные колонии выросли из ткани печени мышей с дефицитом уремии Col4a3 , но не из неуремических мышей дикого типа. (D) Сыворотки мышей с уремией и без уремии были проанализированы с использованием анализа лизата амебоцитов limulus и показали значительно повышенные уровни бактериального эндотоксина.(E) Эксперименты ECIS демонстрируют значительное снижение средней устойчивости в одноклеточных слоях клеток Colon26 после обработки сывороткой мышей с дефицитом уремии Col4a3 (момент времени отмечен стрелками) по сравнению с клетками, обработанными сывороткой мышей дикого типа. . Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; *** P <0,001 по сравнению с диким типом.
(C) Бактериальные колонии выросли из ткани печени мышей с дефицитом уремии Col4a3 , но не из неуремических мышей дикого типа. (D) Сыворотки мышей с уремией и без уремии были проанализированы с использованием анализа лизата амебоцитов limulus и показали значительно повышенные уровни бактериального эндотоксина.(E) Эксперименты ECIS демонстрируют значительное снижение средней устойчивости в одноклеточных слоях клеток Colon26 после обработки сывороткой мышей с дефицитом уремии Col4a3 (момент времени отмечен стрелками) по сравнению с клетками, обработанными сывороткой мышей дикого типа. . Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; *** P <0,001 по сравнению с диким типом.
Проточная цитометрия лейкоцитов кишечника у 8,5-недельных мышей Col4a3 -дефицитных иммунная активация отмечена у уремических мышей.Фактически, культуры печени выявили заражение культивируемыми живыми бактериями у 60% всех уремических мышей с дефицитом Col4a3 (рис. 2С), что было связано с тенденцией к более активным макрофагам и дендритным клеткам в печени (таблица 2). Следовательно, мы перорально заражали уремических мышей комменсалом Escherichia coli , конститутивно экспрессирующим зеленый флуоресцентный белок (GFP), через пероральный желудочный зонд. Мы обнаружили GFP+ бактерии в 40% печени мышей с уремией, но не у мышей без уремии (не показано), что свидетельствует о перемещении даже живых бактерий из кишечного тракта.В соответствии с этими выводами, у уремических мышей с дефицитом Col4a3 наблюдались значительно повышенные уровни бактериального эндотоксина в сыворотке по сравнению с мышами дикого типа без уремии (рис. 2D). Тщательный анализ стенки кишечника с помощью периодического окрашивания кислотой-Шиффом, иммуноокрашивания ZO-1 и просвечивающей электронной микроскопии не выявил структурных изменений, таких как язвы или диффузные аномалии плотных контактов, у мышей дикого типа и мышей с дефицитом Col4a3 (дополнительный рисунок).
2С), что было связано с тенденцией к более активным макрофагам и дендритным клеткам в печени (таблица 2). Следовательно, мы перорально заражали уремических мышей комменсалом Escherichia coli , конститутивно экспрессирующим зеленый флуоресцентный белок (GFP), через пероральный желудочный зонд. Мы обнаружили GFP+ бактерии в 40% печени мышей с уремией, но не у мышей без уремии (не показано), что свидетельствует о перемещении даже живых бактерий из кишечного тракта.В соответствии с этими выводами, у уремических мышей с дефицитом Col4a3 наблюдались значительно повышенные уровни бактериального эндотоксина в сыворотке по сравнению с мышами дикого типа без уремии (рис. 2D). Тщательный анализ стенки кишечника с помощью периодического окрашивания кислотой-Шиффом, иммуноокрашивания ZO-1 и просвечивающей электронной микроскопии не выявил структурных изменений, таких как язвы или диффузные аномалии плотных контактов, у мышей дикого типа и мышей с дефицитом Col4a3 (дополнительный рисунок). 4). Однако, когда культивированные эпителиальные клетки толстой кишки подвергались воздействию сыворотки уремических мышей с дефицитом Col4a3 или неуремических мышей дикого типа, только уремическая сыворотка снижала трансэпителиальную резистентность как маркер трансэпителиальной проницаемости (рис. 2Е).
4). Однако, когда культивированные эпителиальные клетки толстой кишки подвергались воздействию сыворотки уремических мышей с дефицитом Col4a3 или неуремических мышей дикого типа, только уремическая сыворотка снижала трансэпителиальную резистентность как маркер трансэпителиальной проницаемости (рис. 2Е).
Проточная цитометрия лейкоцитов кишечника у 8,5-недельных мышей Col4a3 -дефицитных с лечением антибиотиками и без него — дефицитные мыши с синергической пероральной комбинацией антибиотиков, которая уничтожала факультативную анаэробную кишечную микробиоту из кишечника и печени (рис. 3А). Истощение микробиоты значительно снизило уровни бактериального эндотоксина в сыворотке (рис. 3B) и уровни внутрипеченочной экспрессии мРНК пентраксина-2/сывороточного амилоида P и IL-6 (рис. 3C).Соответственно, проточная цитометрия спленоцитов показала менее активированные Т-клетки и восстановление регуляторных Т-клеток (рис. 3D). Не было обнаружено влияния на функцию почек или внутрипочечные профили лейкоцитов (данные не представлены). Таким образом, мы делаем вывод, что уремический дисбиоз и бактериальная транслокация вызывают системное воспаление, связанное с ХБП.
Таким образом, мы делаем вывод, что уремический дисбиоз и бактериальная транслокация вызывают системное воспаление, связанное с ХБП.
Уремическое системное воспаление корректируется путем эрадикации микробиоты. Все пунктирные линии на B и C представляют значения контрольных животных дикого типа.(A) Репрезентативные фотографии показывают полное уничтожение грамотрицательной фекальной флоры после лечения антибиотиками. График дот-блоттинга иллюстрирует КОЕ культур фекалий в возрасте 7 недель. На графике представлены результаты для неселективных сред, поскольку был взят предел обнаружения (пунктирная линия) 10 КОЕ/г фекалий. (B) Уровни эндотоксина в сыворотке с лечением антибиотиками и без него у мышей с дефицитом Col4a3 . ( C ) Уровни экспрессии мРНК амилоида P и IL-6 в сыворотке крови в острой фазе с лечением антибиотиками и без него у мышей с дефицитом Col4a3 .(D) Проточная цитометрия суспензий клеток селезенки мышей с дефицитом уремии Col4a3 с лечением антибиотиками и без него. Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; ** P <0,01 по сравнению с диким типом.
Данные представляют собой средние значения ± стандартная ошибка среднего по меньшей мере для пяти мышей в каждой группе. * P <0,05 по сравнению с диким типом; ** P <0,01 по сравнению с диким типом.
Бактериальный эндотоксин является важным стимулом для иммунной активации через Toll-подобный рецептор 4 и каспазу 11 при грамотрицательном сепсисе с почечной недостаточностью или без нее. 12,13 Различные стадии ХБП и системного воспаления, связанного с ХБП, связаны с прогрессивным увеличением циркулирующего бактериального эндотоксина, CD14 и других биомаркеров системного воспаления. 2,14,15 Кроме того, мочевина, секретируемая уремическим организмом в просвет кишечника, способствует образованию уреазообразующих бактерий, которые уже наблюдались у людей и сходны с нашими результатами. 16,17 Некоторые типы уразообразующих бактерий также участвуют в производстве так называемых уремических токсинов, таких как индол или п-крезол, которые, как известно, способствуют системному воспалению. В принципе, причинно-следственная связь этой связи может быть двоякой (, например, , воспаление, связанное с ХБП, может способствовать проникновению эндотоксина, или поступление уремического токсина/эндотоксина, связанного с ХБП, может способствовать воспалению).Наше исследование теперь подтверждает, что системная иммунная активация, связанная с ХБП, обратима при уничтожении микробиоты. Это означает, что именно микробиота отвечает за системное воспаление, связанное с ХБП.
В принципе, причинно-следственная связь этой связи может быть двоякой (, например, , воспаление, связанное с ХБП, может способствовать проникновению эндотоксина, или поступление уремического токсина/эндотоксина, связанного с ХБП, может способствовать воспалению).Наше исследование теперь подтверждает, что системная иммунная активация, связанная с ХБП, обратима при уничтожении микробиоты. Это означает, что именно микробиота отвечает за системное воспаление, связанное с ХБП.
Системное введение антибиотиков влияет на микробиоту всего тела, и поэтому остается неясным, какая микробиота и из каких областей в наибольшей степени способствует воспалению, связанному с ХБП. Тем не менее, кишечник содержит, безусловно, наибольшее количество бактериальных клеток, и мы также показываем, используя меченый GFP E.coli , транслокация бактерий через кишечный барьер происходит при ХБП. У мышей с уремией даже живые бактерии достигали печени, вероятно, преодолев кишечный эпителиальный барьер и попадая в воротную вену. Как может происходить эта транслокация, не совсем ясно. Сообщалось, что ХБП, вызванная диетой, богатой аденином, у крыс связана с диффузной дезинтеграцией плотных контактов в эпителиальных клетках кишечника. 18-20 Поскольку Col4a3-дефицитные мыши со спонтанной ХБП лишены этого феномена, возможно, что такие изменения связаны с индуцированной кристаллами аденина эпителиальной цитотоксичностью, а не с уремией per se .Фактически кристаллы могут оказывать прямое цитотоксическое действие на эпителиальные клетки. 21 Тем не менее, мы и другие обнаружили, что уремическая (но не неуремическая) плазма увеличивает проницаемость монослоев кишечных эпителиальных клеток in vitro . 18 Следовательно, рабочая гипотеза заключается в том, что, по крайней мере, очаговая дисфункция кишечного барьера должна способствовать бактериальной транслокации, и, возможно, дисбиоз кишечника выступает в качестве кофактора.
Как может происходить эта транслокация, не совсем ясно. Сообщалось, что ХБП, вызванная диетой, богатой аденином, у крыс связана с диффузной дезинтеграцией плотных контактов в эпителиальных клетках кишечника. 18-20 Поскольку Col4a3-дефицитные мыши со спонтанной ХБП лишены этого феномена, возможно, что такие изменения связаны с индуцированной кристаллами аденина эпителиальной цитотоксичностью, а не с уремией per se .Фактически кристаллы могут оказывать прямое цитотоксическое действие на эпителиальные клетки. 21 Тем не менее, мы и другие обнаружили, что уремическая (но не неуремическая) плазма увеличивает проницаемость монослоев кишечных эпителиальных клеток in vitro . 18 Следовательно, рабочая гипотеза заключается в том, что, по крайней мере, очаговая дисфункция кишечного барьера должна способствовать бактериальной транслокации, и, возможно, дисбиоз кишечника выступает в качестве кофактора.
Увеличение количества кишечных протеобактерий, связанное с ХБП, представляет собой переход к потенциально патогенным бактериям (патобионтам), что часто связано с широким спектром заболеваний. 22 Наши результаты согласуются с несколькими предыдущими исследованиями на людях с уремией, 16 уремических крысах, 16 и уремических мышах. 23 Кишечный дисбиоз связан со сдвигом в секреторном профиле микробиоты, включая такие факторы, как метаболит фосфатидилхолина триметиламин N -оксид, который может непосредственно стимулировать прогрессирование ХБП и сердечно-сосудистых заболеваний. 24,25 Известно, что микробиота чувствительна к изменениям экосистемы, связанным с диетой или обменом веществ. 26,27 Метаболические изменения при уремии, включая метаболический ацидоз и азотемию, дают многочисленные объяснения сдвигов микробиоты. 26,27 Попытки коррекции уремического дисбактериоза пробиотическими препаратами основаны на идее модулировать уремический дисбактериоз целенаправленными вмешательствами. 28 Вместе мы пришли к выводу, что дисбактериоз кишечника, барьерная дисфункция и бактериальная транслокация являются причиной системного воспаления при ХБП и потенциально полностью обратимы.
22 Наши результаты согласуются с несколькими предыдущими исследованиями на людях с уремией, 16 уремических крысах, 16 и уремических мышах. 23 Кишечный дисбиоз связан со сдвигом в секреторном профиле микробиоты, включая такие факторы, как метаболит фосфатидилхолина триметиламин N -оксид, который может непосредственно стимулировать прогрессирование ХБП и сердечно-сосудистых заболеваний. 24,25 Известно, что микробиота чувствительна к изменениям экосистемы, связанным с диетой или обменом веществ. 26,27 Метаболические изменения при уремии, включая метаболический ацидоз и азотемию, дают многочисленные объяснения сдвигов микробиоты. 26,27 Попытки коррекции уремического дисбактериоза пробиотическими препаратами основаны на идее модулировать уремический дисбактериоз целенаправленными вмешательствами. 28 Вместе мы пришли к выводу, что дисбактериоз кишечника, барьерная дисфункция и бактериальная транслокация являются причиной системного воспаления при ХБП и потенциально полностью обратимы.
Краткие методы
Исследования на животных
Col4a3 – дефицитные однопометные мыши и мыши дикого типа с идентичным генетическим фоном Sv129 были выведены в особых условиях содержания без патогенов, помещены в одни и те же клетки и генотипированы, как описано ранее. 29 В возрасте 6 недель группы мышей Col4a3 -дефицитных и мышей дикого типа были рандомизированы для перорального введения 25 мг/кг неомицина, 60 мг/кг ампициллина или 25 мг/кг метронидазола один раз в день. в течение 12 дней.Некоторым мышам штамм E. coli MG1655, несущий плазмиду pM979 для конститутивной экспрессии GFP, вводили через зонд на 13-й день. Все исследования на животных были одобрены местным правительственным комитетом по этике.
СКФ и биоанализы
СКФ измеряли у мышей, находящихся в сознании, с использованием чрескожной детекторной системы для определения кинетики клиренса FITC синистрина (Mannheim Pharma & Diagnostics GmbH), как описано. 31 Сердечная пункция выполнялась в стерильных условиях, и анализ лизата лимулюсных амебоцитов использовался для количественного определения уровня ЛПС в плазме (HIT302; Hycult Biotech, PB Uden, Нидерланды). Уровни амилоида P в сыворотке определяли с помощью коммерческого набора Mouse Pentraxin 2/SAP Quantikine ELISA Kit (R&D Systems, Миннеаполис, Миннесота).
31 Сердечная пункция выполнялась в стерильных условиях, и анализ лизата лимулюсных амебоцитов использовался для количественного определения уровня ЛПС в плазме (HIT302; Hycult Biotech, PB Uden, Нидерланды). Уровни амилоида P в сыворотке определяли с помощью коммерческого набора Mouse Pentraxin 2/SAP Quantikine ELISA Kit (R&D Systems, Миннеаполис, Миннесота).
Количественная оценка и квалификация бактерий
Количество КОЕ
Свежие фекалии растворяли в 500 мкл л PBS, разбавляли и высевали в объеме 50 мкл л на чашки с агаром Мак-Конки в качестве селективной среды для грамотрицательных бактерий и LB. агаровые пластины как неселективная среда.Планшеты инкубировали в течение 1–2 сут при 37°С в аэробных условиях; 2–3 г органной ткани иссекали в стерильных условиях путем процеживания через стерильное сито с размером ячеек 70- мк мкм, тщательно промывали 500 мк мкл PBS и 100 мк л высевали на чашки с агаром MacConkey. Для количественного определения ампициллин-резистентной E. coli MG1655 pM979 использовали агар, содержащий ампициллин (100 мк г/мл). Все подсчеты КОЕ рассчитывали на массу введенного образца стула или ткани при пределе обнаружения 10 КОЕ/г для фекалий и 60 КОЕ/г для печени.
Для количественного определения ампициллин-резистентной E. coli MG1655 pM979 использовали агар, содержащий ампициллин (100 мк г/мл). Все подсчеты КОЕ рассчитывали на массу введенного образца стула или ткани при пределе обнаружения 10 КОЕ/г для фекалий и 60 КОЕ/г для печени.
Выделение ДНК стула и секвенирование ампликона гена 16S рРНК
Набор QIAamp DNA Stool Mini Kit (51504; Qiagen, Germantown, MD) использовали для выделения гДНК из свежесобранных образцов фекалий от обеих линий мышей. Вариабельные области гена 16S рРНК V3–V6 амплифицировали с помощью ПЦР с использованием фекальной гДНК. ПЦР состояла из двух последовательных стадий. Грунтовки, ориентированные на ген RRNA 16S (курсив) и специфические праймеры, несущие адаптеры 5’M13 / RM13 (жирный) 338F-M13 ( GTAAACGCGGGCCAGTG CTCCTACGGGWGGCAGCAGCAGCAGCT ) и 1044R-RM13 ( GGGAACACAGCCCCATGA CTACGCCCCCGACARCCATG ) были использованы для усиления область V3–V6 бактериального гена 16S рРНК.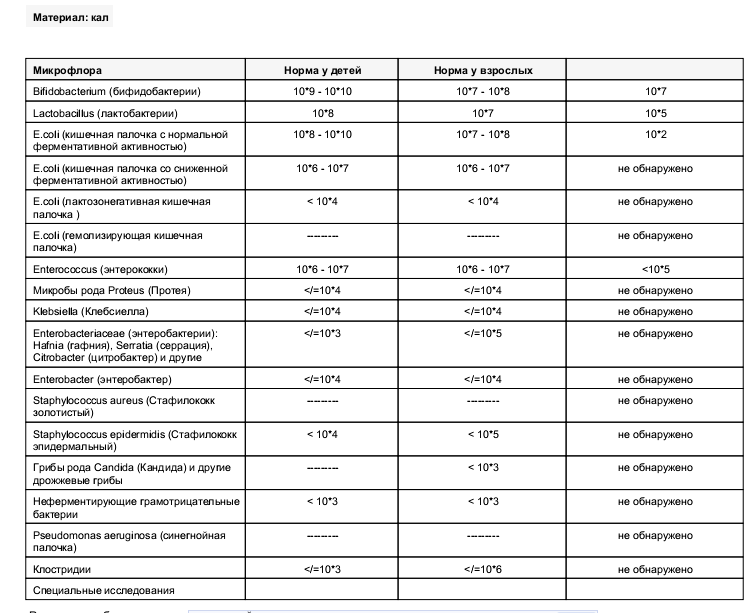 Одна реакция ПЦР содержала по 500 нМ каждого праймера (338F-M13 и 1044R-rM13), 2× DreamTaq PCR Master Mix и 50 нг матричной гДНК. Реакцию ПЦР проводили в двух повторностях с использованием термоциклера peqSTAR 2× Gradient Thermocycler (Peqlab Biotechnology). Условия ПЦР: 95°С в течение 10 минут, затем 20 циклов при 95°С в течение 30 секунд, 55°С в течение 30 секунд и 72°С в течение 45 секунд и конечная стадия элонгации при 72°С в течение 10 минут. Повторные реакции объединяли и загружали в 1% агарозный гель для подтверждения успешной ПЦР-амплификации.После очистки продуктов ПЦР с использованием геля NucleoSpin и набора для очистки ПЦР в соответствии с инструкциями производителя концентрацию и качество очищенных продуктов ПЦР оценивали с помощью Nanodrop (Peqlab Biotechnology). Чтобы штрих-кодировать каждый продукт ПЦР определенной последовательностью MID и добавить 454-специфичную метку Lib-L, вторую ПЦР проводили с использованием M13/rM13-специфичных праймеров, содержащих 454-специфичные праймеры Lib-L (подчеркнуты) A-M13 (CCATCTCATCCCTGCGTGTCTCCGACTCAG).
Одна реакция ПЦР содержала по 500 нМ каждого праймера (338F-M13 и 1044R-rM13), 2× DreamTaq PCR Master Mix и 50 нг матричной гДНК. Реакцию ПЦР проводили в двух повторностях с использованием термоциклера peqSTAR 2× Gradient Thermocycler (Peqlab Biotechnology). Условия ПЦР: 95°С в течение 10 минут, затем 20 циклов при 95°С в течение 30 секунд, 55°С в течение 30 секунд и 72°С в течение 45 секунд и конечная стадия элонгации при 72°С в течение 10 минут. Повторные реакции объединяли и загружали в 1% агарозный гель для подтверждения успешной ПЦР-амплификации.После очистки продуктов ПЦР с использованием геля NucleoSpin и набора для очистки ПЦР в соответствии с инструкциями производителя концентрацию и качество очищенных продуктов ПЦР оценивали с помощью Nanodrop (Peqlab Biotechnology). Чтобы штрих-кодировать каждый продукт ПЦР определенной последовательностью MID и добавить 454-специфичную метку Lib-L, вторую ПЦР проводили с использованием M13/rM13-специфичных праймеров, содержащих 454-специфичные праймеры Lib-L (подчеркнуты) A-M13 (CCATCTCATCCCTGCGTGTCTCCGACTCAG).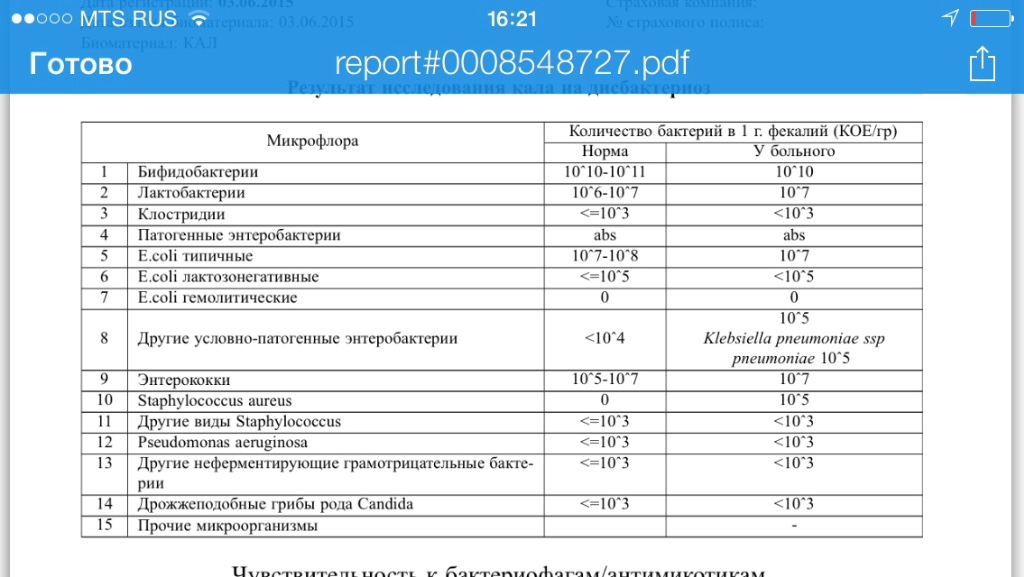 /MIDsequence/ GTAAACGACGGCCAGG ) и B-rM13 ( CCTATCCCCTGTGTGCCTTGGCAGTCTCAGGGAAACAGCTATGA CCATGA ).40 различных штрих-кодов MID размером 10 п.н., исправляющих ошибки, для мультиплексирования перечислены в таблице 3. ПЦР проводили с использованием 400 нМ каждого праймера (A-M13 и B-rM13). Ампликоны второй ПЦР объединяли и очищали осаждением этанолом. Очищенные продукты ПЦР помещали в 0,8% агарозный гель, вырезали полосы, соответствующие последовательностям гена 16S рРНК со штрих-кодом, и экстрагировали ДНК с использованием геля NucleoSpin и набора для очистки ПЦР. ДНК элюировали в ddH 2 O, дополнительно очищали с использованием AMPure Beads (Beckman Coulter, Inc., Brea, CA) и, наконец, ресуспендировали в ddH 2 O. Концентрацию и качество очищенных последовательностей со штрих-кодом оценивали с использованием Nanodrop (Peqlab Biotechnology). Образцы хранили при -20°С. Секвенирование ампликона выполняли в Eurofins на платформе 454 GS FLX Titanium с одной стороны (Lib-L-A) в соответствии с процедурами, рекомендованными для 454 Roche (Roche, Базель, Швейцария).
/MIDsequence/ GTAAACGACGGCCAGG ) и B-rM13 ( CCTATCCCCTGTGTGCCTTGGCAGTCTCAGGGAAACAGCTATGA CCATGA ).40 различных штрих-кодов MID размером 10 п.н., исправляющих ошибки, для мультиплексирования перечислены в таблице 3. ПЦР проводили с использованием 400 нМ каждого праймера (A-M13 и B-rM13). Ампликоны второй ПЦР объединяли и очищали осаждением этанолом. Очищенные продукты ПЦР помещали в 0,8% агарозный гель, вырезали полосы, соответствующие последовательностям гена 16S рРНК со штрих-кодом, и экстрагировали ДНК с использованием геля NucleoSpin и набора для очистки ПЦР. ДНК элюировали в ddH 2 O, дополнительно очищали с использованием AMPure Beads (Beckman Coulter, Inc., Brea, CA) и, наконец, ресуспендировали в ddH 2 O. Концентрацию и качество очищенных последовательностей со штрих-кодом оценивали с использованием Nanodrop (Peqlab Biotechnology). Образцы хранили при -20°С. Секвенирование ампликона выполняли в Eurofins на платформе 454 GS FLX Titanium с одной стороны (Lib-L-A) в соответствии с процедурами, рекомендованными для 454 Roche (Roche, Базель, Швейцария).
Штрих-коды MID для мультиплексирования 454
Биоинформационный анализ
Данные были проанализированы, как описано недавно. 32 Вкратце, необработанные последовательности были предварительно обработаны с использованием FASTX-Toolkit и UCHIME. Последовательности, прошедшие фильтрацию качества (минимальное качество 20), были демультиплексированы и обрезаны для удаления коротких ридов (минимальная длина 100). Последовательности проверяли на наличие химер (UCHIME; стандартные параметры) с использованием справочной базы данных microbiomeutils (r20110519). Самостоятельно написанный сценарий создал файл сопоставления и файл fastA, которые использовались в качестве входных данных для Quantitative Insights in Microbial Ecology (QIIME).
Обработка
Последовательности анализировали с использованием пакета QIIME. Последовательности были отнесены к рабочим таксономическим единицам с 97% попарной идентичностью, а затем таксономически классифицированы с использованием классификатора RDP. На диаграммах показано относительное обилие таксонов на уровне типов в наборах данных (среднее значение ± стандартная ошибка среднего; n = 5). Репрезентативный набор последовательностей был выровнен с использованием PyNAST. Выравнивание использовалось для построения филогенетического дерева с помощью FastTree. Дерево использовалось для расчета расстояний UniFrac между образцами. 33 PERMANOVA 34 использовался для проверки статистической значимости группировок образцов на основе различных матриц расстояний UniFrac. Для измерений α -разнообразия был выполнен анализ разрежения для расчетного количества видов в каждой пробе с использованием алгоритма наблюдаемых видов в QIIME.
На диаграммах показано относительное обилие таксонов на уровне типов в наборах данных (среднее значение ± стандартная ошибка среднего; n = 5). Репрезентативный набор последовательностей был выровнен с использованием PyNAST. Выравнивание использовалось для построения филогенетического дерева с помощью FastTree. Дерево использовалось для расчета расстояний UniFrac между образцами. 33 PERMANOVA 34 использовался для проверки статистической значимости группировок образцов на основе различных матриц расстояний UniFrac. Для измерений α -разнообразия был выполнен анализ разрежения для расчетного количества видов в каждой пробе с использованием алгоритма наблюдаемых видов в QIIME.
Оценка ткани
Части почки, подвздошной кишки и толстой кишки фиксировали в 10% формалине в PBS и заливали в парафин; Срезы 4- мк м окрашивали периодической кислотой–реактивом Шиффа.Для ультраструктурного анализа образцы толстой кишки 8-недельных обработанных и необработанных мышей вырезали и фиксировали в 0,1 М буфере PBS (pH 7,4), дополненном 0,4% параформальдегидом и 2% глутаральдегидом. Полимеризацию (с использованием свежей смолы Epon) проводили при 60°С в течение 24 часов, как описано. 35 В качестве первичных антител для иммунного окрашивания использовали следующие антитела: козьи анти-ZO-1 и кроличьи антиокклюдиновые (ab1 и ab64482 соответственно; Abcam, Inc., Кембридж, Массачусетс).
Полимеризацию (с использованием свежей смолы Epon) проводили при 60°С в течение 24 часов, как описано. 35 В качестве первичных антител для иммунного окрашивания использовали следующие антитела: козьи анти-ZO-1 и кроличьи антиокклюдиновые (ab1 и ab64482 соответственно; Abcam, Inc., Кембридж, Массачусетс).
Количественная ОТ-ПЦР в реальном времени
Тотальную РНК выделяли с использованием набора для выделения РНК (Life Technologies, Карлсбад, Калифорния) в соответствии с инструкциями производителя, а качество РНК оценивали с использованием агарозных гелей.После выделения РНК с помощью обратной транскрипции создавали кДНК (Superscript II; Invitrogen, Carlsbad, CA). Систему обнаружения зеленого красителя SYBR использовали для количественной ПЦР в реальном времени на Light Cycler 480 (Roche) с использованием 18s рРНК в качестве гена домашнего хозяйства. Использовали ген-специфические праймеры, обработанные с помощью ансамбля-BLAST, и праймера NCBI-BLAST (Metabion, Martinsried, Germany), как указано в таблице 4. Нематричные контроли, состоящие из всех использованных реагентов, были отрицательными в отношении генов-мишеней и «домашнего хозяйства». Для снижения риска ложноположительных точек пересечения использовался алгоритм высокой достоверности.Профили кривых плавления анализировали для каждого образца для обнаружения возможных неспецифических продуктов или димеров праймеров. В качестве гена домашнего хозяйства использовали 18s РНК.
Нематричные контроли, состоящие из всех использованных реагентов, были отрицательными в отношении генов-мишеней и «домашнего хозяйства». Для снижения риска ложноположительных точек пересечения использовался алгоритм высокой достоверности.Профили кривых плавления анализировали для каждого образца для обнаружения возможных неспецифических продуктов или димеров праймеров. В качестве гена домашнего хозяйства использовали 18s РНК.
Праймеры, используемые для количественной ОТ-ПЦР в реальном времени
Выделение и проточная цитометрия органных лейкоцитов и стимулированных Т-клеток следующие антитела: анти-CD3
ε (клон 145-2C11; Becton Dickinson, Сан-Диего, Калифорния), анти-CD4 (клон RM4-5; Becton Dickinson), анти-CD8 (клон 53-6.7; Becton Dickinson), анти-CD69 (клон h2.2F3; Becton Dickinson), анти-FOXP3 (421403; BioLegend, Сан-Диего, Калифорния), анти-CD11c (клон HL3; Becton Dickinson), анти-F4/80 (клон MCA ; AbD Serotec), анти-CD86 (клон GL1; Becton Dickinson) и анти–IL-17 (ebio17B7; Becton Dickinson). Внутриклеточное окрашивание на FoxP3 и IL-17 проводили с использованием набора Cytofix/Cytoperm (Becton Dickinson). Анализ стимуляции Т-клеток проводили на клетках селезенки (примерно 10 6 ) в 200 мкл мкл буфера PBS; Добавляли 50 нг/мл ацетата форболмиристата и 1 мкг/мл мкг/мл иномицина и инкубировали при 37°C в течение 4.5 часов до окрашивания. In Vitro Исследования
Внутриклеточное окрашивание на FoxP3 и IL-17 проводили с использованием набора Cytofix/Cytoperm (Becton Dickinson). Анализ стимуляции Т-клеток проводили на клетках селезенки (примерно 10 6 ) в 200 мкл мкл буфера PBS; Добавляли 50 нг/мл ацетата форболмиристата и 1 мкг/мл мкг/мл иномицина и инкубировали при 37°C в течение 4.5 часов до окрашивания. In Vitro Исследования Индуцированные уремической сывороткой изменения сопротивления и емкости бессмертных клеток мышиной толстой кишки-26 (лот 400156–812; CLS, Эппельхайм, Германия) были проанализированы с использованием устройства для измерения импеданса субстрата электрических клеток (ECIS). (Прикладная биофизика Inc., Нью-Йорк, штат Нью-Йорк). Клетки культивировали в среде RPMI Glutamax (Life Sciences, Heidelberg, Germany) с добавлением 10% диализированного FCS (Life Sciences Heidelberg, Германия) перед посевом. Следовательно, 1.0×10 6 замороженных клеток (в 1,0 мл криосреды и 10% ДМСО в диализированной FCS) оттаивали и рекультивировали в указанных средах до слияния. Сначала для измерения ECIS лунки экспериментальной камеры предварительно покрывали на 10 минут цистеином. Во-вторых, еще одно покрытие с 0,01% коллагена (телячья кожа 1 типа) было нанесено на ночь при 4°C. Клетки из того же пассажа высевали с плотностью 600000 клеток на лунку в объеме 400 мкл л среды и инкубировали в течение ночи (37°С и 5% СО 2 ).Среду удаляли на следующий день и осторожно добавляли 360 мкл л свежей среды. Подготовленную камеру подключали к прибору ECIS (многоканальный режим) на 1 час без каких-либо манипуляций. Затем была проведена проверка частоты, а затем еще 1 час в многоканальном режиме. Для стимуляции были взяты скважины без изменений по сопротивлению. Сливающиеся монослои стимулировали 40 мкл мкл сыворотки мышей Sv129 дикого типа (АМК = 24 мг/дл) или мышей с дефицитом Col4a3 (АМК = 240 мг/дл).После стимуляции резистентность регистрировали в течение примерно 18 часов. Начальная точка временной шкалы (рис. 2Е) была установлена на момент времени, когда был достигнут почти постоянный наклон кривых сопротивления.
Сначала для измерения ECIS лунки экспериментальной камеры предварительно покрывали на 10 минут цистеином. Во-вторых, еще одно покрытие с 0,01% коллагена (телячья кожа 1 типа) было нанесено на ночь при 4°C. Клетки из того же пассажа высевали с плотностью 600000 клеток на лунку в объеме 400 мкл л среды и инкубировали в течение ночи (37°С и 5% СО 2 ).Среду удаляли на следующий день и осторожно добавляли 360 мкл л свежей среды. Подготовленную камеру подключали к прибору ECIS (многоканальный режим) на 1 час без каких-либо манипуляций. Затем была проведена проверка частоты, а затем еще 1 час в многоканальном режиме. Для стимуляции были взяты скважины без изменений по сопротивлению. Сливающиеся монослои стимулировали 40 мкл мкл сыворотки мышей Sv129 дикого типа (АМК = 24 мг/дл) или мышей с дефицитом Col4a3 (АМК = 240 мг/дл).После стимуляции резистентность регистрировали в течение примерно 18 часов. Начальная точка временной шкалы (рис. 2Е) была установлена на момент времени, когда был достигнут почти постоянный наклон кривых сопротивления.
Статистический анализ
Данные представлены как среднее ± стандартная ошибка среднего. Сравнение отдельных групп проводили с использованием тестов t или Манна-Уитни U . Нормальное распределение проверяли с помощью критерия Шапиро-Уилка. Несколько групп были проанализированы с помощью ANOVA с последующим пост-тестом Бонферрони.Считалось, что значение P <0,05 указывает на статистическую значимость. PERMANOVA на невзвешенных и взвешенных матрицах расстояний UniFrac выполнялась в QIIME.
Благодарности
Мы благодарим Dan Draganovic, Jana Mandelbaum и Mauel Diekl за квалифицированную техническую помощь.
Этот проект был поддержан медицинским факультетом Мюнхенского университета. Части этого проекта были подготовлены в качестве докторской диссертации на медицинском факультете Мюнхенского университета М.С.К.
- Copyright © 2016 Американского общества нефрологов
Ось кишечник-легкие: кишечная микробиота и воспалительные заболевания легких
03 апреля 2020 г.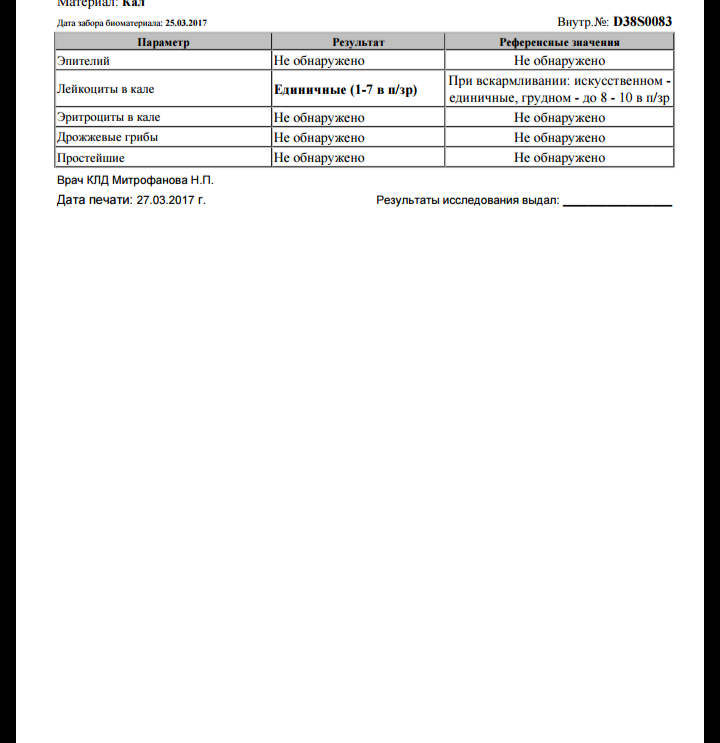
Могут ли микробы в кишечнике пациента быть скрытой причиной трудноконтролируемого воспалительного заболевания легких? Исследователи из клиники Майо работают над этим. В этом вопросе и ответе Джозеф Х. Скальски, доктор медицинских наук, пульмонология и реаниматология в клинике Майо в Рочестере, Миннесота, обсуждает ось кишечник-легкие, дисбиоз и исследования кишечной бактериальной и грибковой микробиоты у пациентов с различными обструктивными заболеваниями. фенотипы болезни.
Почему пульмонологи интересуются микробиотой кишечника?
С появлением новых методов секвенирования, не основанных на культуре, в последнее десятилетие произошел взрыв интереса к изучению микробиома человека. Исследователей-пульмонологов, естественно, интересуют микробы, живущие в легких. Однако микробиота кишечника может быть даже более важной, чем микробиота легких при некоторых легочных заболеваниях.
Хотя в настоящее время известно, что каждая поверхность тела, от легких до глазных яблок, имеет микробиом, подавляющее большинство микробного биоразнообразия находится в богатой питательными веществами среде желудочно-кишечного тракта.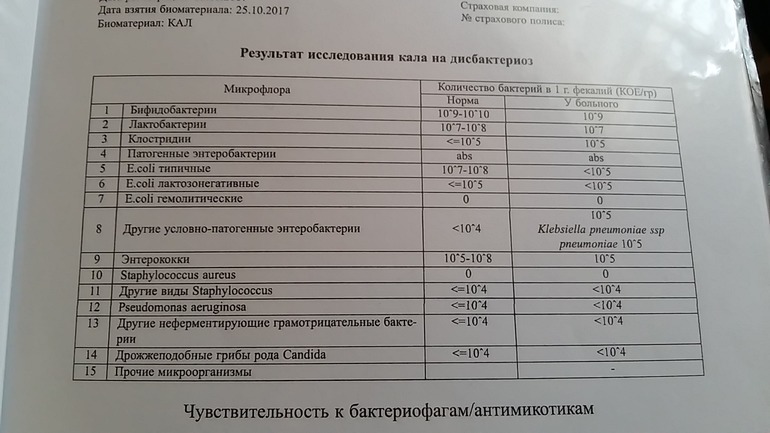 Если рассматривать микробиоту как экосистему, легкие с низким содержанием питательных веществ подобны пустыне, а кишечник, богатый питательными веществами, подобен тропическому лесу.
Если рассматривать микробиоту как экосистему, легкие с низким содержанием питательных веществ подобны пустыне, а кишечник, богатый питательными веществами, подобен тропическому лесу.
На самом деле кишечная микробиота имеет биологическую сложность, которая, вероятно, превышает собственную сложность человеческого организма: в кишечном микробиоме больше клеток и гораздо больше уникальных генных продуктов, чем во всех нативных клетках человеческого тела вместе взятых. Эти кишечные микробы образуют экосистему организмов, которые сосуществуют и конкурируют друг с другом, и все это происходит в просвете кишечника, который по сути представляет собой 25-футовую трубу, предназначенную для поглощения метаболитов.Просвет кишечника также содержит иммунные клетки хозяина, которые чувствуют и реагируют на то, что происходит внутри.
Что такое концепция оси кишечник-легкие?
Концепция оси кишечник-легкие постулирует, что изменения сообществ кишечной микробиоты могут оказывать сильное влияние на заболевания легких.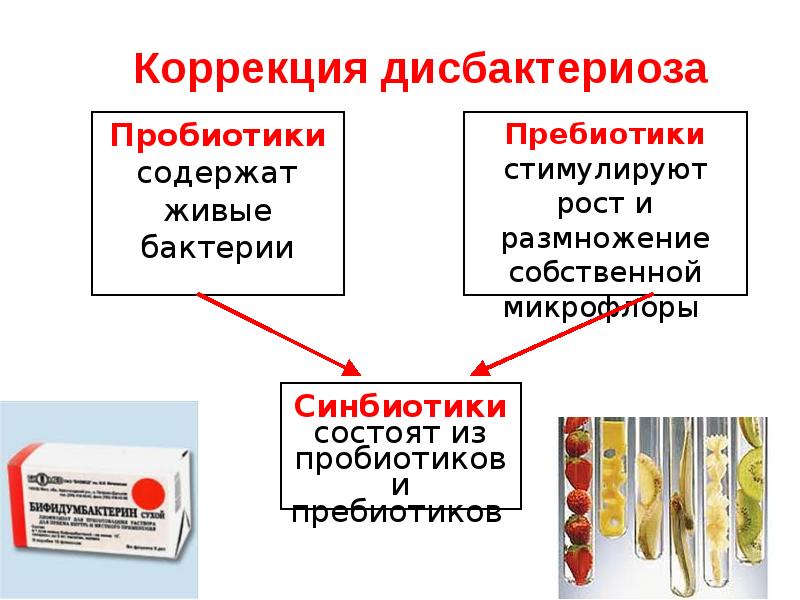 Микробы могут распознаваться иммунными клетками хозяина, что приводит к системному высвобождению цитокинов. Или, в некоторых случаях, «насекомые производят лекарства», так что биологически активные соединения выделяются микробами, всасываются в кровоток и напрямую изменяют функцию легких.
Микробы могут распознаваться иммунными клетками хозяина, что приводит к системному высвобождению цитокинов. Или, в некоторых случаях, «насекомые производят лекарства», так что биологически активные соединения выделяются микробами, всасываются в кровоток и напрямую изменяют функцию легких.
Какое значение имеет связь между грибковым дисбиозом кишечника и астмой?
Каждый человек имеет уникальный состав микробиоты. Когда микробные сообщества оказывают негативное влияние на заболевание легких, это называется дисбиозом. Дисбактериоз — это не то же самое, что кишечная инфекция, потому что он может протекать бессимптомно в течение многих лет.
Помимо бактерий, в кишечнике есть сообщество комменсальных грибов.Многие грибы, играющие важную роль при астме при вдыхании, такие как аспергиллы, пенициллы или альтернариоз, идентифицированы как компоненты кишечной микобиоты человека. Исследование, опубликованное в PLOS Pathogens в 2018 году, показало, что грибковый дисбиоз кишечника усугубляет тяжесть астмы на животных моделях. Распространение отдельных грибков, связанных с дисбактериозом, в кишечнике усиливает тяжесть астмы, при этом в легких вообще не обнаруживается грибок, что свидетельствует о перекрестных помехах между кишечником и легкими по оси кишечник-легкие.Эффект не универсален для всех видов грибов; некоторые усиливают астматическое воспаление, но другие, по-видимому, не действуют или даже могут оказывать защитное действие. Чрезмерное использование антибиотиков широкого спектра действия, по-видимому, разрушает бактериальные сообщества и может быть ключевым фактором риска развития грибкового дисбактериоза.
Распространение отдельных грибков, связанных с дисбактериозом, в кишечнике усиливает тяжесть астмы, при этом в легких вообще не обнаруживается грибок, что свидетельствует о перекрестных помехах между кишечником и легкими по оси кишечник-легкие.Эффект не универсален для всех видов грибов; некоторые усиливают астматическое воспаление, но другие, по-видимому, не действуют или даже могут оказывать защитное действие. Чрезмерное использование антибиотиков широкого спектра действия, по-видимому, разрушает бактериальные сообщества и может быть ключевым фактором риска развития грибкового дисбактериоза.
Пока никто не знает, насколько эти наблюдения важны для человека, но наша лабораторная группа изучает, может ли у некоторых пациентов с трудно поддающейся контролю астмой и хронической обструктивной болезнью легких с частыми обострениями иметься грибковый дисбиоз кишечника.
На чем сосредоточены ваши текущие исследования?
Используя некультуральные методы секвенирования 16S и ITS1, наша лабораторная группа изучает различия в бактериальной и грибковой микробиоте кишечника у пациентов с различными фенотипами обструктивных заболеваний до и после определенных терапевтических изменений. Мы надеемся, что эти исследования в конечном итоге проложат путь к клиническим испытаниям терапевтического изменения микробиоты для устранения дисбиоза у отдельных пациентов с заболеваниями легких.
Мы надеемся, что эти исследования в конечном итоге проложат путь к клиническим испытаниям терапевтического изменения микробиоты для устранения дисбиоза у отдельных пациентов с заболеваниями легких.
Однако анализ этого типа еще не готов для рутинного клинического использования. Микробиом вызвал огромный интерес у широкой публики, и в настоящее время существует несколько компаний, которые будут секвенировать микробиомы кишечника. Мы просто недостаточно знаем об оси кишечник-легкие, чтобы интерпретировать эти данные сегодня, хотя мы надеемся, что наше понимание со временем улучшится.
Для получения дополнительной информации
Skalski JH, et al.Экспансия комменсального грибка Wallemia mellicola в микобиоту желудочно-кишечного тракта усиливает тяжесть аллергического заболевания дыхательных путей у мышей. ПЛОС Патогены. 2018;20:e1007260.
Кишечные микробы и заболевания пищеварительной системы у собак
Ян Суходольский, доктор медицинских наук, доктор медицинских наук, AGAF, DACVM
Доктор Суходольский — профессор медицины мелких животных, заместитель директора по исследованиям и руководитель отдела микробиома в желудочно-кишечной лаборатории Техасского университета A&M. .Он получил степень доктора ветеринарной медицины в Венском университете, Австрия, и докторскую степень в области ветеринарной микробиологии в Техасском университете A&M. Он сертифицирован в области иммунологии Американским колледжем ветеринарных микробиологов. Его исследования сосредоточены на разработке биомаркеров желудочно-кишечных заболеваний и терапевтических подходов к модуляции кишечной микробиоты.
Кишечная микробиота включает вирусы, бактерии, грибки и простейшие. В прошлом слово микрофлора использовалось для описания этой сложной экосистемы, но микробиота (от – биос , «живые организмы») является более подходящим термином.Микробиом — это коллективный геном всех этих микробов. Большинство исследований на сегодняшний день были сосредоточены на бактериальной микробиоте, которая, по оценкам, составляет подавляющее большинство кишечной микробиоты.
По оценкам, в кишечнике находится 100 триллионов микробных клеток, что в 10 раз превышает количество клеток млекопитающих во всем организме. В совокупности микробные гены превосходят гены хозяина примерно в 10 раз.
Эта сложная экосистема кишечных бактерий оказывает огромное влияние на здоровье хозяина.Взаимодействия между бактериями и хозяином опосредованы прямым контактом микробов с иммунной системой и различными метаболитами микробиоты. Физиологический микробиом модулирует иммунную систему, защищает от энтеропатогенов и обеспечивает питательные преимущества для хозяина.
И наоборот, изменения в сложных отношениях между кишечными бактериями и клетками хозяина влияют на иммунные реакции хозяина и метаболический статус и могут привести к заболеванию ( Рисунок 1 ).В недавних исследованиях описан дисбактериоз кишечника (т.е. изменения состава и/или разнообразия кишечной микробиоты) при различных острых и хронических желудочно-кишечных (ЖКТ) заболеваниях. 1 Кроме того, первоначальные данные на моделях человека и животных связывают хронический дисбактериоз, например, вызванный воздействием антибиотиков, с внекишечными расстройствами, такими как диабет и ожирение. 2,3 Эти результаты подчеркивают важность кишечной микробиоты и дисбиоза в регуляции метаболизма хозяина, эффекты которых распространяются далеко за пределы желудочно-кишечного тракта.
Паттерны дисбиоза и метаболические признаки, наблюдаемые при острых и хронических заболеваниях ЖКТ и метаболическом синдроме, только начинают описываться. Признаки дисбиоза и метаболические изменения оцениваются на предмет их диагностического и терапевтического потенциала. В данной статье представлен обзор бактерий в кишечнике собак и роль дисбиоза в этиологии заболеваний ЖКТ.
Рисунок 1. Взаимодействие между микробиотой кишечника, иммунной системой хозяина и метаболизмом.(A) В здоровом кишечнике существует надлежащее пространственное расположение между очень многочисленной микробиотой просвета, эпителием и иммунными клетками (дендритными клетками, лимфоцитами, макрофагами, нейтрофилами), которые присутствуют в небольшом количестве. Микробиота обеспечивает иммуномодулирующие стимулы для иммунной системы, метаболизирует и ферментирует сложные углеводы в полезные короткоцепочечные жирные кислоты (КЖК). Эти SCFAs обеспечивают энергию для эндотелиальных клеток, обладают противовоспалительным действием и регулируют перистальтику кишечника.Нормальная микробиота также превращает первичные желчные кислоты во вторичные желчные кислоты, которые также обладают противовоспалительным действием, индуцируют глюкагоноподобный пептид 1 (который, в свою очередь, повышает уровень инсулина) и уменьшают, например, спорообразование Clostridium difficile. (B) В болезненном состоянии, независимо от первопричины, снижение продукции антимикробных пептидов и слизи приводит к повышению проницаемости кишечника и транслокации бактерий. Рецепторы врожденного иммунитета, такие как Toll-подобные рецепторы на макрофагах и других иммунных клетках, распознают специфические молекулярные паттерны, связанные с патогеном, вследствие дисбактериоза (например, липополисахариды в бактериальных клеточных стенках) и запускают воспалительные реакции.Макрофаги фагоцитируют микробы, вызывая также иммунные реакции, которые могут привести к окислительному стрессу. Окислительный стресс, в свою очередь, может вызвать дисбактериоз кишечника.
РЕДКАЯ ПОРОДА
У каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериального гена сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиома одинаковы у всех животных. Индивидуальные различия в микробных видах могут вызывать индивидуальную реакцию на различные диеты, источники клетчатки и пробиотики.
КИШЕЧНАЯ МИКРОБИОТА В ЗДОРОВЬЕ
Идентификация и компоненты
До недавнего времени идентификация кишечных бактерий осуществлялась почти исключительно с использованием традиционной бактериальной культуры. Культура фекалий все еще может быть полезна для обнаружения специфических энтеропатогенов, таких как Salmonella или Campylobacter jejuni , поскольку этот подход позволяет проводить тестирование чувствительности клинических образцов к антибиотикам, но подавляющее большинство кишечных бактерий являются строгими анаэробами и не обнаруживаются с помощью стандартные методы выращивания.Таким образом, рутинная бактериальная культура не позволяет подробно охарактеризовать сложные кишечные бактериальные сообщества (, рис. 2, ). В настоящее время для характеристики микробиоты кишечника используется ряд молекулярных методов. 4
Традиционные бактериальные культуры, а также молекулярные подходы выявили различия в типе и количестве бактерий в желудочно-кишечном тракте. Бактериальная численность в двенадцатиперстной кишке здоровых собак колеблется от 10 2 до 10 9 колониеобразующих единиц (КОЕ)/г. 5 В толстой кишке содержится гораздо больше, до 10 11 КОЕ/г. 6
Молекулярные инструменты позволили идентифицировать ранее не культивируемые и, следовательно, неизвестные бактерии. В то время как двенадцатиперстная кишка содержит смесь аэробных и факультативно-анаэробных бактерий, толстая кишка колонизирована почти исключительно строгими анаэробами. 7 В толстой кишке преобладают бактерии групп Clostridiaceae, Bacteroidaceae, Prevotellaceae и Fusobacteriaceae ( Рисунок 2 ).Следует отметить, что у каждой собаки есть уникальное микробное сообщество с отчетливыми различиями в пропорциях этих бактериальных групп. Тем не менее, содержание бактериального гена сохраняется у разных людей, что позволяет предположить, что функциональные аспекты микробиомов одинаковы у всех животных. 8 Тем не менее, индивидуальные различия в видах микробов могут вызывать индивидуальную реакцию на разные диеты, источники клетчатки и пробиотики.
Желудочно-кишечный тракт также является домом для разнообразных популяций вирусов и грибков.В одном исследовании описано до 40 видов грибков в образцах фекалий собак; большинство из них были различными Candida spp. 9 На основании этих результатов ожидается, что грибковые организмы будут обнаружены в обычных мазках кала. Их точный вклад в здоровье и болезни остается неясным, так как не было зарегистрировано существенных различий в типах грибков при сравнении здоровых собак с собаками с острой диареей.
Рисунок 2. Преобладающие таксоны бактерий в образцах фекалий здоровых собак.Каждая полоса представляет одну здоровую собаку. Обратите внимание, что присутствующие бактериальные семейства сильно различаются, преобладают анаэробные бактерии, и соотношение этих бактериальных групп различается у каждой здоровой собаки. Обычная бактериальная культура пропускает эти анаэробные бактерии. Мазки фекалий, которые оценивают соотношение грамположительных и грамотрицательных бактерий, также бесполезны для оценки дисбактериоза, поскольку каждая собака имеет уникальное соотношение этих групп.
роли
Сбалансированный микробиом имеет решающее значение для поддержания здоровья хозяина.Нормальная микробиота выполняет следующие функции:
- Модулирует иммунную систему
- Контролирует проникновение энтеропатогенов
- Обеспечивает хозяина питательными веществами путем метаболизма и ферментации различных пищевых компонентов
Кишечные бактерии также способствуют развитию физиологии кишечника. Это было продемонстрировано в исследованиях с выращенными мышами без микробов, которые демонстрируют измененную эпителиальную архитектуру (например, уменьшенное количество лимфоидных фолликулов) по сравнению с мышами, подвергшимися воздействию бактерий при рождении.
Постоянные перекрестные помехи между кишечной микробиотой и иммунными клетками хозяина опосредованы комбинацией метаболитов микробного происхождения (например, короткоцепочечных жирных кислот [SCFA], индола, вторичных желчных кислот), а также молекул на поверхности бактерий, которые активируют рецепторы врожденной иммунной системы хозяина (например, Toll-подобные рецепторы, дендритные клетки).
Комменсальные бактерии, которые предотвращают инвазию транзиторных патогенов через слизистую за счет конкуренции за питательные вещества и участки эпителиальной адгезии, являются важной частью кишечного барьера.Кроме того, они создают физиологически ограничительную среду для нерезидентных видов бактерий за счет секреции противомикробных соединений и модуляции рН просвета.
Основные группы бактерий в кишечнике являются строгими или факультативными анаэробами. Преобладающие семейства бактерий в толстой кишке ( Рисунок 2 ) ферментируют пищевые углеводы (например, крахмал, целлюлозу, пектин, инулин), что приводит к образованию SCFA (например, ацетата, пропионата, бутирата) и других метаболитов.SCFAs являются важным источником энергии и факторов роста эпителиальных клеток кишечника и оказывают модулирующее действие на перистальтику кишечника. Кроме того, SCFAs обладают иммуномодулирующим действием. Например, бутират индуцирует иммунорегуляторные Т-клетки, а ацетат благотворно влияет на проницаемость кишечника.
Новая область исследований направлена на то, чтобы лучше охарактеризовать биологические функции дополнительных метаболитов бактериального происхождения, которые недавно были признаны регуляторами здоровья хозяина, таких как индол и вторичные желчные кислоты.Например, пищевой триптофан метаболизируется бактериями в индол, который, как было показано, снижает экспрессию интерлейкина-8, укрепляет барьерную функцию кишечника и облегчает энтеропатию, вызванную нестероидными противовоспалительными препаратами, у мышей. 10 Некоторые виды бактерий в толстой кишке превращают первичные желчные кислоты во вторичные желчные кислоты (например, литохолевую и дезоксихолевую кислоты). Следовательно, вторичные желчные кислоты присутствуют в толстой кишке в гораздо более высоких концентрациях, чем первичные желчные кислоты.Эта высокая концентрация вторичных желчных кислот в толстой кишке полезна, поскольку эти кислоты являются важным регулятором гомеостаза хозяина посредством активации различных рецепторов по всему телу. Например, специфичный для желчных кислот мембранный рецептор TGR5 экспрессируется в желчном пузыре, в эпителии желчных протоков, на моноцитах и макрофагах, а также в клетках мышц, почек, поджелудочной железы и кишечника. Активация этих рецепторов, к которым вторичные желчные кислоты имеют наибольшее сродство, снижает экспрессию провоспалительных цитокинов и модулирует метаболизм инсулина и глюкозы посредством активации глюкагоноподобного пептида 1. 11
Вторичные желчные кислоты также подавляют прорастание спор Clostridium difficile , тогда как увеличение количества первичных желчных кислот (вследствие дисбактериоза) способствует прорастанию бактериальных спор. Кишечный дисбактериоз приводит к уменьшению числа видов бактерий, преобразующих желчные кислоты, и, следовательно, связан с дисметаболизмом желчных кислот (уменьшение вторичных и увеличение первичных желчных кислот) и потенциально системными эффектами на метаболизм хозяина. 12,13 Кроме того, аномальное увеличение первичных желчных кислот может вызвать секреторную диарею.
ДИСБИОЗ
Дисбактериоз кишечника определяется как различие в соотношении групп бактерий по сравнению с таковым у здоровых собак и часто сопровождается снижением видового разнообразия. Сообщалось о дисбактериозе кишечника при различных острых и хронических желудочно-кишечных заболеваниях, но он также может быть вызван применением антибиотиков широкого спектра действия. 1
Важность микробиоты кишечника для иммунной регуляции и метаболизма хозяина ( Рисунок 1 ) означает, что дисбиотический микробиом может иметь негативные последствия для хозяина.Однако выраженность клинических признаков у разных людей разная. Например, введение метронидазола здоровым собакам вызывало серьезные изменения в микробиоте кишечника с уменьшением количества комменсальных анаэробных бактерий и одновременным увеличением Escherichia coli ; эти изменения сопровождались обширными изменениями метаболических путей в просвете кишечника (например, усиление окислительного стресса, снижение уровня вторичных желчных кислот). 14 У девяти из 16 собак во время приема антибиотиков развился жидкий стул, но у остальных собак не было никаких клинических признаков, несмотря на схожие микробные и биохимические изменения.Это говорит о том, что клинические признаки зависят от взаимодействия множества микробных факторов и факторов хозяина, некоторые из которых (например, лежащая в основе генетическая предрасположенность хозяина, диетические и экологические триггеры) еще предстоит выяснить. Тем не менее дисбактериоз, вызванный антибиотиками, является примером того, как изменения микробного состава и метаболизма могут влиять на здоровье хозяина, поскольку дисбиоз, вызванный антибиотиками в раннем детстве, или повторная пульс-терапия признаны фактором риска развития аллергии, ожирения и воспалительных заболеваний. заболевания кишечника у человека. 3,15
Новые эпидемиологические данные о людях и наше постоянно растущее понимание иммуномодулирующих и метаболических свойств микробиоты кишечника позволяют предположить, что правильная диагностика и коррекция дисбактериоза будут важными целями при различных заболеваниях. Дисбиотический микробиом может причинять вред посредством нескольких механизмов (, вставка 1, ), которые, вероятно, действуют одновременно. Диарея может быть вызвана бактериальными энтеротоксинами, которые стимулируют секрецию слизистой жидкости. Другим недавно признанным механизмом диареи у людей является мальабсорбция желчных кислот из-за неспособности дисбиотической микробиоты преобразовывать первичные желчные кислоты во вторичные. 13 Первоначальные исследования предполагают, что такой механизм может встречаться и у собак, и требуют дальнейшего изучения. 12,16
ВСТАВКА 1 Последствия дисбактериоза
- Гиперпродукция и транслокация бактериальных токсинов
- Воспалительная стимуляция иммунной системы
- Снижение противовоспалительных метаболитов (например, SCFA, индолов, вторичных желчных кислот)
- Изменения ферментов щеточной каемки
- Повреждение рецепторов слизистой оболочки
- Конкуренция за питательные вещества (например, витамин B12)
- Повышенная кишечная проницаемость
Оценка дисбактериоза
Из-за важности комменсальной микробиоты для гомеостаза хозяина важно диагностировать дисбактериоз.Как уже отмечалось, фекальная бактериальная культура не может охарактеризовать множество анаэробов в желудочно-кишечном тракте. Подсчитано, что только очень небольшой процент кишечных бактерий можно культивировать с помощью стандартных лабораторных методов. Лучший способ полностью охарактеризовать микробиоту — использовать высокопроизводительные платформы для секвенирования, которые могут предоставить обзор пропорций всех бактериальных групп в образце; однако стоимость и длительное время выполнения работ ограничивают использование этого метода научными исследованиями. Использование полимеразной цепной реакции (ПЦР) для определения специфических бактериальных таксонов, которые последовательно изменены у собак с хроническими энтеропатиями (ХЭ), может дать более быстрые результаты. 1
Результаты этих множественных ПЦР-анализов можно объединить и выразить в виде математического отношения, индекса дисбиоза (DI; , рис. 3 ). Отрицательный DI (<0) указывает на нормальную микробиоту, тогда как положительный DI (>0) указывает на дисбактериоз, связанный с CE. 17 Затем DI можно использовать для мониторинга реакции микробиоты на терапию ХЭ. Первоначальные долгосрочные последующие исследования у собак с ХЭ предполагают, что для нормализации микробиома требуется несколько месяцев, даже если собаки реагируют в течение нескольких недель снижением показателей клинической активности. 18
Недавнее небольшое исследование, в котором оценивали 3 собак с ХЭ, использовало DI для мониторинга фекальных микробных изменений в ответ на трансплантацию фекальных микробов. 19 У всех 3 собак первоначально наблюдалось немедленное снижение ИД, но через 3 недели дисбактериоз вернулся у 1 собаки (увеличение ИД выше 2), что не показало улучшения клинических признаков. У оставшихся 2 собак наблюдалось частичное улучшение клинических признаков, и их ИД оставался ниже 0 в течение большей части 8-недельного периода наблюдения.Этот первоначальный небольшой набор данных предполагает потенциал для мониторинга микробиоты с течением времени у пациентов с ХЭ и после фекальной микробной трансплантации, но необходимы дополнительные исследования для определения точности и клинической полезности анализа микробиоты.
Анализ образцов кала дает информацию только об изменениях люминальной микробиоты. Использование флуоресцентной гибридизации in situ (FISH) образцов биопсии кишечника позволяет визуализировать, переместились ли бактерии в эпителий слизистой оболочки, как это наблюдается у собак с гранулематозным колитом. 20 Положительный результат указывает на необходимость антимикробной терапии для удаления транслоцированных бактерий. FISH требует специального анализа и доступен только в нескольких референс-лабораториях.
Хотя оценка фекальной микробиоты полезна для выявления дисбактериоза в толстой кишке, образцы кала, вероятно, не точно отражают ситуацию в тонкой кишке. Хотя образцы фекалий многих собак с заболеванием тонкой кишки показывают дисбактериоз, у части собак может быть дисбактериоз исключительно тонкой кишки.Измерения концентрации кобаламина и фолиевой кислоты в сыворотке крови остаются наиболее полезными маркерами дисбактериоза тонкой кишки. У собак с дисбактериозом тонкого кишечника может быть снижен уровень кобаламина в сыворотке крови и повышена концентрация фолиевой кислоты в сыворотке; изменение обоих параметров очень наводит на мысль о состоянии.
Недавние исследования оценили связь между дисбиозом и изменениями различных биохимических путей (например, аномальный метаболизм желчных кислот, аминокислот и триптофана), которые влияют на иммунную систему и метаболизм хозяина. 18,21 Многие новые метаболические биомаркеры, такие как концентрация фекальных желчных кислот, исследуются для лучшей оценки этиологии и лечения желудочно-кишечных заболеваний, и вскоре они могут стать полезными для повседневной практики.
Рисунок 3. Индекс дисбиоза (ИД) повышен у собак с хроническими энтеропатиями (ХЭ). DI представляет собой математическое соотношение, которое суммирует численность различных групп бактерий (например, E coli, Faecalibacterium, Blautia, Fusobacterium) в одно число.DI ниже 0 указывает на нормальную микробиоту, а DI выше 0 указывает на дисбактериоз в толстой кишке. Анализ DI коммерчески доступен в Гастроинтестинальной лаборатории Техасского университета A&M.
Терапевтические аспекты коррекции дисбактериоза
Микробиота играет важную роль в метаболизме хозяина. Недавние метаболомические исследования ясно связали дисбактериоз с различными заболеваниями внутри и вне желудочно-кишечного тракта. Однако требуется дополнительная работа, чтобы определить, как модулировать микробиом для достижения наилучшего терапевтического успеха и прогнозировать ответ на конкретную терапию.
Диета и антимикробная терапия
Дисбактериоз присутствует у многих собак с ХЭ и может быть причиной диареи у некоторых пациентов, но дисбактериоз также может быть следствием воспаления ЖКТ у других пациентов. Вероятен градиент различных моделей заболевания у пациентов, при этом иммунная система хозяина и микробиом вносят свой вклад в различной степени. Таким образом, наличие дисбактериоза не означает неотложной необходимости в антимикробной терапии, поскольку у собак с ХЭ, поддающимся лечению диетой, также может быть дисбактериоз.Некоторые животные с диареей положительно реагируют на противомикробные препараты, но у других антибиотики могут вызвать диарею. Длительное введение антибиотиков может вызвать дисбактериоз, который может создать фактор риска для различных метаболических заболеваний, например, из-за индукции дисметаболизма желчных кислот. 3 В настоящее время лучшим терапевтическим подходом к хроническим заболеваниям ЖКТ остается эмпирический, с последовательным протоколом испытаний пищевых продуктов, противовоспалительных препаратов и/или противомикробных препаратов.
Пробиотики и пребиотики
Поскольку микробиота вовлечена в патофизиологию хронических заболеваний ЖКТ, может быть целесообразным добавление пробиотической и пребиотической терапии.Пробиотики — это живые микроорганизмы, которые при введении в достаточных количествах приносят пользу здоровью хозяина. В нескольких исследованиях оценивались преимущества пробиотиков при острых и хронических заболеваниях ЖКТ. Данные свидетельствуют о том, что пробиотики оказывают лишь незначительное влияние на кишечную микробиоту, но их положительный эффект у собак с воспалительным заболеванием кишечника может быть частично обусловлен иммунной стимуляцией и/или усилением барьерной функции кишечника. 22 Также представляется, что введение более высоких доз и нескольких штаммов повышает вероятность того, что пробиотические бактерии смогут колонизировать кишечник.
Пребиотики представляют собой ферментируемые и неферментируемые волокна, которые после достижения толстой кишки метаболизируются кишечными бактериями с образованием короткоцепочечных жирных кислот и других метаболитов, которые могут оказывать иммуномодулирующее действие. Большинство коммерческих кишечных диет содержат пребиотики.
Трансплантация фекальных микробов
Трансплантация фекальных микробов вызвала большой интерес. Хотя это очень успешный терапевтический подход у людей с рецидивирующей C difficile , его использование при CE у собак требует дальнейшего изучения, поскольку патофизиология этих заболеваний различается.Неподтвержденные данные и небольшие исследования позволяют предположить, что фекальная микробная трансплантация может быть многообещающей у подмножества собак с CE, 19 , но в настоящее время правильный отбор пациентов является чисто эмпирическим, и требуются дополнительные исследования.
Ссылки
- Хоннеффер Дж.Б., Минамото Ю., Суходольский Дж.С. Изменения микробиоты при остром и хроническом воспалении желудочно-кишечного тракта у кошек и собак. World J Gastroenterol 2014; 20:16489-16497.
- Саари А., Вирта Л.Дж., Санкилампи У. и др.Воздействие антибиотиков в младенчестве и риск избыточного веса в первые 24 месяца жизни. Педиатрия 2015;135:617-626.
- Вриз А., Аут С., Фуэнтес С. и др. Влияние перорального ванкомицина на микробиоту кишечника, метаболизм желчных кислот и чувствительность к инсулину. J Гепатол 2014;60:824-831.
- Суходольский Ю.С. Диагностика и интерпретация дисбактериоза кишечника у собак и кошек. Вет J 2016; doi: 10.1016/j.tvjl.2016.04.011
- German AJ, Day MJ, Ruaux CG и др.Сравнение прямых и непрямых тестов на избыточный бактериальный рост в тонком кишечнике и диарею, реагирующую на прием антибиотиков, у собак. J Vet Intern Med 2003;17:33-43.
- Mentula S, Harmoinen J, Heikkilä M, et al. Сравнение культивируемой микробиоты тонкого кишечника и фекальной микробиоты у собак породы бигль. Appl Environ Microbiol 2005; 71:4169-4175.
- Суходольский Дж.С., Камачо Дж., Штайнер Дж.М. Анализ бактериального разнообразия в двенадцатиперстной, тощей, подвздошной и толстой кишке собак с помощью сравнительного анализа гена 16S рРНК. FEMS Microbiology Ecology 2008;66:567-578.
- Охранник БЦ, Суходольский Ю.С. Симпозиум по видам лошадей — кишечная микробиология и метагеномика собак: от филогении к функциям. J Anim Sci 2016;94:2247-2261.
- Foster ML, Dowd SE, Stephenson C, et al. Характеристика грибкового микробиома (микобиома) в образцах фекалий собак. Vet Med Int 2013;2013:658373.
- Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. Метаболит микробиоты индол уменьшает воспаление и повреждение слизистой оболочки в мышиной модели НПВП-энтеропатии. Микробы кишечника 2016;7:246-261.
- Павлидис П., Пауэлл Н., Винсент Р.П. и др. Систематический обзор: желчные кислоты и воспаление кишечника – агрессоры просвета или регуляторы защиты слизистой оболочки? Aliment Pharmacol Ther 2015; 42:802-817.
- Хоннеффер Дж., Гард Б., Штайнер Дж.М. и др. Mo1805 Нецелевой метаболомический анализ выявляет нарушение путей метаболизма желчных кислот, холестерина и триптофана у собак с идиопатическим воспалительным заболеванием кишечника. Гастроэнтерология 2015;148:С-715 (аннотация).
- Дубок Х., Райца С., Рейнто Д. и др. Связь дисбактериоза, дисметаболизма желчных кислот и воспаления кишечника при воспалительных заболеваниях кишечника. Гут 2013; 62: 531-539.
- Суходольский Дж.С., Олсон Э., Хоннеффер Дж. и соавт. Влияние диеты с гидролизованным белком и метронидазола на фекальный микробиом и метаболом у здоровых собак. J Vet Intern Med 2016;30:1455 (аннотация).
- Кокс Л.М., Блазер М.Дж. Антибиотики в раннем возрасте и ожирение. Nat Rev Endocrinol 2015; 11:182-190.
- Кент А.С., Кросс Г., Тейлор Д.Р. и др. Измерение 7альфа-гидрокси-4-холестен-3-она в сыворотке как маркера мальабсорбции желчных кислот у собак с хронической диареей: экспериментальное исследование. Vet Rec Open 2016;3:e000163.
- Alshawaqfeh M, Guard M, Minamoto Y и др. Индекс дисбактериоза для оценки микробных изменений в образцах фекалий собак с хронической энтеропатией. J Vet Intern Med 2016;30:1536 (аннотация).
- Минамото Ю., Отони К.С., Стилман С.М. и др. Изменение профилей фекальной микробиоты и метаболитов сыворотки у собак с идиопатическим воспалительным заболеванием кишечника. Микробы кишечника 2015; 6:33-47.
- Гербек З. Оценка терапевтического потенциала восстановления гомеостаза желудочно-кишечного тракта с помощью трансплантации фекальной микробиоты у собак. Магистерская работа: Университет Любляны, Словения, 2016.
- Симпсон К.В., Доган Б., Ришнив М. и др. Адгезивная и инвазивная Escherichia coli связана с гранулематозным колитом у собак-боксеров. Infect Immun 2006;74:4778-4792.
- Guard BC, Barr JW, Reddivari L, et al.Характеристика микробного дисбактериоза и метаболических изменений у собак с острой диареей. PLoS ONE 2015; 10:e0127259.
- Росси Г., Пенго Г., Калдин М. и др. Сравнение микробиологических, гистологических и иммуномодулирующих параметров в ответ на лечение комбинированной терапией преднизоном и метронидазолом или пробиотическими штаммами VSL#3 у собак с идиопатическим воспалительным заболеванием кишечника. Plos ONE 2014; 9:e94699.
Роль микробиоты кишечника в питании и здоровье
- Ana M Valdes, доцент1 2,
- Jens Walter, заведующий кафедрой питания, микробов и здоровья желудочно-кишечного тракта CAIP4,
- Eran Segal, профессор4,
- Tim D Spector, Профессор5
- 1 Школа медицины, Университет Ноттингем, городской больницы, Ноттингем NG5 1PB, Великобритания
2
2 NIHR Nottingham Биомедицинский научно-исследовательский центр, Ноттингем, Великобритания 3 отдел Сельское хозяйство, пищевые продукты и диетология и кафедра биологических наук Университета Альберты, Эдмонтон, Канада
- 1 Школа медицины, Университет Ноттингем, городской больницы, Ноттингем NG5 1PB, Великобритания
- 4 Факультет компьютерных наук и прикладной математики, Научный институт Вейцмана, Реховот, Израиль
- 5 Департамент исследований близнецов и генетической эпидемиологии, Королевский колледж Лондона, Лондон, Великобритания
- В корреспонденции: Т Д Спектор тим.spector{at}kcl.ac.uk
Ana M Valdes и коллеги обсуждают стратегии модуляции кишечной микробиоты с помощью диеты и пробиотиков
Микробиом относится к коллективным геномам микроорганизмов в определенной среде и микробиоте представляет собой сообщество самих микроорганизмов (вставка 1). Приблизительно 100 триллионов микроорганизмов (большинство из них бактерии, но также вирусы, грибы и простейшие) существуют в желудочно-кишечном тракте человека12 — теперь микробиом лучше всего рассматривать как виртуальный орган тела.Геном человека состоит примерно из 23 000 генов, в то время как микробиом кодирует более трех миллионов генов, производящих тысячи метаболитов, которые замещают многие функции хозяина13 и, следовательно, влияют на приспособленность, фенотип и здоровье хозяина.2
Box 1 ГлоссарийМикробиома — коллективные геномы микроорганизмов в определенной среде
9071 9016 — сообщество микроорганизмов сами
Microbiota Разнообразие -мера сколько различных видов и, в зависимости от индексов разнообразия, насколько равномерно они распределены в сообществе.Низкое разнообразие считается маркером дисбиоза (микробного дисбаланса) в кишечнике и обнаруживается при аутоиммунных заболеваниях, ожирении и кардиометаболических состояниях, а также у пожилых людей
Операционная таксономическая единица — определение, используемое для классификации групп близкородственных организмов. Последовательности ДНК могут быть кластеризованы в соответствии с их сходством друг с другом, а операционные таксономические единицы определяются на основе порога сходства (обычно сходство 97%), установленного исследователем
Безмикробные животные – животные, в которых или на них не живут микроорганизмы
Короткоцепочечные жирные кислоты – жирные кислоты с двумя-шестью атомами углерода, которые образуются путем бактериальной ферментации пищевых волокон
Изучение микробиоты кишечника
Исследования близнецов показали, что, хотя в микробиоте кишечника присутствует наследственный компонент, факторы окружающей среды, связанные с диетой, лекарствами и антропометрическими показателями, являются более важными детерминантами состава микробиоты.45
Кишечные микробы играют ключевую роль во многих аспектах здоровья человека, включая иммунные,6 метаболические5 и нейроповеденческие характеристики (рис. 1).78 Различные уровни доказательств подтверждают роль кишечной микробиоты в здоровье человека, полученные на животных моделях910 и в исследованиях на людях.4111213
Рис. 1Схематическое представление роли кишечной микробиоты в здоровье и заболевании с некоторыми примерами входных и выходных данных. ССЗ = сердечно-сосудистое заболевание; IPA=индолпропионовая кислота; ЛПС = липополисахарид; SCFA = жирные кислоты с короткой цепью; TMAO=триметиламин N-оксид
Модели на животных могут помочь идентифицировать кишечные микробы и механизмы, хотя степень, в которой полученные данные применимы к людям, неизвестна.У людей наблюдательные исследования могут показать перекрестные связи между микробами и признаками здоровья, но они ограничены невозможностью измерить причинно-следственные связи. Самый сильный уровень доказательств получен из интервенционных клинических исследований, в частности, рандомизированных контролируемых испытаний.
Состав кишечной микробиоты обычно количественно определяют с использованием методов на основе ДНК, таких как секвенирование следующего поколения генов 16S рибосомной РНК или секвенирование всего генома дробовиком, которые также позволяют делать выводы о функциях микробиоты.1415 Метаболические продукты микробиоты теперь можно измерить в стуле и сыворотке с помощью метаболических методов.16
Что делает микробиота кишечника?
Микробиота кишечника обеспечивает необходимые возможности для ферментации неперевариваемых субстратов, таких как пищевые волокна и эндогенная кишечная слизь. Эта ферментация поддерживает рост специализированных микробов, которые производят короткоцепочечные жирные кислоты (КЦЖК) и газы.17 Основными производимыми КЦЖК являются ацетат, пропионат и бутират.
Бутират является основным источником энергии для колоноцитов человека, может индуцировать апоптоз клеток рака толстой кишки и может активировать глюконеогенез в кишечнике, оказывая благотворное влияние на гомеостаз глюкозы и энергии.18 Бутират необходим эпителиальным клеткам для потребления большого количества кислорода через β окисления, создавая состояние гипоксии, которое поддерживает кислородный баланс в кишечнике, предотвращая дисбиоз кишечной микробиоты. обильные SCFAs и важный метаболит для роста других бактерий — достигают периферических тканей, где они используются в метаболизме холестерина и липогенезе, и могут играть роль в центральной регуляции аппетита.20 Рандомизированные контролируемые исследования показали, что более высокая выработка SCFAs коррелирует с более низким ожирением, вызванным диетой21, и со сниженной резистентностью к инсулину.22 Бутират и пропионат, но не ацетат, по-видимому, контролируют гормоны кишечника и снижают аппетит и потребление пищи у мышей.21 Микробиология кишечника ферменты участвуют в метаболизме желчных кислот, генерируя неконъюгированные и вторичные желчные кислоты, которые действуют как сигнальные молекулы и регуляторы метаболизма, влияющие на важные пути хозяина.23
Другие специфические продукты кишечной микробиоты непосредственно связаны с последствиями для здоровья человека.Примеры включают триметиламин и индолпропионовую кислоту. Производство триметиламина из диетического фосфатидилхолина и карнитина (из мяса и молочных продуктов) зависит от микробиоты кишечника, и поэтому его количество в крови варьируется у разных людей. Триметиламин окисляется в печени до N-оксида триметиламина, что положительно связано с повышенным риском атеросклероза и серьезных неблагоприятных сердечно-сосудистых событий. для снижения риска заболеваемости сахарным диабетом 2 типа.25
Микробиота кишечника и ожирение
Микробиота кишечника играет роль в развитии и прогрессировании ожирения. Большинство исследований людей с избыточным весом и ожирением показывают дисбактериоз, характеризующийся меньшим разнообразием. 31-39 Свободные от микробов мыши, которые получают фекальные микробы от людей с ожирением, набирают больше веса, чем мыши, которые получают микробы от людей со здоровым весом.4 Большое исследование близнецов в Великобритании показало, что род Christensenella редко встречается у людей с избыточным весом и когда введение стерильным мышам предотвратило увеличение веса.4 Этот микроб и другие, такие как Akkermansia , коррелируют с более низкими отложениями висцерального жира. 12 Хотя большая часть подтверждающих данных получена на моделях мышей, долгосрочное увеличение веса (более 10 лет) у людей коррелирует с низким разнообразием микробиоты, и эта связь очевидна. усугубляется низким потреблением пищевых волокон.28
Дисбиоз кишечной микробиоты, вероятно, способствует ожирению, вызванному диетой, и метаболическим осложнениям с помощью различных механизмов, включая иммунную дисрегуляцию, измененную регуляцию энергии, измененную регуляцию гормонов кишечника и провоспалительные механизмы (такие как липополисахаридные эндотоксины, проникающие через кишечник). барьер и попадание в портальную циркуляцию 2930; рис. 1 ) .
Разнообразие микробиоты и здоровье
Низкое бактериальное разнообразие воспроизводимо наблюдалось у людей с воспалительными заболеваниями кишечника,31 псориатическим артритом,32 диабетом 1 типа,33 атопической экземой,34 глютеновой болезнью,35 ожирением,36 диабетом 2 типа,37 и артериальной скованность38, чем у здоровых людей. При болезни Крона у курильщиков разнообразие кишечного микробиома еще ниже.39 Связь между уменьшенным разнообразием и заболеванием указывает на то, что богатая видами кишечная экосистема более устойчива к воздействиям окружающей среды, поскольку функционально родственные микробы в неповрежденной экосистеме могут компенсировать функцию других отсутствующих микробов. разновидность.Следовательно, разнообразие, по-видимому, в целом является хорошим показателем «здорового кишечника».4041 Но недавние интервенционные исследования показывают, что значительное увеличение количества пищевых волокон может временно уменьшить разнообразие, поскольку микробы, которые переваривают волокна, обогащаются, что приводит к изменению состава. и, посредством конкурентных взаимодействий, снижение разнообразия.22
Функциональная роль микробиома кишечника у людей была показана с помощью трансплантации фекальной микробиоты.42 Эта процедура эффективна в случаях тяжелой резистентной к лекарствам инфекции Clostridium difficile и в настоящее время используется рутинно. для этой цели по всему миру.43 Для других патологий фекальные трансплантаты еще не являются клинической практикой, но были изучены. аутологичные фекалии.45
Влияние пищевых продуктов и лекарств на микробиоту кишечника
Конкретные продукты и режимы питания могут влиять на обилие различных типов бактерий в кишечнике, что, в свою очередь, может влиять на здоровье (таблица 1).
Таблица 1Примеры пищевых продуктов, питательных веществ и режимов питания, которые влияют на здоровье человека в связи с их влиянием на микробиоту кишечника
Интенсивные подсластители обычно используются в качестве заменителей сахара, поскольку они во много раз слаще сахара при минимальной калорийности. Несмотря на то, что регулирующие органы «в целом признали их безопасными», некоторые исследования на животных показали, что эти заменители сахара могут оказывать негативное влияние на микробиоту кишечника. Было показано, что сукралоза, аспартам и сахарин нарушают баланс и разнообразие микробиоты кишечника.46 Крысы, получавшие сукралозу в течение 12 недель, имели значительно более высокие пропорции Bacteroides , Clostridia и общее количество аэробных бактерий в кишечнике, а также значительно более высокий рН фекалий, чем крысы без сукралозы.47 У мышей, получавших сукралозу в течение шести месяцев, наблюдалось увеличение экспрессия в кишечнике бактериальных провоспалительных генов и нарушенные фекальные метаболиты.48
Пищевые добавки, такие как эмульгаторы, повсеместно присутствующие в обработанных пищевых продуктах, также влияют на микробиоту кишечника у животных.49 У мышей, которых кормили относительно низкими концентрациями двух обычно используемых эмульгаторов — карбоксиметилцеллюлозы и полисорбата-80, — наблюдалось снижение микробного разнообразия по сравнению с мышами, не получавшими эмульгаторы. Bacteroidales и Verrucomicrobia были снижены, а протеобактерии, связанные со слизью, способствовали воспалению. К ним относятся некоторые строгие веганские диеты, сыроедение или диеты «чистого питания», безглютеновые диеты и диеты с низким содержанием FODMAP (ферментируемые олигосахариды, дисахариды, моносахариды и полиолы), используемые для лечения синдрома раздраженного кишечника.
Некоторые считают веганов более здоровыми, чем всеядных. Исследование 15 веганов и 16 всеядных животных выявило поразительные различия в сывороточных метаболитах, продуцируемых кишечными микробами, но очень скромные различия в сообществах кишечных бактерий. с низким содержанием жира и высоким содержанием клетчатки в течение 10 дней обнаружили очень скромное влияние на состав микробиома кишечника и отсутствие различий в производстве короткоцепочечных жирных кислот.Вместе эти данные подтверждают большую роль диеты, влияющей на метаболом, полученный из бактерий, чем просто краткосрочное бактериальное сообщество.50
Исследования на животных и в пробирке показывают, что безглютеновый хлеб снижает дисбактериоз микробиоты, наблюдаемый у людей с чувствительностью к глютену или глютеновой болезнью. 5152 Но у большинства людей, которые избегают глютена, нет глютеновой болезни или доказанной непереносимости, а недавнее крупное обсервационное исследование показало повышенный риск сердечных заболеваний у избегающих глютена, возможно, из-за снижения потребления цельного зерна.53 Одно исследование показало, что 21 здоровый человек имел существенно разные профили кишечной микробиоты после четырех недель безглютеновой диеты. У большинства людей наблюдалось более низкое содержание нескольких ключевых видов полезных микробов. с синдромом раздраженного кишечника, и реакцию на эту диету можно предсказать по фекальным бактериальным профилям.57 Диеты с низким содержанием FODMAP приводят к глубоким изменениям микробиоты и метаболома, продолжительность и клиническая значимость которых пока неизвестны.5859
Помимо диеты, лекарства являются ключевым модулятором состава микробиоты кишечника. Крупное голландско-бельгийское популяционное исследование показало, что лекарства (включая осмотические слабительные, прогестерон, ингибиторы TNF-α и рупатадин) обладают наибольшей объяснительной силой в отношении состава микробиоты (10 % вариаций в сообществе).13 Другие исследования показали серьезные эффекты обычно назначаемых ингибиторы протонной помпы на микробное сообщество, что может объяснить более высокие показатели желудочно-кишечных инфекций у людей, принимающих эти препараты.60 Антибиотики явно воздействуют на кишечные микробы, и скоту обычно дают низкие дозы для увеличения их роста и веса. Большая часть антибиотиков во многих странах используется в сельском хозяйстве, особенно при интенсивном выращивании птицы и говядины.61 Несколько обсервационных исследований на людях, а также множество исследований на грызунах указали на ожирение у людей даже в крошечных дозах, обнаруженных в продуктах питания. 61 Но у людей очень разные реакции на антибиотики, и интервенционные исследования не показали последовательных метаболических последствий.62 Пестициды и другие химические вещества обычно распыляют на пищевые продукты, но, хотя уровни могут быть высокими, в настоящее время отсутствуют убедительные доказательства их вреда для здоровья кишечника и воздействия органических продуктов питания.63
Недостаточно клинических данных, чтобы сделать четкие выводы или рекомендации для тех или иных диетических предпочтений на основе кишечной микробиоты. Но будущие исследования пищевых добавок, лекарств, а также безопасности и эффективности диетических модификаций должны учитывать эти достижения и их влияние на микробиоту кишечника.Это становится очевидным у пациентов с раком, получающих иммунохимиотерапию, реципиентов костного мозга и пациентов с аутоиммунными заболеваниями, принимающих биологические препараты, у которых небольшие изменения в их микробиоте могут вызвать серьезные изменения в их реакции.64 Более того, эксперименты на животных продемонстрировали защитное действие фитоэстрогенов. на рак молочной железы зависят от присутствия кишечных микробов (таких как Clostridium saccharogumia , Eggerthella lenta, Blautia producta, и Lactonifactor longoviformis ), которые могут преобразовывать изофлавоны в биологически активные соединения.65
Вставка 2 обобщает наши текущие знания о взаимодействии между микробиотой кишечника, питанием и здоровьем человека.
Box 2 Консенсус и неопределенностиЧто мы знаем
пробиотических добавок имеет несколько полезных эффектов на здоровье человека
Микробы в нашем кишечнике влиянием и человеческой энергии metabolism222324252627282930313233343536373839404142434445
диета и лекарства имеют сильное влияние на состав микробиоты кишечника
Состав микробиоты влияет на реакцию на химиотерапию и иммунотерапию96
Состав микробиома определяет реакцию глюкозы на продукты питания и может быть использован для персонализации диеты94
Потребление пищевых волокон влияет на микрофлору кишечника для улучшения здоровья8687104
Чего мы не знаем
Являются ли натуральные пробиотики в пище лучше пробиотических добавок? Должны ли мы принимать их профилактически?
Могут ли микробы влиять на выбор продуктов и аппетит?
Влияют ли низкие дозы антибиотиков в пищевых продуктах на здоровье человека?
Как пестициды в продуктах питания влияют на микробиом кишечника? Лучше ли органическая пища для микробиоты кишечника?
Должны ли все новые лекарства и пищевые химикаты тестироваться на кишечную микробиоту?
Управление микробиотой кишечника с помощью диеты
Изменения в микробиоте кишечника могут произойти в течение нескольких дней после изменения диеты; заметные различия были обнаружены после того, как афроамериканцы и сельские африканцы поменяли диету всего на две недели.66 Увеличение количества известных бактерий, продуцирующих бутират, у афроамериканцев, потребляющих сельскую африканскую диету, привело к увеличению производства бутирата в 2,5 раза и снижению синтеза вторичной желчной кислоты. пять дней.67 Но здоровая микробиота устойчива к временным изменениям диетических вмешательств, а это означает, что гомеостатические реакции восстанавливают первоначальный состав сообщества, как недавно было показано в случае с хлебом 68
Пребиотические продукты и пищевые волокна
Большинство национальных органов определяют пищевые волокна как съедобные углеводные полимеры с тремя или более мономерными единицами, которые устойчивы к эндогенным пищеварительным ферментам и, таким образом, не гидролизуются и не всасываются в тонком кишечнике.69 Некоторые источники пищевых волокон поддаются ферментации, что означает, что они служат субстратом для роста микробов в дистальном отделе кишечника. 70 Некоторые неперевариваемые углеводы называются «пребиотиками», которые определяются как компоненты пищи или ингредиенты, которые не усваиваются человеческим организмом, но специфически или выборочно питают полезные микроорганизмы толстой кишки (вставка 3).71 Пребиотическая концепция подвергалась критике за то, что она плохо определена и излишне узка,72 и некоторые ученые предпочитают термин «доступные для микробиоты углеводы»11. которые по существу эквивалентны ферментируемым пищевым волокнам в том смысле, что они становятся доступными в качестве субстратов для роста кишечных микробов, которые обладают необходимой ферментативной способностью для их использования.70
Box 3 Что такое пребиотики и пробиотики?Количество белков, насыщенных и ненасыщенных жиров, углеводов и пищевых волокон влияет на количество различных типов бактерий в кишечнике. Микробиоту также можно изменить, добавляя в пищу живые микроорганизмы или периодами голодания.
Пробиотики — это живые бактерии и дрожжи, которые при введении в жизнеспособной форме и в адекватных количествах полезны для здоровья человека.Их обычно добавляют в йогурты или принимают в качестве пищевых добавок.
Пребиотики определяются как субстрат, избирательно используемый микроорганизмами-хозяевами, приносящий пользу для здоровья. Хотя все соединения, считающиеся пребиотиками, представляют собой доступные для микробиоты углеводы или ферментируемые пищевые волокна, обратное неверно. Концепция пребиотиков является предметом текущих дискуссий. Eubacterium rectale ) у некоторых людей.7475 Обогащенные таксоны различаются в зависимости от типа резистентных крахмалов и других пищевых волокон,75 что указывает на то, что сдвиги зависят от химической структуры углеводов и ферментативной способности микробов получать к ним доступ. Микробы также должны «прикрепляться» к субстрату и выдерживать условия, возникающие в результате ферментации (например, низкий pH).76
Влияние доступных для микробиоты углеводов на состав микробиома желудочно-кишечного тракта может быть существенным, при этом определенные виды обогащаются, образуя более составляет более 30% фекальной микробиоты.7577 Таким образом, углеводы, доступные для микробиоты, представляют собой потенциальную стратегию для улучшения полезных членов меньшинства микробиома. Эти изменения длятся только до тех пор, пока потребляются углеводы, и они очень индивидуальны, что обеспечивает основу для персонализированных подходов. Многие краткосрочные испытания кормления очищенными пищевыми волокнами или даже рационами на основе цельных растений либо не влияют на разнообразие микробиоты, либо снижают его,22 но все же могут иметь клинические преимущества, возможно, за счет метаболитов, таких как низкоцепочечные жирные кислоты.2267
Низкое потребление клетчатки снижает выработку жирных кислот с малыми цепочками и изменяет метаболизм микробиоты желудочно-кишечного тракта в сторону использования менее благоприятных питательных веществ,78 что приводит к выработке потенциально вредных метаболитов.7980 Убедительные данные показывают, что западная диета с низким содержанием клетчатки разрушает слизистый барьер толстой кишки. , вызывая вторжение микробиоты, что приводит к восприимчивости патогенов81 и воспалению,82 обеспечивая потенциальный механизм связи западной диеты с хроническими заболеваниями.Два недавних исследования показали, что пагубное влияние диеты с высоким содержанием жиров на проницаемость слизистого слоя и метаболические функции можно предотвратить с помощью диетического введения инулина. 19 дают веские основания для обогащения потребления пищевых волокон для поддержания неповрежденной барьерной функции слизистой оболочки в кишечнике.85
Значительные данные наблюдений показывают, что потребление клетчатки полезно для здоровья человека.Два недавних метаанализа выявили четкую связь между пищевыми волокнами и пользой для здоровья при широком спектре патологий,8687 а недавнее интервенционное исследование показало, что пищевые волокна значительно снижают резистентность к инсулину у пациентов с диабетом 2 типа с четкой связью со сдвигами в микробиоте. и полезные метаболиты (такие как бутират)45.88 Пробиотики (в основном виды Bifidobacterium и Lactobacillus ) могут быть включены в различные продукты, включая продукты питания, пищевые добавки или лекарства.
Есть опасения, что большинство пищевых добавок, содержащих микробы, не могут прижиться в кишечнике и не оказывают влияния на местное население.8990 Но пробиотики могут влиять на здоровье независимо от кишечной микробиоты посредством прямого воздействия на хозяина; например, посредством иммуномодуляции или производства биоактивных соединений.Терапевтический эффект пробиотических добавок изучался при широком спектре заболеваний.
Мы провели поиск в Кокрановской библиотеке систематических обзоров по запросу «пробиотик*», получив 39 исследований, и провели поиск в Medline по запросу «систематический обзор» или «метаанализ» и «пробиотик*», получив 31 исследование. Мы включили информацию о систематических обзорах рандомизированных контролируемых исследований, опубликованных за последние пять лет, в которых основным методом лечения были пробиотики (а не пищевые добавки в целом). Только исследования, которые были сосредоточены на сравнении пробиотиков с контрольной группой, которые содержали хотя бы несколько рандомизированных контролируемых исследований среднего или высокого качества по оценке авторов систематического обзора, по результатам которых в общей сложности было проведено 22 систематических обзора (таблица 2 ) .Анализ 313 испытаний и 46 826 участников показал существенные доказательства благотворного влияния добавок пробиотиков на профилактику диареи, некротизирующего энтероколита, острых инфекций верхних дыхательных путей, обострений легких у детей с муковисцидозом и экземы у детей. Пробиотики также улучшают кардиометаболические параметры и снижают концентрацию С-реактивного белка в сыворотке крови у пациентов с диабетом 2 типа. Важно отметить, что исследования не были однородными и не обязательно соответствовали типу или дозе пробиотических добавок, а также продолжительности вмешательства, что ограничивает точные рекомендации.Новые области лечения пробиотиками включают использование новых микробов и их комбинаций, комбинирование пробиотиков и пребиотиков (синбиотиков)91 и персонализированные подходы, основанные на профилях микробов-кандидатов при воспалении, раке, метаболизме липидов или ожирении.92 Стабильное приживление пробиотика Bifidobacterium longum , например, было показано, что он зависит от индивидуальных особенностей микробиоты кишечника, что дает основание для персонализации применения пробиотиков.93
Таблица 2Резюме систематических обзоров, анализирующих роль пробиотиков в клинических результатах и будущие направления
Учитывая различия в микробиоте кишечника у разных людей, оптимальную диету человека может потребоваться адаптировать к микробиоте его кишечника.Zeevi и соавт.94 получили многомерный профиль микробиоты у 900 человек и отслеживали потребление пищи, непрерывный уровень глюкозы в крови и физическую активность в течение одной недели. Исследователи разработали алгоритм машинного обучения для прогнозирования персонализированной реакции глюкозы после еды на основе клинических данных и данных микробиома кишечника и показали, что он обеспечивает значительно более высокие прогнозы, чем такие подходы, как подсчет углеводов или оценка гликемического индекса. В последующем двойном слепом рандомизированном перекрестном исследовании с участием 26 участников персонализированные диетические вмешательства, основанные на алгоритме, успешно нормализовали уровень глюкозы в крови.94
Исследование реакции на хлеб68 с использованием рандомизированного перекрестного исследования однонедельных диетических вмешательств показало значительную межличностную изменчивость гликемической реакции на разные виды хлеба. Тип хлеба, вызывающий более низкую гликемическую реакцию у каждого человека, можно предсказать, основываясь исключительно на данных о микробиоме, собранных до вмешательства.68 Необходимо провести гораздо больше исследований, чтобы установить, осуществимы ли такие персонализированные подходы, устойчивы ли они и имеют ли они положительный эффект. на клинические исходы.
Выводы
Мы вступаем в эпоху, когда мы можем все больше изменять здоровье с помощью пищи и измерять эффекты с помощью наших микробов или метаболитов. Клетчатка является ключевым питательным веществом для здорового микробиома, и ее упускают из виду, пока бушуют дебаты о сахаре и жире. Больше нельзя игнорировать неблагоприятное воздействие на микробиом лекарств и пищевых ингредиентов, подвергшихся технологической обработке. Учитывая существующие пробелы в знаниях, нам нужны клинические данные, которые можно было бы воплотить в клинической практике, в идеале с помощью рандомизированных контролируемых исследований, в которых используются согласованные матрицы пребиотиков или пробиотиков или трансплантация фекальной микробиоты для оценки изменений в составе микробиоты кишечника и в результатах для здоровья.
Ключевые сообщения
Микробиота кишечника влияет на многие области здоровья человека, от врожденного иммунитета до аппетита и энергетического обмена
Нацеливание на микробиом кишечника с помощью пробиотиков или пищевых волокон приносит пользу здоровью человека и потенциально может снизить ожирение
Лекарства, пищевые ингредиенты, антибиотики и пестициды могут оказывать неблагоприятное воздействие на микробиоту кишечника
Микробиоту следует рассматривать как ключевой аспект питания; медицинскому сообществу следует адаптировать свои образовательные и медицинские сообщения
Потребление клетчатки связано с положительными эффектами в нескольких контекстах
недавно исследовали роль состава кишечного микробиома в кардиометаболических нарушениях.JW изучил микробную экологию микробиоты кишечника, ее роль в здоровье хозяина и то, как ее можно модулировать с помощью диеты, и сообщил о ней. ES возглавляет междисциплинарную лабораторию вычислительных биологов и ученых-экспериментаторов, специализирующихся на питании, генетике, микробиоме и их влиянии на здоровье и болезни. Его цель — разработать персонализированное питание и медицину. TDS возглавляет реестр TwinsUK и британский кишечный проект в качестве главы междисциплинарной группы, изучающей генетические, диетические и образ жизни детерминанты состава микробиома кишечника человека и его связь с распространенными заболеваниями.Все авторы внесли свой вклад, прочитали и одобрили окончательную версию.
Конкурирующие интересы: Мы прочитали и поняли политику BMJ в отношении конкурирующих интересов и заявляем следующее: AMV и TS являются консультантами Zoe Global. JW получил финансирование исследований от отраслевых источников, занимающихся производством и маркетингом пребиотиков и пищевых волокон, и является совладельцем Synbiotics Solutions, разработчика синбиотических продуктов. ES является консультантом DayTwo Inc. AMV финансируется Ноттингемским биомедицинским исследовательским центром NIHR.JW поддерживается в рамках программы Campus Alberta Innovates и грантов Канадского института исследований в области здравоохранения (CIHR), Канадского совета по естественным наукам и инженерным исследованиям (NSERC), JPI HDHL и Канадского фонда инноваций. ES поддерживается Королевским центром генома человека; Фонд Эльзы Кронер Фрезениус; Дональд Л. Шварц, Шерман-Оукс, Калифорния; Джек Н. Халперн, Нью-Йорк, штат Нью-Йорк; Лиза Стейнберг, Канада; и гранты, финансируемые Европейским исследовательским советом и Израильским научным фондом.TwinsUK финансировался Wellcome Trust; Седьмая рамочная программа Европейского сообщества (FP7/2007-2013). Исследование также получает поддержку от Центра клинических исследований биоресурсов Национального института исследований в области здравоохранения (NIHR) и Центра биомедицинских исследований, базирующихся в фонде NHS Foundation Trust Гая и Сент-Томаса и Королевском колледже Лондона.




 В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить. Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация.
В последнее время чаще говорят о дисбиозе, это нарушение функционирования и механизмов взаимодействия организма человека, его микрофлоры и окружающей среды. Почему это важно? Согласно результатам последних исследований, микрофлора заселяет практически все поверхности, все слизистые оболочки и полости тела. Конечно, большая часть живет в толстом и тонком кишечнике, но при этом 80–90% не культивируются (то есть невозможно вырастить и изучить) вне тела человека, и как следствие, о них мы практически ничего не знаем. На одну клетку человека приходится примерно 10 микробных, причем вся микрофлора несет в 150 раз больше генетической информации, чем человек. Представьте: на одну единицу «человек-информации» приходится 150 единиц «микробы-информации»! Только в таком соотношении мы можем функционировать, полноценно жить. Как известно, у человека 4 группы крови, точно так выделены 3 энтеротипа микробиоценоза человека. Каждому человеку в рамках своего энтеротипа присуща своя микробная ассоциация. Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
Энтеротип неизменен, но количество и качество поддерживающих бактерий зависит от питания, заболеваний, использования лекарств, окружающей среды.
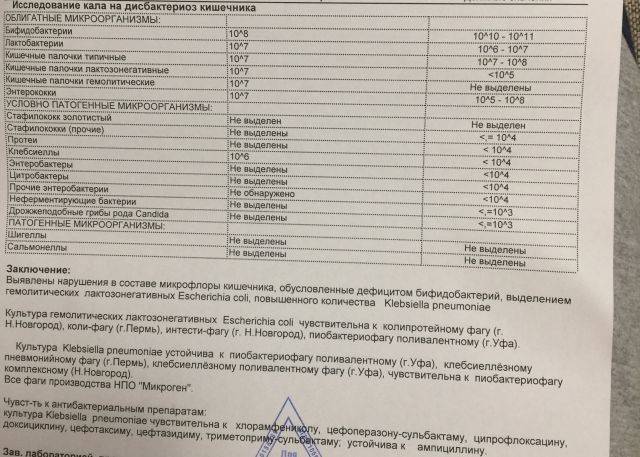
 ), прием лекарств, нерациональное питание
), прием лекарств, нерациональное питание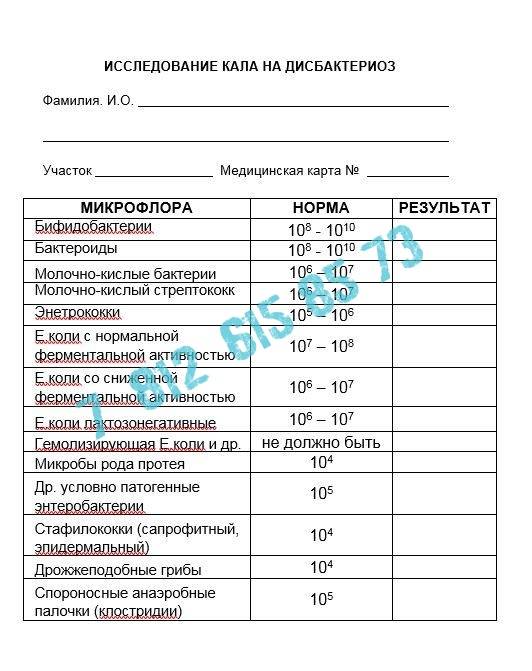 Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.
Можно по нему назначать какое-либо лечение? Нет, поэтому до 3 месяцев не рекомендуют проводить это исследование. Но после 3 месяцев микрофлора становится более или менее постоянной, и если исследование проводилось не один, а 2–3 раза, то можно более уверенно говорить об устойчивом нахождении каких-либо «нежелательных» нам бактерий.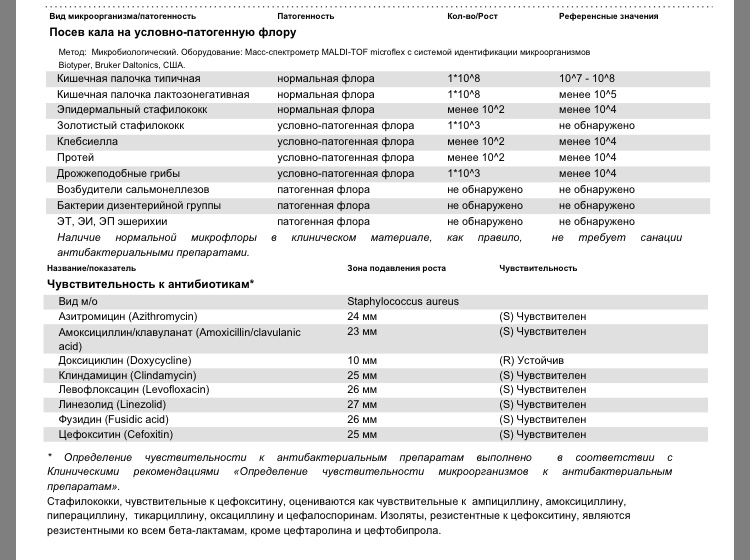 Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
Нет никакой волшебной таблетки, никаким однократным курсом лечения с дисбиозом не справиться! Курсы биопрепаратов (разные, в разное время, разные детям и взрослым), рациональное питание, иногда в помощь лекарственные препараты, и всё — только по рекомендации врача!
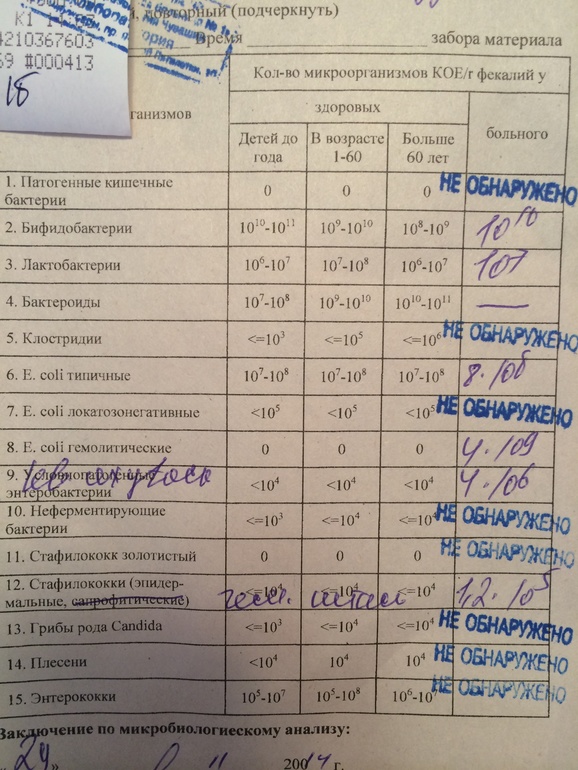 Рекомендуется производить обследование через 14 – 21 день после отмены указанных препаратов.
Рекомендуется производить обследование через 14 – 21 день после отмены указанных препаратов.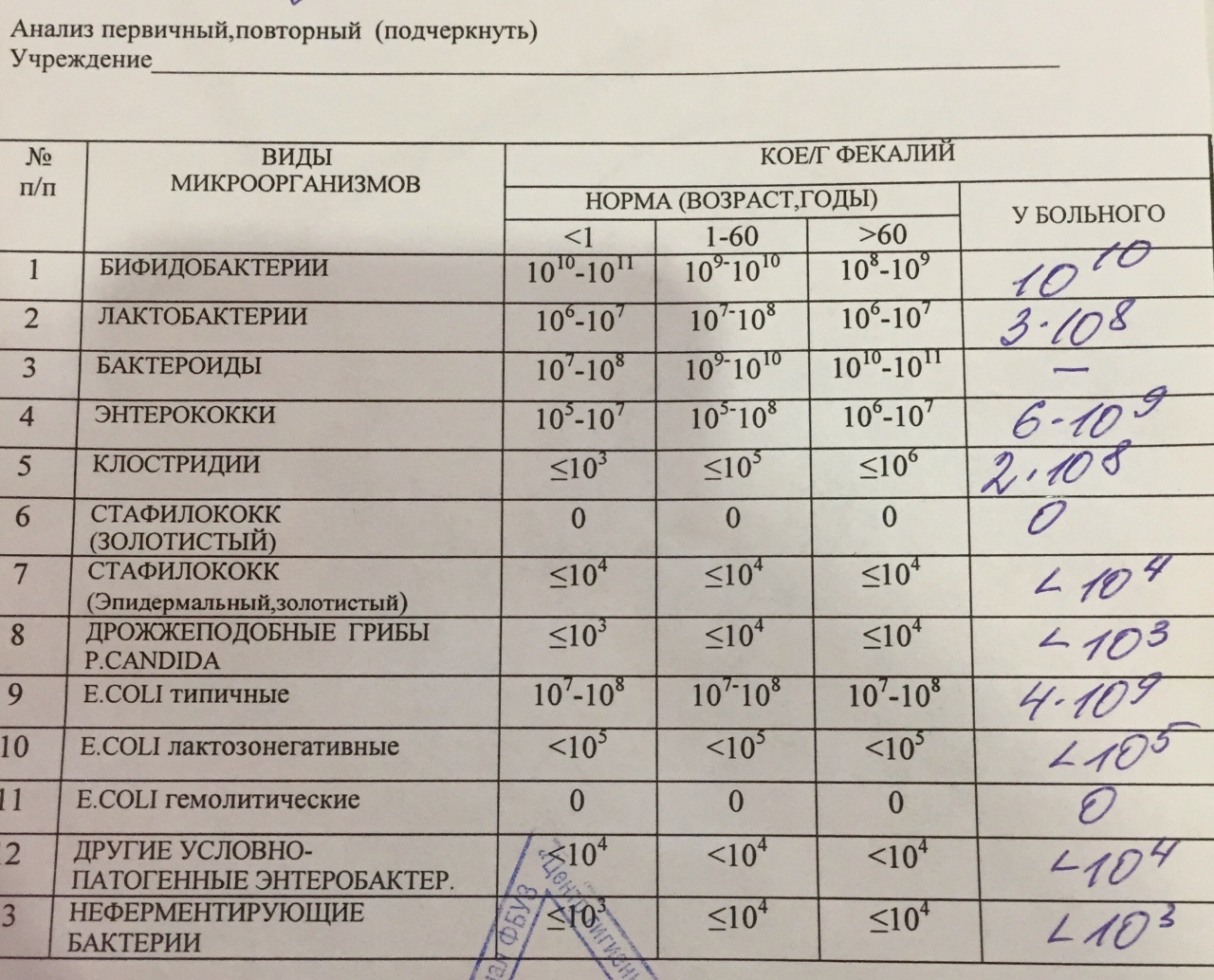 в Краснодаре, 28 адресов
в Краснодаре, 28 адресов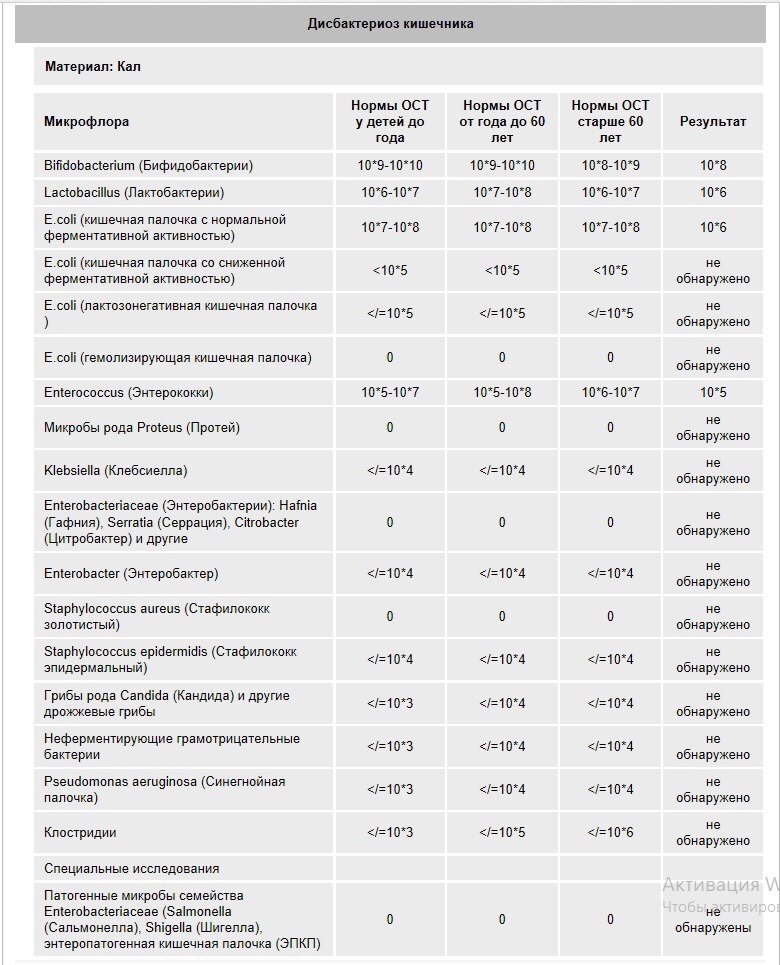
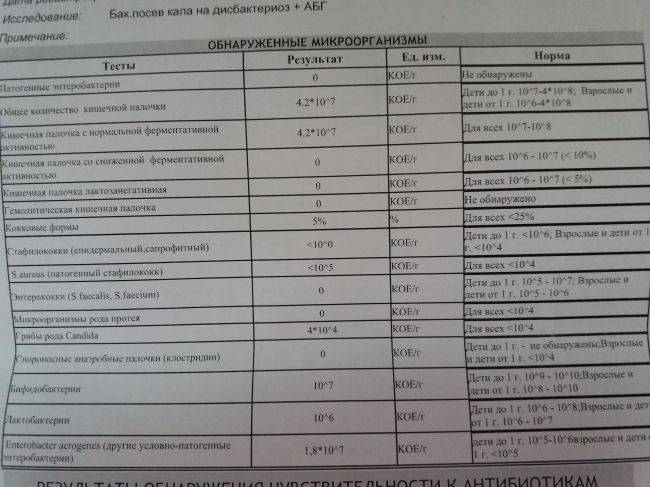
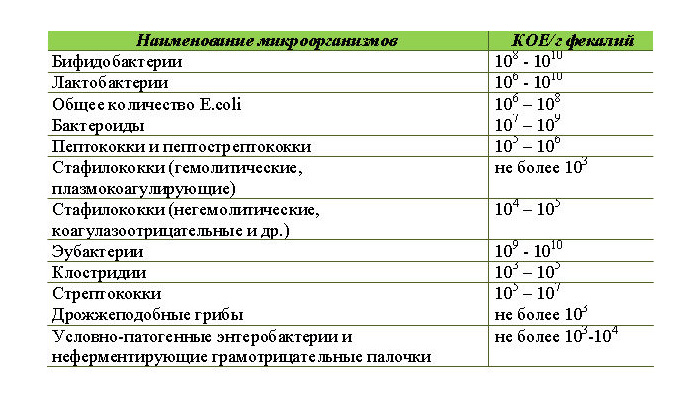

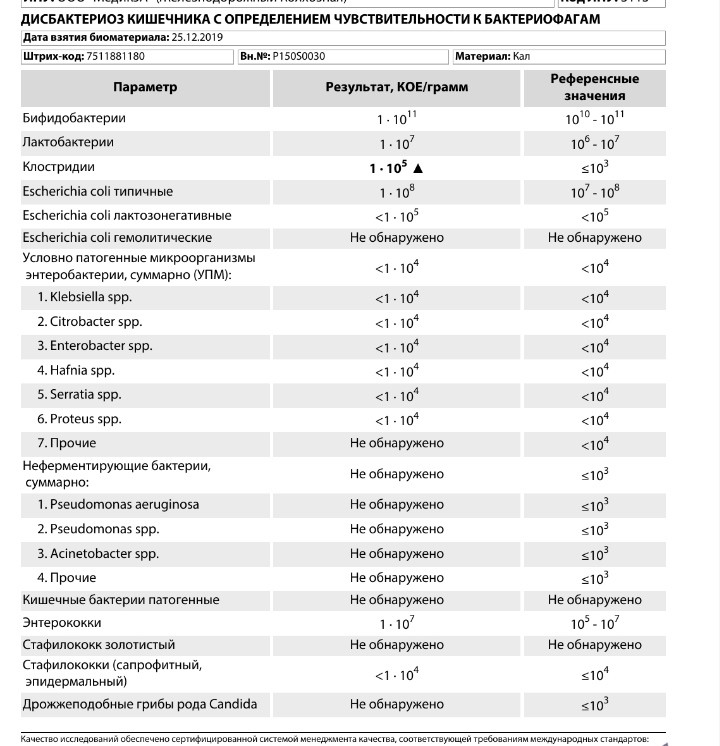

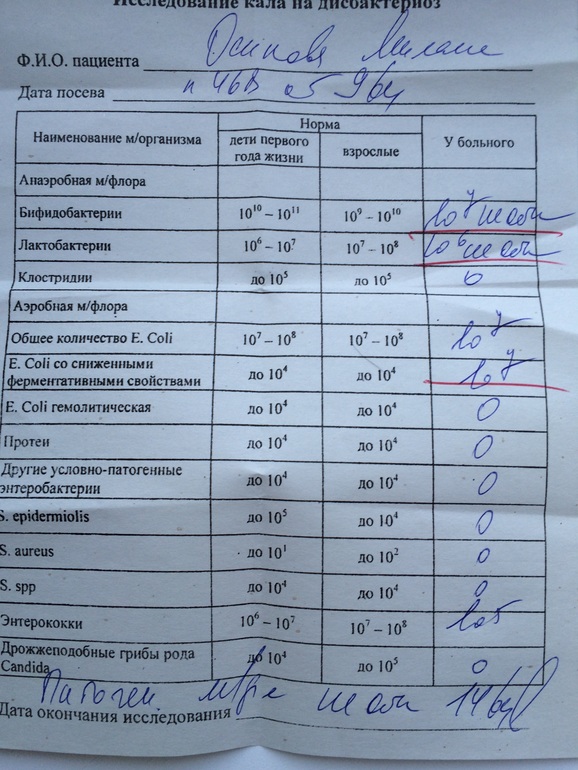





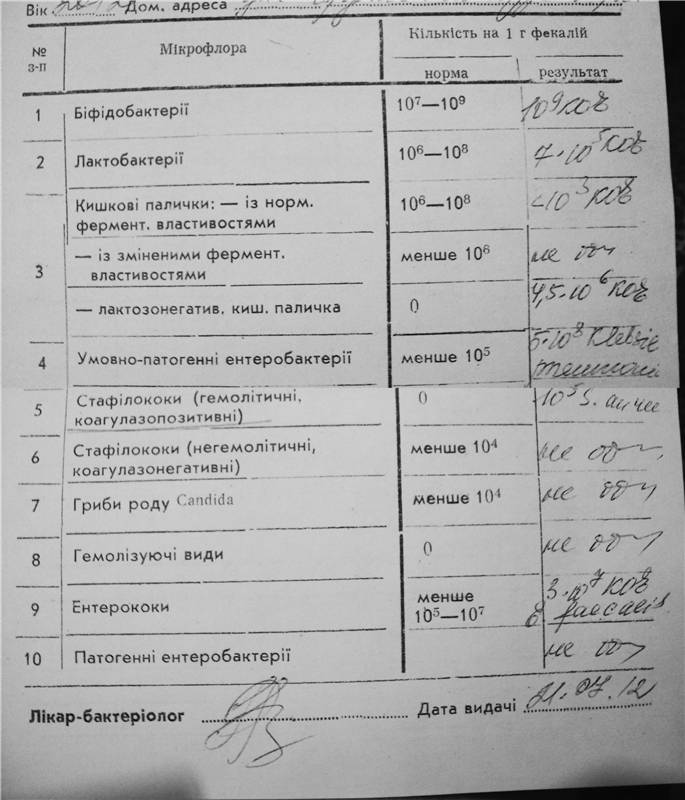
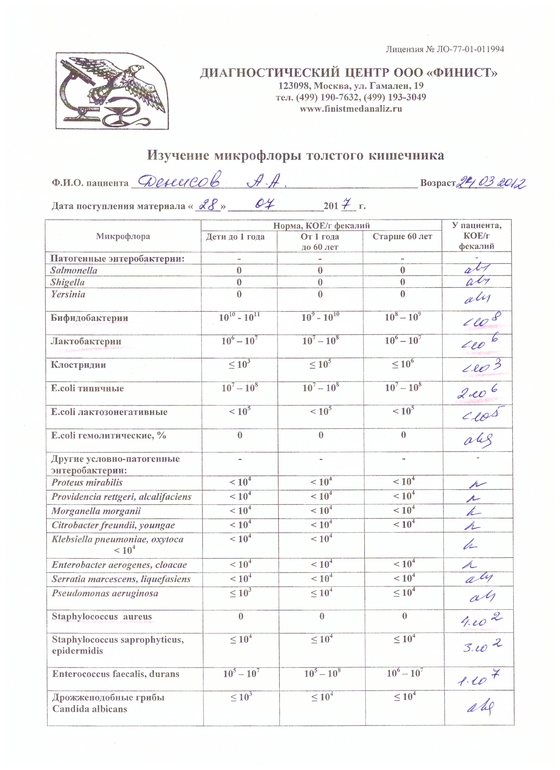

 Зиповская, д. 68
Зиповская, д. 68 118/2
118/2 203
203 86/1
86/1 Ставропольская, д. 210, лит. Д
Ставропольская, д. 210, лит. Д Совхозная, д. 1, лит. 7
Совхозная, д. 1, лит. 7 Евдокии Бершанской, д. 402/Б
Евдокии Бершанской, д. 402/Б Красных партизан, д. 6, корп. 2
Красных партизан, д. 6, корп. 2 40 лет Победы, д. 14
40 лет Победы, д. 14 Седина, д. 204
Седина, д. 204 1 Мая, д. 167
1 Мая, д. 167