Анализ на «дисбактериоз»: пожалуйста, хватит
23 мая 2018
Прилетели как-то на Землю инопланетяне. Посмотрели: ледники тают, озоновые дыры растут, панды не размножаются. Стали думать, отчего это все. Спустились в московский район Бирюлево. Взяли сотню человек, раздели, пощупали, допросили. Сделали вывод: озоновые дыры — из-за брюнетов (много их попалось), панды не размножаются из-за мужиков — их на летающей тарелке оказалось больше половины. Ну, а глобальное потепление — из-за рубля: у всех жителей Бирюлево в карманах оказалась эта валюта. Улетели инопланетяне к себе домой и по результатам исследования напечатали своими зелеными щупальцами десять кандидатских диссертаций.
Вот как-то так и проводится «анализ на дисбактериоз». Поговорим об этом диагнозе с гастроэнтерологом GMS Clinic Головенко Алексеем.
Что не так с этим исследованием? Его же так часто назначают врачи!
- Давайте оговоримся: его назначают врачи только в странах бывшего СССР.

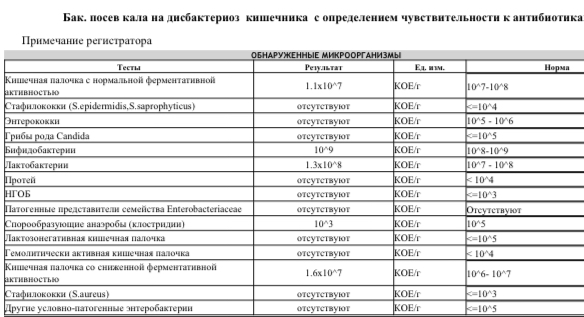
- В нашем желудочно-кишечном тракте обитает не менее 1000 (тысячи!) видов бактерий, а число всех выявленных видов составляет 2172. Выполняя «анализ кала на дисбактериоз» мы помещаем в питательную среду стул и дожидаемся роста (появления колоний) приблизительно 20 видов бактерий, которые мы выбрали только потому, что они в состоянии расти в этой питательной среде. Большая часть кишечных обитателей не культивируется, то есть увидеть своими глазами их колонии в чашке Петри мы не можем.

- Бактерии, обнаруживаемые в стуле (который формируется в толстой кишке) — это совсем не те же бактерии, что обитают в ротовой полости или тонкой кишке. Кроме того, бактерии в стуле (то есть в просвете кишки) — это совсем не бактерии, обитающие в слизи, защищающей кишечную стенку. Вообще, через наш пищеварительный тракт «пролетает» безумное количество чужеродных бактерий, грибов и вирусов. К счастью, большая их часть не могут подобраться к кишечной стенке: обитающая там пристеночная микрофлора конкурирует с «пришельцами». Мы называем это явление колонизационной резистентностью, и именно ему мы обязаны тем, что первая же проглоченная со стаканом московской воды условно-патогенная бактерия не вызывает у нас понос.

- Состав и соотношение кишечных бактерий у каждого человека свои. Изучив (не посевом кала, конечно, а сложнейшими генетическими методами) состав бактерий в стуле, можно, например, угадать принадлежит ли образец жителю Нью-Йорка или побережья Амазонки. Ну, или в каком регионе отдельной страны (например, Дании). проживает человек, отправивший на анализ свои фекалии. В общем, истинный состав кишечной микрофлоры — наши «отпечатки пальцев», и предполагать некую общую норму, а уж тем более судить о «нормальности» флоры всего по 20 видам из 1000 — смешно.
- То, будут ли размножаться бактерии на питательной среде, зависит не только от того, какие бактерии в стуле живут, но и от того, как стул собрали (с унитаза, со стерильной бумаги), как хранили (в холодильнике, у батареи, у окна), как быстро доставили в лабораторию. Много ли людей, которым рекомендовали анализ на дисбактериоз читали вот эту инструкцию, согласно которой кал нужно собрать в стерильную посуду, поместить в холодильник и нести в лабораторию не в руках, а в термосе с кубиком льда? Впрочем, даже при совершении этих действий результат анализа на дисбактериоз интерпретировать нормальный врач не может.

В питательной среде появились колонии бактерий. К счастью для нас, действительно опасная Сальмонелла растет в питательной среде. Большая часть кишечных бактерий, увы, нет.
Так что, нет такого понятия — «дисбактериоз»?
Конечно, есть. Например, псевдомембранозный колит — тяжелое воспаление толстой кишки после антибиотика — самый настоящий дисбактериоз: погибли конкуренты, и поэтому размножается Clostridium difficile. Только для того, чтобы это лечить, совершенно не нужно констатировать очевидное — состав бактерий в кишке изменился. Достаточно подтвердить инфекцию (выявить токсины C.difficile) и назначить лечение.
Кишечная микрофлора, вне сомнения, влияет на все процессы в нашем организме. Пересадив стул от мыши с ожирением мышке с нормальным весом, у последней мы вызываем ожирение. Состав кишечных бактерий принципиально разный у людей с тревожностью и депрессией.
Состав бактерий можно и нужно изучать. Этому посвящено амбициозное международное исследование Human Microbiome Project с бюджетом $115 млн. Естественно, никакие «посевы стула» при этом не используются. Для анализа микробных «джунглей» кишечника используются методы метагеномики. Они позволяют описать, сколько уникальных последовательностей ДНК присутствует у конкретного человека, какие группы бактерий преобладают, а какие отсутствуют. К слову, когда такие технологии (например, секвенирование 16S-рРНК появились, выяснилось, что 75% видов, обнаруживаемых при генетическом анализе того же кала, вообще не известны науке.
Стоп. То есть делать посев стула вообще нет смысла?
Я этого не говорил. Мы обязательно выполняем посев стула, если хотим выявить рост по-настоящему вредных бактерий. Например, у человека с кровавой диареей мы пытаемся найти Сальмонеллу или Шигеллу, Кампилобактерию или особую разновидность кишечной палочки. Здесь посев кала жизненно необходим, ведь так мы сможем назначить лечение антибиотиком — убить конкретного возбудителя.
Грамотный врач выполняет диагностический тест только тогда, когда его результат может изменить лечение. Если и при «дефиците» лактобактерий, и при «избытке» кишечной палочки будет назначено одно и то же лекарство или диета, анализ является пустой тратой денег.
Полноценное исследование собственной микрофлоры уже можно сделать на коммерческой основе в США и Европе. Стоит «удовольствие» около 100 евро, и в результате генетического анализа микрофлоры вы получите заключение (например, вот такое) о преобладающих в вашем пищеварительном тракте бактериях. Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
Проблема в том, что и эти результаты невозможно применить на практике. Потому что:
пока у нас НЕТ способа, избирательно менять состав кишечных бактерий.
Предположим, мы однозначно установили, что у человека имеется дефицит какой-то конкретной микроорганизмы (например, лактобактерий). Мы можем:
- Дать пробиотик (то есть конкретную живую бактерию) и надеяться, что она останется жить в кишечнике.
- Дать пребиотик (то есть «корм» для бактерии) и надеяться, что это усилит рост именно нужной нам бактерии.
- Дать антибиотик (яд для бактерии) и надеяться, что погибнет именно чрезмерно размножившаяся бактерия.
- Пересадить человеку чужую микрофлору — сделать трансплантацию фекальной микробиоты (ввести разбавленный стул здорового человека больному человеку).
Очевидно, избирательным действием можно считать только назначение пробиотика. Максимальная доза лучшего коммерческого пробиотика — это 10 млрд.
Ну, а главное: одно дело — теория и лабораторные исследования, другое дело — клинические испытания (то есть изучение эффекта препаратов у людей). Разберем три типовых для России ситуации, когда человеку предлагают сдать «анализ кала на дисбактериоз»:
Колики у новорожденного
Мама жалуется, что ребенок много плачет. К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
К слову, любой ребенок в первые три месяца жизни кричит от 117 до 133 минут в сутки (мета-анализ). Наличие или отсутствие колик (беспричинный крик более 3 часов за день хотя бы 3 дня в неделю), в целом, не влияет на риск задержки развития ребенка. В одном исследовании, простая беседа с родителями о «безопасности» колик уменьшала продолжительность плача с 2,6 до 0,8 часов в день. Дети — эмпаты.
Чаще бывает не так. Выполняется анализ кала на дисбактериоз, там, естественно (норма-то взята с «потолка»), обнаруживаются «отклонения». Назначается пробиотик. И часто ведь помогает: еще бы, ведь частота колик неумолимо снижается с возрастом ребенка. При этом уверенности в том, что пробиотики вообще эффективны при коликах, у нас нет. Многочисленные мета-анализы, посвященные лечению и профилактике этого состояния, не смогли однозначно подтвердить эффективность пробиотиков. Возможно, какое-то полезное действие оказывает пробиотик Lactobacillus reuteri. Вот только для того, чтобы назначить этот препарат, анализ кала на «дисбактериоз» нам совершенно не нужен.
Атопический дерматит у ребенка
Все уверены, что проблемы с кожей — от «живота». Будь это так, наверное, атопический дерматит прекрасно лечился бы пробиотиками. Но этот подход не слишком эффективен. Последний мета-анализ свидетельствует: применение пробиотиков (главным образом, Lactobacillus rhamnosus GG) несколько уменьшает выраженность экземы, но эффект этот весьма символический, а дополнительная терапия пробиотиком не позволяет сократить частоту применения местных стероидов, которые (вместе с увлажнением кожи) остаются основой лечения атопического дерматита. И вновь: назначить этот пробиотик мы можем вне зависимости от «результатов» «анализа на дисбактериоз».
Вздутие и спазмы в животе у взрослого
Вздутие живота чаще всего является проявлением избыточного бактериального роста в тонкой кишке (СИБРа), при котором помогает не пробиотик, а антибиотик, например, рифаксимин. Это состояние диагностируется при помощи специального дыхательного теста. Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Нередко постоянное вздутие живота является следствием внешнесекреторной недостаточности поджелудочной железы: дефицит ферментов в стуле можно выявить при помощи теста на фекальную эластазу, назначив при снижении постоянную терапию ферментами. Но чаще всего ощущение «вздутия» связано с повышенной чувствительностью кишки (висцеральной гиперчувствительностью), которая развивается у людей с синдромом раздраженного кишечника. Как вы уже догадались, для того, чтобы оценить количество бактерий в тонкой кишке, функцию поджелудочной железы или чувствительность кишки к растяжению, изучать 20 бактерий в кале бессмысленно. Да и эффективность пробиотиков при синдроме раздраженного кишечника вызывает сомнения.
Так нужно хоть в какой-то ситуации сдавать «кал на дисбактериоз»?
Нет. Никогда. Ни при каких обстоятельствах. Мы не лечим вздутие живота, изучая линии на ладони. Мы не лечим сыпь, глядя в хрустальный шар. Мы не делаем бессмысленный анализ на дисбактериоз, чтобы назначить лечение.
Мы ждем, когда доказательная медицина предложит нам эффективные препараты и практические способы понять, что не так с нашими бактериями.
Жду вместе с вами!
Источник: deti.mail.ru
Гастроэнтеролог Детский гастроэнтеролог
Статьи по теме
Интервальное голодание — лучший способ похудеть и лекарство от всех болезней или разрушение организма?
Сторонники лечебного голодания утверждают, что оно помогает омолодить организм и чуть ли не победить рак: в отсутствие питания организм начинает «есть сам себя», уничтожая поврежденные и больные клетки. Интервальное голодание предлагают как самую безопасную диету без ограничения порций. Елена Касимцева, семейный врач и гастроэнтеролог GMS Clinic, расскажет, действительно ли голодание очищает организм, и может ли оно навредить. Текст представлен не полностью. Всю статью вы можете прочитать на Новый Очаг.
Всю статью вы можете прочитать на Новый Очаг.
Сорбенты — что это такое и как они помогают при отравлениях
Пища — не всегда топливо для нашего организма. Нарушения технологического процесса при ее приготовлении чревато отравлениями. Как действовать при пищевом отравлении? Справиться с интоксикациями различной природы помогают сорбенты. Что такое сорбенты и зачем они нужны в домашней аптечке? Разобраться в видах лекарственных препаратов и схемах их приема поможет врач-гастроэнтеролог GMS Clinic Нурматов Шавкат Шарибжанович.
Читать статьюЧто такое сальмонеллез?
Это инфекционное заболевание, которое вызывается бактериями рода Salmonella.
Меня тошнит — что делать? Советы врачей и простые способы помочь себе
Текст предоставлен не полностью. Всю статью вы можете прочитать на РБК Стиль. Дискомфорт в области желудка, повышенное потоотделение и головокружение — частые спутники тошноты. Разбираемся, почему возникает тошнота и как от нее избавиться.
Всю статью вы можете прочитать на РБК Стиль. Дискомфорт в области желудка, повышенное потоотделение и головокружение — частые спутники тошноты. Разбираемся, почему возникает тошнота и как от нее избавиться.
Что такое болезнь Крона и сколько стоит ее лечить
Как я потратила на лечение больше 700 000 ₽.
Читать статьюПольза и вред граната для здоровья: советы врача
Текст предоставлен не полностью. Всю статью вы можете прочитать на РБК Стиль. Разбираемся, что нужно знать о гранате, чем он полезен и как его правильно выбрать?
Читать статьюДругие статьи этого автора
Разумное обследование. Синдром раздраженного кишечника: бесконечное обследование или ранний диагноз?
Гастроэнтеролог GMS Clinic Головенко Алексей в статье для Нового терапевтического журнала.
Ничего лишнего. Анализ кала на дисбактериоз: гадаем на кофейной гуще
Гастроэнтеролог GMS Clinic Головенко Алексей в своей статье для Нового терапевтического журнала рассказал о дисбактериозе.
Читать статьюИстина в еде
Гастроэнтеролог GMS Clinic Головенко Алексей дал интервью для печатного издания CITYMAGAZINE
Читать статью«У всех гастрит»: что делать, если болит желудок?
Гастроэнтеролог GMS Clinic Головенко Алексей выступил экспертом для интернет-журнала Wonderzine
Читать статьюПанкреатит: причины, симптомы и лечение
Гастроэнтеролог GMS Clinic Головенко Алексей выступил экспертом для журнала The Challenger
Читать статьюПищевое отравление: как оказать себе первую помощь
Гастроэнтеролог GMS Clinic Головенко Алексей выступил экспертом для журнала Women’s Health.
Бактериологический посев микрофлоры кишечника — что это такое и как сдать анализ
КДЦ МНИИЭМ им.Г.Н.Габричевского » Бактериология » Бактериологический посев микрофлоры кишечника
| Исследование | Цена | Как сдавать |
|---|---|---|
| Бактериологический посев на дисбактериоз кишечника с определением чувствительности бактерий к бактериофагам и противогрибковым препаратам | 1825-00 | |
| Бактериологический посев на дисбактериоз кишечника с определением чувствительности бактерий к антибиотикам, бактериофагам и противогрибковым препаратам | 2270-00 |
Что такое нормальная микрофлора кишечника?
В человеческом организме присутствует множество разнообразных микроорганизмов. Основным местом их скопления у человека является кишечник. Их число оценивается в 1014 — 1018 разнообразных микробов, а их объём занимает больше половины толстого кишечника. Это огромное число.
Это огромное число.
Учёными установлено, что в здоровом состоянии у человека микрофлора кишечника представляет сложную и сбалансированную систему из бифидобактерий, лактобактерий и кишечной палочкой с нормальными ферментными свойствами. Основной функцией микрофлоры, живущей в симбиозе с человеком, является защита организма от токсинов и вредных бактерий, выработка ферментов, необходимых для пищеварения, участие в обмене веществ, и защита от аллергенов проходящих через пищеварительный тракт.
Однако, не всё так просто, кроме полезных микробов в кишечнике присутствуют микроорганизмы, которые могут нанести вред здоровью человека в случае понижения иммунитета на фоне болезни или по иным причинам, их называют условно-патогенными (золотистый стафилококк, энтеробактерии и др. ). Другой группой, присутствующей в кишечнике, являются сапрофиты (энтерококки, дрожжи, эпидермальный и сапрофитный стафилококки и др.). Третья группа – транзитные микроорганизмы, попадающие в кишечник из внешней среды.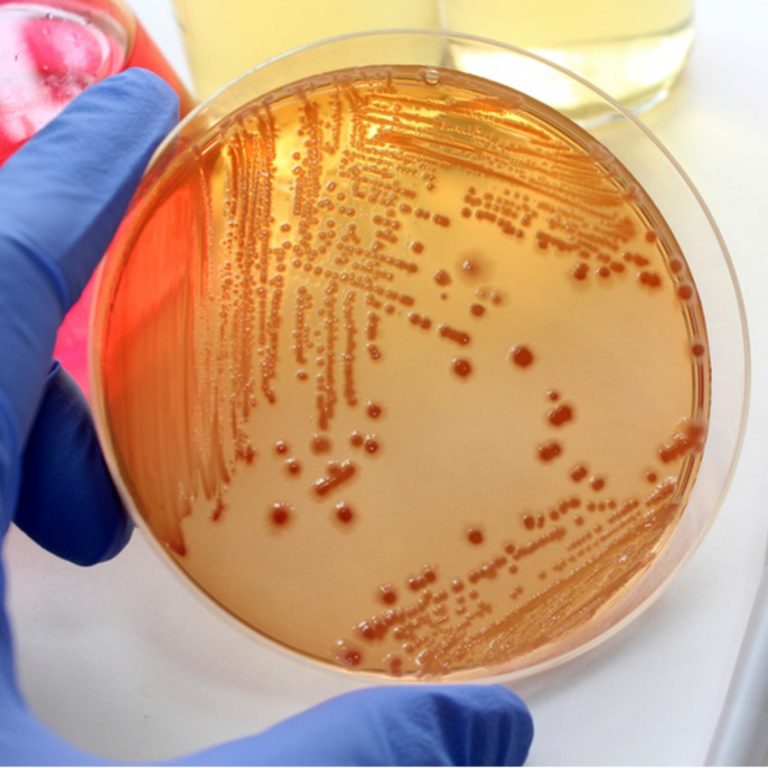 Если человек здоров, то они покидают организм без следа.
Если человек здоров, то они покидают организм без следа.
Пока флора кишечника в норме и иммунитет силён, то проблем с этими группами не возникает, однако в случае заболеваний можно столкнуться с разнообразными нарушениями микроэкологии кишечника – дисбактериозом, дисбиозом, микробиоценозом. В международной научной литературе и медицинской практике данные состояния называются — микроэкологическими нарушениями микрофлоры кишечника.
В Отраслевом стандарте «Протокол ведения больных. Дисбактериоз кишечника» (ОСТ 91500.11.0004-2003), Министерства здравоохранения РФ дано определение дисбактериоза кишечника.
Его рассматривают как клинико-лабораторный синдром, возникающий при различных заболеваниях и клинических ситуациях, характеризующихся изменениями в составе нормальной микрофлоры и появлением других различных микроорганизмов, влияющих на метаболитические и иммунные функции организма.
Подобные изменения часто несут негативный характер и отрицательно сказываются на здоровье пациента. Для полноценной диагностики и определения причин нарушений используется бактериологическое исследование на дисбактериоз.
Для полноценной диагностики и определения причин нарушений используется бактериологическое исследование на дисбактериоз.
Целью бактериологического посева на дисбактериоз является определение состава микрофлоры в месте исследования. Т.е. все присутствующие (обнаруженные ) микроорганизмы разбиваются по родам и определяется их количество в объёме исследуемого материала. В результате анализа вы сможете точно узнать какие микроорганизмы «проживают» у вас в кишечнике и в каком количестве. А это является важнейшим шагом в диагностике заболевания или иного нарушения здоровья и назначением необходимого лечения или коррекции.
Что может быть причиной НЕГАТИВНЫХ изменений микрофлоры кишечника?
Как любая сложная система организм человека подвержен влиянию множества факторов, как внешних, так и внутренних, многие из которых могут негативно влиять на микрофлору провоцировать как лёгкие, так и серьёзные нарушения здоровья.
Самые распространённые причины дисбактериоза, которые позволяет диагностировать и в дальнейшем скорректировать лечащим врачом бактериальный посев:
- Инфекционные заболевания;
- Вредные условия труда;
- Неправильное питание;
- Приём ЛЮБЫХ лекарственных средств без назначения врача;
- Воздействие аллергенов;
- Иммунные заболевания;
- Разнообразные заболевания ЖКТ;
- Бактериальные вагинозы;
- Искусственное вскармливание , мастит у матери;
- Различные возрастные изменения микрофлоры.

Для каждого из состояний свойственно особенное количественное и качественное содержание микроорганизмов в кишечнике. Проще говоря, на основании того в каком количестве, и какие микробы содержатся в кишечнике, можно делать выводы о причинах того или иного нарушения.
Как проводится посев на бактериальную флору кишечника?
Материалом для исследования служат фекалии, которые привозит пациент. С особенностями подготовки к исследованию и графиком его приёма Вы можете ознакомиться нажав на кнопку «Как сдавать» напротив нужного исследования.
После поступления в лабораторию материал проходит следующие этапы исследования:
1. Подготовка материала к посевам;
2. Посев фекалий в разнообразные, заранее подготовленные среды (девять различных сред), каждая из которых направлена на выращивание определённого вида микроорганизмов. В стандартное исследование входит определение : Кишечной палочки(нормальной, со сниженной ферментативной активностью, гемолизирующей ), Лактозонегативных энтеробактерий: Родов Протей; Клебсиелла; Цитробактер; Энтеробактер; Гафния; Серрация; Псевдомонады. Патогенных энтеробактерий : Родов Шигелла; Сальмонелла. Кокковые формы: Родов Стафилококки; Энтерококки; Стрептококки. Дрожжеподобных грибов Candida. Бифидобактерий. Лактобактерии.;
Патогенных энтеробактерий : Родов Шигелла; Сальмонелла. Кокковые формы: Родов Стафилококки; Энтерококки; Стрептококки. Дрожжеподобных грибов Candida. Бифидобактерий. Лактобактерии.;
3. Оценка специалистом лаборатории количества и вида микроорганизмов проводится в течение 5 дней. Такой срок связан с необходимостью выделения и определения разных микроорганизмов в разный период, т.к. им нужны разные температуры и время для роста;
4. При обнаружении патогенных (вредоносных) и условно-патогенных микробов проводится дополнительное исследование на их восприимчивость к различным бактериофагам, антибиотикам и противогрибковым препаратам. Если у пациента не выделены микроорганизмы, требующие постановки чувствительности к бактериофагам, антибиотикам, противогрибковым препаратам, исследование не проводится;
5. После всех этих действий результаты анализа выдаются заказчику;
Т.к. бактериологический посев является многоэтапным исследованием, связанным со сроком выделения и определения различных микроорганизмов , то для проведения полноценного анализа требуется неделя.
Интерпретация результатов.
На бланках указаны данные о норме содержания тех или иных микроорганизмов и их количестве в поступившем материале. Там же вы найдёте дополнительную информацию.
Однако, напоминаем, что правильно интерпретировать результат бактериологического посева на дисбактериоз в совокупности с другими анализами, историей болезни пациента и составить полную картину о заболевании с последующим назначением коррекции или лечения микрофлоры кишечника должен только квалифицированный врач.
Современное понимание дисбиоза при заболеваниях на моделях человека и животных
1. Bien J, Palagani V, Bozko P, et al. Дисбиоз кишечной микробиоты и инфекция Clostridium difficile : есть ли связь с воспалительным заболеванием кишечника? The Adv Гастроэнтерол. 2013; 6: 53–68. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Li J, Butcher J, Mack D, et al. Функциональные влияния микробиома кишечника в патогенезе воспалительных заболеваний кишечника. Воспалительные заболевания кишечника. 2015;21(1):139–153. [PubMed] [Google Scholar]
Воспалительные заболевания кишечника. 2015;21(1):139–153. [PubMed] [Google Scholar]
3. Shanahan F. Микробиота толстой кишки в норме и при болезни. Гастроэнтерология. 2013;29:49–54. [PubMed] [Google Scholar]
4. Knights D, Lassen K, Xavier R. Успехи в патогенезе воспалительных заболеваний кишечника: связь генетики хозяина и микробиома. Кишка. 2013;62(10):1505–10. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Clayton E, Rea M, Shanahan F, et al. Раздраженная связь между Clostridium difficile и воспалительным заболеванием кишечника: оценка носительства в амбулаторных условиях среди пациентов в стадии ремиссии. Американский журнал гастроэнтерологии. 2009 г.;104:1162–9. [PubMed] [Google Scholar]
6. Mondot S, Kang S, Furet JP, et al. Выделение новых филогенетических особенностей микробиоты болезни Крона. Воспалительные заболевания кишечника. 2011;17(1):185–92. [PubMed] [Google Scholar]
7. Shanahan F, Bernstein CN. Развитие эпидемиологии воспалительных заболеваний кишечника. Гастроэнтерология. 2009;25:301–5. [PubMed] [Google Scholar]
Гастроэнтерология. 2009;25:301–5. [PubMed] [Google Scholar]
8. Hedin C, McCarthy N, Louis P, et al. Измененная кишечная микробиота и фенотип Т-клеток крови характерны для пациентов с болезнью Крона и их здоровых братьев и сестер. Кишка. 2014;63(10):1578–86. [PubMed] [Академия Google]
9. Нгуен Г.К. Ошибки и лекарства: понимание патогенеза воспалительного заболевания кишечника. Американский журнал гастроэнтерологии. 2011;106:2143–5. [PubMed] [Google Scholar]
10. Sokol H, Lay C, Seksik P, et al. Анализ бактериальных сообществ кишечника больных ВЗК: что он выявил? Воспалительные заболевания кишечника. 2008;14(6):858–67. [PubMed] [Google Scholar]
11. Joossens M, Huys G, Cnockaert M, et al. Дисбактериоз фекальной микробиоты у больных болезнью Крона и их здоровых родственников. Кишка. 2011;60:631–637. [PubMed] [Академия Google]
12. Fava F, Danese S. Кишечная микробиота при воспалительных заболеваниях кишечника: друг врага? Всемирный журнал гастроэнтерологии. 2011;17(5):557–66. [PMC бесплатная статья] [PubMed] [Google Scholar]
2011;17(5):557–66. [PMC бесплатная статья] [PubMed] [Google Scholar]
13. Rigottier-Gois L. Дисбактериоз при воспалительных заболеваниях кишечника: кислородная гипотеза. Журнал ISME. 2013;7:1256–61. [Бесплатная статья PMC] [PubMed] [Google Scholar]
14. Duboc H, Rajca S, Rainteau D, et al. Связь дисбактериоза, дисметаболизма желчных кислот и воспаления кишечника при воспалительных заболеваниях кишечника. Кишка. 2013; 62: 531–9. [PubMed] [Google Scholar]
15. Моран С., Шихан Д., Шанахан Ф. Микробиота тонкой кишки. Гастроэнтерология. 2015;31(2):130–6. [PubMed] [Google Scholar]
16. Огилви Л.А., Джонс Б.В. Дисбактериоз модулирует способность к модификации желчных кислот в микробиоме кишечника у пациентов с воспалительным заболеванием кишечника: механизм и маркер заболевания? Кишка. 2012;61(11):1642–3. [PMC free article] [PubMed] [Google Scholar]
17. Арслан Н. Ожирение, жировая болезнь печени и микробиота кишечника. Всемирный журнал гастроэнтерологии.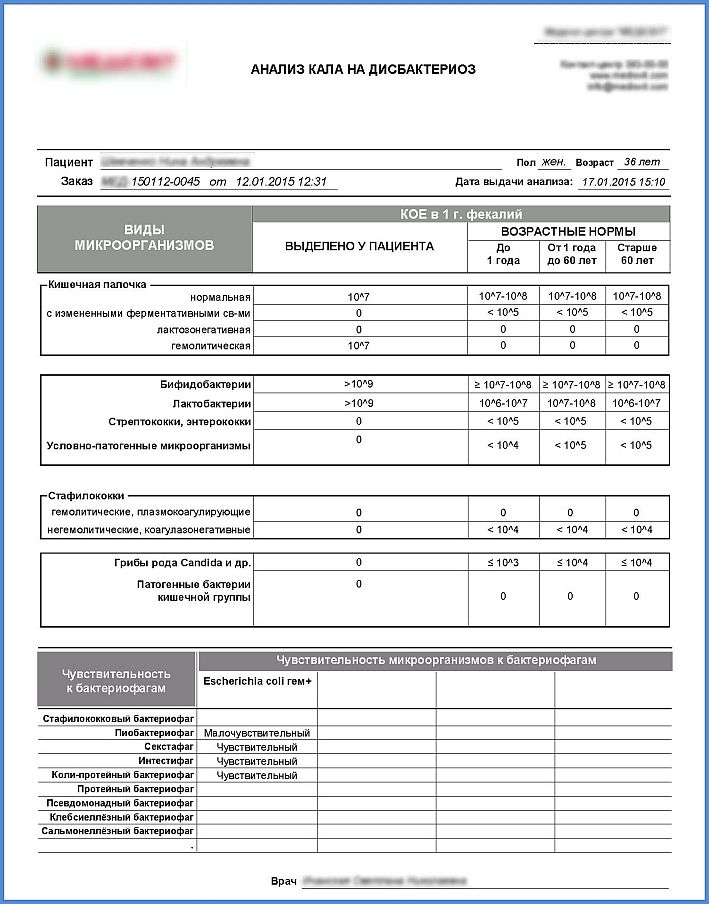 2014;20(44):16452–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014;20(44):16452–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
18. Тилг Х., Мошен А.Р. Микробиота и диабет: развивающиеся отношения. Кишка. 2014;63:1513–21. [PubMed] [Google Scholar]
19. Turnbaugh P, Ley R, Mahowald M, et al. Связанный с ожирением кишечный микробиом с повышенной способностью собирать энергию. Природа. 2006; 444:1027–31. [PubMed] [Google Scholar]
20. Ley R, Bäckhed F, Turnbaugh P, et al. Ожирение изменяет микробную экологию кишечника. Proc Natl Acad Sci USA. 2005; 102:11070–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Hildebrandt M, Hoffmann C, Sherrill-Mix S, et al. Диета с высоким содержанием жиров определяет состав микробиома кишечника мышей независимо от ожирения. Гастроэнтерология. 2009; 137:1716–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Ley R, Turnbaugh P, Klein S, et al. Микробная экология: кишечные микробы человека, связанные с ожирением. Природа. 2006; 444:1022–3. [PubMed] [Google Scholar]
23. Backhed F, Ding H, Wang T, et al. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci USA. 2004; 101:15718–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Backhed F, Ding H, Wang T, et al. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci USA. 2004; 101:15718–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
24. Turnbaugh P, Backhed F, Fulton L, et al. Ожирение, вызванное диетой, связано с заметными, но обратимыми изменениями в микробиоме дистального отдела кишечника мыши. Клеточный микроб-хозяин. 2008;3:213–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Backhed F, Manchester J, Semenkovich C, et al. Механизмы, лежащие в основе устойчивости к диетическому ожирению у безмикробных мышей. Proc Natl Acad Sci USA. 2007; 104: 979–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Vrieze A, Van Nood E, Holleman F, et al. Перенос кишечной микробиоты от худощавых доноров повышает чувствительность к инсулину у лиц с метаболическим синдромом. Гастроэнтерология. 2012;143 [PubMed] [Google Scholar]
27. Cani P, Amar J, Iglesias M, et al. Метаболическая эндотоксемия инициирует ожирение и резистентность к инсулину. Диабет. 2007; 56: 1761–72. [PubMed] [Google Scholar]
Диабет. 2007; 56: 1761–72. [PubMed] [Google Scholar]
28. Giongo A, Gano K, Crabb D, et al. К определению аутоиммунного микробиома при диабете 1 типа. ISME J. 2011; 5: 82–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. McLean MH, Dieguez D, Miller LM, et al. Играет ли микробиота роль в патогенезе аутоиммунных заболеваний? Кишка. 2014;64:332–41. [Бесплатная статья PMC] [PubMed] [Google Scholar]
30. Вен Л., Лей Р., Волчков П. и соавт. Врожденный иммунитет и кишечная микробиота в развитии сахарного диабета 1 типа. Природа. 2008; 455:1109–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Larsen N, Vogensen F, Van Den Berg F, et al. Микробиота кишечника у взрослых людей с диабетом 2 типа отличается от таковой у взрослых без диабета. ПЛОС Один. 2010;5 [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Qin J, Li Y, Cai Z, et al. Метагеномное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. 2012;490(7418):55–60. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
33. Serino M, Luche E, Gres S, et al. Метаболическая адаптация к диете с высоким содержанием жиров связана с изменением микробиоты кишечника. Кишка. 2012; 61: 543–53. [Бесплатная статья PMC] [PubMed] [Google Scholar]
34. Nielsen DS, Krych L, Buschard K, et al. Помимо генетики. Влияние диетических факторов и микробиоты кишечника на диабет 1 типа. Письма ФЭБС. 2014; 588:4234–43. [PubMed] [Google Scholar]
35. Майер Э. Внутренние чувства: новая биология связи между кишечником и мозгом. Обзоры природы Неврология. 2011;12:453–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
36. Mayer EA, Savidge T, Shulman RJ. Взаимодействия кишечно-мозгового микробиома и функциональные расстройства кишечника. Гастроэнтерология. 2014; 146:1500–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Tillisch K, Labus J, Kilpatrick L, et al. Употребление кисломолочного продукта с пробиотиком модулирует мозговую деятельность. Гастроэнтерология.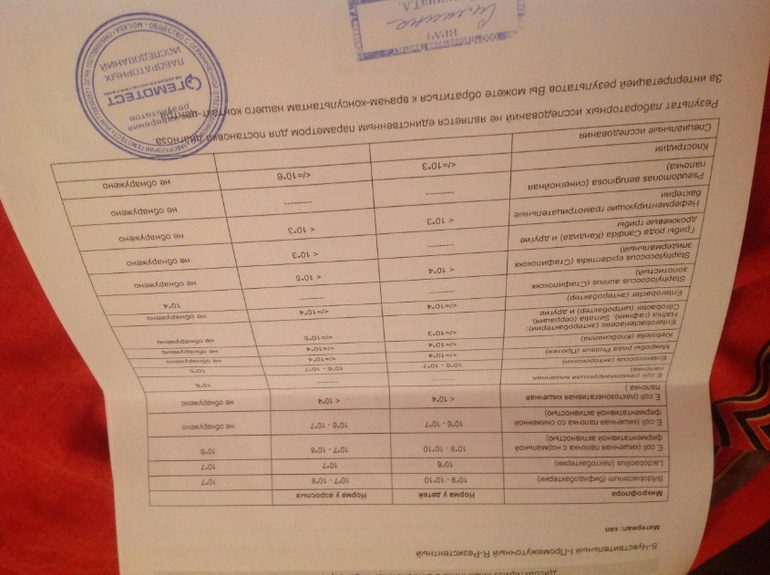 2013; 144:1394–401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2013; 144:1394–401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Bruce-Keller A, Salbaum J, Luo M, et al. Микробиота кишечника тучного типа вызывает нейроповеденческие изменения в отсутствие ожирения. Биол психиатрия. 2015;77(7):607–15. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Buie T, Fuchs G, Furuta G, et al. Рекомендации по оценке и лечению распространенных желудочно-кишечных заболеваний у детей с РАС. Педиатрия. 2010; 125 (Приложение 1): S19–29. [PubMed] [Google Scholar]
40. MacFabe D, Cain N, Boon F, et al. Влияние продукта метаболизма кишечных бактерий пропионовой кислоты на объектно-ориентированное поведение, социальное поведение, познание и нейровоспаление у крыс-подростков: отношение к расстройству аутистического спектра. Поведение мозга Res. 2011; 217:47–54. [PubMed] [Академия Google]
41. Schulz MD, Atay Ç, Heringer J, et al. Дисбактериоз, опосредованный диетой с высоким содержанием жиров, способствует канцерогенезу кишечника независимо от ожирения.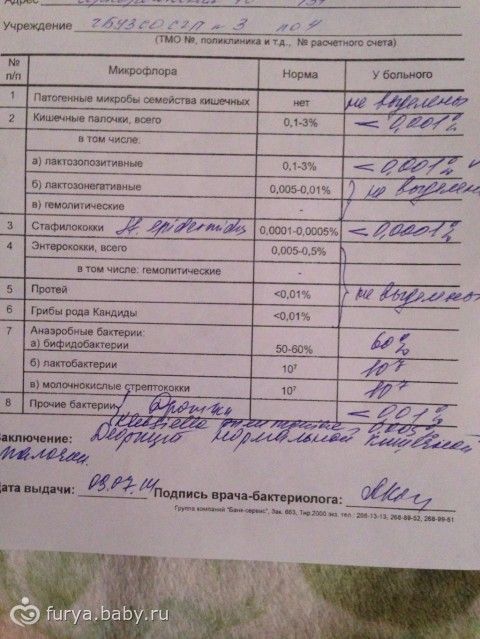 Природа. 2014; 514(7523):508–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Природа. 2014; 514(7523):508–12. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Castellarin M, Warren R, Freeman J, et al. Инфекция Fusobacterium nucleatum преобладает при колоректальной карциноме человека. Геном Res. 2012; 22: 299–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Sobhani I, Tap J, Roudot-Thoraval F, et al. Микробный дисбактериоз у больных колоректальным раком (КРР). ПЛОС Один. 2011;6(1) [бесплатная статья PMC] [PubMed] [Google Scholar]
44. Zackular JP, Baxter NT, Iverson KD, et al. Микробиом кишечника модулирует онкогенез толстой кишки. мБио. 2013;4(6) [бесплатная статья PMC] [PubMed] [Google Scholar]
45. Pagnini C, Corleto VD, Mangoni ML, et al. Изменение местной микрофлоры и гиперпродукция а-дефенсинов в слизистой аденомы толстой кишки. Журнал клинической гастроэнтерологии. 2011;45(7):602–10. [PubMed] [Google Scholar]
46. Элинав Э., Новарски Р., Тайсс С. и соавт. Рак, вызванный воспалением: взаимодействие между опухолями, иммунными клетками и микроорганизмами. Нат Рев Рак. 2013;13:759–71. [PubMed] [Google Scholar]
Нат Рев Рак. 2013;13:759–71. [PubMed] [Google Scholar]
47. Стробер В., Фусс И., Блумберг Р. Иммунология моделей воспаления слизистой оболочки. Анну Рев Иммунол. 2002; 20: 495–549. [PubMed] [Google Scholar]
48. Альбенберг Л., Ву Г. Диета и кишечный микробиом: ассоциации, функции и последствия для здоровья и болезней. Гастроэнтерология. 2014;146(6):1564–72. [Бесплатная статья PMC] [PubMed] [Google Scholar]
49. De Filippo C, Cavalieri D, Paola MD, et al. Влияние диеты на формирование микробиоты кишечника, выявленное сравнительным исследованием детей из Европы и сельских районов Африки. ПНАС. 2010;107(33):14691–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
50. Lee D, Albenberg L, Compher C, et al. Диета в патогенезе и лечении воспалительных заболеваний кишечника. Гастроэнтерология. 2015;148(6):1087–106. [Бесплатная статья PMC] [PubMed] [Google Scholar]
51. Jin D, Wu S, Zhang Y, et al. Недостаток рецептора витамина D вызывает дисбактериоз и изменяет функции кишечного микробиома мышей. Клиническая терапия. 2015;37(5):996–1009. [PubMed] [Google Scholar]
Клиническая терапия. 2015;37(5):996–1009. [PubMed] [Google Scholar]
52. Асса А., Вонг Л., Пиннелл Л. и соавт. Дефицит витамина D предрасполагает к адгезивно-инвазивной барьерной дисфункции, вызванной Escherichia coli, и экспериментальному повреждению толстой кишки. Воспалительные заболевания кишечника. 2015;21(2):297–306. [PubMed] [Google Scholar]
53. Асса А., Вонг Л., Пиннелл Л. и соавт. Дефицит витамина D способствует дисфункции эпителиального барьера и воспалению кишечника. Журнал инфекционных заболеваний. 2014;210(8):1296–305. [PubMed] [Google Scholar]
54. Ooi J, Li Y, Rogers C, et al. Витамин D регулирует микробиом кишечника и защищает мышей от колита, вызванного декстрансульфатом натрия. Журнал питания. 2013;143(10):1679–86. [Бесплатная статья PMC] [PubMed] [Google Scholar]
55. Vitaglione P, Mennella I, Ferracane R, et al. Потребление цельнозерновой пшеницы уменьшает воспаление в рандомизированном контролируемом исследовании с участием людей с избыточным весом и ожирением с нездоровым питанием и образом жизни: роль полифенолов, связанных с пищевыми волокнами злаков. Am J Clin Nutr. 2015;101(2):251–61. [PubMed] [Google Scholar]
Am J Clin Nutr. 2015;101(2):251–61. [PubMed] [Google Scholar]
56. Ben Q, Sun Y, Chai R, et al. Потребление пищевых волокон снижает риск колоректальной аденомы: метаанализ. Гастроэнтерология. 2014;146(3):689–99. [PubMed] [Академия Google]
57. Рассел В., Грац С., Дункан С. и соавт. Диеты с высоким содержанием белка и низким содержанием углеводов способствуют формированию профилей метаболитов, которые, вероятно, вредны для здоровья толстой кишки. Am J Clin Nutr. 2011;93(5):1062–72. [PubMed] [Google Scholar]
58. Chen HM, Yu YN, Wang JL, et al. Снижение потребления пищевых волокон и структурное изменение микробиоты кишечника у пациентов с прогрессирующей колоректальной аденомой. Am J Clin Nutr. 2013;97(5):1044–52. [PubMed] [Google Scholar]
59. Ou J, Carbonero F, Zoetendal E, et al. Диета, микробиота и микробные метаболиты в риске рака толстой кишки у сельских африканцев и афроамериканцев. Am J Clin Nutr. 2013;98(1):111–20. [Бесплатная статья PMC] [PubMed] [Google Scholar]
60. Jacobs E, Lanza E, Alberts D, et al. Волокно, пол и колоректальная аденома: результаты объединенного анализа. Am J Clin Nutr. 2006;83(2):343–9. [PubMed] [Google Scholar]
Jacobs E, Lanza E, Alberts D, et al. Волокно, пол и колоректальная аденома: результаты объединенного анализа. Am J Clin Nutr. 2006;83(2):343–9. [PubMed] [Google Scholar]
61. McCashland T, Brand R, Lyden E, et al. Половые различия в колоректальных полипах и опухолях. AM J Гастроэнтерол. 2001; 96: 882–6. [PubMed] [Google Scholar]
62. Nomura A, Wilkens L, Murphy S, et al. Ассоциация потребления овощей, фруктов и зерна с колоректальным раком: многоэтническое когортное исследование. Am J Clin Nutr. 2008;88(3):730–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
63. Queipo-Ortuño M, Boto-Ordóñez M, Murri M, et al. Влияние полифенолов красного вина и этанола на экологию кишечной микробиоты и биохимические биомаркеры. Am J Clin Nutr. 2012;95(6):1323–34. [PubMed] [Google Scholar]
64. Biswas A, Petnicki-Ocwieja T, Kobayashi K. Nod2: ключевой регулятор, связывающий микробиоту с иммунитетом слизистой оболочки кишечника. Журнал молекулярной медицины. 2012;90(1):15–24.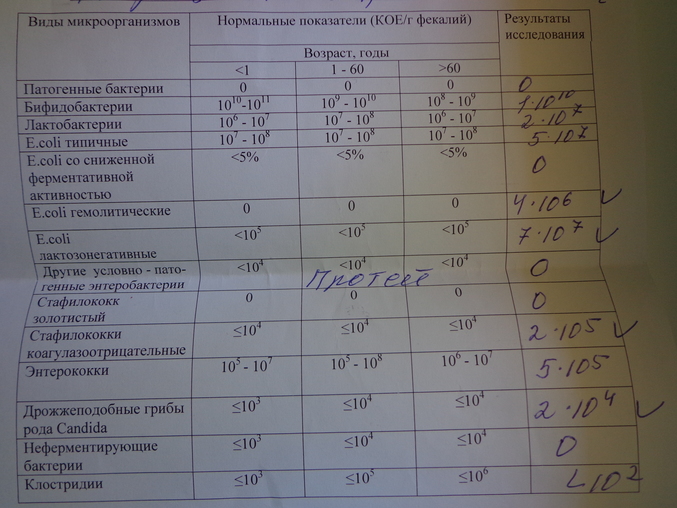 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
65. Ксавье Р., Подольский Д. Раскрытие патогенеза воспалительного заболевания кишечника. Природа. 2007; 448(7152):427–34. [PubMed] [Академия Google]
66. Каби А., Никерсон К., Гомер С. и др. Переваривание генетики воспалительного заболевания кишечника: выводы из исследований генов риска аутофагии. Воспалительные заболевания кишечника. 2012;18(4):782–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
67. Hugot J, Chamaillard M, Zouali H, et al. Ассоциация вариантов повторов NOD2, богатых лейцином, с предрасположенностью к болезни Крона. Природа. 2001; 411: 599–603. [PubMed] [Google Scholar]
68. Petnicki-Ocwieja T, Hrncir T, Liu Y, et al. Nod2 необходим для регуляции комменсальной микробиоты в кишечнике. ПНАС. 2009 г.;106(37):15813–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
69. Bringiotti R, Ierardi E, Lovero R, et al. Кишечная микробиота: взрывоопасная смесь в происхождении воспалительного заболевания кишечника? Всемирный журнал желудочно-кишечной патофизиологии.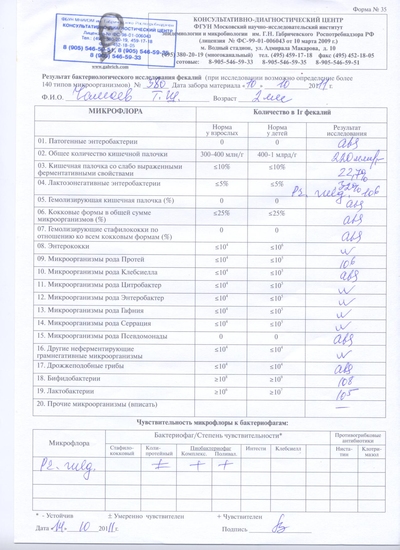 2014;5(4):550–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2014;5(4):550–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
70. Abreu M, Taylor K, Lin Y, et al. Мутации в NOD2 связаны с фибростенозирующим заболеванием у пациентов с болезнью Крона. Гастроэнтерология. 2002;123(3):679–88. [PubMed] [Google Scholar]
71. Shaw M, Kamada N, Warner N, et al. Постоянно расширяющаяся функция NOD2: аутофагия, распознавание вирусов и активация Т-клеток. Тенденции в иммунологии. 2011;32(2):73–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
72. Li E, Hamm C, Gulati A, et al. Фенотип воспалительных заболеваний кишечника, генотип C. difficile и NOD2 связаны со сдвигами в микробном составе подвздошной кишки человека. ПЛОС Один. 2012;7(6) [бесплатная статья PMC] [PubMed] [Google Scholar]
73. Knights D, Silverberg M, Weersma R, et al. Сложная генетика хозяина влияет на микробиом при воспалительном заболевании кишечника. Геномная медицина. 2014;6(12) [бесплатная статья PMC] [PubMed] [Google Scholar]
74. Friswell M, Campbell B, Rhodes J. Роль бактерий в патогенезе воспалительного заболевания кишечника. Кишечник и печень. 2010;4(3):295–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Роль бактерий в патогенезе воспалительного заболевания кишечника. Кишечник и печень. 2010;4(3):295–306. [Бесплатная статья PMC] [PubMed] [Google Scholar]
75. Cadwell K, Liu J, Brown S, et al. Ключевая роль аутофагии и гена аутофагии Atg16l1 в кишечных клетках Панета мыши и человека. Природа. 2008;456(7219): 259–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
76. Lassen K, Kuballa P, Conway K, et al. Вариант Atg16L1 T300A снижает селективную аутофагию, что приводит к изменению передачи сигналов цитокинов и снижению антибактериальной защиты. ПНАС. 2014;111(21):7741–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Раджу Д., Хасси С., Джонс Н. Болезнь Крона Полиморфизм ATG16L1 повышает восприимчивость к инфекции Helicobacter pylori у людей. Аутофагия. 2012;8(9):1387–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Lapaquette P, Glasser A, Huett A, et al. Адгезивно-инвазивная кишечная палочка, связанная с болезнью Крона, избирательно благоприятствует нарушенной аутофагии для внутриклеточной репликации.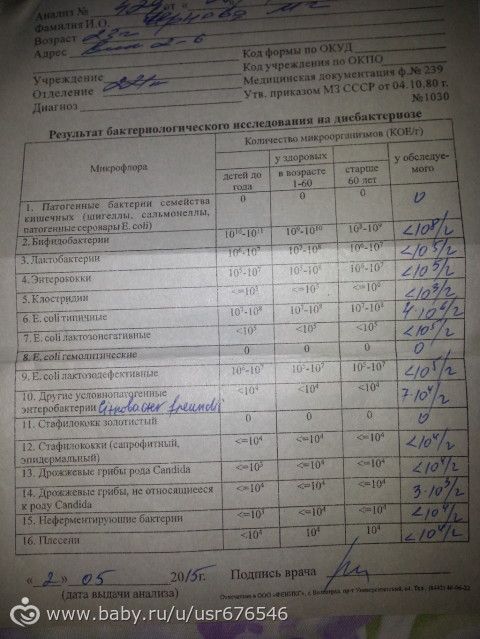 Клеточная микробиология. 2010;12(1):99–113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Клеточная микробиология. 2010;12(1):99–113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Moran C, Walters T, Guo C, et al. Полиморфизмы IL-10R связаны с язвенным колитом с очень ранним началом. Воспалительные заболевания кишечника. 2013;19(1):115–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Shouval D, Biswas A, Goettel J, et al. Передача сигналов рецептора интерлейкина-10 в клетках врожденного иммунитета регулирует иммунную толерантность слизистой оболочки и противовоспалительную функцию макрофагов. Иммунитет. 2014;40(5):706–19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Gassas A, Courtney S, Armstrong C, et al. Трансплантация гемопоэтических стволовых клеток от неродственного донора при детской энтеропатии из-за дефекта рецептора IL-10/IL-10. Детская трансплантация. 2015;19(4):E101–3. [PubMed] [Академия Google]
82. Engelhardt K, Shah N, Faizura-Yeop I, et al. Клинический исход у пациентов с дефицитом рецепторов IL-10 и IL-10 с трансплантацией гемопоэтических стволовых клеток или без нее. Журнал аллергии и клинической иммунологии. 2013;131(3):825–30. [PubMed] [Google Scholar]
Журнал аллергии и клинической иммунологии. 2013;131(3):825–30. [PubMed] [Google Scholar]
83. Murugan D, Albert M, Langemeier J, et al. Воспалительное заболевание кишечника с очень ранним началом, связанное с аберрантным переносом IL-10R1, излечивается с помощью гаплоидентичной трансплантации костного мозга, насыщенной Т-клетками. Журнал клинической иммунологии. 2014;34(3):331–9. [PubMed] [Google Scholar]
84. Glocker E, Kotlarz D, Boztug K, et al. Воспалительные заболевания кишечника и мутации, влияющие на рецептор интерлейкина-10. Медицинский журнал Новой Англии. 2009;361(21):2033–45. [Бесплатная статья PMC] [PubMed] [Google Scholar]
85. Goossens D, Jonkers D, Russel M, et al. Влияние пробиотического напитка с Lactobacillus plantarum 299v на бактериальный состав фекалий и биоптатов слизистой прямой и восходящей ободочной кишки. Алимент Фармакол Тер. 2006; 23: 255–63. [PubMed] [Академия Google]
86. van Baarlen P, Troost F, van Hemert S, et al. Дифференциальная индукция путей NF-kappaB Lactobacillus plantarum в двенадцатиперстной кишке здоровых людей, коррелирующая с иммунной толерантностью. Proc Natl Acad Sci U S A. 2009;106:2371–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Proc Natl Acad Sci U S A. 2009;106:2371–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
87. Plaza-Diaz J, Fernandez-Caballero J, Chueca N, et al. Пиросеквенирование позволяет выявить изменения кишечной микробиоты здоровых взрослых людей, получавших суточную дозу иммуномодулирующих пробиотических штаммов. Питательные вещества. 2015;7:3999–4015. [Бесплатная статья PMC] [PubMed] [Google Scholar]
88. Solis B, Samartin S, Gomez S, et al. Пробиотики как помощь детям, страдающим недоеданием и диареей. Eur J Clin Nutr. 2002; 56 (Приложение 3): S57–9. [PubMed] [Google Scholar]
89. Shen T, Albenberg L, Bittinger K, et al. Разработка микробиоты кишечника для лечения гипераммониемии. Джей Клин Инвест. 2015; 125:2841–50. [Бесплатная статья PMC] [PubMed] [Google Scholar]
90. Veiga P, Gallini C, Beal C, et al. Bifidobacterium animalis subsp. кисломолочный продукт Lactis уменьшает воспаление, изменяя нишу для колитогенных микробов. Proc Natl Acad Sci U S A. 2010;107:18132–7. [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Баллал С., Вейга П., Фенн К. и др. Опосредованный лизоцимом лизис хозяина Lactococcus lactis облегчает доставку супероксиддисмутазы, ослабляющей колит, в воспаленную толстую кишку. Proc Natl Acad Sci U S A. 2015;112:7803–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Brandt L, Aroniadis O, Mellow M, et al. Долгосрочное наблюдение за колоноскопической трансплантацией фекальной микробиоты при рецидивирующей инфекции Clostridium difficile. Am J Гастроэнтерол. 2012; 107:1079–87. [PubMed] [Академия Google]
93. Gough E, Shaikh H, Manges A. Систематический обзор трансплантации кишечной микробиоты (фекальная бактериотерапия) при рецидивирующей инфекции Clostridium difficile. Клин Инфекция Дис. 2011;53:994–1002. [PubMed] [Google Scholar]
94. Youngster I, Russell G, Pindar C, et al. Пероральная, капсулированная, замороженная трансплантация фекальной микробиоты при рецидивирующей инфекции Clostridium difficile. ДЖАМА. 2014; 312:1772–8. [PubMed] [Google Scholar]
ДЖАМА. 2014; 312:1772–8. [PubMed] [Google Scholar]
95. Арониадис О., Брандт Л. Трансплантация фекальной микробиоты: прошлое, настоящее и будущее. Курр Опин Гастроэнтерол. 2013;29: 79–84. [PubMed] [Google Scholar]
96. Khoruts A, Dicksved J, Jansson J, et al. Изменения состава фекального микробиома человека после бактериотерапии рецидивирующей Clostridium difficile-ассоциированной диареи. Дж. Клин Гастроэнтерол. 2010;44:354–60. [PubMed] [Google Scholar]
97. Яниро Г., Биббо С., Скальдаферри Ф. и соавт. Трансплантация фекальной микробиоты при воспалительных заболеваниях кишечника: за гранью волнения. Медицина (Балтимор) 2014; 93: e97. [Бесплатная статья PMC] [PubMed] [Google Scholar]
98. Angelberger S, Reinisch W, Makristathis A, et al. Временная динамика бактериального сообщества различается у пациентов с язвенным колитом после трансплантации фекальной микробиоты. Am J Гастроэнтерол. 2013;108:1620–30. [PubMed] [Google Scholar]
99. Kassam Z, Lee C, Yuan Y, et al.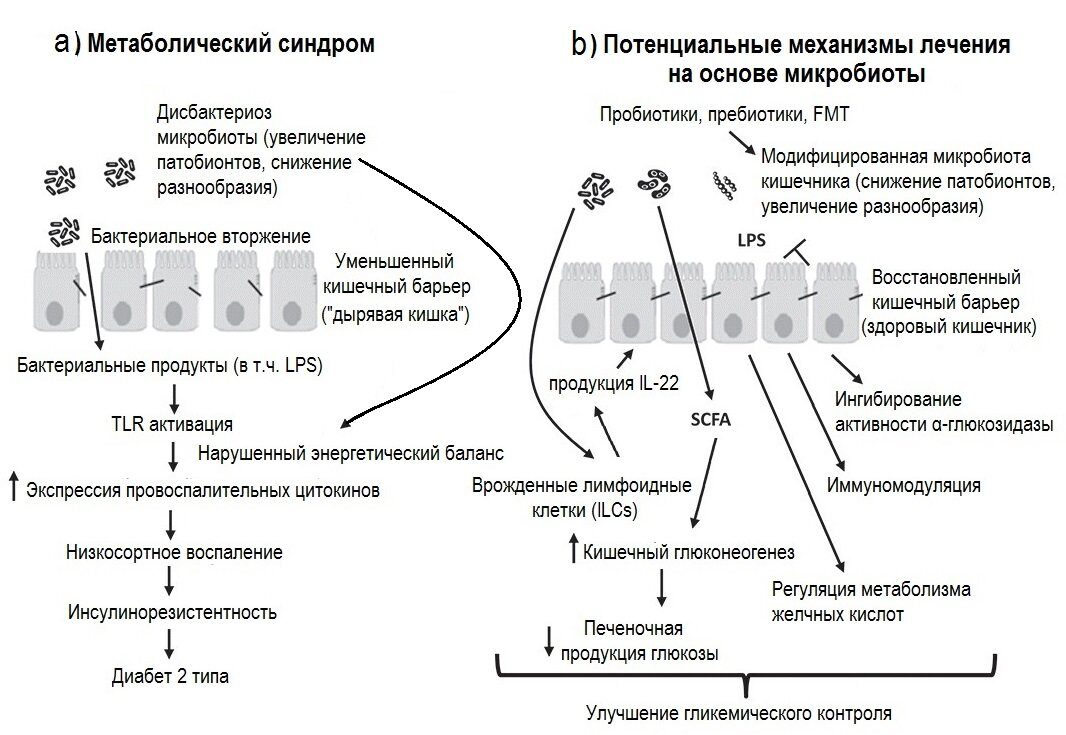 Трансплантация фекальной микробиоты при инфекции Clostridium difficile: систематический обзор и метаанализ. Am J Гастроэнтерол. 2013;108:500–8. [PubMed] [Google Scholar]
Трансплантация фекальной микробиоты при инфекции Clostridium difficile: систематический обзор и метаанализ. Am J Гастроэнтерол. 2013;108:500–8. [PubMed] [Google Scholar]
100. Филлипс М. Реакция кишечника: воздействие окружающей среды на микробиоту человека. Перспектива охраны окружающей среды. 2009 г.;117:А198–205. [Бесплатная статья PMC] [PubMed] [Google Scholar]
101. Biasucci G, Benenati B, Morelli L, et al. Кесарево сечение может повлиять на раннее биоразнообразие кишечных бактерий. Дж Нутр. 2008; 138:1796С–800С. [PubMed] [Google Scholar]
102. Low D, Nguyen D, Mizoguchi E. Модели язвенного колита на животных и их применение в исследованиях лекарств. Препарат Des Devel Ther. 2013;7:1341–57. [Бесплатная статья PMC] [PubMed] [Google Scholar]
103. Lewis M, Inman C, Patel D, et al. Прямые экспериментальные доказательства того, что окружающая среда на ферме в раннем возрасте влияет на регуляцию иммунных реакций. Детская Аллергия Иммунол. 2012; 23: 265–9. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
104. Erny D, Hrabe de Angelis A, Jaitin D, et al. Микробиота хозяина постоянно контролирует созревание и функцию микроглии в ЦНС. Нат Нейроски. 2015;18:965–77. [Бесплатная статья PMC] [PubMed] [Google Scholar]
105. Thaiss CA, Zeevi D, Levy M, et al. Транскрипционный контроль суточных колебаний микробиоты способствует метаболическому гомеостазу. Клетка. 2014;159:514–29. [PubMed] [Google Scholar]
Дисбиоз микробиоты кишечника при заболеваниях
1. Дикарь, округ Колумбия. Микробная экология желудочно-кишечного тракта. Энн Рев Микробиол. 1977; 31: 107–33. [PubMed] [Google Scholar]
2. Reyes A, Haynes M, Hanson N, Angly FE, Heath AC, Rohwer F, et al. Вирусы в фекальной микробиоте монозиготных близнецов и их матерей. Природа. 2010; 466: 334–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Камада Н., Сео С.У., Чен Г.Ю., Нуньес Г. Роль кишечной микробиоты в иммунитете и воспалительных заболеваниях. Нат Рев Иммунол. 2013;13:321–35. [PubMed] [Академия Google]
2013;13:321–35. [PubMed] [Академия Google]
4. Таноуэ Т., Умесаки Ю., Хонда К. Иммунные реакции на комменсалы кишечной микробиоты и патогены. Кишечные микробы. 2010;1:224–33. [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Wen L, Ley RE, Volchkov PY, Stranges PB, Avanesyan L, Stonebraker AC, et al. Врожденный иммунитет и кишечная микробиота в развитии сахарного диабета 1 типа. Природа. 2008; 455:1109–13. [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Zoetendal EG, Akkermans AD, De Vos WM. Анализ гель-электрофореза в температурном градиенте 16S рРНК из образцов фекалий человека выявляет стабильные и специфичные для хозяина сообщества активных бактерий. Appl Environ Microbiol. 1998;64:3854–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Turnbaugh PJ, Hamady M, Yatsunenko T, Cantarel BL, Duncan A, Ley RE, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009; 457:480–4. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Rajilic-Stojanovic M, Smidt H, de Vos WM. Еще раз о разнообразии микробиоты желудочно-кишечного тракта человека. Окружающая среда микробиол. 2007; 9: 2125–36. [PubMed] [Google Scholar]
Rajilic-Stojanovic M, Smidt H, de Vos WM. Еще раз о разнообразии микробиоты желудочно-кишечного тракта человека. Окружающая среда микробиол. 2007; 9: 2125–36. [PubMed] [Google Scholar]
9. Zoetendal EG, Rajilic-Stojanovic M, de Vos WM. Высокопроизводительный анализ разнообразия и функциональности микробиоты желудочно-кишечного тракта. Кишка. 2008; 57: 1605–15. [PubMed] [Академия Google]
10. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, et al. Каталог микробных генов кишечника человека, созданный с помощью метагеномного секвенирования. Природа. 2010; 464:59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Nicholson JK, Holmes E, Kinross J, Burcelin R, Gibson G, Jia W, et al. Метаболические взаимодействия микробиоты кишечника-хозяина. Наука. 2012; 336:1262–7. [PubMed] [Google Scholar]
12. Блаут М., Клавель Т. Метаболическое разнообразие микробиоты кишечника: последствия для здоровья и болезней. Дж Нутр. 2007; 137:751С–5С. [PubMed] [Академия Google]
13. Марчеси Дж., Шанахан Ф. Нормальная микробиота кишечника. Curr Opin Infect Dis. 2007; 20: 508–13. [PubMed] [Google Scholar]
Марчеси Дж., Шанахан Ф. Нормальная микробиота кишечника. Curr Opin Infect Dis. 2007; 20: 508–13. [PubMed] [Google Scholar]
14. Roediger WEW. Утилизация питательных веществ изолированными эпителиальными клетками толстой кишки крысы. Гастроэнтерология. 1982; 83: 424–9. [PubMed] [Google Scholar]
15. Bergman EN. Энергетический вклад летучих жирных кислот из желудочно-кишечного тракта у различных видов. Physiol Rev. 1990; 70: 567–90. [PubMed] [Google Scholar]
16. den Besten G, van Eunen K, Groen AK, Venema K, Reijngoud DJ, Bakker BM. Роль короткоцепочечных жирных кислот во взаимодействии между диетой, кишечной микробиотой и энергетическим метаболизмом хозяина. J липидный рез. 2013;54:2325–40. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Браун А.Дж., Голдсуорти С.М., Барнс А.А., Эйлерт М.М., Чеанг Л., Дэниэлс Д. и др. Связанные с орфанным G-белком рецепторы GPR41 и GPR43 активируются пропионатом и другими короткоцепочечными карбоновыми кислотами. Дж.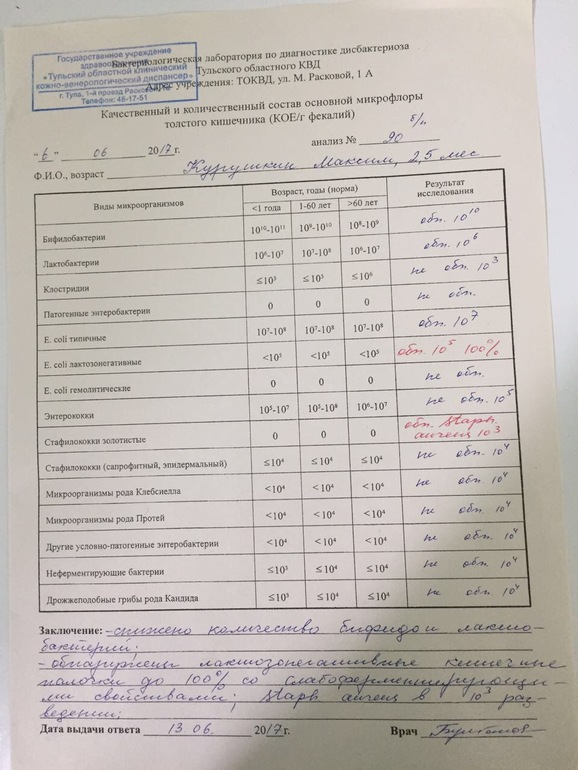 Биол. Хим. 2003; 278:11312–19. [PubMed] [Google Scholar]
Биол. Хим. 2003; 278:11312–19. [PubMed] [Google Scholar]
18. Layden BT, Angueira AR, Brodsky M, Durai V, Lowe WL. Короткоцепочечные жирные кислоты и их рецепторы: новые метаболические мишени. Перевод рез. 2013; 161:131–40. [PubMed] [Google Scholar]
19. Schilderink R, Verseijden C, de Jonge WJ. Диетические ингибиторы гистоновых деацетилаз в кишечном иммунитете и гомеостазе. Фронт Иммунол. 2013;4:226. дои: 10.3389/fimmu.2013.00226. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
20. Selma MV, Espin JC, Tomas-Barberan FA. Взаимодействие между фенолами и кишечной микробиотой: роль в здоровье человека. J Agric Food Chem. 2009; 57: 6485–501. [PubMed] [Google Scholar]
21. Cardona F, Andrés-Lacueva C, Tulipani S, Tinahones FJ, Queipo-Ortuño MI. Влияние полифенолов на микробиоту кишечника и влияние на здоровье человека. Дж. Нутр Биохим. 2013; 24:1415–22. [PubMed] [Google Scholar]
22. Queipo-Ortuno MI, Boto-Ordonez M, Murri M, Gomez-Zumaquero JM, Clemente-Postigo M, Estruch R, et al.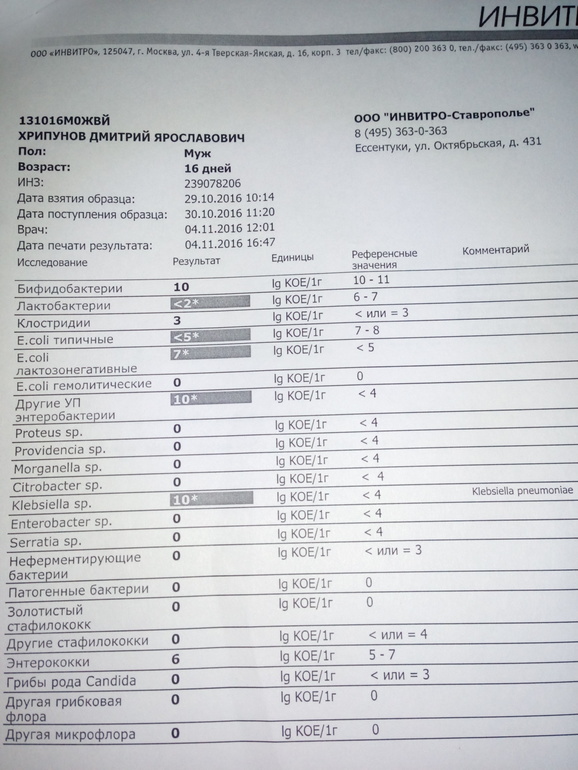 Влияние полифенолов красного вина и этанола на экологию кишечной микробиоты и биохимические биомаркеры. Am J Clin Nutr. 2012;95:1323–34. [PubMed] [Google Scholar]
Влияние полифенолов красного вина и этанола на экологию кишечной микробиоты и биохимические биомаркеры. Am J Clin Nutr. 2012;95:1323–34. [PubMed] [Google Scholar]
23. Арон-Висневски Дж., Габорит Б., Дютур А., Клемент К. Микробиота кишечника и неалкогольная жировая болезнь печени: новые идеи. Клин Микробиол Инфект. 2013;19:338–48. [PubMed] [Google Scholar]
24. Дреник Э.Дж., Фислер Дж., Джонсон Д. Стеатоз печени после шунтирования кишечника – профилактика и купирование метронидазолом, независимо от белково-калорийной недостаточности. Гастроэнтерология. 1982; 82: 535–48. [PubMed] [Google Scholar]
25. Dumas ME, Barton RH, Toye A, Cloarec O, Blancher C, Rothwell A, et al. Метаболическое профилирование выявляет вклад кишечной микробиоты в фенотип жировой дистрофии печени у мышей с резистентностью к инсулину. Proc Natl Acad Sci USA. 2006; 103:12511–16. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Корбин К.Д., Зейзел С.Х. Метаболизм холина обеспечивает новое понимание неалкогольной жировой болезни печени и ее прогрессирования. Курр Опин Гастроэнтерол. 2012;28:159–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Курр Опин Гастроэнтерол. 2012;28:159–65. [Бесплатная статья PMC] [PubMed] [Google Scholar]
27. Wang Z, Klipfell E, Bennett BJ, Koeth R, Levison BS, Dugar B, et al. Метаболизм фосфатидилхолина кишечной флорой способствует развитию сердечно-сосудистых заболеваний. Природа. 2011; 472:57–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Koeth RA, Wang Z, Levison BS, Buffa JA, Org E, Sheehy BT, et al. Метаболизм кишечной микробиоты L-карнитина, питательного вещества в красном мясе, способствует атеросклерозу. Нат Мед. 2013;19: 576–85. [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Baumgart DC, Carding SR. Воспалительные заболевания кишечника: причины и иммунобиология. Ланцет. 2007; 369:1627–40. [PubMed] [Google Scholar]
30. Хансен Дж., Гулати А., Сартор Р.Б. Роль иммунитета слизистых оболочек и генетики хозяина в определении кишечных комменсальных бактерий. Курр Опин Гастроэнтерол. 2010; 26: 564–71. [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Frank DN, St Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci USA. 2007; 104:13780–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Frank DN, St Amand AL, Feldman RA, Boedeker EC, Harpaz N, Pace NR. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci USA. 2007; 104:13780–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermudez-Humaran LG, Gratadoux JJ, et al. Faecalibacterium prausnitzii представляет собой противовоспалительную комменсальную бактерию, идентифицированную при анализе микробиоты кишечника пациентов с болезнью Крона. Proc Natl Acad Sci USA. 2008; 105:16731–6. [Бесплатная статья PMC] [PubMed] [Google Scholar]
33. Joossens M, Huys G, Cnockaert M, De Preter V, Verbeke K, Rutgeerts P, et al. Дисбактериоз фекальной микробиоты у больных болезнью Крона и их здоровых родственников. Кишка. 2011;60:631–637. [PubMed] [Академия Google]
34. Miquel S, Martin R, Rossi O, Bermudez-Humaran LG, Chatel JM, Sokol H, et al. Faecalibacterium prausnitzii и здоровье кишечника человека.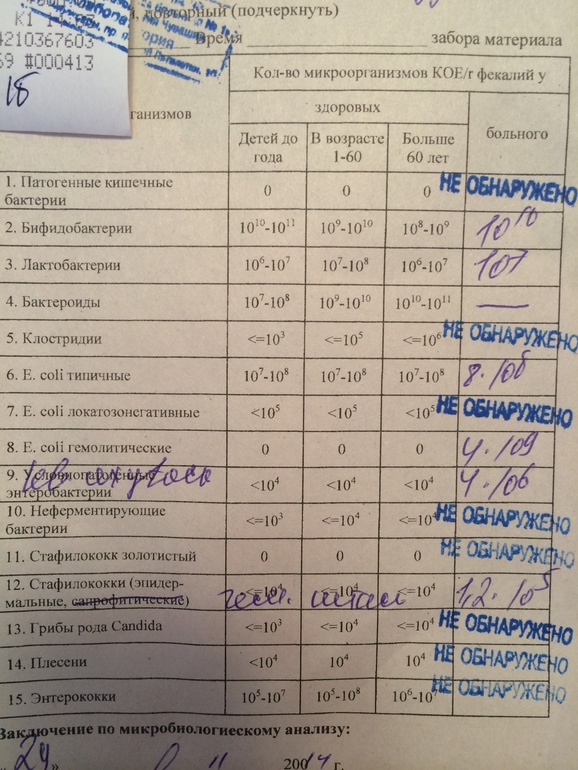 Curr Opin Microbiol. 2013;16:255–61. [PubMed] [Google Scholar]
Curr Opin Microbiol. 2013;16:255–61. [PubMed] [Google Scholar]
35. Darfeuille-Michaud A, Boudeau J, Bulois P, Neut C, Glasser AL, Barnich N, et al. Высокая распространенность адгезивно-инвазивной кишечной палочки, связанной со слизистой оболочкой подвздошной кишки при болезни Крона. Гастроэнтерология. 2004; 127:412–21. [PubMed] [Google Scholar]
36. Rosenfeld G, Bressler B. Mycobacterium avium paratuberculosis и этиология болезни Крона: обзор противоречий с точки зрения клинициста. Можно J Гастроэнтерол. 2010;24:619–24. [Бесплатная статья PMC] [PubMed] [Google Scholar]
37. Gevers D, Kugathasan S, Denson LA, Vazquez-Baeza Y, Van Treuren W, Ren B, et al. Нелеченный микробиом при впервые возникшей болезни Крона. Клеточный микроб-хозяин. 2014;15:382–92. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Кэрролл И.М., Чанг Ю.Х., Парк Дж., Сартор Р.Б., Рингел Ю. Микробиота кишечника, связанная с просветом и слизистой оболочкой, у пациентов с синдромом раздраженного кишечника с преобладанием диареи. Гут Патог. 2010;2:19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Гут Патог. 2010;2:19. [Бесплатная статья PMC] [PubMed] [Google Scholar]
39. Krogius-Kurikka L, Lyra A, Malinen E, Aarnikunnas J, Tuimala J, Paulin L, et al. Анализ микробного сообщества выявил высокий уровень филогенетических изменений в общей микробиоте желудочно-кишечного тракта у пациентов с синдромом раздраженного кишечника с преобладанием диареи. БМК Гастроэнтерол. 2009; 9:95. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Салонен А., де Вос В.М., Пальва А. Желудочно-кишечная микробиота при синдроме раздраженного кишечника: современное состояние и перспективы. Микробиология. 2010;156:3205–15. [PubMed] [Академия Google]
41. De Palma G, Nadal I, Medina M, Donat E, Ribes-Koninckx C, Calabuig M, et al. Дисбактериоз кишечника и снижение количества бактерий, покрытых иммуноглобулином, ассоциированы с глютеновой болезнью у детей. БМС микробиол. 2010;10:63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
42. Shen XJ, Rawls JF, Randall T, Burcal L, Mpande CN, Jenkins N, et al.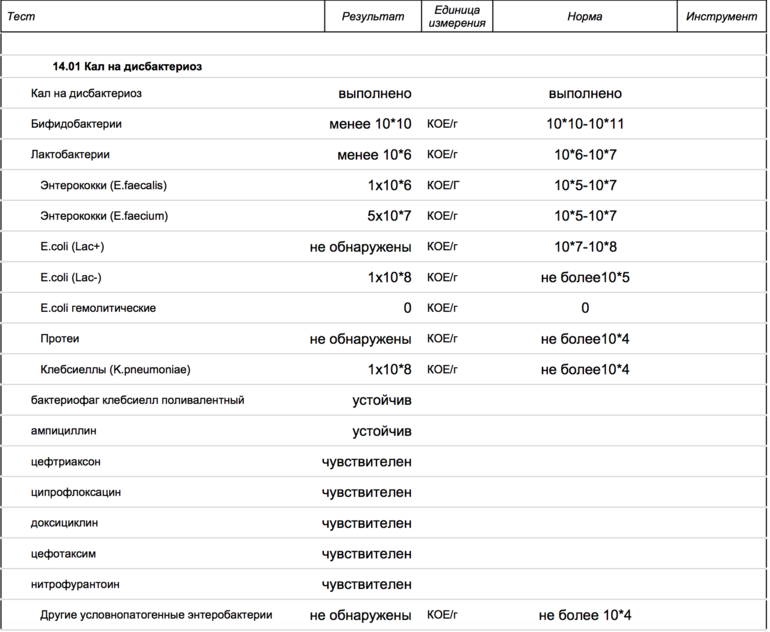 Молекулярная характеристика бактерий, прикрепляющихся к слизистой оболочке, и ассоциации с колоректальными аденомами. Кишечные микробы. 2010;1:138–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Молекулярная характеристика бактерий, прикрепляющихся к слизистой оболочке, и ассоциации с колоректальными аденомами. Кишечные микробы. 2010;1:138–47. [Бесплатная статья PMC] [PubMed] [Google Scholar]
43. Оливарес М., Ниф А., Кастильехо Г., Пальма Г.Д., Вареа В., Капилла А. и др. Генотип HLA-DQ2 определяет ранний состав кишечной микробиоты у младенцев с высоким риском развития глютеновой болезни. Кишка. 2014 г.: 10.1136/gutjnl-2014-306931. [PubMed] [CrossRef] [Google Scholar]
44. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Ожирение изменяет микробную экологию кишечника. Proc Natl Acad Sci USA. 2005; 102:11070–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
45. Лей Р.Э., Тернбо П.Дж., Кляйн С., Гордон Дж.И. Микробная экология: кишечные микробы человека, связанные с ожирением. Природа. 2006; 444:1022–3. [PubMed] [Google Scholar]
46. Collado MC, Isolauri E, Laitinen K, Salminen S. Различный состав микробиоты кишечника во время беременности у женщин с избыточным и нормальным весом. Am J Clin Nutr. 2008; 88: 894–9. [PubMed] [Google Scholar]
Am J Clin Nutr. 2008; 88: 894–9. [PubMed] [Google Scholar]
47. Duncan SH, Lobley GE, Holtrop G, Ince J, Johnstone AM, Louis P, et al. Микробиота толстой кишки человека связана с диетой, ожирением и потерей веса. Инт Дж. Обес. 2008; 32:1720–4. [PubMed] [Академия Google]
48. Kalliomaki M, Collado MC, Salminen S, Isolauri E. Ранние различия в составе фекальной микробиоты у детей могут предсказывать избыточный вес. Am J Clin Nutr. 2008; 87: 534–8. [PubMed] [Google Scholar]
49. Nadal I, Santacruz A, Marcos A, Warnberg J, Garagorri JM, Moreno LA, et al. Изменения в клостридиях, бактероидах и фекальных бактериях, покрывающих иммуноглобулин, связаны с потерей веса у подростков с ожирением. Инт Дж. Обес. 2009; 33: 758–67. [PubMed] [Google Scholar]
50. Santacruz A, Marcos A, Warnberg J, Marti A, Martin-Matillas M, Campoy C, et al. Взаимосвязь между потерей веса и составом микробиоты кишечника у подростков с избыточным весом. Ожирение. 2009 г.;17:1906–15. [PubMed] [Google Scholar]
51. Schwiertz A, Taras D, Schafer K, Beijer S, Bos NA, Donus C, et al. Микробиота и SCFAs у здоровых людей с худощавым телом и избыточным весом. Ожирение. 2010;18:190–5. [PubMed] [Google Scholar]
Schwiertz A, Taras D, Schafer K, Beijer S, Bos NA, Donus C, et al. Микробиота и SCFAs у здоровых людей с худощавым телом и избыточным весом. Ожирение. 2010;18:190–5. [PubMed] [Google Scholar]
52. Zhang H, DiBaise JK, Zuccolo A, Kudrna D, Braidotti M, Yu Y, et al. Микробиота кишечника человека при ожирении и после обходного желудочного анастомоза. Proc Natl Acad Sci USA. 2009; 106: 2365–70. [Бесплатная статья PMC] [PubMed] [Google Scholar]
53. Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, et al. Изменения в микробиоте кишечника контролируют воспаление, вызванное метаболической эндотоксемией, при ожирении и диабете, вызванных диетой с высоким содержанием жиров, у мышей. Диабет. 2008;57:1470–81. [PubMed] [Академия Google]
54. Тернбо П.Дж., Лей Р.Е., Маховальд М.А., Магрини В., Мардис Э.Р., Гордон Д.И. Связанный с ожирением кишечный микробиом с повышенной способностью собирать энергию. Природа. 2006; 444:1027–31. [PubMed] [Google Scholar]
55. Backhed F, Manchester JK, Semenkovich CF, Gordon JI. Механизмы, лежащие в основе устойчивости к диетическому ожирению у безмикробных мышей. Proc Natl Acad Sci USA. 2007; 104: 979–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Backhed F, Manchester JK, Semenkovich CF, Gordon JI. Механизмы, лежащие в основе устойчивости к диетическому ожирению у безмикробных мышей. Proc Natl Acad Sci USA. 2007; 104: 979–84. [Бесплатная статья PMC] [PubMed] [Google Scholar]
56. Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. Микробиота кишечника от близнецов, диссонирующих по ожирению, модулирует метаболизм у мышей. Наука. 2013;341:1241214. [Бесплатная статья PMC] [PubMed] [Google Scholar]
57. Ларсен Н., Вогенсен Ф.К., ван ден Берг Ф.В., Нильсен Д.С., Андреасен А.С., Педерсен Б.К. и соавт. Микробиота кишечника у взрослых людей с диабетом 2 типа отличается от таковой у взрослых без диабета. ПЛОС Один. 2010;5:e9085. [Бесплатная статья PMC] [PubMed] [Google Scholar]
58. Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, et al. Метагеномное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. 2012; 490:55–60. [PubMed] [Google Scholar]
59. Karlsson FH, Tremaroli V, Nookaew I, Bergstrom G, Behre CJ, Fagerberg B, et al. Метагеном кишечника у европейских женщин с нормальным, нарушенным и диабетическим контролем глюкозы. Природа. 2013;498:99–103. [PubMed] [Google Scholar]
Метагеном кишечника у европейских женщин с нормальным, нарушенным и диабетическим контролем глюкозы. Природа. 2013;498:99–103. [PubMed] [Google Scholar]
60. Vrieze A, Van Nood E, Holleman F, Salojarvi J, Kootte RS, Bartelsman JF, et al. Перенос кишечной микробиоты от худощавых доноров повышает чувствительность к инсулину у лиц с метаболическим синдромом. Гастроэнтерология. 2012;143:913–16, e7. [PubMed] [Google Scholar]
61. Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze X, et al. Доминирующие и чувствительные к диете группы бактерий в микробиоте толстой кишки человека. ISME J. 2011; 5: 220–30. [Бесплатная статья PMC] [PubMed] [Google Scholar]
62. Kong LC, Tap J, Aron-Wisnewsky J, Pelloux V, Basdevant A, Bouillot JL, et al. Микробиота кишечника после шунтирования желудка при ожирении человека: увеличение богатства и ассоциации родов бактерий с генами жировой ткани. Am J Clin Nutr. 2013;98:16–24. [PubMed] [Google Scholar]
63. Li JV, Ashrafian H, Bueter M, Kinross J, Sands C, le Roux CW и соавт. Метаболическая хирургия оказывает глубокое влияние на метаболические перекрестные помехи кишечного микроба-хозяина. Кишка. 2011;60:1214–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Метаболическая хирургия оказывает глубокое влияние на метаболические перекрестные помехи кишечного микроба-хозяина. Кишка. 2011;60:1214–23. [Бесплатная статья PMC] [PubMed] [Google Scholar]
64. Li JV, Reshat R, Wu Q, Ashrafian H, Bueter M, le Roux CW, et al. Экспериментальная бариатрическая хирургия у крыс создает цитотоксическую химическую среду в содержимом кишечника. Фронт микробиол. 2011;2:183. [Статья бесплатно PMC] [PubMed] [Google Scholar]
65. Windey K, De Preter V, Louat T, Schuit F, Herman J, Vansant G. Модуляция ферментации белка не влияет на токсичность фекальной воды: рандомизированное перекрестное исследование. сверх исследования у здоровых испытуемых. ПЛОС Один. 2012;7:e52387. doi: 10.1371/journal.pone.0052387. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
66. Evenepoel P, Meijers BKI, Bammens BRM, Verbeke K. Уремические токсины, возникающие в результате микробного метаболизма толстой кишки. Почки Int Suppl. 2009; 76:S12–S9. [PubMed] [Google Scholar]
67. Sirich TL, Meyer TW, Gondouin B, Brunet P, Niwa T. Связанные с белками молекулы: большое семейство с плохим характером. Семин Нефрол. 2014; 34:106–17. [PubMed] [Google Scholar]
Sirich TL, Meyer TW, Gondouin B, Brunet P, Niwa T. Связанные с белками молекулы: большое семейство с плохим характером. Семин Нефрол. 2014; 34:106–17. [PubMed] [Google Scholar]
68. Poesen R, Meijers B, Evenepoel P. Толстая кишка: упускаемый из виду сайт для лечения пациентов с диализом. Семин Циферблат. 2013;26:323–32. [PubMed] [Академия Google]
69. Neufeld K, Kang N, Bienenstock J, Foster J. Снижение тревожного поведения и центральные нейрохимические изменения у стерильных мышей. Нейрогастроэнтерол Мотил. 2011;23:255–64, e119. [PubMed] [Google Scholar]
70. Gaykema R, Goehler LE, Lyte M. Ответ мозга на инфекцию слепой кишки Campylobacter jejuni: анализ с помощью иммуногистохимии Fos. Мозг Behav Immun. 2004; 18: 238–45. [PubMed] [Google Scholar]
71. Goehler LE, Gaykema R, Opitz N, Reddaway R, Badr N, Lyte M. Активация блуждающих афферентов и центральных вегетативных путей: ранние ответы на кишечную инфекцию Campylobacter jejuni. Мозг Behav Immun. 2005;19: 334–44. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
72. Гелер Л.Э., Парк С.М., Опиц Н., Лайт М., Гайкема Р. Инфекция Campylobacter jejuni усиливает тревожное поведение в холборде: возможные анатомические субстраты для висцеросенсорной модуляции исследовательского поведения. Мозг Behav Immun. 2008; 22: 354–66. [Бесплатная статья PMC] [PubMed] [Google Scholar]
73. Lyte M, Li W, Opitz N, Gaykema R, Goehler LE. Индукция тревожноподобного поведения у мышей на начальных этапах заражения возбудителем мышиной гиперплазии толстой кишки Citrobacter rodentium. Физиол Поведение. 2006;89: 350–7. [PubMed] [Google Scholar]
74. Li H, Cao Y. Фабрики молочнокислых бактериальных клеток для получения гамма-аминомасляной кислоты. Аминокислоты. 2010;39:1107–16. [PubMed] [Google Scholar]
75. Лайт М. Пробиотики механически функционируют как средства доставки нейроактивных соединений: микробная эндокринология в разработке и использовании пробиотиков. Биоэссе. 2011; 33: 574–81. [PubMed] [Google Scholar]
76. Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al. Прием внутрь штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мышей через блуждающий нерв. Proc Natl Acad Sci USA. 2011;108:16050–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Bravo JA, Forsythe P, Chew MV, Escaravage E, Savignac HM, Dinan TG, et al. Прием внутрь штамма Lactobacillus регулирует эмоциональное поведение и экспрессию центрального рецептора ГАМК у мышей через блуждающий нерв. Proc Natl Acad Sci USA. 2011;108:16050–5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
77. Коллинз Дж., Бороевич Р., Верду Э.Ф., Хейзинга Дж.Д., Рэтклифф Э.М. Кишечная микробиота влияет на раннее постнатальное развитие энтеральной нервной системы. Нейрогастроэнтерол Мотил. 2014;26:98–107. [PubMed] [Google Scholar]
78. Sudo N, Chida Y, Aiba Y, Sonoda J, Oyama N, Yu XN, et al. Постнатальная микробная колонизация программирует гипоталамо-гипофизарно-надпочечниковую систему на реакцию на стресс у мышей. Дж. Физиол. 2004; 558: 263–75. [Бесплатная статья PMC] [PubMed] [Google Scholar]
79. Диаз Хейтц Р., Ван С., Ануар Ф., Цянь Ю., Бьоркхольм Б., Самуэльссон А. и др. Нормальная микробиота кишечника модулирует развитие и поведение мозга. Proc Natl Acad Sci USA. 2011;108:3047–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2011;108:3047–52. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Hsiao EY, McBride SW, Hsien S, Sharon G, Hyde ER, McCue T, et al. Микробиота модулирует поведенческие и физиологические отклонения, связанные с нарушениями развития нервной системы. Клетка. 2013; 155:1451–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
81. Cámara RJ, Ziegler R, Begré S, Schoepfer AM, von Känel R. Роль психологического стресса в воспалительных заболеваниях кишечника: оценка качества методов 18 проспективных исследований и предложения для будущих исследований. пищеварение. 2009; 80: 129–39. [PubMed] [Google Scholar]
82. Mawdsley J, Rampton D. Психологический стресс при ВЗК: новый взгляд на патогенные и терапевтические последствия. Кишка. 2005; 54:1481–91. [Бесплатная статья PMC] [PubMed] [Google Scholar]
83. Maes M, Kubera M, Leunis JC, Berk M. Повышенный ответ IgA и IgM против кишечных комменсалов при хронической депрессии: дополнительные доказательства повышенной бактериальной транслокации или повышенной кишечной проницаемости. J Аффективное расстройство. 2012; 141:55–62. [PubMed] [Академия Google]
J Аффективное расстройство. 2012; 141:55–62. [PubMed] [Академия Google]
84. O’Mahony L, McCarthy J, Kelly P, Hurley G, Luo F, Chen K, et al. Лактобациллы и бифидобактерии при синдроме раздраженного кишечника: реакция на симптомы и связь с профилями цитокинов. Гастроэнтерология. 2005; 128: 541–51. [PubMed] [Google Scholar]
85. Desbonnet L, Garrett L, Clarke G, Kiely B, Cryan J, Dinan T. Эффекты пробиотика Bifidobacterium infantis в модели депрессии от матери. Неврология. 2010; 170:1179–88. [PubMed] [Академия Google]
86. Myint AM, Kim YK, Verkerk R, Scharpé S, Steinbusch H, Leonard B. Кинурениновый путь при большой депрессии: свидетельство нарушения нейропротекции. J Аффективное расстройство. 2007; 98: 143–51. [PubMed] [Google Scholar]
87. Song C, Wang H. Цитокины опосредовали воспаление и снижали нейрогенез в животных моделях депрессии. Прог Нейропсихофармакол Биол Психиатрия. 2011;35:760–8. [PubMed] [Google Scholar]
88. Бентон Д., Уильямс С. , Браун А. Влияние употребления молочного напитка, содержащего пробиотик, на настроение и когнитивные функции. Eur J Clin Nutr. 2006; 61: 355–61. [PubMed] [Академия Google]
, Браун А. Влияние употребления молочного напитка, содержащего пробиотик, на настроение и когнитивные функции. Eur J Clin Nutr. 2006; 61: 355–61. [PubMed] [Академия Google]
89. Messaoudi M, Lalonde R, Violle N, Javelot H, Desor D, Nejdi A, et al. Оценка психотропных свойств пробиотической композиции (Lactobacillus helveticus R0052 и Bifidobacterium longum R0175) у крыс и людей. Бр Дж Нутр. 2011; 105:755–64. [PubMed] [Google Scholar]
90. Tillisch K, Labus J, Kilpatrick L, Jiang Z, Stains J, Ebrat B, et al. Употребление кисломолочного продукта с пробиотиком модулирует мозговую деятельность. Гастроэнтерология. 2013; 144:1394–401. [Бесплатная статья PMC] [PubMed] [Google Scholar]
91. Dapoigny M, Piche T, Ducrotte P, Lunaud B, Cardot J-M, Bernalier-Donadille A. Профиль эффективности и безопасности полной лиофилизированной культуры LCR35 при синдроме раздраженного кишечника: рандомизированное двойное слепое исследование. Мир J Гастроэнтерол. 2012;18:2067. [Бесплатная статья PMC] [PubMed] [Google Scholar]
92. Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O’Mahony L, et al. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J Гастроэнтерол. 2006; 101:1581–90. [PubMed] [Google Scholar]
Whorwell PJ, Altringer L, Morel J, Bond Y, Charbonneau D, O’Mahony L, et al. Эффективность инкапсулированного пробиотика Bifidobacterium infantis 35624 у женщин с синдромом раздраженного кишечника. Am J Гастроэнтерол. 2006; 101:1581–90. [PubMed] [Google Scholar]
93. Dickerson FB, Stallings C, Origoni A, Katsafanas E, Savage CL, Schweinfurth LA, et al. Влияние пробиотических добавок на симптомы шизофрении и связь с желудочно-кишечным функционированием: рандомизированное плацебо-контролируемое исследование. Prim Care Companion Расстройство ЦНС. 2014;16:pii, PCC.13m01579. [Бесплатная статья PMC] [PubMed] [Google Scholar]
94. Vaghef-Mehrabany E, Alipour B, Homayouni-Rad A, Sharif S-K, Asghari-Jafarabadi M, Zavvari S. Пробиотические добавки улучшают воспалительный статус у пациентов с ревматоидным артритом . Питание. 2014;30:430–5. [PubMed] [Академия Google]
95. Gismondo MR, Drago L, Lombardi A. Обзор пробиотиков, доступных для изменения желудочно-кишечной флоры. Противомикробные агенты Int J.