Информация для лабораторий — T‑SPOT.TB
ИНФОРМАЦИЯ ДЛЯ ЛАБОРАТОРИЙ
Что представляет собой тест T-SPOT.TB?
Тест T-SPOT.TB – это анализ крови, также известный как «тест высвобождения гамма-интерферона» (IGRA), иммунологический тест для диагностики инфицирования микобактериями туберкулеза.
Тест T-SPOT.TB представляет собой тест для диагностики in vitro, который позволяет количественно оценить ответ Т-лимфоцитов, которые были сенсибилизированы к микобактериям туберкулеза. T-SPOT.TB является косвенным тестом, позволяющим диагностировать инфицирование M. tuberculosis (включая заболевание туберкулезом), и предназначен для использования в совокупности с оценкой факторов риска, клинических, рентгенологических данных и других диагностических методов обследования.
Какие пробирки используются для забора крови?
Для взятия крови должны использоваться стандартные пробирки (содержащие литий-гепарин или натрий-гепарин) или пробирки для забора крови Vacutainer® СРТ™.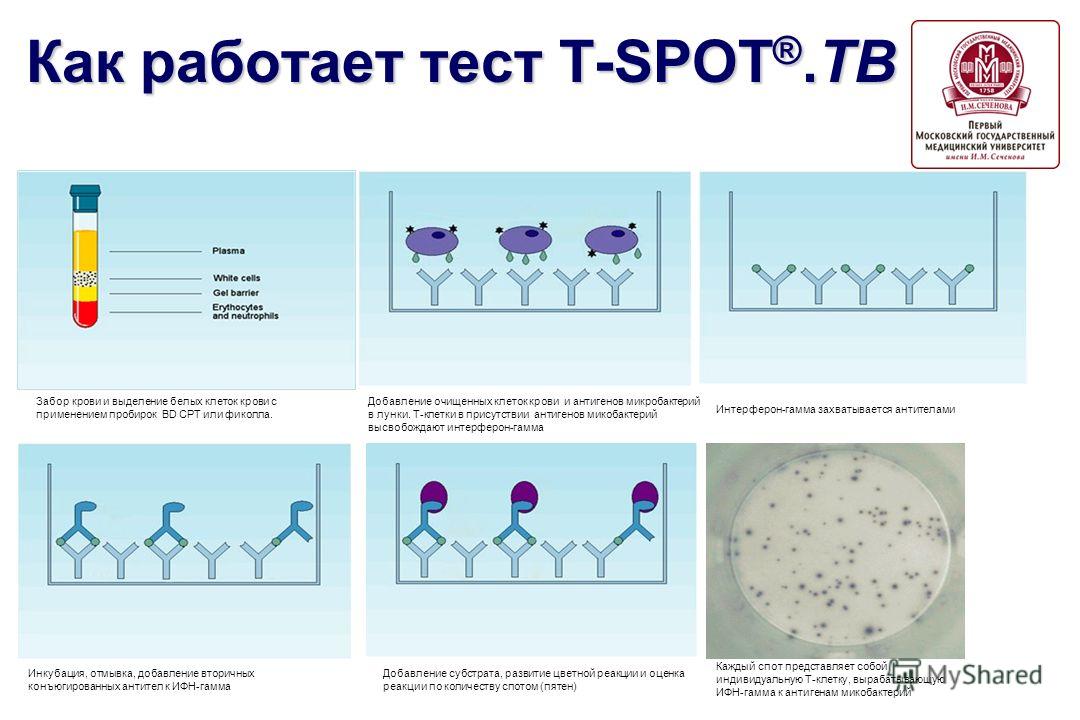
Можно ли использовать пробирки для взятия крови с ЭДТА?
ЭДТА нарушат секрецию гамма-интерферона клетками крови. Поэтому пробирки с этим антикоагулянтом нельзя использовать при взятии крови для теста T-SPOT.TB.
Какой объем крови требуется для проведения теста Т-SPOT.TB?
Требуемый объем крови для проведения теста:
Взрослые и дети от 10 лет и старше: 6 мл
Дети 2-9 лет: 4 мл
Дети до 2 лет: 2 мл.
Примечание: у пациентов с иммуносупрессией требуется взять 2 пробирки крови.
Тест проводится в течение 25-26 часов. Уже на следующий день после забора крови, можно дать заключение о наличии туберкулезной инфекции.
Влияет ли предшествующая вакцинация БЦЖ на результаты теста T-SPOT.TB?
В отличие от кожных туберкулиновых проб, на результаты теста T-SPOT.TB не влияет предшествующая вакцинация БЦЖ. В тесте T-SPOT.TB используются два специфических антигена M. tuberculosis (ESAT-6 и CFP 10). Эти антигены не выявляются во всех штаммах БЦЖ и у большинства представителей семейства нетуберкулезных микобактерий.
Эти антигены не выявляются во всех штаммах БЦЖ и у большинства представителей семейства нетуберкулезных микобактерий.
Оборудование, которое должно быть в лаборатории для проведения теста:
Центрифуга для выделения PBMC (минимум 1800 RCF, способная поддерживать температуру образцов (18-25 °С) при использовании центрифугирования с градиентом плотности для выделения клеток)
Регулируемые автоматические пипетки
Устройство для визуализации и документирования, напр., стереомикроскопом, увеличительное стекло, либо цифровой визуализатор для подсчета лунок
Из чего состоит набор T-SPOT.TB:
1 микротитровальный планшет: 96 лунок, поставляемая в виде 12 х 8-лунок стрипов; лунки покрыты мышиными моноклональными антителами к интерферону-гамма
2 флакона (0,8мл) Панель А: содержит антиген ESAT-6, бычий альбумин и антимикробные агенты
2 флакона (0,8мл) Положительный контроль: содержит фитогемагглютинин для оценки функциональной способности клеток, бычий альбумин и антимикробные агенты
1 флакон (50мкл) 200х концентрированный Конъюгирующий реагент: мышиные моноклональные антитела к интерферону-гамма, конъюгированные с щелочной фосфатазой
1 флакон (25мл) Растворимого субстрата: готовый к использованию раствор BCIP/NBT+
Если Ваша лаборатория не может проводить тест T-SPOT.
 TB ежедневно или ВЫ должны транспортировать кровь для исследования в другую лабораторию, Вы можете использовать реагент T-Cell Xtend.
TB ежедневно или ВЫ должны транспортировать кровь для исследования в другую лабораторию, Вы можете использовать реагент T-Cell Xtend.T-Cell Xtend® — реагент, продлевающий время до начала проведения исследования максимум на 32 часа.
Механизм действия реагента T-Cell Xtend:
При заборе крови происходит ряд изменений, в том числе активация гранулоцитов, приводящих к выработке пероксида, который ингибирует высвобождение интерферона γ Т-клетками. Использование реагента T-Cell Xtend блокирует гранулоциты и позволяет образцам храниться до 32 часов.
Реагент T-Сell Xtend производится также компанией Oxford Immunotec.
Реагент T-Cell Xtend прошел клинические испытания только при проведении теста T-SPOT.TB. На других тестах реагент не исследовался.
Результаты теста T-SPOT.TB могут быть положительными, отрицательными, сомнительными или неопределёнными. Результат определяется путем подсчета и регистрация количества «пятен» в лунках.
Какова тактика при получении сомнительных или неопределенных результатов теста?
В случае получения сомнительных и неопределенных результатов рекомендуется проведение повторного анализа с использованием новой пробы крови, взятой во время следующего визита пациента к врачу.
ПРЕИМУЩЕСТВА ТЕСТА T-SPOT.TB:
Точность:
T-SPOT.TB — единственный тест для диагностики туберкулеза, чувствительность и специфичность которого по данным основных клинических исследований превышают 95% .
Достоверность:
T-SPOT.TB позволяет выявить инфицированных микобактериями туберкулеза даже среди «проблемных» популяций пациентов, включая иммигрантов и иммунокомпрометированных больных, не имеет перекрестных реакций с вакциной БЦЖ.
Простота:
Тестирование методом T-SPOT.TB требует всего одного визита к врачу и одной пробирки крови. Все этапы теста контролирует лаборатория.
Тест T-SPOT.
(PDF) Recombinant in vitro test T-SPOT.TB as a screening method for early diagnosis of tuberculosis infection
51
Tuberculosis and Lung Diseases, Vol. 98, No. 4, 2020
ЛИ Т ЕРАТ У РА
1. Аксенова В. А., Леви Д. Т., Александрова Н. В., Кудлай Д. А. Современное
состояние вопроса заболеваемости детей туберкулезом, препараты для
профилактики и диагностики инфекции // Биопрепараты. Профилактика,
диагностика, лечение. – 2017. – Т. 17, № 3. – С. 145-151.
2. Ананьев С. М. Диагностика латентной туберкулезной инфекции у детей //
Туб. информ. – 2017. – Т. 1, № 2 (2). – С. 15-23.
3. Бородулина Е. А., Бородулин Б. Е., Амосова Е. А., Табашникова А. И.,
Титугина А. Ю. Туберкулиновые пробы и их сравнительная оценка // Туб.
и болезни легких. – 2010. – Т. 87, № 8. – С. 13-17.
4. Овсянкина Е. С., Губкина М. Ф., Панова Л. В., Юхименко Н. В. Анализ
Овсянкина Е. С., Губкина М. Ф., Панова Л. В., Юхименко Н. В. Анализ
эффективности кожных туберкулиновых проб для диагностики тубер-
кулезной инфекции у детей и подростков // Вопросы практической пе-
диатрии. – 2015. – Т. 10, № 5. – С. 36-43.
5. Слогоцкая Л. В., Богородская Е. М., Сенчихина О. Ю., Никитина Г. В., Куд-
лай Д. А. Формирование групп риска заболевания туб еркулезом при раз-
личных иммунологических методах обследования детского населения //
Российский педиатрический журнал. – 2017. – Т. 20, № 4. – С. 207-213.
6. Слогоцкая Л. В., Синицын М. В., Кудлай Д. А. Возможности иммуно-
логических тестов в диагностике латентной туберкулезной инфекции
и туберкулеза // Туб. и болезни легких. – 2019. – Т. 97, № 11. – С. 46-59.
7. Старшинова А. А., Довгалюк И. Ф., Зинченко Ю. С., Кудлай Д. А., Яблон-
ский П. К. Иммунодиагностика туберкулеза сегодня: современные им-
мунологические тесты и дифференцированный подход к их применению
в практике // Практическая пульмонология.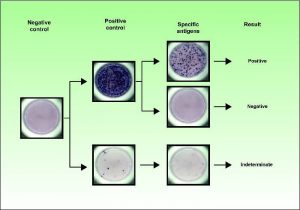 – 2019. – № 2. – С. 28-33.
– 2019. – № 2. – С. 28-33.
8. Старшинова А. А., Кудлай Д. А., Довгалюк И. Ф., Басанцова Н. Ю.,
Зинченко Ю. С., Яблонский П. К. Эффективность применения новых
методов иммунодиагностики туберкулезной инфекции в Россий-
ской Федерации // Педиатрия. – 2019. – Т. 98, № 4. – С. 229-235. DOI:
10.24110/0031-403X-2019-98-4-229-235.
9. Турдумамб етова Г. К., Галиева Р. Ш., Бай телиева А. К. Скрининг латентной
туберкулезной инфекции у детей младшего школьного возраста // Вест-
ник Академии медицинских наук Таджикистана. – 2018. – Т. 8, №3(27).–
С. 369-375. DOI: 10.31712/2221-7355-2018-8-3-369-375.
10. Chapman H. J., Lauzardo M. Advances in diagnosis and treatment of latent
tuberculosis infection // J. Am. Board Fam. Med. – 2014. – Vol. 27, № 5. – P. 704-712.
11. Chiang S. S., Swanson S. D., Jeffrey R. S. New diagnostics for childhood
tuberculosis review // Infectious Disease Clinics of North America. – 2015. –
– 2015. –
Vol. 29, № 3. ‒ Р. 477-502.
12. Colson P. W. Acceptance of treatment for latent tuberculosis infection:
prospective cohort study in the United States and Canada. Tuberculosis
Epidemiologic Studies Consortium // Int. J. Tuberc. Lung Dis. – 2013. – Vol. 17,
№ 4. – P. 473-479.
13. Diel R., Loddenkemper R., Nienhaus A. Predictive value of interferon-γ release
assays and tuberculin skin testing for progression from latent TB infection to
disease state: a meta-analysis // Chest. – 2012. – № 142 (1). – Р. 63-75.
14. Hur Y. G. Identification of immunological biomarkers which may differentiate
latent tuberculosis from exposure to environmental nontuberculous
mycobacteria in children // Clin. Vaccine Immunol. – 2014. – Vol. 21, № 2. –
P. 133-142.
15. Shovkun L., Aksenova V., Kudlay D., Sarychev A. The role of immunological
tests in the diagnosis of tuberculosis infection in children with juvenile
idiopathic arthritis (JIA) // Europ. Respir. J. – 2018. – Vol. 52. – S62 – PA2733.
Respir. J. – 2018. – Vol. 52. – S62 – PA2733.
16. Slogotskaya L. V., Bogorodskaya E., Sentchichina O., Ivanova D., Nikitina G.,
Litvinov V., Seltsovsky P., Kudlay D. A., Nikolenko N., Borisov S. Effectiveness of
tuberculosis detection using a skin test with allergen recombinant (CFP-10-ESAT-6)
in children // Eur. Respir. J. – 2015. – Vol. 46, № S59. – С.РА4524.
17. Slogotskaya L. V., Litvinov V., Kudlay D. A., Ovsyankina E., Seltsovsky P.,
IvanovaD., Nikolenko N. New skin test with recombinant protein CFP10-ESAT6
in patients (children and adults) with tuberculosis, non-tuberculosis disease and
latent TB infection // Eur. Respir. J. – 2012. – Vol. 40 (S56). – P. 416.
18. Slogotskaya L. V., Litvinov V., Ovsyankina E., Seltsovsky P., Kudlay D. Results
of QuantiFERON-TB Gold in-tube and skin testing with recombinant proteins
CFP-10-ESAT-6 in children and adolescents with TB or latent TB infection //
Pediatr. Respir. Rev. – 2013. – Vol. 14, № 2. – P. S65.
Respir. Rev. – 2013. – Vol. 14, № 2. – P. S65.
19. Torres M. Effect of isoniazid on antigen-specific interferon-γ secretion in latent
tuberculosis // Eur. Respir. J. – 2015. – Vol. 45, № 2. – P. 473-482.
20. Whitworth H. S., Scott M., Connell D. W., Dongés B., Lalvani A. IGRAs-
шлюз для диагностики туб еркулеза на основе Т-клеток. Методы. ‒ 2013.–
Vol. 61.– Р. 52-62. DOI: 10.1016 / j. ymeth.2012.12.012.
REFERENCES
1. Аksenova V.А., Lev i D.T., Аleksandrova N.V., Kudlay D.А. Current tuberculosis
incidence in children, agents for the infection prevention and diagnostics.
Biopreparaty. Profilaktika, Diagnostika, Lechenie, 2017, vol. 17, no. 3, pp. 145-151.
(In Russ.)
2. Ananiev S.M. Diagnostics of latent tuberculous infection in children. Tub.
Inform., 2017, vol. 1, no. 2 (2), pp. 15-23. (In Russ.)
3. Borodulina E.А., Borodulin B.E., Аmosova E.А., Tabashnikova А.I., Titugina
А.Yu. Tuberculin tests and their comparative characteristics. Tuberculosis and
Tuberculin tests and their comparative characteristics. Tuberculosis and
Lung Diseases, 2010, vol. 87, no. 8, pp. 13-17. (In Russ.)
4. Ovsyankina E.S., Gubkina M.F., Panova L.V., Yukhimenko N.V. Analysis
oftheeffectiveness of skin tuberculin tests for diagnosis of tuberculous infection
in children and adolescents. Voprosy Prakticheskoy Pediatr ii, 2015, vol. 10, no. 5,
pp. 36-43. (In Russ.)
5. Slogotskaya L.V., Bogorodskaya E.M., Senchikhina O.Yu., Nikitina G.V.,
KudlayD.А. Formation of risk groups among children facing an advanced
risk to develop tuberculosis who should undergo various immunological
examinations. Rossiyskiy Pediatricheskiy Journal, 2017, vol. 20, no. 4, pp. 207-213.
(In Russ.)
6. Slogotskaya L.V., Sinitsyn M.V., Kudlay D.А. Possibilities of immunological tests
in the diagnosis of latent tuberculosis infection and tuberculosis. Tuberculosis
and Lung Diseases, 2019, vol.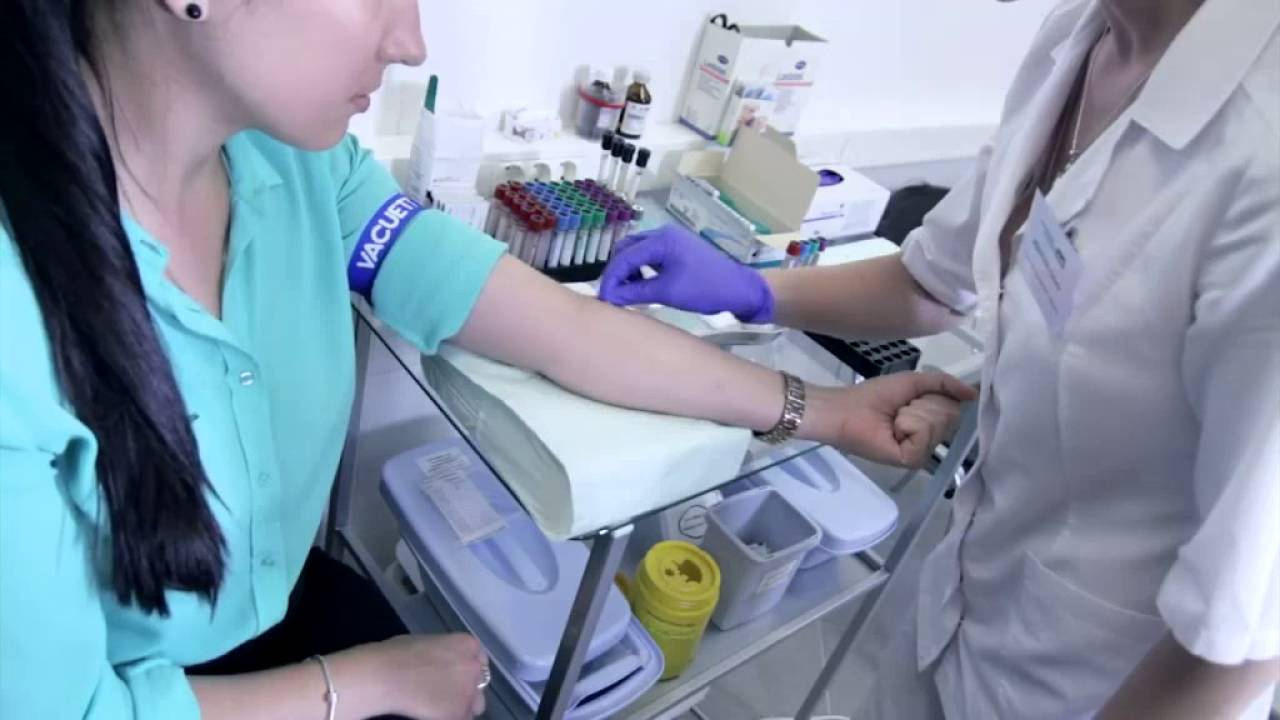 97, no. 11, pp. 46-59. (In Russ.)
97, no. 11, pp. 46-59. (In Russ.)
7. Starshinova А.А., Dovgalyuk I.F., Zinchenko Yu.S., Kud lay D.А., Yablonskiy P.K.
Contemporary immunodiagnosis of tuberculosis: modern immunological tests
and differential approach to their practical use. Prakticheskaya Pulmonologiya,
2019, no. 2, pp. 28-33. (In Russ.)
8. Starshinova А.А., Kudlay D.А., Dovgalyuk I.F., Basantsova N.Yu.,
ZinchenkoYu.S., Yablonskiy P.K. Efficacy of new methods of immunodiagnostics
of tuberculous infection in the Russian Federation. Pediatriya, 2019, vol. 98,
no. 4, pp. 229-235. (In Russ.) doi: 10.24110/0031-403X-2019-98-4-229-235.
9. Turdumambetova G.K., Galieva R.Sh., Baytelieva А.K. Screening for latent
tuberculosis infection in children of middle childhood age. Vestnik Аkademii
Meditsinskikh Nauk Tadzhikistana, 2018, vol. 8, no. 3 (27), pp. 369-375.
(InRuss.) doi: 10.31712/2221-7355-2018-8-3-369-375.
10. Chapman H.J., Lauzardo M. Advances in diagnosis and treatment of latent
Advances in diagnosis and treatment of latent
tuberculosis infection. J. Am. Board Fam. Med., 2014, vol. 27, no. 5, pp. 704-712.
11. Chiang S.S., Swanson S.D., Jeffrey R.S. New diagnostics for childhood
tuberculosis review. Infectious Disease Clinics of North America, 2015, vol. 29,
no. 3, pp. 477-502.
12. Colson P.W. Acceptance of treatment for latent tuberculosis infection:
prospective cohort study in the United States and Canada. Tuberculosis
Epidemiologic Studies Consortium. Int. J. Tuberc. Lung Dis., 2013, vol. 17,
no. 4, pp. 473-479.
13. Diel R., Loddenkemper R., Nienhaus A. Predictive value of interferon-γ release
assays and tuberculin skin testing for progression from latent TB infection to
disease state: a meta-analysis. Chest, 2012, no. 142 (1), pp. 63-75.
14. Hur Y.G. Identification of immunological biomarkers which may differentiate
latent tuberculosis from exposure to environmental nontuberculous
mycobacteria in children. Clin. Vaccine Immunol., 2014, vol. 21, no. 2,
Clin. Vaccine Immunol., 2014, vol. 21, no. 2,
pp. 133-142.
15. Shovkun L., Aksenova V., Kudlay D., Sarychev A. The role of immunological
tests in the diagnosis of tuberculosis infection in children with juvenile
idiopathic arthritis (JIA). Europ. Respir. J., 2018, vol. 52, S62, PA2733.
16. Slogotskaya L.V., Bogorodskaya E., Sentchichina O., Ivanova D., Nikitina G.,
Litvinov V., Seltsovsky P., Kudlay D.A., Nikolenko N., Borisov S. Effectiveness
of tuberculosis detection using a skin test with allergen recombinant
(CFP-10-ESAT-6) in children. Eur. Res pir. J., 2015, vol. 46, no. S59, pp. РА4524.
17. Slogotskaya L.V., Litvinov V., Kudlay D.A., Ovsyankina E., Seltsovsky P.,
IvanovaD., Nikolenko N. New skin test with recombinant protein CFP10-ESAT6
in patients (children and adults) with tuberculosis, non-tuberculosis disease
and latent TB infection. Eur. Resp ir. J., 2012, vol. 40 (S56), pp. 416.
18. Slogotskaya L.V., Litvinov V., Ovsyankina E., Seltsovsky P., Kudlay D. Results
Slogotskaya L.V., Litvinov V., Ovsyankina E., Seltsovsky P., Kudlay D. Results
of QuantiFERON-TB Gold in-tube and skin testing with recombinant proteins
CFP-10-ESAT-6 in children and adolescents with TB or latent TB infection.
Pediatr. R espi r. Re v., 2013, vol. 14, no. 2, pp. S65.
19. Torres M. Effect of isoniazid on antigen-specific interferon-γ secretion in latent
tuberculosis. Eur. Respir. J., 2015, vol. 45, no. 2, pp. 473-482.
20. Whitworth H.S., Scott M., Connell D.W., Dongés B., Lalvani A. IGRAs-the
gateway to T cell based TB diagnosis. Metody, 2013, vol. 61, pp. 52-62. doi:
10.1016 / j. ymeth.2012.12.012.
ООО «Городская поликлиника»
5 Февраль 2018 00:00
Новый метод диагностики туберкулезной инфекции «T-SPOT»
Что такое тест для диагностики туберкулеза T-SPOT.TB?
T-SPOT.TB является in vitro диагностическим тестом (тест по анализу крови), основанный на выявлении секреции интерферона-гамма лимфоцитами, стимулированными специфическими антигенами Mycobacterium tuberculosis ESAT-6 и CFP-10.
Есть ли категории пациентов, которым противопоказана диагностика с помощью теста T-SPOT.TB?
Нет, данный тест может использоваться для обследования на туберкулез у всех групп пациентов (включая детей любого возраста) при любых заболеваниях и состояниях организма .
Влияют ли предшествующие прививки или назначения любых препаратов на результат теста T-SPOT.TB?
Нет, данный тест может использоваться в любое время, независимо от вакцинации и приема препаратов.
Влияет ли предшествующая вакцинация БЦЖ на результаты теста T-SPOT.TB?
Нет, не влияет. В отличие от кожных туберкулиновых проб, предшествующая вакцинация БЦЖ не влияет на результаты теста T-SPOT.TB . В тесте T-SPOT.TB используются два специфических антигена M. Tuberculosis (ESAT-6 и CFP 10), которые не дают перекрестную реакцию с вакциной БЦЖ и с большинством распространенных видов нетуберкулезных микобактерий (НТМ).
T-SPOT.TB – простой анализ крови для диагностики туберкулеза, который всегда продемонстрирует достоверный результат.
Как подготовиться к анализу крови по методу Т-SPOT.TB.
Особенной подготовки не требуется. Для проведения теста берется анализ крови из вены натощак.
Какое время необходимо для получения результатов анализа.
Результат анализа будет готов на следующий день
Кто состоит в группе риска развития туберкулеза?
Чаще подвержены инфицированию те, кто имеет:
— ВИЧ-инфекцию;
— сахарный диабет;
— онкозаболевания;
— лейкоз;
— заболевания почек;
— дефицит веса.
Пациенты этих групп часто имеют иммунодефицитные состояния, поэтому методом выбора в диагностике туберкулеза является тест T-SPOT.TB
С какого возраста можно делать тест Т-SPOT.TB?
Тест Т-SPOT.TB можно делать детям с рождения
Можно ли во время карантина в детском учреждении сделать тест Т-SPOT.TB?
Тест Т-SPOT.TB можно делать, если в детском коллективе карантин, в то время как кожные тесты необходимо проводить не ранее чем через месяц после снятия карантина
Был контакт с больным туберкулезом, через какое время пройти обследование на туберкулез?
При контакте с больным туберкулезом тест Т-СПОТ правильно провести через 8 недель после последнего контакта (время необходимо для формирования иммунного ответа).
Можно ли делать тест Т-СПОТ вместо пробы Манту для оформления карты в детские учреждения:
Возможно. Тест Т-SPOT.TB включен в Федеральные клинические рекомендации по диагностике и лечению латентной туберкулёзной инфекции у детей, утвержденные Российским обществом фтизиатров, под ред. д.м.н. проф. В.А. Аксеновой, 2015г.
Как часто надо проводить тестирование методом Т-SPOT.TB?
Как и любой иммунологический скрининг на туберкулез у детей необходимо проводить один раз в год. У пациентов групп риска тестирование проводится 2 раза в год.
Нормативная документация, регламентирующая профилактическое обследование на туберкулёз методом T-SPOT.TB:
1. Федеральные клинические рекомендации по диагностике и лечению латентной туберкулёзной инфекции у детей, утвержденные Российским обществом фтизиатров в 2015г.
2. Федеральные клинические рекомендации по профилактике, диагностике и туберкулеза у больных ВИЧ-инфекцией, утвержденные Российским обществом фтизиатров в 2016г под ред. д.м.н. проф. И.А. Васильевой
д.м.н. проф. И.А. Васильевой
3. Национальные клинические рекомендации «Фтизиатрия» под редакцией президента Национальной ассоциации фтизиатров, директора ФГБУ «СПб НИИФ» Минздрава России д-ра мед. наук, проф. П.К. Яблонского, 2015
4. Рекомендации по скринингу и мониторингу туберкулезной инфекции у больных, получающих генно-инженерные биологические препараты, утвержденные Ассоциацией ревматологов РФ.
5. Клинические рекомендации: Выявление и диагностика туберкулеза у детей, поступающих и обучающихся в образовательных организациях, утвержденные Российским обществом фтизиатров и МЗ в 2017г.
| ПРОЦЕДУРЫ | |||||
| Взятие крови без последующего лабораторного исследования | — | 350 р. | 8091 | ||
| Взятие крови из вены | — | 250 р. |
8089 | ||
| Взятие крови из пальца | — | 250 р. | 8090 | ||
| Взятие мазков на цитологию | — | 280 р. | 8094 | ||
| Взятия мазка для ПЦР-анализа | — | 280 р. | 8096 | ||
| Взятия мазка на бакпосев | — | 280 р. | 8097 | ||
| Взятия мазка на флору | — | 280 р. |
8095 | ||
| Взятия мазка на эозинофилы | — | 280 р. | 10020 | ||
| Инъекция в/м (по направлению врача) | — | 300 р. | 8098 | ||
| Инъекция п/к (по направлению врача) | — | 300 р. | 10018 | ||
| Приготовление проб для выполнения анализа | — | 250 р. | 8092 | ||
| Проведение нагрузки глюкозой | — | 200 р. |
8093 | ||
| КЛИНИЧЕСКИЙ АНАЛИЗ КРОВИ | |||||
| Клинический анализ крови (CBC) | 4-8 ч. | 620 р. | 1 д. | 310 р. | 8190 |
| Клинический анализ крови (CBC) + СОЭ | 4-8 ч. | 960 р. | 1 д. | 480 р. | 8191 |
| Клинический анализ крови CBC/Diff (Общий анализ крови с лейкоцитарной формулой) + СОЭ | 4-8 ч. | 1200 р. | 1 д. | 600 р. | 8192 |
| Клинический анализ крови CBC/Diff/Retic (Общий анализ крови с лейкоцитарной формулой и ретикулоцитами) + СОЭ | 4-8 ч. |
1700 р. | 1 д. | 850 р. | 8193 |
| Клинический анализ крови CBC8/Retic (Общий анализ крови с ретикулоцитами) + СОЭ | 4-8 ч. | 1580 р. | 1 д. | 790 р. | 8194 |
| Определение количества тромбоцитов (при абнормальных значениях выполняется световая микроскопия мазка) | 4-8 ч. | 620 р. | 1 д. | 310 р. | 8195 |
| Определение эритроцитов с базофильной зернистостью | 4-8 ч. | 500 р. | 1 д. | 250 р. | 8196 |
| СОЭ (Скорость Оседания Эритроцитов) | 4-8 ч. |
360 р. | 1 д. | 180 р. | 8197 |
| ПИЩЕВАЯ НЕПЕРЕНОСИМОСТЬ (IgG / IgG4) | |||||
| Тестирование на пищевую непереносимость (Biomerica) (Определение специфических IgG к 90 пищевым аллергенам) | — | до 3 д. | 12870 р. | 8185 | |
| Тестирование на пищевую непереносимость (Dr.Fooke) (Определение специфических IgG4 к 192 пищевым аллергенам) | — | до 3 д. | 22880 р. | 8187 | |
| Тестирование на пищевую непереносимость (Dr.Fooke) (Определение специфических IgG4 к 96 пищевым аллергенам) | — | до 3 д. |
14190 р. | 8186 | |
| ИММУНОГЕМАТОЛОГИЯ | |||||
| Аллоиммунные антиэритроцитарные антитела (в непрямой реакции Кумбса, включая антирезус Ат), кач.ан. | — | до 3 д. | 610 р. | 8416 | |
Туберкулез: как его выявить и обезвредить
На вопросы отвечает главный внештатный специалист, детский фтизиатр министерства здравоохранения Ульяновской области Валихан Насифуллаевна Утемишева.
– Какие меры предпринимаются сегодня для борьбы с этим опасным заболеванием?
– Для борьбы с туберкулезом проводятся профилактические мероприятия: вакцинация детей, раннее выявление, изоляция, лечение и реабилитация больных туберкулезом, а также содействие биологическому выздоровлению детей и подростков, инфицированных микобактерией туберкулеза. В нашей стране, как и во многих других странах мира, реализуется национальная программа профилактики туберкулеза. Проводится санитарная, социальная, вакцино- и химиопрофилактика.
В нашей стране, как и во многих других странах мира, реализуется национальная программа профилактики туберкулеза. Проводится санитарная, социальная, вакцино- и химиопрофилактика.
– Санитарная профилактика направлена на противодействие передачи микобактерии от одного человека другому?
– Да, она помогает предупредить инфицирование здоровых людей. Заболевание заразное, особенно если поражены органы дыхания и началась деструкция в очаге воспаления. Бактериовыделители (больные открытой формой туберкулеза) выделяют в окружающую среду микобактерии (МБТ) с капельками слизи и мокроты при чихании, кашле, разговоре. Поэтому основная задача санитарной профилактики туберкулеза – ограничить и сделать безопасным контакт с больным окружающих его здоровых людей в быту, в общественных местах, на работе.
– Распространенность туберкулеза – это сугубо медицинская проблема?
– Проблема имеет комплексный характер, в частности, большое значение имеет социальный аспект: бытовые условия жизни и качество питания, экологическая обстановка, соблюдение требований гигиены, индивидуальной защиты на производственных предприятиях, уровень физической активности населения, ситуация с употреблением психоактивных веществ, возможность санаторно-курортного лечения. Соответственно, для снижения распространенности туберкулеза проводится широкий комплекс профилактических мер по целому ряду направлений. Это повышение благосостояния, общей культуры и санитарной грамотности населения, борьба с загрязнением окружающей среды, формирование здорового образа жизни людей, в том числе развитие физической культуры и спорта, борьба с вредными привычками, расширение сети санаторно-курортных учреждений, повышение качества питания и другие.
Соответственно, для снижения распространенности туберкулеза проводится широкий комплекс профилактических мер по целому ряду направлений. Это повышение благосостояния, общей культуры и санитарной грамотности населения, борьба с загрязнением окружающей среды, формирование здорового образа жизни людей, в том числе развитие физической культуры и спорта, борьба с вредными привычками, расширение сети санаторно-курортных учреждений, повышение качества питания и другие.
– Дети – одна из наиболее уязвимых групп населения. Какие меры применяются для снижения вероятности заболевания детей?
– Профилактика туберкулеза начинается до рождения малыша – все взрослые старше 15 лет, окружающие будущую маму, должны пройти флюорографию. Так как дети обычно заражаются от взрослых больных, мама должна быть уверена, что вокруг ее ребенка будут находиться здоровые люди. Далее профилактика продолжается в родильном доме. Здоровым новорожденным на третьи-седьмые сутки жизни вводят вакцину против туберкулеза, БЦЖ (БЦЖ-М). Впоследствии этот искусственно созданный иммунитет ослабевает, поэтому в шесть-семь лет проводится ревакцинация БЦЖ не заразившимся МБТ детям. На момент вакцинации ребенок должен быть клинически здоров, обязателен осмотр врача-педиатра перед прививкой.
Впоследствии этот искусственно созданный иммунитет ослабевает, поэтому в шесть-семь лет проводится ревакцинация БЦЖ не заразившимся МБТ детям. На момент вакцинации ребенок должен быть клинически здоров, обязателен осмотр врача-педиатра перед прививкой.
– С какой целью проводится вакцинация?
– Вакцина защищает детей от тяжелых смертельных форм туберкулеза. Она изготовлена из живого, но ослабленного штамма микобактерии туберкулеза, утратившего вирулентность – способность вызывать заболевание, который, тем не менее, имеет способность приживаться в организме человека, размножаться в месте введения и вызывать ответную специфическую реакцию, сопровождающуюся аллергической перестройкой
организма.
– Как защитить ребенка, если кто-либо из родных и близких болен туберкулезом?
– Если в окружении ребенка выявляется больной родственник, сосед или сотрудник в детском учреждении, ребенок наблюдается как контактный у врача-фтизиатра, назначается обследование, профилактическое противотуберкулезное лечение в течение трех-шести месяцев. В очаге туберкулезной инфекции необходимо проводить постоянную влажную уборку, изолировать больного, например, направить в санаторий, после изоляции больного провести заключительную дезинфекцию.
В очаге туберкулезной инфекции необходимо проводить постоянную влажную уборку, изолировать больного, например, направить в санаторий, после изоляции больного провести заключительную дезинфекцию.
– Как узнать, заразился ребенок или нет?
– Узнать, заразился ребенок туберкулезом или нет, помогает проба Манту. В нашей области функционируют два прекрасных детских санатория: «Белое Озеро» в Николаевском районе и «Юлово» в Инзенском районе, где проводится не только контролируемое профилактическое лечение, но и оздоровление детей в возрасте от пяти до 14 лет с хроническими заболеваниями органов дыхания, часто и длительно болеющих детей; организовано обучение по общеобразовательным программам, т.е. социализация ребенка.
– Какие меры профилактики помогают снизить риск заболевания?
– Соблюдение элементарных правил личной гигиены: мыть руки после прихода с улицы, обязательно перед едой, после посещения туалета, не плеваться, не сорить где попало, бережно относиться к природе, ежедневно заниматься физической зарядкой, спортом, регулярно гулять на свежем воздухе, не отказываться от проб Манту, диаскинтеста и флюорографии. Также присутствие других простых и важных моментов, таких как полноценное сбалансированное питание, ведение здорового образа жизни, является надежной мерой повышения естественной устойчивости не только к туберкулезной инфекции, но и поможет подрастающему поколению вырасти здоровым, бодрым и счастливым.
Также присутствие других простых и важных моментов, таких как полноценное сбалансированное питание, ведение здорового образа жизни, является надежной мерой повышения естественной устойчивости не только к туберкулезной инфекции, но и поможет подрастающему поколению вырасти здоровым, бодрым и счастливым.
– Какие методы диагностики применяются для диагностики туберкулеза у подростков и тех детей, родители которых отказались от пробы?
– В подростковом возрасте происходит перестройка нейроэндокринного аппарата, поэтому данный возраст считается критическим. Оптимальным способом диагностики туберкулеза у подростков 15 – 17 лет является флюорография.
Родители и законные представители ребенка должны быть осведомлены, что не прошедшие обследование на туберкулез дети не допускаются в детский коллектив. Если родитель (законный представитель) ребенка отказывается от внутрикожных методов иммунодиагностики, возможно назначение альтернативных коммерческих иммунодиагностических тестов invitro: T-SPOT. TB (Т-СПОТ.ТБ) или QuantiFERON-TBGold (квантифероновый тест).
TB (Т-СПОТ.ТБ) или QuantiFERON-TBGold (квантифероновый тест).
В обоих случаях для проведения исследования осуществляется забор крови из вены. При отказе от любых иммунологических тестов врач может назначить обзорную рентгенографию органов грудной клетки ребенку с письменного согласия законного представителя.
Диагностика туберкулезной инфекции in vitro (в пробирке)
Диагностика туберкулезной инфекции in vitro (в пробирке)
В ряде случаев, из-за отказов родителей от постановки пробы Манту, Диаскинтеста или при наличии медицинских показаний с целью выявления латентной (скрытой) и активной туберкулезной инфекции показано проведение диагностических тестов in vitro (в пробирке).
Для этого, в Оксфордском Университете (Великобритания), был разработан иммунологический тест in vitro (в пробирке). «T-Spot-диагностика туберкулезной инфекции»- T-SPOT.TB
Для его проведения нужна кровь исследуемого.
Название T-SPOT.TB расшифровывается так:
литера T обозначает T-лимфоциты, клетки крови, на основе ответа которых производится исследование
Слово SPOT это перевод с английского языка, означающий «пятно». В результате лабораторного опыта в лунке образуются пятна, каждое из которых маркирует Т-лимфоцит.
TB это сокращенное международное обозначение туберкулеза
Показания к анализу крови методом T-SPOT.TB:
-Отказ от традиционных методов диагностики
-Скрининг лиц с иммуносупрессией (ВИЧ, прием цитостатиков и др)
-Аллергические заболевания в период обострения
-Аутоиммунные заболевания
— Сложные дифференциально-диагностические случаи
Важно помнить, что T-SPOT является способом количественной диагностики наличия в организме туберкулеза, но не дает возможности отличить активную форму туберкулеза от латентной.
T-SPOT не чувствителен к БЖЦ-вакцине и нетуберкулёзным микобактериям.
У T-SPOT нет противопоказаний и побочных реакций, вакцинацию БЦЖ можно проводить сразу после его проведения, отсутствует период ожидания реакции, так как анализ проводится с использованием крови in vitro.
Проба Манту с 2ТЕ и проба с Диаскинтестом, рентгенологические обследования проводятся на бесплатной основе. Иммунологические тесты in vitro (T-Spot, Quantiferon) проводятся как альтернативные методы, они не входят в программу государственных гарантий по организации бесплатной медицинской помощи гражданам и проводятся на платной основе.
где и как сдать ПЦР, анализ на антитела
Даниил Давыдов
разобрался с анализами
Профиль автораАнализы на коронавирусную инфекцию необходимы, чтобы разобраться, есть ли у человека с симптомами ОРВИ или пневмонии коронавирусная болезнь. А еще помогают понять, болел ли человек коронавирусной болезнью в прошлом и есть ли теперь у него иммунитет.
«Выяснить отношения» с коронавирусной инфекцией помогают два типа анализов:
- ПЦР-анализ на SARS-CoV-2.
- Тесты на антитела к этому вирусу.
О них эта статья.
Будьте внимательны к источникам информации о здоровье — и сходите к врачу
Эта статья — о коронавирусной болезни, или COVID-19. Во всех статьях о коронавирусной болезни мы придерживаемся позиции Всемирной организации здравоохранения, или ВОЗ. Прежде чем читать дальше, рекомендуем ознакомиться с позицией ВОЗ относительно COVID-19.
Во всех статьях о коронавирусной болезни мы придерживаемся позиции Всемирной организации здравоохранения, или ВОЗ. Прежде чем читать дальше, рекомендуем ознакомиться с позицией ВОЗ относительно COVID-19.
Наши статьи написаны с любовью к доказательной медицине. Мы ссылаемся на авторитетные источники и ходим за комментариями к докторам с хорошей репутацией. Но помните: ответственность за ваше здоровье лежит на вас и на лечащем враче. Мы не выписываем рецептов, мы даем рекомендации. Полагаться на нашу точку зрения или нет — решать вам.
ПЦР-тест на SARS-CoV-2
Что за анализ. Полимеразная цепная реакция (ПЦР) — молекулярно-генетический анализ, который помогает выявлять возбудителя — РНК коронавируса SARS-CoV-2 — в организме. Если в теле человека есть достаточное для определения в лаборатории количество коронавирусных частиц, ПЦР даст положительный результат — даже если человек чувствует себя здоровым.
ПЦР-тесты назначают:
- чтобы подтвердить или опровергнуть коронавирусную болезнь;
- чтобы убедиться, что пациент с коронавирусной болезнью выздоровел.

А вот кто входит в список людей с подозрением на коронавирусную болезнь:
- Все, кто близко контактировал с больным COVID-19.
- Все пациенты с диагнозом «внебольничная пневмония».
- Все люди старше 65 лет, обратившиеся за медицинской помощью с симптомами ОРВИ — кашлем, насморком, болью в горле, температурой, затрудненным дыханием.
- Медицинские работники с риском инфицирования COVID-19 на рабочих местах — они должны сдавать этот анализ раз в неделю.
- Все медицинские работники с симптомами ОРВИ.
- Все люди с симптомами ОРВИ, которые находятся в учреждениях постоянного пребывания, — это специальные учебно-воспитательные учреждения закрытого типа, кадетские корпуса, дома-интернаты, учреждения ФСИН России. Персонал таких организаций тоже должен сдавать анализ.
В Москве работодатели обязаны каждые две недели тестировать на коронавирус методом ПЦР не менее 10% сотрудников, которые ходят на работу.
ПЦР-тесты для всех вышеперечисленных групп граждан должны быть бесплатными.
Как подготовиться к анализу. За три часа до анализа нельзя есть и чистить зубы. За один-три часа до исследования не рекомендуется полоскать рот лекарственными средствами и рассасывать любые таблетки. Непосредственно перед взятием мазка не стоит жевать жевательную резинку. Если нос заложен, то перед процедурой нужно как следует высморкаться.
Как сдают анализ. РНК коронавируса будут искать в мазке со слизистой носоглотки или ротоглотки. Врач проведет по вашему нёбу и внутренней поверхности носа специальной стерильной палочкой, запечатает образец в контейнер и отправит на исследование.
Мазок для ПЦР-анализа врач может взять на дому. Жители Москвы могут сдать анализ в амбулаторном КТ-центре — это центр компьютерной томографии на базе государственной поликлиники или в государственной больнице.
Результаты анализа могут быть положительными или отрицательными. Если тест даст положительный результат, то руководитель лаборатории обязан в течение двух часов сообщить об этом в ближайшее отделение Роспотребнадзора и передать биоматериал в центр гигиены и эпидемиологии для повторного тестирования. Если центр подтвердит результат, человеку подтвердят диагноз «коронавирусная болезнь».
Если центр подтвердит результат, человеку подтвердят диагноз «коронавирусная болезнь».
Если результат отрицательный, это, к сожалению, не гарантирует, что человек не инфицирован. У теста есть предел чувствительности, так что небольшое количество вируса в организме анализ может и не выявить. Решение о дальнейших действиях примет врач. Если подозрения на COVID-19 все еще серьезные, например человек чувствует себя плохо, а КТ указывает на поражения легких, врач продолжит лечить человека и назначит повторный анализ.
Чтобы подтвердить выздоровление от коронавирусной болезни, надо получить два отрицательных результата ПЦР-теста. После этого пациенту закрывают больничный и он имеет право прекратить самоизоляцию. Без двух отрицательных результатов ПЦР-тестов выписаться нельзя — это требование Роспотребнадзора.
Где сдать бесплатно. Людям, которые чувствуют симптомы ОРВИ и подозревают, что уже болеют, стоит вызвать врача из поликлиники на дом. Доктор сам возьмет мазок на анализ и отправит его в лабораторию.
Где сдать за деньги. Сдавать ПЦР-тест на коронавирусную болезнь можно и в частной лаборатории за деньги. Но лаборатории имеют право брать биоматериал на исследования только у людей без признаков инфекции, не контактировавших с больными COVID-19. Если у вас есть симптомы ОРВИ, анализы в частной лаборатории не возьмут.
Получается, что сдавать ПЦР-тест за деньги имеет смысл только людям, которые чувствуют себя хорошо, но подозревают, что могут быть бессимптомными носителями болезни.
Сетевые частные клиники и лаборатории, где можно сдать ПЦР-анализ на коронавирус
Стоимость
2690 Р
Сроки
1 рабочий день с момента доставки в лабораторию
Стоимость
2895 Р в офисе, 4895 Р на дому
Сроки
1 календарный день с момента доставки в лабораторию
Стоимость
в клинике — 2500 Р, на дому в пределах Мкада — 4350 Р, на дому в пределах 30 км от Мкада — 5350 Р
Сроки
36 часов с момента взятия мазка
Стоимость
вв лаборатории — 2395 Р, на дому только в пределах 20 км от Мкада — 5395 Р
Стоимость
3500 Р
Полный список российских лабораторий, которые имеют право делать анализы на коронавирусную инфекцию, есть на сайте Роспотребнадзора.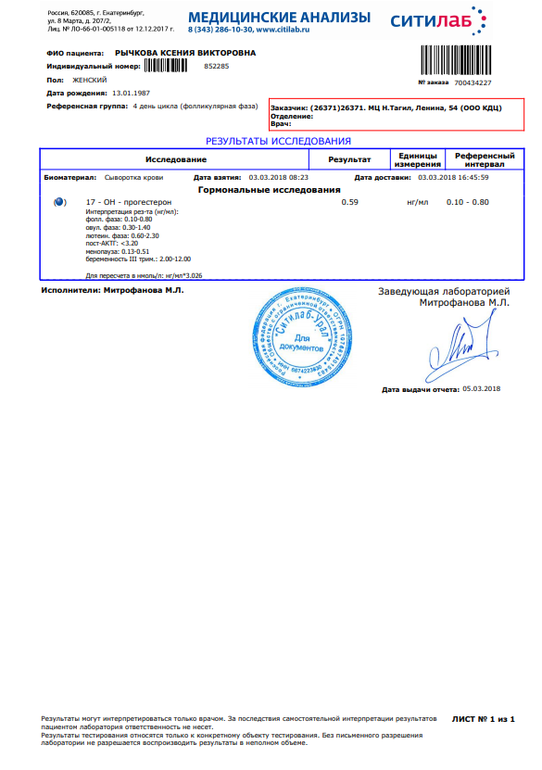
Лучше быть здоровым и богатым
Рассказываем, как выбрать хорошего врача и не платить за лишние анализы. Дважды в неделю — в вашей почте вместе с другими статьями о деньгах. Подпишитесь, это бесплатно
Тесты на антитела к SARS-CoV-2
Что за анализы. Тесты на антитела к SARS-CoV-2 позволяют выявить специфические антитела к коронавирусу — IgM, IgA и IgG, то есть обнаруживают иммунный ответ организма на инфекцию. Чаще всего определяют IgM и IgG. Сам вирус в организме тест не ищет.
Анализы на антитела назначают, чтобы разобраться, встречался ли когда-нибудь человек с коронавирусной болезнью. Вот какие могут быть варианты:
- если человек заразился примерно семь дней назад, в крови будет высокий уровень IgA или IgM и не будет или будет очень мало IgG. Скорее всего, при таком результате он до сих пор болеет;
- если с момента выздоровления прошло не больше двух недель, в крови будут определяться Ig всех трех типов;
- если человек переболел больше чем две недели назад, в крови не будет или будет очень мало IgA или IgM и будет повышенный уровень IgG.

Антитела IgM образуются в организме примерно на седьмой день болезни, у недавно заболевшего человека тест может дать ложноотрицательный результат. Именно поэтому врачи не назначают анализ на антитела для диагностики коронавирусной болезни.
Диагностическая интерпретация тестов, Минздрав ИспанииPDF, 721 КБ
ПЦР-тесты (PCR) определяют инфекцию на следующий день после заражения. РНК вируса определяется в крови до 21—30 дней — в зависимости от тяжести болезни. Тесты на антитела для диагностики коронавирусной болезни не используют, но антитела появляются примерно на четвертый — седьмой день с момента заражения. IgM появляются на шестой-седьмой день, а IgG — на десятый-одиннадцатыйЭто подтверждающие тесты: врачам они помогают понять, насколько эффективно организм человека борется с болезнью, а эпидемиологам с работодателями — разобраться, сколько человек уже переболело в конкретном регионе или в рабочем коллективе.
В Москве анализы назначают:
- Всем сотрудникам медицинских организаций Департамента здравоохранения города Москвы — еженедельно.

- Всем пациентам, которые лежат в больницах, — в день госпитализации.
- Пациентам, которые болеют дома и наблюдаются в КТ-центрах, — при первом обращении.
- Пациентам поликлиник — по направлению врача.
Кому рекомендуют сдать тест. Некоторые частные лаборатории рекомендуют сдать анализы на IgG, чтобы понять, есть ли у вас иммунитет к COVID-19. Антитела этого типа — это защитные белки, которые появляются в крови у людей, выздоровевших от коронавирусной болезни, а также у тех, кто переболел бессимптомно, приблизительно на третьей неделе с момента заражения. Однако мы пока не знаем, насколько надежно IgG защищают от повторного заражения коронавирусной болезнью.
Считать, что положительный анализ на IgG дает право жить как до эпидемии, нельзя. Самый надежный способ снизить опасность повторного заражения — продолжать придерживаться режима социального дистанцирования.
Как подготовиться к анализу. Специальной подготовки не требуется, но некоторые лаборатории советуют ничего не есть за 4 часа до сдачи крови. Чистую воду пить можно — так медсестре будет легче взять кровь.
Чистую воду пить можно — так медсестре будет легче взять кровь.
Как сдают анализ. Медсестра возьмет кровь из вены. Сдать кровь можно в офисе лаборатории или на дому.
Результаты анализа. Тесты на антитела бывают качественными и количественными.
Качественные тесты подтверждают сам факт наличия или отсутствия антител к коронавирусу в организме тестируемого человека. То есть дают ответ на вопрос, встречался ли человек с коронавирусом.
Положительный качественный тест на IgM говорит о том, что человек, вероятно, болен прямо сейчас. В этой ситуации нужно проконсультироваться с врачом — скорее всего, он порекомендует сдать ПЦР-тест на SARS-CoV-2. Если человек болел в прошлом, но уже выздоровел, тест на IgM, скорее всего, этого не покажет.
Положительный качественный тест на IgG говорит, что человек болел в прошлом, но, вероятно, уже выздоровел. Точнее сказать по этому тесту не получится.
Можно сделать качественный тест на IgM и IgG одновременно. Из всех качественных анализов этот тест самый информативный, потому что «ловит» оба типа иммуноглобулинов.
Из всех качественных анализов этот тест самый информативный, потому что «ловит» оба типа иммуноглобулинов.
Количественные тесты позволяют понять, сколько именно антител находится в вашей крови. Такие тесты нужны врачам и ученым. Если повторять количественный тест на IgG раз в 2—4 недели, то можно понять, нарастает ли иммунный ответ или снижается.
Где сдать бесплатно. Если тест назначает лечащий врач, он выдаст направление на бесплатный анализ. Если человек хочет сдать анализ по собственному желанию, сделать это придется в частной клинике за деньги или заказать тест на дом. Исключение — жители Москвы и Подмосковья. Департамент здравоохранения города Москвы организовал для них две бесплатные программы тестирования.
С 15 мая 2020 года началась программа бесплатного скринингового обследования москвичей на коронавирусную инфекцию. Это нужно, чтобы выявить бессимптомных носителей инфекции и людей, которые переболели COVID-19 и предположительно выработали иммунитет к вирусу.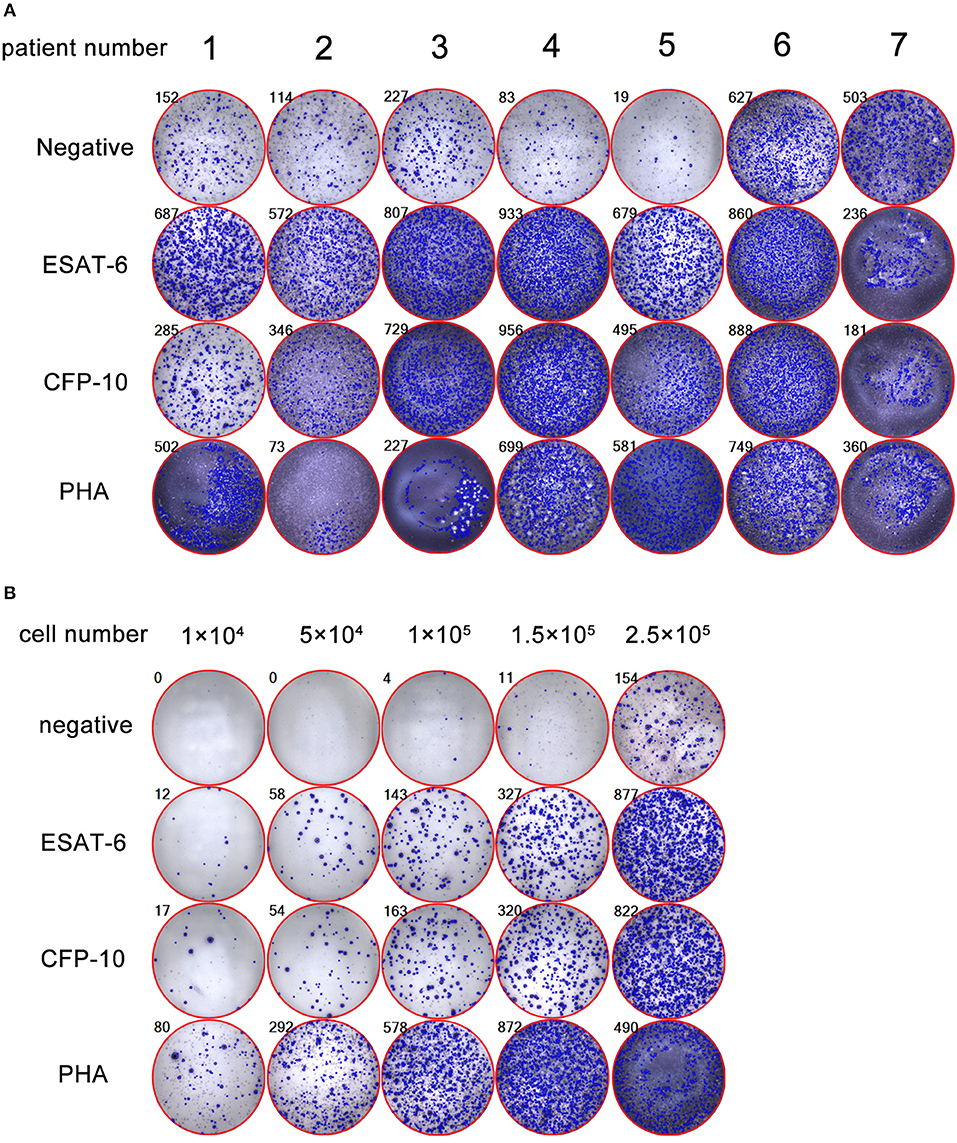 Попасть в скрининговую программу можно только по приглашению. Департамент выбирает участников случайным образом и присылает им приглашение смс-сообщением или на электронную почту. В письме будет ссылка с записью на тестирование, доступная три дня. При этом человек имеет право отказаться от тестирования.
Попасть в скрининговую программу можно только по приглашению. Департамент выбирает участников случайным образом и присылает им приглашение смс-сообщением или на электронную почту. В письме будет ссылка с записью на тестирование, доступная три дня. При этом человек имеет право отказаться от тестирования.
С 27 мая 2020 года началась еще одна программа тестирования на наличие антител к коронавирусу. В ней может добровольно поучаствовать любой здоровый совершеннолетний человек с московским полисом ОМС.
Как москвичам бесплатно сдать тест на антитела
В марте 2020 года я тяжело и долго болела, среди прочего меня беспокоила высокая, выше 39,5 °C, температура и сдавленность в груди. Как и многие, я надеялась, что уже переболела коронавирусом, поэтому решила сдать анализ на антитела к нему сразу, как тестирование станет общедоступным.
Полина
бесплатно протестировалась на коронавирус
В мае 2020 года в новостях появилась информация о том, что Мосгорздрав предлагает бесплатное тестирование на антитела к COVID-19. Я записалась на исследование через сайт «Мос-ру». Мне понадобилось только указать номер своего полиса ОМС и выбрать время. Сайт выдал обычный талончик, и в назначенный день я отправилась на тестирование.
Я записалась на исследование через сайт «Мос-ру». Мне понадобилось только указать номер своего полиса ОМС и выбрать время. Сайт выдал обычный талончик, и в назначенный день я отправилась на тестирование.
Я сдала тест в городской поликлинике соседнего района: в поликлинике по прописке провести такой анализ не предлагали. Для сдающих анализ организовали отдельный вход. Все меры безопасности были соблюдены: на входе выдавали маски, перчатки и бахилы, следили за тем, чтобы посетители сразу расходились по помещению для соблюдения дистанции. Я взяла с собой паспорт и полис, но они не понадобились: спросили только мою фамилию и время, на которое я была записана.
Затем мне пришлось заполнить согласие на проведение медицинских манипуляций и обработку личных данных. Этим документом я разрешала одновременно провести исследование и на коронавирус, и на антитела к нему. В одном кабинете брали мазки из носоглотки, в другом — кровь из вены. Вся процедура — от заполнения документов до взятия крови — заняла 15 минут.
Я узнала результаты исследования меньше чем за сутки: в воскресенье около семи вечера побывала в поликлинике, а в понедельник в первой половине дня они уже появились в моей электронной карте. В итоге у меня на руках два заключения, оба отрицательные.
Исследование на коронавирусы COVID-19 (2019-nCoV) Определение антител IgM и IgG к коронавирусу SARS-CoV-2Где сдать за деньги. Вот примеры частных клиник и лабораторий, где можно сдать анализы на антитела.
Где сдать платный анализ на антитела к коронавирусу
Анализ
Количественный на IgG
Цена с учетом забора крови
1250 Р
Сроки
2 рабочих дня
Анализ
Качественный на IgG
Цена с учетом забора крови
950 Р
Сроки
2 рабочих дня
Анализ
Качественный на IgG
Цена с учетом забора крови
1180 Р
Анализ
Качественный на IgM
Цена с учетом забора крови
1180 Р
Анализ
Качественный на IgM
Цена с учетом забора крови
1170 Р
Сроки
1 рабочий день, не считая дня сдачи анализа
Анализ
Качественный на IgG
Цена с учетом забора крови
1170 Р
Сроки
1 рабочий день, не считая дня сдачи анализа
Анализ
Качественный на IgM и IgG
Цена с учетом забора крови
2120 Р
Сроки
1 рабочий день, не считая дня сдачи анализа
Анализ
Экспресс-диагностика на IgM и IgG
Цена с учетом забора крови
3800 Р
Сроки
15—20 минут
Анализ
Качественный на IgA
Цена с учетом забора крови
2600 Р
Анализ
Качественный на IgG
Цена с учетом забора крови
2600 Р
Анализ
Качественный на IgA и IgG
Цена с учетом забора крови
4500 Р
Анализ
Качественный на IgG
Цена с учетом забора крови
1550—2200 Р в зависимости от тест-системы
Сроки
В течение часа
Анализ
Количественный на IgG
Цена с учетом забора крови
2000 Р
Анализ
Экспресс-диагностика на IgM и IgG
Цена с учетом забора крови
1600 Р
Сроки
2—3 часа
Анализ
Полуколичественный на IgG
Цена с учетом забора крови
1600 Р
Сроки
2—3 часа
Анализ
Количественный на IgM и IgG
Цена с учетом забора крови
3500 Р
Сроки
3—6 рабочих дней
Анализ
Качественный на IgM и IgG
Цена с учетом забора крови
5451 Р
Сроки
1 рабочий день
Экспресс-тест. Существует еще экспресс-тест, который можно заказать на дом с доставкой по России. Он предназначен для быстрого обнаружения IgG и IgM в сыворотке крови примерно за 10—15 минут. Это работает примерно как тест на беременность, только по капиллярной крови — нужно будет проколоть палец стерильным прокалывателем и капнуть немного крови на тест-полоску.
Существует еще экспресс-тест, который можно заказать на дом с доставкой по России. Он предназначен для быстрого обнаружения IgG и IgM в сыворотке крови примерно за 10—15 минут. Это работает примерно как тест на беременность, только по капиллярной крови — нужно будет проколоть палец стерильным прокалывателем и капнуть немного крови на тест-полоску.
Тест подойдет тем, кто сдает анализ «для себя» и кому не нужен официальный бланк с результатами анализа. Анализ на IgM и IgG (качественный тест) обойдется в 2000 Р. Сроки выполнения — несколько минут.
Как работает экспресс-тест. ИсточникGale Apps — Технические трудности
Технические трудности
Приложение, к которому вы пытаетесь получить доступ, в настоящее время недоступно. Приносим свои извинения за доставленные неудобства. Повторите попытку через несколько секунд.
Если проблемы с доступом сохраняются, обратитесь за помощью в наш отдел технической поддержки по телефону 1-800-877-4253. Еще раз спасибо, что выбрали Gale, обучающую компанию Cengage.
Еще раз спасибо, что выбрали Gale, обучающую компанию Cengage.
org.springframework.remoting.RemoteAccessException: невозможно получить доступ к удаленной службе [authorizationService@theBLISAuthorizationService]; вложенным исключением является Ice.UnknownException
unknown = «java.lang.IndexOutOfBoundsException: индекс 0 выходит за границы для длины 0
в java.base/jdk.internal.util.Preconditions.outOfBounds(Preconditions.ява: 64)
в java.base/jdk.internal.util.Preconditions.outOfBoundsCheckIndex(Preconditions.java:70)
в java.base/jdk.internal.util.Preconditions.checkIndex(Preconditions.java:248)
в java.base/java.util.Objects.checkIndex(Objects.java:372)
в java.base/java.util.ArrayList.get(ArrayList.java:458)
на com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure. populateSessionProperties(LazyUserSessionDataLoaderStoredProcedure.ява: 60)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.reQuery(LazyUserSessionDataLoaderStoredProcedure.java:53)
в com.gale.blis.data.model.session.UserGroupEntitlementsManager.reinitializeUserGroupEntitlements(UserGroupEntitlementsManager.java:30)
в com.gale.blis.data.model.session.UserGroupSessionManager.getUserGroupEntitlements(UserGroupSessionManager.java:17)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getProductSubscriptionCriteria(CrossSearchProductContentModuleFetcher.java:244)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getSubscribedCrossSearchProductsForUser(CrossSearchProductContentModuleFetcher.java:71)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getAvailableContentModulesForProduct(CrossSearchProductContentModuleFetcher.
populateSessionProperties(LazyUserSessionDataLoaderStoredProcedure.ява: 60)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.reQuery(LazyUserSessionDataLoaderStoredProcedure.java:53)
в com.gale.blis.data.model.session.UserGroupEntitlementsManager.reinitializeUserGroupEntitlements(UserGroupEntitlementsManager.java:30)
в com.gale.blis.data.model.session.UserGroupSessionManager.getUserGroupEntitlements(UserGroupSessionManager.java:17)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getProductSubscriptionCriteria(CrossSearchProductContentModuleFetcher.java:244)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getSubscribedCrossSearchProductsForUser(CrossSearchProductContentModuleFetcher.java:71)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getAvailableContentModulesForProduct(CrossSearchProductContentModuleFetcher. java:52)
в ком.gale.blis.api.authorize.strategy.productentry.strategy.AbstractProductEntryAuthorizer.getContentModules(AbstractProductEntryAuthorizer.java:130)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.isAuthorized(CrossSearchProductEntryAuthorizer.java:82)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.authorizeProductEntry(CrossSearchProductEntryAuthorizer.java:44)
в ком.gale.blis.api.authorize.strategy.ProductEntryAuthorizer.authorize(ProductEntryAuthorizer.java:31)
в com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody0(BLISAuthorizationServiceImpl.java:57)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody1$advice(BLISAuthorizationServiceImpl.java:61)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize(BLISAuthorizationServiceImpl.java:1)
на com.
java:52)
в ком.gale.blis.api.authorize.strategy.productentry.strategy.AbstractProductEntryAuthorizer.getContentModules(AbstractProductEntryAuthorizer.java:130)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.isAuthorized(CrossSearchProductEntryAuthorizer.java:82)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.authorizeProductEntry(CrossSearchProductEntryAuthorizer.java:44)
в ком.gale.blis.api.authorize.strategy.ProductEntryAuthorizer.authorize(ProductEntryAuthorizer.java:31)
в com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody0(BLISAuthorizationServiceImpl.java:57)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody1$advice(BLISAuthorizationServiceImpl.java:61)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize(BLISAuthorizationServiceImpl.java:1)
на com. gale.blis.auth._AuthorizationServiceDisp._iceD_authorize(_AuthorizationServiceDisp.java:141)
в com.gale.blis.auth._AuthorizationServiceDisp._iceDispatch(_AuthorizationServiceDisp.java:359)
в IceInternal.Incoming.invoke(Incoming.java:209)
в Ice.ConnectionI.invokeAll(ConnectionI.java:2800)
в Ice.ConnectionI.dispatch(ConnectionI.java:1385)
в Ice.ConnectionI.message(ConnectionI.java:1296)
в IceInternal.ThreadPool.запустить (ThreadPool.java: 396)
в IceInternal.ThreadPool.access$500(ThreadPool.java:7)
в IceInternal.ThreadPool$EventHandlerThread.run(ThreadPool.java:765)
в java.base/java.lang.Thread.run(Thread.java:834)
»
org.springframework.remoting.ice.IceClientInterceptor.convertIceAccessException(IceClientInterceptor.java:365) org.springframework.remoting.ice.IceClientInterceptor.вызывать (IceClientInterceptor.
gale.blis.auth._AuthorizationServiceDisp._iceD_authorize(_AuthorizationServiceDisp.java:141)
в com.gale.blis.auth._AuthorizationServiceDisp._iceDispatch(_AuthorizationServiceDisp.java:359)
в IceInternal.Incoming.invoke(Incoming.java:209)
в Ice.ConnectionI.invokeAll(ConnectionI.java:2800)
в Ice.ConnectionI.dispatch(ConnectionI.java:1385)
в Ice.ConnectionI.message(ConnectionI.java:1296)
в IceInternal.ThreadPool.запустить (ThreadPool.java: 396)
в IceInternal.ThreadPool.access$500(ThreadPool.java:7)
в IceInternal.ThreadPool$EventHandlerThread.run(ThreadPool.java:765)
в java.base/java.lang.Thread.run(Thread.java:834)
»
org.springframework.remoting.ice.IceClientInterceptor.convertIceAccessException(IceClientInterceptor.java:365) org.springframework.remoting.ice.IceClientInterceptor.вызывать (IceClientInterceptor. java:327) org.springframework.remoting.ice.MonitoringIceProxyFactoryBean.invoke(MonitoringIceProxyFactoryBean.java:71) org.springframework.aop.framework.ReflectiveMethodInvocation.proceed(ReflectiveMethodInvocation.java:186) org.springframework.aop.framework.JdkDynamicAopProxy.invoke(JdkDynamicAopProxy.java:212) com.sun.proxy.$Proxy130.authorize(Неизвестный источник) ком.gale.auth.service.BlisService.getAuthorizationResponse(BlisService.java:61) com.gale.apps.service.impl.MetadataResolverService.resolveMetadata(MetadataResolverService.java:65) com.gale.apps.controllers.DiscoveryController.resolveDocument(DiscoveryController.java:57) com.gale.apps.controllers.DocumentController.redirectToDocument(DocumentController.java:22) jdk.internal.reflect.GeneratedMethodAccessor301.invoke (неизвестный источник) Ява.base/jdk.internal.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.base/java.lang.reflect.Method.invoke(Method.java:566) org.springframework.
java:327) org.springframework.remoting.ice.MonitoringIceProxyFactoryBean.invoke(MonitoringIceProxyFactoryBean.java:71) org.springframework.aop.framework.ReflectiveMethodInvocation.proceed(ReflectiveMethodInvocation.java:186) org.springframework.aop.framework.JdkDynamicAopProxy.invoke(JdkDynamicAopProxy.java:212) com.sun.proxy.$Proxy130.authorize(Неизвестный источник) ком.gale.auth.service.BlisService.getAuthorizationResponse(BlisService.java:61) com.gale.apps.service.impl.MetadataResolverService.resolveMetadata(MetadataResolverService.java:65) com.gale.apps.controllers.DiscoveryController.resolveDocument(DiscoveryController.java:57) com.gale.apps.controllers.DocumentController.redirectToDocument(DocumentController.java:22) jdk.internal.reflect.GeneratedMethodAccessor301.invoke (неизвестный источник) Ява.base/jdk.internal.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.base/java.lang.reflect.Method.invoke(Method.java:566) org.springframework. web.method.support.InvocableHandlerMethod.doInvoke(InvocableHandlerMethod.java:215) org.springframework.web.method.support.InvocableHandlerMethod.invokeForRequest(InvocableHandlerMethod.java:142) org.springframework.web.servlet.mvc.method.annotation.ServletInvocableHandlerMethod.invokeAndHandle(ServletInvocableHandlerMethod.java:102) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.invokeHandlerMethod (RequestMappingHandlerAdapter.java:895) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.handleInternal (RequestMappingHandlerAdapter.java:800) org.springframework.web.servlet.mvc.method.AbstractHandlerMethodAdapter.дескриптор (AbstractHandlerMethodAdapter.java:87) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:1038) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:942) org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.
web.method.support.InvocableHandlerMethod.doInvoke(InvocableHandlerMethod.java:215) org.springframework.web.method.support.InvocableHandlerMethod.invokeForRequest(InvocableHandlerMethod.java:142) org.springframework.web.servlet.mvc.method.annotation.ServletInvocableHandlerMethod.invokeAndHandle(ServletInvocableHandlerMethod.java:102) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.invokeHandlerMethod (RequestMappingHandlerAdapter.java:895) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.handleInternal (RequestMappingHandlerAdapter.java:800) org.springframework.web.servlet.mvc.method.AbstractHandlerMethodAdapter.дескриптор (AbstractHandlerMethodAdapter.java:87) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:1038) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:942) org.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet. java:998) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:890) javax.servlet.http.HttpServlet.service(HttpServlet.java:626) org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:875) javax.servlet.http.HttpServlet.service(HttpServlet.java:733) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:227) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) орг.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:53) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.filters.HttpHeaderSecurityFilter.doFilter(HttpHeaderSecurityFilter.java:126) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.ява: 189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.
java:998) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:890) javax.servlet.http.HttpServlet.service(HttpServlet.java:626) org.springframework.web.servlet.FrameworkServlet.service(FrameworkServlet.java:875) javax.servlet.http.HttpServlet.service(HttpServlet.java:733) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:227) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) орг.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:53) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.filters.HttpHeaderSecurityFilter.doFilter(HttpHeaderSecurityFilter.java:126) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.ява: 189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain. java:162) org.springframework.web.servlet.resource.ResourceUrlEncodingFilter.doFilter(ResourceUrlEncodingFilter.java:63) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) орг.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.внутреннийDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.
java:162) org.springframework.web.servlet.resource.ResourceUrlEncodingFilter.doFilter(ResourceUrlEncodingFilter.java:63) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) орг.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.внутреннийDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain. internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:130) org.springframework.boot.web.servlet.support.ErrorPageFilter.access$000(ErrorPageFilter.java:66) org.springframework.boot.web.servlet.support.ErrorPageFilter$1.doFilterInternal(ErrorPageFilter.java:105) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) орг.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:123) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.web.trace.servlet.HttpTraceFilter.doFilterInternal(HttpTraceFilter.java:90) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.
internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:130) org.springframework.boot.web.servlet.support.ErrorPageFilter.access$000(ErrorPageFilter.java:66) org.springframework.boot.web.servlet.support.ErrorPageFilter$1.doFilterInternal(ErrorPageFilter.java:105) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) орг.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:123) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.web.trace.servlet.HttpTraceFilter.doFilterInternal(HttpTraceFilter.java:90) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter. java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.RequestContextFilter.doFilterInternal (RequestContextFilter.java: 99) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.FormContentFilter.doFilterInternal (FormContentFilter.java:92) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.HiddenHttpMethodFilter.
java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.RequestContextFilter.doFilterInternal (RequestContextFilter.java: 99) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.FormContentFilter.doFilterInternal (FormContentFilter.java:92) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.HiddenHttpMethodFilter. doFilterInternal (HiddenHttpMethodFilter.java:93) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.внутреннийDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:154) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:122) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.doFilterInternal(WebMvcMetricsFilter.java:107) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.
doFilterInternal (HiddenHttpMethodFilter.java:93) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.внутреннийDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:154) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:122) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.doFilterInternal(WebMvcMetricsFilter.java:107) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework. web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:200) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.core.StandardWrapperValve.invoke(StandardWrapperValve.ява: 202) org.apache.catalina.core.StandardContextValve.invoke(StandardContextValve.java:97) org.apache.catalina.authenticator.AuthenticatorBase.invoke(AuthenticatorBase.java:542) org.apache.catalina.core.StandardHostValve.invoke(StandardHostValve.java:143) org.apache.catalina.valves.ErrorReportValve.invoke(ErrorReportValve.java:92) org.apache.catalina.valves.AbstractAccessLogValve.invoke(AbstractAccessLogValve.ява: 687) org.apache.catalina.core.StandardEngineValve.invoke(StandardEngineValve.java:78) org.apache.catalina.connector.CoyoteAdapter.
web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:200) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.core.StandardWrapperValve.invoke(StandardWrapperValve.ява: 202) org.apache.catalina.core.StandardContextValve.invoke(StandardContextValve.java:97) org.apache.catalina.authenticator.AuthenticatorBase.invoke(AuthenticatorBase.java:542) org.apache.catalina.core.StandardHostValve.invoke(StandardHostValve.java:143) org.apache.catalina.valves.ErrorReportValve.invoke(ErrorReportValve.java:92) org.apache.catalina.valves.AbstractAccessLogValve.invoke(AbstractAccessLogValve.ява: 687) org.apache.catalina.core.StandardEngineValve.invoke(StandardEngineValve.java:78) org.apache.catalina.connector.CoyoteAdapter. service(CoyoteAdapter.java:357) org.apache.coyote.http11.Http11Processor.service(Http11Processor.java:374) org.apache.coyote.AbstractProcessorLight.process(AbstractProcessorLight.java:65) org.apache.coyote.AbstractProtocol$ConnectionHandler.process(AbstractProtocol.ява: 893) org.apache.tomcat.util.net.NioEndpoint$SocketProcessor.doRun(NioEndpoint.java:1707) org.apache.tomcat.util.net.SocketProcessorBase.run(SocketProcessorBase.java:49) java.base/java.util.concurrent.ThreadPoolExecutor.runWorker(ThreadPoolExecutor.java:1128) java.base/java.util.concurrent.ThreadPoolExecutor$Worker.run(ThreadPoolExecutor.java:628) org.apache.tomcat.util.threads.TaskThread$WrappingRunnable.запустить (TaskThread.java: 61) java.base/java.lang.Thread.run(Thread.java:834)
service(CoyoteAdapter.java:357) org.apache.coyote.http11.Http11Processor.service(Http11Processor.java:374) org.apache.coyote.AbstractProcessorLight.process(AbstractProcessorLight.java:65) org.apache.coyote.AbstractProtocol$ConnectionHandler.process(AbstractProtocol.ява: 893) org.apache.tomcat.util.net.NioEndpoint$SocketProcessor.doRun(NioEndpoint.java:1707) org.apache.tomcat.util.net.SocketProcessorBase.run(SocketProcessorBase.java:49) java.base/java.util.concurrent.ThreadPoolExecutor.runWorker(ThreadPoolExecutor.java:1128) java.base/java.util.concurrent.ThreadPoolExecutor$Worker.run(ThreadPoolExecutor.java:628) org.apache.tomcat.util.threads.TaskThread$WrappingRunnable.запустить (TaskThread.java: 61) java.base/java.lang.Thread.run(Thread.java:834)
(PDF) Сравнение специфических анализов крови in vitro с туберкулиновой кожной пробой для диагностики латентного туберкулеза до терапии анти-ФНО
показывает, что результаты этих тестов не полностью согласуются
с общепринятыми рекомендациями, поскольку пациенты были
включены в группе ЛТБИ в основном на основании результатов ТКП,
, которые были положительными у 30 пациентов группы II и могли соответствовать
ложноположительным результатам у вакцинированной БЦЖ популяции.
Показана высокая частота ложноположительных результатов
результатов ТКП от 6 до 10 мм при выборе порога 5 мм с промежуточными результатами ТСТ. Во Франции
до июля 2005 г. порог ТКП у пациентов с ИМИД составлял
10 мм, что отличалось от порога большинства других
стран (5 мм) и оправдывалось почти 100%
вакцинацией БЦЖ. .
89
Согласно проспективному исследованию
группы RATIO, у 4 из первых 13 случаев активного ТБ, получавших лечение
блокаторами ФНО, результат TST составлял от 6 до 10 мм (
10
5 и
личное общение). Это наблюдение привело к снижению
порога TST с 10 до 5 мм, что является пороговым значением
, широко используемым в других странах для выявления ЛТБИ перед терапией анти-TNFα
.
4630
Но риск заключался в назначении избытка антибиотиков
пациентам с промежуточными результатами ТКП только из-за
предыдущей вакцинации БЦЖ. Чтобы исследовать биологическую значимость этой рекомендации, мы проанализировали 10 пациентов с
Чтобы исследовать биологическую значимость этой рекомендации, мы проанализировали 10 пациентов с
промежуточным результатом ТКП, которые получали бы антибиотики, если бы
они начали терапию против TNFα после июля 2005 г. Результаты анализа in vitro
для эти пациенты значительно отличались от таковых
пациентов с ЛТБИ (группа II) и были сходны с таковыми с
результатом ТКП (5 мм по их количественным результатам.
Только 2 имели положительные результаты с CFP-10+ESAT -6 анализов ELISPOT
, и ни один из них не дал положительных результатов с анализами пролиферации тимидина
и анализами разведения PKH-26.Этот результат предполагает
, что это изменение порогового уровня привело к снижению
специфичности ТКП. Кроме того, используя анализ ROC-кривой, мы определили оптимальные пороговые значения TST для
диагноза ЛТБИ, учитывая, что положительное включение CFP-10 тимидина
было золотым стандартом ЛТИ. Интересно, что мы
Интересно, что мы
обнаружили, что оптимальное пороговое значение TST составляло 9 или 10 мм с использованием анализа включения тимидина
CFP-10, предполагая также, что
5-мм пороговое значение является слишком низким и может привести к диагностике ЛТИ в
избыток (данные не показаны).Логическим следствием является
возможность неправильного назначения антибиотиков, как было предложено другими,
31
и риск токсичности антибиотиков.
13–15
Таким образом, тесты in vitro, вероятно, обладают более высокой специфичностью, чем ТКП
в IMID для диагностики ЛТБИ, особенно с 5-мм отсечкой для
ТКП. Примечательно, что у этих 10 пациентов, которые не лечились антибиотиками
, не развилась дальнейшая активная туберкулезная инфекция после терапии
анти-ФНО.
В общей популяции анализы на высвобождение IFNc предлагают более
точный подход, чем ТКП, для выявления лиц с
ЛТБИ. Действительно, среди недавних контактов с больными ТБ и среди ВИЧ-
положительных пациентов такие результаты тестов идентифицировали контакт с M. tuberculosis
tuberculosis
лучше, чем ТКП.
12 32 33
За исключением ВИЧ-
положительного населения, пациенты с иммунодефицитом
не подвергались обследованию с анализом крови in vitro.Piana et al
обнаружили среди 96 пациентов с гематологическими нарушениями и
отрицательных результатов ТКП 34 (35%) с положительным результатом T-SPOT TB
.
21
Richeldi et al также обнаружили субклиническую активную инфекцию
у пациента с болезнью Крона с ложноотрицательным результатом
ТКП,
26
и совсем недавно, Efthimiou et al. ЛТБИ с отрицательным результатом ТКП и положительным результатом теста QFT-G
до терапии анти-ФНО.
27
Наши результаты и эти данные
предполагают лучшую чувствительность и специфичность анализов крови in vitro
, чем ТКП в IMID. Эти результаты должны быть подтверждены в
более крупных исследованиях.
В заключение, новые анализы in vitro на основе Т-клеток, исследующие
иммуноспецифический противотуберкулезный ответ, могут принести пользу пациентам с
IMID, несмотря на состояние иммунодепрессии, и могут стать мощным
новым инструментом диагностики ЛТБИ в IMID Население. В нашем исследовании
В нашем исследовании
, по сравнению с ТКП, тесты in vitro имели как лучшую
чувствительность, с положительными результатами у 5 пациентов с определенной ЛТИ
и отрицательными результатами ТКП, так и лучшую специфичность, с отрицательными
результатами в большинстве случаев. пациенты, имеющие промежуточные результаты ТКП (6–
10 мм) как единственные критерии ЛТИ. Эти тесты, и особенно коммерческие наборы
, нуждаются в дальнейшей оценке у пациентов с IMID
путем сравнения с результатами ТКП.
Профилактический прием противотуберкулезных антибиотиков перед терапией против ФНО
необходим при наличии определенных клинических и/или рентгенологических
признаков ЛТБИ. При отсутствии этих данных
специфические анализы крови на ТБ могут заменить ТКП для принятия решения о профилактическом лечении антибиотиками.
Аффилиации авторов
………………………………..
Джереми Селлам, Ксавье Мариетт, Rhumatologie, Больница Бисетр,
Assistance Publique-Hoˆpitaux de Paris, Universite´ Paris-Sud, Le Cream
Bicetre, France
Haifa Hamdi, Dominique Emilie, INSERM UMR-S764, Service de
Microbiologie-Immunologie Biologique, Hospital Antoine Be´clere,
Assistance Publique-Hoˆpitaux de Paris, Institut Paris-Sud sur les Cytokines,
Universite´ Paris-Sud, Clamart, France
Carine Roy, Gabriel Baron, Philippe Ravaud, Departement
d’Epide´miologie, Biostatistique et Recherche Clinique, Groupe Hospitalier
Bichat Claude-Bernard, Assistance Publique-Hoˆpitaux de Paris, Universite´
Paris VII, Париж, Франция
Marc Lemann, Служба гастроэнтерологии, Госпиталь Сен-Луи,
Assistance Publique-Hoˆpitaux de Paris, Париж, Франция 90 005
Xavier Pue’chal, Service de Rhumatologie, Centre Hospitalier du Mans, Le
Mans, France
Maxime Breban, Service de Rhumatologie, Hoˆpital Ambroise Pare,
Assistance Publique-Hopitaux de Paris, Boulogne, France
5
5 Фрэнсис Беренбаум, Служба ревматологии, Госпиталь Сен-Антуан,
Assistance Publique-Hoˆpitaux de Paris, Париж, Франция
Marc Humbert, Служба пульмонологии, Госпиталь Антуана Беклера,
Assistance Publique-Hoˆpitaux de Paris, Universite´ Paris-Sud, Clamart,
France
Karin Weldingh, Отделение инфекционных болезней и иммунологии,
Statens Serum Institut, Копенгаген, Дания
Таблица 5 Сравнение положительных результатов анализов in vitro у пациентов без латентной туберкулезной инфекции (ЛТБИ) и туберкулиновые
кожные пробы (TST) (5 мм, те, у которых нет признаков LTBI, за исключением результата TST между 6 и 10 мм (промежуточный ТКП) и
с ЛТИ (соответствует группе II)
Тест на антиген
Пациенты без ЛТБИ и ТКП
(5 мм
Пациенты с ТКП
6–10 мм Пациенты с ЛТИ Группа II 5 P
4
P
2
CFP-10 Тимидин 1/13 (7. 7)* 0/10 (0) 23/35 (65,7) 0,99 ,0,0001
7)* 0/10 (0) 23/35 (65,7) 0,99 ,0,0001
ПКХ-26 1/13 (7,7)* 0/10 (0) 16/35 (45,7) 0,99 0,008
ЭЛИСПОТ 0/13 (0) 1/10 (10) 18/35 (51,4) 0,43 0,03
ЭСАТ-6 Тимидин 0/8 (0) 0/3 (0) 10/19 (52,6) 1,0 0,22
ЭЛИСПОТ 1/8 ( 12,5) 1/3 (33,4) 16/19 (84,2) 0,50 0,12
*Различны 2 пациента с положительными результатами.
P
1
, пациенты с промежуточным результатом ТКП (6–10 мм) по сравнению с пациентами без ЛТБИ и результата ТКП (5 мм.P
2
, пациенты с промежуточным результатом ТКП (6–10 мм)
по сравнению с пациентами с ЛТБИ.
1614 Селлам, Хамди, Рой и др.
www.annrheumdis.com
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка браузера для приема файлов cookie
Существует множество причин, по которым файл cookie не может быть установлен правильно. Ниже приведены наиболее распространенные причины:
Ниже приведены наиболее распространенные причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы принять файлы cookie, или спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файл cookie.
- Ваш браузер не поддерживает файлы cookie. Попробуйте другой браузер, если вы подозреваете это.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы это исправить, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.
Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.

Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Предоставить доступ без файлов cookie потребует от сайта создания нового сеанса для каждой посещаемой вами страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в файле cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт
не может определить ваше имя электронной почты, если вы не решите ввести его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступ к
остальной части вашего компьютера, и только сайт, создавший файл cookie, может его прочитать.
Успехи в диагностике туберкулезной инфекции
Ситуация с туберкулезом в миреПо данным Всемирной организации здравоохранения (ВОЗ),1 треть населения мира в настоящее время имеет латентную туберкулезную инфекцию (ЛТИ).В 2006 г. в мире было зарегистрировано более 9200000 новых случаев туберкулеза (ТБ) с распространенностью более 14 миллионов человек и почти 1,7 миллиона летальных исходов, что составляет смертность 18%. ВОЗ считает, что уровень заболеваемости туберкулезом в мире достиг своего пика примерно в 2002 г., после чего он стабилизировался или начал снижаться, но этому факту противодействует рост населения, а это означает, что фактическое число новых случаев продолжается. подниматься. В 2005 г. в регионе Европы ВОЗ было зарегистрировано 426 717 случаев туберкулеза с показателем заболеваемости 48/100 000 жителей, с большой разницей между различными районами континента.
Туберкулез в Испании Согласно последним данным, опубликованным Испанской сетью эпидемиологического надзора (Red de Vigilancia Epidemiológica), в середине июля 2009 г. было зарегистрировано 3340 новых случаев туберкулеза.2
было зарегистрировано 3340 новых случаев туберкулеза.2
Согласно предварительным данным, опубликованным этой национальной центра, в 2009 г. зарегистрировано 6070 случаев туберкулеза. Однако к этим цифрам следует относиться с долей скептицизма, поскольку, несмотря на то, что ТБ является заболеванием, требующим обязательного уведомления, по оценкам, как минимум одна треть случаев не регистрируется.
Целевая популяция Имеющиеся данные о естественном течении ТБ свидетельствуют о том, что в первые два года после заражения Mycobacterium tuberculosis у 5–10 % инфицированных развивается туберкулез.3 При надлежащем иммунном ответе со стороны инфицированного человека, бацилла может оставаться неактивной в течение десятилетий или даже на протяжении всей жизни. Следовательно, диагностика и лечение туберкулезной инфекции будут более эффективными, если они будут направлены на лиц с повышенным риском прогрессирования инфекции в туберкулезное заболевание, включая недавно инфицированных лиц и пациентов с ослабленным иммунитетом. 4
4
Стандартным методом диагностики туберкулезной инфекции является туберкулиновая проба, которая после введения очищенного белкового производного (PPD) свидетельствует о состоянии предшествующей гиперчувствительности организма к указанному веществу. В Европе используется туберкулин PPD RT-23. В Соединенных Штатах есть два препарата, Аплисол и Туберсол, оба с одинаковым ответом на RT-23. Основным недостатком PPD является то, что используемые белки неспецифичны для M.tuberculosis, но они являются общими с другими нетуберкулезными микобактериями и Mycobacterium bovis, которые снижают специфичность указанного теста.
Иммунологическая основа Лица, инфицированные M.tuberculosis, реагируют на PPD отсроченной реакцией гиперчувствительности, опосредованной клетками (особенно Т-лимфоцитами), и через 48–72 ч в области инъекции появляется уплотнение. Этот гиперчувствительный ответ сохраняется на всю жизнь, хотя он может быть снижен у пожилых людей, а также при определенных клинических изменениях.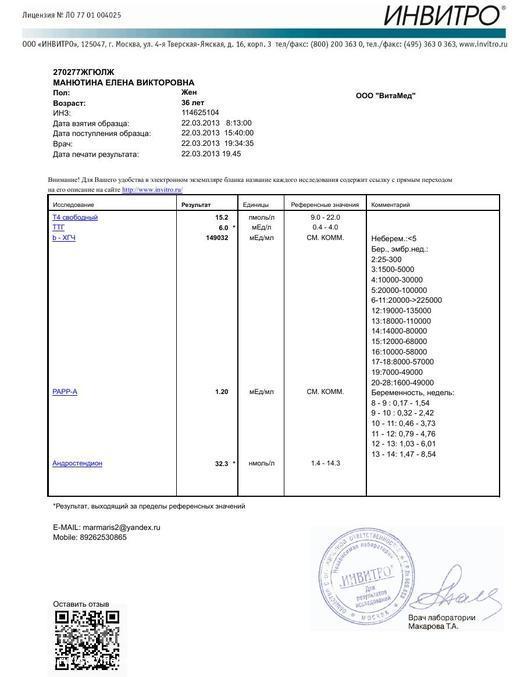 Повторный PPD у несенсибилизированного человека не сам по себе вызывает иммунный ответ.
Повторный PPD у несенсибилизированного человека не сам по себе вызывает иммунный ответ.
Техника Манту5 включает внутрикожную инъекцию 2 единиц туберкулина PPD RT-23 (0,1 мл) с помощью иглы 27-го калибра с внутренней стороны предплечья в область, где нет повреждений кожи. Для того чтобы техника была правильной, во время инъекции должна образоваться папула диаметром 6–10 мм. Это наиболее распространенный метод PPD.
Чтение и интерпретацияРезультаты считываются через 72 часа после инъекции путем измерения диаметра поперечного сечения уплотнения по продольной оси предплечья.Измерение производится в миллиметрах. В случаях, когда нет уплотнения, а есть только эритема, это интерпретируется как 0 мм.
По данным Испанского общества пульмонологов и торакальных хирургов (SEPAR), следующие уплотнения считаются положительными6:
- —
У невакцинированных лиц ≥5 мм.
- —
У лиц, вакцинированных БЦЖ, возникает проблема определения того, вызвана ли туберкулиновая индурация туберкулезной инфекцией или же ответом на антигены, общие с вакциной БЦЖ (M.
 бовис БЦЖ). В этой ситуации принимаются во внимание определенные клинические состояния, считая PPD-положительным с диаметром ≥5 мм, если, помимо вакцинации, субъекты либо живут, либо поддерживают частые контакты с бациллоносными больными, представляют рентгенограмму грудной клетки с поражениями, предполагающими перенесенный туберкулез которые никогда не лечились, инфицированы ВИЧ или больны пневмокониозом.
бовис БЦЖ). В этой ситуации принимаются во внимание определенные клинические состояния, считая PPD-положительным с диаметром ≥5 мм, если, помимо вакцинации, субъекты либо живут, либо поддерживают частые контакты с бациллоносными больными, представляют рентгенограмму грудной клетки с поражениями, предполагающими перенесенный туберкулез которые никогда не лечились, инфицированы ВИЧ или больны пневмокониозом. - —
У остальных субъектов, вакцинированных БЦЖ, результаты определяются как инфекция, а не вторичная реакция на вакцину, если размер уплотнения >15 мм.В целом реакция на вакцину обычно не вызывает уплотнений более 14 мм, и считается, что чем больше их размер и чем больше времени прошло с момента прививки, тем вероятнее, что это связано с туберкулезной инфекцией, а не с реакцией на вакцину. (исследования в этом направлении показывают, что влияние БЦЖ на туберкулиновую реакцию может быть ограничено через 10–15 лет после вакцинации)4
Чем выше вероятность заражения или развития заболевания (например, в лица, недавно контактировавшие с ВИЧ-инфицированными, или лица, инфицированные ВИЧ), в меньшей степени история вакцинации должна влиять на интерпретацию результатов теста.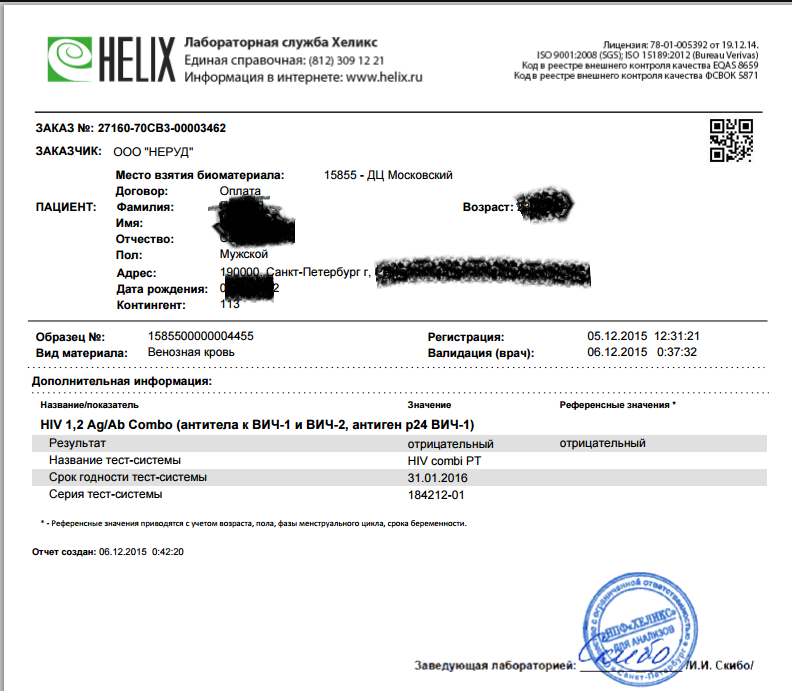 У пациентов, инфицированных ВИЧ, PPD
У пациентов, инфицированных ВИЧ, PPD
Туберкулиновые реакции с везикулами или некрозом в области инокуляции также считаются признаками туберкулезной инфекции, независимо от размера уплотнения или вакцинации в анамнезе.
В случае контактных исследований интерпретация довольно упрощена, так как не следует учитывать историю вакцинации, а уплотнение ≥5 мм считается признаком туберкулезной инфекции.
В таблице 1 приведены ситуации, которые могут привести к ложным положительным результатам теста.
Существуют определенные обстоятельства, зависящие от индивидуума, которые могут вызвать ложноотрицательные результаты при PPD, например, сопутствующая вирусная инфекция, вакцинация живыми вирусами, иммуносупрессивные ситуации или лечение препаратами, снижающими иммунный ответ.
В таблице 2 приведены ситуации, которые могут привести к ложноотрицательным результатам теста.
У некоторых людей, в основном у пожилых людей, инфицированных много лет назад или у лиц, вакцинированных в детстве, первоначальный PPD может быть отрицательным, а повторный тест через 7–10 дней может показать положительный результат.Этот феномен «усилителя» подразумевает, что первый PPD может иметь эффект памяти в иммунной системе, который после второго теста вызывает иммунный ответ. Окончательным результатом испытания считается результат второго чтения.
Так называемая туберкулиновая конверсия — это ситуация, в которой человек с PPD, считающийся отрицательным, позже становится положительным. Это представляет собой приобретение недавно перенесенной туберкулезной инфекции и определяется как «преобразователь». Функционально это определяется как человек, у которого туберкулиновая проба переходит от
мм к показателю ≥5 мм с разницей не менее 5 мм менее чем за 2 года. PPD, как и все диагностические тесты, следует использовать только у лиц, у которых возможное терапевтическое вмешательство может быть основано на результатах. 3 При ТБ есть только две возможности для терапевтического вмешательства: лечение пациентов и химиопрофилактика или превентивное лечение. инфицированных пациентов с высоким риском развития туберкулеза.
3 При ТБ есть только две возможности для терапевтического вмешательства: лечение пациентов и химиопрофилактика или превентивное лечение. инфицированных пациентов с высоким риском развития туберкулеза.
В таблице 3 показаны показания для PPD в соответствии с SEPAR.6
Новые методы диагностики туберкулезной инфекции in vitroВ последние годы были исследованы и одобрены новые методы диагностики, основанные на количественном определении клеточного иммунного ответа in vitro.Эти методы, обычно называемые в литературе анализом высвобождения гамма-интерферона (IGRA), определяют высвобождение гамма-интерферона в ответ на специфические туберкулезные антигены.7
Иммунный ответ на туберкулезную инфекцию , и его участие имеет важное значение в иммунном ответе, который защищает от указанного микроорганизма. Этот цитокин, продуцируемый CD4+, CD8+ и NK Т-лимфоцитами, активирует инфицированные макрофаги с последующим высвобождением IL-1 и TNF-α, ограничивая рост и размножение микобактерий.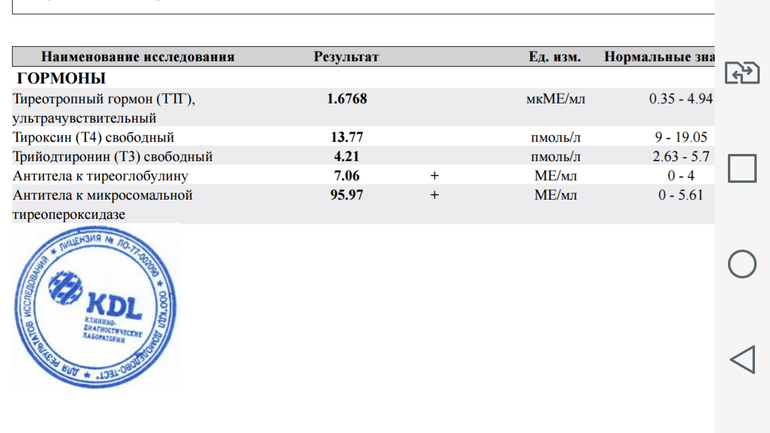 Люди с дефицитом рецепторов или генов, кодирующих синтез этой молекулы, более подвержены микобактериальным инфекциям с большей частотой и большей степенью тяжести.
Люди с дефицитом рецепторов или генов, кодирующих синтез этой молекулы, более подвержены микобактериальным инфекциям с большей частотой и большей степенью тяжести.
Существует два коммерческих метода диагностики туберкулезной инфекции in vitro: QuantiFERON-TB-Gold In Tube (Cellestis®, Виктория, Австралия)8 и T-SPOT.TB (Oxford Immunotec®, Оксфорд, Соединенное Королевство). ).9 Первое поколение QuantiFERON-TB, одобренное Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в 2001 году, обнаруживало высвобождение гамма-интерферона в ответ на PPD.В 2004 году FDA одобрило второе поколение этого диагностического теста, известное как QuantiFERON-TB Gold, в котором, в отличие от первого поколения, не использовался PPD в качестве микобактериальных антигенов, а вместо этого использовались синтетические пептиды, имитирующие более специфические антигены, такие как Early Secreted Антигенная мишень-6 (ESAT-6) и белок культурального фильтрата-10 (CFP-10). Эти две молекулы кодируются областью RD-1 генома M.tuberculosis и значительно повышают специфичность по сравнению с PPD. Эти антигены отсутствуют у М.bovis БЦЖ и у большинства нетуберкулезных микобактерий (кроме Mycobacterium kansasii, Mycobacterium marinum, Mycobacterium szulgai) (табл. 4).
Эти две молекулы кодируются областью RD-1 генома M.tuberculosis и значительно повышают специфичность по сравнению с PPD. Эти антигены отсутствуют у М.bovis БЦЖ и у большинства нетуберкулезных микобактерий (кроме Mycobacterium kansasii, Mycobacterium marinum, Mycobacterium szulgai) (табл. 4).
В настоящее время на рынке представлено третье поколение этого теста, известное как QuantiFERON-TB Gold In Tube (QFT-GIT), которое включает третий микобактериальный антиген: TB 7.7, и пробирки, специально предназначенные для взятия образцов крови для этого теста. (таблица 5).
Методы испытаний и интерпретация- 1.
QFT-GIT: В этом методе используются 3 специальные пробирки, которые входят в комплект реагентов (одна из пробирок включает ESAT-6, CFP-10 и TB 7.7 специфических туберкулезных антигенов, называемых проблемной трубкой; другой содержит фитогемагглютинин, который является положительной контрольной пробиркой; а третья не содержит реагентов (пробирка с отрицательным контролем).
 Всего требуется 3 мл крови (1 мл на пробирку), и кровь извлекается непосредственно в сами пробирки. Затем после встряхивания пробирки инкубируют в течение 18–22 ч при 37°С, после чего пробирки центрифугируют и полученную плазму используют для иммуноферментного анализа, который выявляет и количественно определяет гамма-интерферон, высвобождаемый лимфоцитами лейкоцитов. пациент.Этот шаг может быть выполнен либо вручную, либо полностью автоматически. После инкубации плазма может храниться несколько недель без ущерба для результатов, что при необходимости облегчило бы организацию работы лаборатории. В методике используется специальное программное обеспечение для выдачи результатов.
Всего требуется 3 мл крови (1 мл на пробирку), и кровь извлекается непосредственно в сами пробирки. Затем после встряхивания пробирки инкубируют в течение 18–22 ч при 37°С, после чего пробирки центрифугируют и полученную плазму используют для иммуноферментного анализа, который выявляет и количественно определяет гамма-интерферон, высвобождаемый лимфоцитами лейкоцитов. пациент.Этот шаг может быть выполнен либо вручную, либо полностью автоматически. После инкубации плазма может храниться несколько недель без ущерба для результатов, что при необходимости облегчило бы организацию работы лаборатории. В методике используется специальное программное обеспечение для выдачи результатов. - 2.
T-SPOT.TB: Для проведения этой методики используется 8–10 мл гепаринизированной крови. В лаборатории, следуя указаниям производителя, отделяют мононуклеарный слой, в котором после промывки и последующего подсчета количество клеток будет доведено до количества 250000 клеток/мл.Это количество будет использовано в качестве инокулята в 4 лунках, включенных в этот тест (2 лунки с антигенами ESAT-6 и CFP-10, а остальные 2 для положительного и отрицательного контроля).
 Планшет инкубируют в течение 18–22 часов при 37°C в инкубаторе с СО2, после чего делают иммунозондирование, позволяющее количественно определить количество клеток, продуцирующих интерферон (наблюдают в виде пятен, каждое пятно представляет собой след отдельного T -лимфоцитарный секретор интерферона). Алгоритм интерпретации, разработанный производителем, облегчает выдачу результатов.Технически, T-SPOT.TB требует больше крови, больше времени на подготовку и требует больше усилий, чем QFT-GIT. Кроме того, он не позволяет работать с образцами по-другому. Рекомендации, рекомендованные производителями этих тестов для их интерпретации, приведены в таблицах 5 и 6.8,9
Планшет инкубируют в течение 18–22 часов при 37°C в инкубаторе с СО2, после чего делают иммунозондирование, позволяющее количественно определить количество клеток, продуцирующих интерферон (наблюдают в виде пятен, каждое пятно представляет собой след отдельного T -лимфоцитарный секретор интерферона). Алгоритм интерпретации, разработанный производителем, облегчает выдачу результатов.Технически, T-SPOT.TB требует больше крови, больше времени на подготовку и требует больше усилий, чем QFT-GIT. Кроме того, он не позволяет работать с образцами по-другому. Рекомендации, рекомендованные производителями этих тестов для их интерпретации, приведены в таблицах 5 и 6.8,9
не создают помех для вакцины БЦЖ, избегают субъективности интерпретации, избегают встречи для ознакомления с результатами, и они включают положительный контроль, который дает ценную информацию для интерпретации явно отрицательного теста либо как истинно отрицательного, либо как неопределенного как результате технических ошибок или из-за иммуносупрессии.
Из-за отсутствия настоящего эталонного теста для диагностики туберкулезной инфекции трудно установить чувствительность и специфичность этих новых диагностических методов.
Для решения проблемы чувствительности использовались три стратегии: (1) обследование пациентов с активным туберкулезом, которые, следовательно, должны быть инфицированы; (2) оценить лиц, находившихся в контакте с больными туберкулезом, и стратифицировать их по степени воздействия; (3) проанализировать соответствие между тестами определения IGRA и PPD.10,11
Клиническая эффективность методов определения IGRA у иммунокомпетентных пациентов Важным аспектом передачи ТБ является то, что риск заражения в основном определяется частотой, продолжительностью и близостью контакта с человеком, у которого диагностирован туберкулез. Поэтому, чтобы новый метод считался более чувствительным и более специфичным, чем PPD, он должен быть более тесно связан с уровнем воздействия и не должен принимать во внимание состояние вакцинации (БЦЖ). Эта теория использовалась для сравнения степени точности методов определения IGRA с PPD в контактных исследованиях,11,12 которые пришли к выводу, что эти новые методы коррелируют так же хорошо или даже лучше, чем PPD, независимо от БЦЖ.
Эта теория использовалась для сравнения степени точности методов определения IGRA с PPD в контактных исследованиях,11,12 которые пришли к выводу, что эти новые методы коррелируют так же хорошо или даже лучше, чем PPD, независимо от БЦЖ.
В одном из самых крупных опубликованных на сегодняшний день исследований, включавшем 535 субъектов,12 на результаты QTF-GIT и T-SPOT.TB не повлияла вакцинация БЦЖ в анамнезе, хотя это произошло с туберкулиновым тестом, что свидетельствует о большей специфичности первого.Кроме того, IGRA также лучше коррелирует с подверженностью заболеванию туберкулезом.13–18 В одном из исследований, проведенных с участием детей, подвергшихся воздействию,18 была обнаружена зависимость доза-реакция между бактериальной нагрузкой в мокроте и положительным результатом IGRA. Те, кто был в контакте с больными с большей бактериальной обсемененностью мокроты, чаще имели положительные IGRA и туберкулиновые тесты.19–22
Клиническая эффективность QTF-ЖКТ и T-SPOT. наиболее важная причина коинфекции у пациентов, инфицированных ВИЧ, ситуация, которая затрагивает примерно 13 миллионов человек в мире. 1 В Африке ТБ является основной причиной смерти пациентов, инфицированных ВИЧ, и, кроме того, это наиболее частое заболевание у пациентов со СПИДом, получающих антиретровирусные препараты. Выявление LTI имеет решающее значение для лиц, инфицированных ВИЧ, поскольку у них более высокий уровень прогрессирования заболевания туберкулезом, чем у неинфицированных лиц, даже если они проходят антиретровирусное лечение.
1 В Африке ТБ является основной причиной смерти пациентов, инфицированных ВИЧ, и, кроме того, это наиболее частое заболевание у пациентов со СПИДом, получающих антиретровирусные препараты. Выявление LTI имеет решающее значение для лиц, инфицированных ВИЧ, поскольку у них более высокий уровень прогрессирования заболевания туберкулезом, чем у неинфицированных лиц, даже если они проходят антиретровирусное лечение.Диагноз LTI у пациентов, инфицированных ВИЧ, традиционно основывался на PPD, который, в дополнение к упомянутым выше недостаткам, добавляет у этих пациентов значительный уровень анергии.23,24
По сравнению с PPD, данные о текущем поколении методов определения IGRA предполагают большую специфичность,25 меньше ложноположительных результатов из-за предыдущей вакцинации БЦЖ26 и большую чувствительность в популяциях с низкой заболеваемостью ТБ.27 Однако, имеется мало данных, описывающих эффективность IGRA у лиц, инфицированных ВИЧ, чьи иммунные изменения могут повлиять на выполнение этих тестов, основанных на активации лимфоцитов. 28
28
Что касается диагностической эффективности IGRA у лиц, инфицированных ВИЧ, серия исследований подтвердила более высокую чувствительность T-SPOT.ТБ над ППД. Недавнее исследование23 показало, что T-SPOT.TB более чувствителен, чем PPD, и лучше коррелирует с активным туберкулезом.
Что касается уровня CD4, несколько авторов29 обнаружили ряд неопределенных результатов, связанных с уровнями CD4 у пациентов. Так, частота неопределенных результатов у больных с CD4≥100 клеток/мм3 составила 3%, а у больных с CD43
— 24%. Если принять во внимание вирусную нагрузку, количество неопределенных результатов увеличивается пропорционально ее увеличению.Так, например, у пациентов с неопределяемой вирусной нагрузкой было получено 15% неопределенных результатов. У пациентов, отнесенных к категории 2 (1log−4logРНК ВИЧ-копий/мл), были получены 17% неопределенных результатов; в категории 3 (4log-7logРНК ВИЧ-1 копий/мл) она составила 28%.30,31Воспалительные заболевания кишечника Воспалительные заболевания кишечника (ВЗК) включают гетерогенную группу заболеваний, протекающих с хроническим воспалением слизистой оболочки желудочно-кишечного тракта. До трети больных ВЗК имеют тяжелую форму заболевания, что требует применения иммуномодулирующих препаратов или биологических препаратов для контроля неадекватной реакции иммунной системы у этих больных.Фактор некроза опухоли альфа (TNF-α) представляет собой провоспалительный цитокин, который играет важную роль в патогенезе ВЗК. Было показано, что инфликсимаб (IFX), моноклональное антитело IgG1, которое специфически связывается с TNF-α, индуцирует и поддерживает ремиссию как при болезни Крона, так и при язвенном колите.
До трети больных ВЗК имеют тяжелую форму заболевания, что требует применения иммуномодулирующих препаратов или биологических препаратов для контроля неадекватной реакции иммунной системы у этих больных.Фактор некроза опухоли альфа (TNF-α) представляет собой провоспалительный цитокин, который играет важную роль в патогенезе ВЗК. Было показано, что инфликсимаб (IFX), моноклональное антитело IgG1, которое специфически связывается с TNF-α, индуцирует и поддерживает ремиссию как при болезни Крона, так и при язвенном колите.
В 2001 году FDA сообщило о 70 случаях туберкулеза из 147 000 пациентов, получавших IFX во всем мире, как по поводу ВЗК, так и по поводу ревматоидного артрита.Две трети случаев были обнаружены в Европе, а Испания была европейской страной с наибольшим числом пораженных пациентов.32 У большинства была внелегочная локализация с диссеминированным заболеванием в 24% случаев. Этот тип туберкулезного заболевания связан с иммуносупрессией, что позволяет предположить, что TNF-α играет важную роль в ответе хозяина на туберкулез, который включает образование гранулем. 33 Учитывая, что большинство случаев возникло после начала лечения IFX. , что распространенность ТБ в их странах была низкой и что они недавно не контактировали с пациентами с диагнозом ТБ, они пришли к выводу, что ТБ был вызван реактивацией LTI.34 Эти результаты поддерживают рекомендацию о принятии мер для исключения наличия LTI до начала лечения антителами против TNF-α. В нашей стране Испанская группа по болезни Крона и язвенному колиту (Grupo Español para la Enfermedad de Crohn y la Colitis Ulcerosa — GETECCU) опубликовала свои собственные рекомендации35 в 2003 г., которые были пересмотрены в 2006 г.36, согласно которым пациенты с диагнозом LTI должны получить лечение изониазидом до начала лечения биологическими препаратами.Результаты, полученные на сегодняшний день, показывают значительное снижение случаев ТБ в этой популяции.37–39
33 Учитывая, что большинство случаев возникло после начала лечения IFX. , что распространенность ТБ в их странах была низкой и что они недавно не контактировали с пациентами с диагнозом ТБ, они пришли к выводу, что ТБ был вызван реактивацией LTI.34 Эти результаты поддерживают рекомендацию о принятии мер для исключения наличия LTI до начала лечения антителами против TNF-α. В нашей стране Испанская группа по болезни Крона и язвенному колиту (Grupo Español para la Enfermedad de Crohn y la Colitis Ulcerosa — GETECCU) опубликовала свои собственные рекомендации35 в 2003 г., которые были пересмотрены в 2006 г.36, согласно которым пациенты с диагнозом LTI должны получить лечение изониазидом до начала лечения биологическими препаратами.Результаты, полученные на сегодняшний день, показывают значительное снижение случаев ТБ в этой популяции.37–39
Пациенты с хроническими воспалительными ревматическими заболеваниями имеют высокий риск ТБ, который еще больше увеличился после включения биологической терапии. В большинстве случаев заболевание возникает вследствие реактивации латентной инфекции; поэтому его заболеваемость значительно варьирует в зависимости от распространенности инфекции в изучаемой области.
В большинстве случаев заболевание возникает вследствие реактивации латентной инфекции; поэтому его заболеваемость значительно варьирует в зависимости от распространенности инфекции в изучаемой области.
Практика систематического скрининга как на инфекцию, так и на туберкулез до начала биологической терапии привела к снижению заболеваемости ТБ среди этой группы населения.Опыт испанской когорты пациентов, получавших лечение биологическими препаратами (BIOBADASER) Испанского общества ревматологов, показывает снижение случаев ТБ с момента внедрения официальных рекомендаций в 2002 г. по сравнению с предыдущими годами (117 против 522 случаев/100 000 человек в год). , соответственно). Тем не менее, мы должны также отметить значительное увеличение использования этанерцепта (человеческий белок, состоящий из рецептора p75 фактора некроза опухоли и части Fc человеческого IgG1) во время второго периода исследования в ущерб IFX, который может частично объяснить снижение заболеваемости.Даже если предположить эффективность этих мер, заболеваемость туберкулезом в этом коллективе больных по-прежнему почти в пять раз выше, чем среди населения Испании в целом. Этот факт можно объяснить несколькими причинами: неадекватным применением протоколов, несоблюдением режима лечения туберкулезной инфекции, экзогенной реинфекцией и ограничениями PPD для диагностики латентной инфекции в клиническом контексте этих пациентов.
Этот факт можно объяснить несколькими причинами: неадекватным применением протоколов, несоблюдением режима лечения туберкулезной инфекции, экзогенной реинфекцией и ограничениями PPD для диагностики латентной инфекции в клиническом контексте этих пациентов.
Опыт с IGRA в диагностике LTI при заболеваниях, опосредованных воспалительными механизмами, все еще довольно ограничен и основан на небольших перекрестных исследованиях, сосредоточенных на оценке соответствия между PPD и IGRAs, без корреляции результатов с факторами риска туберкулезной инфекции.Они пришли к выводу, что согласие между PPD и IGRA низкое и что противоречивые результаты (PPD+, IGRA-) связаны с предыдущей вакцинацией БЦЖ.37–41
Что касается корреляции между IGRA и факторами риска ТБ, в недавнем исследовании из 142 пациентов с заболеванием, опосредованным воспалительным механизмом,37 IGRA были более тесно связаны с факторами риска LTI, чем туберкулин. Более того, положительный результат PPD коррелировал с предыдущей вакцинацией БЦЖ, что неверно для IGRA. Мартин и др.39 сравнили два теста IGRA у пациентов с ревматоидным артритом и обнаружили, что как QTF-ЖКТ, так и T-SPOT.TB коррелируют с факторами риска ТБ.
Более того, положительный результат PPD коррелировал с предыдущей вакцинацией БЦЖ, что неверно для IGRA. Мартин и др.39 сравнили два теста IGRA у пациентов с ревматоидным артритом и обнаружили, что как QTF-ЖКТ, так и T-SPOT.TB коррелируют с факторами риска ТБ.
На основании имеющихся данных можно сделать вывод, что у пациентов с воспалительным заболеванием, опосредованным иммунными механизмами, которые проходят лечение иммунодепрессантами, специфичность IGRA выше, чем PPD.
Хроническая почечная недостаточность Пациенты с хронической почечной недостаточностью (ХПН), нуждающиеся в гемодиализе или перитонеальном диализе, являются примером популяции, для которой характерно проявление кожной анергии к антигенам PPD и которая имеет высокий риск развития активного ТБ42–45.Этот риск примерно в 10–25 раз выше для реактивации LTI по сравнению с общей популяцией. связаны с многочисленными изменениями иммунной системы, большинство из которых связано с изменением клеточного иммунитета. 50,51 Среди них снижение пролиферативной реакции лимфоцитов, дефицит интерлейкина-2, дефицит периферических В-лимфоцитов и усиление клеточного апоптоза.52–54 В недавнем исследовании 203 пациентов с ХПН, находящихся на гемодиализе,55 сравнивались три метода диагностики туберкулезной инфекции (PPD, T-SPOT.TB и экспертная оценка). PPD показал очень низкую чувствительность и показал положительный результат только у одного из каждых пяти пациентов. T-SPOT.TB был положительным примерно у трех из каждых четырех пациентов с факторами риска LTI. Чувствительность, подтвержденная группой экспертов, подтвердивших случаи LTI, составила почти 75%.
50,51 Среди них снижение пролиферативной реакции лимфоцитов, дефицит интерлейкина-2, дефицит периферических В-лимфоцитов и усиление клеточного апоптоза.52–54 В недавнем исследовании 203 пациентов с ХПН, находящихся на гемодиализе,55 сравнивались три метода диагностики туберкулезной инфекции (PPD, T-SPOT.TB и экспертная оценка). PPD показал очень низкую чувствительность и показал положительный результат только у одного из каждых пяти пациентов. T-SPOT.TB был положительным примерно у трех из каждых четырех пациентов с факторами риска LTI. Чувствительность, подтвержденная группой экспертов, подтвердивших случаи LTI, составила почти 75%.
Что касается перитонеального диализа, исследование Palomar et al.56 утверждает, что эти новые методы измеряют тип иммунного ответа, отличный от того, который связан с отсроченной реакцией гиперчувствительности на PPD, и, в отличие от того, что происходит в контактном исследовании, у пациентов с иммунодепрессией недавняя туберкулезная инфекция так же важна, как и отдаленная инфекция.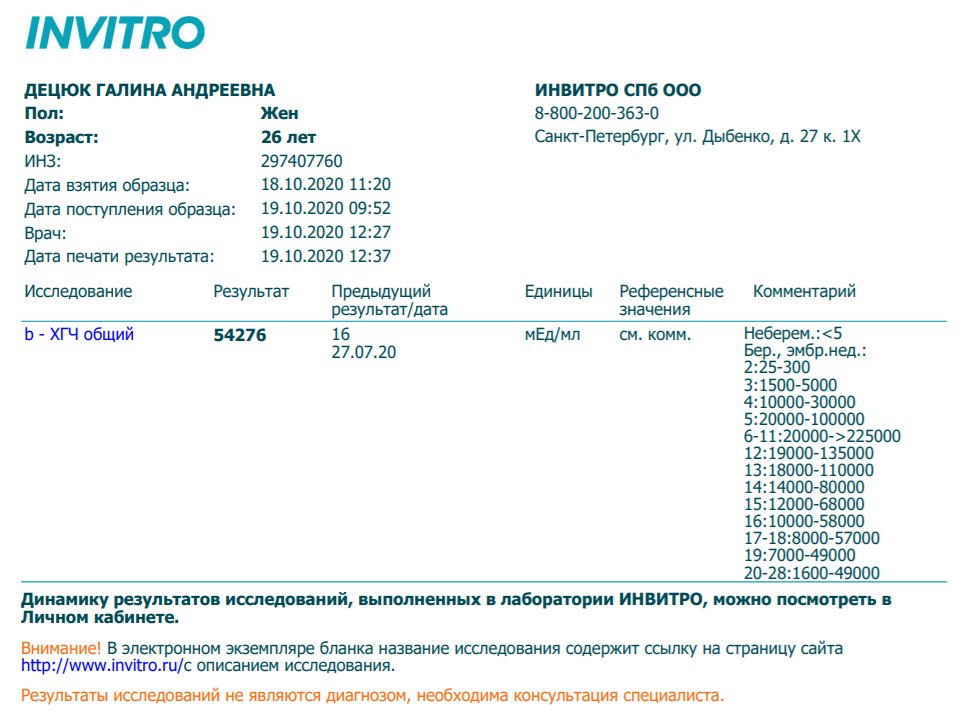 В исследовании сделан вывод о том, что IGRA дополняют PPD, поскольку их одновременное выполнение увеличивает вероятность диагностики туберкулеза.
В исследовании сделан вывод о том, что IGRA дополняют PPD, поскольку их одновременное выполнение увеличивает вероятность диагностики туберкулеза.
Для человека с положительным PPD риск развития активного туберкулеза оценивается в 5–10%.57 Однако существует очень мало лонгитюдных исследований, которые позволяют нам сделать выводы о способности IGRA прогнозировать риск развития активного ТБ.
В исследовании, проведенном в Германии с участием 601 контакта, близкого к людям с положительными мазками и положительными культурами на M.tuberculosis, QFT-GIT показал лучшие результаты в прогнозировании активного TB58, чем PPD, с использованием точки отсечения 5 мм . У пяти (2,3%) из 219 контактов с уплотнениями ≥5 мм на PPD развился туберкулез, а у шести (14.у 6%) из 41 контакта с положительными результатами QFT-GIT развилось заболевание (P = 0,003). Однако необычно большая часть (59%) контактов имела уплотнение (PPD) от 5 до 9 мм. Доля тех, кто считался положительным из-за PPD с точкой отсечения 10 мм, у которых развился активный ТБ (5 из 90 [5,6%]), была аналогична доле положительных результатов QFT-GIT (6 из 41 [14,6%]). Р=0,1). Кроме того, только у 2 из 6 контактов с положительными результатами QFT-GIT, у которых развился активный ТБ, диагноз был подтвержден посевом.В другом исследовании чувствительность для прогнозирования более позднего активного ТБ существенно не различалась для двух тестов.59
Доля тех, кто считался положительным из-за PPD с точкой отсечения 10 мм, у которых развился активный ТБ (5 из 90 [5,6%]), была аналогична доле положительных результатов QFT-GIT (6 из 41 [14,6%]). Р=0,1). Кроме того, только у 2 из 6 контактов с положительными результатами QFT-GIT, у которых развился активный ТБ, диагноз был подтвержден посевом.В другом исследовании чувствительность для прогнозирования более позднего активного ТБ существенно не различалась для двух тестов.59
Другое исследование 339 иммигрантов в Нидерландах показало, что PPD и QFT-GIT имеют схожую ценность для прогнозирования активного ТБ.60 Было проведено двухлетнее наблюдение за контактными лицами, у которых PPD был ≥5 мм между 0 и 3 месяцами после постановки диагноза у пациентов-индексов. Активный туберкулез развился у 9 (3,1%) из 288 контактов с PPD ≥10 мм, по сравнению с 7 (3,8%) из 184 с PPD ≥15 мм, 5 (2.Заболевание развилось у 8%) из 178 с положительным результатом QFT-GIT и у 6 (3,3%) из 181 с положительным результатом T-SPOT.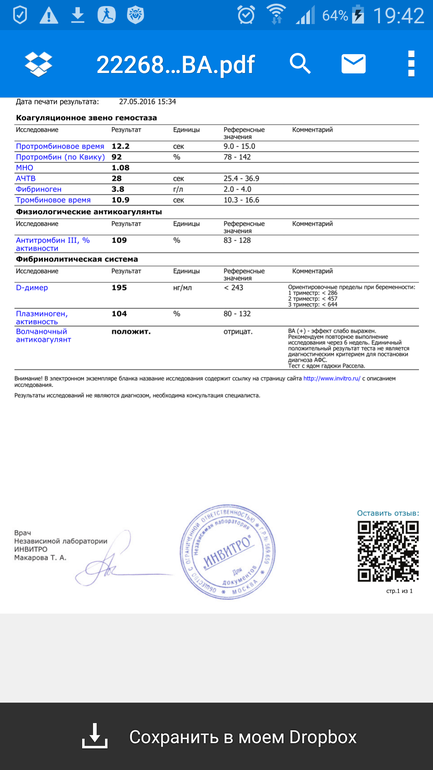 TB. Чувствительность выявления развития активного ТБ в течение периода наблюдения составила 100% для ППД с точкой отсечения 10 мм, 88% для ППД с точкой отсечения 15 мм, 63% для QFT-ЖКТ. и 75% для T-SPOT.TB. Несмотря на то, что PPD с точкой отсечки 10 мм выявил наибольшее количество контактов, у которых развился активный ТБ (9 из 9 [100%]), а QFT-GIT выявил наименьшее количество контактов, у которых развился активный ТБ (5 из из 9 [63%]), чувствительность двух тестов статистически не отличалась (P=.08).
TB. Чувствительность выявления развития активного ТБ в течение периода наблюдения составила 100% для ППД с точкой отсечения 10 мм, 88% для ППД с точкой отсечения 15 мм, 63% для QFT-ЖКТ. и 75% для T-SPOT.TB. Несмотря на то, что PPD с точкой отсечки 10 мм выявил наибольшее количество контактов, у которых развился активный ТБ (9 из 9 [100%]), а QFT-GIT выявил наименьшее количество контактов, у которых развился активный ТБ (5 из из 9 [63%]), чувствительность двух тестов статистически не отличалась (P=.08).
В заключение следует отметить, что IGRA для прогнозирования развития туберкулезного заболевания, по-видимому, не дает существенных различий по сравнению с PPD.
Использование QTF-GIT и T-SPOT.TB в исследованиях контактов До сих пор многие исследования основывались на изучении контактов при ТБ. Первоначально они были основаны на PPD, но после включения IGRA эти новые методы неоднократно становились предметом исследований, связанных с контактными исследованиями. недавнее воздействие (большая продолжительность воздействия или большее количество кислотоустойчивых бацилл в исходных образцах мокроты) было больше связано с положительными результатами для IGRA, чем для PPD, что позволяет предположить, что IGRA может быть лучше, чем PPD, для выявления недавней инфекции. В этих исследованиях люди с меньшим воздействием с большей вероятностью были положительными на PPD, чем на IGRA, что предполагает, что PPD мог быть лучше, чем обнаружение инфекции с помощью IGRA для обнаружения старой/отдаленной инфекции, которая была вызвана ранее (и поэтому не был вызван в результате) недавнего воздействия.63
В этих исследованиях люди с меньшим воздействием с большей вероятностью были положительными на PPD, чем на IGRA, что предполагает, что PPD мог быть лучше, чем обнаружение инфекции с помощью IGRA для обнаружения старой/отдаленной инфекции, которая была вызвана ранее (и поэтому не был вызван в результате) недавнего воздействия.63
В другом исследовании61 близость недавнего воздействия (имеется в виду та же самая комната, другая комната, другое жилище) больше связана с результатами PPD, чем с Результаты QFT-GIT.
В случае с IGRA в отношении изучения контактов можно сделать вывод, что хотя и есть предположения, что их позитивность может свидетельствовать о недавнем заражении, это не доказано и для подтверждения этого потребуются дополнительные исследования.
Преобразования и реверсии в IGRA Исследования, проведенные до сих пор относительно IGRA, не проводили серийный контроль указанных тестов. В исследовании Hill et al., которое было проведено с использованием серийного теста IGRA в серии контактов, контактировавших с людьми с диагнозом ТБ в стране с высокой распространенностью (Гамбия), было отмечено, что IGRA — точнее, ELISPOT — представить конверсии и реверсии, которые произошли после воздействия M.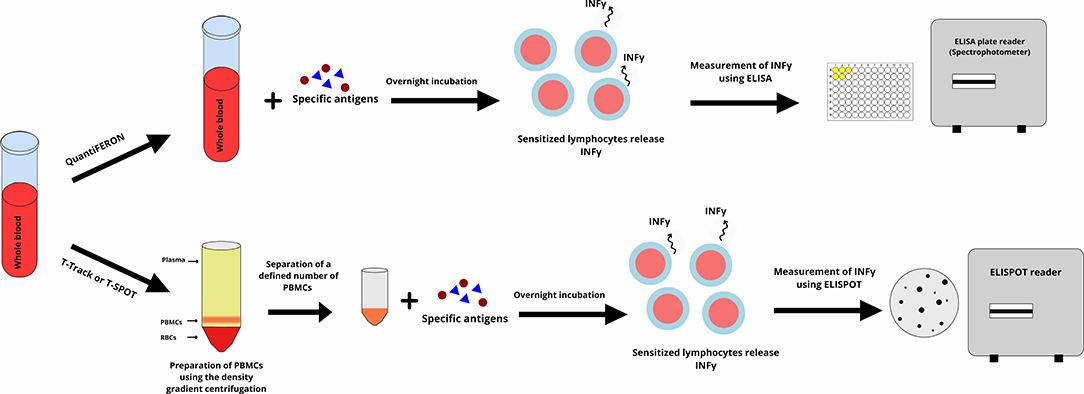 tuberculosis.67–71
tuberculosis.67–71
Чтобы интерпретировать результат серийного исследования, мы должны сначала ответить на ряд вопросов:
- 1.
Какова воспроизводимость ответа Т-клеток в определенный период времени? (вариации межиндивидуальной реакции).
- 2.
Что мы считаем реверсией и какую точку отсечения мы должны использовать для ее определения?
- 3.
Каково клиническое значение и прогноз реверсии?
- 4.
Что такое преобразование и какую точку отсечения следует использовать для его определения? Как его можно отличить от неспецифических вариаций ответа Т-клеток с течением времени?
- 5.
Каков прогноз конверсии IGRA? Имеют ли лица с явной конверсией (например, значительное увеличение ответа гамма-интерферона с течением времени) больший риск прогрессирования заболевания в активную форму, чем лица с более слабой конверсией или отрицательными результатами?
К сожалению, ни одно из исследований, опубликованных на сегодняшний день, не дает данных по указанным вопросам, которые, кажется, демонстрируют, что конверсия и реверсия возникают, когда тесты IGRA являются последовательными, а также когда PPD являются последовательными. 68–71
68–71
Эти серийные исследования в то же время демонстрируют, что IGRA являются очень динамичными тестами и что ответ Т-клеток, особенно слабоположительный ответ, имеет тенденцию колебаться во времени, даже при отсутствии специфического лечения.
Хотя имеющиеся в настоящее время данные ограничены, они предполагают, что положительные результаты различаются больше, чем отрицательные. Это отчасти ожидаемо, поскольку положительные результаты могут варьироваться в обоих направлениях, тогда как отрицательные результаты могут варьироваться от 0 до диагностического порога.Короче говоря, эти новые диагностические методы могут быть по своей природе склонны к конверсиям и реверсиям, и до сих пор не установлено, влияет ли этот характерный динамизм на оценку результатов.
С другой стороны, многие из этих серийных тестов проводились в странах с высокой заболеваемостью ТБ. Неясно, будут ли аналогичные результаты обнаружены в странах, где контакт с туберкулезом встречается реже.
В целом, реверсии менее часты, когда ответ на гамма-интерферон сильный.
Напротив, реверсии IGRA более часты, когда оба теста расходятся (например, положительный IGRA, отрицательный PPD). Дискордантные результаты почти всегда слабоположительны и обычно чуть выше точки отсечения.
Почему происходят реверсии IGRA? Некоторые могут отражать заживление туберкулезной инфекции (спонтанно или вторично по отношению к лечению). Другие реверсии вызваны биологическими различиями между людьми, положительными на IGRA, а также могут быть вызваны вариабельностью процедур, проводимых в лаборатории.
В повседневной практике люди, у которых был положительный результат на IGRA, не будут проходить тест снова, как и лица с положительным результатом на PPD.
В таком случае важны ли реверсии за рамками научных исследований? Вероятно, нет, пока у нас не будет лучшего понимания значения и прогноза упомянутых реверсий.
Конверсии IGRA и их значение Несмотря на тот факт, что высокий уровень конверсий IGRA был задокументирован в группах высокого риска с высокой заболеваемостью ТБ, нет единого мнения о том, как определять конверсии.
С имеющимися данными мы не можем ответить на следующие вопросы:
Какая степень увеличения гамма-интерферона указывает на новую инфекцию? Насколько эта изменчивость обусловлена самим тестом или биологической изменчивостью? Следует ли использовать одну и ту же точку отсечения для определения LTI и конверсий? Некоторые исследования показывают, что если для определения конверсий используется точка отсечения «от отрицательного к положительному», они могут быть выше при IGRA, чем при PPD, что может указывать на большую чувствительность к конверсиям (не обязательно для диагностики LTI).Однако часть из них может быть связана с неспецифическими вариациями вокруг точки отсечения. Ни одно из завершенных исследований не принимает во внимание указанные варианты.
Прогноз конверсии IGRA и потенциальное использование IGRA в качестве прогностического теста для развития туберкулеза Риск развития активного ТБ был установлен в различных когортных исследованиях с использованием PPD в качестве эталонного теста. Точно так же, благодаря контролируемым клиническим анализам, мы знаем, что начало профилактического лечения у лиц с положительным PPD снижает риск активного заболевания.72
Точно так же, благодаря контролируемым клиническим анализам, мы знаем, что начало профилактического лечения у лиц с положительным PPD снижает риск активного заболевания.72
К сожалению, для IGRA нет эквивалентных данных. Имеющиеся у нас данные ограничены небольшим исследованием73, которое было проведено между семейными контактами индексных случаев и в результате была получена ассоциация между людьми с сильным ответом гамма-интерферона на стимуляцию ESAT-6 и последующим переходом к активному ТБ. Несмотря на это, прогноз положительного результата IGRA еще предстоит определить.
Каков прогноз конверсии IGRA? Конверсия подразумевает недавнее заражение (инцидент), а прогноз отличается от другого заражения, которое уже существовало ранее (распространенное).С другой стороны, прогноз «сильной конверсии» может сильно отличаться от прогноза «слабой конверсии». Нет данных, которые непосредственно отвечали бы на вопрос о прогнозе конверсий, но новые данные свидетельствуют о том, что ответы на антигены ESAT-6 и CFP-10 тесно коррелируют с репликацией in vivo и с прогрессированием от инфекции к болезнь.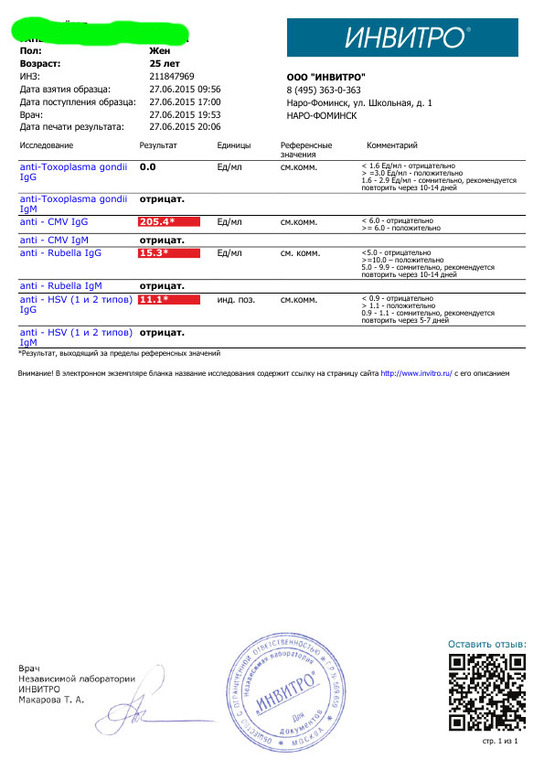 Недавно Andersen et al.74 предложили гипотезу, согласно которой высокие и/или повышающиеся уровни гамма-интерферона, продуцируемые Т-клетками в ответ на ESAT-6 у недавно инфицированных людей, могут быть признаком начинающегося заболевания и, следовательно, могут служить в качестве прогностический маркер более позднего развития клинической картины заболевания в ближайшем будущем.
Недавно Andersen et al.74 предложили гипотезу, согласно которой высокие и/или повышающиеся уровни гамма-интерферона, продуцируемые Т-клетками в ответ на ESAT-6 у недавно инфицированных людей, могут быть признаком начинающегося заболевания и, следовательно, могут служить в качестве прогностический маркер более позднего развития клинической картины заболевания в ближайшем будущем.
Изучение контактов больных туберкулезом рекомендуется как средство выявления инфицированных лиц, у которых впоследствии может развиться заболевание. Было продемонстрировано, что лечение инфицированных лиц, главным образом изониазидом, снижает риск развития новых случаев туберкулеза.75 На эффективность и рентабельность этих программ очень влияет точность при выявлении инфицированных лиц с риском развития заболевания туберкулезом. .76
Рекомендации по использованию IGRA зависят от каждой страны. Так, например, Центры по контролю за заболеваниями (CDC) в США рекомендуют во всех случаях заменять PPD на IGRA. Напротив, в Соединенном Королевстве Национальный институт здравоохранения и клинического мастерства (NICE) рекомендует использовать IGRA в сочетании с PPD, но только в тех случаях, когда туберкулин был положительным.77
Напротив, в Соединенном Королевстве Национальный институт здравоохранения и клинического мастерства (NICE) рекомендует использовать IGRA в сочетании с PPD, но только в тех случаях, когда туберкулин был положительным.77
Недавно опубликованное исследование78, сравнивающее два доступные в настоящее время тесты (QTF-GIT и T-SPOT.TB) приходит к выводу, что для изучения контактов совместные стратегии PPD/IGRA более экономичны, чем использование только T-SPOT.TB–QTF-GIT или PPD.
Рекомендации (рис. 1)Методы определения IGRA у пациентов с иммуносупрессией и у детей следует проводить при отрицательном результате PPD, так как он может быть ложноотрицательным вследствие иммунных нарушений, а также при положительном результате у лиц с ранее были привиты БЦЖ, так как это могло быть связано с самой вакциной.
ВыводыСуществует два мета-анализа10,79–88, которые обобщают результаты, полученные на сегодняшний день с помощью IGRA. Основные выводы представлены в таблице 7.
В качестве резюме и с учетом современных знаний возникает вопрос, может ли IGRA заменить PPD для исключения туберкулезной инфекции у пациентов, которым предстоит лечение агентами, которые могут повлиять на иммунную систему. функция. Там, где мы находимся сегодня, кажется, что они могут быть комплиментом, но не заменой.Отсутствуют данные о длительном развитии ТБ, которые позволили бы нам принять решение о лечении исключительно на основании результата IGRA. Но это еще не все, так как теоретическая основа IGRA также указывает на то, что эти методы измеряют тип иммунного ответа, который отличается от того, что обнаруживается в реакциях замедленной гиперчувствительности на PPD. В отличие от того, что происходит в контактных исследованиях, у пациентов, которым предстоит лечение иммунодепрессантами, важны как недавние, так и отдаленные инфекции.В любом случае IGRA представляет собой заметный прогресс в диагностике туберкулезной инфекции. Их место для скрининга лиц из группы риска — среди этих кандидатов на лечение агентами против фактора некроза опухоли — еще предстоит определить. Для этого необходимы лонгитюдные исследования, чтобы получить убедительные данные о прогностической ценности показателей риска развития ТБ в долгосрочной перспективе.
функция. Там, где мы находимся сегодня, кажется, что они могут быть комплиментом, но не заменой.Отсутствуют данные о длительном развитии ТБ, которые позволили бы нам принять решение о лечении исключительно на основании результата IGRA. Но это еще не все, так как теоретическая основа IGRA также указывает на то, что эти методы измеряют тип иммунного ответа, который отличается от того, что обнаруживается в реакциях замедленной гиперчувствительности на PPD. В отличие от того, что происходит в контактных исследованиях, у пациентов, которым предстоит лечение иммунодепрессантами, важны как недавние, так и отдаленные инфекции.В любом случае IGRA представляет собой заметный прогресс в диагностике туберкулезной инфекции. Их место для скрининга лиц из группы риска — среди этих кандидатов на лечение агентами против фактора некроза опухоли — еще предстоит определить. Для этого необходимы лонгитюдные исследования, чтобы получить убедительные данные о прогностической ценности показателей риска развития ТБ в долгосрочной перспективе.
Конфликт интересов отсутствует.
Иммунодиагностика туберкулезной инфекции in vitro при решении вопроса о назначении профилактической химиотерапии – DOAJ
Иммунодиагностика туберкулезной инфекции in vitro в решении вопроса о назначении профилактической химиотерапии — DOAJДетские инфекции (Москва) (сентябрь 2020 г.)
- Э.П. Еременко,
- Сергеева И.А.,
- Бородулин Б.Е.,
- Амосова Е.А.
Принадлежности
- Э.
 П. Еременко
П. Еременко - Самарский государственный медицинский университет Минздрава России
- Сергеева И.А.
- Детская поликлиника матери и ребенка ИДЦ
- Б.Э. Бородулин
- Самарский государственный медицинский университет Минздрава России
- Амосова Е.А.
- Самарский государственный медицинский университет Минздрава России
- ДОИ
- https://дои.
 орг/10.22627/2072-8107-2020-19-3-34-38
орг/10.22627/2072-8107-2020-19-3-34-38 - Том и выпуск журнала
- Том. 19,
нет. 3
с. 34 – 38
Аннотация
Читать онлайн
Для иммунодиагностики туберкулезной инфекции, помимо стандартных кожных проб (реакция Манту с 2 ТЕ ППД-Л и Диаскинтест), в настоящее время применяют тесты in vitro, одним из которых является Т-точка. Туберкулезный тест. Цель исследования. Оценить тест T-SPOT как метод раннего выявления туберкулезной инфекции у детей и подростков и его роль как дополнительного метода в решении проблемы необходимости химиопрофилактики.Материалы и методы. Проведен анализ результатов T-SPOT.ТБ у 794 детей в возрасте от 2 до 17 лет включительно в период с 2016 по 2019 годы. Были выделены две группы: 1 группа (n = 596) — дети, которым по основной методике выполняли T-SPOT.TB; 2-я группа — 198 детей с положительными результатами кожных проб на рекомбинантный аллерген туберкулеза после скрининга.Результаты T-SPOT.TB оценивались с учетом данных предшествующей иммунодиагностики и сопутствующей патологии. Результаты. Установлено, что Т-СПОТ.ТБ. может использоваться как самостоятельный метод при отказе от кожных проб. Уровень латентной туберкулезной инфекции выше среди детей с сопутствующей патологией по результатам Т-СПОТ.ТБ в 2 раза. Заключение. T-SPOT.TB может быть альтернативным методом диагностики туберкулезной инфекции во время скрининга.
Туберкулезный тест. Цель исследования. Оценить тест T-SPOT как метод раннего выявления туберкулезной инфекции у детей и подростков и его роль как дополнительного метода в решении проблемы необходимости химиопрофилактики.Материалы и методы. Проведен анализ результатов T-SPOT.ТБ у 794 детей в возрасте от 2 до 17 лет включительно в период с 2016 по 2019 годы. Были выделены две группы: 1 группа (n = 596) — дети, которым по основной методике выполняли T-SPOT.TB; 2-я группа — 198 детей с положительными результатами кожных проб на рекомбинантный аллерген туберкулеза после скрининга.Результаты T-SPOT.TB оценивались с учетом данных предшествующей иммунодиагностики и сопутствующей патологии. Результаты. Установлено, что Т-СПОТ.ТБ. может использоваться как самостоятельный метод при отказе от кожных проб. Уровень латентной туберкулезной инфекции выше среди детей с сопутствующей патологией по результатам Т-СПОТ.ТБ в 2 раза. Заключение. T-SPOT.TB может быть альтернативным методом диагностики туберкулезной инфекции во время скрининга. У детей с сопутствующей патологией Т-точки.ТБ может служить ведущим методом иммунодиагностики туберкулеза. Положительный результат T-SPOT.TB может служить дополнительным методом для решения вопроса о назначении профилактической химиотерапии.
У детей с сопутствующей патологией Т-точки.ТБ может служить ведущим методом иммунодиагностики туберкулеза. Положительный результат T-SPOT.TB может служить дополнительным методом для решения вопроса о назначении профилактической химиотерапии.
Ключевые слова
Опубликовано в
Детские инфекции (Москва)- ISSN
- 2072-8107 (печать)
- Издатель
- ООО «Диагностика и вакцины»
- Страна издателя
- Российская Федерация
- Субъекты LCC
- Медицина: педиатрия
- Веб-сайт
- http://детинф.
 elpub.ru/
elpub.ru/
О журнале
QR-код WeChat
Закрывать
Успехи в диагностике латентной туберкулезной инфекции у пациентов, получающих заместительную почечную терапию
После многих лет отсутствия каких-либо новых разработок в этой области недавно были включены новые диагностические инструменты как в латентной, так и в активной фазе заражения.Требовались новые методы при исследовании населения в целом для совершенствования имеющегося арсенала, а в случае с почечными больными, особенно в запущенных стадиях и при заместительной терапии, потребность в совершенствовании была очевидна. В связи с публикацией в этом номере Журнала исследования, анализирующего результаты сравнения туберкулиновой кожной пробы (ТКП) и новых методов диагностики in vitro для выявления латентной туберкулезной инфекции (ЛТБИ), мы подведем итоги. потенциальное влияние этих методов на лечение пациентов с почечной недостаточностью в этих редакционных комментариях.
потенциальное влияние этих методов на лечение пациентов с почечной недостаточностью в этих редакционных комментариях.
ТУБЕРКУЛЕЗ СЕГОДНЯ
Согласно данным Всемирной организации здравоохранения (ВОЗ),1 треть населения мира в настоящее время больна ЛТБИ. В 2006 г. во всем мире было зарегистрировано более 9 200 000 новых случаев туберкулеза (ТБ) с распространенностью более 14 миллионов человек и почти 1,7 миллиона смертей, что соответствует уровню смертности 18%. ВОЗ считает, что глобальный уровень заболеваемости достиг своего пика в 2002 г. с колебаниями, связанными с изменением численности населения. Согласно последним данным, опубликованным Red de Vigilancia Epidemiológica de España (Испанская сеть эпидемиологического надзора), в 2009 г. было зарегистрировано 2 6070 случаев туберкулеза.Однако к этим цифрам следует относиться с осторожностью, поскольку, несмотря на то, что ТБ является заболеванием, подлежащим регистрации, по оценкам, как минимум одна треть случаев остается незарегистрированной.
По данным Реестра Испанского общества нефрологов (SEN), частота пациентов, получающих заместительную почечную терапию (ЗПТ), в 2009 г. составила 129 пациентов на миллион населения (пмп), причем большинство (85%) находятся на гемодиализе (ГД ), 12% при перитонеальном диализе (ПД) и 2,8% при преддиализной трансплантации почки (КТ).Распространенность составила 1039,4 пациентов с ПМП, из них 47,67% с ГД, 4,8% с ПД и 47,51% с функционирующими трансплантатами. Хотя число пациентов, получающих ЗПТ, остается стабильным в течение последних десяти лет в Испании, существуют различия между различными регионами страны. В Европе заболеваемость колеблется от 94,6 до 263 пациентов с пмп, а распространенность — от 64,9 до 1115,1 пациентов с пмп, поэтому мы находимся в среднем диапазоне по сравнению с соседними странами. те, кто проходит диализ, который вызывает изменения в иммунной системе, связанные с уремией, имеют состояние иммунодефицита, что делает их более восприимчивыми к инфекциям.Эти изменения в первую очередь влияют на клеточный иммунитет,4 включая снижение пролиферативной реакции лимфоцитов, дефицит интерлейкина-2, дефицит периферических В-лимфоцитов и увеличение клеточного апоптоза.5-7 Поскольку ЛТБИ характеризуется значительным клеточным иммунным ответом (в отсутствие обнаруживаемых микобактерий), изменение этого ответа может привести к увеличению реактивации ТБ у пациентов с уремией и гипоответу в тестах, основанных на замедленной гиперчувствительности.
ДИАГНОСТИКА ТУБЕРКУЛЕЗНОЙ ИНФЕКЦИИ
Обычным методом диагностики туберкулезной инфекции является ТКП, которая четко показывает после инъекции очищенного белкового производного (PPD) состояние предшествующей гиперчувствительности в организме при столкновении с этим веществом. В Европе используется туберкулин RT-23 PPD. В последние годы были исследованы и одобрены новые методы диагностики, основанные на количественном определении клеточного иммунного ответа in vitro. Эти методы, обычно называемые аббревиатурой IGRA (тесты на высвобождение гамма-интерферона), обнаруживают высвобождение гамма-интерферона в ответ на специфические антигены туберкулеза.8 Интерферон-гамма является незаменимой молекулой в защитном иммунном ответе против этого микроорганизма. Этот цитокин, продуцируемый CD4+ T-лимфоцитами, CD8+ T-лимфоцитами и NK-клетками, активирует инфицированные макрофаги с последующим высвобождением IL-1 и TNF-альфа, которые ограничивают рост и размножение микобактерий. У лиц с дефицитом рецепторов или генов, кодирующих синтез этой молекулы, микобактериальные инфекции могут возникать чаще и с большей степенью тяжести.То же самое можно сказать и о пациентах, проходящих иммунодепрессивную терапию, которая влияет на эти сигнальные пути иммунного ответа.
ИССЛЕДОВАНИЯ IN VITRO, ОСНОВАННЫЕ НА ПРОДУКЦИИ ИНТЕРФЕРОНА (IGRA)
На рынке представлены два метода диагностики ТБ инфекции in vitro: QuantiFERON-TB-Gold In Tube (Cellestis®, Виктория, Австралия)9 и T- SPOT.TB (Oxford Immunotec®, Оксфорд, Великобритания)10. QuantiFERON TB первого поколения, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США в 2001 г., обнаруживал высвобождение гамма-интерферона в ответ на TST.В 2004 году FDA одобрило второе поколение этого диагностического теста под названием QuantiFERON-TB Gold, в котором, в отличие от первого поколения, используются не микобактериальные антигены TST, а скорее синтетические пептиды, имитирующие более специфические антигены, такие как ранний секретируемый антиген. Мишень-6 (ESAT-6) и белок культурального фильтрата-10 (CFP-10). Эти две молекулы кодируются областью RD-1 генома Mycobacterium tuberculosis и значительно повышают специфичность по сравнению с TST.Эти антигены отсутствуют у M. bovis и у большинства нетуберкулезных микобактерий (за исключением M. kansasii, M. marinum или M. szulgai). В настоящее время третье поколение этого теста под названием QuantiFERON-TB Gold In Tube (QFT-GIT) уже находится на рынке и включает в себя третий микобактериальный антиген: TB 7.7 и пробирки, специально предназначенные для сбора образцов крови для этого теста.
ДЕЙСТВИТЕЛЬНОСТЬ QTF-ЖКТ И T.SPOT.TB В ПРОГНОЗИРОВАНИИ РАЗВИТИЯ ТУБЕРКУЛЕЗНОЙ ЗАБОЛЕВАНИЯ
Риск развития активного туберкулеза у человека с положительной ТКП оценивается в 5%-10%.11,12 Однако существует несколько лонгитюдных исследований, которые позволяют нам сделать вывод о способности IGRA прогнозировать риск развития активного ТБ.
В Германии было проведено исследование 601 человека, имевшего тесные контакты, у которых был взят мазок на кислотоустойчивые бациллы и положительный результат посева на M.tuberculosis. QFT-GIT показал лучшую производительность в прогнозировании активного TB13, чем TST, используя точку отсечки 5 мм. У пяти (2,3%) из 219 близких контактов с уплотнением >5 мм развился туберкулез, тогда как у шести (14.у 6%) из 41 близкого контакта с положительными результатами QFT-GIT развилось заболевание. Однако 59% близких контактов имели уплотнение (TST) 5-9 мм. Процент тех, кто считался ТКП-положительным с точкой отсечения 10 мм и у которых развился активный ТБ (5 из 90 [5,6%]), был аналогичен проценту тех, кто был QFT-ЖКТ-положительным (6 из 41 [14,6%]). ]). Кроме того, только 2 из 6 близких контактов, которые были QFT-GIT-позитивными и у которых развился активный ТБ, были подтверждены микробиологически. В другом исследовании чувствительность для прогнозирования последующего активного туберкулеза не показала никакой разницы между двумя тестами.14
Результаты другого исследования с участием 339 иммигрантов в Нидерландах показали, что TST и QFT-GIT имеют одинаковую достоверность в прогнозировании активного ТБ. от 0 до 3 месяцев после постановки диагноза индексному пациенту. У девяти (3,1%) из 288 близких контактов с TST>10 мм развился активный ТБ, у семи (3,8%) из 184 с TST>15 мм, у пяти (2,8%) из 178 с положительным результатом QFT-GIT и шесть (3.3%) из 181 с положительным T-SPOT.ТБ также развилось заболевание. Чувствительность выявления развития активного ТБ в периоде наблюдения составила 100 % для ТКП с точкой отсечения 10 мм, 88 % для ТКП с точкой отсечения 15 мм, 63 % для QFT-ЖКТ и 75% для T-SPOT.TB. Хотя ТКП с точкой отсечения 10 мм выявила наибольшее количество близких контактов, у которых развился активный ТБ (100%), а QFT-ЖКТ выявила наименьшее количество близких контактов, у которых развился активный ТБ (5/[63%]) , чувствительность обоих тестов не отличалась.Ввиду всего опубликованного IGRA не дает дополнительных преимуществ в прогнозировании развития туберкулеза по сравнению с TST.
ИСПОЛЬЗОВАНИЕ QTF-GIT И T.SPOT.TB ПРИ ОТСЛЕЖИВАНИИ КОНТАКТОВ
На сегодняшний день было проведено множество исследований, основанных на отслеживании контактов ТБ. Первоначально он был основан на TST, но с момента появления IGRA последние часто становились предметом исследований в этой группе.16, 7 устойчивых к алкоголю бацилл в мокроте) ассоциируется с более положительным результатом IGRA, чем с положительной ТКП, что позволяет предположить, что IGRA может быть более эффективным при выявлении недавней инфекции.
ЧУВСТВИТЕЛЬНОСТЬ СКРИНИНГОВЫХ ТЕСТОВ
Существует два метаанализа18, 9, которые обобщают результаты, полученные на данный момент на IGRA (таблица 1).
НЕДЕЙСТВИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ ДЛЯ ОБОИХ ТЕСТОВ
Неубедительные результаты QTF-GIT
Из общего числа 21 922 пациентов 469 (2,14%) представили неубедительные результаты (ДИ 95%, 0,02–0,023).
Неубедительные результаты для T-SPOT.TB
Из общего числа 12 165 пациентов 462 (3.80 %) имели неубедительные результаты (95 % ДИ, 0,035–0,042). Если добавить 80 случаев, в которых не было достаточного количества клеток для тестирования, количество неубедительных результатов увеличилось бы до 4,46 (ДИ 95%, 0,041-0,048).
Разница в проценте неубедительных результатов между двумя IGRA больше для QTF-GIT.
Неубедительные результаты у пациентов с ослабленным иммунитетом
В случаях, когда QTF-GIT увеличивается до 4,42% и в случаях, когда T.SPOT.TB — до 6,12%.
ПРЕИМУЩЕСТВА ТЕСТИРОВАНИЯ IGRA ПО СРАВНЕНИЮ С ТУБЕРКУЛИНОВЫМ КОЖНЫМ ТЕСТОМ
Методы IGRA обладают важными преимуществами по сравнению с TST: 1) они не мешают действию вакцины БЦЖ; 2) Они избегают субъективности в интерпретации и визитах для чтения, и 3) Они включают положительный контроль, который предоставляет ценную информацию при интерпретации предположительно ложноотрицательного теста как истинно отрицательного или неубедительного (технические ошибки или иммуносупрессия).
Опыт работы с диализными пациентами
Из-за изменений в иммунной системе у диализных пациентов особенно высока вероятность развития активного ТБ, заболеваемость которым может достигать восьмикратного увеличения заболеваемости ТБ по сравнению с населением в целом.20 Более того, это связано с более высокой смертностью, поэтому выявление ЛТБИ является важной проблемой в этой популяции. В течение десятилетий ТКП давала плохие результаты в выявлении латентного туберкулеза у этих пациентов и уровень анергии, который мог достигать 44%.21-24 Хотя они начинают публиковать исследования по достоверности IGRA в выявлении ЛТБИ, иногда сравнивая их с туберкулином, у нас мало данных о чувствительности и частоте неубедительных результатов у пациентов с почечной недостаточностью в целом и, в частности, при лечение заместительными методами.
На сегодняшний день подобных исследований на популяции БП не проводилось. В исследовании, опубликованном в этом выпуске, была проанализирована достоверность IGRA по сравнению с TST для выявления ЛТИ у 54 пациентов с БП, и были получены многообещающие результаты.Как и в исследовании, проведенном на пациентах с БХ, имеется значительный процент неубедительных результатов. Поэтому жизненно необходимо накапливать новые ряды для усиления и уточнения результатов. В этом исследовании оценка эксперта-пульмонолога используется в качестве золотого стандарта для выявления ЛТБИ, и авторы пришли к выводу, что IGRA может дополнять туберкулиновую кожную пробу, но до сих пор нет достаточных доказательств.
Пациенты, перенесшие трансплантацию почки
Распространенность туберкулеза среди реципиентов трансплантата почки широко публиковалась.Заболеваемость ЛТИ среди этих пациентов оценивается в 20-70 раз выше, чем в общей популяции.25 У этих пациентов ТБ способствует дисфункции трансплантата за счет прямого воздействия на трансплантат, а также взаимодействия с лекарственными средствами. Кроме того, это увеличивает смертность.26 Снижение риска ТБ является важным приоритетом при трансплантации органов, особенно в странах, где это заболевание является эндемичным. Противотуберкулезное лечение затруднено, в частности, из-за противотуберкулезных препаратов, индуцирующих цитохром Р-450 (рифампицин)27, и дисфункции печени, вызванной изониазидом.28 Результаты IGRA при трансплантации паренхиматозных органов противоречивы, в то время как в одних исследованиях чувствительность аналогична ТКП, в других выше.25,29
Полезность IGRA в будущем , вопрос заключается в том, может ли IGRA заменить TST, чтобы исключить туберкулезную инфекцию у пациентов с ослабленным иммунитетом. В ожидании дальнейших исследований по этому вопросу мы можем констатировать, что: 1) В настоящее время недостаточно данных о долгосрочном развитии ТБ, которые позволяют нам принимать решение о том, лечить или нет, основываясь исключительно на результатах IGRA в пациенты, получающие ЗПТ; 2) Теоретическая основа IGRA указывает на то, что эти методы измеряют другой тип иммунного ответа, чем тот, который возникает при замедленной гиперчувствительности к ТКП; 3) В отличие от того, что происходит в исследовании по отслеживанию контактов, у пациентов с ослабленным иммунитетом одинаково важны как недавние, так и отдаленные туберкулезные инфекции; 4) Кажется, пока нет достаточных доказательств того, что IGRA может заменить TST, и 5) Мы можем сделать вывод, что IGRA являются дополнительными тестами для TST, поскольку одновременное выполнение обоих тестов увеличивает вероятность диагностики ТБ.В любом случае IGRA представляет собой значительный прогресс в диагностике туберкулезной инфекции.
Таблица 1. Результаты исследования, сравнивающего различные методы диагностики для выявления подтвержденного туберкулеза
| 1. | Мори Т., Сакатани М., Ямагиши Ф. и др. Специфическое выявление туберкулезной инфекции: гамма-интерфероновый анализ с использованием новых антигенов. Am J Repair Crit Care Med 2004; 170: 59–64. |
| 2. | Рибера Э., Мартинес Васкес Х.М., Окана И. и др. Диагностическое значение уровня гамма-интерферона в асците при туберкулезном перитоните. Сравнение с активностью аденозиндезаминазы. Туберкул 1991; 72: 193–197. |
| 3. | Симамото Х., Хамада К., Хигути И. и др. Туберкулез брюшной полости: поражение брюшины показано с помощью ПЭТ F-18 FDG.Clin Nucl Med 2007; 32: 716–718. |
| 4. | Кирш Р., Пятидесятница М., Холл Пде М., Эпштейн Д.П., Уотермейер Г., Фридерих П.В. Роль колоноскопической биопсии в различении болезни Крона и туберкулеза кишечника. Дж. Клин Патол 2006; 59: 840–844. |
| 5. | Чанг К.М., Ким Х.С., Пак С.И. и др. Изменения заболеваемости болезнью Крона и туберкулезом кишечника в Корее.Korean J Gastroenterol 2008; 52: 351–358. |
| 6. | Kim SH, Choi SJ, Kim HB, Kim NJ, Oh MD, Choe KW. Диагностическая полезность анализа на основе Т-клеток для внелегочного туберкулеза. Arch Intern Med 2007; 167: 2255–2259. |
| 7. | Мадариага М.Г., Джалали З., Суинделлс С. Клиническая полезность гамма-анализа интерферона в диагностике туберкулеза.J Am Board Fam Med 2007; 20: 540–547. |
| 8. | Маршалл Дж.Б. Туберкулез желудочно-кишечного тракта и брюшины. Am J Gastroenterol 1993; 88: 989–999. |
| 9. | Stange EF, Travis SP, Vermeire S, et al. Европейский консенсус основан на фактических данных по диагностике и лечению болезни Крона. определения и диагностика. Gut 2006; 55 приложение 1:i1–i15. |
| 10. | Park JB, Yang SK, Myung SJ и др. Клиническая характеристика при диагностике и течении болезни Крона у корейских больных. Korean J Gastroenterol 2004; 43:8–17. |
| 11. | Кобаяши К., Уэно Ф., Бито С. и др. Разработка согласованных утверждений для диагностики и лечения кишечной болезни Бехчета с использованием модифицированного подхода Дельфи.J Gastroenterol 2007;42:737–745. |
| 12. | Брэдбери А.В., Милн А.А., Мюри Дж.А. Хирургические аспекты болезни Бехчета. Бр Дж. Сург 1994; 81: 1712–1721. |
| 13. | Шарма С.К., Тахир М., Мохан А., Смит-Рорберг Д., Мишра Х.К., Пандей Р.М. Диагностическая точность анализов асцитической жидкости на ИФН-гамма и аденозиндезаминазу при диагностике туберкулезного асцита.J Interferon Cytokine Res 2006; 26:484–488. |
| 14. | Шарма М.П., Бхатия В. Туберкулез брюшной полости. Indian J Med Res 2004; 120:305–315. |
| 15. | Ким Х.А., Чунг С.С., Ким К.Х., Ли Р.А. Изменение клинических признаков болезни Крона при хирургическом лечении. J Korean Surg Soc 2005; 69: 135–138. |
| 16. | Баумгарт, округ Колумбия. Диагностика и лечение болезни Крона и язвенного колита. Dtsch Arztebl Int 2009; 106: 123–133. |
| 17. | Алмади М.А., Гош С., Алджебрин А.М. Дифференциация туберкулеза кишечника от болезни Крона: диагностическая проблема. Am J Gastroenterol 2009;104:1003–1012. |
| 18. | Ган Х.Т., Чен Ю.К., Оуян К., Бу Х., Ян XY.Дифференциация туберкулеза кишечника и болезни Крона в эндоскопических биоптатах методом полимеразной цепной реакции. Am J Gastroenterol 2002; 97: 1446–1451. |
| 19. | Nos P, Domenech E. Послеоперационный рецидив болезни Крона: практический подход. World J Gastroenterol 2008;14:5540–5548. |
| 20. | Бенито Гарсия П., Прието Висенте В., Гейхо Мартинес Ф. и др.Туберкулез кишечника: проблема диагностики. Rev Esp Enferm Dig 2008; 100: 109–110. |
| 21. | Амарапуркар Д.Н., Патель Н.Д., Амарапуркар А.Д., Агал С., Байгал Р., Гупте П. Тканевая полимеразная цепная реакция в диагностике туберкулеза кишечника и болезни Крона. J Assoc Physicians India 2004; 52: 863–867. |
| 22. | Герхардт Т., Вольф М., Фишер Х.П., Зауэрбрух Т., Райхель К.Подводные камни в диагностике туберкулеза кишечника: клинический случай. Scand J Gastroenterol 2005;40:240–243. |
| 23. | Брок И., Велдинг К., Лиллебек Т., Фоллманн Ф., Андерсен П. Сравнение туберкулиновой кожной пробы и нового специфического анализа крови при контактах с туберкулезом. Am J Respir Crit Care Med 2004; 170: 65–69. |
| 24. | Talati NJ, Seybold U, Humphrey B, et al.Плохая согласованность между тестами на высвобождение гамма-интерферона и туберкулиновыми кожными пробами в диагностике латентной туберкулезной инфекции у ВИЧ-инфицированных. BMC Infect Dis 2009; 9:15. |
| 25. | Kwon CI, Park PW, Kang H, et al. Полезность ангиотензинпревращающего фермента в дифференциальной диагностике болезни Крона и туберкулеза кишечника. Korean J Intern Med 2007; 22: 1–7. |
| 26. | Ак О., Дабак Г., Озер С., Сайги А., Дабак Р. Оценка теста Quantiferon-TB Gold при легочном и внелегочном туберкулезе. Jpn J Infect Dis 2009; 62: 149–151. |
| 27. | Connell TG, Ritz N, Paxton GA, Buttery JP, Curtis N, Ranganathan SC. Ранганатан СК. Трехстороннее сравнение кожных туберкулиновых проб, QuantiFERON-TB gold и T-SPOT.TB у детей. ПЛоС Один 2008;3 |
| Рубрики Разное |


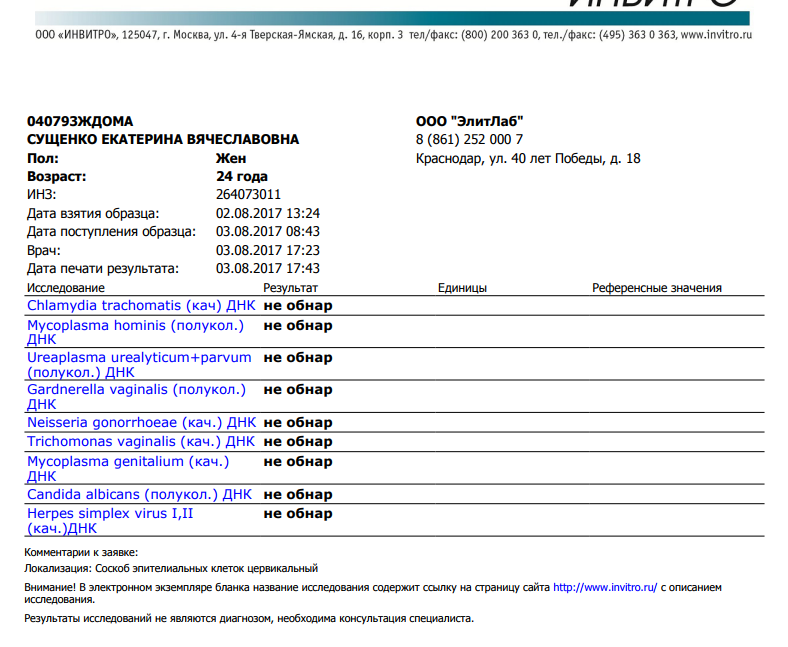


 бовис БЦЖ). В этой ситуации принимаются во внимание определенные клинические состояния, считая PPD-положительным с диаметром ≥5 мм, если, помимо вакцинации, субъекты либо живут, либо поддерживают частые контакты с бациллоносными больными, представляют рентгенограмму грудной клетки с поражениями, предполагающими перенесенный туберкулез которые никогда не лечились, инфицированы ВИЧ или больны пневмокониозом.
бовис БЦЖ). В этой ситуации принимаются во внимание определенные клинические состояния, считая PPD-положительным с диаметром ≥5 мм, если, помимо вакцинации, субъекты либо живут, либо поддерживают частые контакты с бациллоносными больными, представляют рентгенограмму грудной клетки с поражениями, предполагающими перенесенный туберкулез которые никогда не лечились, инфицированы ВИЧ или больны пневмокониозом.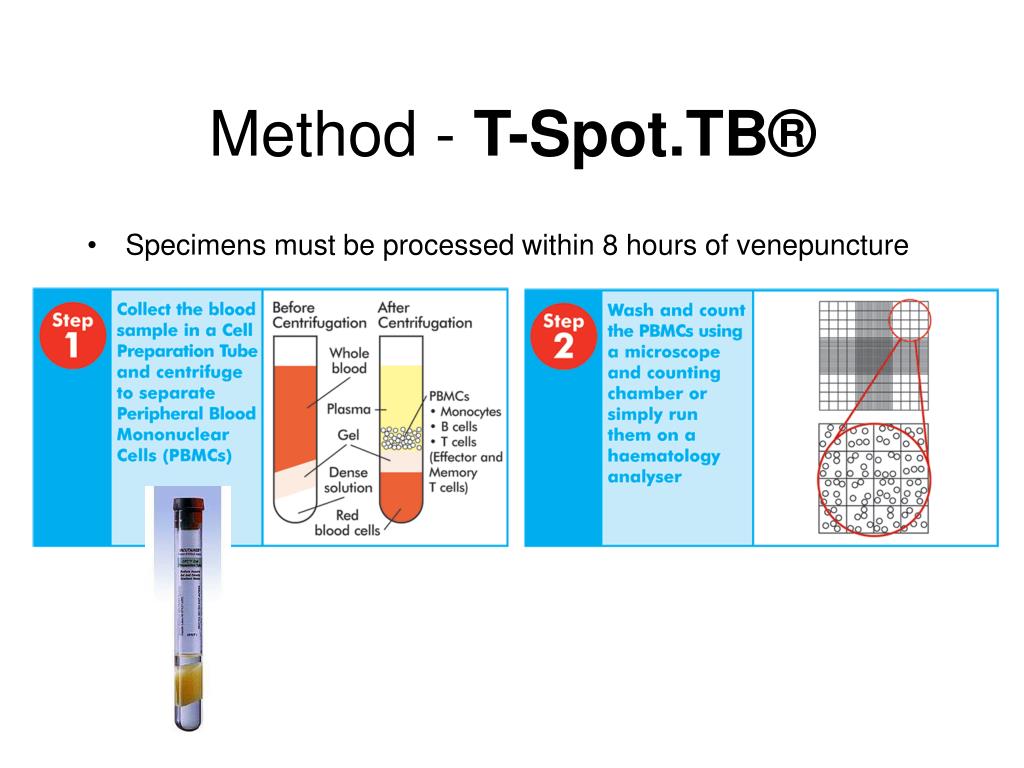 Всего требуется 3 мл крови (1 мл на пробирку), и кровь извлекается непосредственно в сами пробирки. Затем после встряхивания пробирки инкубируют в течение 18–22 ч при 37°С, после чего пробирки центрифугируют и полученную плазму используют для иммуноферментного анализа, который выявляет и количественно определяет гамма-интерферон, высвобождаемый лимфоцитами лейкоцитов. пациент.Этот шаг может быть выполнен либо вручную, либо полностью автоматически. После инкубации плазма может храниться несколько недель без ущерба для результатов, что при необходимости облегчило бы организацию работы лаборатории. В методике используется специальное программное обеспечение для выдачи результатов.
Всего требуется 3 мл крови (1 мл на пробирку), и кровь извлекается непосредственно в сами пробирки. Затем после встряхивания пробирки инкубируют в течение 18–22 ч при 37°С, после чего пробирки центрифугируют и полученную плазму используют для иммуноферментного анализа, который выявляет и количественно определяет гамма-интерферон, высвобождаемый лимфоцитами лейкоцитов. пациент.Этот шаг может быть выполнен либо вручную, либо полностью автоматически. После инкубации плазма может храниться несколько недель без ущерба для результатов, что при необходимости облегчило бы организацию работы лаборатории. В методике используется специальное программное обеспечение для выдачи результатов. Планшет инкубируют в течение 18–22 часов при 37°C в инкубаторе с СО2, после чего делают иммунозондирование, позволяющее количественно определить количество клеток, продуцирующих интерферон (наблюдают в виде пятен, каждое пятно представляет собой след отдельного T -лимфоцитарный секретор интерферона). Алгоритм интерпретации, разработанный производителем, облегчает выдачу результатов.Технически, T-SPOT.TB требует больше крови, больше времени на подготовку и требует больше усилий, чем QFT-GIT. Кроме того, он не позволяет работать с образцами по-другому. Рекомендации, рекомендованные производителями этих тестов для их интерпретации, приведены в таблицах 5 и 6.8,9
Планшет инкубируют в течение 18–22 часов при 37°C в инкубаторе с СО2, после чего делают иммунозондирование, позволяющее количественно определить количество клеток, продуцирующих интерферон (наблюдают в виде пятен, каждое пятно представляет собой след отдельного T -лимфоцитарный секретор интерферона). Алгоритм интерпретации, разработанный производителем, облегчает выдачу результатов.Технически, T-SPOT.TB требует больше крови, больше времени на подготовку и требует больше усилий, чем QFT-GIT. Кроме того, он не позволяет работать с образцами по-другому. Рекомендации, рекомендованные производителями этих тестов для их интерпретации, приведены в таблицах 5 и 6.8,9 П. Еременко
П. Еременко орг/10.22627/2072-8107-2020-19-3-34-38
орг/10.22627/2072-8107-2020-19-3-34-38 elpub.ru/
elpub.ru/