Страница статьи : Вопросы вирусологии
Zell R., Delwart E., Gorbalenya A.E., Hovi T., King A.M.Q., Knowles N.J., et al. ICTV Virus Taxonomy Profile: Picornaviridae. J. Gen. Virol. 2017; 98(10): 2421-2. Doi: https://doi.org/10.1099/jgv.0.000911
Carson S.D., Chapman N.M., Hafenstein S., Tracy S. Variations of coxsackievirus B3 capsid primary structure, ligands, and stability are selected for in a coxsackievirus and adenovirus receptor-limited environment. J. Virol. 2011; 85(7): 3306-14. Doi: https://doi.org/10.1128/JVI.01827-10
Delorme-Axford E., Sadovsky Y., Coyne C.B. Lipid raft- and SRC family kinase-dependent entry of coxsackievirus B into human placental trophoblasts. J. Virol. 2013; 87(15): 8569-81. Doi: https://doi.org/10.1128/JVI.00708-13
Shieh J.T., Bergelson J.M. Interaction with decay-accelerating factor facilitates coxsackievirus B infection of polarized epithelial cells.
Shafren D.R., Dorahy D.J., Ingham R.A., Burns G.F., Barry R.D. Coxsackievirus A21 binds to decay-accelerating factor but requires intercellular adhesion molecule 1 for cell entry. J. Virol. 1997; 71(6): 4736-43.
Bergelson J.M., Coyne C.B. Picornavirus entry. Adv. Exp. Med. Biol. 2013; 790: 24-41. Doi: https://doi.org/10.1007/978-1-4614-7651-1_2
Kim C., Bergelson J.M. Echovirus 7 entry into polarized intestinal epithelial cells requires clathrin and Rab7. MBio. 2012; 3(2): e00304-11. Doi: https://doi.org/10.1128/mBio.00304-11
Sobo K., Rubbia-Brandt L., Brown T.D.K., Stuart A.D., McKee T.A. Decay-accelerating factor binding determines the entry route of echovirus 11 in polarized epithelial cells. J. Virol. 2011; 85(23): 12376-86. Doi: https://doi.org/10.1128/JVI.00016-11
Goodfellow I. G., Sioofy A.B., Powell R.M., Evans D.J. Echoviruses bind heparan sulfate at the cell surface. J. Virol. 2001; 75(10): 4918-21. Doi: https://doi.org/10.1128/JVI.75.10.4918-4921.2001
G., Sioofy A.B., Powell R.M., Evans D.J. Echoviruses bind heparan sulfate at the cell surface. J. Virol. 2001; 75(10): 4918-21. Doi: https://doi.org/10.1128/JVI.75.10.4918-4921.2001
Israelsson S., Gullberg M., Jonsson N., Roivainen M., Edman K., Lindberg A.M. Studies of echovirus 5 interactions with the cell surface: heparan sulfate mediates attachment to the host cell. Virus Res. 2010; 151(2): 170-6. Doi: https://doi.org/10.1016/j.virusres.2010.05.001
McLeish N.J., Williams C.H., Kaloudas D., Roivainen M.M., Stanway G. Symmetry-related clustering of positive charges is a common mechanism for heparan sulfate binding in enteroviruses. J. Virol. 2012; 86(20): 11163-70. Doi: https://doi.org/10.1128/JVI.00640-12
Jokinen J., White D.J., Salmela M., Huhtala M., Kapyla J., Sipila K., et al. Molecular mechanism of alpha2beta1 integrin interaction with human echovirus 1. EMBO J. 2010; 29(1): 196-208. Doi: https://doi.
Ylipaasto P., Eskelinen M., Salmela K., Hovi T., Roivainen M. Vitronectin receptors, alpha v integrins, are recognized by several non-RGD-containing echoviruses in a continuous laboratory cell line and also in primary human Langerhans’ islets and endothelial cells. J. Gen. Virol. 2010; 91(Pt. 1): 155-65. Doi: https://doi.org/10.1099/vir.0.012450-0
Nelsen-Salz B., Eggers H.J., Zimmermann H. Integrin alpha(v)beta3 (vitronectin receptor) is a candidate receptor for the virulent echovirus 9 strain Barty. J. Gen. Virol. 1999; 80(Pt. 9): 2311-3. Doi: https://doi.org/10.1099/0022-1317-80-9-2311
Rezaikin A.V., Novoselov A.V., Sergeev A.G., Fadeyev F.A., Lebedev S.V. Two clusters of mutations map distinct receptor-binding sites of echovirus 11 for the decay-accelerating factor (CD55) and for canyon-binding receptors. Virus Res. 2009; 145(1): 74-9. Doi: https://doi.org/10.1016/j.virusres. 2009.06.004
2009.06.004
Novoselov A.V., Rezaykin A.V., Sergeev A.G., Fadeyev F.A., Grigoryeva J.V., Sokolova Z.I. A single amino acid substitution controls DAF-dependent phenotype of echovirus 11 in rhabdomyosarcoma cells. Virus Res. 2012; 166(1-2): 87-96. Doi: https://doi.org/10.1016/j.virusres.2012.03.007
Triantafilou M., Triantafilou K., Wilson K.M., Takada Y., Fernandez N., Stanway G. Involvement of beta2-microglobulin and integrin alphaVbeta3 molecules in the coxsackievirus A9 infectious cycle. J. Gen. Virol. 1999; 80(Pt. 10): 2591-600. Doi: https://doi.org/10.1099/0022-1317-80-10-2591
Heikkila O., Susi P., Stanway G., Hyypia T. Integrin alphaVbeta6 is a high-affinity receptor for coxsackievirus A9. J. Gen. Virol. 2009; 90(Pt. 1): 197-204. Doi: https://doi.org/10.1099/vir.0.004838-0
Heikkila O., Merilahti P., Hakanen M., Karelehto E., Alanko J., Sukki M., et al. Integrins are not essential for entry of coxsackievirus A9 into SW480 human colon adenocarcinoma cells.
Basnet S., Palmenberg A.C., Gern J.E. Rhinoviruses and their receptors. Chest. 2019; 155(5): 1018-1025. Doi: https://doi.org/10.1016/j.chest.2018.12.012
Newcombe N.G., Andersson P., Johansson E.S., Au G.G., Lindberg A.M., Barry R.D., et al. Cellular receptor interactions of C-cluster human group A coxsackieviruses. J. Gen. Virol. 2003; 84(11): 3041-50. Doi: https://doi.org/10.1099/vir.0.19329-0
Mbida A.D., Pozzetto B., Gaudin O.G., Grattard F., Le Bihan J.C., Akono Y., et al. A 44,000 glycoprotein is involved in the attachment of Echovirus-11 onto susceptible cells. Virology. 1992; 189(1): 350-3. Doi: https://doi.org/10.1016/0042-6822(92)90714-z
Mbida A.D., Gaudin O.G., Sabido O., Pozzetto B., Le Bihan J.C. Monoclonal antibody specific for the cellular receptor of echoviruses. Intervirology. 1992; 33(1): 17-22. Doi: https://doi.org/10.1159/000150226
Doi: https://doi.org/10.1159/000150226
Ward T., Powell R.M., Pipkin P.A., Evans D.J., Minor P.D., Almond J.W. Role for beta2-microglobulin in echovirus infection of rhabdomyosarcoma cells. J. Virol. 1998; 72(7): 5360-5.
Ward T., Powell R.M., Evans D.J., Almond J.W. Serum albumin inhibits echovirus 7 uncoating. J. Gen. Virol. 1999; 80(Pt. 2): 283-90. Doi: https://doi.org/10.1099/0022-1317-80-2-283
Ward T., Powell R.M., Chaudhry Y., Meredith J., Almond J.W., Kraus W., et al. Fatty acid-depleted albumin induces the formation of echovirus A particles. J. Virol. 2000; 74(7): 3410-2. Doi: https://doi.org/10.1128/jvi.74.7.3410-3412.2000
Pyzik M., Rath T., Lencer W.I., Baker K., Blumberg R.S. FcRn: The architect behind the immune and nonimmune functions of IgG and albumin. J. Immunol. 2015; 194(10): 4595-603. Doi: https://doi.org/10.4049/jimmunol.1403014
Zhu X. , Peng J., Raychowdhury R., Nakajima A., Lencer W.I., Blumberg R.S. The heavy chain of neonatal Fc receptor for IgG is sequestered in endoplasmic reticulum by forming oligomers in the absence of beta2-microglobulin association. Biochem. J. 2002; 367(3): 703-14. Doi: https://doi.org/10.1042/BJ20020200
, Peng J., Raychowdhury R., Nakajima A., Lencer W.I., Blumberg R.S. The heavy chain of neonatal Fc receptor for IgG is sequestered in endoplasmic reticulum by forming oligomers in the absence of beta2-microglobulin association. Biochem. J. 2002; 367(3): 703-14. Doi: https://doi.org/10.1042/BJ20020200
Sockolosky J.T., Szoka F.C. The neonatal Fc receptor, FcRn, as a target for drug delivery and therapy. Adv. Drug Deliv. Rev. 2015; 91: 109-24. Doi: https://doi.org/10.1016/j.addr.2015.02.005
Arola A., Santti J., Ruuskanen O., Halonen P., Hyypiä T. Identification of enteroviruses in clinical specimens by competitive PCR followed by genetic typing using sequence analysis. J. Clin. Microbiol. 1996; 34(2): 313-8.
Palacios G., Casas I., Tenorio A., Freire C. Molecular identification of enterovirus by analyzing a partial VP1 genomic region with different methods. J. Clin. Microbiol. 2002; 40(1): 182-92. Doi: https://doi.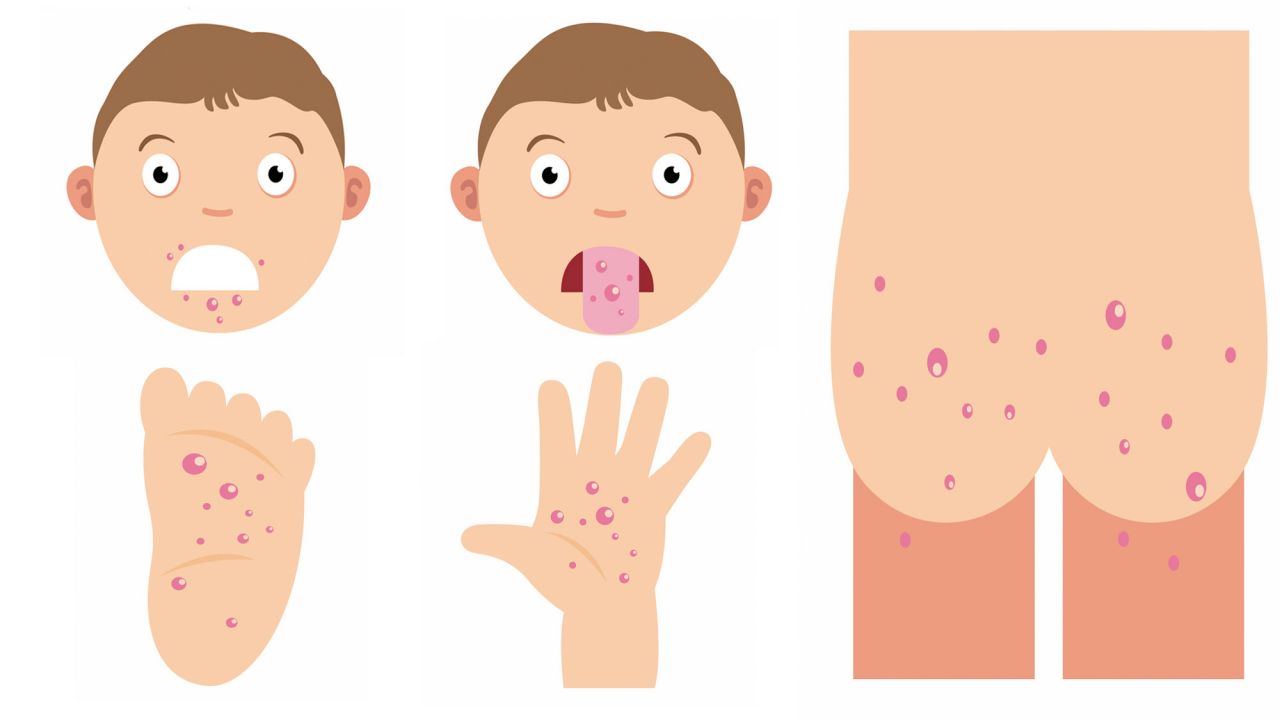
Husson-van Vliet J., Roussel P. Pipetting errors in viral titrations: a useful approach. J. Virol. Methods. 1988; 22(2-3): 183-90. Doi: https://doi.org/10.1016/0166-0934(88)90101-2
Wulff N.H., Tzatzaris M., Young P.J. Monte Carlo simulation of the Spearman-Kaerber TCID50. J. Clin. Bioinforma. 2012; 2(1): 5. Doi: https://doi.org/10.1186/2043-9113-2-5
Schmidtke M., Selinka H.C., Heim A., Jahn B., Tonew M., Kandolf R., et al. Attachment of coxsackievirus B3 variants to various cell lines: mapping of phenotypic differences to capsid protein VP1. Virology. 2000; 275(1): 77-88. Doi: https://doi.org/10.1006/viro.2000.0485
Morosky S., Wells A.I., Lemon K., Evans A.S., Schamus S., Bakkenist C.J., et al. The neonatal Fc receptor is a pan-echovirus receptor. Proc. Natl. Acad. Sci. U.S.A. 2019; 116(9): 3758-63. Doi: https://doi.org/10.1073/pnas.1817341116
Chevaliez S. , Balanant J., Maillard P., Lone Y.C., Lemonnier F.A., Delpeyroux F. Role of class I human leukocyte antigen molecules in early steps of echovirus infection of rhabdomyosarcoma cells. Virology. 2008; 381(2): 203-14. Doi: https://doi.org/10.1016/j.virol.2008.08.006
, Balanant J., Maillard P., Lone Y.C., Lemonnier F.A., Delpeyroux F. Role of class I human leukocyte antigen molecules in early steps of echovirus infection of rhabdomyosarcoma cells. Virology. 2008; 381(2): 203-14. Doi: https://doi.org/10.1016/j.virol.2008.08.006
Heikkila O., Susi P., Tevaluoto T., Harma H., Marjomaki V., Hyypia T., et al. Internalization of coxsackievirus A9 is mediated by beta2-microglobulin, dynamin, and Arf6 but not by caveolin-1 or clathrin. J. Virol. 2010; 84(7): 3666-81. Doi: https://doi.org/10.1128/JVI.01340-09
Avery L.B., Wang M., Kavosi M.S., Joyce A., Kurz J.C., Fan Y.Y., et al. Utility of a human FcRn transgenic mouse model in drug discovery for early assessment and prediction of human pharmacokinetics of monoclonal antibodies. MAbs. 2016; 8(6): 1064-78. Doi: https://doi.org/10.1080/19420862.2016.1193660
Roopenian D.C., Christianson G.J., Proetzel G., Sproule T.J. Human FcRn transgenic mice for pharmacokinetic evaluation of therapeutic antibodies. Methods Mol. Biol. 2016; 1438: 103-14. Doi: https://doi.org/10.1007/978-1-4939-3661-8_6
Methods Mol. Biol. 2016; 1438: 103-14. Doi: https://doi.org/10.1007/978-1-4939-3661-8_6
Вирус Коксаки пришел в Югру — Российская газета
В нескольких муниципалитетах Югры зарегистрирован скачок заболеваемости одним из видов энтеровирусной инфекции.
На днях в социальных сетях среди жителей Сургута прошла волна паники. Виной тому — сообщение, в котором говорилось, что в городе «разгуливает» вирус Коксаки и нужно немедленно предпринимать меры, защищать детей. За разъяснением «РГ» обратилась к заместителю руководителя Роспотребнадзора Югры Инне Кудрявцевой.
По ее словам, осенне-летний сезон — стабильный период подъема заболеваемости энтеровирусными инфекциями. Характерными признаками таких инфекций, как правило, является сыпь на конечностях, животе, зеве, фарингит, ангина с изъявлениями. Простым языком, это — обычная простуда. Но на этот раз ей приписали страшное название — вирус Коксаки.
— Если пять лет назад это считалось просто вирусом, то современные технологии дошли до того уровня, что мы смогли опередить его «природу», — говорит Кудрявцева.
Вирус Коксаки — это циркулирующее по территории Югры энтеровирусное заболевание, которое имеет до двух сотен подвидов: Коксаки А2, А3, А6, А9, А10, ECHOE9… Его проявления зарегистрировали в девяти муниципальных образованиях округа. Но в двух из них они выражены особенно ярко: в Сургуте — 16,69 случаев на 100 тысяч населения, а в Нижневартовске — 13,02. В целом, заболеваемость в Югре составила 8,97 на 100 тысяч населения. Большинство из них — дети до 14 лет. Степень тяжести, в основном, легкая и средняя. Среди людей бытует мнение, что вирус привезли из-за рубежа. Чаще всего винят Турцию. Но вирус «завезенного» характера официально зарегистрирован лишь у 30 процентов заболевших.
На данный момент предпринимаются все меры по профилактике вируса Коксаки: проводится мониторинг воды и бассейнов, работает «горячая линия» по вопросам профилактики энтеровирусной инфекции, разрабатываются рекомендация, ограничения массовых мероприятий, введен усиленный дезинфекционный режим.
Жителям Югры рекомендуется почаще мыть руки, пить бутилированную или кипяченую воду и соблюдать условия хранения пищи. Все потому, что передается энтеровирусное заболевание воздушно-капельным, контактном-бытовым способами, а также — через воду и еду.
Все потому, что передается энтеровирусное заболевание воздушно-капельным, контактном-бытовым способами, а также — через воду и еду.
Российские аптеки — журнал для профессионалов аптечного дела
Новости с турецких курортов взбудоражили всех – и туристов, и туроператоров, и владельцев отелей, и обычных людей в российских городах и селах. Название возбудителя – вирус Коксаки – произносится не иначе как в паре со словом «эпидемия». Попробуем спокойно разобраться в ситуации.
Что это такое?
РНК-содержащие вирусы Коксаки – лишь один из видов большого рода энтеровирусов, куда входят и полиовирусы, и ECHO-вирусы, и многие другие. Известны как минимум 23 серотипа вируса Коксаки А и 6 серотипов вируса Коксаки В.Что вызывают вирусы Коксаки?
Инфекционную патологию с высыпаниями в виде пузырьков (везикул). Если возникает везикулярная сыпь на коже (экзантема), она называется «болезнь рука-нога-рот» (еще одно название – «турецкая краснуха»). Если поражается слизистая глотки, и в частности миндалины, говорят о герпетической ангине.
Если поражается слизистая глотки, и в частности миндалины, говорят о герпетической ангине.Это опасные состояния?
Нет. В подавляющем большинстве случаев все протекает относительно легко и без осложнений.Какие осложнения могут возникнуть?
Самое опасное – серозный менингит, то есть негнойное воспаление оболочек головного мозга. Встречается крайне редко, летальные случаи на его фоне встречаются еще реже.Кто болеет вирусом Коксаки?
Чаще всего дети в возрасте до 5 лет, реже – до 10 лет, однако случаи описаны и у взрослых.Как передается возбудитель?
Фекально-оральным путем. Источник инфекции – больной человек, он распространяет вирус в окружающей среде. Здоровый ребенок или взрослый могут заразиться как при непосредственном контакте (поцелуй, объятия), так и через воду в бассейне и предметы обихода, благо во влажной среде и при комнатной температуре возбудитель способен выживать до 2 недель.В Турции в 2017 году разразилась какая-то особенная эпидемия Коксаки?
Нет, это обычная сезонная вспышка, в субтропиках они регистрируются круглогодично. Для наших широт пик заболеваемости обычно приходится на конец лета – начало осени, на период наиболее интенсивных контактов детей после летних каникул в детских садах и школах.
Для наших широт пик заболеваемости обычно приходится на конец лета – начало осени, на период наиболее интенсивных контактов детей после летних каникул в детских садах и школах.Это даже не самая крупная вспышка. За все время наблюдений чемпионом по числу зараженных остается вспышка в Китае в конце июля 2012 года, когда заболели 1 520 274 человека и 431 из них умерли (летальность 0,03%).
Коксаки встречается только в Турции?
Нет, вспышки периодически регистрируются по всему миру: на Тайване и в Китае, в США и Камбодже, в Испании и Болгарии, в Брунее и России.Чем лечиться?
Заболевание проходит самостоятельно. Специфических противовирусных препаратов не существует. Могут потребоваться НПВС при высокой температуре, они же помогут уменьшить боль от язвочек, которые образуются на месте лопнувших пузырьков сыпи. У маленьких детей необходимо следить за признаками обезвоживания, стараться не допускать их появления – при помощи обильного теплого питья. При зудящей сыпи могут помочь топические и системные антигистамины.
Как предотвратить заражение?
Соблюдать правила личной гигиены, тщательно мыть руки с мылом перед едой, после посещения туалета и возвращения с прогулок. Использовать для питья только бутилированную или кипяченую воду. Соблюдать температурные условия хранения пищи, употреблять только продукты с известными и неистекшими сроками хранения. Хорошо промывать фрукты, ягоды, овощи. Ограничивать допуск детей в бассейны курортов, где зафиксированы случаи заболевания до стабилизации эпидемиологической ситуации.Есть ли вакцина?
Нет, хотя попытки ее разработать были.Остается ли иммунитет после перенесенной инфекции?
Да, но только серотипоспецифический: если человек сталкивался с вирусом Коксаки А19, ничего не помешает ему в следующий раз заболеть при встрече с вирусом Коксаки В3. Это, кстати, затрудняет и разработку вакцины.Можно ли ехать в Турцию?
Можно, помня о правилах профилактики энтеровирусных инфекций. Причем это касается не только нынешнего года, их нужно соблюдать всегда.
Есть ли повод для паники?
Нет.Вам могут понравиться другие статьи:
ПодробностиС новым сиянием!
Красивая кожа отличается естественным блеском – не жирным, а тем самым «свечением изнутри», которое говорит об ухоженности и здоровье.
Новый год под прицелом ученых
Наука может изучить все, до чего дотянется. Рождественские и новогодние каникулы не исключение. Исследователи самых различных медицинских специальностей по-разному рассматривали влияние этих пр…
Рождественские и новогодние каникулы не исключение. Исследователи самых различных медицинских специальностей по-разному рассматривали влияние этих пр…
Идеальное тело
Известно, что устранить отечность, вернуть тонус коже, уменьшить проявления целлюлита помогают лимфодренажные методики, такие как прессотерапия, электромиостимуляция, аппаратный или р…
Подробнее ПодробностиСимвол года 2022: усатый-полосатый
По китайскому календарю, ставшему невероятно популярным на просторах Старого и Нового Света, 2022 год станет годом Черного Водяного Тигра. По традиции мы рассказываем, как связа…
По традиции мы рассказываем, как связа…
Праздник к нам приходит
Он врывается в наши города вместе с ароматами мандаринов, свежей хвои и имбирного печенья. И по давней традиции его встречают с радостью, украшая улицы и устраивая новогодние вечеринк…
Подробнее ПодробностиПоздравляем коллег!
В конце декабря у всех очень напряженный график и одна большая проблема: нужно успеть выбрать и купить подарки для друзей и домашних. А руководителям – еще и подумать о коллективе. Как порадовать и…
А руководителям – еще и подумать о коллективе. Как порадовать и…
Вирусы Коксаки — Справочник химика 21
Изучение противовирусной активности проводили в НИИ эпидемиологии и микробиологии НАН Белоруси (Минск). Определение токсичности исследуемых соединений и их антивирусной активности проводили в культуре, которая перевивалась с клеток почки зеленой мартышки — BGM в логарифмической фазе роста культуры (третьи сутки ш vitro). В качестве ростовой среды использовали Даль-беко модифицированную среду Игла (ДМЕМ) с 10% эмбриональной сывороткой крупного рогатого скота и добавлением антибиотика гентамнцина в дозе 100 мкг/мл. Противовирусную активность препаратов по отношению к РНК-содержащим вирусам Коксаки БЗ (Nan y), ЕСНО-30, и ДНК-содержащего вируса простого герпеса [c. 284]
284]
Полиовирусы (1 — 3-й типы), большинство вирусов Коксаки В, E HO, некоторые типы вирусов Коксаки А (7, 9, 14, 16, 21-й) при размножении в культуре клеток почек обезьян проявляют ЦПД (см. рис. 3.2). В культуре клеток почек эмбриона человека, амниона [c.297]
Вирусы Коксаки группы А и В, полиовирусы и другие энтеровирусы [c.297]
Вирусы Коксаки групп А и В [c.297]
Вирусы Коксаки А из материала от больных наиболее успешно удается вьщелить только на однодневных мышах-сосунках, так как они не размножаются в большинстве культур клеток обезьян и человека. [c.298]
Идентификацию штаммов вирусов Коксаки А, В и E HO, обладающих гемагглютинирующими свойствами, осуществляют с помощью РТГА с использованием антигенов из зараженных клеточных культур и 1%-й взвеси эритроцитов человека группы 0(1). [c.298]
Оптимальные значения pH удаления коагуляцией бактериофага Т-4 составляли 5,1—5,5, бактериофага М-2—5,9—6,1, вирусов коксаки и бактериальных —5,5—5,6 [185, 192, 195]. [c.234]
[c.234]
Вирусы относятся к ультрамикробам, которые настолько малы, что проходят через мембранные фильтры, задерживающие обычные бактерии. Так, размер частиц вируса полиомиелита составляет 8—17 нм, вируса Коксаки и E HO — 20—30 нм, инфекционного гепатита — 40-56 нм. Вирус полиомиелита выделен также в форме кристаллического протеина, обладающего инфекционными свойствами. Для вирусов характерны отсутствие клеточного строения, простота химического состава (обычно гидратированный белок и специфическая нуклеиновая кислота), своеобразие обмена веществ (не имея своей ферментативной системы, они являются паразитами живой клетки животных и растений). Вирусы не размножаются на искусственных питательных средах накапливаются они и проходят определенный цикл развития в соответствующих живых клетках. Действие многих антибиотиков и химиотерапевтических веществ на них малоэффективно. [c.186]
Значительная часть патогенных возбудителей удаляется при обработке-воды коагулянтами. Джилкриз и Келли [155] установили, что при экспериментальном заражении речной воды коагуляция сернокислым алюминием-удаляет вирусы на 40%, кишечную палочку — на 85%, а бактериофаги кишечной палочки — на 90%. Чанг с сотрудниками [156, 157] отмечает, что прибавка к воде сульфата алюминия удаляет вирус Коксаки на 98,6%. Обнаружено, что процессы обеззараживания протекают параллельно с осветлением воды. При этом реагенты не инактивируют микроорганизмы, а лишь-увлекают их в осадок. [c.349]
Джилкриз и Келли [155] установили, что при экспериментальном заражении речной воды коагуляция сернокислым алюминием-удаляет вирусы на 40%, кишечную палочку — на 85%, а бактериофаги кишечной палочки — на 90%. Чанг с сотрудниками [156, 157] отмечает, что прибавка к воде сульфата алюминия удаляет вирус Коксаки на 98,6%. Обнаружено, что процессы обеззараживания протекают параллельно с осветлением воды. При этом реагенты не инактивируют микроорганизмы, а лишь-увлекают их в осадок. [c.349]
Франкова, Дожанская и другие [158, 159] также изучали удаление вирусов Коксаки А при обработке воды сульфатом алюминия. Они показали, что чем больше концентрация вируса, тем большая доза коагулянта требуется, чтобы сделать воду пригодной для питья. Дозы А12(504)з до 100 мг/л снижают содержание вируса в воде, но не делают ее безопасной для питья. При введении в воду вируса в виде суспензии тканевой или мозговой культуры достаточно полное удаление ее достигается при дозе реагента 200— 500 мг/л. В воде, зараженной культурой вируса, очищенной пропуском через мембранные фильтры, коагуляция удаляет вирус лишь в небольшой степени. Добавление поливинилового спирта (0,01%) при обработке воды А12(504)з значительно повышает эффективность очистки. Высокий эффект коагуляции достигается при pH, соответствующем изоэлектрической точке. В этом случае вода может быть очищена до степени, делающей ее пригодной для питья. [c.349]
В воде, зараженной культурой вируса, очищенной пропуском через мембранные фильтры, коагуляция удаляет вирус лишь в небольшой степени. Добавление поливинилового спирта (0,01%) при обработке воды А12(504)з значительно повышает эффективность очистки. Высокий эффект коагуляции достигается при pH, соответствующем изоэлектрической точке. В этом случае вода может быть очищена до степени, делающей ее пригодной для питья. [c.349]
Энтеровирусы человека. Некоторые вирусы человека могут передаваться через воду при ее загрязнении фекалиями [146]. К ним относятся возбудитель инфекционного гепатита, энтеровирусы (полиовпрус, вирусы Коксаки и E HO), аденовирусы и реовнрусы. Классификация вирусов человека включает приблизительно 100 типов, и все они, за исключением неизвестных возбудителей инфекционного гепатита, были найдены в сточных водах и загрязненных открытых водоемах [147]. [c.190]
Полновнрусы, вирусы Коксаки и E HO выживали в водах пз 4 фермерских прудов прн 20 н 4°С до 9 нед [161]. В той же воде при добавле[пп1 в нее 95 г хлорида магнпя вирусы выживали до 12 нед, в присутствии солей марганца — до 5 нед, в присутствии солей железа менее 3 нед. [c.192]
В той же воде при добавле[пп1 в нее 95 г хлорида магнпя вирусы выживали до 12 нед, в присутствии солей марганца — до 5 нед, в присутствии солей железа менее 3 нед. [c.192]
А. Выживаемость в морской воде. Большие количества вирусов содержатся в фекалиях [24] и могут длительно выживать в природных водах. Ни первичная обработка, ни вторичная очистка сточных вод не снижают существенно содержание в них кишечных вирусов, хлорирование также в этом плане часто неэффективно [25]. При хранении умеренно загрязненных сточных вод при средних температурах наблюдается инактивация 99% вирусов Коксаки через 7 дней. Более длительно они выживают при низких температурах [26]. На рис. 51 показано влияние температуры воды на выживаемость различных кишечных вирусов [27]. Большинство вирусов выживало в водах эстуария более 56 дней зимой и менее 32 дней летом. В загрязненной воде нолиовирусы выживали 35 [c.233]
Вода, используемая для питья и купания, может служить источником распространения большинства вирусов. Группа Pi orna наиболее часто присутствует в сточных водах. Она включает нолиовирусы, вирусы Коксаки и E HO. В фекалиях нередко обнаруживаются аденовирусы. [c.278]
Группа Pi orna наиболее часто присутствует в сточных водах. Она включает нолиовирусы, вирусы Коксаки и E HO. В фекалиях нередко обнаруживаются аденовирусы. [c.278]
Изучение динамики инактивации аттенуированного (LS 2 ав) и вирулентного (Магоней) штаммов вируса полиомиелита, серотип, а также вирусов Коксаки А-7, В-3 и ЕСНО-7 показало, что исследованные вирусы были одинаково чувствительны к действию продуктов электролиза поваренной соли. Вирулицидное действие продуктов электролиза зависит от тех же факторов, что и бактерицидное. Исходная концентрация вирусов в обрабатываемой воде определяла в значительной мере дозу, а также продолжительность контакта, обеспечивающие желаемый эффект. Кроме того, установлено, что эффект инактивации продуктами электролиза энтеровирусов и фагов кишечной палочки зависит от активной реакции (pH) среды. Аналогичные результаты были получены при инактивации вируса хлором. Так, при одинаковом содержании остаточного хлора в воде с pH 7,3—7,6 инактивация вируса и фага кишечной палочки проходит [c. 101]
101]
В течение первых 5 мин озонирования озон расходовался главным образом на окисление мертвых органических веществ. При этом в течение первой минуты озонирования так называемые легкоокисляемые вещества были полностью окислены. Инактивация основной массы энтеровирусов произошла на б—7-й минуте озонирования — в момент появления следов остаточного озона в воде. Через 15 мин озонирования в воде оставалось около 0,3% первоначального количества вирусов полиомиелита и около 0,1% вирусов Коксаки, концентрация остаточного озона составляла 0,2 мг/л. Фактически процесс инактивации энтеровирусов приблизился к полному завершению. Динамика инактивации энтеровирусов, наблюдавшаяся в опытах, указывает на то, что вирусы Коксаки В типа 3 несколько менее устойчивы к действию озона, чем вирусы полиомиелита серотина 3. [c.114]
Таким образом, концентрация остаточного озона в воде порядка 0,2 мг/л свидетельствует о высокой степени инактивации энтеровирусов (99,7—99,9%). Вирусы Коксаки В типа 3 менее стойки к действию озона, чем вирусы полиомиелита серотипа 3. Озонирование воды является эффективным методом обеззараживания в отношении энтеровирусов. [c.114]
Вирусы Коксаки В типа 3 менее стойки к действию озона, чем вирусы полиомиелита серотипа 3. Озонирование воды является эффективным методом обеззараживания в отношении энтеровирусов. [c.114]
Фекальными отходами людей могут быть обусловлены следующие болезни бактериальные инфекции — тифоидная лихорадка, паратиф, холера, шигеллоз (бациллярная дизентерия) вирусные инфекции — полиомиелит, вирусы Коксаки, инфекционный гепатит (существует много других кишечных вирусов) протозоальные инфекции — гистолитическая амебная дизентерия гельминтозы — солитеры рыбный, бычий и свиной, острица, червеобразная аскарида, власоглав человеческий, крючкообразный глист. [c.135]
В. П. Широбокову [184] удалось показать, что крымский бентонит (Курцивское месторождение), переведенный в Na-форму и обработанный по методу Френкель-Конрата 11851, адсорбирует из водной взвеси больше 99% исходного количества вирусов. При этом для полной адсорбции используются небольшие концентрации бентонита, в частности, даже концентрация бентонита 0,025% обеспечивает практически полное удаление вируса Коксаки В- .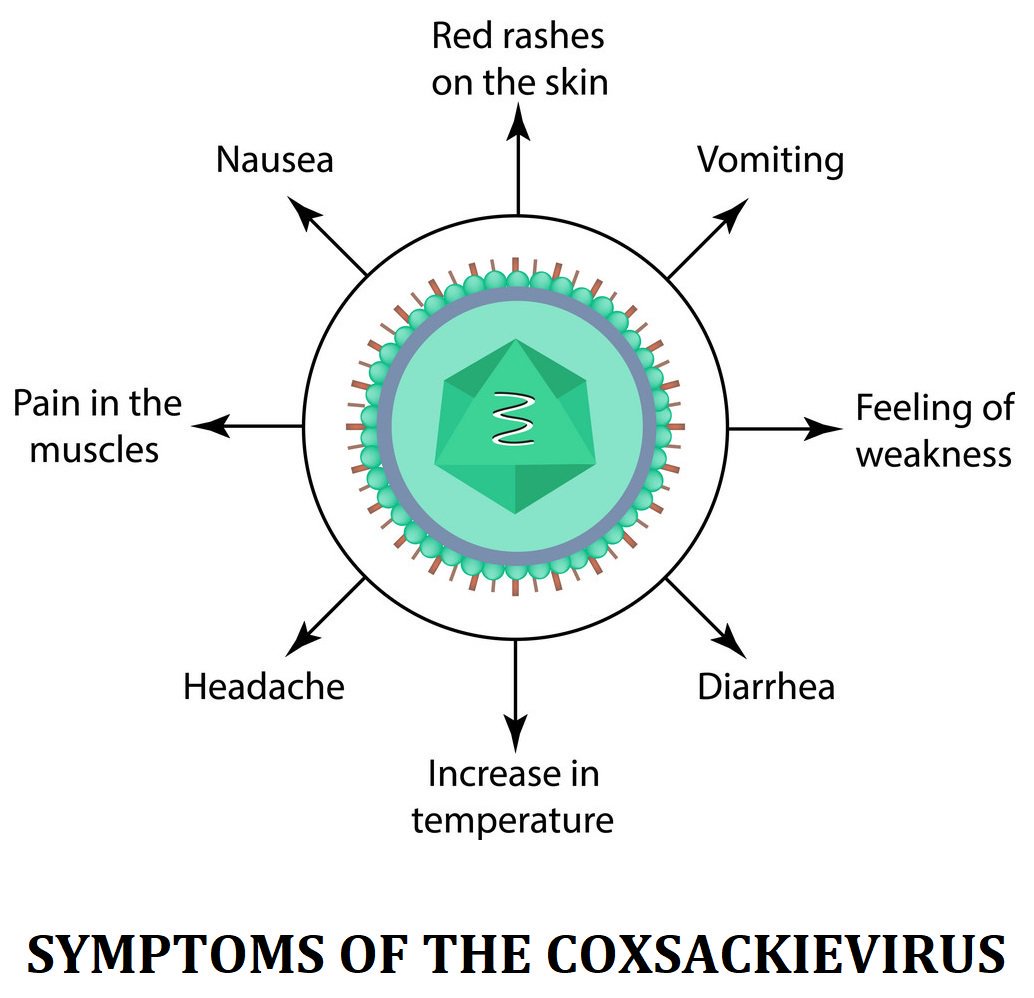 [c.309]
[c.309]
ЕСНО-вирусы. Вирусы Коксаки [c.133]
Вирусы Коксаки — типичные пикорнавирусы. [c.134]
Некоторые вирусы Коксаки способны вызывать гемагглюти-нацию эритроцитов человека. [c.134]
Инфекционный процесс, вызванный вирусами Коксаки, сопровождается синтезом типоспецифических антигенов, обнаруживаемых в сыворотке через неделю после начала заболевания. Лабораторная диагностика [c.135]
Л, В. Григорьева [12] для исследования бытовых стоков и вод открытых водоемов на вирусное загрязнение применяла также сыворотку крови, которую добавляли в воду. Белки сыворотки с адсорбированными на них вирусами высаливались сернокислым аммонием и очищались диализом в проточной водопроводной воде. Л. В. Григорьева и Т. В. Старовойтова [13], использовавшие указанные методические приемы, выделили вирусы Коксаки из 29,4% образцов сточных вод и из 14,0% проб воды из рек Украины. [c.70]
[c.70]
В. П. Широбоков [69], в частности, использовал крымский бентонит Курцивского месторождения. Автору удалось показать, что на геле бентонита адсорбируется больше 99% исходной инфекционности вирусов Коксаки. При этом требуется очень небольшое количество бентонита, даже при концентрации его в 0,025% происходит практически полная адсорбция вируса Коксаки В1 из вируссодержащей суспензии. Учитывая, что предлагаемый бентонитовый метод концентрирования вирусов прост, не требует сложного и дорогостоящего оборудования и поэтому доступен любой вирусологической лаборатории, он может оказаться перспективным при разработке методов индикации вирусов из воды. В этом убеж- [c.72]
Установлено [74], что вирус полиомиелита может быть жизнеспособным в водопроводной воде более 100 дней. Энтеровирусы в сточной воде могут сохраняться месяцами. Так, вирус Коксаки А5 не терял полностью инфекционных свойств в течение четырех месяцев, если температура была не выше 8—10° С [84]. При температуре 4° С вирусы Коксаки А5 выживали в сточной воде в течение 200 дней, что в 1,5—2 раза больше, чем в естественной, и в 7—11 раз больше, чем в морской воде. Большую выживаемость вирусов в сточной воде исследователи объясняют защитным влиянием органических примесей, содержащихся в бытовых сточных водах. Так, вирус в осадке сточной воды обнаруживался даже на 300-й день, если он сохранялся при температуре 4° С [12]. [c.77]
При температуре 4° С вирусы Коксаки А5 выживали в сточной воде в течение 200 дней, что в 1,5—2 раза больше, чем в естественной, и в 7—11 раз больше, чем в морской воде. Большую выживаемость вирусов в сточной воде исследователи объясняют защитным влиянием органических примесей, содержащихся в бытовых сточных водах. Так, вирус в осадке сточной воды обнаруживался даже на 300-й день, если он сохранялся при температуре 4° С [12]. [c.77]
Длительность выживания вирусов Коксаки в авто-клавированной водопроводной воде, по данным [12], зависит от температуры хранения и концентрации вируса в известной мере она обусловлена также индивидуаль- [c.77]
Исследования [84] показали, что вирус Коксаки удается разрушить с помощью активного хлора, содержащегося в дозе, большей чем 0,2 мг/л. Изучено влияние хлора на вирусы полиомиелита. Вирусы полиомиелита [c.78]
Проанализированы литературные данные об устойчивости вирусов к действию препаратов хлора [76]. Оказалось, что вирус Тейлора устойчивее вируса Коксаки А2 Последний устойчивее вируса полиомиелита I типа Выше указывалось также, что аттенуированные штаммы вирусов устойчивее вирулентных. Если проводить хлори рование питьевой воды дважды, то вирусы полностью инактивируются. При этом дозировка реагента до очистки должна обеспечивать остаточный хлор в концентрации 1 мг л. Время контакта воды с хлором не менее 30 мин. После очистки проводят повторное хлорирование воды. Надежды на успешную инактивацию вирусов могут не оправдаться, если вирусная частица окружена органическими или неорганическими примесями. Известно [106], что примеси образуют на поверхности вирусной частицы защитную оболочку, ограждающую ее от действия хлора. [c.79]
Оказалось, что вирус Тейлора устойчивее вируса Коксаки А2 Последний устойчивее вируса полиомиелита I типа Выше указывалось также, что аттенуированные штаммы вирусов устойчивее вирулентных. Если проводить хлори рование питьевой воды дважды, то вирусы полностью инактивируются. При этом дозировка реагента до очистки должна обеспечивать остаточный хлор в концентрации 1 мг л. Время контакта воды с хлором не менее 30 мин. После очистки проводят повторное хлорирование воды. Надежды на успешную инактивацию вирусов могут не оправдаться, если вирусная частица окружена органическими или неорганическими примесями. Известно [106], что примеси образуют на поверхности вирусной частицы защитную оболочку, ограждающую ее от действия хлора. [c.79]
Вирусологическими, бактериологическими и санитарно-химическими исследованиями процесса очистки бытовых сточных вод на лабораторных моделях сооружений подземной фильтрации и в естественных условиях ими установлено, что бытовые стоки хорошо освобождаются от вирусов. В качестве тест-организмов использовались вирусы Коксаки А5, А14 и бактериофаг кишечной палочки № 163. Хотя после искусственного инфицирования сточная жидкость содержала Ю ИДбо вируса мл, в 0,1— 1,0 жл фильтрата сточной жидкости, полученного после сооружений, обнаружить вирусы не всегда удавалось. Поэтому исследователи для концентрирования вирусов использовали ионообменники, в частности ЭДЭ-10П. Однако выделить вирусы из фильтрата позже 20 дня со времени внесения не удавалось. В то же время случаи выделения в упомянутый срок составляли не более сотых долей процента (0,042% и близкие к этому цифры). [c.83]
В качестве тест-организмов использовались вирусы Коксаки А5, А14 и бактериофаг кишечной палочки № 163. Хотя после искусственного инфицирования сточная жидкость содержала Ю ИДбо вируса мл, в 0,1— 1,0 жл фильтрата сточной жидкости, полученного после сооружений, обнаружить вирусы не всегда удавалось. Поэтому исследователи для концентрирования вирусов использовали ионообменники, в частности ЭДЭ-10П. Однако выделить вирусы из фильтрата позже 20 дня со времени внесения не удавалось. В то же время случаи выделения в упомянутый срок составляли не более сотых долей процента (0,042% и близкие к этому цифры). [c.83]
Эффективность удаления микроорганизмов из воды при коагуляции была предметом многочисленных исследовании. Установлено [84], что ири экспериментальном заражении речной воды коагуляция с помощью квасцов удаляет вирусы на 40%, кишечную палочку на 85%, а бактериофаги кишечной палочки — на 90%. Добавлением к воде 25 мг л сернокислого алюминия вирус Коксаки удаляется на 98,6%. Если эта доза сернокислого алюминия используется в двухэтапном процессе коагуляции, то при этом вода освобождается от вируса иа 99,9%, от кишечной палочки на 99,99% [75]. Этими исследованиями обнаружено, что процессы обеззараживания протекают параллельно с осветлением воды. При этом реагенты не инактивируют микроорганизмы, а лишь увлекают их в осадок. Эти наблюдения в известной мере проливают свет на механизм действия коагулянтов и других материалов, использующихся для очистки и обеззараживания воды. Все же механизм удаления вирусов недостаточно изучен. Известно [100], что энтеровирусы можно концентрировать на гидроокиси алюминия. Приведенные данные позволяют предполагать участие [c.88]
Если эта доза сернокислого алюминия используется в двухэтапном процессе коагуляции, то при этом вода освобождается от вируса иа 99,9%, от кишечной палочки на 99,99% [75]. Этими исследованиями обнаружено, что процессы обеззараживания протекают параллельно с осветлением воды. При этом реагенты не инактивируют микроорганизмы, а лишь увлекают их в осадок. Эти наблюдения в известной мере проливают свет на механизм действия коагулянтов и других материалов, использующихся для очистки и обеззараживания воды. Все же механизм удаления вирусов недостаточно изучен. Известно [100], что энтеровирусы можно концентрировать на гидроокиси алюминия. Приведенные данные позволяют предполагать участие [c.88]
Одну пару камер разъединяли через 2, 4, 6, 8, 12, 24, 48 ч контакта, затем зараженную зеркальную и клеточные культуры помещали отдельно в разные термостаты. Демонтирование камер, фиксирование, окраску и морфологические исследования стекол проводили через 18, 24, 48 ч раздельного культивирования. Оказалось, что минимальное время контакта, необходимое для появления зеркального ЦПЭ, равно 4 ч для вируса РРУ и 6 ч для аденовируса, вируса Коксаки А-13 и сулемы. Более короткая экспозиция четкого эффекта не дает. Зеркальный эффект при [c.29]
Оказалось, что минимальное время контакта, необходимое для появления зеркального ЦПЭ, равно 4 ч для вируса РРУ и 6 ч для аденовируса, вируса Коксаки А-13 и сулемы. Более короткая экспозиция четкого эффекта не дает. Зеркальный эффект при [c.29]
В качестве экстремального агента в работе использовали три различных вида вируса Коксаки А-13 (штамм 401 и 639), вирус классической чумы птиц и аденовирус (штамм 5) химический клеточный яд — двухлористую ртуть (сулему) и ультрафиолетовую радиацию (экспозиция 40—45 с лампа БУВ-30, расстояние [c.31]
В качестве экстремальных агентов использовались вирус Коксаки А-13, вирус классической чумы птиц РРУ), двухлористая ртуть (сулема), ультрафиолетовая радиация. [c.32]
Вирусы Коксаки А-13 размножаются в первичных культурах клеток тканей и органов эмбриона человека и приматов, в культурах почечной и амниотической тканей человека. [c.35]
Цитопатнческос действие вируса Коксаки А-13 выражается в дегенерации клеточных культур, завершающейся полной деструкцией клеток с последующим их отслоением и освобождением 03 них вирусных частиц. Р1а окрашенных препаратах ЦПЭ характеризуется пикнозом ядер, исчезновением ядрышек, появлением в центре клеток РНК-содержащих эозинофильных масс, которые, увеличиваясь в размерах, смещают ядро к периферии клетки. [c.35]
Р1а окрашенных препаратах ЦПЭ характеризуется пикнозом ядер, исчезновением ядрышек, появлением в центре клеток РНК-содержащих эозинофильных масс, которые, увеличиваясь в размерах, смещают ядро к периферии клетки. [c.35]
Биологической особенностью вирусов Коксаки А-13 является способность вызывать у новорожденных мышей вялые параличи, обусловленные распространенным миозитом с острым воспалением и некрозом (типа ценкеровского) скелетных мышц. [c.35]
Характеристика проблемы, на решение которой направлена Программа / КонсультантПлюс
Характеристика проблемы, на решение которой
направлена Программа
Актуальность проблемы ЭВИ и ее эпидемиологическая значимость определяется высокой контагиозностью, широким распространением, возникновением эпидемических подъемов и вспышечной заболеваемости, устойчивостью вируса во внешней среде, длительностью выделения возбудителя с фекалиями, в т.ч. у лиц без клинической картины заболевания, отсутствием средств специфической профилактики, многообразием возбудителей ЭВИ, вызывающих полиморфные клинические проявления, возможностью тяжелых последствий вплоть до летальных исходов. Ежегодно в стране регистрируются сезонные подъемы заболеваемости ЭВИ (июль — октябрь), групповые очаги заболеваний, остается риск завоза инфекции с сопредельных государств.
Ежегодно в стране регистрируются сезонные подъемы заболеваемости ЭВИ (июль — октябрь), групповые очаги заболеваний, остается риск завоза инфекции с сопредельных государств.
В рамках реализации ведомственной целевой программы «Эпидемиологический надзор и профилактика энтеровирусной (неполио) инфекции на 2015 — 2017 гг.» (далее — Программа) проводилась работа по совершенствованию санитарного законодательства и методического обеспечения в части надзора за энтеровирусной инфекцией в Российской Федерации. За период действия Программы приняты меры по актуализации методических указаний МУ 3.1.1.2363-08 «Эпидемиологический надзор и профилактика энтеровирусной (неполио) инфекции» и МУК 4.2.2357-08 «Организация и проведение вирусологических исследований материалов из объектов окружающей среды на полиовирусы, другие (неполио) энтеровирусы».
В целях совершенствования эпидемиологического надзора за ЭВИ, повышения качества лабораторной диагностики ЭВИ в соответствии с приказом Роспотребнадзора от 19. 12.2016 N 1236 «О совершенствовании эпидемиологического надзора за ЭВИ» на базе ФБУН «Екатеринбургский НИИ вирусных инфекций» создан методический центр по изучению энтеровирусных инфекций, обеспечено его взаимодействие с Референс-центром по мониторингу за энтеровирусными инфекциями (ФБУН «Нижегородский НИИЭМ им. академика И.Н. Блохиной» Роспотребнадзора).
12.2016 N 1236 «О совершенствовании эпидемиологического надзора за ЭВИ» на базе ФБУН «Екатеринбургский НИИ вирусных инфекций» создан методический центр по изучению энтеровирусных инфекций, обеспечено его взаимодействие с Референс-центром по мониторингу за энтеровирусными инфекциями (ФБУН «Нижегородский НИИЭМ им. академика И.Н. Блохиной» Роспотребнадзора).
В целях оптимизации взаимодействия Референс-центра по мониторингу за энтеровирусными инфекциями, региональных научно-методических центров по изучению энтеровирусных инфекций (ФБУН «Екатеринбургский НИИ вирусных инфекций» Роспотребнадзора и ФБУН «Хабаровский НИИЭМ» Роспотребнадзора) с территориальными органами и организациями Роспотребнадзора проведено закрепление субъектов страны за соответствующими научно-исследовательскими организациями, заключены соглашения о сотрудничестве.
В период реализации Программы отмечался рост заболеваемости ЭВИ, что может быть связано как со сменой доминирующих штаммов энтеровирусов (ЭВ), так и с улучшением надзора в ряде субъектов Российской Федерации, регистрацией не только случаев энтеровирусного менингита (ЭВМ), но и малых форм.
Лабораторное подтверждение диагноза ЭВИ (суммарно всеми методами) за прошедший период увеличилось на 7,9% и составило 97,3%.
Проведен анализ пейзажа типов энтеровирусов (ЭВ) в субъектах Российской Федерации, генотипирование и анализ филогенетических взаимосвязей энтеровирусов, выявленных в клинических образцах и в пробах из объектов окружающей среды. В 2015 — 2017 гг. в Российской Федерации активно циркулировали представители вида Энтеровирус А (ЭВА) и наблюдался высокий уровень заболеваемости малыми формами ЭВИ. При этом вирус Коксаки А6 сохранял доминирующее положение среди ЭВА. Данный вирус выделялся у больных всеми формами ЭВИ, но преимущественно при малых формах.
Кроме того, за прошедший период действия Программы возобновилась циркуляция ЭВ71 генотипа С1 (последний раз в Российской Федерации выделялся в 2007 г.), идентифицирован вирус нового, недавно открытого, типа ЭВА120.
Впервые в Российской Федерации у больных ЭВМ был обнаружен энтеровирус 75. Также случаи заболеваний ЭВМ были связаны с активизацией циркуляции вируса ЕСНО9, продолжившейся циркуляцией вируса ЕСНО30 генотипа h и редкого вируса ЕСНО33, который был генетически отличен от ранее выделенных российских штаммов. Установлено, что штаммы вируса ЕСНО30, идентифицированные в ряде субъектов страны, относятся к новому для Российской Федерации геноварианту, сформировавшемуся в результате отдельного заноса на территорию страны, ориентировочно в конце 2016 г. — начале 2017 г.
Установлено, что штаммы вируса ЕСНО30, идентифицированные в ряде субъектов страны, относятся к новому для Российской Федерации геноварианту, сформировавшемуся в результате отдельного заноса на территорию страны, ориентировочно в конце 2016 г. — начале 2017 г.
Несмотря на проделанную работу остается ряд проблем в осуществлении эпиднадзора за ЭВИ, которые требуют решения.
Распределение заболеваемости ЭВИ по территории Российской Федерации продолжает оставаться неравномерным, наиболее высокая заболеваемость ЭВИ зарегистрирована в ряде субъектов Сибирского и Дальневосточного федеральных округов. В то же время не зарегистрированы случаи ЭВИ в Республике Ингушетия, Чеченской Республике, Чукотском АО, что может быть связано с проблемами в диагностике ЭВИ, недостаточной квалификационной подготовкой медицинских работников по вопросам эпидемиологии, диагностики и профилактики энтеровирусной инфекции и недостаточным вниманием к проблеме.
За период реализации программы не получены молекулярно-генетические характеристики ЭВ, циркулирующих в Республике Ингушетия, Кабардино-Балкарской, Чеченской республиках.
Систематические положительные находки ЭВ в сточных водах при отсутствии регистрации ЭВИ, возможно, свидетельствуют о недостатках в работе по выявлению больных.
Не в полном объеме проводится работа по установлению причин и условий возникновения эпидемических подъемов заболеваемости ЭВИ.
Не во всех случаях идентификация энтеровирусов проводится до их типа. В стандартах оказания медицинской помощи отсутствуют исследования на ЭВ. Трудности в диагностике ЭВИ не всегда позволяют своевременно и адекватно оценить проявления эпидемического процесса и масштабы циркуляции ЭВ, что приводит к несвоевременности начала противоэпидемических мероприятий.
Необходима оценка существующих методов лабораторной диагностики ЭВИ, разработка подходов к прогнозированию ситуации.
В связи с тем, что в международных базах данных практически не представлены геномные последовательности ЭВ, циркулирующих в Турции, Египте, Афганистане, Пакистане, других африканских странах, ряде стран Средней и Юго-Восточной Азии, Украине, остается актуальной характеристика ЭВ, выделенных от лиц, прибывших из зон активного туризма и политически нестабильных регионов, трудовых мигрантов.
Все это определяет необходимость дальнейшего совершенствования эпидемиологического надзора за ЭВИ.
В Подмосковье усилят меры профилактики инфекции, вызываемой вирусом Коксаки
19 авг. 2017 г., 10:51
Минздрав Подмосковья дал распоряжение региональным государственным учреждениям здравоохранения провести дополнительные профилактические мероприятия, направленные на снижение заболеваемости энтеровирусной инфекцией, соответствующий документ опубликован на сайте Министерства здравоохранения Московской области.
В число энтеровирусов входит вирус Коксаки, вспышка которого наблюдается сейчас в Турции. По данным Роспотребнадзора, на отдыхе в этой стране вирус подцепили уже более 800 россиян. Из Турции вирус Коксаки попал в том числе и в Московский регион.
Как поясняется в материале, в связи с напряженной эпидемиологической обстановкой и высоким риском завоза и распространения инфекции в Подмосковье вводятся дополнительные профилактические меры против энтеровирусной инфекции.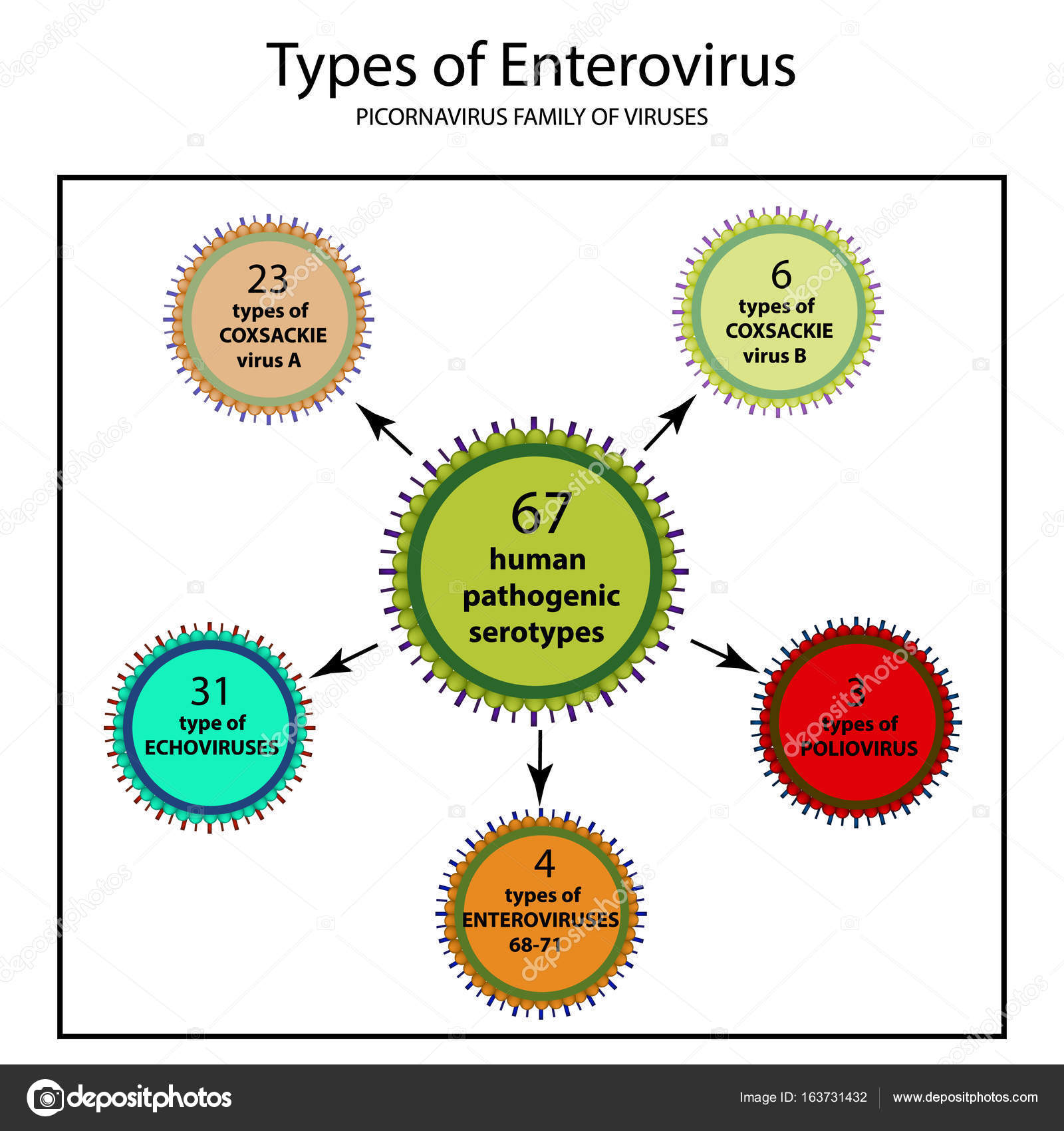 Усиленная профилактика также позволит предупредить дальнейшее распространение заболевания.
Усиленная профилактика также позволит предупредить дальнейшее распространение заболевания.
«Руководителям государственных учреждений здравоохранения своевременно выявлять случаи заболевания энтеровирусной инфекцией, «подозрительные и вероятные случаи энтеровирусной инфекции», своевременно изолировать (непосредственно после выявления), госпитализировать по клиническим и эпидемиологическим показаниям больных с инфекцией и лиц с подозрением на заболевание в инфекционные отделения», – уточняется в распоряжении.
Так, Минздрав требует обязательно госпитализировать больных энтеровирусной инфекцией и лиц с подозрением на данное заболевание, у которых наблюдаются симптомы серозного менингита, менингоэнцефалита, вирусных энцефалитов и миелита, а также пациентов с увеитами, геморрагическими конъюнктивитами и миокардитами.
При подозрении на инфекцию медики должны провести лабораторное обследование пациента в день обращения или госпитализации. Больных и лиц с подозрением на болезнь должны в обязательном порядке изолировать от коллективов и из общежитий, подчеркивается в документе.
Также ведомство распорядилось при подозрении на заболевание проводить профилактические мероприятия и дезинфекцию в эпидемическом очаге энтеровирусной инфекции, а также вести медицинское наблюдение за лицами, контактировавшими с больными. Так, наблюдение за людьми из группы риска должно длиться 10 дней в случаях контакта с пациентом с легкой формой энтеровирусной инфекции и 20 дней, если человек контактировал с заболевшим формой инфекции с поражением нервной системы. При этом в детских коллективах на эти же сроки устанавливается карантин.
Областной Минздрав требует провести дополнительное обучение персонала в медицинских учреждениях и оперативно докладывать об осложнении эпидемической ситуации по энтеровирусной инфекции, сообщая о каждом случае заболевания или подозрения на заболевание.
Ранее заведующий лабораторией молекулярной диагностики и эпидемиологии кишечных инфекций центрального НИИ эпидемиологии Роспотребнадзора Александр Подколзин заявил, что борьба с вирусом Коксаки в Московском регионе достаточно эффективна и не позволит болезни распространиться и перерасти в эпидемию.
Вирус Коксаки был впервые описан в конце 1940-х годов Гилбертом Даллдорфом. Эта вирусная инфекция относится к семейству герпетических вирусов, живущих и размножающихся в пищеварительном тракте человека. Вирус очень заразен и может легко передаваться от человека к человеку: при кашле или из-за контакта с мочой, слюной или кровью. Болеют преимущественно дети до 10 лет.
Источник: http://indubnacity.ru/novosti_oblasti/novosti_podmoskovya/v_podmoskove_usilyat_mery_profilaktiki_infekcii_vyzyvaemoy_virusom_koksaki_20170819
Вирус Коксаки А – обзор
Лабораторная диагностика
Большинство, но не все энтеровирусы легко выделяются в клеточной культуре, хотя молекулярное тестирование в настоящее время является стандартом для диагностики острой энтеровирусной инфекции. Праймеры, охватывающие консервативную общую 5′-некодирующую область, позволяют амплифицировать полный спектр Коксаки А- и В-вирусов, эховирусов, полиовирусов и энтеровирусов с 68 по 71 с помощью ОТ-ПЦР. Имеются коммерческие наборы, которые можно использовать для тестирования спинномозговой жидкости, кала, смывов бронхов и трахеи, сыворотки или плазмы, а также образцов вскрытия.ОТ-ПЦР дает гораздо более быстрые результаты, чем вирусная культура, и было обнаружено, что для некоторых типов образцов она более чувствительна. Он не дает вируса для дальнейшей идентификации, но референс-лаборатории могут затем идентифицировать тип вируса с помощью секвенирования РНК. Изменяя дизайн праймеров, тесты ОТ-ПЦР можно сделать селективными к конкретным видам или типам вирусов.
Имеются коммерческие наборы, которые можно использовать для тестирования спинномозговой жидкости, кала, смывов бронхов и трахеи, сыворотки или плазмы, а также образцов вскрытия.ОТ-ПЦР дает гораздо более быстрые результаты, чем вирусная культура, и было обнаружено, что для некоторых типов образцов она более чувствительна. Он не дает вируса для дальнейшей идентификации, но референс-лаборатории могут затем идентифицировать тип вируса с помощью секвенирования РНК. Изменяя дизайн праймеров, тесты ОТ-ПЦР можно сделать селективными к конкретным видам или типам вирусов.
До появления ОТ-ПЦР энтеровирусная инфекция обычно диагностировалась путем выделения вируса из фекалий или иногда из горла на ранних стадиях заболевания или, при необходимости, из глаз, везикулярной жидкости, мочи, ЦСЖ, крови или органов, таких как сердце или мозг при вскрытии.Выделение из «стерильных» мест гораздо больше свидетельствует о причинно-следственной связи с клиническим заболеванием, чем выделение из фекалий. Классически первичные культуры почек обезьян были стандартным субстратом, но уменьшение доступности этих клеток привело к тому, что в большинстве лабораторий они были заменены непрерывными клеточными линиями. Полиовирусы хорошо растут практически в любом типе клеток обезьяны или человека. Диплоидные эмбриональные фибробласты легких человека (HDF или HEL) поддерживают рост большинства эховирусов, но лишь некоторых вирусов Коксаки.Линия клеток почки обезьяны, BGM, особенно чувствительна к вирусам Коксаки B. Линия рабдомиосаркомы человека, RD, поддерживает рост некоторых вирусов Коксаки А, ранее считавшихся невозможными для роста в клеточной культуре, в дополнение ко многим эховирусам. Энтеровирус 70 прихотлив, но его трудно выделить в клетках HDF. Цитопатические эффекты напоминают эффекты полиовируса, но развиваются медленнее, начиная с очагов округлых рефрактильных клеток, которые затем лизируются и отделяются от субстрата.Слепой пассаж может быть необходим для выявления присутствия вируса, особенно вируса Коксаки А.
Классически первичные культуры почек обезьян были стандартным субстратом, но уменьшение доступности этих клеток привело к тому, что в большинстве лабораторий они были заменены непрерывными клеточными линиями. Полиовирусы хорошо растут практически в любом типе клеток обезьяны или человека. Диплоидные эмбриональные фибробласты легких человека (HDF или HEL) поддерживают рост большинства эховирусов, но лишь некоторых вирусов Коксаки.Линия клеток почки обезьяны, BGM, особенно чувствительна к вирусам Коксаки B. Линия рабдомиосаркомы человека, RD, поддерживает рост некоторых вирусов Коксаки А, ранее считавшихся невозможными для роста в клеточной культуре, в дополнение ко многим эховирусам. Энтеровирус 70 прихотлив, но его трудно выделить в клетках HDF. Цитопатические эффекты напоминают эффекты полиовируса, но развиваются медленнее, начиная с очагов округлых рефрактильных клеток, которые затем лизируются и отделяются от субстрата.Слепой пассаж может быть необходим для выявления присутствия вируса, особенно вируса Коксаки А. Предварительное отнесение к семейству Picornaviridae обычно производится на основе характерного CPE.
Предварительное отнесение к семейству Picornaviridae обычно производится на основе характерного CPE.
Использование инокуляции мышей в настоящее время представляет в основном исторический интерес, хотя некоторые вирусы Коксаки А (например, типы 1, 19, 22) могут быть выделены только таким способом. Новорожденных мышей (в возрасте до 24 часов) инокулируют либо внутрибрюшинно, либо внутримозгово, затем наблюдают на наличие болезни, убивают или подвергают гистологии.
Точно так же серология не имеет большого значения. В прошлом использовался тест микронейтрализации с использованием известных серотипов энтеровирусов, но он трудоемок, плохо стандартизирован, относительно нечувствителен и слишком типоспецифичен. Обнаружение одного высокого титра антител не имеет практического клинического значения, а парные образцы, демонстрирующие нарастающий титр, часто недоступны. При кардите, вызванном вирусом Коксаки, или геморрагическом конъюнктивите, вызванном энтеровирусом 70, вирусспецифические антитела IgM могут быть идентифицированы с помощью ИФА с захватом IgM в любое время до двух месяцев после появления симптомов, но перекрестные реакции с другими энтеровирусами ограничивают полезность этого подхода.
Анализы для прямого обнаружения антигена были разработаны для конкретных «чистых» образцов, например, иммунофлуоресценция для выявления энтеровируса 70 в соскобах с конъюнктивы или других энтеровирусов в лейкоцитах ЦСЖ. Типоспецифические моноклональные антитела полезны только тогда, когда число возможных серотипов строго ограничено, например, при идентификации энтеровируса 70 или вируса Коксаки А24 при остром геморрагическом конъюнктивите.
Типирование изолятов энтеровирусов часто показано как для мониторинга и анализа вспышек заболеваний, так и для идентификации циркулирующих штаммов полиовируса.Для типирования изолята широко применялась нейтрализация репликации вируса, и эту трудоемкую процедуру можно было сократить за счет использования «пересекающихся» серий «поливалентных» пулов сывороток. Каждый пул содержит лошадиные антитела, скажем, против 10 из 68 серотипов энтеровируса человека; пулы смешивают, чтобы убедиться, что антитела к любому данному серотипу присутствуют в нескольких и отсутствуют в нескольких других, поэтому изолят можно точно идентифицировать путем тщательного изучения структуры пулов, демонстрирующих нейтрализацию инфекционности. Агрегированные вирионы могут избежать нейтрализации и, следовательно, их невозможно типировать; эту проблему можно решить путем диспергирования комков с помощью хлороформа или с помощью анализа уменьшения налета. Совсем недавно были описаны различные схемы с использованием ОТ-ПЦР с соответствующими праймерами, особенно с акцентом на область VP1 с последующим секвенированием продуктов ПЦР.
Агрегированные вирионы могут избежать нейтрализации и, следовательно, их невозможно типировать; эту проблему можно решить путем диспергирования комков с помощью хлороформа или с помощью анализа уменьшения налета. Совсем недавно были описаны различные схемы с использованием ОТ-ПЦР с соответствующими праймерами, особенно с акцентом на область VP1 с последующим секвенированием продуктов ПЦР.
Вирус Коксаки А – обзор
Энтеровирусы
Неполиомиелитные энтеровирусы представляют собой вирусы с одноцепочечной РНК, принадлежащие к семейству Picornaviridae, и включают вирусы Коксаки А и В, эховирусы и «пронумерованные» энтеровирусы.Инфицирование новорожденных вирусами Коксаки и эховирусами может быть результатом трансплацентарной передачи вируса, контакта с инфицированными выделениями во время родов и контакта между людьми после рождения. Коксакивирусная и эховирусная инфекции у новорожденных приводят к широкому спектру клинических проявлений, начиная от бессимптомной инфекции и заканчивая фатальным гепатитом, энцефалитом, миокардитом и синдромом диссеминированного внутрисосудистого свертывания крови. Наиболее частые проявления неспецифичны, включая лихорадку, раздражительность и вялость, что приводит к оценке бактериального сепсиса.У некоторых младенцев появляется макулопапулезная сыпь. Хотя энтеровирусные инфекции, как правило, возникают чаще всего зимой и осенью, у новорожденных наблюдается меньшая сезонность. 90 В анамнезе часто имеется недавнее заболевание матери или другое заболевание, связанное с тесным контактом. 91
Наиболее частые проявления неспецифичны, включая лихорадку, раздражительность и вялость, что приводит к оценке бактериального сепсиса.У некоторых младенцев появляется макулопапулезная сыпь. Хотя энтеровирусные инфекции, как правило, возникают чаще всего зимой и осенью, у новорожденных наблюдается меньшая сезонность. 90 В анамнезе часто имеется недавнее заболевание матери или другое заболевание, связанное с тесным контактом. 91
Вирусы, связанные с тяжелым гепатитом, часто с некрозом печени, включают эховирус 6, энтеровирус 71 и вирусы Коксаки B1-4. 92-94 У лиц, перенесших вирусный гепатит Коксаки В1, может развиться кальцификация печени.
Образцы, обеспечивающие наивысший результат для вирусной культуры, представляют собой мазки или жидкости, полученные из дыхательных путей или желудочно-кишечного тракта или из спинномозговой жидкости. Диагноз также может быть поставлен путем обнаружения энтеровирусной РНК с помощью ПЦР с обратной транскриптазой.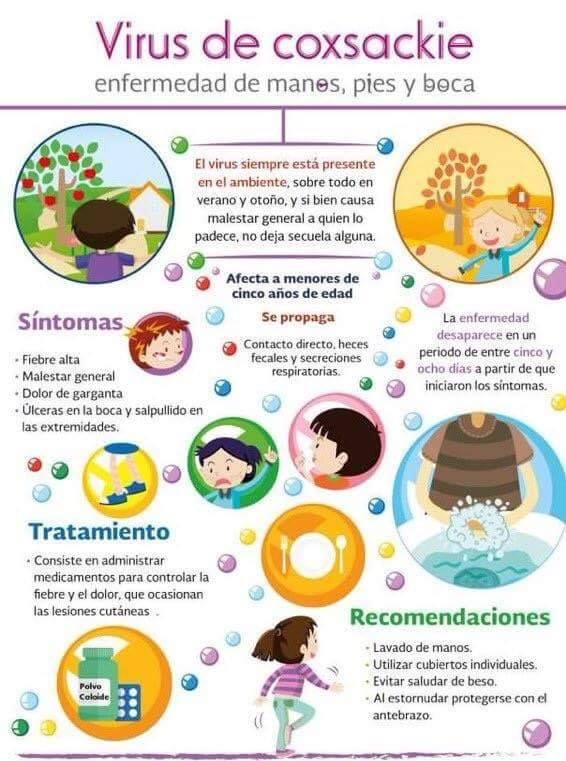 Серологическое тестирование имеет ограниченную ценность из-за низкой чувствительности, возникающей из-за отсутствия общего антигена у многих антигенно различных энтеровирусов. 95
Серологическое тестирование имеет ограниченную ценность из-за низкой чувствительности, возникающей из-за отсутствия общего антигена у многих антигенно различных энтеровирусов. 95
Лечение преимущественно поддерживающее. Плеконарил является наиболее многообещающим противовирусным средством 96 и в настоящее время проходит оценку в многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании.Внутривенный иммуноглобулин (IVIg) использовался как для постконтактной профилактики, так и для лечения, но убедительных доказательств эффективности не существует. Сообщается, что у новорожденных с тяжелым гепатитом смертность составляет от 24 до 31% в больших сериях и до 71%, если миокардит также очевиден. 92,97 Большинство выживших не имеют остаточной печеночной недостаточности.
Генетическая характеристика вируса Коксаки А9, вызывающего асептический менингит, в Альберте, Канада, 2010 г. | Virology Journal
«>Pallansch M, Roos R: Энтеровирусы: полиовирусы, вирусы Коксаки, эховирусы и новые энтеровирусы. В поле Вирусология . 5-е издание. Под редакцией: Knipe DM, Howley PM. Филадельфия, Пенсильвания: Липпинкотт Уильямс Уилкинс; 2011: 839-894.
Google Scholar
Cui A, Yu D, Zhu Z, Meng L, Li H, Liu J, Liu G, Mao N, Xu W: Вспышка асептического менингита, вызванного вирусом Коксаки A9, в Ганьсу, Китайская Народная Республика. Virol J 2010, 7: 72. 10.1186/1743-422X-7-72
PubMed ПабМед Центральный Статья Google Scholar
Solomon T, Lewthwaite P, Perera D, Cardosa MJ, McMinn P, Ooi MH: Вирусология, эпидемиология, патогенез и борьба с энтеровирусом 71. Ланцет Infect Dis 2010, 10: 778-790. 10.1016/S1473-3099(10)70194-8
PubMed Статья Google Scholar
Стэнвей Г., Браун Ф., Кристиан П.: Пикорнавирусы. В Вирус Таксономия-классификация и номенклатура вирусов. 8-й отчет Международного комитета по таксономии вирусов . Под редакцией: Fauquet CM, Mayo MA, Maniloff J. Amsterdam, Нидерланды: Elsevier Academic Press; 2005: 757-778.
Google Scholar
Центры по контролю и профилактике заболеваний: Кластеры острых респираторных заболеваний, связанных с энтеровирусом человека 68 — Азия, Европа и США, 2008–2010 гг. MMWR Morb Mortal Wkly Rep 2011, 60: 1301-1304.
Google Scholar
Tavares FN, Campos RM, Burlandy FM, Fontella R, de Melo MM, da Costa EV, da Silva EE: Молекулярная характеристика и филогенетическое исследование вируса Коксаки A24v, вызывающего вспышки острого геморрагического конъюнктивита (AHC) в Бразилии. PLoS One 2011, 6: e23206. 10.1371/journal.pone.0023206
10.1371/journal.pone.0023206
PubMed КАС ПабМед Центральный Статья Google Scholar
Tsai HP, Huang SW, Wu FL, Kuo PH, Wang SM, Liu CC, Su IJ, Wang JR: Вспышка асептического менингита, связанная с эховирусом 18, на Тайване: эпидемиология, диагностические и генетические аспекты. J Med Microbiol 2011, 60: 1360-1365.10.1099/jmm.0.027698-0
PubMed Статья Google Scholar
Перевосчиковс Ю., Брила А., Фирстова Л., Комарова Т., Лученко И., Осмяна Ю., Саврасова Л., Сингарёва И., Стороженко Ю., Волоскука Н., Замятина Н.: Продолжающаяся вспышка асептического менингита в Юго-Восточной Латвии, июнь — август 2010 г. Euro Surveill 2010, 15 (32):9-11.
Google Scholar
Savolainen-Kopra C, Paananen A, Blomqvist S, Klemola P, Simonen ML, Lappalainen M, Vuorinen T, Kuusi M, Lemey P, Roivainen M: Крупной вспышке эховируса 30 в Финляндии предшествовала скрытая циркуляция тот же генотип. Вирусные гены 2011, 42: 28-36. 10.1007/s11262-010-0536-x
Вирусные гены 2011, 42: 28-36. 10.1007/s11262-010-0536-x
PubMed КАС Статья Google Scholar
Wu PC, Huang LM, Kao CL, Fan TY, Cheng AL, Chang LY: Вспышка инфекции вирусом Коксаки A16: сравнение с другими энтеровирусами в дошкольном учреждении в Тайбэе. J Microbiol Immunol Infect 2010, 43: 271-277. 10.1016/S1684-1182(10)60043-6
PubMed Статья Google Scholar
Минор П., Браун Ф., Доминго Э.: Таксономия вирусов.Классификация и номенклатура вирусов. Шестой отчет Международного комитета по таксономии вирусов . Под редакцией: Мерфи Ф.А., Фоке К.М., Бишоп Д.Х.Л. Вена, Австрия: Springer-Verlag; 1995:329-336.
Google Scholar
Caro V, Guillot S, Delpeyroux F, Crainic R: Молекулярная стратегия «серотипирования» энтеровирусов человека.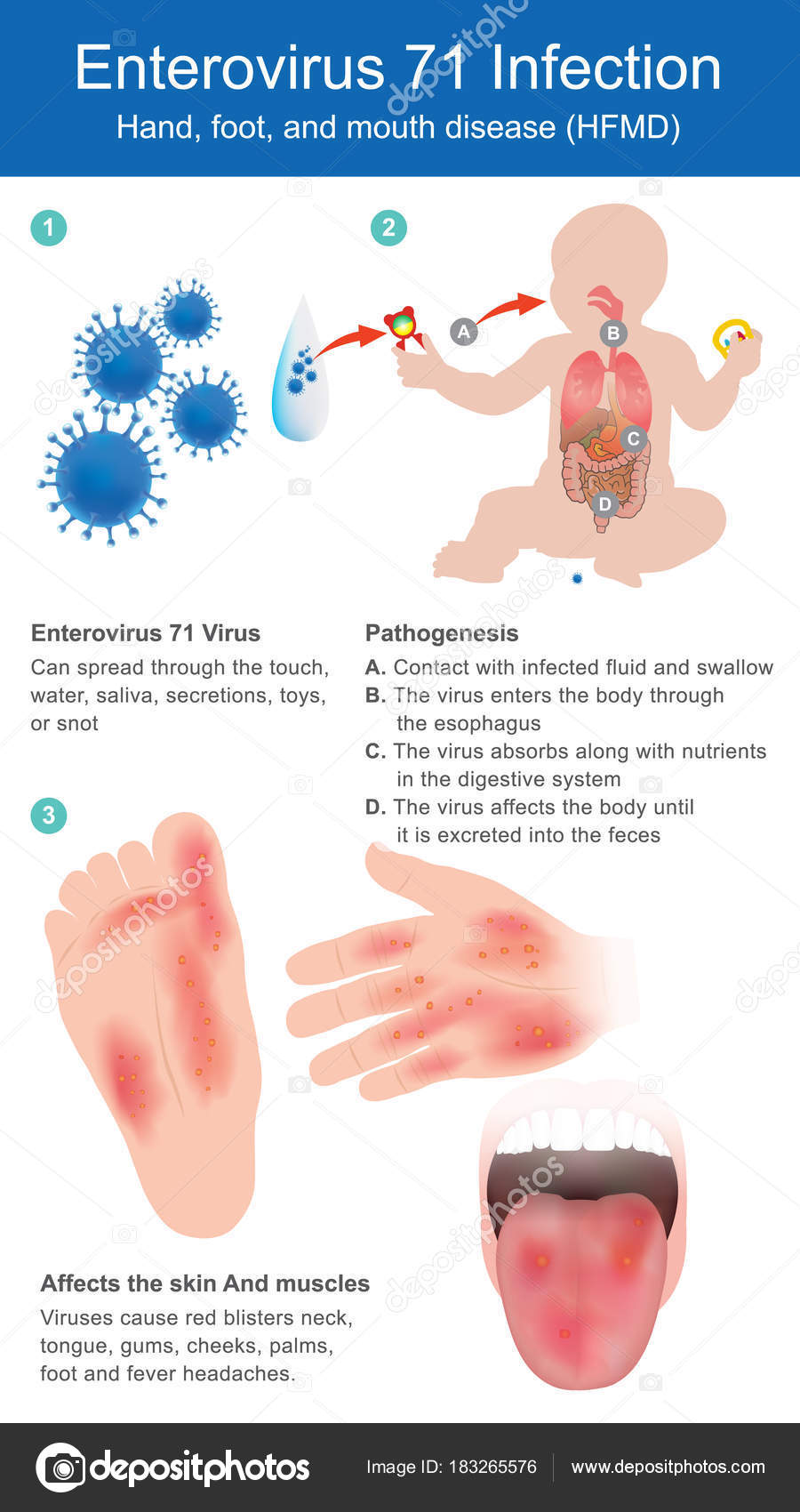 J Gen Virol 2001, 82: 79-91.
J Gen Virol 2001, 82: 79-91.
ПабМед КАС Статья Google Scholar
Norder H, Bjerregaard L, Magnius LO: Гомотипические эховирусы имеют сходную аминотерминальную последовательность VP1, подходящую для типирования. J Med Virol 2001, 63: 35-44. 10.1002/1096-9071(200101)63:1<35::AID-JMV1005>3.0.CO;2-Q
PubMed КАС Статья Google Scholar
Оберсте М.С., Махер К., Килпатрик Д.Р., Флемистер М.Р., Браун Б.А., Палланш М.А.: Типирование энтеровирусов человека путем частичного секвенирования VP1. J Clin Microbiol 1999, 37: 1288-1293.
ПабМед КАС ПабМед Центральный Google Scholar
Насри Д., Буслама Л., Пиллет С., Бурле Т., Ауни М., Поццетто Б.: Основное обоснование, современные методы и будущие направления молекулярного типирования энтеровируса человека. Expert Rev Mol Diagn 2007, 7: 419-434. 10.1586/14737159.7.4.419
Expert Rev Mol Diagn 2007, 7: 419-434. 10.1586/14737159.7.4.419
ПабМед КАС Статья Google Scholar
Oberste MS, Maher K, Pallansch MA: Молекулярная филогения всех серотипов энтеровирусов человека на основе сравнения последовательностей на 5’-конце области, кодирующей VP2. Virus Res 1998, 58: 35-43. 10.1016/S0168-1702(98)00101-4
PubMed КАС Статья Google Scholar
Ишико Х., Шимада Ю., Йонаха М., Хасимото О., Хаяши А., Сакае К., Такеда Н.: Молекулярная диагностика энтеровирусов человека с помощью филогенетической классификации с использованием последовательности VP4. J Infect Dis 2002, 185: 744-754. 10.1086/339298
ПабМед КАС Статья Google Scholar
King AMQ, Brown F, Christian P, Hovi T, Hyypia T, Knowles NJ, Lemon SM, Minor PD, Palmenberg AC, Skern T: Picornaviridae. В таксономии вирусов . Седьмой отчет Международного комитета по таксономии вирусов . Под редакцией: ван Регенмортель MHV, Fauquet CM, Bishop DHL.Нью-Йорк-Сан-Диего, США: Academic Press; 2000:657-673.
Google Scholar
Oberste MS, Michele SM, Maher K, Schnurr D, Cisterna D, Junttila N, Uddin M, Chomel JJ, Lau CS, Ridha W, al-Busaidy S, Norder H, Magnius LO, Pallansch MA: Molecular идентификация и характеристика двух предложенных новых серотипов энтеровирусов, EV74 и EV75. J Gen Virol 2004, 85: 3205-3212. 10.1099/vir.0.80148-0
PubMed КАС Статья Google Scholar
Oberste MS, Maher K, Nix WA, Michele SM, Uddin M, Schnurr D, al-Busaidy S, Akoua-Koffi C, Pallansch MA: Молекулярная идентификация 13 новых типов энтеровирусов, EV79-88, EV97, и EV100-101, представители вида энтеровируса человека B. Virus Res 2007, 128: 34-42. 10.1016/j.virusres.2007.04.001
Virus Res 2007, 128: 34-42. 10.1016/j.virusres.2007.04.001
PubMed КАС Статья Google Scholar
Лукашев А.Н.: Роль рекомбинации в эволюции энтеровирусов. Rev Med Virol 2005, 15: 157-167. 10.1002/rmv.457
PubMed КАС Статья Google Scholar
Лукашев А.Н., Лашкевич В.А., Иванова О.Е., Королева Г.А., Хинкканен А.Е., Илонен Дж.: Рекомбинация в циркулирующем энтеровирусе человека В: независимая эволюция структурных и неструктурных участков генома. J Gen Virol 2005, 86: 3281-3290. 10.1099/vir.0.81264-0
PubMed КАС Статья Google Scholar
Доминго Э., Мартин В., Пералес С., Эскармис С.: Вирусы Коксаки и теория квазивидов: эволюция энтеровирусов. Curr Top Microbiol Immunol 2008, 323: 3-32. 10.1007/978-3-540-75546-3_1
Curr Top Microbiol Immunol 2008, 323: 3-32. 10.1007/978-3-540-75546-3_1
ПабМед КАС Google Scholar
Racaniello VR: Picornaviridae: вирусы и их репликация. В поле Вирусология . 5-е издание. Под редакцией: Knipe DM, Howley PM. Филадельфия, Пенсильвания: Липпинкотт Уильямс Уилкинс; 2011: 795-838.
Google Scholar
Служба здравоохранения Альберты. Рост заболеваемости энтеровирусами, вызывающими асептический менингит, этой весной и летом . http://www.albertahealthservices.ca/2350.asp
Chang KH, Auvinen P, Hyypia T, Stanway G: Нуклеотидная последовательность вируса Коксаки A9; последствия для связывания рецепторов и классификации энтеровирусов. J Gen Virol 1989, 70 (Pt 12):3269-3280.
ПабМед КАС Статья Google Scholar
Лукашев А.Н., Лашкевич В.А., Иванова О.Е., Королева Г.А., Хинкканен А.Е., Илонен Дж.: Рекомбинация в циркулирующих энтеровирусах. Дж Вирол 2003, 77: 10423-10431. 10.1128/ОВИ.77.19.10423-10431.2003
ПабМед КАС ПабМед Центральный Статья Google Scholar
Perera D, Shimizu H, Yoshida H, Tu PV, Ishiko H, McMinn PC, Cardosa MJ: Сравнение областей VP1, VP2 и VP4 для молекулярного типирования энтеровирусов человека. J Med Virol 2010, 82: 649-657. 10.1002/jmv.21652
PubMed КАС Статья Google Scholar
Kubo H, Iritani N, Seto Y: Молекулярная классификация энтеровирусов, не идентифицированных тестами на нейтрализацию. Emerg Infect Dis 2002, 8: 298-304. 10.3201/eid0803.010200
PubMed КАС ПабМед Центральный Статья Google Scholar
Al-Hello H, Paananen A, Eskelinen M, Ylipaasto P, Hovi T, Salmela K, Lukashev AN, Bobegamage S, Roivainen M: Штамм энтеровируса, выделенный от ребенка с диабетом, принадлежит к генетическому подкластеру эховируса 11, но также нейтрализуется монотипическими антисыворотками к вирусу Коксаки А9. J Gen Virol 2008, 89: 1949-1959. 10.1099/vir.0.83474-0
PubMed КАС Статья Google Scholar
Abzug MJ: Представление, диагностика и лечение энтеровирусных инфекций у новорожденных. Педиатрические препараты 2004, 6: 1-10. 10.2165/00148581-200406010-00001
ПабМед Статья Google Scholar
Romero JR: Энтеровирусы. В Клиническая вирусология . 3-е издание. Под редакцией: Richman DD, Whitley RJ, Hayden FG. Вашингтон: ASM Press; 2009.
Google Scholar
Anderson RM, May RM: Infectious Diseases of Humans . Великобритания: Оксфордские научные публикации; 1991.
Google Scholar
Santti J, Harvala H, Kinnunen L, Hyypia T: Молекулярная эпидемиология и эволюция вируса Коксаки A9. J Gen Virol 2000, 81: 1361-1372.
ПабМед КАС Статья Google Scholar
Fox JD, Han S, Samuelson A, Zhang Y, Neale ML, Westmoreland D: Разработка и оценка амплификации на основе последовательности нуклеиновых кислот (NASBA) для диагностики энтеровирусных инфекций с использованием базового набора NucliSens. J Clin Virol 2002, 24: 117-130. 10.1016/S1386-6532(01)00241-4
PubMed КАС Статья Google Scholar
Coiras MT, Aguilar JC, Garcia ML, Casas I, Perez-Brena P: Одновременное обнаружение четырнадцати респираторных вирусов в клинических образцах с помощью двух множественных анализов гнездовой ПЦР с обратной транскрипцией. J Med Virol 2004, 72: 484-495. 10.1002/jmv.20008
J Med Virol 2004, 72: 484-495. 10.1002/jmv.20008
PubMed КАС Статья Google Scholar
Martino TA, Tellier R, Petric M, Irwin DM, Afshar A, Liu PP: Полная консенсусная последовательность вируса Коксаки B6 и создание инфекционных клонов с помощью длинной RT-PCR. Virus Res 1999, 64: 77-86. 10.1016/S0168-1702(99)00081-7
PubMed КАС Статья Google Scholar
Van de PY, De WR: Построение деревьев эволюционных расстояний с помощью TREECON для окон: учет различий в частоте замен нуклеотидов между сайтами. Comput Appl Biosci 1997, 13: 227-230.
Google Scholar
Lole KS, Bollinger RC, Paranjape RS, Gadkari D, Kulkarni SS, Novak NG, Ingersoll R, Sheppard HW, Ray SC: Полноразмерные геномы вируса иммунодефицита человека типа 1 от сероконвертеров, инфицированных субтипом C, в Индии, с признаками межсубтиповой рекомбинации. J Virol 1999, 73: 152-160.
J Virol 1999, 73: 152-160.
ПабМед КАС ПабМед Центральный Google Scholar
Отличительные признаки
Род выделен на основе генетических признаков.
Вирион
Морфология
Расшифрованы кристаллические структуры многих энтеровирусов ( Энтеровирус А : Коксакивирус А7, Коксаки А16, энтеровирус А71; Энтеровирус В : Коксаки А9, Коксаки В3, эховирус 1, эховирус 7, эховирус 11, эховирус 12, везикулярная болезнь свиней вирус 1; энтеровирус C : полиовирус 1, полиовирус 2, полиовирус 3, вирус Коксаки A21, вирус Коксаки A24; энтеровирус D : энтеровирус D68; энтеровирус E : энтеровирус E1; риновирус E1; риновирус A16; риновирус B : риновирус B14; риновирус C : риновирус C15).БО 1В, 1С и 1D энтеровирусов и риновирусов человека являются одними из самых крупных в семействе (длина цепи VP1-3, 238–302 а. о.), и это отражается в типично длинных петлях между β-тяжами, больше чем средняя толщина стенки капсида (46 Å) и сильно выраженный рельеф поверхности по сравнению с большинством других пикорнавирусов. Возвышенность на 5-кратной оси окружает бороздка глубиной 25 Å, или «каньон», в которую связывается клеточный рецептор полиовируса. Место связывания карманного фактора находится под дном этого каньона внутри одномерного β-ствола.Вирионы могут быть преобразованы с помощью различных обработок (мягкое нагревание, связывание с рецептором или некоторые нейтрализующие антитела) в измененные («А») частицы 135S, в которых отсутствует 1А (VP4) и которые обладают измененной антигенностью.
о.), и это отражается в типично длинных петлях между β-тяжами, больше чем средняя толщина стенки капсида (46 Å) и сильно выраженный рельеф поверхности по сравнению с большинством других пикорнавирусов. Возвышенность на 5-кратной оси окружает бороздка глубиной 25 Å, или «каньон», в которую связывается клеточный рецептор полиовируса. Место связывания карманного фактора находится под дном этого каньона внутри одномерного β-ствола.Вирионы могут быть преобразованы с помощью различных обработок (мягкое нагревание, связывание с рецептором или некоторые нейтрализующие антитела) в измененные («А») частицы 135S, в которых отсутствует 1А (VP4) и которые обладают измененной антигенностью.
Физико-химические и физические свойства
Кислотная стабильность варьируется. Вирионы большинства энтеровирусов стабильны при рН 3,0, тогда как вирионы риновирусов нестабильны при рН ниже 5–6. Точно так же плавучая плотность в CsCl вирионов энтеровирусов составляет 1,30–1,34 г см -3 , тогда как плотность риновирусов колеблется от 1. 38 до 1,42 г см -3 . Иногда у энтеровирусов можно наблюдать небольшую долю (около 1% популяции) тяжелых частиц (плотность: 1,43 г см -3 ). В вирусных препаратах часто наблюдаются пустые капсиды.
38 до 1,42 г см -3 . Иногда у энтеровирусов можно наблюдать небольшую долю (около 1% популяции) тяжелых частиц (плотность: 1,43 г см -3 ). В вирусных препаратах часто наблюдаются пустые капсиды.
Нуклеиновая кислота
Геном (Kitamura et al., 1981, Racaniello and Baltimore, 1981, van der Werf et al., 1981): c. 7 100–7 450 нт (5′-UTR: 610–822 нт; ORF: 6 417–6 645 нт; 3′-UTR: 37–99 нт). Геном содержит IRES типа I и не содержит поли(С)-тракта. cre находится в 2C (представители Enterovirus A , Enterovirus B , Enterovirus C и Enterovirus D ) или 2A (представители Rhinovirus A 0 0 0 0 9 Rhino ) или 1D ) или 1B (члены Enterovirus C ). Идентичность последовательностей для различных энтеровирусов или между энтеровирусами и риновирусами составляет более 50% по всему геному, хотя она может быть больше или меньше для отдельных областей генома.5′-UTR риновирусов человека короче (около 650 нуклеотидов), чем у энтеровирусов, из-за делеции примерно 100 нуклеотидов между IRES и сайтом начала трансляции. Некоторые члены Enterovirus C и Enterovirus D также имеют меньшие делеции в этой области. Члены Enterovirus E и Enterovirus F имеют несовершенную дупликацию первых ~ 100 нуклеотидов, позволяющую сформировать вторую структуру РНК, похожую на лист клевера. Члены энтеровируса G имеют вставку длиной около 30 нуклеотидов примерно в 65 нуклеотидах от 5′-конца генома, что приводит к более длинной стебель-петле D в структуре листа клевера.Делеции разного размера в одной и той же области наблюдались у некоторых энтеровирусов человека. Для EV-7 и других энтеровирусов была предложена открытая рамка считывания выше по течению (uORF), кодирующая дополнительный полипептид из 67 аминокислот, названный UP (Lulla et al., 2019).
Некоторые члены Enterovirus C и Enterovirus D также имеют меньшие делеции в этой области. Члены Enterovirus E и Enterovirus F имеют несовершенную дупликацию первых ~ 100 нуклеотидов, позволяющую сформировать вторую структуру РНК, похожую на лист клевера. Члены энтеровируса G имеют вставку длиной около 30 нуклеотидов примерно в 65 нуклеотидах от 5′-конца генома, что приводит к более длинной стебель-петле D в структуре листа клевера.Делеции разного размера в одной и той же области наблюдались у некоторых энтеровирусов человека. Для EV-7 и других энтеровирусов была предложена открытая рамка считывания выше по течению (uORF), кодирующая дополнительный полипептид из 67 аминокислот, названный UP (Lulla et al., 2019).
Организация генома и репликация
Структура генома:
VPg+5′-UTR IRES-I -[1A-1B-1C-1D/2A1 pro (/2A2 pro )-2B-2C1 hel (-2C2 pro )/3A- 3B-3C-3D]-3’UTR-поли(А)
Выведенный полипротеин энтеровирусов колеблется от 2,138 до 2,214 аминокислот. Геномы не кодируют белок L. Белок 2A обладает протеиназной активностью с остатком цистеина в активном центре (2A pro ), который относится к семейству малых бактериальных сериновых протеаз, расщепляет полипротеин на его собственном N-конце. Члены энтеровируса K имеют второй 2A pro с остатком серина в активном центре. Различные штаммы Enterovirus G имеют область, кодирующую цистеиновую протеазу, подобную свиному торовирусу, вставленную между областями гена 2C и 3A.Определенные гидрофобные молекулы, которые связываются с капсидом, конкурируя с карманным фактором, оказывают сильное противовирусное действие, препятствуя связыванию рецептора и/или снятию оболочки. Описаны противовирусные карманосвязывающие препараты.
Геномы не кодируют белок L. Белок 2A обладает протеиназной активностью с остатком цистеина в активном центре (2A pro ), который относится к семейству малых бактериальных сериновых протеаз, расщепляет полипротеин на его собственном N-конце. Члены энтеровируса K имеют второй 2A pro с остатком серина в активном центре. Различные штаммы Enterovirus G имеют область, кодирующую цистеиновую протеазу, подобную свиному торовирусу, вставленную между областями гена 2C и 3A.Определенные гидрофобные молекулы, которые связываются с капсидом, конкурируя с карманным фактором, оказывают сильное противовирусное действие, препятствуя связыванию рецептора и/или снятию оболочки. Описаны противовирусные карманосвязывающие препараты.
Биология
Вирусы размножаются главным образом в желудочно-кишечном тракте или верхних дыхательных путях, а иногда и в тех и других, но они также могут размножаться в других тканях, например, в нервах, мышцах и т.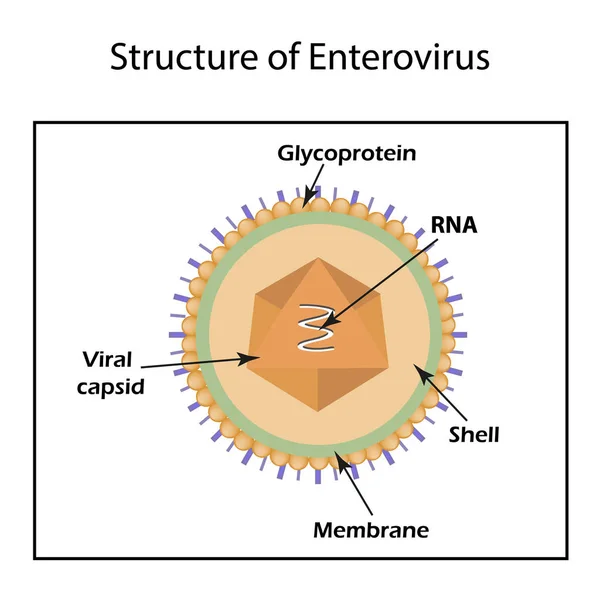 д. Инфекция часто может протекать бессимптомно. Клинические проявления включают простуду, легкий менингит, энцефалит, миелит, миокардит и конъюнктивит.Вирус везикулярной болезни свиней является вариантом вируса Коксаки В5 и вызывает везикулярную болезнь у свиней, клинически неотличимую от ящура (род Aphthovirus ), и везикулярную болезнь у свиней, вызываемую вирусом долины Сенека (род Senecavirus ). Cap-зависимая трансляция мРНК хозяина ингибируется 2A pro , который расщепляет эукариотический фактор инициации хозяина 4G (eIF-4G). Многие различные молекулы клеточной поверхности, многие из которых не охарактеризованы, служат вирусными рецепторами.Хорошо охарактеризованные взаимодействия рецептор/вирус включают рецептор полиовируса (PVR)/полиовирусы, рецептор коксаки-аденовируса (CAR)/вирусы Коксаки B, молекулу межклеточной адгезии 1 (ICAM-1)/риновирусы «основной группы» и некоторые представители Энтеровирус C видов, рецептор липопротеинов низкой плотности (LDLR) / риновирусы «незначительной группы», фактор ускорения распада (DAF) / различные энтеровирусы, интегрин VLA-2 / эховирус 1 и сиаловая кислота / энтеровирус D70.
д. Инфекция часто может протекать бессимптомно. Клинические проявления включают простуду, легкий менингит, энцефалит, миелит, миокардит и конъюнктивит.Вирус везикулярной болезни свиней является вариантом вируса Коксаки В5 и вызывает везикулярную болезнь у свиней, клинически неотличимую от ящура (род Aphthovirus ), и везикулярную болезнь у свиней, вызываемую вирусом долины Сенека (род Senecavirus ). Cap-зависимая трансляция мРНК хозяина ингибируется 2A pro , который расщепляет эукариотический фактор инициации хозяина 4G (eIF-4G). Многие различные молекулы клеточной поверхности, многие из которых не охарактеризованы, служат вирусными рецепторами.Хорошо охарактеризованные взаимодействия рецептор/вирус включают рецептор полиовируса (PVR)/полиовирусы, рецептор коксаки-аденовируса (CAR)/вирусы Коксаки B, молекулу межклеточной адгезии 1 (ICAM-1)/риновирусы «основной группы» и некоторые представители Энтеровирус C видов, рецептор липопротеинов низкой плотности (LDLR) / риновирусы «незначительной группы», фактор ускорения распада (DAF) / различные энтеровирусы, интегрин VLA-2 / эховирус 1 и сиаловая кислота / энтеровирус D70. Полиовирус типа 2, относящийся к виду Enterovirus C , как полагают, был искоренен благодаря вмешательству человека из циркуляции в человеческом населении.
Полиовирус типа 2, относящийся к виду Enterovirus C , как полагают, был искоренен благодаря вмешательству человека из циркуляции в человеческом населении.
Антигенность
Приблизительно 75 серотипов энтеровирусов и 100 серотипов риновирусов были классифицированы посредством нейтрализации инфекционности.
Происхождение имен
Энтеровирус : от греческого entero n , «кишка»
Критерии демаркации видов
Представители вида рода Энтеровирусы :
- расходятся менее чем на 30% по последовательности аа полипротеина
- расходятся менее чем на 40% в последовательности P1 aa
- расходятся менее чем на 30% по последовательности неструктурных белков 2C + 3CD
- имеют общую организацию генома
Дивергенция (количество различий на сайт между последовательностями) между представителями разных видов Enterovirus колеблется от 0.29–0,59 для P1 и 0,1–0,48 для 3CD.
Более 300 типов вирусов были охарактеризованы генетически с помощью филогенетической кластеризации (Oberste et al., 1999, Palmenberg et al., 2009, Simmonds et al., 2010, McIntyre et al., 2013). Энтеровирус A : 25 типов, Энтеровирус B : 63 типа, Энтеровирус C : 23 типа, Энтеровирус D : 5 типов, Энтеровирус E : 5 типов, Энтеровирус F : 900 G : 22 типа, Энтеровирус H : 1 тип, Энтеровирус I : 1 тип, Энтеровирус J : 6 типов, Энтеровирус K : 2 типа, Энтеровирус L : 1 тип, 9007 Rhinovirus : 1 тип, : 80 типов, Rhinovirus B : 32 типа, Rhinovirus C : 57 типов.Недавно были опубликованы рекомендации по номенклатуре энтеровирусов (Simmonds et al., 2020).
Виды-члены
Образцовый изолят вида
| Вид | Название вируса | Изолят | Номер доступа | Номер RefSeq | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| энтеровирус | Коксаки А2 | Флитвуд (Делавэр / 47) | AY421760 | NC_038306 | полный геном | CVA2 | ||||||||||||||||||||
| энтеровирус | Коксаки А3 | Olson (Нью-Йорк / 48) | AY421761 | Полный геном | CVA3 | |||||||||||||||||||||
| энтеровирус | Коксаки A4 | High Point (Северная Каролина / 50) | AY421762 | Полный геном | CVA4 | |||||||||||||||||||||
| энтеровирус | Коксаки A5 | Сварц (Нью-Йорк / 50) | AY421763 | Полный геном | CVA5 | |||||||||||||||||||||
| энтеровирус | Коксаки A6 | Гдула | AY421764 | полный геном | CVA6 | |||||||||||||||||||||
| энтеровирус | Коксаки А7 | Паркер | AY421765 | полный геном | CVA7 | |||||||||||||||||||||
| энтеровирус | Коксаки A8 | Донован ( Нью-Йорк / 49) | AY421766 | Полный геном | CVA8 | |||||||||||||||||||||
| энтеровирус | Коксаки А10 | Kowalik (Нью-Йорк / 50) | AY421767 | Полный геном | CVA10 | |||||||||||||||||||||
| энтеровирус | Коксаки А12 | Техас 12 (Техас / 48) | AY421768 | полный геном | CVA12 | |||||||||||||||||||||
| энтеровирус | Коксаки А14 | G-14 (Южная Африка/50) | AY421769 906 90 | полный геном | CVA14 | |||||||||||||||||||||
| энтеровирус A | Коксаки А16 | G-10 (Южная Африка / 51) | U05876 | полный геном | CVA16 | |||||||||||||||||||||
| энтеровирус | энтеровирус А71 | BrCr | U22521 | полный геном | EV-A71 | |||||||||||||||||||||
| энтеровирус | энтеровирус А76 | FRA91-10369 AY697458 | полный геном | EV-A76 | ||||||||||||||||||||||
| энтеровирус | энтеровирус A89 | BAN00-10359 AY697459 | полный геном | EV-A89 | ||||||||||||||||||||||
| энтеровирус | энтеровирус А90 | BAN99 -10399 | AY697460 | Полный генератор Оме | EV-А90 | |||||||||||||||||||||
| энтеровирус | энтеровирус A91 | BAN00-10406 AY697461 | полный геном | EV-A91 | ||||||||||||||||||||||
| энтеровирус | энтеровирус А92 | USA / GA99 / RJG-7 | EF667344 | полный геном | EV-А92 | |||||||||||||||||||||
| энтеровирус | энтеровирус A114 | V13-0285 / IND / 2013 | KU355876 | Полный геном | EV-A114 | |||||||||||||||||||||
| энтеровирус | энтеровирус A119 | HU / 09C13CMR (Камерун) | KC787153 | Частичное геном | EV-A119 | |||||||||||||||||||||
| энтеровирус | энтеровирус A120 | MAD-2741-11 (Мадагаскар) | LK021688 | Компл.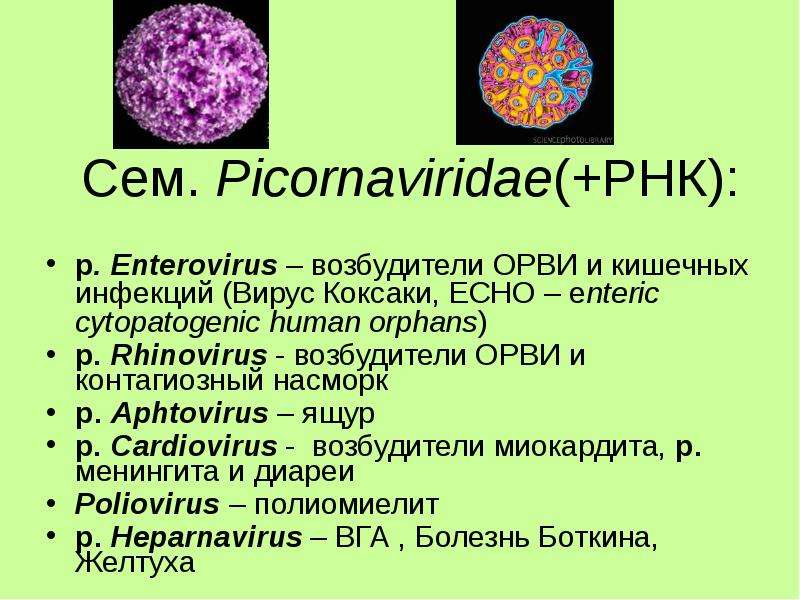 ете генома ете генома | EV-А120 | |||||||||||||||||||||
| энтеровирус | энтеровирус A121 | V13-0682 / IND / 2013 | KU355877 | полный геном | EV-A121 | |||||||||||||||||||||
| энтеровирус | энтеровирус А122; Simian Virus 19 | M19S | 8 M19S | AF326754 | полный генома | EV-A122 | ||||||||||||||||||||
| Enterovirus A123; Simian Virus 43 | OM112T | AF326761 | AF326761 | полный геном | EV-A123 | |||||||||||||||||||||
| 9 8 Enterovirus A | Enterovirus A124; Simian Virus 46 | OM22 | AF326764 | AF326764 | полный геном | EV-A124 | ||||||||||||||||||||
| Enterovirus A | Enterovirus A125; бабуина энтеровирус А13 | А13 | AF326750 | полный геном | EV-A125 | |||||||||||||||||||||
| энтеровирус Б | Коксаки В3 | Нанси (Коннектикут / США / 49) | M88483 | NC_038307 | полный геном | CVB3 | ||||||||||||||||||||
| энтеровирус Б | Коксаки В1 | Япония | M16560 | полный геном | CVB1 | |||||||||||||||||||||
| энтеровирус Б | Коксаки В2 | Огайо -1 (Огайо / США / 47) | AF081485 | полный генома | CVB2 | 0 | Coxsackievirus B4 | JVB (Нью-Йорк / US / 51) (Benschoten) | x05690 | Полный геном | CVB4 | |||||||||||||||
| En terovirus Б | Коксаки В5 | Фолкнер (Кентукки / США / 52) | AF114383 | полный геном | CVB5 | |||||||||||||||||||||
| энтеровирус Б | Коксаки В6 | Шмитта (Филиппины / 53) ( 1-15-21) | AF039205 | полный геном | ||||||||||||||||||||||
| энтеровирус Б | Коксаки А9 | Григс D00627 | полный геном | CVA9 | ||||||||||||||||||||||
| Enterovirus B | Echovirus 1 | Farouk (Египет / 51) | AF029859 | 9888E1 | E1 | |||||||||||||||||||||
| Enterovirus B | Echovirus 1; ЕСНО-вирус 8 | Брайсон (Огайо) | AF250874 | Частичный геном | Е1 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 2 | Корнелис (Коннектикут / США / 51) | AY302545 | полный геном | Е2 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 3 | Моррись (Коннектикут / США / 51) | AY302553 | полный геном | E3 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 4 | Pesacek (Коннектикут / США / 51) | AY302557 | полный геном | Е4 | |||||||||||||||||||||
| энтеровирус B | ЕСНО-вирус 5 | Нойс (Мэн / 54) | AF083069 | полный геном | E5 | |||||||||||||||||||||
| Энтеровирус B | эховирус 6 90 690 | D’Амори (Род-Айленд / 55) | AY302558 | полный геном | ||||||||||||||||||||||
| энтеровирус B | 7 ЕСНО-вирус | Уоллес (Огайо) | AY302559 | полный геном | Е7 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 9 | Хилл (Огайо / США / 53) | X84981 | полный геном | Е9 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 11 | Грегори (Огайо) | X80059 | полный геном | Е11 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 12 | Трэвис (Филиппины / 53) | X79047 | полный геном | Е12 | |||||||||||||||||||||
| Энтеровирус B | эховирус 13 | Del Carmen (Филиппины с / 53) | AY302539 | полный геном | Е13 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 14 | буксировочный (Род-Айленд / 54) | AY302540 | полный геном | Е14 | |||||||||||||||||||||
| Enterovirus B | 8 | CH 96-51 (Charleston) (Западная Вирджиния / 51) | AY302541 | E15 | Enterovirus B | Echovirus 16 | Харрингтона (штат Массачусетс / 51) | AY302542 | полный геном | Е16 | ||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 17 | CHHE-29 (Мехико) | AY302543 | полный геном | E17 | |||||||||||||||||||||
| Энтеровирус B | эховирус 18 | Меткаф (Огайо) | AF317694 | полный геном | Е18 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 19 | Берк (Огайо) | AY302544 | полный геном | Е19 | |||||||||||||||||||||
| Enterovirus b | Echovirus 20 | JV-1 (Вашингтон DC / 55) | AY302546 | |||||||||||||||||||||||
| Enterovirus B | Echovirus 21 | Farina (E26D) Массачусетс / 50) | AY302547 | полный геном | Е21 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 24 | DeCamp (Огайо / 56) | AY302548 | полный геном | Е24 | |||||||||||||||||||||
| Энтеровирус B | эховирус 25 | JV-4 (Вашингтон DC / 57) | AY302549 | E25 | E25 | 0 | «> | Echovirus 26 | Coronel (11-3-6) (Филиппины / 53) | AY302550 | геном | |||||||||||||||
| энтеровируса B | 27 | ЕСНО-вирусBacon (1-36-4) (Филиппины / 53) | AY302551 | полный геном | ||||||||||||||||||||||
| энтеровируса B | Echovirus 29 | JV-10 (Вашингтон DC / 55) | AY302552 | E29 | E29 | |||||||||||||||||||||
| Echovirus 30 | Bastianni (Нью-Йорк / 58) | AF162711 | Полный геном | E30 | ||||||||||||||||||||||
| Энтеровирус B | эховирус 31 0 8 Колдуэлл (Канзас / 55) | AY302554 | полный геном | Е31 | ||||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 32 | ПР-10 (Puerto Rico) | AY302555 | полный геном | E32 | |||||||||||||||||||||
| энтеровирус Б | ЕСНО-вирус 33 | Толука-3 (Мексика / 59) | AY302556 | полный геном | Е33 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус В69 | Толука-1 (Мексика / 59) | AY302560 | полный геном | EV-В69 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус В73 | CA55-1988 | AF241359 | полный геном | Е. В. -B73 В. -B73 | |||||||||||||||||||||
| Энтеровирус B | энтеровирус B74 | USA/CA75-1 0213 | AY556057 | полный геном | EV-B74 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B75 | США / OK85-10362 | AY556070 | полный геном | EV-B75 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B77 | CF496-99 AJ4 | полный геном | EV-B77 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус B78 | Агиуса-W137-126 / 99 | AY208120 | Частичное геном | EV-B78 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B79 | США / CA79-10384 | AY843297 | полный геном | EV-B79 | |||||||||||||||||||||
| Энтеровирус B | Энтеровирус B80 | USA/CA67-10387 | A Y843298 | полный геном | EV-В80 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B81 | США / CA68-10389 | AY843299 | полный геном | EV-B81 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B82 | США / CA64-10390 | AY843300 | полный геном | EV-B82 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B83 | США / CA76-10392 | AY843301 | полный геном | EV-B83 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B84 | CIV2003-10603 DQ 2 | полный геном | EV-B84 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус B85 | BAN00-10353 | AY843303 | 9070 9полный геном | EV-B85 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B86 | BAN00-10354 AY843304 | полный геном | EV-B86 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус В87 | BAN00-10396 AY843305 | полный геном | EV-В87 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус B88 | BAN01-10398 AY843306 | полный геном | Е. В. -B88 В. -B88 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус B93 | 38-03 (ДР Конго) | KM273013 | Частичное геном | EV-B93 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B97 | BAN99-10355 | AY843307 | Полный геном 9 0690 | EV-B97 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B98 | T92-1499 AB426608 | полный геном | EV-B98 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус В100 | BAN2000-10500 DQ 3 | полный геном | EV-B100 | ||||||||||||||||||||||
| энтеровирус Б | энтеровирус В101 | CIV03-10361 AY843308 | полный геном | EV-В101 | ||||||||||||||||||||||
| Enterovirus B | Enterovirus B106 | 148 / yn / ЧН / 12 (China / 2012) | KF9 «> | EV-B106 | EV-B106 | Enterovirus B | Enterovirus B107 | TN94-0349 | AB426609 | Полный геном | EV-B107 | |||||||||||||||
| Энтеровирус B | энтеровирус B110 | LM1861 (шимпанзе/Камерун/2006) | JF416928; JF416931; JF416934; JF416937 Все | Частичное геном | EV-B110 | |||||||||||||||||||||
| энтеровирус B | энтеровирус B111 | Q0011 / XZ / CHN / 2000 | KF312882 | Полный геном | EV-B111 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус В112 | GAB130 (шимпанзе / Габон) | KJ418244 | полный геном | EV-В112 | |||||||||||||||||||||
| энтеровирус Б | энтеровирус B113 | GAB653 ( мандрил/Габон) | KJ701249 | Полный геном | EV-B113 | |||||||||||||||||||||
| Энтеровирус B | B165 (верветка) | AF326751 | полный геном | EV-В114 | ||||||||||||||||||||||
| энтеровирус С | полиовируса 1 | Махони | V01149 | NC_002058 | Полное геном | PV1 | ||||||||||||||||||||
| энтеровирус С | полиовируса 1 | Sabin (LSC-2ab) | V01150 | полный геном | PV1 | |||||||||||||||||||||
| энтеровирус С | полиовируса 2 | Лансинг (Мичиган / 37) | M12197 | полный геном | ||||||||||||||||||||||
| энтеровирус С | полиовируса 2 | Сэйбин (P712- Ч-2ab) | X00595 | полный геном | PV2 | |||||||||||||||||||||
| Энтеровирус С | поли Овирь 3 | Леон (Калифорния / 37) | K01392 | Полный генома | P-3 | Poliovirus 3 | Sabin (Леон 12А-1-B) | x00925 | Полный геном | PV3 | ||||||||||||||||
| Энтеровирус C | Коксакивирус A1 | T. Т. Т. | полный геном | CVA-11 | ||||||||||||||||||||||
| энтеровирус С | Коксаки А13 | Флорес (Мексика / 52) | AF499637 | полный геном | CVA-13 | |||||||||||||||||||||
| энтеровирус C | вирус Коксаки A13; Coxsackievivirus a18 | G-13 (Южная Африка / 50) | AF499640 | CVA-13 | CVA-13 | CoxSackievivirus A17 | G12 (Южная Африка / 51 | AF499639 | Полный генома | CVA-17 | 0 | Coxsackievivirus A1 | NIH-8663 (Dohi) (Япония / 52) | AF499641 | Complete Genome | CVA-19 | ||||||||||
| энтеровирус C | Коксаки А20 | IH-35 (Нью-Йорк / 55) | AF499642 | Полный геном | CVA-20 | |||||||||||||||||||||
| энтеровирус C | Коксаки А21 | Kuykendall (Калифорния/52) | AF546702 | Полный геном | CVA-21 | |||||||||||||||||||||
| 9068 8 энтеровирус C | Коксаки А22 | Чульман (Нью-Йорк / 55) | AF499643 | Полный геном | CVA-22 | |||||||||||||||||||||
| энтеровирус C | Коксаки А24 | Джозеф | EF026081 | Полный геном | CVA-24 | |||||||||||||||||||||
| энтеровирус C | энтеровирус C95 | T08-083 / Чад / 2008 | JX417822 | Частичное геном | EV-C95 | |||||||||||||||||||||
| энтеровирус С | энтеровирус С96 | BAN00-10499 | EF015886 | полный геном | EV-С96 | |||||||||||||||||||||
| энтеровирус С | энтеровирус С99 | США-GA84-10636 | EF555644 | Полный геном | EV-C99 | |||||||||||||||||||||
| En terovirus С | энтеровирус С102 | BAN99-10424 | EF555645 | полный геном | EV-С102 | |||||||||||||||||||||
| энтеровирус С | энтеровирус С104 | CL-1231094 FL | EU840733 | Частичное геном | EV-C104 | |||||||||||||||||||||
| энтеровирус C | энтеровирус C105 | PER153 (Перу / 2010) | JX3 | Полный геном | EV-C105 | |||||||||||||||||||||
| энтеровирус C | энтеровирус C109 | NICA08-4327 GQ865517 | полный геном | EV-C109 | ||||||||||||||||||||||
| энтеровирус С | энтеровирус C113 | BBD-48 / Бангладеш / 2009 | KC344833 | Полный геном | EV-C113 | |||||||||||||||||||||
| Ent erovirus C | энтеровирус C116 | 126 / Россия / 2010 | JX514942 | Полный геном | EV-C116 | |||||||||||||||||||||
| энтеровирус C | энтеровирус C117 | LIT22 / Вильнюс (Литва / 2011) | JX262382 | Полный геном | EV-C117 | |||||||||||||||||||||
| энтеровирус C | энтеровирус C118 | ISR10 (Израиль / 2011) | JX | 8 | Полный геном | EV-C118 | ||||||||||||||||||||
| + | D энтеровирус | энтеровирус D68 | Фермон AY426531 | NC_038308 полный геном | EV-D68 | |||||||||||||||||||||
| D энтеровирус | энтеровирус D68; человек риновирус 87 | F02-3607 хлебных | AY355268 | Частичное геном | EV-D68 | |||||||||||||||||||||
| D энтеровируса | энтеровирус D70 | J670 / 71 (Япония / 71) | D00820 | полный геном | EV-D70 | |||||||||||||||||||||
| энтеровирус D | энтеровирус D94 | Е210 (Египет) | DQ | 6 | полный геном | EV-D94 | ||||||||||||||||||||
| энтеровирус D | энтеровирус D111 | KK2640 (шимпанзе/Камерун/2006) | JF416929; JF416932; JF416935; JF416938 Все | Частичный геном | EV-D111 | |||||||||||||||||||||
| энтеровирус D | энтеровирус D120 | MB6201 (горилл / Камерун) | KF040080 | Частичное геном | EV-D120 | |||||||||||||||||||||
| Энтеровирус Е | Энтеровирус Е1; крупного рогатого скота энтеровирус 1 | ВГ-5-27 | D00214 NC_001859 | полный геном | EV-E1 | |||||||||||||||||||||
| энтеровирус Е | энтеровирус Е2 | PS42 (АТСС VR-758) | DQ0 | Полный геном | EV-E2 | |||||||||||||||||||||
0 | Enterovirus E | D | D | D 14/3/96 (Германия / 1996) | dq0 | EV-E3 | ||||||||||||||||||||
| Энтеровирус E | энтеровирус E4 | PAK-NIH-21E5 (сточные воды/Карачи/2009) | JQ6; JQ6 | Все | Частичный геном | EV-Е4 | ||||||||||||||||||||
| энтеровирус Е | энтеровирус Е5 | MexKSU / 5 (Мексика / 2015) | KU172420 | полный геном | EV-Е5 | |||||||||||||||||||||
| Энтеровирус F | энтеровирус F1; бычьей энтеровирус 2 | Бев-261-M2-RM2 | DQ0 | |||||||||||||||||||||||
| NC_021220 | полный геном | EV-F1 | ||||||||||||||||||||||||
| энтеровирус F | энтеровирус F2 | PS89 | DQ0 | Полное геном | EV-F2 | |||||||||||||||||||||
| энтеровирус F | энтеровирус F3 | PS87 / Белфаст (АТСС VR-774) | DQ0 | полный геном | EV-F3 | |||||||||||||||||||||
| энтеровирус F | Enterovirus F4 | W1 (Briteail Tashum / Новая Зеландия) | AY462106 | EV-F4 | 8 «> | Enterovirus F5 | M80 (Норфолк / Англия / 1960) | Нет записей в Генбанке | EV-F5 | |||||||||||||||||
| Энтеровирус F 9 0049 | 8 | T11F (Великобритания / 1960) | 9078 EV-F6 | 0 | 8 | 8 | Enterovirus F7 | AN12 / BOS Taurus / JPN / 2014 | LC038188 | Полный геном | EV-F7 | |||||||||||||||
| Энтеровирус G | Entero; Porcine Enterovirus 9 | UKG / 410/73 | AF363453 | NC_004441 | EV-G1 | EV-G1 | 0 | Enterovirus G | Enterovirus G2; Раньше Энтеровирус 10 | LP54 (Англия / 75) | AF363455 | EV-G2 | ||||||||||||||
0 | Enterovirus G3 | SW / K23 / 2008 / Hun | HQ702854 | 8 Полный генома | EV-G3 | |||||||||||||||||||||
| Enterovirus G4 | Enterovirus G4 | дикий кабан / WBD / 2019 / Hun | JN807387 | EV-G4 | ||||||||||||||||||||||
| 9 Enterovirus G | Enterovirus G5 | Ovine / TB4-OEV / 2009 / HUN | JQ277724 | EV-G5 | ||||||||||||||||||||||
| Enterovirus G6 | SW / 2009 /KOR | JQ818253 | Полный геном | EV-G6 | ||||||||||||||||||||||
| Энтеровирус G | Enterovirus G7 | Ovine / 990 / UK-NI | MG | 6 | MG | 6 | 0 | EV-G7 | EV-G7 | 0 | 8 | Enterovirus G8 | SW / 714418 / Caolanh_VN / 2012-02-21 | KT265911 | полный геном | EV-G8 | ||||||||||
| энтеровирус G | энтеровирус G9 | 734087 / ThanBinh_VN / 2012-03-20 | KT265961 | полный геном | EV-G9 | |||||||||||||||||||||
| энтеровирус G | энтеровирус G10 | SW / PoEnV-БЕЛ-12R021 | KP982873 | полный геном | EV-G10 | |||||||||||||||||||||
| энтеровирус G | энтеровирус G11 | sw/744257/2012/Вьетнам | KJ156451 | Частичный геном | EV-G11 | |||||||||||||||||||||
| Энтеровир US G | Enterovirus G12 | SW / 714222 / Caolanh / VN / 2012-02-16 | KT265900 | EV-G12 | ||||||||||||||||||||||
| Enterovirus G | Enterovirus G13 | SW / 714270 / Caolanh / Vn / 2012-02-16 | KT265903 | EV-G13 | Enterovirus G | Enterovirus G14 | SW / 714405 / Caolanh / VN / 2012 -02-21 | KT265909 | Partial Genome | EV-G14 | 0 | Enterovirus G15 | SW / 724307 / Caolanh / VN / 2012-03-14 | KT265941 | Частичный генома | EV-G15|||||||||||
| Enterovirus G | Enterovirus G16 | дикий кабан / BS14-17H3 / DAKLAK_VN / 2014 | KT266010 | Частичный генома 90 690 | EV-G16 | |||||||||||||||||||||
| энтеровирус G | энтеровирус G17 | SW / 08 / NC_USA / 2015 | KY761948 | полный геном | EV-G17 | |||||||||||||||||||||
| энтеровирус G | Enterovirus G18 | SW / GER / F26-2 / 23-12-2013 9069 / 23-12-2013 9069 / 23-12-2013 | EV-G18 | 0 | Enterovirus G | Enterovirus G19 | SW / GER / F8-2 / 04-02-2013 | MF113372 | MF113372 | EV-G19 | «> | Enterovirus G20 | GOOT / JL14 / CHA / 2019 | KU297674 | Полный геном | EV-G20 | ||||||||||
| Энтеровирус H | энтеровирус h2; Simian Enterovirus | 1715 UWB | AF326759 | NC_038309 | EV-H | EV-H | ||||||||||||||||||||
| Enterovirus I | Enterovirus I1; Dromedary Camel Enterovirus 1 | 19CC | KP345887 | KP345887 | NC_03890 | полный генома | EV-I1 | |||||||||||||||||||
| Enterovirus I | Enterovirus I2; верблюд верблюд энтеровирус 2 | 20CC KP345888 | полный геном | EV-I2 | ||||||||||||||||||||||
| энтеровирус J | энтеровирус J1 | SV6-1631 | AF326766 NC_010415 | полный геном | EV-J1 | |||||||||||||||||||||
| энтеровирус J | энтеровирус J103 | USA / GA99-пу-1 | FJ007373 | полный геном | EV-J103 | |||||||||||||||||||||
| энтеровирус J | энтеровирус J108 | N125 | AF414372 | полный геном | EV-J108 | |||||||||||||||||||||
| энтеровирус J | энтеровирус J112 | BAN / 2008/17920 | JX537981 | Частичный геном | Е. В. -J112 В. -J112 | |||||||||||||||||||||
| Энтеровирус J | 9 0688 Enterovirus j115Ban / 2008/711221 | JX537991 | EV-J115 | EV-J115 | Enterovirus j121 | CPZ_CHE20 | KF541639; KF648606 Все | Частичное геном | EV-J121 | |||||||||||||||||
| энтеровирус K | энтеровирус K1 | Грызун / Ee / PicoV / NX2015 | KX156158 | NC_038989 | Полный кодирования генома | EV-K1 | ||||||||||||||||||||
| энтеровируса К | энтеровирус К2 | Грызун / MC / PicoV / Tibet2015 | KX156159 | Полный кодирования генома | EV-К2 | |||||||||||||||||||||
| энтеровирус л | энтеровирус L1 | Macaca мулатка / SEV-GX / 2014 / Китай | KU587555 | NC_029905 | Полный геном | EV-L1 | ||||||||||||||||||||
| риновирусная | риновирусы A1 | VR -1559 | FJ445111 | NC_038311 | Полный геном | RV-A1 | ||||||||||||||||||||
| Риновирусная | риновирусы A1B | B632 | D00239 | Полный геном | RV-A1B | |||||||||||||||||||||
| Риновирусная | риновирусы A2 | ПГП | X02316 | Полный геном | RV-A2 | |||||||||||||||||||||
| Риновирусных | риновирусы A7 | 68CV11 | DQ473503 | Полный геном | RV-A7 | |||||||||||||||||||||
| Риновирусных | риновирусов A8 | MRH-CV12 | FJ445113 | полный геном | RV-A8 | |||||||||||||||||||||
| риновирус | риновирус А9 | 211-CV13-АТСС VR489 | FJ445177 | полный геном | RV- A9 | |||||||||||||||||||||
| Риновирус А | риновирус А10 | 204-CV14 | DQ473498 | полный геном | РВ-А10 | |||||||||||||||||||||
| риновирус | риновирус A11 | 1-CV15 | EF173414 | полный геном | RV- A11 | |||||||||||||||||||||
| Риновирусная | риновирусы A12 | 181-CV16 | EF173415 | Полный геном | RV-A12 | |||||||||||||||||||||
| Риновирусная | риновирусы A13 | 353 (Юг Каролина / 59) | FJ445116 | полный геном | РВ-А13 | |||||||||||||||||||||
| риновирус | риновирус A15 | 1734 (Южная Каролина / 60) | DQ473493 | полный геном | Р. В. -A15 В. -A15 | |||||||||||||||||||||
| Риновирус A | риновирус A16 | 9068 8 11757 (Washington DC / 60)L24917 | Полный геном | RV-A16 | ||||||||||||||||||||||
| Риновирусная | риновирусы A18 | 5986-CV17 | FJ445118 | Полный геном | Р.В. -A18 | |||||||||||||||||||||
| риновирус | риновирус А19 | АТСС VR- | тысяча сто двадцать девять FJ445119 | полный геном | RV-А19 | |||||||||||||||||||||
| риновирус | риновирус А20 | ATCC VR-1130 | FJ445120 | полный геном | RV-А20 | |||||||||||||||||||||
| риновирус | риновирус А21 | АТСС VR-тысячу сто тридцать-один | FJ445121 | полный геном | РВ-А21 | |||||||||||||||||||||
| Риновирус A | риновирус A22 | ATCC VR-1132 | FJ445122 | Полный геном | RV-A22 | |||||||||||||||||||||
| Риновирусная | риновирусы A23 | 5124-CV24 | DQ473497 | Полный геном | RV-A23 | |||||||||||||||||||||
| Риновирусная | риновирус A24 | 5146-CV25 | EF173416 | полный геном | RV-А24 | |||||||||||||||||||||
| риновирус | риновирус А25 | АТСС VR-1135 | FJ445123 | полный геном | RV-A25 | |||||||||||||||||||||
| Риновирусная | риновирусы A28 | 6101-CV29 | DQ473508 | Полный геном | RV-A28 | |||||||||||||||||||||
| Риновирусная | риновирусы A29 | ATCC VR-1139 | FJ445125 | Полный геном | RV-А29 | |||||||||||||||||||||
| риновирус | риновирус A30 | 106F | DQ473512 | полный геном | RV-А30 | |||||||||||||||||||||
| риновирус | риновирус А31 | ATCC VR-506 | FJ445126 | полный геном | RV-А31 | |||||||||||||||||||||
| риновирус | риновирус А32 | АТСС VR-1142 | FJ445127 | полный геном | РВ-А32 | |||||||||||||||||||||
| риновирус А | риновирус А33 | АТСС VR-330 | FJ445128 | полный геном | RV-А33 | |||||||||||||||||||||
| риновирус | риновирус A34 | 137-3 DQ473501 | Полный геном | RV-A34 | ||||||||||||||||||||||
| 906 88 Риновирусная A | риновирусов A36 | 342H | DQ473505 | Полный геном | RV-A36 | |||||||||||||||||||||
| Риновирусная | риновирусы A38 | CH79 | DQ473495 | Полный геном | RV-А38 | |||||||||||||||||||||
| риновирус | риновирус A39 | 209 (Мэриленд / 62) | AY751783 | полный геном | РВ-А39 | |||||||||||||||||||||
| риновирус | риновирус A40 | АТСС VR-341 | FJ445129 | Полный геном | RV-A40 | |||||||||||||||||||||
| риновирусная | риновирусы A41 | 56110 (Северная Каролина / 61) | DQ473491 | Полный геном | RV-A41 | |||||||||||||||||||||
| Риновирус А 9069 0 | риновирус А43 | АТСС VR-1153 | FJ445131 | полный геном | RV-С43 | |||||||||||||||||||||
| риновирус | риновирус А45 | АТСС VR-1155 | FJ445132 | полный геном | RV-А45 | |||||||||||||||||||||
| риновирус | риновирус A46 | Crell (Baylor 2) (Техас / 64) | DQ473506 | полный геном | РВ-А46 | |||||||||||||||||||||
| риновирус A | риновирус А47 | АТСС VR-1157 | FJ445133 | полный геном | RV-А47 | |||||||||||||||||||||
| риновирус | риновирусов А49 | 8213 | DQ473496 | полный геном | RV-A49 | |||||||||||||||||||||
| Риновирус А | Риновирус А50 9069 0 | АТСС VR-517 | FJ445135 | полный геном | RV-А50 | |||||||||||||||||||||
| риновирус | риновирус А51 | АТСС VR- | тысяча сто шестьдесят-один FJ445136 | полный геном | RV- А51 | |||||||||||||||||||||
| риновирус | риновирус A53 | F01-3928 DQ473507 | полный геном | RV-A53 | ||||||||||||||||||||||
| риновирус | риновирус А54 | АТСС VR- 1165 | FJ445138 | полный геном | РВ-А54 | |||||||||||||||||||||
| риновирус | риновирус А55 | Wis315E (Висконсин / 64) | DQ473511 | полный геном | РВ-А55 | |||||||||||||||||||||
| Риновирус A | риновирус A56 | CH82 [V-151-011-021] полный геном1-ВСР 57 | FJ445141 | полный геном | RV-А57 | |||||||||||||||||||||
| риновирус | риновирус А58 | АТСС VR-+1168 | FJ445142 | полный геном | РВ-А58 | |||||||||||||||||||||
| риновирус | риновирус A59 | 611-CV 35 | DQ473500 | полный геном | RV-А59 | |||||||||||||||||||||
| риновирус | риновирус A60 | АТСС VR-1473 | FJ445143 | полный геном | РВ-А60 | |||||||||||||||||||||
| риновирус | риновирус А61 | АТСС VR-тысяча сто семьдесят-один | FJ445144 | полный геном | РВ-А61 | |||||||||||||||||||||
| Риновирус A | Риновирус A62 | ATCC VR-1172 | FJ445145 | 9 0709полный геном | РВ-А62 | |||||||||||||||||||||
| риновирус | риновирус А63 | АТСС VR-1173 | FJ445146 | полный геном | РВ-А63 | |||||||||||||||||||||
| риновирус | риновирус A64 | 6258-CV44 | EF173417 | полный геном | РВ-А64 | |||||||||||||||||||||
| риновирус | риновирус А65 | АТСС VR-1175 | FJ445147 | полный геном | RV-А65 | |||||||||||||||||||||
| риновирус | риновирус А66 | АТСС VR-тысяча сто семьдесят шесть | FJ445148 | полный геном | RV-А66 | |||||||||||||||||||||
| риновирус | риновирусов A67 | ATCC VR-1177 | FJ445149 | Полный геном | 906 88 RV-A67||||||||||||||||||||||
| Риновирусная | риновирусы A68 | АТСС VR-1178 | FJ445150 | Полный геном | RV-A68 | |||||||||||||||||||||
| Риновирусная | риновирусы A71 | АТСС VR-тысяча сто восемьдесят одна | FJ445152 | полный геном | RV-A71 | |||||||||||||||||||||
| риновирус | риновирус A73 | 107E | DQ473492 | полный геном | РВ-A73 | |||||||||||||||||||||
| риновирусная | риновирусов A74 | 328a | DQ473494 | Полный геном | RV-A74 | |||||||||||||||||||||
| риновирусная | риновирусы A75 | 328F | DQ473510 | Полный геном | RV-A75 | |||||||||||||||||||||
| Риновир нам | риновирусы A76 | H00062 | DQ473502 | Полный геном | RV-A76 | |||||||||||||||||||||
| Риновирусная | риновирусы A77 | АТСС VR-1187 | FJ445154 | Полный геном | RV-A77 | |||||||||||||||||||||
| риновирусная | риновирусы A78 | 2030-65 | EF173418 | Полный геном | RV-A78 | |||||||||||||||||||||
| риновирусная | риновирусов A80 | АТСС VR-1190 | FJ445156 | полный геном | RV-А80 | |||||||||||||||||||||
| риновирус | риновирус A81 | АТСС VR-1191 | FJ445157 | полный геном | РВ-A81 | |||||||||||||||||||||
| Риновирус А | Риновирус А82 | Санта Круз (Калифорния) | DQ473509 | полный геном | РВ-А82 | |||||||||||||||||||||
| риновирус | риновирус А85 | АТСС VR-+1195 | FJ445163 | полный геном | RV- А85 | |||||||||||||||||||||
| риновирус А | риновирус A88 | CVD-01-0165 Дамбраускас | DQ473504 | полный геном | RV-A88 | |||||||||||||||||||||
| риновирус | риновирус A89 | 41467-галло | M16248 | полный геном | РВ-A89 | |||||||||||||||||||||
| риновирус | риновирус А90 | АТСС VR-тысяча двести девяносто один | FJ445167 | полный геном | РВ-А90 | |||||||||||||||||||||
| Риновирус А | Риновирус А94 | SF-1803 9 0690 | EF173419 | полный геном | РВ-А94 | |||||||||||||||||||||
| риновирус | риновирус А96 | АТСС VR-1296 | FJ445171 | полный геном | РВ-А96 | |||||||||||||||||||||
| риновирусная | риновирусы A100 | АТСС VR-1300 | FJ445175 | Полный геном | RV-A100 | |||||||||||||||||||||
| риновирусная | риновирусы A101 | грн-A101 | GQ415051 | полный геном | RV-A101 | |||||||||||||||||||||
| Риновирусная | риновирусы A102 | AMS323 | EF155421 | Полный геном | RV-A102 | |||||||||||||||||||||
| Риновирусная | риновирусы A103 | WA327E/09 | JF | 5 | Полный геном | RV-A103 | ||||||||||||||||||||
| Риновирусная | риновирусы A104 | p1025_sR2625_2009 | JN562727 | Полный геном | RV-A104 | |||||||||||||||||||||
| Риновирусная | риновирусы A105 | p1064_sR985_2009 | JN614995 | Полный геном | RV-A105 | |||||||||||||||||||||
| Риновирусная | риновирусы A106 | p1044_sR114_2008 | JQ245971 | Полный геном | RV-A106 | |||||||||||||||||||||
| Риновирусная A | риновирусов A107 | S07259 KC859319 | Частичный геном | RV-A107 | ||||||||||||||||||||||
| Риновирусная | риновирусы A108 | S07696 KC859318 | Частичный геном | 906 88 RV-A108|||||||||||||||||||||||
| Риновирусная B | риновирусы B3 | февралем | DQ473485 | NC_038312 | Полный геном | RV-B3 | ||||||||||||||||||||
| Риновирусная B | риновирусы B4 | 16/60 DQ473490 | полный геном | RV-В4 | ||||||||||||||||||||||
| риновирус Б | риновирус В5 | Нормана / АТСС VR-485 | FJ445112 | полный геном | Р. В. -B5 В. -B5 | |||||||||||||||||||||
| риновирусная B | риновирусы B6 | Томпсон DQ473486 | Полный геном | RV-B6 | ||||||||||||||||||||||
| риновирусная B | риновирусы B14 | 1059 (Южная Каролина /59) | K02121 | Полный геном | RV-B14 | |||||||||||||||||||||
| риновирус Б | риновирус В17 | 33342 (Северная Каролина / 59) | EF173420 | полный геном | РВ-В17 | |||||||||||||||||||||
| риновирус Б | риновирус В26 | 5660 -CV27 / АТСС VR-1136 | FJ445124 | полный геном | RV-B26 | |||||||||||||||||||||
| риновирус Б | риновирус В27 | 5870-CV28 / АТСС VR-1 137 | FJ445186 | Полный генома | РВ-В27 | |||||||||||||||||||||
| риновирус Б | риновирус В35 | 164A | DQ473487 | полный геном | RV-B35 | |||||||||||||||||||||
| риновирус Б | риновирус В37 | 151-1 | EF173423 | Полный геном | RV-B37 | |||||||||||||||||||||
| риновирус Б | риновирус В42 | 56822 (Северная Каролина / 61) / АТСС VR-338 | FJ445130 | полный геном | RV-B42 | |||||||||||||||||||||
| риновирус Б | риновирус B48 | тысяча пятьсот пять DQ473488 | полный геном | RV-B48 | ||||||||||||||||||||||
| риновирус Б | риновирус B52 | F01-3772 / АТСС VR-1162 | FJ445188 | полный геном | Р. В. -B52 В. -B52 | |||||||||||||||||||||
| риновирус Б | риновирус В69 | F01-2513-Митчинсон / АТСС VR-1179 | FJ445151 | полный геном | РВ-В69 | |||||||||||||||||||||
| риновирус B | риновирус B70 | F02-2547-Treganza | DQ473489 | Полный геном | RV-B70 | |||||||||||||||||||||
| риновирус Б | риновирус B72 | K2207 / АТСС VR- | тысяча сто восемьдесят две FJ445153 | полный геном | RV-B72 | |||||||||||||||||||||
| риновирус Б | риновирус B79 | 101- 1 / АТСС VR-тысяча сто восемьдесят девять | FJ445155 | полный геном | RV-B79 | |||||||||||||||||||||
| риновирус Б | риновирус B83 | Байлор 7 / АТСС VR-1193 | FJ445161 | полный геном | RV-B83 | |||||||||||||||||||||
| риновирус Б | риновирус B84 | 432D / АТСС VR-1194 | FJ445162 | полный геном | RV-B84 | |||||||||||||||||||||
| риновирус B | риновирус B86 | 121564-Johnson/ATCC VR-1196 | FJ445164 | Полный геном | RV-B86 9 0690 | |||||||||||||||||||||
| риновирус Б | риновирус B91 | JM1 / АТСС VR-тысяча двести девяносто два | FJ445168 | полный геном | RV-B91 | |||||||||||||||||||||
| риновирус Б | риновирус В92 | SF -1662 / АТСС VR-1293 | FJ445169 | полный геном | RV-B92 | |||||||||||||||||||||
| риновирус Б | риновирус B93 | SF-1492 | EF173425 | полный геном | RV- B93 | |||||||||||||||||||||
| риновирус Б | риновирус B97 | SF-тысяча триста семьдесят две / АТСС VR-тысяча двести девяносто семь | FJ445172 | полный геном | RV-B97 | |||||||||||||||||||||
| риновирус Б | риновирус B99 | 604/ATCC VR-1299 | FJ445174 | Полный геном | RV-B99 | Риновирусная B | риновирусы B100 | CU211 (Таиланд / 2006) | HQ123444 | Полная кодирования генома | RV-B100 | |||||||||||||||
| Риновирусная B | риновирусы B101 | p1156_sR810_2007 | JF781500 | полный геном | RV-B101 | |||||||||||||||||||||
| риновирус Б | риновирус В102 | p1044_sR122_2007 | JX074053 | полный геном | RV-B102 | |||||||||||||||||||||
| риновирус B | риновирус В103 | p1160_sR1153_2009 | JN614996 | полный геном | РВ-В103 | |||||||||||||||||||||
| риновирус Б | риновирус В104 | F10 | FJ445137 | полный геном | RV-B104 | |||||||||||||||||||||
| риновирус С | риновирус С1 | NAT001 | EF077279 | NC_038878 | полный геном | РВ-С1 | ||||||||||||||||||||
| риновирус С | риновирус С2 | NAT045 | EF077280 | полный геном | RV-C2 | |||||||||||||||||||||
| Риновирусная С | риновирус C3 | QPM | EF186077 | полный геном | RV-C3 | |||||||||||||||||||||
| риновирус C | риновирус С4 | O24 | EF582385 | полный геном | РВ-С4 | |||||||||||||||||||||
| риновирус С | риновирус С5 | O25 | EF582386 | полный геном | РВ-С5 | |||||||||||||||||||||
| Риновирус С | rh inovirus С6 | O26 | EF582387 | полный геном | РВ-С6 | |||||||||||||||||||||
| риновирус С | риновирус C7 | NY-074 (1078) | DQ875932 | полный геном | Р. В. С7 В. С7 | |||||||||||||||||||||
| риновирус С | риновирус С8 | Н4 | GQ223227 | полный геном | РВ-С8 | |||||||||||||||||||||
| риновирус С | риновирус С9 | Н10 GQ223228 | полный геном | РВ-С9 | ||||||||||||||||||||||
| риновирус С | риновирус С10 | QCE | GQ323774 | полный геном | РВ-С10 | |||||||||||||||||||||
| риновирус С | риновирус C11 | CL-170085 | EU840952 | Co mplete генома | RV-C11 | |||||||||||||||||||||
| риновирус C | риновирус C12 | Resp_3922 / 07 | HM236958 | Частичный геном | РВ-С12 | |||||||||||||||||||||
| риновирус C | риновирус C13 | Resp_2951 / 06 | HM236908 | Частичный геном | RV-C13 | |||||||||||||||||||||
| Риновирусная C | риновирусы C14 | Resp_3090 / 06 | HM236911 | Частичное геном | RV-C14 | |||||||||||||||||||||
| риновирусная C | риновирусы C15 | W10 (США / 2007) | GU219984 | Полный геном | RV-C15 | |||||||||||||||||||||
| риновирусная C | риновирусы C16 | ID639T /TAN/2008 | KR997882 | Частичный геном | RV-C16 | |||||||||||||||||||||
| риновирус С | риновирус С17 | Resp_5145 / 07 | HM236936 | Частичный геном | РВ-С17 | |||||||||||||||||||||
| риновирус С | риновирус С18 | Resp_3631 / 07 | HM236918 | Частичный геном | РВ-С18 | |||||||||||||||||||||
| риновирус С | риновирус С19 | CL-Fnp5 | EU840728 | Частичный геном | РВ-С19 | |||||||||||||||||||||
| риновирус С | риновирус С20 | Resp_3995 / 07 | HM236923 | Частичный геном | РВ-С20 | |||||||||||||||||||||
| риновирус С | риновирус С21 | Resp_5071 / 07 | HM236903 | Частичный геном | RV-C21 | |||||||||||||||||||||
| Рейн ovirus С | риновирус С22 | 3430-MY-10 | KJ675507 | полный геном | РВ-С22 | |||||||||||||||||||||
| риновирус С | риновирус С23 | 8713-MY-10 | KJ675506 | полный геном | РВ-С23 | |||||||||||||||||||||
| риновирус С | риновирус С24 | Resp_7147 / 07 | HM236939 | Частичный геном | РВ-С24 | |||||||||||||||||||||
| риновирус С | риновирус С25 | Resp_2832 / 06 | HM236952 | Частичный геном | РВ-С25 | |||||||||||||||||||||
| риновирус С | риновирус С26 | Resp_2514 / 06 | HM236904 | Частичный геном | RV-C26 | |||||||||||||||||||||
| Риновирус C | Риновирус C2 7 | Resp_2784 / 06 | HM236906 | Частичный геном | РВ-С27 | |||||||||||||||||||||
| риновирус С | риновирус С28 | Resp_3105 / 06 | HM236954 | Частичный геном | РВ-С28 | |||||||||||||||||||||
| риновирус С | риновирус С29 | Resp_5345 / 07 | HM236949 | Частичный геном | РВ-С29 | |||||||||||||||||||||
| риновирус С | риновирус С30 | Resp_3898 / 07 | HM236968 | Частичный геном | РВ-С30 | |||||||||||||||||||||
| риновирус С | риновирус С31 | Resp_4923 / 07 | HM236964 | Частичный геном | РВ-С31 | |||||||||||||||||||||
| риновирус C | риновирус C32 | Resp_6131/07 | HM236897 | Частичный геном | РВ-С32 | |||||||||||||||||||||
| риновирус С | риновирус С33 | Resp_4917 / 07 | HM236934 | Частичный геном | РВ-С33 | |||||||||||||||||||||
| риновирус С | риновирус С34 | Mex14 / Мексика / 2014 | KM486097 | Полный кодирования генома | РВ-С34 | |||||||||||||||||||||
| риновирус С | риновирус С35 | ИНДР-метагеномной-1 | JF436925 | полный геном | РВ-С35 | |||||||||||||||||||||
| риновирус С | риновирус С36 | Resp_2480 / 07 | JF416311 | Частичный геном | РВ-С36 | |||||||||||||||||||||
| риновирус С | риновирус C37 | Resp_6135/08 | JF416321 | 907 09Частичный геном | RV-C37 | |||||||||||||||||||||
| Риновирусная C | риновирусы C38 | Resp_6142 / 08 | JF416322 | Частичный геном | RV-C38 | |||||||||||||||||||||
| Риновирусная C | риновирус С39 | WA823M02 | JN205461 | полный геном | РВ-С39 | |||||||||||||||||||||
| риновирус С | риновирус С40 | p1221_sR1448_2009 | JN815251 | полный геном | РВ-С40 | |||||||||||||||||||||
| риновирусная C | риновирусы C41 | 2536 / USA / 2000 | KF | 1 | Полный геном | RV-C41 | ||||||||||||||||||||
| риновирусная C | риновирусы C42 | 1570-my- 10 | KJ675505 | Полный геном | 9068 8 RV-С42||||||||||||||||||||||
| риновирус С | риновирус С43 | p1281_s6410_1999 | JN815249 | полный геном | РВ-С43 | |||||||||||||||||||||
| риновирус С | риновирус С44 | Resp_15588 / 09 | JF416310 | Частичный геном | RV-C44 | |||||||||||||||||||||
| Риновирусная C | риновирусы C45 | cpz1-2013 / УЗА | KY624849 | Полный геном | RV-C45 | |||||||||||||||||||||
| риновирус С | риновирус С46 | Resp_5153 / 07 | JF416318 | Частичный геном | РВ-С46 | |||||||||||||||||||||
| риновирус С | риновирус С47 | PNG7254-3947 JF519760 | Частичный геном | RV-C47 | ||||||||||||||||||||||
| Риновирусная C | риновирусы C48 | PNG7293-3193 JF519762 | Частичный геном | RV-C48 | ||||||||||||||||||||||
| Риновирусная C | риновирусы C49 | p1277_s6237_2000 JN798566 | Полный геном | RV-C49 | ||||||||||||||||||||||
| Риновирусная C | риновирусы C50 | SG1 / AUS / 2008 | KF688606 | Полный геном | RV-C50 | |||||||||||||||||||||
| Риновирусная C | риновирусы C51 | LZ508 / Китай / 2007 | JF317015 | Полный геном | RV-C51 | |||||||||||||||||||||
| Риновирусная C | риновирусы C54 | D3490 / SPA / 2009 | KP282614 | Полная геном | RV-C54 | |||||||||||||||||||||
| Риновир нас C | риновирусы C55 | ID529T / TAN / 2008 | KR997885 | Частичный геном | RV-C55 | |||||||||||||||||||||
| Риновирусная C | риновирусы C56 | JPN / Kumamoto1 / 2009 | LC004772 | Частичный геном | RV-C56 | |||||||||||||||||||||
| Риновирусная C | риновирусы С57 | 7383-MY-10 | KP8 | Полный геном имена | RV-C57 |
вирусов, выбор типовых изолятов и аббревиатуры вирусов не являются официальными обозначениями ICTV.
Некоторые вирусы, первоначально описанные как новые эховирусы, позже оказались ошибочно идентифицированными. Таким образом, эховирус 8 имеет тот же серотип, что и эховирус 1, эховирус 10 теперь является реовирусом 1, эховирус 28 теперь является риновирусом человека A1A, эховирус 22 теперь является пареховирусом человека 1, эховирус 23 теперь представляет собой пареховирус человека 2. Точно так же вирус Коксаки A23 имеет тот же серотип. как эховирус 9, и коксакивирус A15 имеет тот же серотип, что и коксакивирус A11, и коксакивирус A18 имеет тот же серотип, что и коксакивирус A13.Вирус гепатита А (род Hepatovirus ) ранее назывался энтеровирусом 72. Было обнаружено, что человеческий риновирус 87 является штаммом энтеровируса D68. Ряд обезьяньих вирусов (SV), ранее перечисленных как предварительные члены рода, были перемещены в род Sapelovirus , вид Sapelovirus B и переименованы в simian sapelovirus (SSV) 1 (ранее SV2), SSV-2 ( ранее СВ 49) и ССВ-3 (ранее СВ16, СВ-18, СВ42, СВ44 и СВ45).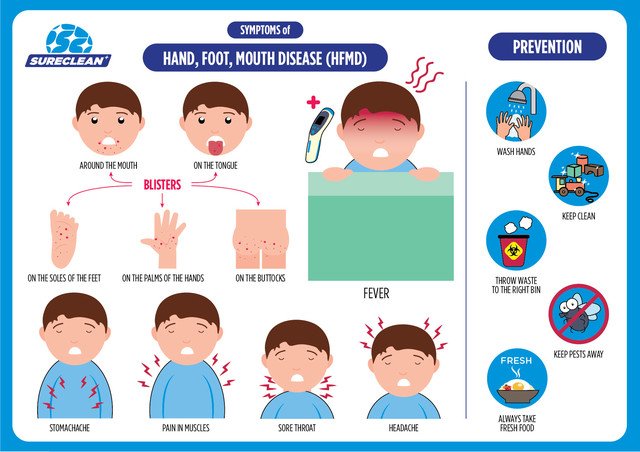 Обезьяний агент 4 (SA4), SV4, SV28 и вирус бляшек A2 были отнесены к виду Enterovirus H .Обезьяньи энтеровирусы N125 и N203 были помещены в новый тип, энтеровирус 108, который был отнесен к виду Enterovirus J вместе с энтеровирусом 103 и обезьяньим вирусом 6. Тип SV-47 остается неотнесенным к виду. Энтеровирусы свиней (PEV), принадлежащие к группе CPE I (типы 1-7 и 11-13), были перемещены в род Teschovirus , вид Teschovirus A и переименованы в teschovirus свиней (PTV) 1-10. Члены исчезнувшего вида Porcine enterovirus A (PEV тип 8; CPE группа II) были перемещены в род Sapelovirus и переименованы в Sapelovirus A (серотип свиного сапеловируса 1).Вымерший вид Энтеровирус свиней B (типы PEV 9, 10; группа CPE III) был переименован в Enterovirus G .
Обезьяний агент 4 (SA4), SV4, SV28 и вирус бляшек A2 были отнесены к виду Enterovirus H .Обезьяньи энтеровирусы N125 и N203 были помещены в новый тип, энтеровирус 108, который был отнесен к виду Enterovirus J вместе с энтеровирусом 103 и обезьяньим вирусом 6. Тип SV-47 остается неотнесенным к виду. Энтеровирусы свиней (PEV), принадлежащие к группе CPE I (типы 1-7 и 11-13), были перемещены в род Teschovirus , вид Teschovirus A и переименованы в teschovirus свиней (PTV) 1-10. Члены исчезнувшего вида Porcine enterovirus A (PEV тип 8; CPE группа II) были перемещены в род Sapelovirus и переименованы в Sapelovirus A (серотип свиного сапеловируса 1).Вымерший вид Энтеровирус свиней B (типы PEV 9, 10; группа CPE III) был переименован в Enterovirus G .
Вирус Коксаки группы B Статья
[1]
Kühl U,Pauschinger M,Noutsias M,Seeberg B,Bock T,Lassner D,Poller W,Kandolf R,Schultheiss HP, Высокая распространенность вирусных геномов и множественных вирусных инфекций в миокарде взрослых с [PubMed PMID: 15699250]
[2]
ЭНТЕРОВИРУСЫ; Комитет по энтеровирусам, Национальный фонд детского паралича. Американский журнал общественного здравоохранения и здоровья нации. 1957 декабрь; [PubMed PMID: 13487867]
Американский журнал общественного здравоохранения и здоровья нации. 1957 декабрь; [PubMed PMID: 13487867]
[3]
Адамс М.Дж., Лефковиц Э.Дж., Кинг А.М., Харрах Б., Харрисон Р.Л., Ноулз Н.Дж., Кропински А.М., Крупович М., Кун Д.Х., Мушегян А.Р., Ниберт М., Сабанадзович С., Санфасон Х., Сидделл С.Г., Симмондс П., Варсани А., Зербини FM, Горбаленя А. Е., Дэвисон А. Дж., Голосование по ратификации таксономических предложений в Международный комитет по таксономии вирусов (2016).Архив вирусологии. 2016 Октябрь; [PubMed PMID: 27424026]
[4]
Lim BK, Ju ES, Lao DH, Yun SH, Lee YJ, Kim DK, Jeon ES, Разработка системы диагностического анализа энтеровирусов для диагностики вирусного миокардита у людей. Микробиология и иммунология. апрель 2013 г. [PubMed PMID: 23586632]
[5]
Muehlenbachs A, Bhatnagar J, Zaki SR, Тканевой тропизм, патология и патогенез энтеровирусной инфекции.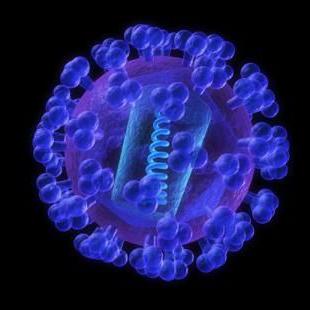 Журнал патологии. 2015 Январь [PubMed PMID: 25211036]
Журнал патологии. 2015 Январь [PubMed PMID: 25211036]
[6]
Каплан М.Х., Кляйн С.В., Макфи Дж., Харпер Р.Г., Коксакивирусные инфекции группы В у младенцев в возрасте до трех месяцев: серьезное детское заболевание. Обзоры инфекционных болезней. 1983 г., ноябрь-декабрь; [PubMed PMID: 6318288]
[7]
Сиофи-Ходжине А.Б., Лехтонен Дж., Нурминен Н., Лайтинен О.Х., Оикаринен С., Хухтала Х., Пакканен О., Руокоранта Т., Ханканиеми М.М., Топпари Дж., Ваха-Макиля М., Илонен Дж., Вейола Р., Книп М., Хёти Х., Инфекции, вызванные вирусом Коксаки B1, связаны с инициацией инсулинозависимого аутоиммунитета, который прогрессирует до диабета 1 типа.Диабетология. 2018 май; [PubMed PMID: 273]
[8]
Gear JH, Measroch V, Коксакивирусные инфекции новорожденных.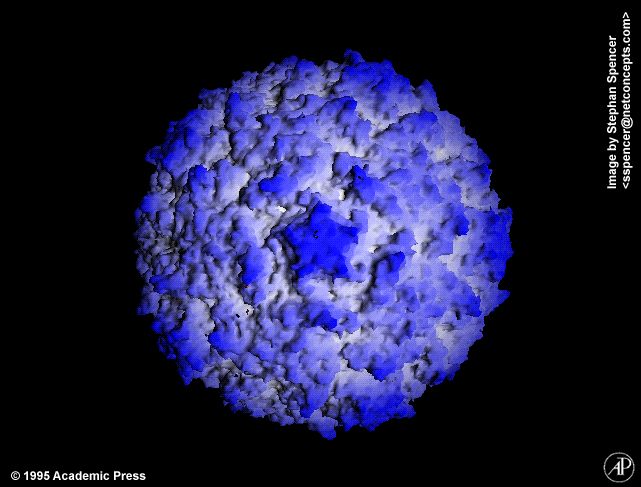 Успехи медицинской вирусологии. Fortschritte der medizinischen Virusforschung. Прогресс в медицинской вирусологии. 1973 год; [PubMed PMID: 4572439]
Успехи медицинской вирусологии. Fortschritte der medizinischen Virusforschung. Прогресс в медицинской вирусологии. 1973 год; [PubMed PMID: 4572439]
[9]
Предотвращение опасности энтеровирусов для новорожденных.Ланцет (Лондон, Англия). 1986 г., 25 января; [PubMed PMID: 2868212]
[10]
JOHNSSON T, Исследования этиологии болезни Борнхольма (эпидемическая плевродиния). II. Эпидемиологические наблюдения. Архив для gesamte Virusforschung. 12 апреля 1954 г .; [PubMed PMID: 13171858]
[11]
KIBRICK S, ТЕКУЩЕЕ СОСТОЯНИЕ ВИРУСОВ КОКСАКИ И ЭХО-ВИРУСОВ ПРИ БОЛЕЗНЯХ ЧЕЛОВЕКА.Успехи медицинской вирусологии. Fortschritte der medizinischen Virusforschung. Прогресс в медицинской вирусологии. 1964 год; [PubMed PMID: 14310575]
[13]
Wilfert CM, Lehrman SN, Katz SL, Энтеровирусы и менингит.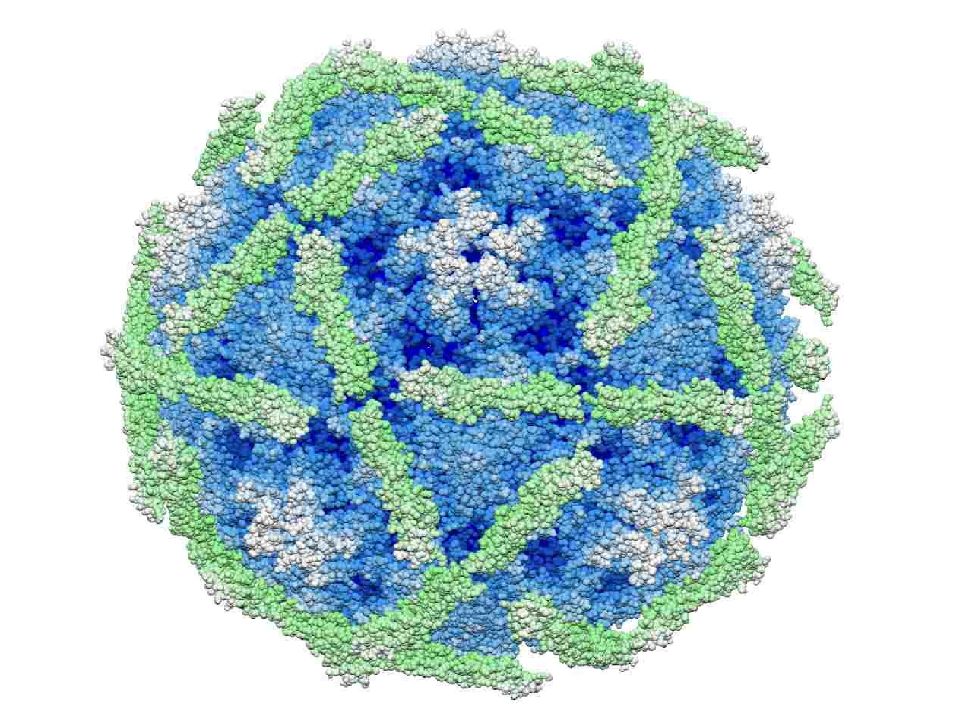 Детская инфекционная болезнь. 1983 г., июль-август; [PubMed PMID: 6310537]
Детская инфекционная болезнь. 1983 г., июль-август; [PubMed PMID: 6310537]
[14]
Rotbart HA, Brennan PJ, Fife KH, Romero JR, Griffin JA, McKinlay MA, Hayden FG, Энтеровирусный менингит у взрослых.Клинические инфекционные заболевания: официальное издание Американского общества инфекционистов. 1998 г., октябрь; [PubMed PMID: 9798053]
[15]
Esfandiarei M,McManus BM, Молекулярная биология и патогенез вирусного миокардита. Ежегодный обзор патологии. 2008 г.; [PubMed PMID: 18039131]
[17]
Selinka HC, Wolde A, Sauter M, Kandolf R, Klingel K, Взаимодействия вирус-рецептор вирусов Коксаки B и их предполагаемое влияние на кардиотропизм.Медицинская микробиология и иммунология. 2004 май; [PubMed PMID: 12
2004 май; [PubMed PMID: 12
[18]
Berger JR, Chumley W, Pittman T, Given C, Nuovo G, Персистирующий энцефалит Коксаки B: отчет о случае и обзор литературы. Журнал нейровирусологии. 2006 декабрь; [PubMed PMID: 17162666]
[19]
Ричардсон М., Эллиман Д., Магуайр Х., Симпсон Дж., Николл А. Доказательная база инкубационных периодов, периодов заразности и политики исключения для борьбы с инфекционными заболеваниями в школах и дошкольных учреждениях.Журнал детских инфекционных болезней. 2001 апрель; [PubMed PMID: 11332662]
[21]
Artenstein MS, Cadigan FC Jr, Buescher EL, Клинические и эпидемиологические особенности вирусных инфекций Коксаки группы B. Анналы внутренней медицины. 1965 г., октябрь; [PubMed PMID: 58
1965 г., октябрь; [PubMed PMID: 58
[22]
Rorabaugh ML, Berlin LE, Heldrich F, Roberts K, Rosenberg LA, Doran T, Modlin JF, Асептический менингит у младенцев в возрасте до 2 лет: острое заболевание и неврологические осложнения.Педиатрия. 1993 г., август; [PubMed PMID: 8337018]
[23]
Wilfert CM, Lauer BA, Cohen M, Costenbader ML, Myers E, Эпидемия эховирусного менингита 18. Журнал инфекционных болезней. 1975 январь; [PubMed PMID: 1167369]
[25]
Sawyer MH, Holland D, Aintablian N, Connor JD, Keyser EF, Waecker NJ Jr, Диагностика энтеровирусной инфекции центральной нервной системы с помощью полимеразной цепной реакции во время крупной общественной вспышки.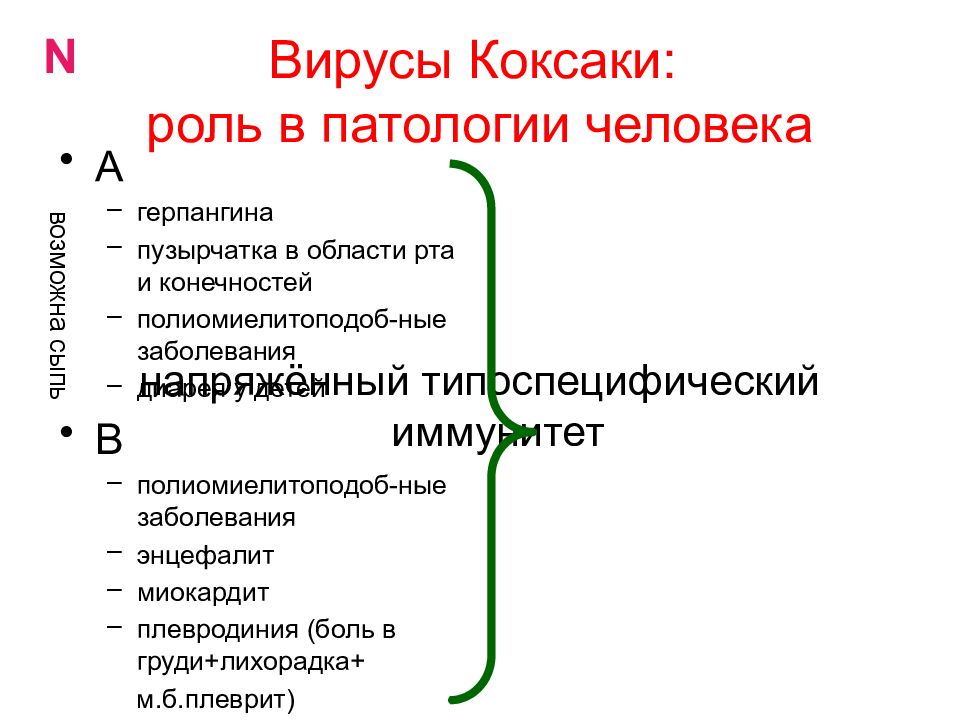 Журнал детских инфекционных болезней. 1994 март; [PubMed PMID: 8177623]
Журнал детских инфекционных болезней. 1994 март; [PubMed PMID: 8177623]
[26]
Rotbart HA, McCracken GH Jr, Whitley RJ, Modlin JF, Cascino M, Shah S, Blum D, Клиническое значение энтеровирусов при тяжелых летних лихорадочных заболеваниях у детей. Журнал детских инфекционных болезней. 1999 г., октябрь; [PubMed PMID: 10530582]
[27]
Rotbart HA, Ahmed A, Hickey S, Dagan R, McCracken GH Jr, Whitley RJ, Modlin JF, Cascino M, O’Connell JF, Menegus MA, Blum D, Диагностика энтеровирусной инфекции с помощью полимеразной цепной реакции нескольких типов образцов.Журнал детских инфекционных болезней. 1997 апрель; [PubMed PMID:45]
[28]
Rotbart HA, Sawyer MH, Fast S, Lewinski C, Murphy N, Keyser EF, Spadoro J, Kao SY, Loeffelholz M, Диагностика энтеровирусного менингита с помощью ПЦР с колориметрическим анализом обнаружения в микролунках. Журнал клинической микробиологии. 1994 г., октябрь; [PubMed PMID: 7814507]
[29]
Белл Э.Дж., Маккартни Р.А., Баскилл Д., Чаудхури А.К., ИФА с захватом мю-антител для экспресс-диагностики энтеровирусных инфекций у пациентов с асептическим менингитом.Журнал медицинской вирусологии. 1986 июль; [PubMed PMID: 3016164]
[31]
Hyöty H, Leon F, Knip M. Разработка вакцины против диабета 1 типа путем воздействия на вирус Коксаки B. Экспертный обзор вакцин. 2018 декабрь; [PubMed PMID: 30449209]
Атомная структура вируса Коксаки А10, способствующая открытию ингибитора широкого спектра действия против энтеровирусов человека , включая заполненные частицы, представляющие зрелый вирион, и NEP (дополнительный рис.С1а). В общей сложности 21 783 заполненных частицы и 43 768 частиц NEP, выбранных из 2303 изображений, были подвергнуты 3D-реконструкции с использованием программного пакета jspr
25 . Номинальное разрешение карт плотности зрелого вириона и NEP составляет 2,84 и 3,12 Å соответственно (рис. 1a–d, дополнительный рисунок S1b и дополнительная таблица S1). Локальное разрешение зрелого вириона варьируется от 2,6 Å (антипараллельное ядро β-ствола) до 3,3 Å (несколько высокодинамичных поверхностных петель, таких как GH-петля VP1 и EF-петля VP2), в то время как разрешение для NEP составляет от 2.8 и 4,0 Å, оцененные с использованием ResMap 26 (дополнительный рисунок S1c, d). Наши крио-ЭМ-карты четко показывают плотности боковых цепей большинства аминокислот, что позволяет нам строить атомные модели для каждой карты, при этом модель и карта очень хорошо совпадают (рис. 1e–h). Рис. 1: Крио-ЭМ структуры с атомарным разрешением частиц CV-A10.a , b Крио-ЭМ карты зрелого вириона CV-A10, рассматриваемые вдоль икосаэдрической пятикратной ( a ) и двукратной ( b ) осей соответственно.Цветная полоса обозначает соответствующий радиус от центра сферы (единица измерения в Å). Та же цветовая гамма была соблюдена во всем. c , d Крио-ЭМ карты CV-A10 NEP вдоль икосаэдрической пятикратной ( c ) и двукратной ( d ) осей соответственно. e , f Атомные модели зрелого вириона CV-A10 ( e ) и NEP ( f ), рассматриваемые вдоль двойной оси икосаэдра, соответственно. Модели капсидных белков VP1, VP2, VP3 и VP4 были окрашены в синий, зеленый, красный и желтый цвета соответственно.Везде использовалась одна и та же цветовая схема, если не указано иное. g , h Структурные особенности зрелого вириона CV-A10 ( g ) и NEP ( h ) с атомным разрешением, соответственно, с плотностью сегментов (сетка) в сером цвете и соответствующей атомной моделью (палочки) в цвете. Хорошо разрешенные плотности почти всех боковых цепей демонстрируют высокое разрешение крио-ЭМ-карты
Крио-ЭМ-карта зрелого вириона демонстрирует характерные для энтеровирусов особенности поверхности, в том числе «мезу» на пятикратной оси симметрии, «каньон» вокруг мезы и трехлопастный «пропеллер» на оси симметрии третьего порядка (рис.1а, б, д). В зрелом вирионе большая часть экспонированных на поверхности гидрофильных петель, включая петли BC, EF и GH VP1 и петля EF VP2, хорошо разрешается, в то время как плотность некоторых остатков (включая остатки 1, 10–17, и 297 VP1, остатки 1–10 VP2 и остатки 1–27 и 69 VP4) отсутствуют. На карте NEP некоторые открытые на поверхности петли, такие как петли GH VP1 и VP3, не разрешены; кроме того, на этой карте также отсутствуют остатки 1–96, 112–123 и 321–324 VP0, 1–72 и 297 VP1 и 176–182 VP3.
Структурное сравнение зрелого вириона и NEP
Согласно нашим картам, NEP немного расширен по сравнению со зрелым вирионом (157 против 152 Å в радиусе, расширение ~ 3%) (рис. 2a). Капсид NEP тоньше, чем у зрелого вириона (рис. 2а), вероятно, из-за расширения NEP. По сравнению со зрелым вирусом, NEP демонстрирует вращение протомерного строительного блока (VP1, VP0 и VP3) против часовой стрелки на 4,8°, вращающееся вокруг угла VP3 на икосаэдрической оси третьего порядка (рис.2b), а VP1 был отодвинут от области квазитрехкратной оси, демонстрируя сдвиг на 6 Å в сторону пятикратной оси (рис. 2b), что привело к увеличению расстояния между протомерами (рис. 2c, d). В частности, канал двойной оси заметно открыт в NEP, чем в зрелом вирионе (рис. 2c, d, обозначен пунктирными прямоугольниками на рис. 2e, f). Второй канал возникает вблизи оси квазитройного порядка в основании каньона НЭП (обозначен пунктирными кружками на рис. 2д, е). В зрелом вирионе этот канал блокируется GH-петлей VP1, фрагментом VP1, состоящим из остатков 60–70, и GH-петлей VP3 (рис.2д, е). Кроме того, на границе VP2/VP3 между соседними протомерами вблизи оси третьего порядка в NEP образуется немного более широкая канавка (обозначена пунктирными овалами на рис. 2e, f). Помимо этих значительных измененных общих свойств поверхности, площади интерфейса между капсидными белками внутри пентамеров или между пентамерами значительно уменьшены в NEP CV-A10 (дополнительная таблица S2), что свидетельствует о более динамичном характере NEP.
Рис. 2: Сравнение структуры капсида зрелого вириона CV-A10 и NEP.a Два полусреза центральной плиты толщиной 20 Å через атомные модели частицы NEP CV-A10 (слева) и зрелого вириона (справа). Черный овал и пятиугольник представляют оси двойного и пятерного порядка соответственно. Также указаны радиусы и толщина капсида для двух типов частиц. b Одна протомерная единица CV-A10 NEP (выделена серым цветом) совмещена с единицей зрелого вириона (выделена цветом). Также были отмечены вращение и трансляция от зрелого вириона к NEP.Черный овал, треугольник и пятиугольник представляют оси двойного, тройного и пятерного порядка соответственно. c , d Структурные конфигурации четырех соседних протомеров вокруг оси второго порядка для зрелого вириона CV-A10 ( c ) и NEP ( d ) соответственно. Основные различия между ними обозначены пунктирным прямоугольником. e , f Увеличенный вид икосаэдрической двойной области зрелого вириона CV-A10 ( e ) и NEP ( f ).Пунктирный прямоугольник, кружок и овал показывают расположение канала двойного порядка, второго канала вблизи оси квазитройного порядка и еще одной небольшой канавки, образованной на границе VP2/VP3 между соседними протомерами вблизи оси третьего порядка, возникающей в NEP, соответственно
Конденсированное ядро РНК, окруженное рыхлой оболочкой РНК, можно наблюдать в капсиде зрелого вириона CV-A10 с помощью низкочастотной фильтрации этой карты с разрешением 5 Å (дополнительный рисунок S2a). Были идентифицированы основные плотности, соединяющие оболочку капсида и оболочку РНК под областью тройной симметричной оси и пентамером (дополнительная рис.S2a, b), а возможными остатками, участвующими во взаимодействии капсида с РНК, могут быть Arg43 и Arg62 из VP4, Arg18 из VP1 и, в меньшей степени, Ser10 из VP2 (дополнительный рисунок S2b). Анализ электростатического потенциала внутренней поверхности пентамеров выявил преобладающую кластеризацию положительно заряженных остатков в зрелом вирионе CV-A10, включая большинство остатков, участвующих в образовании мостика с отрицательно заряженной РНК (дополнительный рисунок S2c), тогда как эти кластеризованные положительно заряженные пятна были ослаблены в NEP (дополнительный рис.S2c), предполагая, что электростатический потенциал может быть одной из движущих сил для инкапсуляции/упаковки генома РНК.
Область «каньона» зрелого вириона CV-A10
Для некоторых пикорнавирусов «каньон», вращающийся по пятикратным осям, представляет собой место, где рецепторы с иммуноглобулиноподобной складкой встраиваются в 19 . Также было показано, что область «каньона» участвует в связывании неиммуноглобулиноподобных рецепторов некоторых энтеровирусов 19,27 .Подобно другим энтеровирусам, вирион CV-A10 также имеет каньон, окружающий ось пятикратного сгиба (рис. 1a, b), который кажется более мелким и узким, чем у EV-A71, CV-A16 и полиовируса типа 1. (PV-1) (рис. 3a и дополнительный рис. S3). Вероятно, это связано с тем, что BC-петля CV-A10 VP1 на северном крае каньона движется внутрь, тогда как EF-петля VP2 и C-конец VP1 на южном крае простираются к каньону (рис. 3a).
Рис. 3: Сравнение области каньона среди CV-A10, CV-A16 и EV-A71.a Молекулярные поверхности одной асимметричной единицы плюс соседний VP1 внутри пентамера зрелого вириона CV-A10, EV-A71 (3VBF) и CV-A16 (5C4W), визуализированные снаружи капсида. Поверхность окрашена в радиальном направлении, как показано на цветовой полосе. b Модельное выравнивание одной асимметричной единицы и С-конца соседнего VP1 в пентамере зрелого вириона CV-A10 с пентамером EV-A71(3VBF) (верхняя панель) или CV-A16 (5C4W) (нижняя панель). Положение каньона обозначено пунктирной линией. c , d Увеличенное изображение основных различий в открытых участках петли, окружающих каньон, между CV-A10 и EV-A71 ( c ) или между CV-A10 и CV-A16 ( d ) . Модели EV-A71 и CV-A16 окрашены в серый цвет, а зрелый вирион CV-A10 — в цвет. Для зрелого вириона CV-A10 петля BC, петля GH и С-конец VP1, петля EF VP2 и петля GH VP3 обозначены черными стрелками. Pro 213 VP1 в CV-A10 также обозначен черной стрелкой
Открытые на поверхности петли, образующие края каньона, являются наиболее важными нейтрализующими иммуногенными сайтами энтеровирусов 28,29,30,31,32 .Несколько участков поверхностных петель вокруг каньона CV-A10 значительно отличаются от таковых у EV-A71 и CV-A16 не только по аминокислотной последовательности (дополнительный рисунок S4), но и по конформациям (рис. 3b – d). В частности, петля BC VP1 демонстрирует явно отличные конформации в CV-A10 по сравнению с таковыми в EV-A71 и CV-A16, а петля GH VP1 CV-A10 не имеет типичной малой α-спирали, как в EV-A71 и CV-A16, но образует петлю (рис. 3c, d), вероятно, из-за присутствия Pro213 в петле GH VP1 CV-A10, что могло нарушить формирование α-спирали.В меньшей степени GH-петля VP3 принимает несколько более расширенную конформацию в CV-A10, чем в EV-A71 или CV-A16 (рис. 3c, d). Кроме того, петля EF VP2 изогнута и принимает очень отчетливую конформацию в CV-A10 (рис. 3b-d). В совокупности эти петли формируют другую среду каньона в CV-A10 по сравнению с EV-A71 и CV-A10.
Карманный фактор внутри вириона CV-A10
Энтеровирусы обладают гидрофобным «карманом», расположенным под «каньоном» 9,10,19 .Он часто занят липидным «карманным фактором» клетки-хозяина, который стабилизирует вирион 9,10,19 . На нашей карте зрелого вириона CV-A10 внутри «кармана» можно четко наблюдать плотность, соответствующую карманному фактору (рис. 4а). Сопоставление доступных структур карманного фактора пикорнавирусов с соответствующей плотностью нашей крио-ЭМ карты зрелого вириона с разрешением 2,84 Å показало, что плотность карманного фактора CV-A10 имеет наибольшее сходство с плотностью EV-A71 (PDB 3VBF, рис.4b, c), соответствующей жирной кислоте с алифатической цепью примерно из 18 атомов углерода 11,33 . Фактор кармана CV-A10 имеет около 40 Å 2 поверхности, доступной для растворителя (рис. 4a), что аналогично коэффициенту EV-A71 11,12 и CV-A16 13 . Эти наблюдения согласуются с высококонсервативной первичной последовательностью, лежащей в кармане VP1 и аналогичной среде кармана VP1 среди CV-A10, EV-A71 и CV-A16 (дополнительная таблица S3 и дополнительный рисунок.S5а–с).
Рис. 4: Карманная область VP1 и идентификация карманного фактора в зрелом вирионе CV-A10.a Увеличенное изображение области кармана VP1 в зрелом вирионе CV-A10. Расположение кармана по отношению к полному протомеру CV-A10 показано на небольшой панели в правом нижнем углу. Плотность, соответствующая карманному фактору, выделена ярко-розовым цветом. Вход в карман обозначен черной стрелкой. b Гидрофобный карман (голубая сетка) в VP1 зрелого вириона CV-A10 занят естественным липидом (ярко-розовый). c Подгонка предполагаемых структур карманных факторов из семи известных структур энтеровирусов (CV-A16: 5C4W, CV-B3: 1COV, EV-A71: 3VBF, EV-D68: 4WM8, HRV-16: 1AYN, HRV-2: 1FPN и PV-1: 1VBD) в соответствующую плотность на крио-ЭМ карте зрелого вириона CV-A10. d Увеличенный вид области кармана VP1 в CV-A10 NEP. Был адаптирован тот же стиль визуализации, что и в ( a ). Никакой плотности, соответствующей карманному фактору, не наблюдается. e Пустой свернутый карман (голубая сетка) CV-A10 NEP. f Сравнение карманной области зрелого вириона CV-A10 (синий) и NEP (серый). Здесь плотность и атомная модель, соответствующая карманному фактору, показаны ярко-розовым цветом
На карте CV-A10 NEP плотность, соответствующая карманному фактору, не наблюдалась (рис. 4d). Фактически гидрофобный карман в NEP схлопывается по сравнению с таковым в зрелом вирионе (рис. 4б, д). Объем кармана значительно уменьшается, поскольку четыре остатка (Ile109, Val191, Met228 и Phe231 VP1) перемещаются внутрь (рис.4f), что делает невозможным учет карманного фактора.
Высокопроизводительный скрининг структурно-связывающих соединений
Некоторые небольшие гидрофобные молекулы могут связываться с гидрофобным карманом различных энтеровирусов, что приводит к ингибированию соответствующих энтеровирусных инфекций 20,21 . Один из таких ингибиторов карманного связывания, а именно плеконарил, показал хорошую эффективность при лечении респираторных заболеваний, вызванных пикорнавирусом, в клинических испытаниях 22 .Таким образом, мы исследовали, может ли плеконарил ингибировать инфекцию CV-A10. Два других хорошо охарактеризованных ингибитора карманного связывания, WIN51711 34 и Пиродавир 35,36 , также оценивались параллельно с плеконарилом. Удивительно, но на основании наблюдения за цитопатическим эффектом (CPE) ни одно из трех соединений (плеконарил, пиродавир и WIN51711) не проявляло ингибирующего действия в отношении трех штаммов CV-A10 (Kowalik, S0148b и S0273b) даже при самой высокой испытанной концентрации (100 мкл). мкг/мл) (дополнительная таблица S4), несмотря на то, что они показали ингибирующий эффект в отношении других энтеровирусов, включая EV-A71, CV-A16 и EV-D68 (дополнительная таблица S4), на уровнях, сравнимых с уровнями, о которых сообщалось ранее 33,35, 37,38,39 .Структурное моделирование показало, что существуют потенциальные конфликты между соединениями и ключевыми остатками, выстилающими карман VP1 CV-A10 (дополнительный рисунок S6), что может препятствовать связыванию этих соединений с карманом VP1 CV-A10, что приводит к отсутствию ингибирующее действие на CV-A10. Это столкновение может быть связано с несколькими вариациями аминокислот и конформаций в высококонсервативной области кармана VP1 среди CV-A10, EV-A71, CV-A16 и EV-D68 (дополнительный рисунок S6 и дополнительная таблица S3).
Для поиска мощного ингибитора карманного связывания против CV-A10 мы сначала провели высокопроизводительный виртуальный скрининг на основе структуры. Согласно нашей крио-ЭМ-структуре зрелого вириона, карманный фактор CV-A10 в основном скрыт в гидрофобном кармане VP1, и его основная часть образует обильные гидрофобные взаимодействия с окружающими остатками, тогда как его головка образует водородные связи с остатками вблизи входа. и среднее положение кармана, включая Ile109, Ile111 и Asn226 (рис.5а). Мы провели фактический скрининг около 4 миллионов небольших соединений, рассчитав, могут ли они связываться с областью кармана VP1 этой структуры зрелого вириона CV-A10. После виртуального скрининга 258 соединений с высокими показателями стыковки были отобраны для дальнейшей оценки с помощью клеточных анализов ингибирования in vitro. Было обнаружено, что четыре из этих соединений, обозначенных ICA16, ICA17, ICA25 и ICA135 (рис. 5b–f и дополнительная таблица S5), способны ингибировать инфекцию CV-A10. Значения полумаксимальной эффективной концентрации (EC50) и цитотоксической концентрации (CC50) этих четырех соединений показаны на рис.5г. Модели стыковки in silico показали, что все сайты связывания четырех соединений расположены вблизи входа и средней части кармана VP1, частично перекрываясь с сайтами карманного фактора CV-A10 (рис. 5b–f, обозначены пунктиром). прямоугольник на рис. 5b). Несколько остатков VP1, таких как Ile109, Ile111, Asn226 и, в меньшей степени, Asp108, Lys272 и Cys224, вероятно, играют важную роль во взаимодействиях между соединениями и карманом (рис. 5c–f). В частности, ICA135 потенциально может образовывать водородные связи с остатком Ile109, а все остальные три соединения потенциально могут образовывать водородные связи с остатком Ile111 (рис.5в–е). Стоит отметить, что Ile109 и Ile111, расположенные вблизи входа и среднего положения кармана VP1, также участвуют в образовании водородных связей с карманным фактором CV-A10 (рис. 5а).
Рис. 5: Способы связывания SPH и четырех карманно-связывающих соединений и измерение активности анти-CV-A10.a Карманный фактор CV-A10, SPH, занимает часть кармана (показана прозрачной поверхностью) и образует водородные связи с I109, I111 и N226 VP1 в CV-A10.Водородные связи показаны синими пунктирными линиями. b Предполагаемые положения связывания четырех соединений в кармане VP1 зрелого вириона CV-A10. Карман (прозрачная поверхность) и фактор кармана также показаны для иллюстрации относительного расположения четырех соединений. Четыре соединения показаны в виде палочек и окрашены элементами, при этом атомы углерода ICA16, ICA17, ICA25 и ICA135 окрашены в лососевый, желтый, пурпурный и голубой цвета соответственно. Область перекрытия внутри кармана между фактором кармана CV-A10 и четырьмя соединениями обозначена пунктирным прямоугольником. c – f Способы связывания ICA16 ( c ), ICA17 ( d ), ICA25 ( e ) и ICA135 ( f ) с карманом VP1 зрелого CV-A10 анализ стыковки (используя Glide 6.9 в режиме SP). CV-A10 показан синим мультяшным рисунком, а составы — карандашом. Потенциальные водородные связи, образующиеся между карманом и соединениями, показаны синими пунктирными линиями, а остатки, участвующие в образовании водородных связей, отмечены красным. г Список значений EC50, CC50 и SI (CC50/EC50) четырех соединений в сравнении с CV-A10 (S0148b).50 мкл серийно разведенных соединений смешивали с 50 мкл вируса CV-A10, содержащего 100TCID50. Смеси инкубировали в течение 1 часа, а затем добавляли к 2 × 10 4 клеток RD с последующей инкубацией при 37 °C в течение 48 часов. Затем культуральные супернатанты собирали и анализировали на титры вируса с помощью анализа бляшек. Каждый эксперимент проводили не менее трех раз
Ингибирующее действие ICA135 in vitro и in vivo на инфекцию CV-A10
На основании результатов анализа снижения выхода вируса (рис.5g), ICA135 оказался наиболее мощным среди четырех идентифицированных ингибиторов. Чтобы измерить его ингибирующую активность, мы дополнительно проанализировали репликацию CV-A10 в отсутствие или в присутствии различных концентраций ICA135 с помощью количественной ПЦР. Как показано на рис. 6а, ICA135 ингибировал репликацию CV-A10 дозозависимым образом, при этом полумаксимальная ингибирующая концентрация (IC50) составляла 1,446 мкМ.
Рис. 6. Ингибирующая активность ICA135 in vitro и in vivo в отношении инфекции CV-A10.a Ингибирующее действие ICA135 на инфекцию CV-A10 клеток RD.50 мкл вируса CV-A10/S0148b, содержащего 100 TCID50, смешивали с 50 мкл разведения соединения и инкубировали при 37°С в течение 1 ч. Смеси добавляли к 2 × 10 4 клеток RD, чтобы сделать возможной инфекцию при 37°C в течение 6 часов. Затем смеси заменяли свежей средой и планшеты инкубировали при 37 °C в течение 24 часов. Клетки и среду собирали и подвергали анализу ПЦР в реальном времени. Каждый опыт проводили не менее трех раз. b , c Ингибирующее действие ICA135 in vivo.Группам 7-дневных мышей ICR ( n = 14 или 15) внутрибрюшинно (ip) инокулировали 8 × 10 4 TCID50 CV-A10/S0148b в отсутствие или в присутствии 50 мг/кг массы тела. ICA135. Затем мышей ежедневно контролировали на выживаемость ( b ) и клинические признаки ( c ) в течение 14 дней. Клинические оценки оценивались следующим образом: 0 — здоровые; 1, ограниченная подвижность; 2, слабость конечностей; 3, паралич; 4, смерть. Кривые выживания для контрольной и лечебной групп сравнивали с помощью критерия логарифмического ранга с использованием программного обеспечения GraphPad Prism.Средние клинические баллы для двух групп сравнивали с помощью двухстороннего теста ANOVA. Статистическая значимость была указана как ** P ≤ 0,01
Ингибирующее действие ICA135 in vivo оценивали на установленной мышиной модели CV-A10 24,40 . У контрольных мышей ( n = 15), инфицированных имитацией (ДМСО) CV-A10, постепенно развивались клинические признаки, такие как слабость конечностей и паралич, и 60% из них умерли к концу 14-дневного наблюдения. период (рис.6б, в). Напротив, большинство (78,6%) мышей, привитых CV-A10, обработанным ICA135 ( n = 14), не болели в течение 14-дневного периода, и в двух из трех летальных случаев возникновение смерть была значительно отсрочена (12 и 13 dpi соответственно) по сравнению с таковой в контрольной группе (5–10 dpi) (рис. 6b, c). Очевидно, что показатель выживаемости в группе лечения ICA135 был значительно ( P ≤ 0,01) выше, чем у контрольной группы (рис. 6b). Эти результаты показывают, что ICA135 выполняет защитную функцию in vivo.
ICA135 является ингибитором широкого спектра энтеровирусов человека
Энтеровирусы, поражающие человека, подразделяются на четыре вида: A, B, C и D. Зная, что ICA135 является ингибитором CV-A10, мы спросили, обладает ли он также ингибирующим действием. способность против других энтеровирусов человека. Были протестированы репрезентативные вирусы четырех видов, включая EV-A71 и CV-A16 вида A, CV-B3 вида B, PV-1 вида C и EV-D68 вида D. Результаты заражения in vitro: анализы ингибирования показали, что ICA135 проявляет ингибирующее действие на все протестированные вирусы с IC50 в диапазоне от 0.566 и 9,68 мкМ (рис. 7a–e, левые панели). Эти данные очень хорошо согласуются с результатами анализа докинга in silico, который показал, что ICA135 потенциально может связываться с гидрофобными карманами VP1 EV-A71, CV-A16, CV-B3, PV-1 и EV-D68 с сродство с высоким связыванием (рис. 7a–e, правые панели и дополнительная таблица S5). Хотя эти протестированные вирусы принадлежат к разным видам энтеровирусов человека, они по-прежнему имеют в целом схожую первичную последовательность, лежащую в кармане VP1, и общую форму гидрофобного кармана VP1 с CV-A10 (дополнительная рис.S5d–f и дополнительную таблицу S3), и, таким образом, все они могут обеспечить подходящую среду для связывания ICA135. В совокупности приведенные выше результаты демонстрируют, что ICA135 является ингибитором широкого спектра действия энтеровирусов человека.
Рис. 7: Антиэнтеровирусная активность широкого спектра действия ICA135.a – e ICA135 тестировали на ингибирующую активность in vitro в отношении группы энтеровирусов, включая EV-A71 штамм G082 ( a ), CV-A16 штамм SZ05 ( b ), CV-B3 штамм Nancy ( c ), штамм PV1 Sabin ( d ) и штамм EV-D68 US/MO/14-18947 ( e ).Данные, показанные на левой панели, являются репрезентативными результатами как минимум двух независимых экспериментов для каждого вируса. Способы связывания ICA135 с соответствующими вирусами (правые панели) были предсказаны с помощью анализа стыковки. EV-A71 (PDB 3VBF), CV-A16 (PDB 5C4W), EV-D68 (PDB 4WM8), CV-B3 (PDB 1COV) и PV-1 (PDB 1VBD) показаны на синем рисунке с ICA135 на ручке. Возможные водородные связи показаны синими пунктирными линиями. Остатки, участвующие в образовании водородных связей или π–π-стекинге, помечены красным цветом
Вероятная передача вируса Коксаки B3 от человека к шимпанзе, Дания — том 18, номер 7 — июль 2012 г. — журнал Emerging Infectious Diseases
Аффилиация авторов: Копенгагенский университет, Копенгаген, Дания (S.К.А. Нильсен, Т. Мурье, М.Т.П. Гилберт, Л. П. Нильсен); Ольборгский университет, Ольборг, Дания (У. Баандруп, Л.П. Нильсен); Копенгагенский зоопарк, Копенгаген (Т. М. Соланд, М. Ф. Бертельсен); и Statens Serum Institut, Копенгаген (LP Nielsen)
Распознаются шесть серотипов вирусов Коксаки B (CBV) (семейство Picornaviridae, род Enterovirus ): CB1–6. Инфекции CBV распространены среди людей и обычно вызывают незначительные симптомы. Тем не менее, CBV также связаны с несколькими серьезными острыми проявлениями у младенцев, детей и взрослых.CBV являются одной из наиболее распространенных причин менингита, а также могут вызывать энцефалит ( 1 ). Кроме того, хорошо задокументировано, что энтеровирусы являются причиной острого миокардита, при этом вирусы вида Энтеровирус человека B, особенно CBV, являются наиболее распространенными этиологическими агентами ( 2 ).
Обыкновенный шимпанзе ( Pan troglodytes ) и бонобо ( P. paniscus ) являются ближайшими живыми родственниками человека ( 3 ). Исследования показали, что дикие шимпанзе из Камеруна выделяют различные типы энтеровирусов с фекалиями и что некоторые из энтеровирусов тесно связаны с теми, которые, как известно, заражают людей ( 4 ).Также было показано, что смертельный миокардит, вызванный CBV, может возникать у других приматов, включая орангутангов и курносых обезьян ( 5 , 6 ). Мы сообщаем о случае вероятной передачи энтеровируса от человека к шимпанзе, что поднимает вопрос о том, регулярно ли энтеровирусы передаются между людьми, шимпанзе и другими приматами.
Шимпанзе в Копенгагенском зоопарке (Копенгаген, Дания) содержатся вместе, и им разрешен контакт друг с другом в любое время.В октябре 2010 г. респираторные симптомы (кашель, чихание и серозные выделения из носа) развились у всех шимпанзе в зоопарке; однако особенно пострадала 7-летняя самка шимпанзе. Она была шимпанзе из Западной Африки ( P. troglodytes verus ), родившейся в зоопарке; типичная продолжительность жизни таких шимпанзе составляет 50-60 лет. После 36 часов респираторных симптомов, вялости и снижения аппетита шимпанзе умер 25 октября.
Рисунок 1
Рисунок 1.. . Посмертные срезы тканей шимпанзе с инфекцией вирусом Коксаки В, Дания. А) Срез миокарда, демонстрирующий артефакты замораживания и диффузную лимфоцитарную инфильтрацию. Масштабная линейка = 80 мкм. Б)…
При патологоанатомическом исследовании выявлены выраженный застой в печени и умеренный застой в тонкой кишке. Сердце вялое, в миокарде отмечаются бледные прожилки. При гистографическом исследовании в легких была выявлена умеренная мононуклеарная интерстициальная инфильтрация, а в миокарде была выраженная инфильтрация, состоящая в основном из CD3-позитивных Т-лимфоцитов, смешанных с небольшим количеством гранулоцитов.Кроме того, наблюдался многоочаговый выраженный мионекроз; сердечные миоциты были полностью поглощены воспалительными клетками (рис. 1).
Одноэтапная ПЦР в реальном времени была проведена на РНК, выделенной из крови, ткани миокарда и фекалий, для определения наличия последовательностей энтеровируса. Все результаты были строго положительными; пороговые значения цикла образцов были необычно низкими по сравнению с общими значениями, наблюдаемыми для образцов, инфицированных энтеровирусом у людей ( 7 , 8 ).На основании гистопатологических и микробиологических данных мы пришли к выводу, что шимпанзе умер от генерализованной инфекции энтеровирусом, вызвавшей сильное воспаление сердечной мышцы.
Далее мы охарактеризовали вирус, используя РНК, выделенную из сердца. Вирус подвергали обратной транскрипции с использованием системы синтеза первой нити SuperScript III для ОТ-ПЦР (Invitrogen, Карлсбад, Калифорния), а затем подвергали ПЦР-амплификации с использованием специфичного для энтеровируса метода ПЦР дальнего действия.Почти полный вирусный геном (≈7200 нуклеотидов; 96%) амплифицировали с последовательностями праймеров 5′-GGTGCGAAGAGTCTATTGAGC-3′ и 5′-CACCGAAYGCGGAKAATTTACCCC-3′. ПЦР-амплификацию проводили с использованием набора Platinum Taq DNA Polymerase High Fidelity Kit (Invitrogen). Реакции проводили в объемах 25 мкл, содержащих 1× буфер HiFi, 2 ммоль/л MgSO 4 , 0,2 ммоль/л dNTP, 0,4 мкмоль/л каждого праймера, 1 мкл кДНК-матрицы и 1 ед. фермента. Условия циклирования: 94°С в течение 2 мин; 35 циклов: 94°С – 30 с, 55°С – 30 с, 68°С – 7 мин 45 с; с последующим окончательным удлинением при 72°С в течение 7 мин.
Рисунок 2
Рисунок 2. . . Филогенетическое древо вирусов Коксаки B, полученное с помощью анализа соседнего соединения. Дерево было сгенерировано с использованием модели расстояния Тамура-Ней и 1000 бутстрепных повторов. Масштабная линейка представляет оценочное…
После ПЦР-амплификации ампликоны были фрагментированы, преобразованы в библиотеку секвенирования и секвенированы с использованием системы Genome Sequencer FLX (Roche, Копенгаген, Дания). Локальная база данных, содержащая все последовательности вирусов, кроме последовательностей ВИЧ, извлеченных из базы данных вирусных геномов в GenBank (загружена 7 июня 2011 г.; www.ncbi.nlm.nih.gov/genomes/GenomesHome.cgi?taxid=10239), с которым сравнивали все прочтения последовательностей с помощью BLASTn (http://blast.ncbi.nlm.nih.gov/Blast.cgi). ). Это сравнение выявило 89 121 прочтение последовательности со сходством с последовательностями вируса CB3 (ожидаемое значение <10 -6 ). Используя полный геном вируса CB3 (штамм PD, инвентарный номер GenBank AF231765) в качестве эталона, мы сопоставили все считывания последовательностей со сходством с энтеровирусами с помощью программного обеспечения SMALT (www.sanger.ac.uk/resources/software/smalt). Консенсусная последовательность, составляющая заявленный вирус CB3, была сконструирована из картированных прочтений (инвентарный номер GenBank JN979570). Чтобы оценить вероятность того, что зарегистрированный вирус CB3 имеет человеческое происхождение, мы провели филогенетический анализ с использованием метода соседнего соединения. Филогенез был создан с использованием опубликованных полногеномных последовательностей CBV; были представлены все серотипы CBV и вирус CB3 шимпанзе (рис. 2). Филогенез показывает топологию, в которой новый вирус CB3 сгруппирован внутри клады, содержащей вирусы CB3 человека.Таким образом, наиболее вероятно, что вирус CB3, заразивший самку шимпанзе, имел человеческое происхождение, а не новый тип.
Кроме того, был построен график сходства с последовательностью белка вируса CB3 шимпанзе и последовательностью белка эталонного штамма CB3 (инвентарный номер GenBank AAA74400) (данные не показаны). В целом график показал > 95% сходства между двумя последовательностями; однако сходство 83% было показано в области 2А последовательностей. Такое изменение в белке 2A теоретически может способствовать изменению патогенности вируса CB3, хотя, так ли это, потребуются дополнительные анализы.
Вирус CB3 был обнаружен в чрезвычайно высокой концентрации в сердечной мышце шимпанзе, умершего от миокардита. Учитывая близкое сходство почти полной последовательности вирусного генома с человеческими вирусами CB3, источником вируса, вероятно, был человек. Заражение колонии шимпанзе, скорее всего, произошло при тесном контакте с смотрителем животных или другим работником зоопарка. Альтернативные объяснения, такие как передача инфекции при контакте между колонией шимпанзе и другими животными зоопарка или посетителями зоопарка, маловероятны, поскольку шимпанзе не контактировали с другими животными и отделены от публики стеклянной стеной высотой 4 м.
В роду Enterovirus некоторые энтеровирусы, поражающие людей, также поражают животных (например, полиовирусы могут инфицировать нечеловеческих приматов и людей), а некоторые приматы могут быть инфицированы несколькими другими типами энтеровирусов. Вирус CB5 был выделен от детеныша шимпанзе со смертельным исходом ( 12 ), а мыши могут быть инфицированы несколькими вирусами Коксаки. Более того, вирус везикулярной болезни свиней, поражающий свиней, серотипически идентичен и антигенно близкородственен вирусу Коксаки В5 человека ( 9 – 11 ).
В этом отчете показано, что передача вирусов от человека к шимпанзе возможна и может привести к летальному исходу. Еще предстоит выяснить, регулярно ли передаются энтеровирусы между людьми, шимпанзе и другими приматами, и служат ли некоторые приматы резервуарами для мутаций энтеровирусов, которые затем могут инфицировать других приматов.
Г-жа Нильсен — аспирант Центра геогенетики Копенгагенского университета, Дания. Ее исследовательские интересы включают инфекционные заболевания, высокопроизводительное секвенирование и обнаружение вирусов.
Вверх
Выводы, данные и мнения, высказанные авторами в этом журнале, не обязательно отражают официальную позицию Министерства здравоохранения и социальных служб США, Службы общественного здравоохранения, Центров по контролю и профилактике заболеваний или аффилированных лиц авторов.
